紫山药(Dioscrorea alata L.)是山药的一种,具有养胃润肺、益肾健脾等功效,是一种药食两用植物[1]。紫山药含有多糖、花青素、薯蓣皂苷、尿囊素、多酚等活性成分,具有抗氧化、延缓衰老、降血糖、降血脂等功能,这些功能与其生物活性物质密切相关[2-4]。
抑制α-葡萄糖苷酶的活性是防治糖尿病的有效手段,通过抑制α-葡萄糖苷酶的活性,可以防止餐后血糖水平升高[5]。KWON等[6]研究发现,从茄子里提取的酚类物质具有抑制糖代谢相关酶活性的作用。LES等[7]发现石榴汁中的酚类物质具有较强的α-葡萄糖苷酶抑制活性。GUO等[8]研究发现,紫山药乙醇提取物对α-葡萄糖苷酶活性具有一定的抑制作用。因此,分离纯化紫山药多酚,并研究其α-葡萄糖苷酶抑制活性,对明确紫山药多酚的降血糖作用具有重要意义。
大孔树脂具备较强的选择性和吸附性能,使用成本低,受杂质及酸碱的影响较小,性质稳定再生能力强,在天然活性成分的分离纯化方面得到了广泛应用[9]。不同的植物所含的酚类物质性质不同,不同树脂的极性、颗粒大小和比表面积均能影响其对酚类物质纯化的效果,所以,选择适宜的树脂至关重要[10]。近年来,大孔树脂在植物多酚分离纯化方面的研究已有大量文献报道,且取得了良好的效果[11-12]。ZHANG等[13]利用离子液体协同超声提取紫山药多酚,取得了良好的提取效率。大孔树脂分离纯化紫山药多酚尚未见报道。
本文探讨了大孔树脂对紫山药多酚的分离纯化效果,利用不同洗脱剂获得不同洗脱组分,比较不同洗脱组分的α-葡萄糖苷酶抑制活性,并分析多酚的组成,研究结果为阐明紫山药酚类物质的降血糖活性提供依据。
1 材料与方法
1.1 材料与试剂
紫山药产自广州增城县;D4006、AB-8、D101、ADS-7、NKA-9型大孔树脂,郑州和成新材料科技有限公司;α-葡萄糖苷酶、4-硝基苯-α-D-吡喃葡萄糖苷(4-nitrophenyl α-D-glucopyranoside,pNPG),分析纯,Amresco 公司;各种酚类物质标准品均为色谱纯,Sigma公司其余试剂均为分析纯。
1.2 仪器与设备
DHL-B型电脑恒流泵,上海青浦沪西仪器厂;BSZ-100型自动部分收集器,上海琪特分析仪器有限公司;RE52-AA型旋转蒸发器,上海亚荣生化仪器厂;JC-LDGZ-12S型冷冻干燥机,青岛聚创环保有限公司;LC-20A型高效液相色谱仪,日本岛津公司。
1.3 试验方法
1.3.1 紫山药粗多酚的制备
将紫山药洗涤后,切片冷冻干燥,研磨成粉末后过100目筛备用。取100 g紫山药粉于10 L提取罐中,加入7 L蒸馏水,60 ℃条件下浸提2.5 h,过滤去渣后将溶液浓缩至100 mL,加入400 mL无水乙醇,放入4 ℃冰箱内静置24 h后过滤除去絮状沉淀,收集滤液浓缩后,置于冷冻干燥机内干燥48 h,得到紫山药粗多酚备用。
1.3.2 大孔树脂的筛选
大孔树脂预处理和筛选参考杨希娟等[12]的方法略作修改,将一定量的大孔树脂预处理后风干备用,称取5种大孔树脂各1 g,置于5个250 mL的三角瓶中,分别加入200 mL、0.91 g/L的紫山药粗多酚溶液,在室温下于120 r/min振荡12 h后,测定多酚浓度,过滤取出吸附饱和的树脂,放入5个250 mL三角瓶中,分别加入50%的乙醇溶液200 mL,振荡解吸12 h后测定多酚浓度。根据公式(1)和公式(2)分别计算树脂的吸附率和解吸率[14]。
吸附率![]()
(1)
解吸率![]()
(2)
式中:C0,吸附前溶液中多酚质量浓度,g/L;C1,吸附平衡后溶液中剩余多酚的质量浓度,g/L;C2,解吸平衡后溶液中多酚的质量浓度,g/L。
1.3.3 AB-8树脂静态吸附-解吸试验
1.3.3.1 吸附时间确定
准确称取AB-8树脂1 g,放入5个250 mL的三角瓶中,分别加入200 mL、2.0 g/L的紫山药粗多酚溶液。在室温下于120 r/min下振荡,每隔1 h测定各三角瓶中溶液多酚浓度,计算吸附率。
1.3.3.2 多酚浓度对大孔树脂吸附率的影响
参考巫永华等[14]的方法略作修改,准确称取6份AB-8树脂各1 g,将其放入6个250 mL的三角瓶中,加入200 mL质量浓度分别为0.5、1.0、1.5、2.0、2.5、3.0 g/L 的紫山药粗多酚溶液,在室温下于120 r/min下振荡4 h,测定各三角瓶中溶液多酚浓度,计算吸附率。
1.3.3.3 pH值对吸附率的影响
准确称取7份AB-8树脂各1 g,分别放入7个250 mL的三角瓶中,分别加入200 mL、2.0 g/L的不同pH值的紫山药粗多酚溶液(pH= 2.0、3.0、4.0、5.0、6.0、7.0、8.0),在室温下于120 r/min振荡4 h,测定各三角瓶中溶液多酚浓度,计算吸附率。
1.3.3.4 乙醇浓度对解吸率的影响
参考巫永华等[14]的方法略作修改,准确称取8份AB-8树脂各1 g,放入8个250 mL的三角瓶中,分别加入200 mL、2.0 g/L 的紫山药粗多酚溶液,在室温下于120 r/min下振荡4 h,测定各三角瓶中溶液多酚浓度,抽滤取出树脂后,再放入8个250 mL的三角瓶中,分别加入20%、30%、40%、50%、60%、70%、80%、90%的乙醇溶液200 mL,振荡解吸12 h后,测定各三角瓶中溶液多酚浓度,计算解吸率。
1.3.4 AB-8树脂动态吸附-解吸试验
1.3.4.1 上样流速对树脂吸附效果的影响
将适量的AB-8大孔树脂湿法填充入25 mm×300 mm的色谱柱中,用蒸馏水冲压至平衡无气泡。用质量浓度为2.0 g/L的紫山药粗多酚,分别以0.5、1.0、1.5 mL/min的流速进行上样,底部收集流出液,自动收集器设定每管5 mL,每管吸取0.1 mL溶液测定其多酚的浓度。
1.3.4.2 洗脱流速对解吸率的影响
大孔树脂吸附饱和后,以50%(体积分数)的乙醇为洗脱剂,分别以0.6、1.2、1.8 mL/min的流速洗脱,底部收集流出液,自动收集器设定每管5 mL,每管吸取0.1 mL溶液测定其多酚的浓度。
1.3.5 总酚含量的测定
参考LUENGO[15]的方法略作修改。配制质量浓度为0.10 g/L的没食子酸标准液,绘制标准曲线,其回归方程为y=0.792 6x+0.009 4,R2=0.999 4。测定样品中多酚含量时,按照作标准曲线的方法进行操作,根据回归方程计算样品中多酚浓度。
1.3.6 α-葡萄糖苷酶的抑制活性测定
参照GHANI等[16]的方法略作修改,具体如下:96微孔板反应体系中加入40 μL的α-葡萄糖苷酶溶液,然后加入不同待测样品40 μL,置于37 ℃的恒温水浴锅中反应10 min,再加入pNPG溶液40 μL,然后恒温孵育30 min,再加入120 μL 0.2 mol/L的碳酸钠溶液终止反应,于405 nm处检测吸光度值,计算其IC50。
酶活性抑制率![]()
(3)
式中:A0,酶与底物反应后的吸光值;A1,加入样品后酶与底物反应的吸光值;A2,样品自身吸光值。
1.3.7 不同洗脱剂洗脱组分的α-葡萄糖苷酶的抑制活性
分别用50%的乙醇、三氯甲烷和乙酸乙酯作为洗脱剂,洗脱饱和吸附紫山药粗多酚的树脂柱,收集不同的洗脱组分,分别测定不同洗脱组分的α-葡萄糖苷酶活性抑制率,以阿卡波糖为阳性对照,以粗多酚作为阴性对照。
1.3.8 高效液相色谱法分析紫山药多酚单酚成分
准确称取一定量的儿茶素、山奈酚、槲皮素、芦丁、没食子酸、表儿茶素、阿魏酸、绿原酸、咖啡酸标准品,用甲醇配制成质量浓度为0.4 g/L的单一标准液,各取200 μL混合,再用0.22 μm滤膜过滤后用于HPLC检测。
分析条件:依利特 C18色谱柱(100 mm×4.6 mm,5 μm);柱温:30 ℃,紫外检测波长280 nm,进样量:10 μL,流速:1.0 mL/min。流动相梯度洗脱程序:A:甲醇;B:0.1%冰乙酸;流动相梯度:0 min(85%B),10 min(75%B),25 min(65%B),35 min(55%B),60 min(5%B)。
1.4 数据处理
试验数据采用SPSS 21.0进行分析,采用Origin 2019b制图。做3次平行测定,结果以平均值±标准差(x±SD)表示。
2 结果与分析
2.1 最佳树脂的筛选
由图1可知,不同的树脂对紫山药多酚的吸附能力差异较大,NKA-9吸附率最高,为77.3%,而AB-8吸附率为72.2%,二者差异不明显(P>0.05),D101吸附率最低,仅为52.2%。从解吸效果上看,D101解吸率最高,为89.6%,AB-8的解吸率为87.7%,二者差异不明显(P>0.05),D4006解吸率最低,为69.3%。不同的大孔树脂由于其极性、比表面积和孔径等不同,对天然产物会表现出不同的吸附和解吸性能[14]。NKA-9具有较高的吸附率,但解吸率较低。D101解吸率高,但吸附率较低。综合比较考虑,AB-8树脂保持了较高的吸附率,同时又具有较高的解吸率。所以,选择AB-8树脂分离纯化紫山药多酚较为合适。
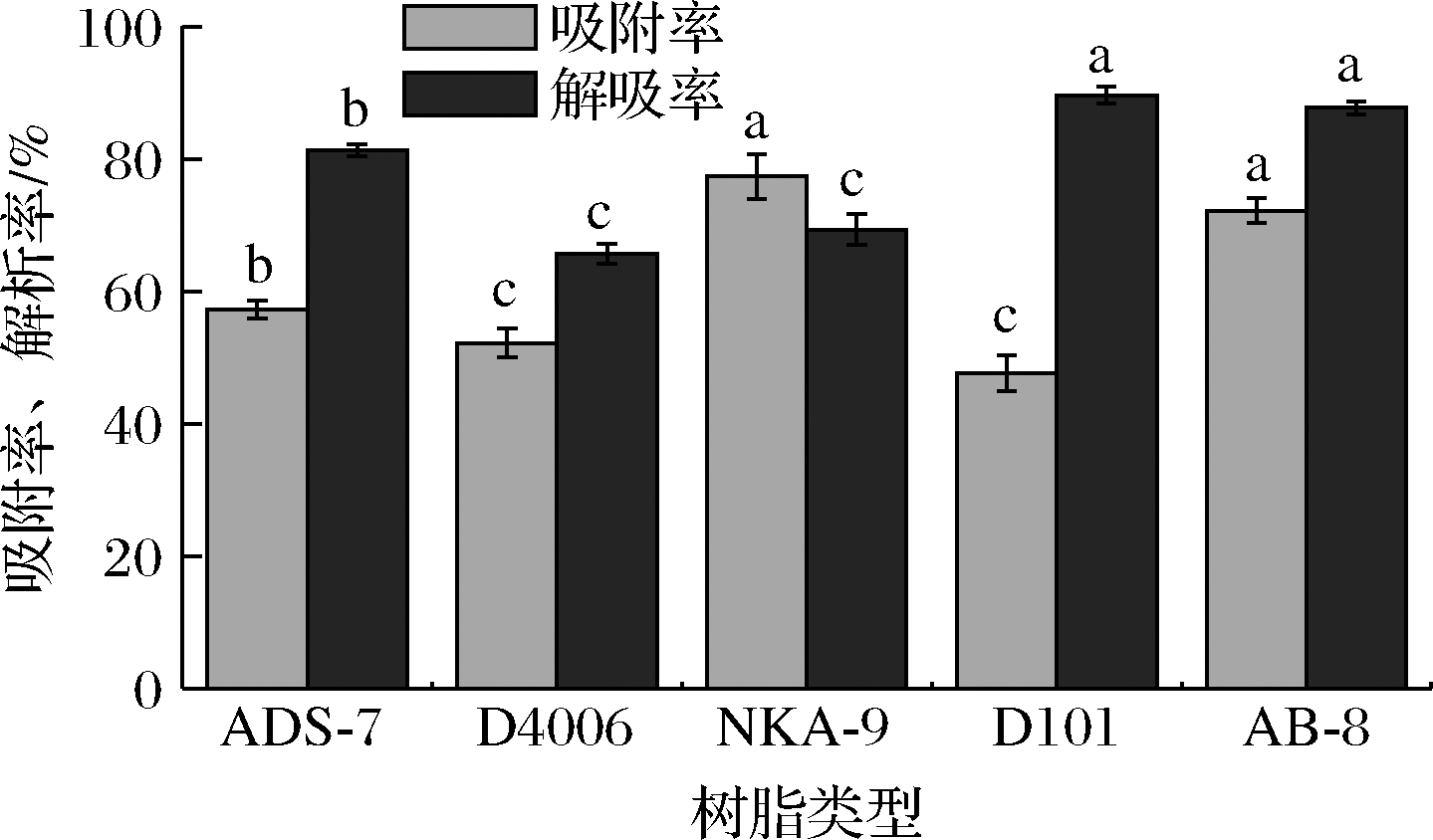
图1 五种大孔树脂的吸附-解吸效果比较
Fig.1 Comparison of adsorption and desorption properties of five resins
注:不同字母表示组间差异显著(P<0.05)(下同)
2.2 静态吸附、解吸试验结果
2.2.1 AB-8树脂的静态吸附曲线
由图2可知,在AB-8大孔树脂吸附紫山药多酚的过程中,吸附时间小于4 h时,吸附率与吸附时间呈明显的正相关性。但当吸附时间超过4 h,吸附率的增加放缓,这是由于树脂对于紫山药多酚的吸附接近饱和状态。因此,选定AB-8树脂对于紫山药多酚的静态吸附时间为4 h,此时吸附率为85.43%。
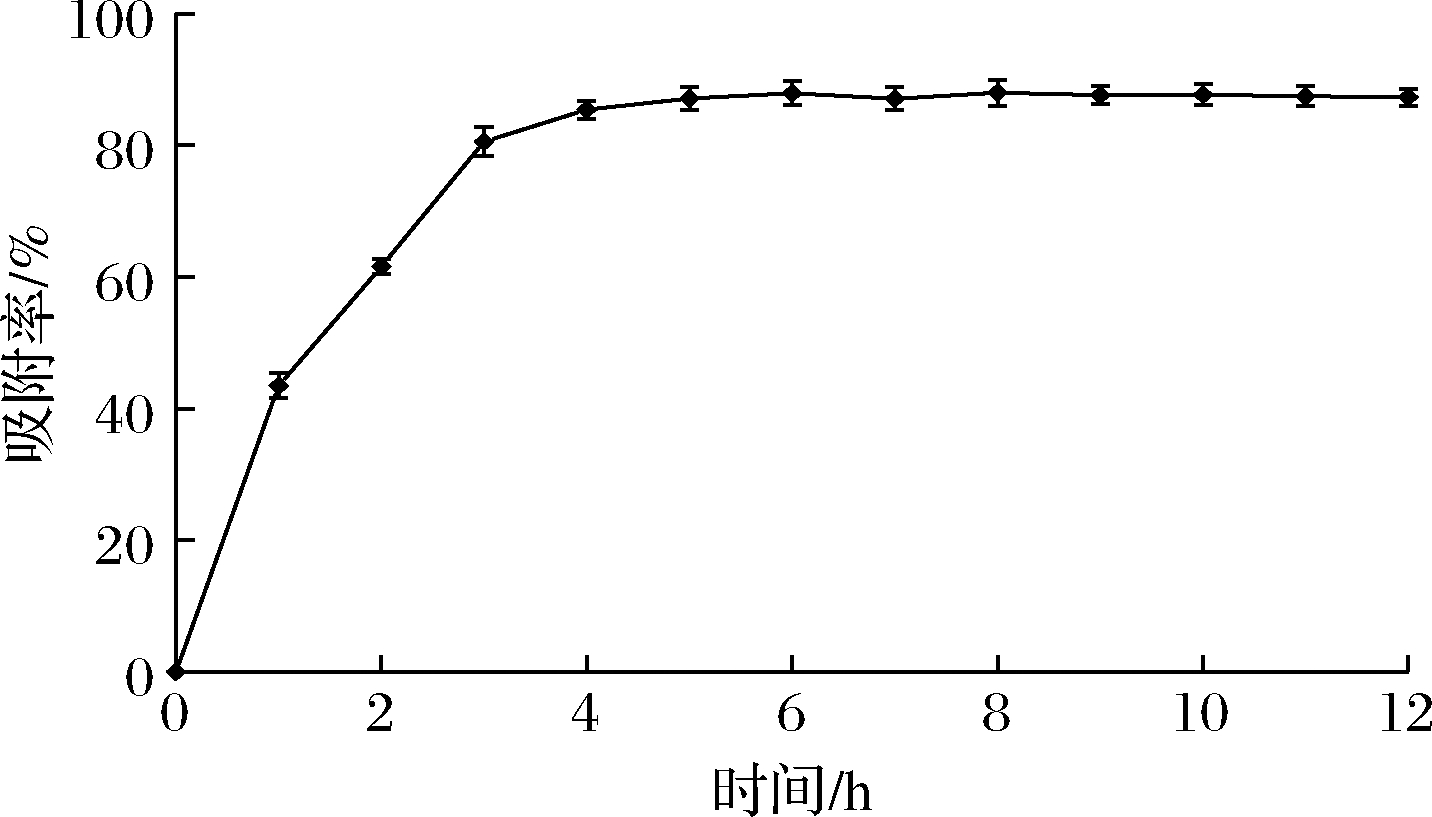
图2 AB-8树脂静态吸附曲线
Fig.2 Static adsorption curve of AB-8 resin
2.2.2 样品浓度对AB-8树脂吸附率的影响
由图3可知,在质量浓度低于2.0 g/L时,紫山药多酚质量浓度与吸附率呈正相关,质量浓度为2.0 g/L时吸附率最大,浓度继续增大,吸附率有所降低。在一定质量浓度范围内,浓度增加有利于酚类物质分子与树脂的接触,提高树脂的吸附率,但是浓度过高溶液黏度增加,流动性降低,且体系中相关杂质也会增加,不利于酚类物质与树脂的接触,从而降低了吸附率[17]。因此,选择多酚质量浓度为2.0 g/L作为分离纯化的上样浓度,此时吸附率为89.33%。

图3 样品浓度对AB-8树脂吸附率的影响
Fig.3 Effect of sample concentration on adsorption rate of AB-8 resin
2.2.3 样品溶液pH对AB-8树脂吸附率的影响
由图4可知,溶液的pH值为2~5时,AB-8树脂对紫山药多酚的吸附率与溶液的pH值呈正相关,样品液的pH值为5时吸附率最高,此时吸附率为91.97%。当pH继续升高时,吸附率反而降低。多酚是一类含有羟基的化合物,pH的大小直接影响酚类物质在溶液中的状态[18]。紫山药多酚溶液在弱酸性环境下较稳定,有利于AB-8树脂对酚类物质的吸附,当溶液酸性减弱时,更多的酚羟基电离,致使酚类物质与大孔树脂间的作用减弱,从而降低了大孔树脂对多酚的吸附能力,导致吸附率降低[19]。
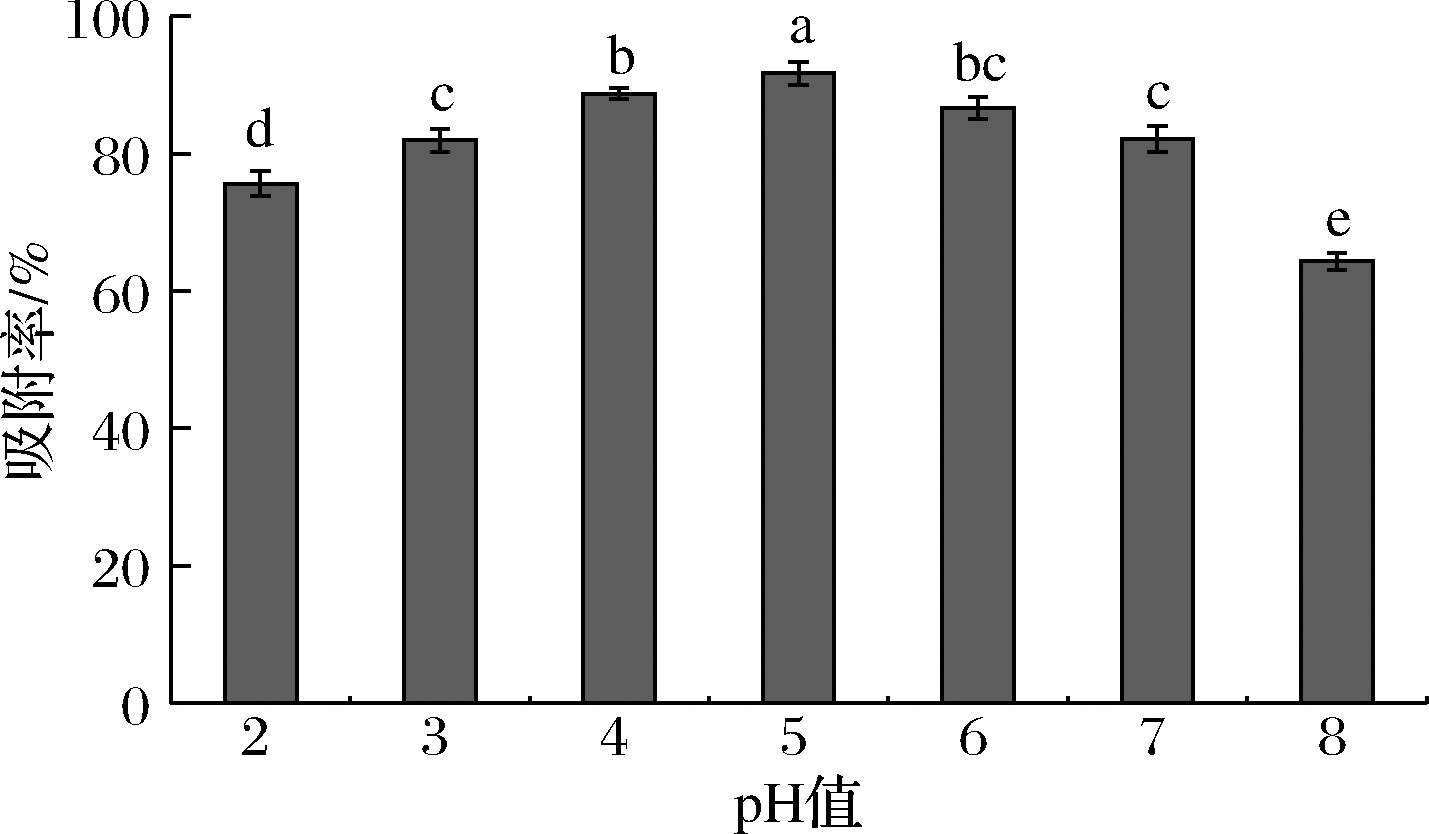
图4 pH值对AB-8树脂吸附率的影响
Fig.4 Effects of pH value on absorption rate of AB-8 resin
2.2.4 乙醇浓度对解吸率的影响
由图5可知,乙醇体积分数为20%~90%时,解吸率呈现先增后降的趋势,当乙醇的体积分数为50%时,其对紫山药多酚的解吸率最大,为87.7%。乙醇水溶液对多酚的解吸率与其极性有关,随着乙醇浓度的增大,其极性降低,当乙醇体积分数为50%时,紫山药中酚类物质的极性可能与此时溶液的极性更相近,更多的酚类物质被解吸下来。因此,选择50%的乙醇作为解吸剂较为适宜。
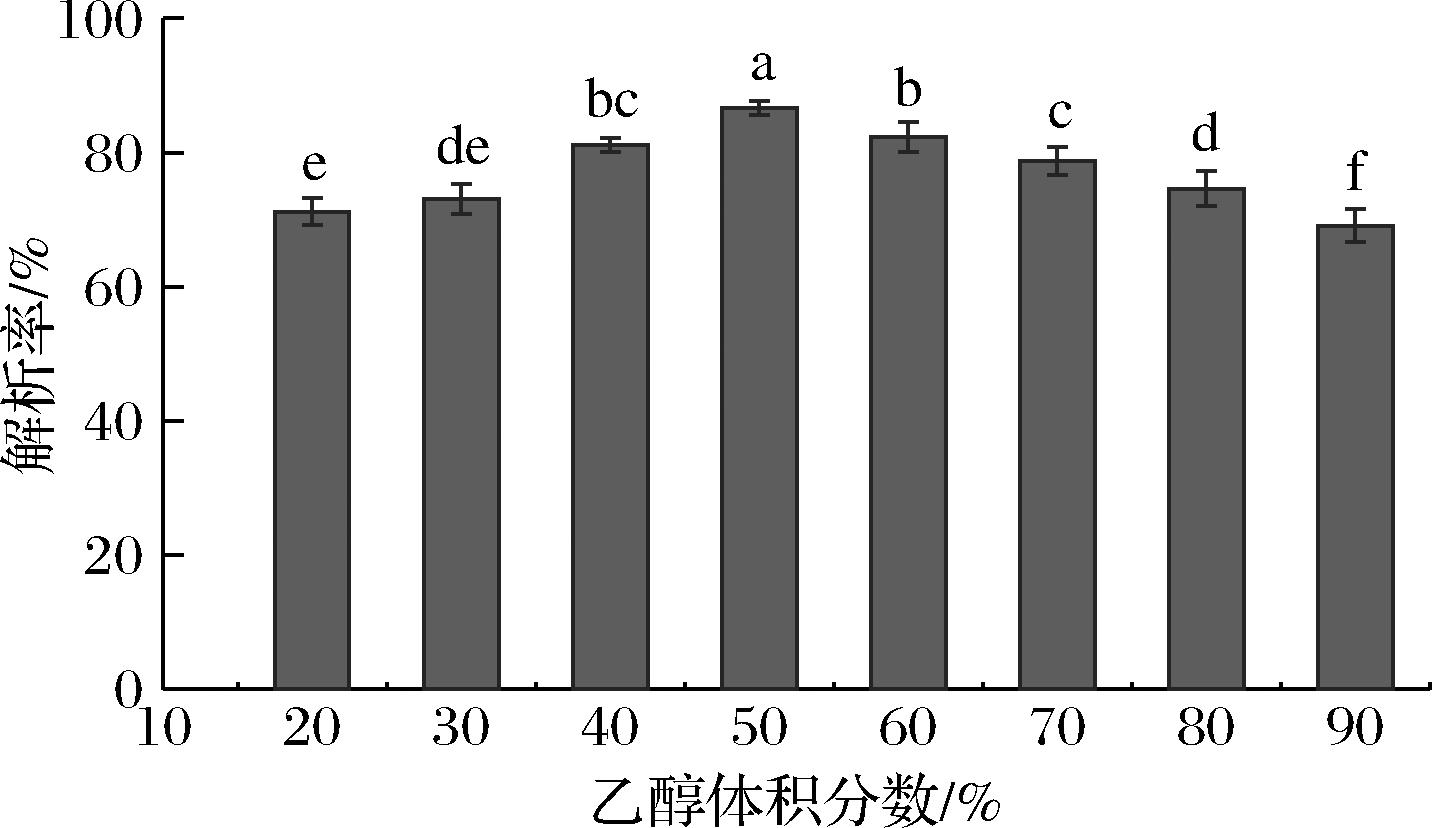
图5 乙醇体积分数对AB-8树脂解吸率的影响
Fig.5 Effect of ethanol volume fraction on desorption rate of AB-8 resin
2.3 动态吸附-解吸试验结果
2.3.1 动态吸附曲线
由图6可知,上样流速对AB-8树脂吸附有较大影响,随着样品流速的增大,泄漏点出现的时间越早,树脂的吸附量越少,这个可能与流速过大会导致吸附的多酚重新被洗脱下来有关[20]。当样品流速分别为0.5、1.0、1.5 mL/min时,泄露点分别在110、80、40 mL时出现,此时的吸附量分别为198、144、72 mg。试验结果表明,上样流速越慢,树脂吸附的多酚越多,为了提高整个树脂吸附效率,缩短分离纯化时间,上样流速为1.0 mL/min较为适宜。
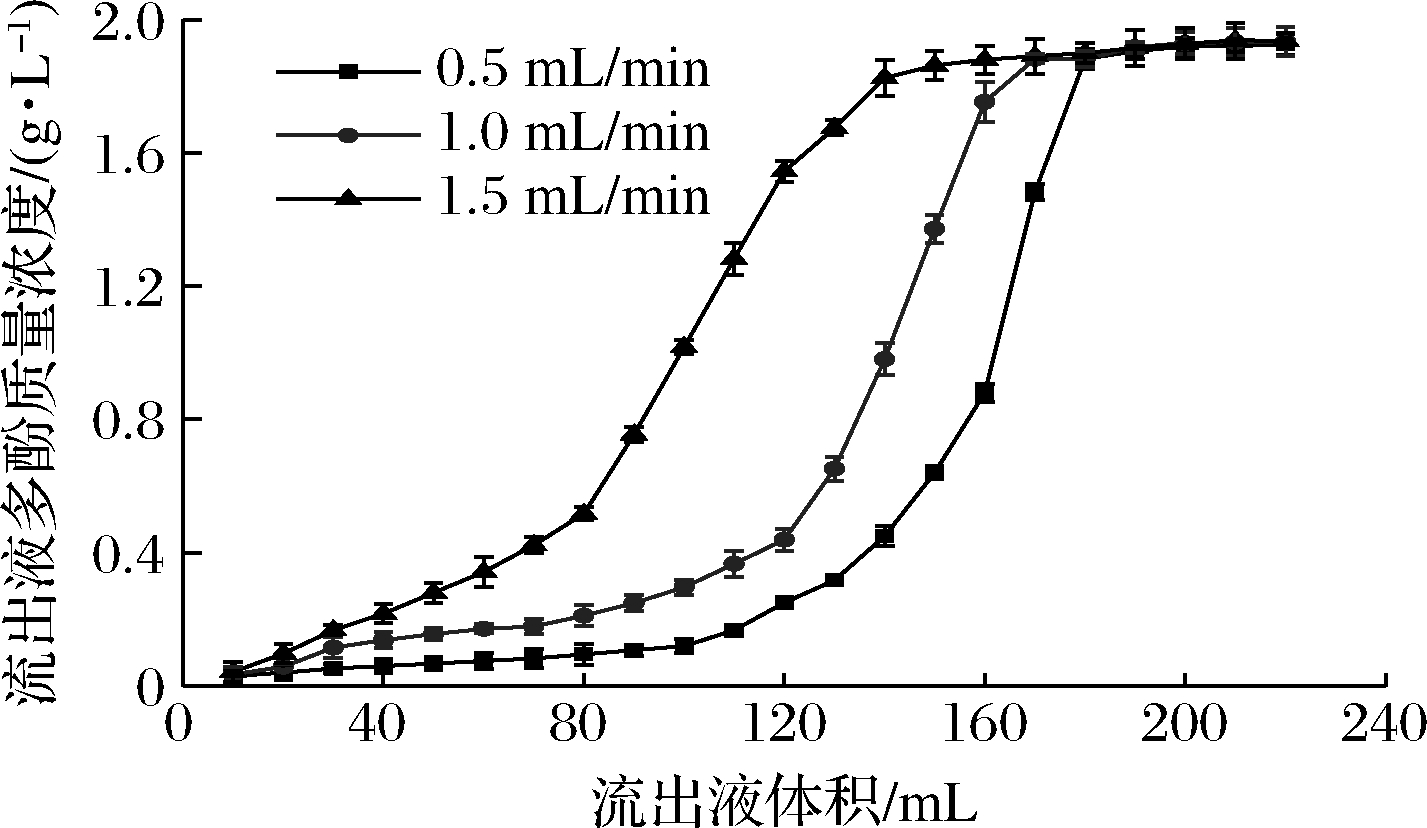
图6 上样流速对吸附效果的影响
Fig.6 Effect of loading velocity on adsorption
2.3.2 动态洗脱曲线
由图7可知,洗脱速度为0.6 mL/min时,洗脱液的浓度峰值出现在第4管,酚类物质主要集中在1~12管;而流速为1.2、1.8 mL/min时,洗脱液的浓度峰值均在第6管,但后者的洗脱液浓度峰值较低,酚类物质分别集中在1~14管与1~17管,由此可见,以流速为1.2 mL/min洗脱时,酚类物质洗脱的较为集中且耗时短。一般来说,洗脱液的流速慢有利于洗脱剂与树脂上的多酚接触从而充分解吸,但如果流速过慢,会导致解吸的时间过长,流动过程中一些被洗脱下来的多酚可能会被重新吸附[21],而洗脱液的流速过快时,会导致洗脱剂与树脂接触时间过短,洗脱剂不能充分解吸多酚,拖尾现象严重,降低生产效率[21]。因此,选择1.2 mL/min的洗脱流速较为适宜,在此条件下,洗脱液体积为104 mL,多酚回收率为72.7%,多酚纯度由13.91%提升到59.06%,纯度提高了3.25倍。
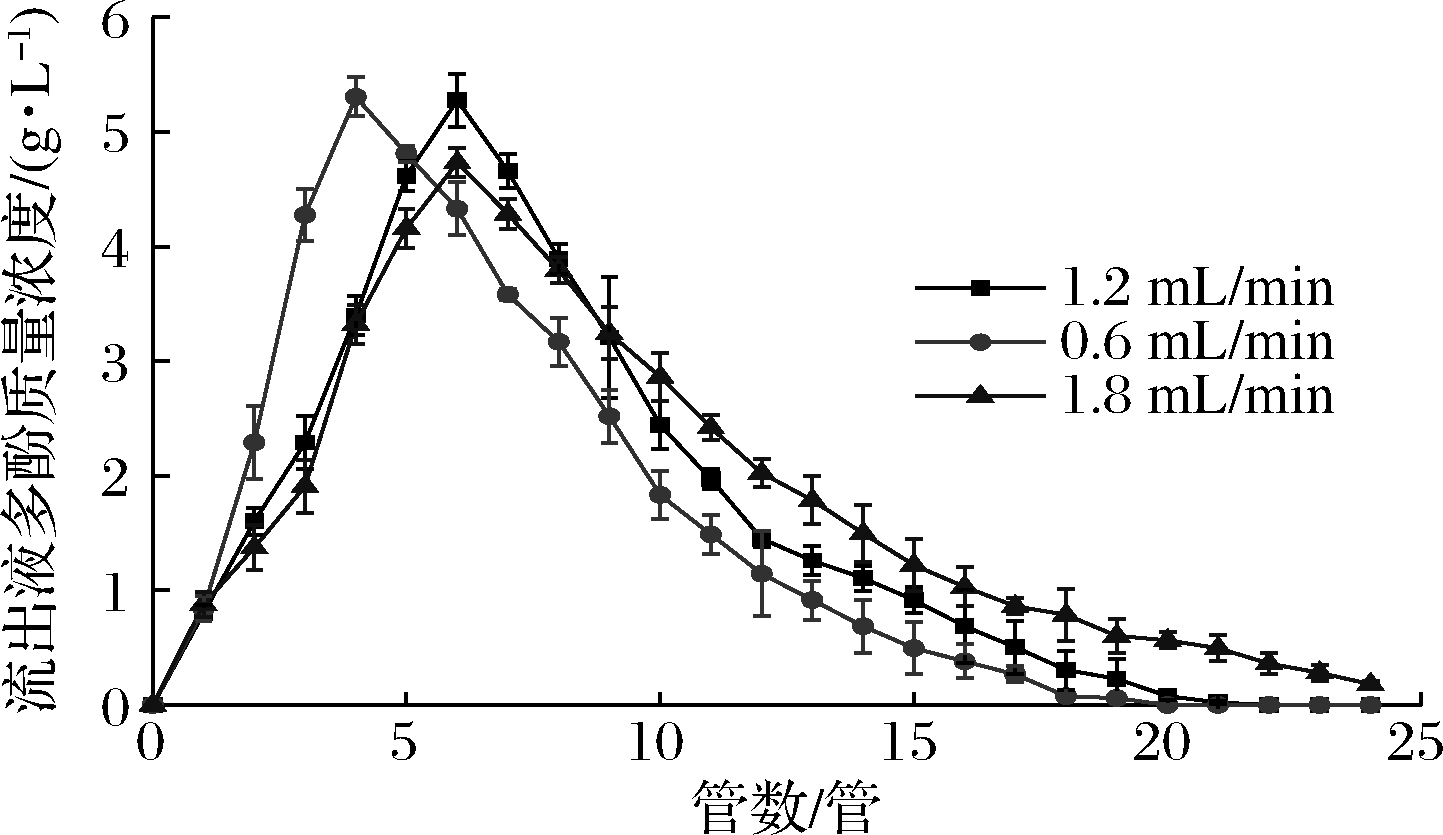
图7 洗脱流速对解吸效果的影响
Fig.7 Effect of elution velocity on desorption
2.4 不同溶剂洗脱组分对α-葡萄糖苷酶活性的抑制作用
α-葡萄糖苷酶是一种重要的碳水化合物水解酶,抑制α-葡萄糖苷酶的活性能有效减少碳水化合物的水解,降低肠道对葡萄糖的吸收,从而降低血糖浓度,对于治疗和预防糖尿病具有重要的意义[22]。分别用50%乙醇、乙酸乙酯和三氯甲烷作为洗脱剂,获得了3种洗脱组分,测定了其对α-葡萄糖苷酶活性的抑制效果。结果如图8所示,在一定的质量浓度范围内,样品浓度与α-葡萄糖苷酶的抑制率呈正相关,但不同洗脱溶剂洗下来的多酚组分对α-葡萄糖苷酶活性的抑制作用差异较大,由图8可知,乙酸乙酯洗脱组分>50%乙醇洗脱组分>三氯甲烷洗脱组分。由表1可知,乙酸乙酯洗脱组分对α-葡萄糖苷酶的抑制活性的IC50值最小,为0.126 g/L,50%乙醇的IC50值为0.216 g/L,而三氯甲烷的IC50值为14.69 g/L。由此可见,乙酸乙酯洗脱组分中含有较多的抑制α-葡萄糖苷酶活性的成分。

图8 不同溶剂洗脱物的α-葡萄糖苷酶的抑制能力
Fig.8 The α-glucosidase inhibition ability of eluted fractions with different solvents
表1 不同洗脱组分的α-葡萄糖苷酶活性抑制比较(IC50值)
Table 1 Comparison of α-glucosidase inhibition of eluted fractions with different solvents (IC50value)

样品阿卡波糖粗多酚50%乙醇洗脱组分乙酸乙酯洗脱组分三氯甲烷洗脱组分IC50值/(g·L-1)0.141±0.0051.68±0.1490.216±0.0230.126±0.01914.69±0.710
2.5 紫山药多酚不同洗脱组分分析
由图9可知,与标准品图谱对照,50%乙醇洗脱组分主要含有儿茶素、咖啡酸、表儿茶素、阿魏酸、芦丁和槲皮素;乙酸乙酯洗脱物中主要含有绿原酸、表儿茶素、阿魏酸、芦丁和槲皮素;三氯甲烷含有没食子酸,其他未知。有研究表明,绿原酸[23]、槲皮素[24]、芦丁等具有α-葡萄糖苷酶抑制活性,且芦丁[25]对α-葡萄糖苷酶的抑制作用较强,这与实验得出的乙酸乙酯洗脱组分具有较强的α-葡萄糖苷酶抑制活性相一致。
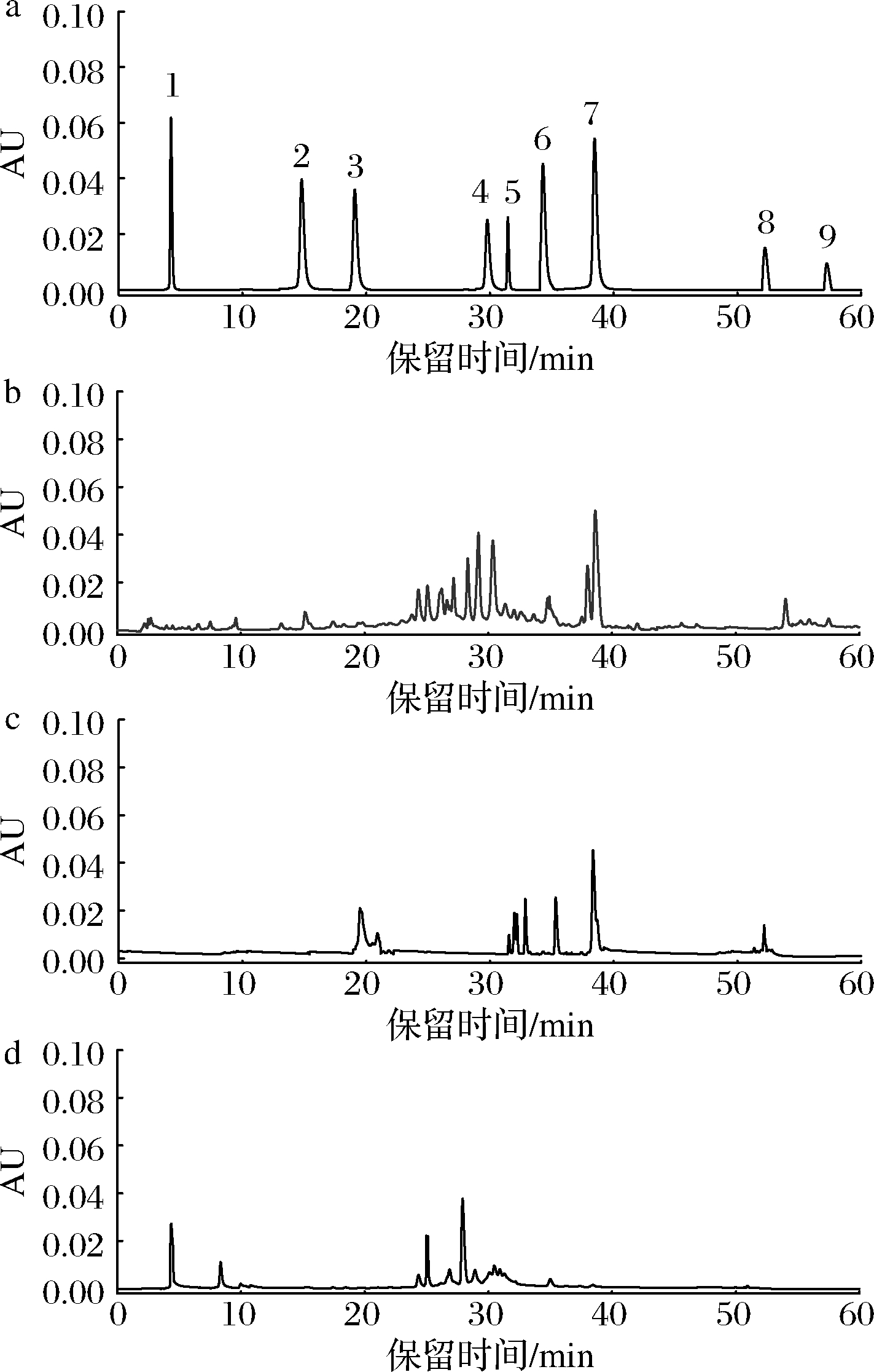
1-没食子酸;2-儿茶素;3-绿原酸;4-咖啡酸;5-表儿茶素;6-阿魏酸;7-芦丁;8-槲皮素;9-山奈酚
a-标准品;b-50%乙醇洗脱物;c-乙酸乙酯洗脱物;d-三氯甲烷洗脱物
图9 标准品和不同洗脱组分的高效液相色谱图
Fig.9 The HPLC results of polyphenols standard,and eluted fractions with different solvents
3 结论
(1)AB-8大孔树脂较适于紫山药多酚分离纯化,其分离纯化工艺为:静态吸附4 h,溶液pH为5.0,上样质量浓度为2.0 g/L,上样流速为1.0 mL/min;用50%(体积分数)的乙醇作为洗脱剂,在流速为1.2 mL/min时洗脱,收集洗脱液体积104 mL,此时多酚回收率为72.7%,多酚纯度由13.91%提升到了59.06%,纯度提高了3.25倍。
(2)比较了50%(体积分数)乙醇、乙酸乙酯和三氯甲烷洗脱组分的α-葡萄糖苷酶抑制活性,乙酸乙酯洗脱组分具有最强的α-葡萄糖苷酶抑制活性,其抑制率达到91.92%,经高效液相色谱分析其主要含有芦丁、绿原酸、表儿茶素、阿魏酸和槲皮素,试验结果为紫山药多酚降血糖的研究提供了基础数据,后续研究进一步分离单组分,采用质谱、核磁共振对其结构进行鉴定,明确其功能。
[1] 于东.紫山药功能性营养成分及加工技术研究[D].杭州:浙江大学,2011.
YU D.Study on the functional nutrients and processing technology of purple yam[D].Hangzhou:Zhejiang University,2011.
[2] 王彦平,宿时,陈月英.紫山药多糖超声结合酶法提取工艺优化及抗氧化活性研究[J].食品工业科技,2017,38(8): 189-192;198.
WANG Y P,SU S,CHEN Y Y.Study on optimization of ultrasonic-enzymatic extraction of polysaccharides from purple yam and its antioxidant activity[J].Science and Technology of Food Industry,2017,38(8):189-192;198.
[3] MORIYA C,HOSOYA T,AGAWA S,et al.New acylated anthocyanins from purple yam and their antioxidant activity[J].Bioscience,Biotechnology,and Biochemistry,2015,79(9):1 484-1 492.
[4] CHRISTINA Y I,RIFA′I M.Bioactivity of purple yam tuber (Dioscorea alata L.) on the level of CD8+and CD8+CD462L+ T cells and histology of liver in BALB/c mice model of digestive allergy[J].The Journal of Experimental Life Sciences,2014,4(2):27-33.
[5] HE K,SHI J C,MAO X M.Safety and efficacy of acarbose in the treatment of diabetes in Chinese patients[J].Therapeutics and Clinical Risk Management,2014,10(1):505-511.
[6] KWON Y I,APOSTOLIDIS E,SHETTY K.In vitro studies of eggplant (Solanum melongena) phenolics as inhibitors of key enzymes relevant for type 2 diabetes and hypertension[J].Bioresource Technology,2008,99(8):2 981-2 988.
[7] LES F,ARBONÉS-MAINAR J M,VALERO M S,et al.Pomegranate polyphenols and urolithin A inhibit α-glucosidase,dipeptidyl peptidase-4,lipase,triglyceride accumulation and adipogenesis related genes in 3T3-L1 adipocyte-like cells[J].Journal of Ethnopharmacology,2018,220:67-74.
[8] GUO X X,SHA X H,LIU J,et al.Chinese purple yam (Dioscorea alata L.) extracts inhibit diabetes-related enzymes and protect HepG2 cells against oxidative stress and insulin resistance induced by FFA[J].Food Science and Technology Research,2015,21(5):677-683.
[9] IGNAT I,VOLF I,POPA V I.A critical review of methods for characterisation of polyphenolic compounds in fruits and vegetables[J].Food Chemistry,2011,126(4):1 821-1 835.
[10] GUO C X,QIAO J P,ZHANG S W,et al.Purification of polyphenols from kiwi fruit peel extracts using macroporous resins and high-performance liquid chromatography analysis[J].International Journal of Food Science &Technology,2018,53(6):1 486-1 493.
[11] GAO N X,WANG Y H,JIAO X Y,et al.Preparative purification of polyphenols from Aronia melanocarpa (chokeberry) with cellular antioxidant and antiproliferative activity[J].Molecules(Based,Switzerland),2018,23(1):139.
[12] 杨希娟,党斌,张杰,等.黑青稞麸皮结合态酚类物质大孔树脂分离纯化工艺优化[J].农业工程学报,2018,34(21):295-303.
YANG X J,DANG B,ZHANG J,et al.Process optimization on separation and purification of bound polyphenol in black highland barley bran by macroporous resin[J].Transactions of the Chinese Society of Agricultural Engineering,2018,34(21):295-303.
[13] ZHANG J H,ZONG A Z,XU T C,et al.A novel method:Ionic liquid-based ultrasound-assisted extraction of polyphenols from Chinese purple yam[J].Natural Product Research,2018,32(7):863-866.
[14] 巫永华,张建萍,赵节昌,等.大孔树脂纯化黄精多酚及其抗氧化性与组成分析[J].农业工程学报,2020,36(1):318-326.
WU Y H,ZHANG J P,ZHAO J C,et al.Antioxidation and composition analysis of purified polygonatum sibiricum Polyphenols using macroporous resin[J].Transactions of the Chinese Society of Agricultural Engineering,2020,36(1):318-326.
[15] LUENGO E, LVAREZ I,RASO J.Improving the pressing extraction of polyphenols of orange peel by pulsed electric fields[J].Innovative Food Science &Emerging Technologies,2013,17:79-84.
LVAREZ I,RASO J.Improving the pressing extraction of polyphenols of orange peel by pulsed electric fields[J].Innovative Food Science &Emerging Technologies,2013,17:79-84.
[16] GHANI U,NUR-E-ALAM M,YOUSAF M,et al.Natural flavonoid α-glucosidase inhibitors from Retama raetam:Enzyme inhibition and molecular docking reveal important interactions with the enzyme active site[J].Bioorganic Chemistry,2019,87:736-742.
[17] 巫永华,刘恩岐,张建萍,等.山楂叶多酚的纯化及其抗氧化特性与组分分析[J].食品与发酵工业,2020,46(2):165-172.
WU Y H,LIU E Q,ZHANG J P,et al.Purification,antioxidant capacity and component analysis of hawthorn leaf polyphenols[J].Food and Fermentation Industries,2020,46(2):165-172.
[18] WANG C,XIE Y T,WANG H Y,et al.Phenolic compounds in beer inhibit formation of polycyclic aromatic hydrocarbons from charcoal-grilled chicken wings[J].Food Chemistry,2019,294(10):578-586.
[19] SUN L J,GUO Y R,FU C C,et al.Simultaneous separation and purification of total polyphenols,chlorogenic acid and phlorizin from thinned young apples[J].Food Chemistry,2013,136(2):1 022-1 029
[20] 甘芝霖,倪元颖,郭悦,等.大孔树脂分离纯化玫瑰果多酚及其抗氧化性[J].农业工程学报,2015,31(24):298-306.
GAN Z L,NI Y Y,GUO Y,et al.Separation and purification of rosehip polyphenols by macroporous resin and its antioxidant activity[J].Transactions of the Chinese Society of Agricultural Engineering,2015,31(24):298-306.
[21] 马乐,韩军岐,白欢欢,等.采用大孔树脂分离纯化核桃青皮中多酚[J].食品与发酵工业,2016,42(3):237-242.
MA L,HAN J Q,BAI H H,et al.Separation and purification of polyphenols from walnut green husk by macroporous resin[J].Food and Fermentation Industries,2016,42(3):237-242.
[22] ZHANG L,ZHU M F,TU Z C,et al.α-Glucosidase inhibition,anti-glycation and antioxidant activities of Liquidambar formosana Hance leaf,and identification of phytochemical profile[J].South African Journal of Botany,2017,113:239-247.
[23] 曾桥,韦承伯,夏飞,等.响应面法优化超声波辅助提取杜仲叶茯砖茶绿原酸及其体外降血糖抗氧化活性[J].食品与发酵工业,2018,44 (9):204-211.
ZENG Q,WEI C B,XIA F,et al.Optimization of ultrasonic-assisted extraction of Eucommia ulmoides leaves Fu brick tea chlorogenic acid via response surface analysis and its hypoglycemic and antioxidant activities in vitro[J].Food and Fermentation Industries,2018,44(9):204-211.
[24] IRONDI E A,OBOH G,AKINDAHUNSI A A,et al.Phenolic composition and inhibitory activity of Mangifera indica and Mucuna urens seeds extracts against key enzymes linked to the pathology and complications of type 2 diabetes[J].Asian Pacific Journal of Tropical Biomedicine,2014,4(11):903-910.
[25] LI Y Q,ZHOU F C,GAO F,et al.Comparative evaluation of quercetin,isoquercetin and rutin as inhibitors of α-glucosidase[J].Journal of Agricultural and Food Chemistry,2009,57(24):11 463-11 468.