燃料乙醇是以生物质为原料通过微生物发酵产生的,具有环保、清洁、可再生等诸多优点,被认为是最具发展前景的石油替代能源[1]。酿酒酵母(Saccharomyces cerevissiae)是生产乙醇最常使用的菌株,在工业上已经形成完整的发酵体系,但在实际发酵过程中,酿酒酵母因受到高温、高渗、有害物质等多重胁迫的影响,其生长、繁殖与代谢能力会下降,导致糖利用率和乙醇终产量很难达到理论水平[2]。甘蔗糖蜜来源广泛、价格低廉,含有酵母细胞生长所必须的碳源、氮源、无机盐等诸多营养物质,是生产乙醇较为理想的经济类原料[3]。但甘蔗糖蜜中含有大量胶体、灰分、金属离子、酚类等多种抑制物,其中的酚类化合物丁香醛、阿魏酸、香草醛、丁香酸等[4-5],会对多种细菌、真菌及酵母产生明显的抑制作用[6]。
研究表明,酚类化合物可在糖制品如糖浆或糖蜜中存在,有学者运用LC-UV-ESI-MS技术对红糖提取物中的酚类化合物进行检测,显示含有丰富的香草酸、香草醛和丁香醛等多酚化合物[7]。酚类化合物对细胞的毒性作用与其分子质量、疏水性和甲氧基的数目及位置有关,它们可破坏细胞膜的完整性,通过抑制中心碳代谢的关键酶、干扰蛋白质合成速率或增加用于修复细胞结构损伤的ATP和NAD(P)H来影响酵母细胞的生长和代谢能力[8],但这种毒性机制并不适用于所有微生物,其毒性强弱还与微生物自身的结构及代谢有着密切的联系[9]。
本文选取具有代表性的丁香醛作为实验对象,通过外源添加不同质量浓度的丁香醛,测定其对酿酒酵母细胞生长的抑制情况;以蔗糖代替甘蔗糖蜜中的可发酵性糖进行乙醇发酵实验,探究丁香醛对酿酒酵母细胞生长、糖代谢和乙醇代谢的影响,并进一步通过测定丁香醛处理前后酵母细胞膜通透性和胞内丙二醛(malondialdehyde,MDA)含量的变化,结合扫描电镜(scanning electron microscopy,SEM)观察酵母细胞形态变化、傅里叶变换红外光谱(Fourier transform infrared spectrum,FTIR)分析细胞壁和细胞膜结构成分变化,探究丁香醛对酿酒酵母细胞的毒性机理,为实现甘蔗糖蜜高浓度乙醇发酵的生产水平提供理论依据。
1 材料与方法
1.1 实验材料
菌种:酿酒酵母(S.cerevisiae)GJ2008由广西科技大学发酵工程研究所保藏。
培养基:一(二)级种子培养基(g/L):葡萄糖20(50),蛋白胨20,酵母浸粉10,pH自然,115 ℃蒸汽灭菌20 min;蔗糖发酵培养基(g/L):蔗糖250,蛋白胨20,酵母浸粉10,pH自然,121 ℃蒸汽灭菌20 min。
试剂:丁香醛(纯度98%),上海麦克林生化科技有限公司;蔗糖(AR),南宁糖业股份有限公司;葡萄糖、果糖、戊二醛(AR),天津市科密欧化学试剂有限公司;二甲基亚砜(AR),天津市大茂化学试剂厂;三氯乙酸、硫酸(AR),西陇科学股份有限公司;乙腈、乙醇(GR),安徽时联特种溶剂有限公司。
1.2 仪器与设备
LDZH-100KBS立式压力蒸汽灭菌器,上海申安医疗器械厂;ZWYR-C2402C叠式恒温调速摇床,上海智诚分析仪器制造有限公司;HIMAC大容量冷冻离心机,日本株式会社日立制作所;HH系列数显恒温水浴锅,金坛市科析仪器有限公司;赛里安456-GC气相色谱仪,荷兰赛里安仪器有限公司;HITACHI高效液相色谱分析仪,日立科学仪器(北京)有限公司;UV-8000S紫外可见分光光度计,上海元析仪器有限公司;Alpha1-2LDplus真空冷冻干燥机,德国CHRIST公司;phenom(飞纳)台式扫描电镜,复纳科学仪器(上海)有限公司;Frontier傅里叶红外光谱仪,兴和仪器(上海)有限公司。
1.3 实验方法
1.3.1 种子液制备
将保藏菌株酿酒酵母GJ2008接入一级种子培养基中活化,于摇床150 r/min、30 ℃培养12~14 h;以10%的接种量转至新鲜一级种子培养基中,培养6~8 h,调整菌悬液浓度为108CFU/mL,备用。
1.3.2 丁香醛对酿酒酵母细胞生长的影响
将种子液以10%接种量接入二级种子培养基中,分别添加不同质量浓度丁香醛(0、0.5、1.0、1.2、1.4、1.6、1.8、2.0 g/L)和1 mL的二甲基亚砜作为助溶剂[10],30 ℃、150 r/min培养,定时取样,测定菌体在560 nm下的吸光度,以发酵时间为横坐标,吸光度值为纵坐标,绘制生长曲线。
1.3.3 蔗糖乙醇发酵过程中糖与乙醇含量的测定
将种子液以10%接种量接至蔗糖发酵培养基中,根据1.3.2中的结果,于发酵培养基中添加1.4 g/L丁香醛,以未添加丁香醛的菌液为对照组,30 ℃、150 r/min 培养36 h,定时取样,保留上清液,使用高效液相色谱仪和气相色谱仪检测糖和乙醇质量浓度。按公式(1)~公式(8)计算糖变化速率、乙醇生成速率等。
高效液相色谱仪测糖条件:色谱柱Alltima 5 μm Amino(250 mm×4.6 mm),配示差检测器;流动相为V(纯乙腈)∶V(超纯水)=75∶25,流速为1 mL/min,进样量为20 μL。
气相色谱仪测乙醇条件:TM-930色谱柱(25 m×0.53 mm×1 μm),配FID检测器和液体自动进样系统;柱温初始温度40 ℃,以5 ℃/min的速率升至80 ℃,保持2 min,再以10 ℃/min的速率升至150 ℃,总运行15 min,检测器温度230 ℃;进样量0.5 μL;分流比20∶1。
糖类变化速率![]()
(1)
式中:m为发酵过程中糖减少量,g/L;t为取样间隔时间,h。
(残)总糖/(g·L-1)=(残)果糖+(残)葡萄糖+(残)蔗糖×1.05
(2)
式中:1.05为1分子蔗糖(相对分子质量为342)水解为1分子果糖(相对分子质量180)和1分子葡萄糖(相对分子质量180),1.05=(180+180)/342。
总糖消耗速率![]()
(3)
式中:m为取样间隔时间内总糖消耗量,g/L;t为取样间隔时间,h。
乙醇生成速率![]()
(4)
式中:m为取样间隔时间内乙醇生成量,g/L;t为取样间隔时间,h。
葡萄糖或果糖利用率![]()
(5)
式中:m1为蔗糖水解生成的葡萄糖或果糖量,g/L;m2为残葡萄糖或果糖量,g/L;0.511为糖转化为醇的最大理论值。
总糖利用率![]()
(6)
式中:m1为初总糖量,g/L;m2为残总糖量,g/L。
总糖发酵效率![]()
(7)
式中:m1为初总糖量,g/L;m2为最终乙醇质量浓度,g/L;0.511为糖转化为醇的最大理论值。
耗糖发酵效率![]()
(8)
式中:m1为初总糖量,g/L;m2为残总糖量,g/L;m3最终乙醇质量浓度,g/L;0.511为糖转化为醇的最大理论值。
1.3.4 酿酒酵母细胞形态观察
将种子液以10%接种量接种到蔗糖发酵培养基中,培养9 h,添加丁香醛使其终质量浓度为1.4 g/L,以未添加丁香醛作为对照组,继续培养3 h,6 000 r/min、10 min收集菌体,加入2.5%(体积分数)的戊二醛于4 ℃冰箱固定过夜;再以20%、50%、70%、80%、90%、100%(体积分数)的乙醇梯度洗脱,收集菌体进行真空冷冻干燥,喷金,于扫描电子显微镜下观察酵母细胞形态。
1.3.5 核酸和蛋白质的测定
按照1.3.4的细胞培养方法,分别取经丁香醛(0、1.4 g/L)处理0、3、6 h的发酵液,3 000 r/min离心20 min,收集上清液,于260、280 nm下分别测定核酸和蛋白质的含量。
1.3.6 酿酒酵母胞内MDA含量测定
按照1.3.4的细胞培养方法,分别取经丁香醛处理0、3、6 h的菌体,加入适量10%(质量分数)三氯乙酸提取液和0.6%(质量分数)硫代巴比妥酸(thiobarbituric acid,TBA)试剂混匀,于100 ℃水浴煮沸15 min,迅速冷却后8 000 r/min离心5 min,取上清液测定450、532、600 nm下的吸光度值,以0.6% TBA为空白对照;菌体烘干测定质量,根据公式(9)、公式(10)计算MDA浓度。
MDA浓度/(μmol·L-1)=6.45(A532-A600)-0.56×A450
(9)
MDA含量![]()
(10)
式中:V为提取液量,L;m为样品质量,g。
1.3.7 FTIR测定
按照1.3.4的细胞培养方法,收集丁香醛处理3 h的菌体,用PBS缓冲液洗涤菌体3次,进行真空冷冻干燥,将冻干的酵母菌体2 mg与溴化钾200 mg充分研磨混合均匀,压片,于FTIR下测定丁香醛处理前后酿酒酵母红外吸附光谱图[11]。
1.4 数据统计与分析
以上每个指标都采取3个平行实验。实验数据采用单因素方差分析(GraphPad Prism 8.1软件)进行显著性分析(P<0.05),数据图表由Origin 9.5软件进行绘制。
2 结果与分析
2.1 丁香醛对酿酒酵母细胞生长的影响
通过在二级培养基中外源添加不同浓度的丁香醛,测定酿酒酵母GJ2008生长曲线,探究其对酵母细胞生长的影响,结果见图1。

图1 不同质量浓度丁香醛胁迫下酿酒酵母GJ2008生长曲线
Fig.1 Growth curves of S.cerevisiae GJ2008 under different concentrations of syringaldehyde
由图1可知,对照组无明显延滞期,细胞能快速适应环境进入生长期,在8 h达到稳定期;添加0.5 g/L丁香醛时,酵母细胞生长趋势与对照组相似,最终OD值略低于对照组;添加1.0、1.2 g/L的丁香醛时,酵母细胞达到稳定期的时间延长2 h;而当丁香醛质量浓度在1.4~2.0 g/L时,细胞生长出现延滞期,到达稳定期时间也由8 h延至10~16 h,最终OD值远低于对照组。以上结果表明丁香醛会抑制酿酒酵母细胞的生长,且随着丁香醛浓度的增加,细胞生长受抑制程度逐渐增强。因此,为进一步研究丁香醛对酿酒酵母细胞发酵和理化特性的影响,选取1.4 g/L丁香醛作为酵母细胞的胁迫质量浓度。
2.2 丁香醛对蔗糖乙醇发酵过程中糖代谢和乙醇代谢的影响
2.2.1 丁香醛对蔗糖乙醇发酵过程中糖代谢的影响
探究在丁香醛胁迫下,残蔗糖、残葡萄糖与残果糖的质量浓度和蔗糖水解速率、葡萄糖与果糖消耗速率的变化对了解蔗糖发酵过程的糖代谢规律具有重要意义,结果见图2。
由图2可知,SYD与CK相比,发酵过程中残蔗糖、残葡萄糖与残果糖浓度变化趋势相似,其中残葡萄糖和残果糖浓度曲线出现先上升后下降的情况,这跟蔗糖水解生成葡萄糖和果糖的量和同期的消耗量有关。在0~12 h,CK的葡萄糖和果糖消耗速率高于丁香醛处理组,而12~36 h则相反,发酵结束时最终残葡萄糖和残果糖浓度相差无几,但SYD残葡萄糖和残果糖达到最高点的时间都比对照组延后了3 h,说明丁香醛影响了糖代谢的中间过程。值得注意的是,CK和SYD有一共同点,最终残葡萄糖浓度都低于残果糖浓度,且在0~21 h葡萄糖消耗速率大于果糖消耗速率,21~36 h由于葡萄糖基本消耗完全,果糖消耗速率开始大于葡萄糖消耗速率,产生此现象的原因与发酵过程中酵母细胞己糖跨膜转运对葡萄糖亲和力优于果糖有关[12]。由上述结果可知,在蔗糖乙醇发酵过程中添加1.4 g/L丁香醛虽然对总糖消耗影响不大,但却会影响糖代谢的中间过程。
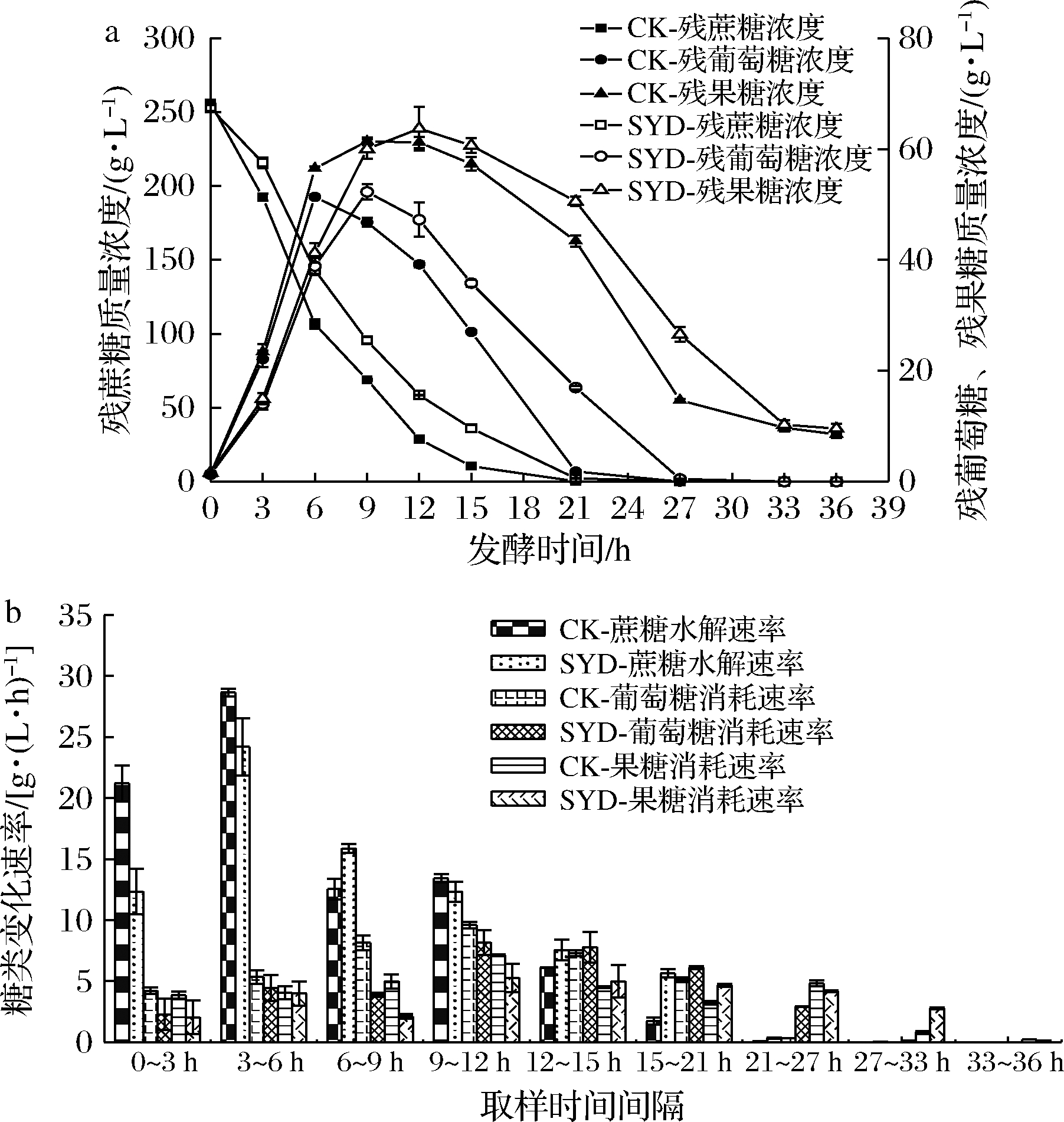
a-250 g/L蔗糖乙醇发酵过程中残蔗糖、残果糖和残葡萄糖质量浓度曲线;b-250 g/L蔗糖乙醇发酵过程中蔗糖水解速率、葡萄糖和果糖消耗速率
图2 丁香醛对蔗糖乙醇发酵过程中糖代谢的影响
Fig.2 Effects of syringaldehyde on sugar metabolism during ethanol fermentation with sucrose
注:CK表示对照组;SYD表示1.4 g/L丁香醛处理组(下同)
2.2.2 丁香醛对蔗糖乙醇发酵过程中细胞生物量、残总糖和乙醇浓度的影响
在乙醇发酵过程中,细胞生长、总糖消耗和乙醇生成这3个指标是衡量发酵过程好坏的重要因素。根据气、液相测定的实验数据以及通过1.3.3公式计算糖和醇的变化速率,绘制曲线如图3所示。
由图3可知,SYD与CK相比,最终残总糖浓度无明显差异,但OD值和最终乙醇浓度均减少18.65%,说明丁香醛影响了酵母细胞生长和发酵产乙醇的性能。从总糖消耗速率与乙醇生成速率的角度分析,SYD在0~12 h总糖消耗速率低于CK,而12~36 h却又高于CK,使得最终糖消耗基本相同。SYD乙醇生成速率在0~15 h处于劣势,虽在15~27 h以微小的优势略高于CK,但最终乙醇质量浓度(99.81 g/L)远低于对照组(122.69 g/L),分析原因是丁香醛渗透到细胞膜内,抑制细胞的生长,减缓了总糖消耗速率,影响了细胞膜作为选择性屏障及酶基质的功能,使得产乙醇性能显著降低[13]。以上结果说明,丁香醛抑制了细胞的生长,降低了乙醇生成速率和最终乙醇浓度,使得酵母细胞产乙醇性能下降。

a-250 g/L蔗糖乙醇发酵过程中生物量、残总糖和乙醇生成曲线;b-250 g/L蔗糖乙醇发酵过程中总糖消耗速率与乙醇生成速率
图3 丁香醛对蔗糖乙醇发酵过程中细胞生物量、残总糖和乙醇的影响
Fig.3 Effects of syringaldehyde on biomass,total residual sugar and ethanol production during ethanol fermentation with sucrose
2.2.3 丁香醛对蔗糖乙醇发酵效果的影响
将气相色谱仪、高效液相色谱仪测出的乙醇与葡萄糖、果糖、蔗糖数据根据1.3.3的公式计算得到表1。
表1 250 g/L蔗糖乙醇发酵结果
Table 1 The results of ethanol fermentation with 250 g/L sucrose
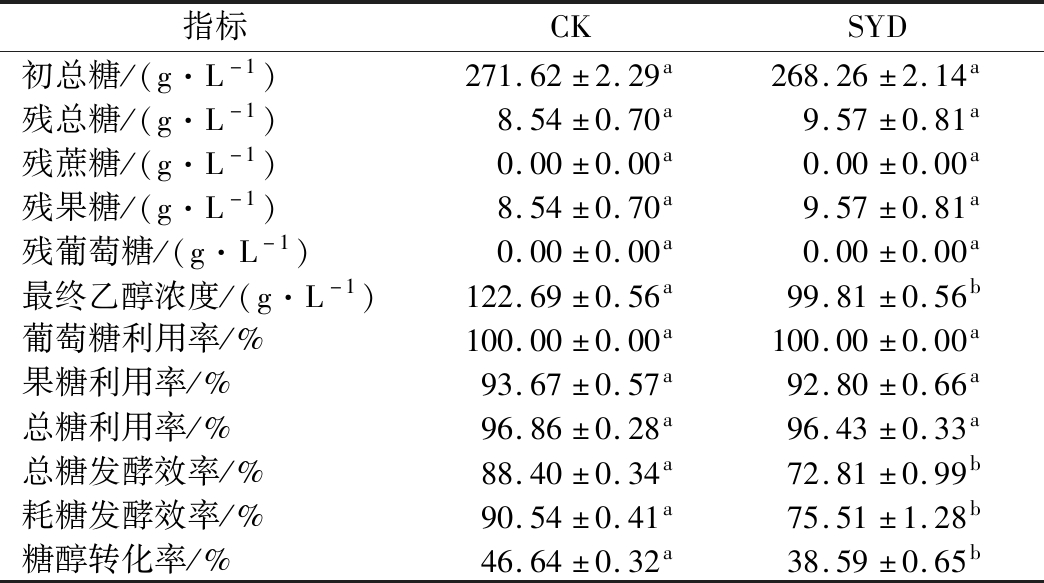
指标CKSYD初总糖/(g·L-1)271.62±2.29a268.26±2.14a残总糖/(g·L-1)8.54±0.70a9.57±0.81a残蔗糖/(g·L-1)0.00±0.00a0.00±0.00a残果糖/(g·L-1)8.54±0.70a9.57±0.81a残葡萄糖/(g·L-1)0.00±0.00a0.00±0.00a最终乙醇浓度/(g·L-1)122.69±0.56a99.81±0.56b葡萄糖利用率/%100.00±0.00a100.00±0.00a果糖利用率/%93.67±0.57a92.80±0.66a总糖利用率/%96.86±0.28a96.43±0.33a总糖发酵效率/%88.40±0.34a72.81±0.99b耗糖发酵效率/%90.54±0.41a75.51±1.28b糖醇转化率/%46.64±0.32a38.59±0.65b
注:小写字母不同表示组间存在显著性差异(P<0.001)
由表1可知,添加1.4 g/L SYD与CK相比,最终乙醇浓度、总糖发酵效率、耗糖发酵效率和糖醇转化率分别降低了18.65%、17.64%、17.26%、17.26%。酵母细胞消耗的总糖可用于菌体生长、繁殖、代谢产乙醇及其他高级醇等副产物,而本文SYD糖醇转化率和耗糖发酵效率较低,其原因可能是酵母细胞为应对胁迫环境,发酵产物转向杂醇油等其他副产物[14]。综上可知,在蔗糖乙醇发酵过程中外源添加1.4 g/L丁香醛会使最终乙醇生成浓度与糖醇转化率降低。
2.3 丁香醛对酿酒酵母细胞形态的影响
为探究丁香醛是否会对酿酒酵母的形态造成损伤,本文通过SEM观察了1.4 g/L丁香醛胁迫下酿酒酵母细胞形态的变化,结果如图4所示。对照组酵母细胞表面光滑、饱满,平整、紧凑,没有出现破裂或孔现象;而丁香醛处理组酵母细胞出现些许空洞、胞间粘连、部分细胞内容物外泄的情况,使得部分细胞受到损伤甚至死亡。

a-对照组;b-丁香醛处理组(3 h)
图4 对照组和丁香醛处理组中酿酒酵母GJ2008的SEM(×8 000)
Fig.4 SEM (×8 000) images of S.cerevisiae GJ2008 in control group and syringaldehydes treatment group
2.4 丁香醛对酿酒酵母细胞膜通透性的影响
测定发酵上清液中的OD260值和OD280值不仅可反映核酸和蛋白质的泄漏情况,且可间接反映细胞膜损伤的程度[15]。由图5可知,酵母细胞经1.4 g/L丁香醛胁迫处理后,其胞内核酸和蛋白质外泄量显著性增加(P<0.05),且随着处理时间的增加,其外泄量就越多;与CK相比,SYD在处理6 h后,核酸和蛋白质外泄量分别增加了56.39%、58.29%。以上结果说明,丁香醛破坏了部分酵母细胞膜的完整性,增大了细胞膜通透性,使得胞内物外泄,影响细胞正常的生理功能。
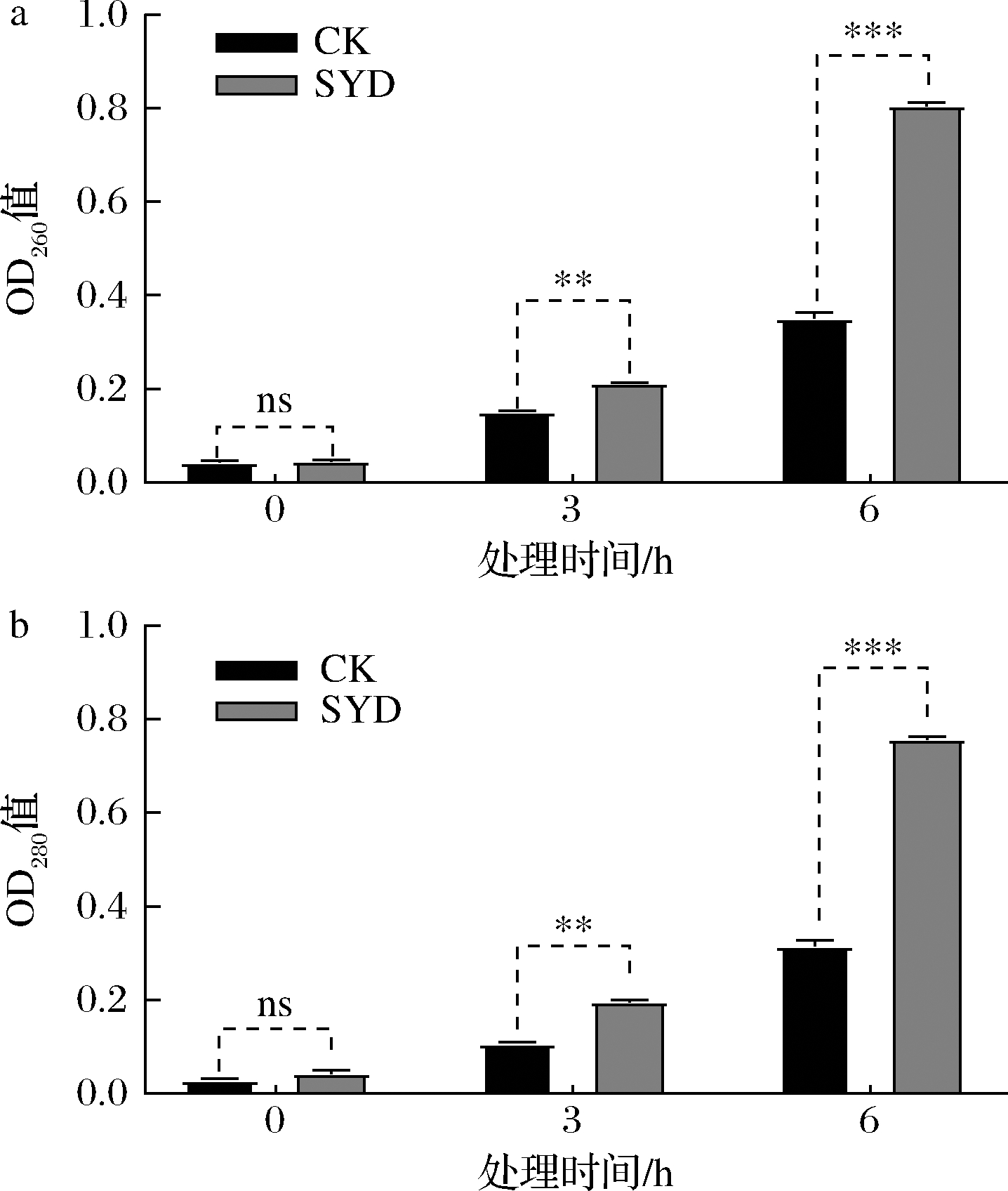
a-OD260值;b-OD280值
图5 丁香醛胁迫下酿酒酵母GJ2008细胞膜通透性的变化
Fig.5 Changes of membrane permeability of S.cerevisiae GJ2008 under syringaldehydes stress
注:ns表示组间无显著性差异;**、***分别是在P<0.01、P<0.001下表示组间存在显著性差异(下同)
2.5 丁香醛对酿酒酵母细胞内MDA含量的影响
测定丁香醛胁迫下酵母胞内MDA含量的变化不仅可反映机体内脂质过氧化的程度,还可间接反映细胞受到活性氧(reactive oxygen species,ROS)攻击后的损伤程度[16],结果如图6所示。
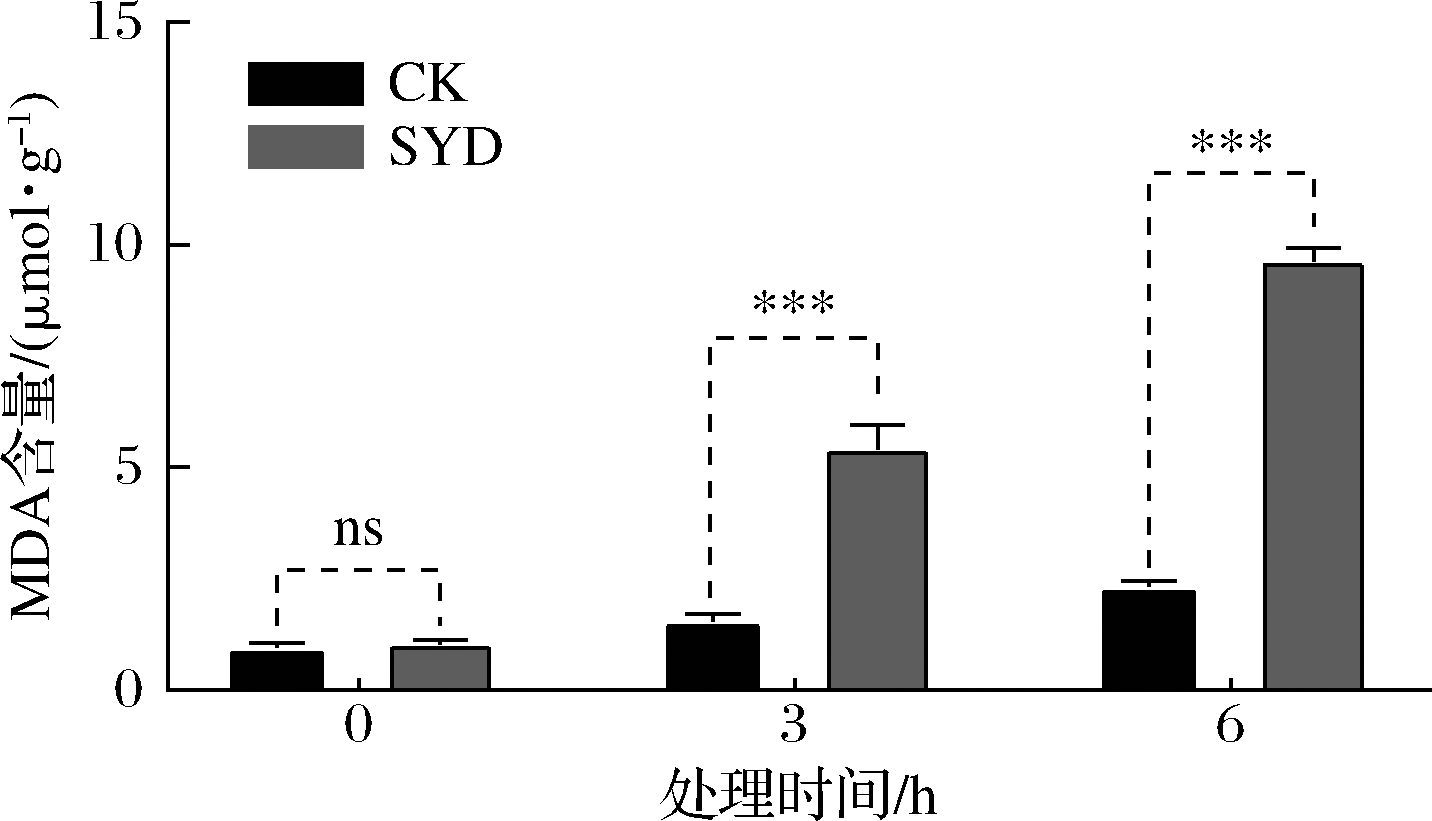
图6 丁香醛胁迫下酿酒酵母GJ2008胞内MDA含量的变化
Fig.6 Changes of intracellular MDA content of S.cerevisiae GJ2008 under syringaldehydes stress
由图6可知,与CK相比,SYD胞内MDA含量显著性增加(P<0.05),且随着处理时间的延长而逐渐增加,结果与2.4中核酸与蛋白质外泄量随着时间增加而增加呈高度相似性;胞内MDA值在经丁香醛处理3 h和6 h后分别增加了3.47和4.13倍。酵母在正常的生理状态下,菌体生长迅速,代谢能力强,其体内的抗氧化酶能够及时的清除氧化代谢产物,但当处于严重的胁迫环境时,产生的过多氧自由基会对部分酵母造成氧化损伤,使得过氧化产物MDA含量增加并积累。以上研究结果表明,酿酒酵母在1.4 g/L丁香醛胁迫下会造成细胞膜脂质过氧化反应,MDA含量显著性增加,胞内自由基过多积累,细胞受损。
2.6 FTIR结果分析
本文采用FTIR间接表征了1.4 g/L丁香醛处理前后酿酒酵母细胞结构中活性基团变化情况,结果如图7所示。参考相关文献[17-19],可将酿酒酵母中主要红外峰位进行归属,如表2所示。
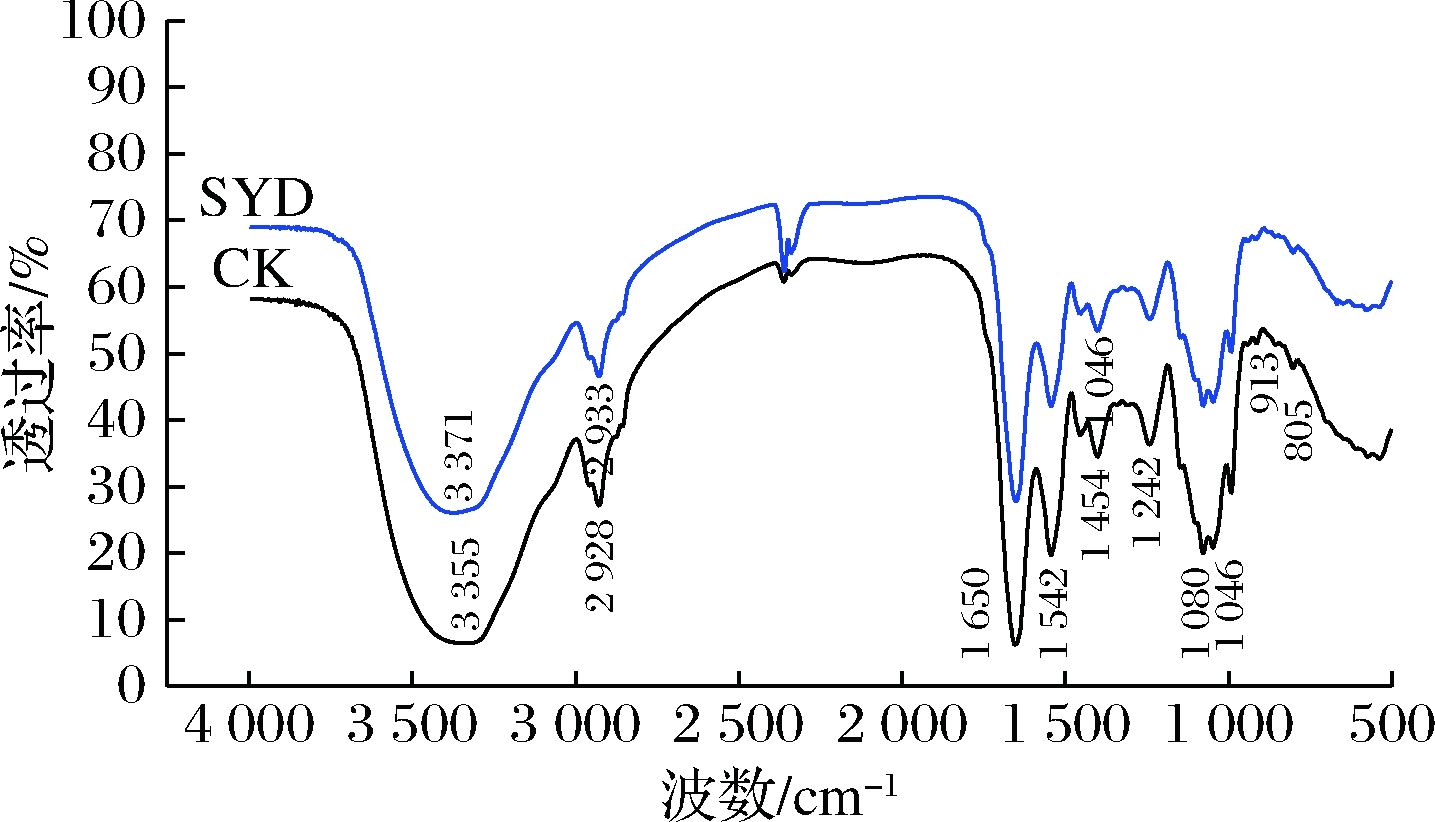
图7 丁香醛胁迫下酿酒酵母GJ2008红外光谱图变化
Fig.7 Changes of fourier infrared spectra of S.cerevisiae GJ2008 under syringaldehydes stress
表2 酿酒酵母GJ2008主要红外峰位可能的归属
Table 2 The possible attribution of the main infrared peaks of S.cerevisiae GJ2008
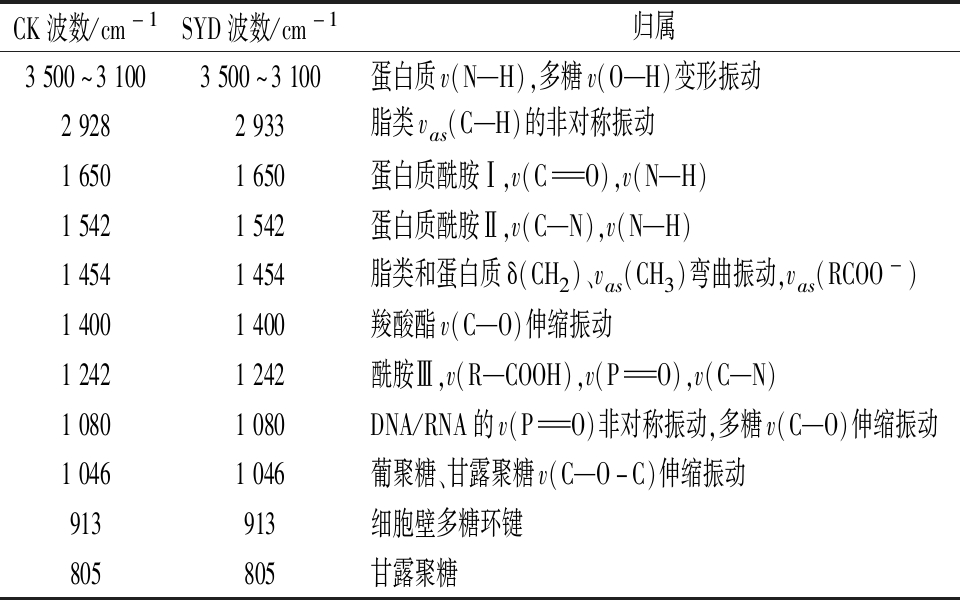
CK波数/cm-1SYD波数/cm-1归属3500~31003500~3100蛋白质v(N—H),多糖v(O—H)变形振动29282933脂类vas(C—H)的非对称振动16501650蛋白质酰胺Ⅰ,v(C O),v(N—H)15421542蛋白质酰胺Ⅱ,v(C—N),v(N—H)14541454脂类和蛋白质δ(CH2)、vas(CH3)弯曲振动,vas(RCOO-)14001400羧酸酯v(C—O)伸缩振动12421242酰胺Ⅲ,v(R—COOH),v(P O),v(C—N)10801080DNA/RNA的v(P O)非对称振动,多糖v(C—O)伸缩振动10461046葡聚糖、甘露聚糖v(C—O-C)伸缩振动913913细胞壁多糖环键805805甘露聚糖
由图7和表2可知,比较对照组和丁香醛处理组酿酒酵母红外图谱,没有出现新的红外吸收峰,说明酿酒酵母在丁香醛胁迫下仍保持原有的基本化学结构。值得注意的是,在3 500~3 100 cm-1有一个强而宽的吸收峰,这是基团N—H变形振动和分子内或分子间氢键O—H伸缩振动产生的,酵母经丁香醛胁迫后,3 355 cm-1处的强宽峰蓝移至3 371 cm-1,说明酵母细胞膜上的多糖、脂肪酸及蛋白质的O—H和N—H基团可能发生了变化;在2 928 cm-1处有一较强的吸收峰,这是由三酰基甘油中脂肪酸的C—H基团的非对称振动引起的,而丁香醛处理组此基团的吸收峰移至2 933 cm-1,表明脂肪酸的C—H基团发生了位移。综上,丁香醛通过影响细胞膜上脂肪酸、蛋白质和多糖结构,改变了细胞膜通透性,进而引起部分细胞损伤甚至死亡。
3 结论与讨论
酿酒酵母是甘蔗糖蜜乙醇发酵的主体微生物,在将糖转化成乙醇的过程中会面对各种环境胁迫,酵母也会对胁迫条件做出应答。为揭示发酵过程中丁香醛对酿酒酵母的影响,本研究以耐高糖的优良酿酒酵母GJ2008为出发菌株,250 g/L蔗糖替代甘蔗糖蜜中的可发酵性糖作为发酵体系,考察不同浓度丁香醛对酿酒酵母细胞生长的影响,并系统的探究酿酒酵母在1.4 g/L丁香醛胁迫下的毒性机理。
随着丁香醛浓度的增大酿酒酵母细胞生长受抑制程度不断增强。在酵母蔗糖乙醇发酵过程中,丁香醛处理组与对照组糖消耗速率和乙醇生成速率均呈现先升高后下降的趋势,说明发酵刚开始时,酵母活性较高且营养物质丰富,使得生长代谢速度加快,乙醇生成速率也比较快;而发酵后期,由于发酵液中乙醇和其他副产物含量的增多造成酵母活性降低、乙醇生成速率减慢。值得注意的是,丁香醛处理组与对照组相比,最大乙醇生成速率的发酵时间向后延长了3 h,分析原因是丁香醛可改变细胞膜上蛋白与脂质的比例,干扰离子通道、ATP合成,从而扰乱细胞膜的功能,抑制细胞生长,造成乙醇发酵效率降低、最终乙醇浓度不高等不良现象[20]。此结论与儿茶酚对酿酒酵母细胞发酵过程中糖和乙醇代谢影响的结论相似[21]。研究表明,细胞在外界胁迫下,会改变细胞形态、增大细胞膜通透性、破坏膜流动性与稳定性[22];同时,会在胞内累积ROS[23],虽然适量ROS是细胞生长、繁殖所必需的,但是过多的ROS会攻击膜和蛋白质[24-25],使细胞质膜发生过氧化反应,引起膜氧化损伤[26],细胞膜表面上的蛋白质和酶表达系统受到抑制[27],进而影响细胞正常生长与代谢。而本研究表明酿酒酵母在丁香醛胁迫下,部分细胞发生皱褶、空洞、胞内物外泄,出现胞间粘连在一起的现象;同时,MDA含量的显著增加和细胞膜脂肪酸、蛋白质、多糖成分中部分基团的改变也证明了丁香醛破坏了酵母细胞膜的完整性,这也从理化特性的角度解释了糖醇代谢受阻的原因。后期可通过转录组学和代谢组学手段进行深层次分析丁香醛对酿酒酵母乙醇发酵的影响机制。
本文通过对丁香醛胁迫下酿酒酵母的生长、发酵过程和理化特性进行研究,揭示了丁香醛对酵母细胞的毒性机理,为后期培育耐受型菌株并提高糖蜜乙醇发酵能力,实现糖蜜高浓度乙醇发酵生产提供了理论基础。
[1] MOHD AZHAR S H,ABDULLA R,JAMBO S A,et al.Yeasts in sustainable bioethanol production:A review[J].Biochemistry and Biophysics Reports,2017,10:52-61.
[2] JEONG D,YE S J,PARK H,et al.Simultaneous fermentation of galacturonic acid and five-carbon sugars by engineered Saccharomyces cerevisiae[J].Bioresource Technology,2020,295:122259.
[3] 李清岚,崔春,王炜.甘蔗糖蜜和甜菜糖蜜中主要活性物质及其生理功能研究进展[J].食品与机械,2021,37(4):207-211.
LI Q L,CUI C,WANG W.Research progress on the main active components and physiological functions of sugarcane molasses and beet molasses[J].Food and Machinery,2021,37(4):207-211.
[4] PAYET B,SHUM CHEONG SING A,SMADJA J.Comparison of the concentrations of phenolic constituents in cane sugar manufacturing products with their antioxidant activities[J].Journal of Agricultural and Food Chemistry,2006,54(19):7 270-7 276.
[5] SINGH A,LAL U R,MUKHTAR H M,et al.Phytochemical profile of sugarcane and its potential health aspects[J].Pharmacognosy Reviews,2015,9(17):45-54.
[6] GOVARDHAN SINGH R S,NEGI P S,et al.Phenolic composition,antioxidant and antimicrobial activities of free and bound phenolic extracts of Moringa oleifera seed flour[J].Journal of Functional Foods,2013,5(4):1 883-1 891.
[7] PAYET B,SHUM CHEONG SING A,SMADJA J.Assessment of antioxidant activity of cane brown sugars by ABTS and DPPH radical scavenging assays:Determination of their polyphenolic and volatile constituents[J].Journal of Agricultural and Food Chemistry,2005,53(26):10 074-10 079.
[8] CABA AS K T,PE
AS K T,PE A-MORENO I C,PARENTE D C,et al.Selection of Saccharomyces cerevisiae isolates for ethanol production in the presence of inhibitors[J].3 Biotech,2019,9(1):6.
A-MORENO I C,PARENTE D C,et al.Selection of Saccharomyces cerevisiae isolates for ethanol production in the presence of inhibitors[J].3 Biotech,2019,9(1):6.
[9] 周平平.生物炼制发酵微生物的呋喃醛和酚醛抑制物脱毒机制和应用研究[D].上海:华东理工大学,2019.
ZHOU P P.Analysis of detoxification mechanism of furan and phenolic aldehyde inhibitors of biorefinery fermenting strains and its extended applications[D].Shanghai:East China University of Science and Technology,2019.
[10] 顾翰琦,刘冉,邵玲智,等.酿酒酵母对酚类抑制物耐受性研究[J].生物技术通报,2020,36(6):136-142.
GU H Q,LIU R,SHAO L Z,et al.Study on the tolerance of Saccharomyces cerevisiae strain to phenolic inhibitors[J].Biotechnology Bulletin,2020,36(6):136-142.
[11] LORENZO F,CORTE L,ROSCINI L,et al.A novel FTIR-based approach to evaluate the interactions between lignocellulosic inhibitory compounds and their effect on yeast metabolism[J].RSC Advances,2016,6(53):47 981-47 989.
[12] LIN Z G,LI W H.Expansion of hexose transporter genes was associated with the evolution of aerobic fermentation in yeasts[J].Molecular Biology and Evolution,2010,28(1):131-142.
[13] PALMQVIST E,HAHN-H GERDAL B.Fermentation of lignocellulosic hydrolysates.II:Inhibitors and mechanisms of inhibition[J].Bioresource Technology,2000,74(1):25-33.
GERDAL B.Fermentation of lignocellulosic hydrolysates.II:Inhibitors and mechanisms of inhibition[J].Bioresource Technology,2000,74(1):25-33.
[14] BISSON L F,FAN Q W,WALKER G A.Sugar and glycerol transport in Saccharomyces cerevisiae[J].Advances in Experimental Medicine and Biology,2016,892:125-168.
[15] SHI Y G,ZHU Y J,SHAO S Y,et al.Alkyl ferulate esters as multifunctional food additives:Antibacterial activity and mode of action against Escherichia coli in vitro[J].Journal of Agricultural and Food Chemistry,2018,66(45):12 088-12 101.
[16] 王玉.高渗、低温和氧化条件下酵母细胞应激产生活性物质的研究[D].天津:天津科技大学,2005.
WANG Y,Studies on stress response of yeast cell and derivative produced under hyperosmosis,low temperature and oxidative condition[D].Tianjin:Tianjin University of Science and Technology,2005.
[17] 沈扬皓,郑新艳,王晓彧,等.甲醛修饰酿酒酵母对铀的吸附研究[J].环境科学学报,2017,37(9):3 390-3 397.
SHEN Y H,ZHENG X Y,WANG X Y,et al.Biosorption of uranium by methanal modified Saccharomyces cerevisiae[J].Acta Scientiae Circumstantiae,2017,37(9):3 390-3 397.
[18] SALMAN A,SHUFAN E,SHARAHA U,et al.Distinction between mixed genus bacteria using infrared spectroscopy and multivariate analysis[J].Vibrational Spectroscopy,2019,100:6-13.
[19] DAS S,DEY P,ROY D,et al.N-Acetyl-D-glucosamine production by a chitinase of marine fungal origin:A case study of potential industrial significance for valorization of waste chitins[J].Applied Biochemistry and Biotechnology,2019,187(1):407-423.
[20] KEWELOH H,WEYRAUCH G,REHM H J.Phenol-induced membrane changes in free and immobilized Escherichia coli[J].Applied Microbiology and Biotechnology,1990,33(1):66-71.
[21] 曾令杰,丰丕雪,黄锦翔,等.基于转录组测序技术的儿茶酚胁迫下酿酒酵母响应机制研究[J].食品与发酵工业,2021,47(17):47-53.
ZENG L J,FENG P X,HUANG J X,et al.Mechanism of Saccharomyces cerevisiae response to catechol stress at transcriptome level[J].Food and Fermentation Industries,2021,47(17):47-53.
[22] ECHEVERRIGARAY S,SCARIOT F J,MENEGOTTO M,et al.Anthocyanin adsorption by Saccharomyces cerevisiae during wine fermentation is associated to the loss of yeast cell wall/membrane integrity[J].International Journal of Food Microbiology,2020,314:108383.
[23] WANG X F,ZHAO G P,LIANG J T,et al.PFOS-induced apoptosis through mitochondrion-dependent pathway in human-hamster hybrid cells[J].Mutation Research/Genetic Toxicology and Environmental Mutagenesis,2013,754(1-2):51-57.
[24] 陆其聪,方涛,戴和平,等.纳米氧化铜对酿酒酵母的细胞毒性机制研究[J].环境科学学报,2013,33(8):2 341-2 348.
LU Q C,FANG T,DAI H P,et al.The cytotoxicity mechanism of CuO nanoparticles to yeast Saccharomyces cerevisiae BY4741[J].Acta Scientiae Circumstantiae,2013,33(8):2 341-2 348.
[25] MA Q,FANG H Q,SHANG W,et al.Superoxide flashes:Early mitochondrial signals for oxidative stress-induced apoptosis[J].The Journal of Biological Chemistry,2011,286(31):27 573-27 581.
[26] REN Z H,GUO C Y,HE H Y,et al.Effects of deoxynivalenol on mitochondrial dynamics and autophagy in pig spleen lymphocytes[J].Food and Chemical Toxicology,2020,140:111357.
[27] DONG S J,YI C F,LI H.Changes of Saccharomyces cerevisiae cell membrane components and promotion to ethanol tolerance during the bioethanol fermentation[J].The International Journal of Biochemistry &Cell Biology,2015,69:196-203.