藠头是百合科的多年生宿根性草本植物,辣椒是茄科辣椒属植物,在我国主要产地集中于云南四川和湖南等地,发酵后的藠头和辣椒具有优秀的抗菌、抗缺氧和免疫调节功能[1-2]。此外,发酵后产生的乳酸及有机酸能够提高食欲,促进胃肠消化[3]。泡藠头与泡辣椒作为自然发酵的蔬菜制品,具有丰富的微生物群系,泡藠头和泡辣椒中的微生物主要来源于环境和原料表面[4]。泡藠头和泡辣椒中微生物种群的构成与原料、环境以及制作工艺等因素密切相关[5]。研究表明,乳酸菌为主要优势菌群[4-6],其对泡藠头和泡辣椒风味品质的形成具有重要的作用[7]。乳酸菌及其混合发酵产生的酸和醇是形成酯类化合物 (藠头香气) 的主要来源[8]。研究发现,泡藠头与泡椒发酵液中富含戊糖片球菌(Pediococcus pentosaceus)、发酵乳杆菌(Lactobacillus fermentum)、食果糖乳杆菌(Lactobacillus fructivorans)和植物乳杆菌(Lactobacillus plantarum)等乳酸菌[9-11]。其中植物乳杆菌具有较强的产酸能力与耐盐性,可作为腌渍藠头和辣椒的发酵菌种[12]。
相较传统的纯化培养技术,高通量测序技术实现了不同样品间微生物菌群的比较分析。目前关于高通量测序技术在发酵辣椒和藠头的微生物多样性分析中的应用报道较少,关于云南腌渍辣椒和藠头的细菌和真菌多样性研究更是尚未发现。
本研究采用高通量测序技术对昆明、文山和红河地区的腌渍藠头和辣椒中细菌和真菌菌落结构进行分析,以期为后续腌渍藠头和辣椒等特色泡菜制品的微生物多样性研究提供一定的数据参考。
1 材料与方法
1.1 供试样品与试剂
1.1.1 供试样品
腌渍藠头、辣椒:采自云南省文山州、红河州和昆明市的农贸市场,共采集样品5种,分别标记为文山泡藠头(WJ)、文山泡辣椒(WL)、红河泡藠头(HJ)、红河泡辣椒(HL)、昆明泡藠头(KJ)。
1.1.2 试剂
基因组DNA提取试剂盒、DNA凝胶回收试剂盒、PCR试剂盒、Manual_XLR70试剂盒,Qiagen公司;TruSeq测序配套试剂,北京诺禾致源科技股份有限公司。
1.2 仪器与设备
Illumina NovaSeq6000测序平台、JY04S-3C型凝胶成像分析系统、JY600C型核酸电泳仪,北京君意东方电泳设备有限公司;TGL-16aR型冷冻离心机,上海安亭科学仪器厂。
1.3 实验方法
1.3.1 样品采集
分别于云南省文山州、红河州和昆明市的农贸市场对腌渍藠头和辣椒进行采集,装入样品袋中低温保存运回实验室。
1.3.2 基因组DNA提取
采用十六烷基三甲基溴化铵(cetyltrimethylammonium bromide,CTAB)或十二烷基磺酸钠(sodium dodecyl sulfate,SDS)提取的方法对样本的基因组DNA进行提取,之后利用1%琼脂糖凝胶电泳检测DNA的纯度和浓度,取适量的样本DNA于离心管中,使用无菌水稀释样本至1 ng/μL。
1.3.3 PCR扩增及Illumina测序
对样品基因组进行扩增,引物序列为341F(5′-CCTACGGGNGGCWGCAG-3′),806R(5′-GGACTACHVGGGTATCTAAT-3′)扩增细菌16S rDNA V3~V4区。对样品基因组扩增,引物序列为5′-CTTGGTCATTTAGAGGAAGTAA-3′和5′-TGCGTTCTTCATCG ATGC-3′扩增真菌ITS1(ITS1~ITS2)区。
所有PCR反应均使用15 μL Phusion®High-Fidelity PCR Master Mix(New England Biolabs)、0.2 μmol/L正反向引物和约10 ng模板DNA进行。PCR扩增条件为95 ℃预变性30 s,循环1次,95 ℃变性15 s,60~72 ℃退火15 s,72 ℃延伸30~60 s,循环30次,最后72 ℃ 再延伸15 min。将等量的1×负载缓冲液(含SYB green)与PCR产物混合,使用2%琼脂糖凝胶进行电泳检测,琼脂糖凝胶电泳检测合格后,寄往北京诺禾致源科技股份有限公司完成高通量测序,测序平台为Illumina NovaSeq6000。
1.3.4 数据分析
测序完成后,按照目的片段的大小,剔除质量不合格的原始序列,对合格的序列进行拼接。按照97%相似度阈值进行分类,建立操作分类单元(operational taxonomic unit,OTU),通过核糖体数据库项目朴素贝叶斯算法鉴定OTU种系型。基于细菌群落的组成,在门和属两个水平上进行样品的细菌多样性分析。同时,对OTUs进行丰度、α多样性计算等分析,以得到样本内物种丰富度和均匀度信息、不同样本或分组间的共有和特有OTUs信息等。使用Origin 8.5软件绘制图形。
2 结果与分析
2.1 泡藠头和泡辣椒的细菌菌落组成
通过对97%相似水平的OTU代表序列进行分类学分析,统计各个样品门和属水平的菌落组成,根据各样品不同属的细菌所占比例作图,并将相对丰度<0.1%的部分合并为其他(other)。不同地区泡藠头和泡辣椒细菌相对丰度占比如图1和图2所示。

图1 泡藠头和泡辣椒样品中细菌门水平分布图
Fig.1 Phylum level distribution of bacteria in pickled Chinese onion and pickled pepper

图2 泡藠头和泡辣椒样品中细菌属水平分布图
Fig.2 Genus level distribution of bacteria in pickled Chinese onion and pickled pepper
如图1所示,基于OTU结果表明,厚壁菌门(Firmicutes)、变形杆菌门(Proteobacteria)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes)为泡藠头和泡辣椒的主要共有菌门。其中,厚壁菌门和变形杆菌门为优势菌门,相对丰度占比分别为50.61%、58.07%、53.13%、99.20%、11.97% 和47.36%、35.63%、44.96%、0.58%、58.18%。此外,当样品中变形杆菌门相对丰度升高时,厚壁菌门相对丰度降低;其中WL中变形菌门比例最高,达到了58.19%;另外,WL中放线菌门和拟杆菌门相对丰度为16.83%和10.42%,与LIANG等[13]的研究结果一致。向凡舒等[14]运用高通量测序技术对腌制蔬菜的细菌菌群结构分析结果表明其优势细菌门也为厚壁菌门。综上所述,泡藠头和泡椒的菌落结构相似,但相对丰度差别较大。
如图2所示,泡藠头和泡辣椒样品中相对丰度>1%的细菌有17个属,包括乳酸杆菌属(Lactobacillus)、明串珠菌属(Leuconostoc)、乳球菌属(Lactococcus)和魏斯氏菌属(Weissella)等乳酸菌和假单胞菌属(Pseudomonas)、葡萄球菌属(Staphylococcus)等常见致病菌。其中,WJ中乳酸杆菌属的相对丰度最高,占比为98.07%,明显高于其他样品;在不同地区的泡藠头和泡辣椒样品中明串珠菌属相对丰度占比为0.02%~19.46%,KJ中明串珠菌属相对丰度占比最高,为19.46%;在HL和HJ中魏斯氏菌属相对丰度占比较高,分别为8.96%和17.70%。研究表明,乳酸菌在促进蛋白质分解为脂肪酸和改善风味方面具有很大优势,这大大延长了泡辣椒和泡藠头的贮藏期并且具有良好的风味[15]。此外既往研究结果得出,发酵蔬菜中的乳酸菌大多数来自于乳酸杆菌属,这与本研究结果相符[16-21]。另外JEONG等[22]研究表明韩国发酵蔬菜中乳酸杆菌属、魏斯氏菌属和明串珠菌属丰度较高,造成不同地区泡藠头中乳酸菌类群存在差异的原因除与原料种类有关外,还与地域和制作工艺等诸多因素有关。
2.2 泡藠头和泡辣椒的真菌菌落组成
根据OTU结果,对泡藠头和泡辣椒中每个样品中真菌OTU进行分类学分析,进而研究泡藠头和泡辣椒中的真菌菌落的组成,真菌纲水平和属水平分析结果如图3和图4所示。
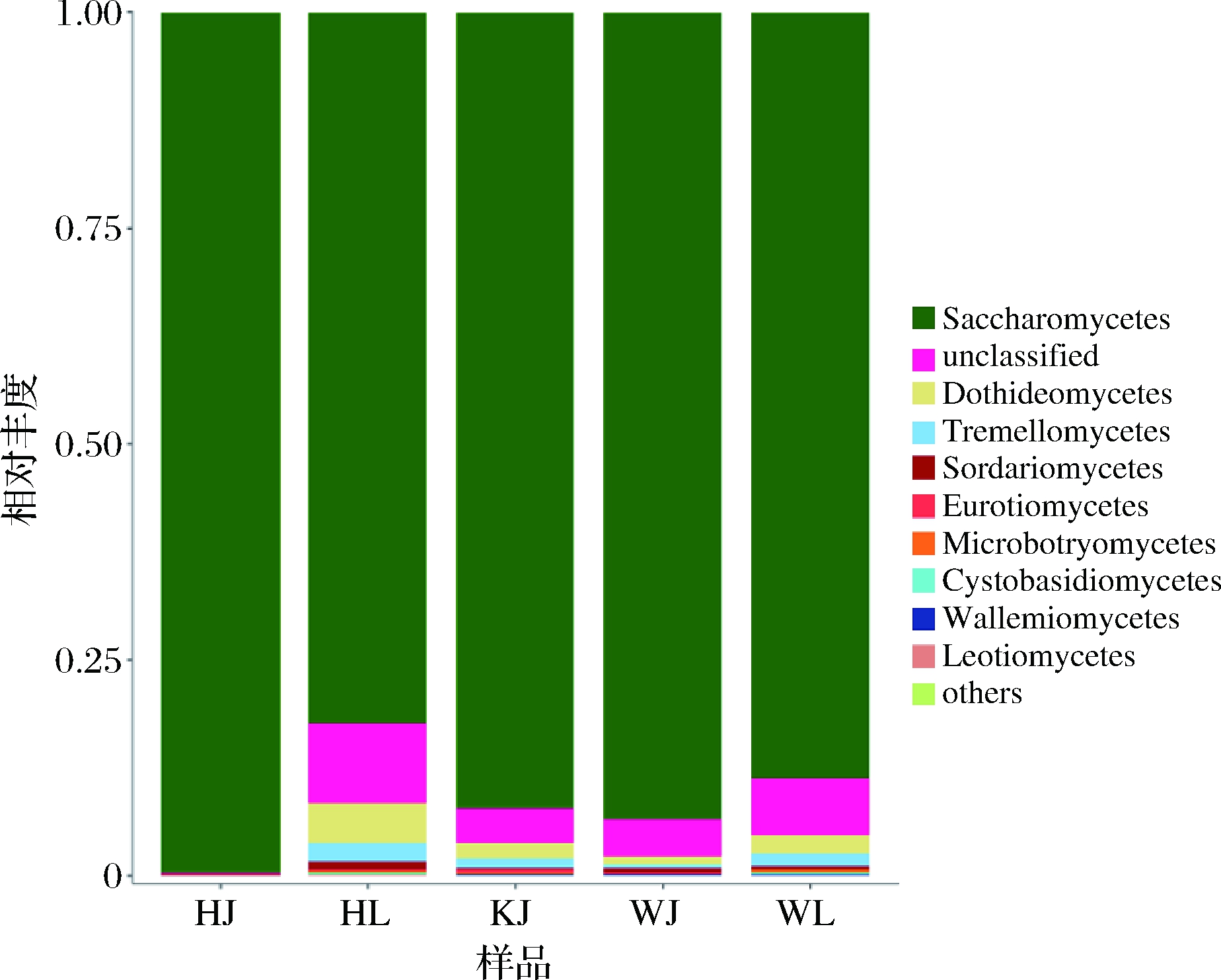
图3 泡藠头和泡辣椒样品真菌纲水平的分布图
Fig.3 Class level distribution of fungi in pickled Chinese onion and pickled pepper

图4 泡藠头和泡辣椒样品真菌属的分布图
Fig.4 Genus level distribution of fungi in pickled Chinese onion and pickled hot pepper
如图3所示,泡藠头和泡辣椒样品中真菌在纲水平上,共检测到酵母菌(Saccharomycetes)、座囊菌(Dothideomycetes)和伞菌(Agaricomycetes)。其中,酵母菌在KJ、WJ、HJ和WJ中占比>75%。这表明,泡辣椒和泡藠头样品的优势真菌门为酵母菌,这可能与其较高的食盐耐受力有关。李恒等[23]研究表明,发酵蔬菜样品中优势真菌门为酵母菌,与本实验研究的结果相同,酵母菌被认为是传统发酵泡菜中的主要真菌。
由图4可知,泡藠头和泡辣椒样品中相对丰度>1%的真菌有8个属,分别为接合酵母菌属(Zygosaccharomyces)、毕赤酵母属(Pichia)、阿萨希丝孢酵母属(Trichosporon)、汉逊酵母属(Hanseniaspora)、念珠菌属(Candida)、孢子菌属(Mycosphaerella)、环孢菌(Torulaspora)和枝孢菌(Cladosporium)。其中,WL、WJ、HJ和HL中接合酵母菌属为优势菌种,相对丰度占比分别为60%;KJ中毕赤酵母属为优势菌种。有研究报告指出,采样地点不同和原料不同的发酵蔬菜样品的优势真菌均为接合酵母菌属[24]。而本研究也首次发现阿萨希丝孢酵母属在泡藠头或泡辣椒中作为主要真菌属,阿萨希丝孢酵母属多见于温热地区,是一种常见致病酵母菌[25-26],可能由于发酵时气候炎热,导致出现真菌感染,其在泡藠头和泡辣椒的作用特性和危害有待进一步探索。
2.3 OTUs分类学分析及多样性分析
2.3.1 OTU聚类统计
如表1和表2所示,在OTU划分的基础上,所有真菌序列划分为133个门、316个纲、488个目、851个科和1 342个属;所有的细菌序列则被划分为133个门、316个纲、488个目、851个科和1 342个属。
表1 样品真菌群落各分类地位数量 单位:个
Table 1 Number of fungal communities in each taxonomic position
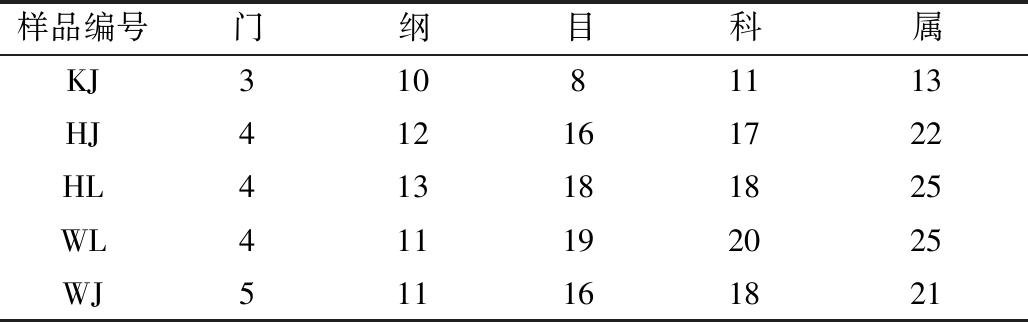
样品编号门纲目科属KJ31081113HJ412161722HL413181825WL411192025WJ511161821
表2 样品细菌群落各分类地位数量 单位:个
Table 2 Number of bacterial communities in each taxonomic position
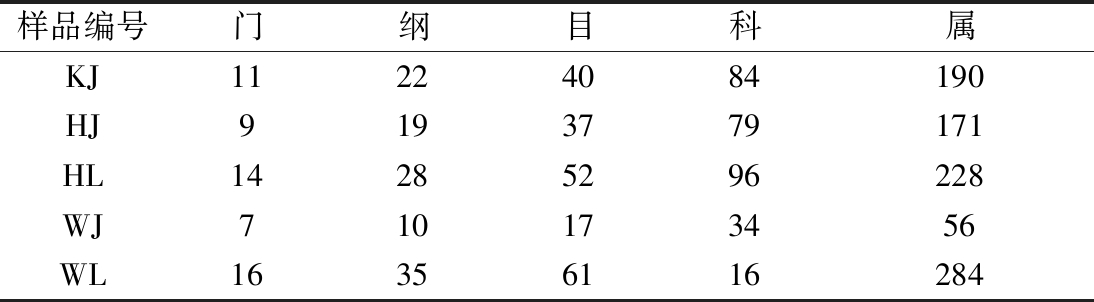
样品编号门纲目科属KJ11224084190HJ9193779171HL14285296228WJ710173456WL16356116284
由图5-a可知,5个样品中共有真菌OTU数量为178,而样品KJ、WL、WJ、HL和HJ中特有的真菌OTU数量分别为1 065、614、609、570和671,说明昆明地区的泡藠头中的真菌群落多样性高于其他2个地区。由图5-b可知,5种泡菜样品中共有细菌OTU有110个。在不同样品组间独有细菌OTU数量也存在差异,其中,WL的OTU数量最多,有341个,WJ的OTU数量最少,有17个;而HJ、HL和KJ的OTU数量分别为195、67和151个。表明在文山地区的的泡藠头和泡辣椒间细菌种类存在差异。综合分析,在3个地区的泡菜样品中细菌的OTU数量明显少于真菌的OTU数量。

a-真菌;b-细菌
图5 微生物群落维恩图
Fig.5 Venn diagram of microbial community
2.3.2 α-多样性分析
α多样性分析能够表示样品中微生物的丰富度与均匀度,其中Chao1指数能够评价微生物菌落的丰富度,其值的大小随着菌群丰富度的升高而增加;Shannon指数和Simpson指数在反应微生物菌落丰富度的基础上还能够反应样品中菌落结构均匀度,Shannon指数和Simpson指数随着微生物菌落丰富度与均匀度的升高而增大[13]。
由表3可知,就真菌而言,在5种样品中HJ的Chao1指数和Shannon指数最高;KJ的Chao1指数最低,WL的Shannon指数最低。这说明HJ样品具有最高的真菌物种多样性和均匀度,而KJ样品的真菌物种多样性最低,WL的真菌物种均匀度最低。
表3 真菌生物多样性指标
Table 3 Indicators of fungal biodiversity
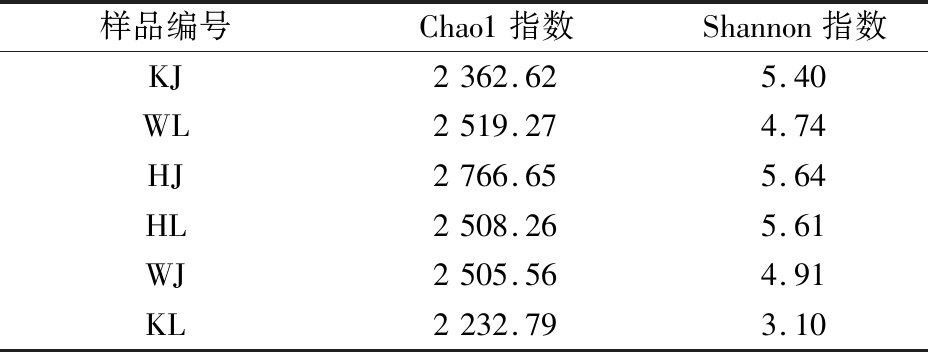
样品编号Chao1指数Shannon指数KJ2362.625.40WL2519.274.74HJ2766.655.64HL2508.265.61WJ2505.564.91KL2232.793.10
由表4可知,通过Chao1、Shannon和Simpson指数对泡藠头和泡辣椒样品中细菌的菌群多样性和丰度进行了比较。其中,WL的Chao1、Shannon和Simpson指数均高于其他各样品组,WJ的Chao1、Shannon和Simpson指数最低;此外泡辣椒样品的Shannon和Simpson指数均高于泡藠头样品。结果表明,泡藠头中的细菌菌群丰度与多样性高于泡辣椒,并且文山地区泡辣椒的细菌的菌群多样性显著高于其他地区。由此我们可以推断,泡辣椒和泡藠头中细菌菌群丰度和多样性随着环境原料的变化而改变,文山地区由于其环境因素,泡藠头中的细菌多样性显著高于其他各组样品。
表4 细菌生物多样性指标
Table 4 Indicators of bacterial biodiversity

样品名称Chao1指数Shannon指数Simpson指数KJ1203.095.440.91HJ1524.276.270.94HL1589.686.830.97WJ462.8680.710.12WL1874.597.340.98
2.3.3 不同地区样品间物种组成分析
为进一步确定泡菜产地和泡菜种类对泡菜中细菌和真菌菌落结构的影响因素,通过采用OTU水平非加权UniFrac距离的主成分分析(principal component analysis,PCA)和聚类堆叠树状图对5种泡菜样品的β多样性进行进一步的比较分析。
PCA作为评价微生物群落相似性的可视化方法,样本间的距离越近,微生物群落结构越相似。真菌群落PCA结果如图6所示,红河地区的泡辣椒和泡藠头样品主要分布在第1象限;昆明地区泡藠头样品分布在第2象限;文山地区的泡辣椒和泡藠头样品分布在第3和第4象限。3个地区的泡辣椒和泡藠头样品在PCA图中的距离相差较远,说明3个地区泡辣椒和泡藠头样品中细菌菌落的结构存在较大差异,其中红河地区与文山地区的辣椒和泡藠头样品中细菌菌落的结构差异小于昆明地区泡藠头样品。
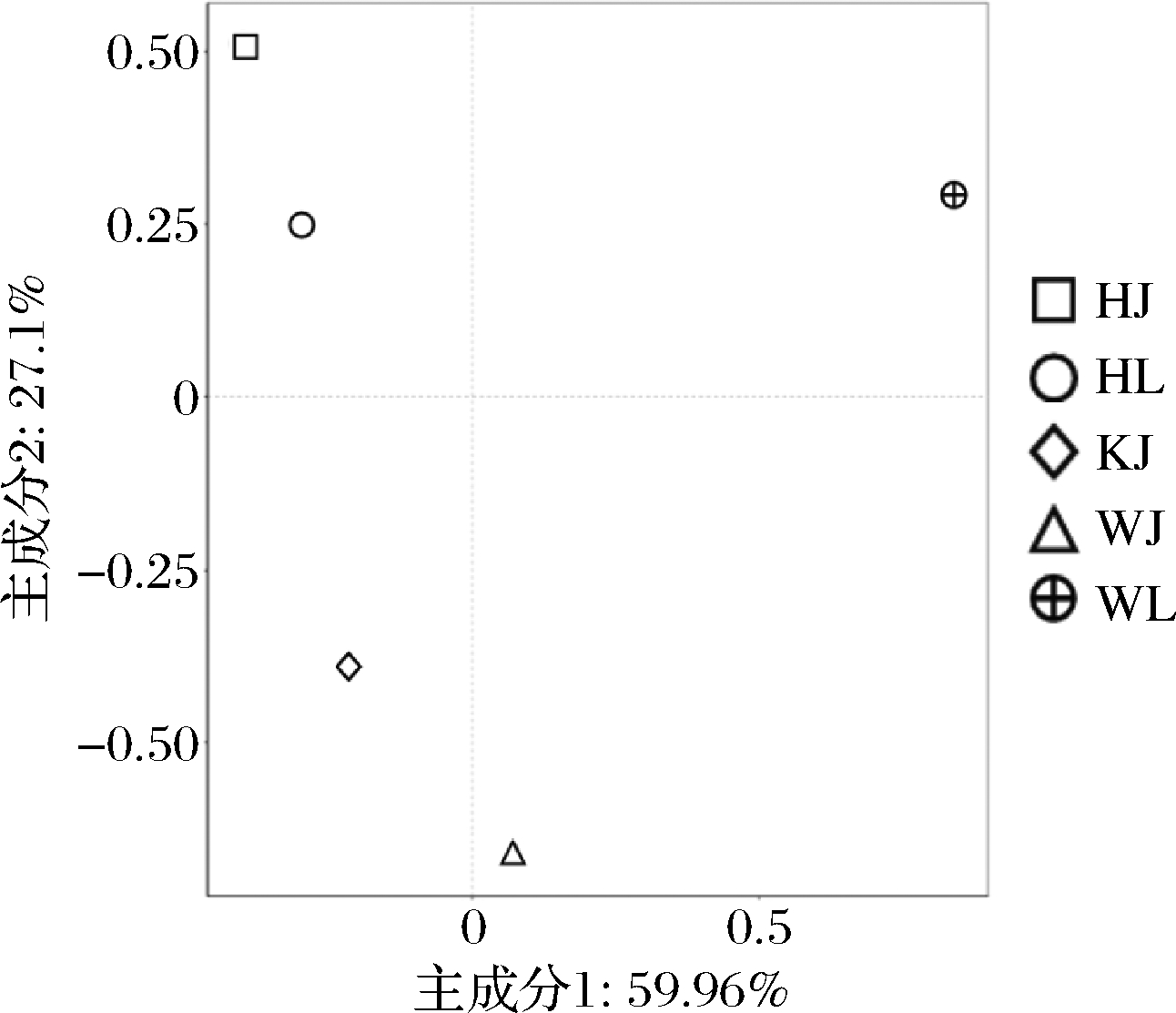
图6 真菌主成分分析
Fig.6 Principal component analysis of fungal
细菌群落PCA结果如图7所示,3个地区的样品间距离较远,说明这3个地区样品间细菌群落相似性较低;样品HL和HJ在图中距离较近,表明2个样品间细菌群落结构相似度较高;样品WL和WJ各自离散,说明2个样品间细菌群落结构相似性低。
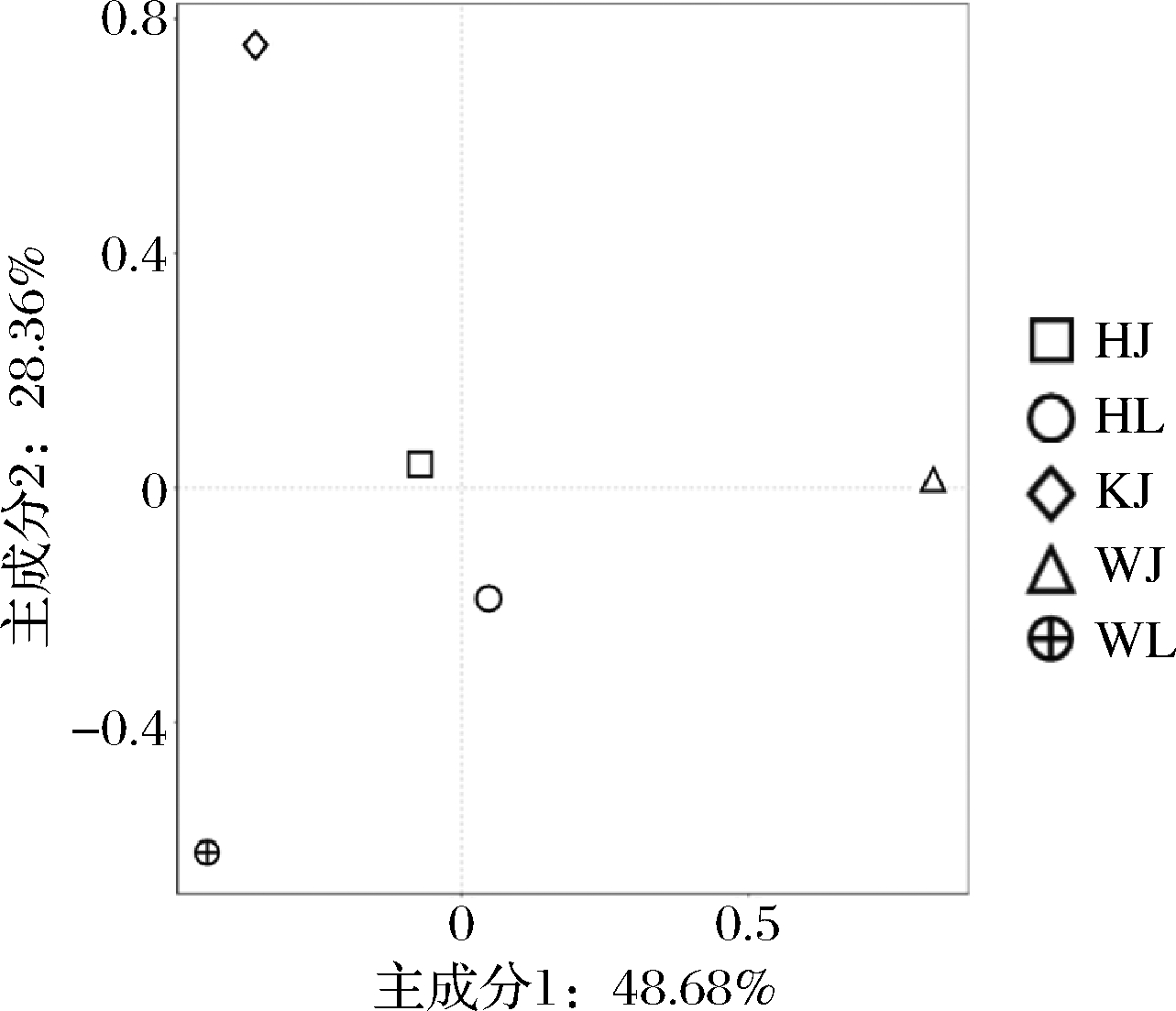
图7 细菌主成分分析
Fig.7 Principal component analysis of bacteria
为了能更加清楚的反应样品中真菌和细菌群落结构的差异,通过聚类堆叠树状图对5种样品进行聚类分析。真菌聚类堆叠树状图如图8所示,5种样品可分为2个大类,其中昆明地区泡藠头为一类,而文山和红河地区的泡辣椒和泡藠头聚类为一类,该结果与PCA结果相似。

图8 基于OTU水平的真菌聚类分析
Fig.8 Cluster analysis of fungal based on OTU level
细菌聚类堆叠树状图如图9所示,5种样品中,HL和HJ为一类,其余3种样品各自为一类,这与PCA结果基本一致。从泡辣椒和泡藠头真菌群落的β多样性分析结果来看,不同地区的泡辣椒和泡藠头相似度差别较大,这可能与地域差异性导致的微生物群落的核心类群不同有关。

图9 基于OTU水平的细菌聚类分析
Fig.9 Cluster analysis of bacteria based on OTU level
3 结论
本研究利用高通量测序技术分析了云南省昆明市、文山州和红河州的泡藠头和泡辣椒中细菌和真菌的菌群构成及相对丰度。结果表明,样品中优势细菌类群主要是由隶属于厚壁菌门(Firmicutes)的乳酸杆菌属(Lactobacillus)、明串珠菌属(Leuconostoc)、乳球菌属(Lactococcus)和魏斯氏菌属(Weissella)构成;优势真菌类群主要是由接合酵母菌属(Zygosaccharomyces)和毕赤酵母菌属(Pichia)构成。通过对比昆明市、文山州和红河州的泡藠头和泡辣椒微生物结构,发现文山州泡藠头和泡辣椒细菌群落结构种类多样性及丰度要显著高于其他地区,红河州的泡藠头和泡辣椒真菌群落结构种类多样性及丰度要显著高于其他地区。
[1] 荆雪娇,李艳琴,燕平梅,等.传统发酵蔬菜微生物群落结构分析[J].食品与发酵科技,2016,52(1):28-32.
JING X J,LI Y Q,YAN P M,et al.Microbial community structure analysis of traditional fermented vegetables[J].Food and Fermentation Technology,2016,52(1):28-32.
[2] 陶兴无,高冰.接种乳酸菌对甜酸藠头腌制工艺和品质的影响[J].中国酿造,2007,26(3):53-55.
TAO X W,GAO B.Effects of inoculated lactic acid bacteria on pickling process and quality of sweet and sour Allium chinense[J].China Brewing,2007,26(3):53-55.
[3] 谢靓,蒋立文.不同食盐含量对发酵辣椒质构的变化研究[J].中国酿造,2014,33(11):59-62.
XIE L,JIANG L W.Effect of different salt content on change of fermented chili texture[J].China Brewing,2014,33(11):59-62.
[4] 赵楠,葛黎红,郭壮,等.泡辣椒发酵过程中质构劣化规律及其影响因素研究[J].中国酿造,2020,39(1):119-123.
ZHAO N,GE L H,GUO Z,et al.Texture change of pickled pepper during fermentation and its influence factors[J].China Brewing,2020,39(1):119-123.
[5] XIAO Y S,XIONG T,PENG Z,et al.Correlation between microbiota and flavours in fermentation of Chinese Sichuan Paocai[J].Food Research International,2018,114:123-132.
[6] 赵玲艳,黄嘉欣,杨剑,等.盐渍辣椒真菌多样性分析[J].中国食品学报,2021,21(4):310-317.
ZHAO L Y,HUANG J X,YANG J,et al.Analysis on the diversity of fungi in salted pepper[J].Journal of Chinese Institute of Food Science and Technology,2021,21(4):310-317.
[7] 韩俊燕,赵国忠,赵建新,等.发酵辣椒细菌多样性的16S rDNA测序分析[J].中国食品学报,2018,18(5):246-251.
HAN J Y,ZHAO G Z,ZHAO J X,et al.16S rDNA sequencing analysis of bacterial diversity of fermented pepper[J].Journal of Chinese Institute of Food Science and Technology,2018,18(5):246-251.
[8] 尚雪娇,折米娜,邓长阳,等.恩施市3种泡辣椒样品中细菌多样性研究[J].中国酿造,2019,38(2):53-57.
SHANG X J,ZHE M N,DENG C Y,et al.Bacterial diversity in 3 kinds of pickled chili samples from Enshi[J].China Brewing,2019,38(2):53-57.
[9] 葛东颖,仇港,赵楠,等.盐渍藠头盐水细菌多样性及基因功能预测分析[J].中国酿造,2020,39(10):157-161.
GE D Y,QIU G,ZHAO N,et al.Bacterial diversity and gene functional prediction of saline Allium chinense G.Don brine[J].China Brewing,2020,39(10):157-161.
[10] 鲍伟,韩姣姣,张旨轩,等.基于高通量测序技术对浙江传统发酵蔬菜微生物多样性的解析[J].食品科学,2021,42(6):178-185.
BAO W,HAN J J,ZHANG Z X,et al.Analysis of microbial community diversity in traditional fermented vegetables in Zhejiang using high-throughput sequencing[J].Food Science,2021,42(6):178-185.
[11] 朱琳,高凤,曾椿淋,等.萝卜泡菜细菌多样性的高通量测序分析[J].现代食品科技,2018,34(2):225-231.
ZHU L,GAO F,ZENG C L,et al.The analysis of microbial diversity in the fermentation broth of pickled radish based on the high-throughput DNA sequencing[J].Modern Food Science and Technology,2018,34(2):225-231
[12] 魏雯丽,宫尾茂雄,吴正云,等.不同工厂豇豆泡菜发酵过程中理化特性及细菌群落多样性研究[J].中国酿造,2020,39(9):111-115.
WEI W L,MIYAO S G,WU Z Y,et al.Physicochemical property and bacterial diversity in cowpea Paocai during the fermentation from different factories[J].China Brewing,2020,39(9):111-115.
[13] LIANG H P,ZHANG A,WU Z Y,et al.Microbial community characteristics in industrial matured Chinese paocai,a fermented vegetable food,from different factories[J].Food Science and Technology Research,2016,22(5):595-604.
[14] 向凡舒,龙旭霞,赵楠,等.原料对盐渍泡菜细菌类群及基因功能的影响[J].食品研究与开发,2021,42(2):191-196.
XIANG F S,LONG X X,ZHAO N,et al.Effect of raw materials on bacterial flora and gene function in saline pickles[J].Food Research and Development,2021,42(2):191-196.
[15] MARVIG C L,KRISTIANSEN R M,MADSEN M G,et al.Identification and characterisation of organisms associated with chocolate pralines and sugar syrups used for their production[J].International Journal of Food Microbiology,2014,185:167-176.
[16] DAMODHARAN K,PALANIYANDI S A,YANG S H,et al.In vitro probiotic characterization of Lactobacillus strains from fermented radish and their anti-adherence activity against enteric pathogens[J].Canadian Journal of Microbiology,2015,61(11):837-850.
[17] 刘巧,罗强,张明,等.利用16S rDNA分析不同地区传统发酵泡菜的细菌多样性[J].食品与发酵工业,2020,46(22):91-97.
LIU Q,LUO Q,ZHANG M,et al.Bacterial diversity analysis of traditional naturally fermented pickles from different regions in China by 16S rDNA[J].Food and Fermentation Industries,2020,46(22):91-97.
[18] 谷懿寰,彭倩楠,姜帅铭,等.海南传统发酵蔬菜中微生物多样性分析[J].中国食品学报,2020,20(3):282-290.
GU Y H,PENG Q N,JIANG S M,et al.Analysis of microbial diversity in tradition fermented vegetables in Hainan[J].Journal of Chinese Institute of Food Science and Technology,2020,20(3):282-290.
[19] 金华,吕嘉枥,罗潇.传统自然发酵蔬菜的显微表征及其细菌群落多样性分析[J].中国调味品,2021,46(3):11-17.
JIN H,LYU J Z,LUO X.Analysis of microscopic characterization and diversity of bacterial community in traditional natural fermented vegetables[J].China Condiment,2021,46(3):11-17.
[20] 郭倩倩,卢彪.晴隆酸菜发酵过程中微生物菌群多样性动态分析[J].中国酿造,2020,39(8):86-91.
GUO Q Q,LU B.Dynamic analysis of microbial flora diversity in the Qinglong sauerkraut fermentation process[J].China Brewing,2020,39(8):86-91.
[21] 吕嘉枥,晁倩文,刘秉坤,等.传统老坛自然发酵泡菜中真菌群落结构多样性分析[J].陕西科技大学学报,2019,37(6):53-59.
LYU J L,CHAO Q W,LIU B K,et al.Diversity analysis of fungal community structure in natural fermented pickles of traditional altar [J].Journal of Shaanxi University of Science &Technology,2019,37(6):53-59.
[22] JEONG S H,LEE S H,JUNG J Y,et al.Microbial succession and metabolite changes during long-term storage of kimchi[J].Journal of Food Science,2013,78(5):M763-M769.
[23] 李恒,陈功,伍亚龙,等.高通量测序方法研究传统四川泡菜母水中微生物群落的动态变化[J].食品科学,2018,39(24):131-138.
LI H,CHEN G,WU Y L,et al.Analysis of microbial community dynamics of traditional Sichuan paocai brine by high-throughput sequencing[J].Food Science,2018,39(24):131-138.
[24] GUAN Q Q,ZHENG W D,HUANG T,et al.Comparison of microbial communities and physiochemical characteristics of two traditionally fermented vegetables[J].Food Research International,2020,128:108755.
[25] LIU L,SHE X,QIAN Y,et al.Effect of different fermenting containers on the deterioration of Sichuan pickle[J].LWT,2019,111:829-836.
[26] LIU X F,LIU C J,ZHANG H Y,et al.The bacterial community structure of yond bap,a traditional fermented goat milk product,from distinct Chinese regions[J].Dairy Science &Technology,2015,95(3):369-380.