肉制品在加工过程中经常会受到剪切作用,如绞肉、斩拌、拌料混合、打浆、挤压等机械剪切,管道输送过程中的速度梯度剪切等。流体食品受剪切作用后黏度减小,具有剪切稀化效应,多认为是剪切作用打破了体系原有的稳定结构,减少了分子间的相互缠结造成的[1]。剪切稀化现象是可逆的,即当剪切作用取消后,剪切稀化效应会在放置的过程中逐渐减小,这是因为在放置过程中布朗运动使大分子重新恢复到其无取向的自然状态,被破坏的结构重新形成[2]。
肌原纤维蛋白凝胶是通过蛋白质分子变性聚集、分子间相互作用而形成的[3],不同程度的剪切稀化效应下,肌原纤维蛋白可能具有不同的凝胶性质。肌原纤维蛋白的凝胶性质直接关系到肉制品的硬度、持水性、咀嚼性等,影响肉制品的口感[4],凝胶特性受到很多因素的影响,如盐离子浓度[5]、pH[6]、高静水压[7]等,但目前关于剪切稀化效应对肌原纤维蛋白凝胶特性影响的研究还很少。
本实验将肌原纤维蛋白溶液进行充分剪切(10 000 r/min,5 min),在获得一致的剪切稀化效应的基础上,根据剪切稀化效应随放置时间延长逐渐减小的特性,通过控制放置时间获得不同的剪切稀化程度,探究肌原纤维剪切稀化效应对蛋白凝胶特性的影响,以期为肉制品加工参数优化和产品质量控制提供理论依据。
1 材料与方法
1.1 材料与试剂
鸡胸肉购于永辉超市。
牛血清蛋白,上海麦克林生化科技有限公司;乙二醇四乙酸(ethylene glycol tetraacetic acid,EGTA),上海麦克林生化科技有限公司;其他化学试剂均为国产分析纯。
1.2 仪器与设备
TA.XT Plus质构仪,英国Stable Micro System公司;MCR302模块化旋转与界面流变仪,德国Anton公司;TGL-16医用冷冻离心机,四川蜀科仪器有限公司;FSH-Ⅱ高速剪切器,江苏金坛市环宇科学仪器厂;Spectrum 100红外光谱仪,美国Perkin-Elmer公司;Phenom Pro 扫描电镜,荷兰Phenom World 公司。
1.3 实验方法
1.3.1 实验设计
剪切稀化效应最直观的体现在流体的黏度变化上,因此本实验以黏度作为剪切稀化程度的指标,剪切稀化程度越高的溶液黏度越低。将肌原纤维蛋白溶液充分剪切后(10 000 r/min,5 min),用保鲜膜封装,在4 ℃ 条件下保存。实验组通过放置0、12、24、36、48、60和72 h,获得不同剪切稀化程度,再分别进行凝胶制备和参数测定;对照组每隔12 h进行充分剪切(10 000 r/min,5 min),在此剪切条件下溶液的黏度处在同一水平,即剪切稀化程度相同,制备凝胶和测定参数,以排除放置过程中无关因素如氧化,水分蒸发等对凝胶的影响。
1.3.2 肌原纤维蛋白的提取
参照GE等[8]的方法,以鸡胸肉为原料,去除多余脂肪和结缔组织后搅碎,加入4倍体积的缓冲液A(内含0.1 mol/L NaCl,2 mmol/L MgCl2·6H2O,10 mmol/L 乙二醇双四乙酸,20 mmol/L Na2HPO4/NaH2PO4,pH 7.0)匀浆(10 000 r/min,1 min),离心(8 000 r/min,15 min,4 ℃)后去除上清液,重复上述操作3次;将所得沉淀分散于4倍体积的缓冲液B(内含0.1 mol/L NaCl,pH 7.0)匀浆(10 000 r/min,1 min),离心(8 000 r/min,15 min,4 ℃)后收集沉淀物,重复操作2次;加入4倍体积的缓冲液C(内含0.1 mol/L NaCl,pH 6.0),匀浆后用4层纱布过滤,离心(8 000 r/min,15 min,4 ℃),离心后所得沉淀即为肌原纤维蛋白。
1.3.3 肌原纤维蛋白热致凝胶的制备
以牛血清蛋白做标准曲线,双缩脲法测定蛋白浓度,用缓冲液(内含0.6 mol/L NaCl,20 mmol/L Na2HPO4/NaH2PO4,pH 6.5)调节蛋白浓度到40 mg/mL,经10 000 r/min剪切5 min后,实验组和对照组按照以下顺序在水浴锅中煮制凝胶:25 ℃平衡30 min、升温到75 ℃并加热30 min、取出冰浴30 min后于4 ℃冰箱中保存。
1.3.4 肌原纤维蛋白流变性质的测定
参照DAI等[9]的方法,使用MCR302模块化旋转与界面流变仪进行旋转测试和温度扫描。旋转测试使用PP50探头,间隙为0.5 mm,剪切速率范围为0.1~100 s-1。
温度扫描使用PP50探头,间隙为1 mm,温度扫描范围25~75 ℃,升温速率1 ℃/min,振荡频率1 Hz,应力振幅0.01。
1.3.5 凝胶持水性的测定
将制得的凝胶称重到离心管中,在8 000×g,4 ℃下离心10 min后,移去多余水分,按照公式(1)计算凝胶的持水性:
凝胶持水性![]()
(1)
式中:m1,离心管质量,mg;m2,离心前的离心管与凝胶总质量,mg;m3,离心后的离心管与凝胶总质量,mg。
1.3.6 凝胶强度的测定
使用P/0.5模具,测定模板为TPA,触发类型为Stain,测前、测中、测后速度分别为2、1.0、1.0 mm/s,触发力5 g,形变40%,凝胶强度定义为穿破凝胶的压力,单位为g。
1.3.7 凝胶微观结构的观察
将制好的肌原纤维蛋白凝胶在2.5%(体积分数)的戊二醛中固定48 h,用磷酸缓冲液(pH 6.5)清洗3次后依次用体积分数为60%、70%、80%、90%、95%、100%的乙醇溶液洗脱30 min进行梯度脱水,用叔丁醇置换3次后冷冻干燥48 h,喷金处理,放大10 000倍观察凝胶的微观结构。
1.3.8 凝胶化学作用力的测定
0.5 g凝胶分别与9.5 mL SA溶液(含0.05 mol/L NaCl)、SB溶液(含0.6 mol/L NaCl)、SC溶液(含0.6 mol/L NaCl,1.5 mol/L尿素)、SD溶液(含0.6 mol/L NaCl,8 mol/L尿素)混合,均质(10 000 r/min)3 min后,在4 ℃冰箱内保存3 h后离心(10 000×g,4 ℃,15 min,)以牛血清蛋白做标准曲线,采用福林酚法[10]对上清液的蛋白质含量进行测定。离子键、氢键、疏水相互作用分别采用SB与SA、SC与SB、SD与SC溶液中蛋白质浓度差表示。
1.3.9 肌原纤维蛋白凝胶二级结构的测定
使用傅里叶红外光谱仪对肌原纤维蛋白凝胶的二级结构进行测定。凝胶冷冻干燥48 h后用玛瑙研钵磨成粉末,在全波长400~4 000 cm-1下扫描,测定条件:扫描次数32次,分辨率4 cm-1。使用仪器自带软件进行自动基线校正、平滑、标准化处理后,导出数据。各二级结构的定量使用Peakfit 4.12对蛋白质酰胺Ι带(1 600~1 700 cm-1)进行分析,将导出的数据依次进行基线校正、Gaussian去卷积、二阶导数拟合,根据各子峰面积计算α-螺旋(1 650~1 657 cm-1);β-折叠(1 612~1 640 cm-1);β-转角(1 680~1 696 cm-1);无规则卷曲(1 640~1 650 cm-1)占总二级结构的比例[11]。
1.4 数据分析
实验重复3次,数据处理采用SPSS Statistics软件,采用Duncan′s多重比较和显著性分析(P<0.05)。图形通过Origin 2018软件绘制。
2 结果与分析
2.1 不同放置时间下肌原纤维蛋白剪切稀化程度的变化
图1中的黏度曲线变化趋势相同,黏度随剪切速率增加而减小,表明肌原纤维蛋白溶液具有明显的剪切稀化特性。对照组中,不同放置时间下的肌原纤维蛋白溶液进行充分剪切后(10 000 r/min,5 min),黏度在130~165 Pa·s内波动,与实验组(黏度从139.80 Pa·s增加到845.87 Pa·s)相比变化并不明显,说明在此剪切条件下(10 000 r/min,5 min),肌原纤维蛋白溶液的黏度处在同一水平,可以得到一致的剪切稀化程度。

a-实验组;b-对照组
图1 不同放置时间下肌原纤维蛋白的黏度随剪切速率的变化
Fig.1 Change in viscosity of myofibrillar protein with shear rate under different storage time
实验组中,肌原纤维蛋白溶液在0~72 h的放置过程中,黏度随放置时间逐渐增加,分别为139.80、557.80、708.18、761.06、798.72、824.20、845.87 Pa·s,表明剪切稀化程度随放置时间的延长而逐渐减小;而且黏度随时间变化的幅度越来越小,当时间从60 h增加到72 h时,黏度不再明显增加,说明放置72 h的肌原纤维蛋白溶液已经接近零剪切的状态。
可以从两方面来解释剪切稀化效应随放置时间延长而减小的现象:一是剪切作用破坏了肌原纤维蛋白的网架结构,在放置过程中被破坏的结构重新形成,使黏度上升,剪切稀化程度逐渐减小;另一方面,剪切作用后使散乱的肌原纤维蛋白滚动旋转而收缩成团,减少了相互的缠结,在放置过程中蛋白质分子重新回到原来的自然状态,相互勾挂缠结,使黏度上升,剪切稀化效应逐渐减小[2]。
2.2 剪切稀化效应对肌原纤维蛋白储能模量的影响
储能模量是指样品在弹性形变中储存能量的大小,其数值大小与被测物体的弹性相关[12]。如图2所示,实验组和对照组的储能模量变化趋势相似:在25~45 ℃储能模量缓慢增加,因为升温使肌原纤维蛋白开始热聚集;在45~60 ℃储能模量下降,这是由于轻酶解肌球蛋白和肌动球蛋白变性,使流动性增加[13];在60~75 ℃储能模量又逐渐增长,是因为高温使蛋白质剧烈变性,形成更为稳定的网络结构[14]。
实验组的剪切稀化程度随着放置时间的增加而逐渐减小,凝胶的最终储能模量从75 Pa逐渐增加到375 Pa,而对照组在剪切稀化程度保持不变的情况下,最终储能模量在60~120 Pa波动,与实验组相比并未随放置时间发生明显变化;这表明是剪切稀化效应的减小导致了肌原纤维蛋白凝胶储能模量的升高。实验组中,放置时间长的初始储能模量高,这可能是因为剪切稀化效应的减小使蛋白质体系结构恢复,弹性增加[15];在加热后期放置时间对储能模量的影响越来越明显,这可能是因为剪切稀化效应会破坏肌球蛋白和肌动蛋白之间的疏水相互作用和二硫键[16],不利于蛋白质的展开和相互作用,造成了凝胶储能模量偏低。
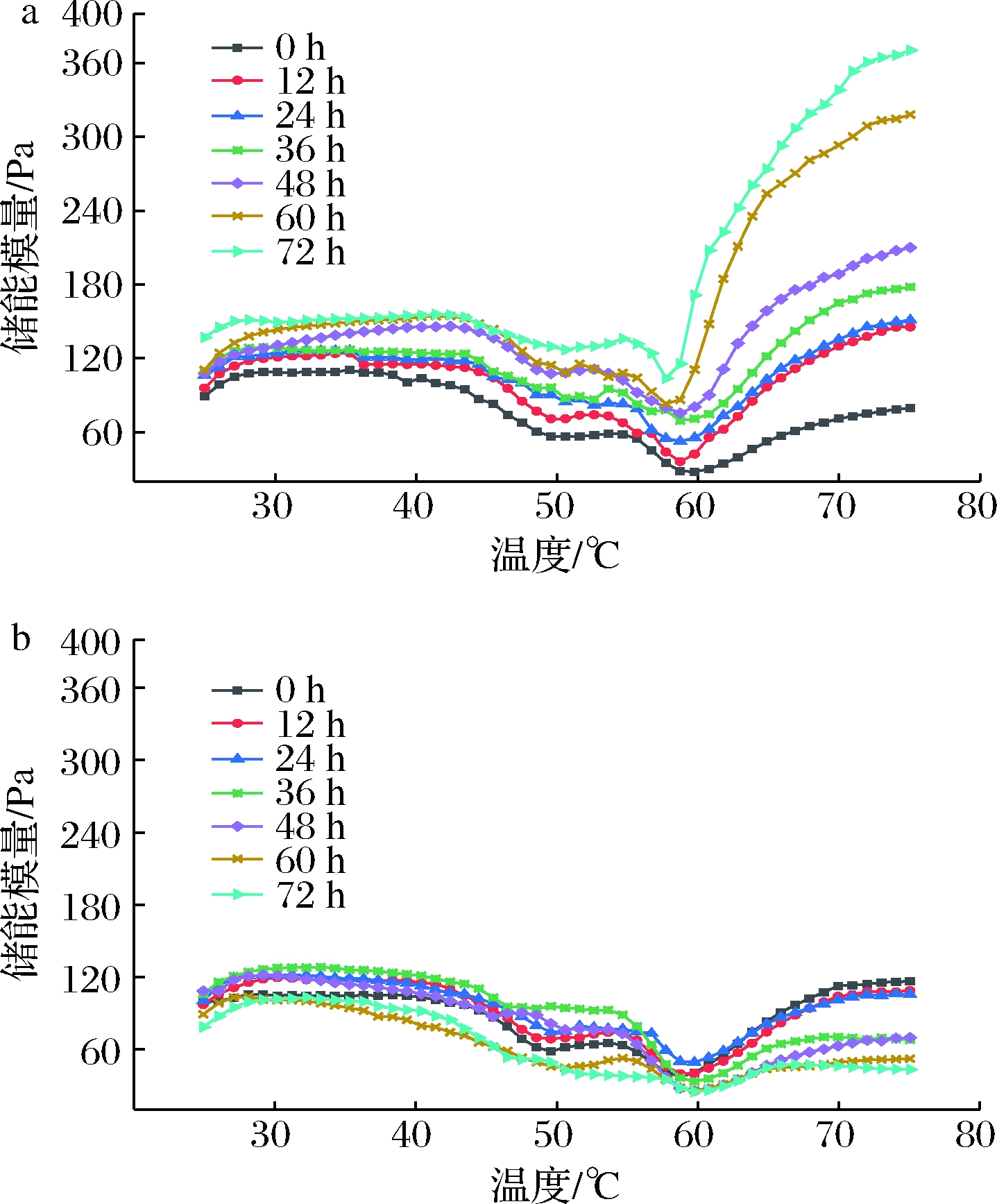
a-实验组;b-对照组
图2 不同放置时间下肌原纤维蛋白的储能模量随温度的变化
Fig.2 Change in storage modulus of myofibrillar protein with temperature under different storage time
2.3 剪切稀化效应对肌原纤维蛋白凝胶持水性的影响
肌原纤维蛋白相互聚集形成网络结构,并将水分填充在网络结构中即形成凝胶,良好的凝胶结构可以很好地固定凝胶中的水分[17],持水性大小可以反映凝胶性能的优劣。凝胶持水性随放置时间的变化如图3所示,随着放置时间延长,实验组的剪切稀化效应逐渐减小,凝胶的持水性逐渐延长;前36 h内凝胶的持水性变化较为显著(P<0.05),而在后36 h的放置条件下,凝胶的持水性虽然在延长,但是变化并不明显。对照组在剪切稀化效应保持一致的条件下,凝胶持水性并未随着放置时间的延长发生显著变化(P<0.05),实验组12~72 h放置时间下的凝胶持水性均显著高于对照组(P<0.05);这一结果说明是剪切稀化程度的降低造成了凝胶持水性的增加。
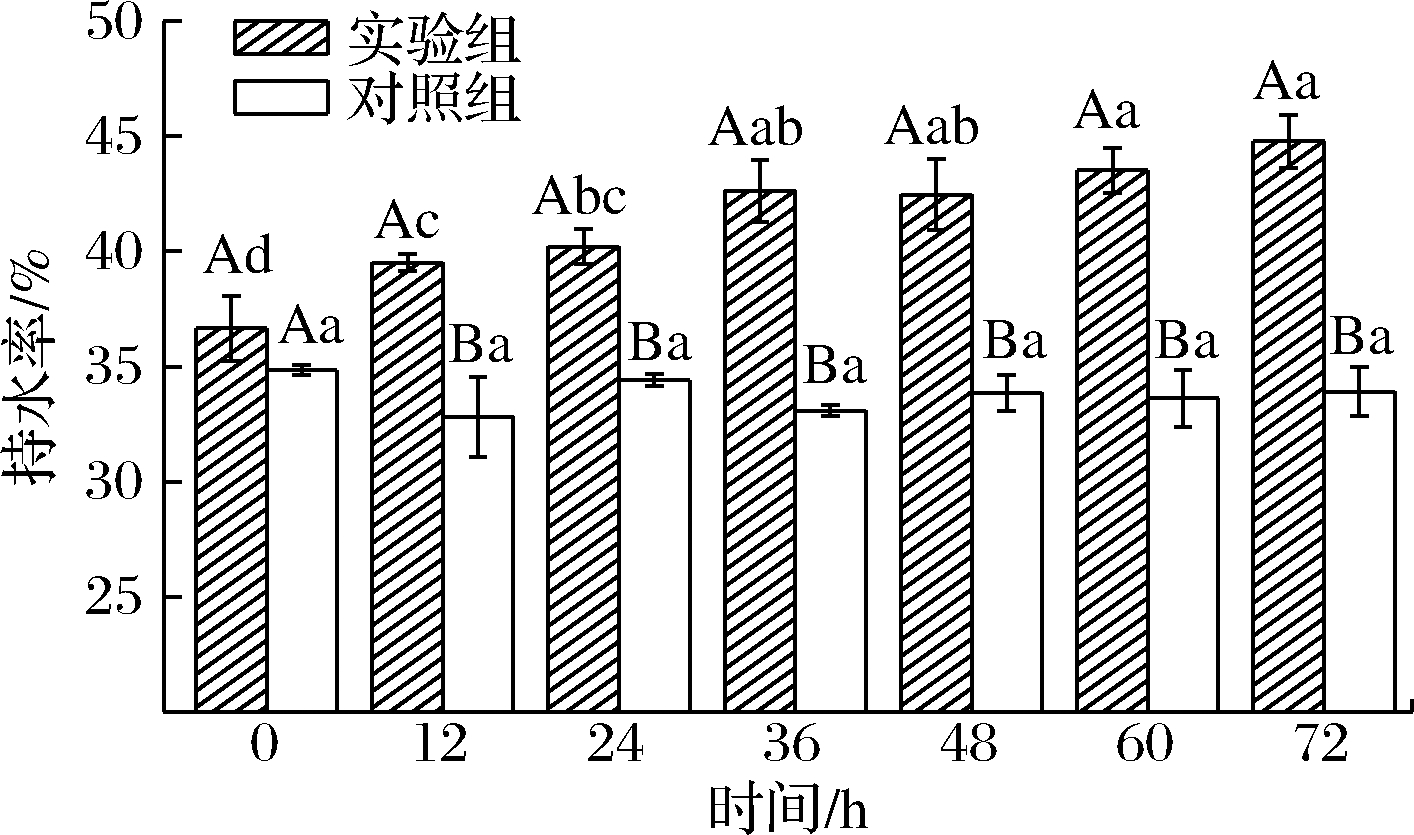
图3 不同放置时间下肌原纤维蛋白凝胶持水性的变化
Fig.3 Change in water holding capacity of myofibrillar protein gels under different storage time
注:字母A,B-实验组和对照组之间具有显著差异,字母a~d-实验组和对照组在组内具有显著差异;显著性水平(P<0.05)(下同)
随着放置时间的延长,剪切稀化程度逐渐减小,肌原纤维蛋白溶液被打破的结构逐渐恢复,使形成的凝胶结构更加稳固,从而促进持水性的增加[17],这可能是造成持水性随剪切稀化程度减小而升高的原因。同时持水性还和氢键作用[18]相关,有研究表明高强度的剪切会弱化蛋白质的相互作用[19],而高强度的剪切代表着剪切稀化程度升高,因此可以推断剪切稀化程度的升高会弱化蛋白质与水的氢键作用,从而使凝胶持水性降低。
2.4 剪切稀化效应对肌原纤维蛋白凝胶强度的影响
肌原纤维蛋白的凝胶强度是影响肉制品加工特性、感官性质的重要因素[20]。肌原纤维蛋白凝胶强度随放置时间的变化如图4所示,实验组中,随着放置时间的延长,剪切稀化程度逐渐降低;实验组在前48 h内,每隔12 h凝胶强度均显著增加(P<0.05),而在48~72 h,凝胶强度的增加并不显著(P<0.05),这与黏度在前面变化明显,后面变化不明显的现象相符合。对照组在保持剪切稀化程度一致的情况下,凝胶强度并未随放置时间而发生显著变化(P<0.05),且实验组12~72 h放置时间下的凝胶强度显著高于对照组(P<0.05);这表明是剪切稀化程度的降低导致了凝胶强度的增加。

图4 不同放置时间下肌原纤维蛋白凝胶强度的变化
Fig.4 Change in the gel strength of myofibrillar protein gels under different storage time
随着剪切稀化程度的降低,被打乱的大分子重新恢复到原有的取向,肌原纤维蛋白溶液体系逐渐趋于稳定状态,这可能会增加肌原纤维蛋白之间的相互作用程度,促进肌原纤维蛋白的聚集,而相互作用和聚集程度的增加有利于形成凝胶的三维结构,使凝胶强度增加[21]。
2.5 剪切稀化效应对肌原纤维蛋白凝胶微观结构的影响
凝胶微观结构随放置时间的变化如图5所示。随着放置时间的延长,实验组的剪切稀化程度逐渐减小,凝胶的微观结构逐渐由松散变得紧凑,孔径尺寸逐渐减小,孔径分布逐渐变得均匀;在前48 h,凝胶的微观结构变化较为明显,当放置时间为60 h时,凝胶的孔径已经变得细小而密集,放置时间再增加到72 h时,微观结构较60 h条件下的变化并不明显,这与凝胶强度和持水性在前期变化明显,后期变化不明显的趋势相同。对照组在保持剪切稀化程度相同的情况下,凝胶的微观结构不随放置时间发生显著变化(P<0.05),一直有较大且分布不均匀的孔径,与实验组中放置时间为0 h条件下的凝胶相似;这表明是剪切稀化效应导致了凝胶微观结构发生变化,即剪切稀化程度的降低会使凝胶结构变得紧凑,凝胶孔径变的小而质密,有利于形成严密的凝胶结构,这可能是因为随着放置时间的延长,剪切稀化程度逐渐降低,肌原纤维蛋白体系逐渐向平衡方向发展,蛋白质之间充分作用,使聚集程度增加,分布也更加均匀,形成的微观结构也更加质密有序。研究表明,凝胶微观结构越松散粗糙,凝胶的持水性越差,密集且均匀的孔径可以更好地束缚住凝胶中的水[22],这与持水性随放置时间延长而增加的结果一致。

a~g,A~G分别表示实验组和对照组在放置时间为0、12、24、36、48、60、72 h条件下的凝胶微观结构
图5 不同放置时间下肌原纤维蛋白凝胶微观结构的变化
Fig.5 Micro-structure observation of myofibrillar protein gels under different storage time
2.6 剪切稀化效应对肌原纤维蛋白凝胶化学作用力的影响
由图6可知,肌原纤维蛋白凝胶的疏水相互作用值明显要高于氢键和离子键,这说明疏水相互作用是维持凝胶结构稳定的主要作用力[23],可能是由于加热的原因造成氢键和离子键作用力较小[24];实验组的剪切稀化程度随着放置时间的延长逐渐降低,同时离子键、氢键和疏水相互作用均逐渐升高;离子键和疏水相互作用与凝胶持水性和质构特性的变化趋势相同,先随放置时间延长显著增加(P<0.05)后变化不明显;氢键作用随放置时间延长持续显著增加(P<0.05)。对照组的剪切稀化程度不变,与实验组相比,3种化学作用力不随放置时间延长发生明显变化,12~72 h内,实验组的3种化学作用力均显著(P<0.05)高于对照组;上述结论说明是剪切稀化程度的降低使肌原纤维蛋白凝胶的离子键、氢键以及疏水相互作用力升高。
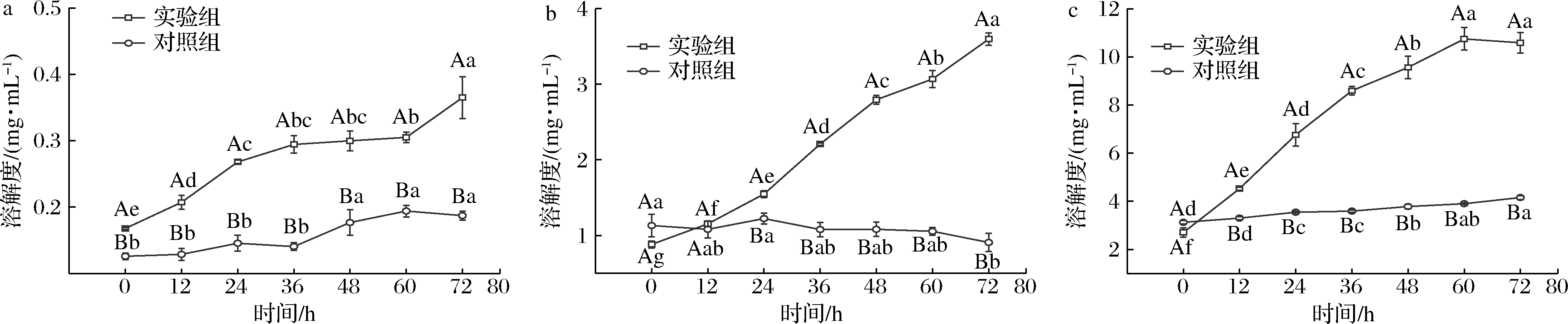
a-离子键;b-氢键;c-疏水相互作用
图6 不同放置时间下肌原纤维蛋白凝胶化学作用力的变化
Fig.6 Change in chemical force of myofibrillar protein gels under different storage time
化学作用力是维持蛋白质凝胶结构稳定的重要原因,剪切稀化效应的减小使化学作用力增加,这是凝胶持水性、凝胶强度和储能模量升高的直接原因[25]。剪切稀化效应的减小伴随着结构的恢复和蛋白质体系的平衡,这有利于蛋白质充分暴露基团并相互作用,这可能是促使化学作用力增加的原因。
2.7 剪切稀化效应对肌原纤维蛋白凝胶二级结构的影响
如表1所示,在72 h内,实验组和对照组中α-螺旋和无规则卷曲的含量均未发生显著变化(P<0.05),α-螺旋的含量均维持在12%左右,无规则卷曲的含量均维持在21%左右,实验组和对照组之间无显著性差异(P<0.05);α-螺旋和无规则卷曲对加热较为敏感,长时间的加热会造成α-螺旋持续向无规则卷曲转化[26],本研究中凝胶加热的条件一致,因此α-螺旋和无规则卷曲含量无明显变化。
表1 不同放置时间下肌原纤维蛋白凝胶各二级结构的相对含量
Table 1 Relative content of each secondary structure of myofibrillar protein gels under different storage time
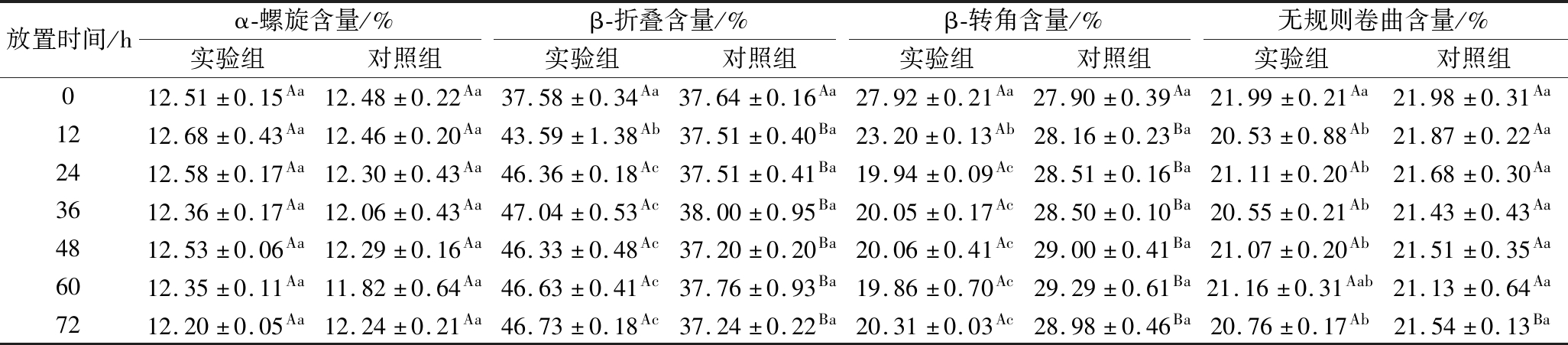
放置时间/hα-螺旋含量/%β-折叠含量/%β-转角含量/%无规则卷曲含量/%实验组对照组实验组对照组实验组对照组实验组对照组012.51±0.15Aa12.48±0.22Aa37.58±0.34Aa37.64±0.16Aa27.92±0.21Aa27.90±0.39Aa21.99±0.21Aa21.98±0.31Aa1212.68±0.43Aa12.46±0.20Aa43.59±1.38Ab37.51±0.40Ba23.20±0.13Ab28.16±0.23Ba20.53±0.88Ab21.87±0.22Aa2412.58±0.17Aa12.30±0.43Aa46.36±0.18Ac37.51±0.41Ba19.94±0.09Ac28.51±0.16Ba21.11±0.20Ab21.68±0.30Aa3612.36±0.17Aa12.06±0.43Aa47.04±0.53Ac38.00±0.95Ba20.05±0.17Ac28.50±0.10Ba20.55±0.21Ab21.43±0.43Aa4812.53±0.06Aa12.29±0.16Aa46.33±0.48Ac37.20±0.20Ba20.06±0.41Ac29.00±0.41Ba21.07±0.20Ab21.51±0.35Aa6012.35±0.11Aa11.82±0.64Aa46.63±0.41Ac37.76±0.93Ba19.86±0.70Ac29.29±0.61Ba21.16±0.31Aab21.13±0.64Aa7212.20±0.05Aa12.24±0.21Aa46.73±0.18Ac37.24±0.22Ba20.31±0.03Ac28.98±0.46Ba20.76±0.17Ab21.54±0.13Ba
注:字母A,B-实验组和对照组之间具有显著差异,字母a~d-实验组和对照组在组内具有显著差异;显著性水平(P<0.05)
实验组的剪切稀化程度随着放置时间的延长逐渐降低,同时β-转角含量逐渐降低、β-折叠含量逐渐增加;放置时间为36 h时β-折叠含量达到最大值,而后不发生显著变化(P<0.05);β-转角含量在60 h达到最低值,而且从24 h后就没有发生显著的变化(P<0.05);β-折叠和β-转角变化趋势相同,在前24 h 内变化显著(P<0.05)之后变化不明显。对照组的剪切稀化程度不变,β-折叠、β-转角的含量也不随放置时间发生明显变化;在12~72 h内,实验组的β-折叠、β-转角含量与对照组均有显著差异(P<0.05)。这表明是剪切稀化效应的降低使肌原纤维蛋白凝胶的β-折叠含量增加、β-转角含量降低。HAN等[27]指出,β-折叠含量的增加有助于凝胶弹性的形成;KANG等[28]的研究表明,β-折叠含量与其持水性正相关;这与本研究中得到的结果一致。剪切稀化效应可能是通过改变凝胶中β-折叠的含量,来影响肌原纤维蛋白凝胶特性。
3 结论与讨论
随着放置时间的延长,实验组的黏度逐渐增加,剪切稀化效应逐渐减小,肌原纤维蛋白凝胶特性发生了明显的变化,对照组的黏度处在同一水平,剪切稀化效应不随放置时间变化,则肌原纤维蛋白的凝胶特性不发生明显的变化。这表明是剪切稀化效应使肌原纤维蛋白的凝胶特性发生了变化:随着剪切稀化效应的减小,凝胶的持水性和凝胶强度显著增加(P<0.05),储能模量明显升高,形成凝胶的结构更加质密,孔径更加小而密集;对肌原纤维蛋白凝胶化学作用力和二级结构变化的探究表明,剪切稀化效应的降低会使凝胶的离子键、氢键、疏水相互作用力显著升高(P<0.05),β-折叠含量显著增加(P<0.05),这可能是造成凝胶持水性,凝胶强度,储能模量增加,凝胶结构更质密的原因。在凝胶类肉制品的加工过程中,应当考虑剪切稀化效应对产品品质的影响,通过放置一段时间来降低剪切稀化程度,可以提高凝胶的持水性、弹性等,有利于提高产品得率和产品质量。
[1] QUEMADA D.Rheological modelling of complex fluids.I.The concept of effective volume fraction revisited[J].The European Physical Journal Applied Physics,1998,20(1):119-127.
[2] 李里特.食品物性学[M].北京:中国农业出版社,1998.
LI L T.Food Physiology[M].Beijing:China Agriculture Press,1998.
[3] ZHAO X,XU X L,ZHOU G H.Covalent chemical modification of myofibrillar proteins to improve their gelation properties:A systematic review [J].Comprehensive Reviews in Food Science and Food Safety,2021,20(1):924-959.
[4] CHEN X,TUME R K,XIONG Y L,et al.Structural modification of myofibrillar proteins by high-pressure processing for functionally improved,value-added,and healthy muscle gelled foods [J].Critical Reviews in Food Science and Nutrition,2018,58(17):2 981-3 003.
[5] LIU H T,ZHANG J N,WANG H,et al.High-intensity ultrasound improves the physical stability of myofibrillar protein emulsion at low ionic strength by destroying and suppressing myosin molecular assembly [J].Ultrasonics Sonochemistry,2021,74:105554.
[6] ZHANG Y M,PUOLANNE E,ERTBJERG P.Mimicking myofibrillar protein denaturation in frozen-thawed meat:Effect of pH at high ionic strength [J].Food Chemistry,2021,338:128017.
[7] ZHENG H B,HAN M Y,BAI Y,et al.Combination of high pressure and heat on the gelation of chicken myofibrillar proteins [J].Innovative Food Science &Emerging Technologies,2019,52:122-130.
[8] GE G,HAN Y R,ZHENG J B,et al.Physicochemical characteristics and gel-forming properties of myofibrillar protein in an oxidative system affected by partial substitution of NaCl with KCl,MgCl2 or CaCl2[J].Food Chemistry,2020,309:125614.
[9] DAI H,SUN Y,XIA W,et al.Effect of phospholipids on the physicochemical properties of myofibrillar proteins solution mediated by NaCl concentration [J].LWT-Food Science And Technology,2021,141(5):110895.
[10] LOWRY O H,ROSEBROUGH N J,FARR A L,et al.Protein measurement with the folin phenol reagent[J].Journal of Biological Chemistry,1951,193(1):265-275.
[11] PELTON J T,MCLEAN L R.Spectroscopic methods for analysis of protein secondary structure [J].Analytical Biochemistry,2000,277(2):167-176.
[12] AMIRI A,SHAHEDI M,KADIVAR M.Structural properties of gluten modified by ascorbic acid and transglutaminase [J].International Journal of Food Properties,2017,20:1 588-1 599.
[13] CHEN X,XU X L,LIU D M,et al.Rheological behavior,conformational changes and interactions of water-soluble myofibrillar protein during heating [J].Food Hydrocolloids,2018,77:524-533.
[14] VISESSANGUAN W,OGAWA M,NAKAI S,et al.Physicochemical changes and mechanism of heat-induced gelation of arrowtooth flounder myosin [J].Journal of Agricultural and Food Chemistry,2000,48(4):1 016-1 023.
[15] 邹咪,郭全友,汤嘉慧,等.两种养殖模式下大黄鱼肌原纤维蛋白流变学特征研究[J].食品与发酵工业,2020,46(2):61-65.
ZOU M,GUO Q R,TANG J H,et al.Rhological sudy of large yellow croaker myofibrillar protein in two farmed modes[J].Food and Fermentation Industries,2020,46(2):61-65.
[16] LI K,KANG Z L,ZHAO Y Y,et al.Use of high-intensity ultrasound to improve functional properties of batter suspensions prepared from PSE-like chicken breast meat [J].Food and Bioprocess Technology,2014,7(12):3 466-3 477.
[17] WANG X,WANG L M,YANG K,et al.Radio frequency heating improves water retention of pork myofibrillar protein gel:An analysis from water distribution and structure [J].Food Chemistry,2021,350:129265.
[18] FENG M Q,PAN L H,YANG X,et al.Thermal gelling properties and mechanism of porcine myofibrillar protein containing flaxseed gum at different NaCl concentrations[J].LWT-Food Science and Technology,2018,87:361-367.
[19] MOAKES R J A,SULLO A,NORTON I T.Preparation and characterisation of whey protein fluid gels:The effects of shear and thermal history [J].Food Hydrocolloids,2015,45:227-235.
[20] LI F F,WANG B,KONG B H,et al.Decreased gelling properties of protein in mirror carp (Cyprinus carpio) are due to protein aggregation and structure deterioration when subjected to freeze-thaw cycles [J].Food Hydrocolloids,2019,97:105223.
[21] SHI H B,ZHOU T,WANG X,et al.Effects of the structure and gel properties of myofibrillar protein on chicken breast quality treated with ultrasound-assisted potassium alginate [J].Food Chemistry,2021,358:129873.
[22] URBONAITE V,DE JONGH H H J,VAN DER LINDEN E,et al.Water holding of soy protein gels is set by coarseness,modulated by calcium binding,rather than gel stiffness [J].Food Hydrocolloids,2015,46:103-111.
[23] 白登荣,刘根,贺雪华,等.γ-聚谷氨酸复合TGase对鸡肉肌原纤维蛋白凝胶特性的影响[J].食品与发酵工业,2018,44(1):104-112.
BAI D R,LIU G,HE X H,et al.Effects of γ-polyglutamic acid combined with transglutaminase treatment on the gelatin properties of chicken myofibrillar protein[J].Food and Fermentation Industries,2018,44(1):104-112.
[24] LIU R,ZHAO S M,XIE B J,et al.Contribution of protein conformation and intermolecular bonds to fish and pork gelation properties [J].Food Hydrocolloids,2011,25(5):898-906.
[25] 王静宇,胡新,刘晓艳,等.肌原纤维蛋白热诱导凝胶特性及化学作用力研究进展[J].食品与发酵工业,2020,46(8):300-306.
WANG J Y,HU X,LIU X Y,et al.Advances in heat-induced gel properties and chemical forces of myofibrillar protein gel[J].Food and Fermentation Industries,2020,46(8):300-306.
[26] XU Y J,HAN M Y,HUANG M Y,et al.Enhanced heat stability and antioxidant activity of myofibrillar protein-dextran conjugate by the covalent adduction of polyphenols [J].Food Chemistry,2021,352:129376.
[27] HAN Z Y,ZHANG J L,ZHENG J Y,et al.The study of protein conformation and hydration characteristics of meat batters at various phase transition temperatures combined with low-field nuclear magnetic resonance and fourier transform infrared spectroscopy [J].Food Chemistry,2019,280:263-269.
[28] KANG Z L,ZHANG X H,LI X,et al.The effects of sodium chloride on proteins aggregation,conformation and gel properties of pork myofibrillar protein running head:Relationship aggregation,conformation and gel properties [J].Journal of Food Science and Technology,2021,58(6):2 258-2 264.