β-葡聚糖(β-glucan,BG)是D-葡萄糖以β-(1,3)(1,4)糖苷键连接的线性聚合物[1],因其高黏度的特点,在降血糖、降胆固醇、维持肠道健康方面发挥良好的生理活性[2]。美国食品和药物管理局(Food and Drug Administration,FDA)以及欧洲食品安全局(European Food Safety Authority,EFSA)已证实了它的生理功能益处[3]。由于其良好的功能特性和胶凝特性,BG在低脂食品生产领域具有良好的应用前景,如PI ERO等[4]将燕麦β-葡聚糖作为脂肪替代品添加到低脂肉饼中,明显改善产品的质构特性;LIU等[5]证实了燕麦β-葡聚糖水解物在低脂肉丸生产中的应用潜力。但BG存在成胶浓度高,成胶速率慢,硬度较大,流动性和贮藏稳定性差[6-7]等缺陷,限制了它在食品中的应用范围。因此,如何改善BG的胶凝性质,提高功能性食品中的膳食比例俨然成为食品领域亟待解决的生产难题。已有文献证实胶体复配是改善凝胶性质最简单有效的手段,如在明胶体系中加入结冷胶可改善混合凝胶性能[8],魔芋胶和黄原胶共混表现出协同增效的凝胶效果[9]。
ERO等[4]将燕麦β-葡聚糖作为脂肪替代品添加到低脂肉饼中,明显改善产品的质构特性;LIU等[5]证实了燕麦β-葡聚糖水解物在低脂肉丸生产中的应用潜力。但BG存在成胶浓度高,成胶速率慢,硬度较大,流动性和贮藏稳定性差[6-7]等缺陷,限制了它在食品中的应用范围。因此,如何改善BG的胶凝性质,提高功能性食品中的膳食比例俨然成为食品领域亟待解决的生产难题。已有文献证实胶体复配是改善凝胶性质最简单有效的手段,如在明胶体系中加入结冷胶可改善混合凝胶性能[8],魔芋胶和黄原胶共混表现出协同增效的凝胶效果[9]。
魔芋葡甘露聚糖(konjac glucomannan,KGM)是由D-葡萄糖和D-甘露糖以β-(1,4)糖苷键连接而成的大分子聚合物[9],具有较强的吸水性、高膨胀率及高黏度[10]。研究表明,KGM在抑制脂肪酸合成、降胆固醇、降血糖、肠道益生等方面发挥益处[11],常作为代糖代脂原料而广泛应用于食品加工领域。目前,KGM的应用多采用碱热脱乙酰的方式使之形成热稳定凝胶,但碱热处理会降低KGM的功能活性[12]。在非碱热条件下,KGM分子在水溶液中能有效保留其功能活性,在低浓度下形成较弱的水溶胶[13]。研究发现,适量KGM可降低卡拉胶的脆度、提高凝胶弹性[9]。综上,在保留生理活性的基础上,水溶胶KGM在降低凝胶硬度,增强持水性等方面表现出较大潜力。
鉴于BG和KGM在胶凝性质方面具有潜在的互补性以及功能活性方面的增效性,二者共混可能改善单一凝胶性质,提高功能性食品中的膳食纤维比例,拓宽生产应用领域。因此,将BG和KGM进行物理共混,通过流变学性质、质构特性、持水性测定探究不同KGM添加量对复合凝胶性质的影响,通过扫描电镜、傅里叶变换红外光谱(Fourier transform infrared,FTIR)等手段探究二者的相互作用,为其在功能性食品的开发应用方面提供数据基础。
1 材料与方法
1.1 试验材料
燕麦β-葡聚糖(纯度>88%),张家口一康生物有限公司;纯化魔芋微粉(纯度>86%),湖北十堰花仙子魔芋制品有限公司。
1.2 仪器与设备
TA-XT plus质构仪,英国Stable Micro Systems公司;MCR302流变仪,奥地利安东帕有限公司;LGJ-10型冷冻干燥机,北京松源华兴科技有限公司;AXTG16G型离心机,盐城市安信实验仪器有限公司;FA2004A型电子分析天平,上海精天电子仪器有限公司;Spectrum100红外光谱仪,美国Perking Elmer公司;Phenom Pro扫描电镜,荷兰Phenom World公司。
1.3 试验方法
1.3.1 BKG复合凝胶的制备
固定总糖浓度为5%(质量分数),设置KGM添加量为0%,0.3%,0.5%,0.7%,1%(质量分数),依次记为BKG1,BKG2,BKG3,BKG4,BKG5。
称取一定质量的BG,加热搅拌溶解,随后缓慢加入不同质量的KGM,继续置于80 ℃水浴搅拌2 h,使二者搅拌均匀,取出倒模冷却,置于4 ℃冰箱静置存放,分别在3、5、7 d时测定其凝胶性质。
1.3.2 复合凝胶的表观特征
参考樊蕊等[7]的方法,稍作调整,样品经冷藏存放一定时间后,以复合体系不流动、结构不坍塌作为是否形成凝胶的判定标准,观察记录各个样品的组织状态。
1.3.3 流变学特性检测
将制备好的凝胶于室温平衡2 h,选择PP25平板,平板间隙1 mm,在恒定25 ℃下进行流变测量。
选择旋转模式进行稳态黏度扫描,剪切速率0.1~100 s-1,采集21个数据点。采用幂律方程模型对数据进行拟合分析[14],如公式(1)所示:
τ=k×γn
(1)
式中:τ-剪切应力;γ-剪切速率;k-稠度系数;n-流性指数。
在振荡模式下,应变在10 rad/s的恒定角频率(ω)下从0.01%增加到100%,以确定线性黏弹区;根据线性黏弹区选择应变0.5%进行动态频率扫描,角频率范围0.1~100 rad/s,采集16个数据点。
1.3.4 质构特性测定
质构测定参考WANG等[8]的方法稍作调整,使用TA-XT plus质构仪的TPA模式,选取P/0.5探头,测前、测试、测后速度设置为1 mm/s,压缩形变50%,时间5 s,触发力0.049 N;凝胶强度测定采用压缩模式,选取P/0.5探头,测前、测试、测后速度设置为0.5 mm/s,测试距离4 mm,感应力0.039 N。
1.3.5 持水性测定
准确称量1~2 g凝胶于离心管中,8 000 r/min离心20 min,取出,滤纸吸干凝胶表面水分,称重记录[7],持水性的计算如公式(2)所示:
持水性![]()
(2)
式中:m-离心析水后凝胶质量,g;M-离心前凝胶质量,g。
1.3.6 红外光谱扫描
凝胶在-80 ℃下冷冻12 h,转移至真空冷冻干燥机干燥48 h,得到冻干凝胶样品,切薄片置于载样台,在波长4 000~600 cm-1内扫描16次,分辨率4 cm-1。
1.3.7 扫描电镜观察
将冷冻干燥得到的冻干凝胶切为0.5 cm厚的片状,用双面胶固定在样品台上,喷金,在2 000倍下进行观察拍照[15]。
1.4 数据处理及分析
所有测量均重复3次,数据以“平均值±标准差”表示,分别采用SPSS 22.0统计分析软件和Origin 8.5数据绘图软件处理数据,采用ANOVA进行显著分析,P <0.05时认为差异显著。
2 结果与分析
2.1 凝胶的表观特征
为直观反映复合凝胶随贮藏时间的变化情况,对复合凝胶的表观特征进行记录。如表1所示,与复合组对比,单一BG能较快形成固体凝胶,且表面光滑、质地紧实。随着KGM添加量的增加,成胶时间延长,或不形成固体凝胶(如BKG4,BKG5)。当KGM添加量>0.7%时,BKG凝胶表现出微流动性,且在贮藏周期内性质稳定;当KGM添加量<0.5%时,由于胶凝作用,BKG凝胶在存放周期内表观状态变化明显,逐渐形成紧实的固体凝胶。说明KGM的添加量及存放时间对BKG凝胶表观状态影响较大,KGM的复合弱化了BG的胶凝性能,延长了成胶时间,增加KGM添加量可获得贮藏稳定的复合凝胶。
表1 不同存放时间下复合体系的表观特征
Table 1 The apparent structure characteristics of composite system under different storage time
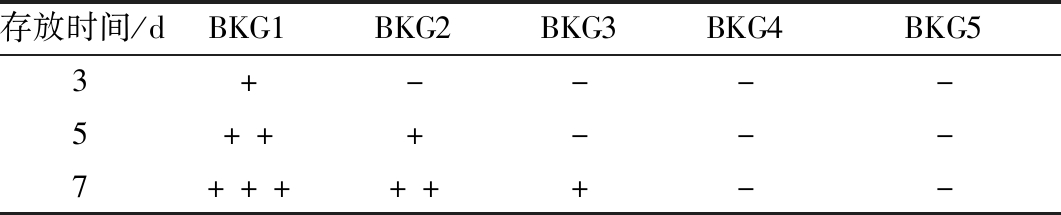
存放时间/dBKG1BKG2BKG3BKG4BKG53+----5+++---7++++++--
注:-为样品具有弱流动性,不成固体凝胶;+为样品形成固体凝胶,但较粗糙,不紧实;++为凝胶较平整光滑;+++为凝胶光滑坚硬紧实[7]
2.2 凝胶的流变特性
2.2.1 静态流变学特性
流变学特性常用来表征复合凝胶的胶凝过程。不同存放时间下的复合凝胶的流变学曲线如图1所示,在0.1~100 s-1剪切速率内,不同KGM添加量的复合凝胶在不同存放时间下均表现出典型的剪切稀化行为。凝聚层的剪切稀化特性可归因于剪切下的结构破坏或重排[16],在0~20 s-1剪切速率范围,由于剪切力的作用,凝聚层被破坏,黏度急剧下降;继续增大剪切,凝胶内部逐渐形成最佳定向取向,黏度趋于平稳。复合体系的表观黏度随KGM添加量的增加呈现先降低后增加的趋势。黏度值用以说明二者相互作用[16],少量的KGM抑制了BG的凝胶性能,成胶结构较为松散,故表现为黏度的下降(如BKG2);当KGM添加量>0.5%时,由于KGM大分子间发生交联缠绕、聚集,表现出黏度上升。各凝胶组随贮藏时间的延长黏度均显著增加。这可能由于在存放周期内,复合体系逐渐形成稳定凝胶,分子间氢键等键作用力增强,导致剪切黏度上升[17]。
根据幂律方程模型对凝胶数据进行拟合,结果如表2所示,拟合方程相关系数均在0.89以上,具有较好的相关性。不同样品的流性指数n<1,表明样品为剪切稀释型假塑性流体[18]。随着KGM添加量的增加,k值增加,这与黏度曲线反映结果一致;n值也随之增加,随后在KGM添加量为1%时n值降低,说明随着KGM的添加,体系假塑性降低,流动性能增强,证明了KGM存在弱化了BG凝胶性能;而1%的KGM可能完全抑制BG凝胶的形成,而表现出KGM高黏稠性质。对比不同存放时间下的n值变化,随存放时间的延长,n值降低,体系假塑性增强,这展现了凝胶结构的缓慢形成过程。这也印证了表1记录结果,KGM的添加延长了BG的成胶时间。
表2 不同复合体系的幂律方程参数
Table 2 Power law equation parameters of different composite systems
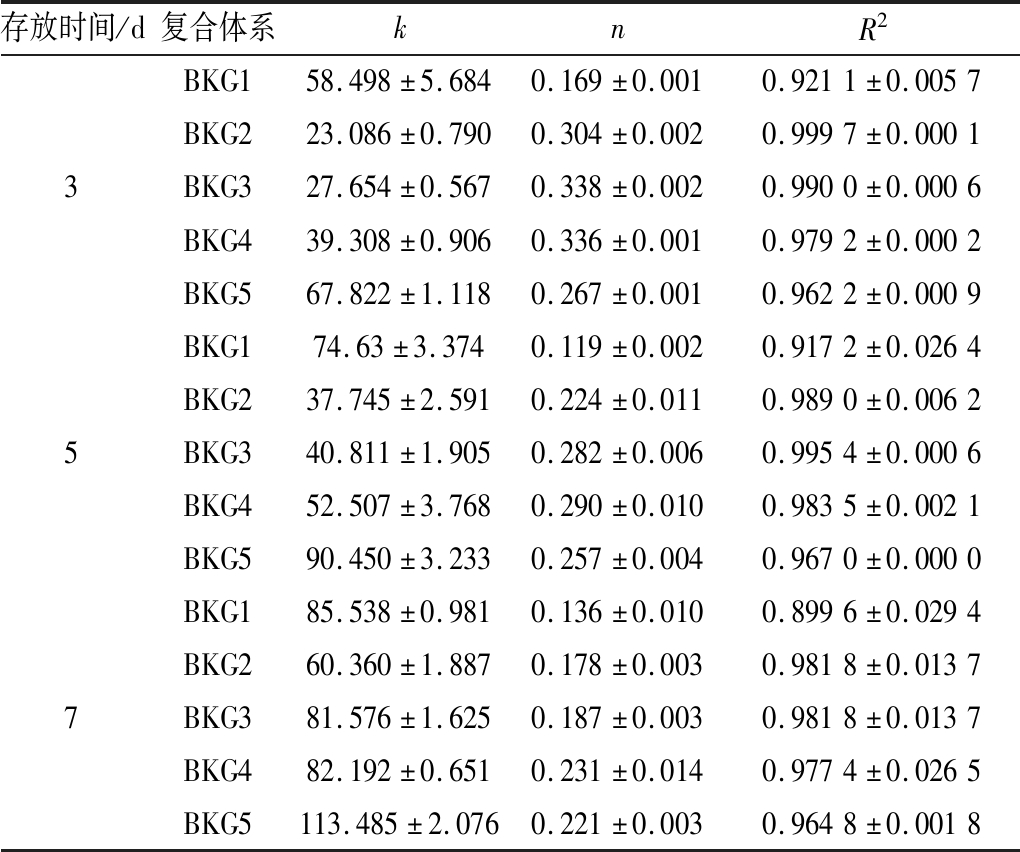
存放时间/d复合体系knR2BKG158.498±5.6840.169±0.0010.9211±0.0057BKG223.086±0.7900.304±0.0020.9997±0.00013BKG327.654±0.5670.338±0.0020.9900±0.0006BKG439.308±0.9060.336±0.0010.9792±0.0002BKG567.822±1.1180.267±0.0010.9622±0.0009BKG174.63±3.3740.119±0.0020.9172±0.0264BKG237.745±2.5910.224±0.0110.9890±0.00625BKG340.811±1.9050.282±0.0060.9954±0.0006BKG452.507±3.7680.290±0.0100.9835±0.0021BKG590.450±3.2330.257±0.0040.9670±0.0000BKG185.538±0.9810.136±0.0100.8996±0.0294BKG260.360±1.8870.178±0.0030.9818±0.01377BKG381.576±1.6250.187±0.0030.9818±0.0137BKG482.192±0.6510.231±0.0140.9774±0.0265BKG5113.485±2.0760.221±0.0030.9648±0.0018

a-存放3 d;b-存放5 d;c-存放7 d
图1 不同存放时间下复合体系的表观黏度
Fig.1 Apparent viscosity of composite system under different storage time
2.2.2 动态流变学特性
对不同存放时间的BKG凝胶进行动态扫描,储能模量(G′)、损耗模量(G″)随角频率(ω)的变化趋势如图2所示。从流变学的角度来看,当损耗模量G′至少比G″大1个数量级,并且模量不依赖于或仅轻微依赖于频率时,就建立了真正的弹性凝胶网络[19]。因此,G′可作为凝胶化程度的量度,在固化凝胶中,G′通常比较稳定,不随频率的变化而发生变化,当G′随频率变化明显时,则表示凝胶较弱,由此可以评估凝胶的成胶过程及成胶能力。
图2-a、图2-c、图2-e显示BKG凝胶在存放3、5、7 d时的G′,图2-b、图2-d、图2-f则为G′'在3、5、7 d的变化曲线。对比图2-a、图2-c、图2-e,BKG1、BKG2具有较低的频率依赖,G′ >G″,表现为类固体性质,但BKG2表现出更强的频率依赖,且BKG2的G′,G″均明显低于BKG1,说明KGM的少量复合,样品的凝胶性能弱化;随存放时间延长,二者的模量均显著增加且G′在7 d时几乎不随频率变化,这与MAKELA等[20]的研究结论一致,证实了BG成胶时间较长的特点。二者对比说明少量的KGM不足以完全抑制BG凝胶网络的形成,但降低了其成胶速度和强度,二者表现出拮抗的复配效果。凝胶的动态流变行为可以通过考虑聚合物分子的流动性来解释,大分子KGM的大量缠结限制了BG分子在水溶液中的伸展,因此需要更长的时间进行重新排列形成凝胶结构[21]。
当KGM添加量>0.5%时,G′均表现出明显的频率依赖,说明增加KGM添加量,可能完全抑制复合凝胶弹性网络的形成,从而导致高KGM添加组的轻微流动性(表1)。在贮藏过程中,BKG3,BKG4,BKG5三组凝胶始终表现出高度频率依赖,且G′,G″随贮藏时间变化较小,说明提高KGM添加量可减弱BG的胶凝能力,增强流动性和贮藏稳定性。这一性质可能更适于模拟奶油顺滑的口感和应用的稳定性。
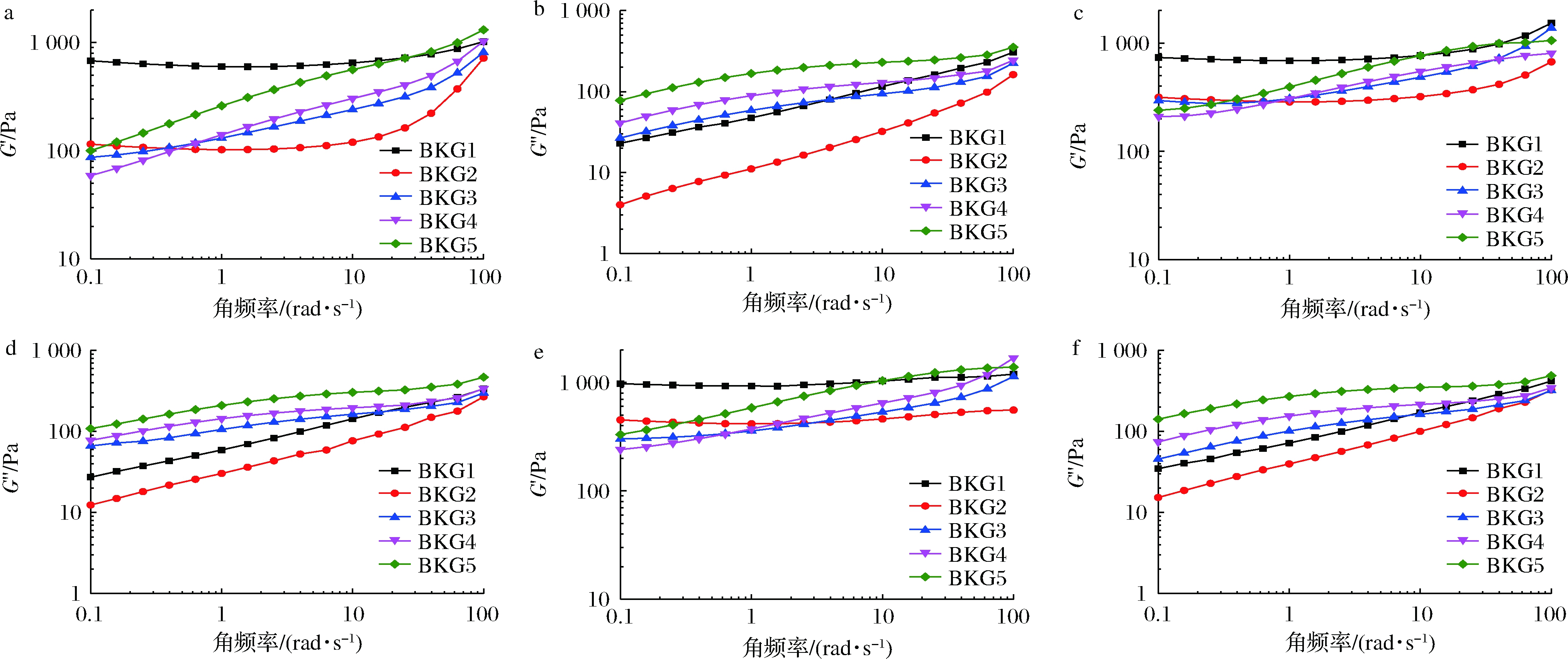
a-G′-3 d;b-G″-3 d;c-G′-5 d;d-G″-5 d;e-G′-7 d;f-G″-7 d
图2 不同存放时间下复合体系的G′,G″ 随角频率变化曲线
Fig.2 The curve of G′,G″ changing with ω of composite system under different storage time
另外,BKG1和BKG2的G′,G″随频率变化具有相似的曲线趋势,而BKG3,BKG4,BKG5三组具有类似的曲线趋势,这可能提示低添加量和高添加量组间存在明显结构差异。为进一步探究KGM的添加对复合凝胶的影响,实验对比了5% BG凝胶,添加量为1%的BKG凝胶及质量分数为1%的KGM溶胶的G′,G″(图3)。1%KGM溶胶在高频范围内,G′>G″,弹性性质占主导地位,在低频范围内,G′<G″,黏性性质占主导地位。在BKG中,流变学性质与KGM溶胶相似,G′,G″在低频范围趋于交叉,随频率增加,差值逐渐增大。这提示了当复合体系中KGM的添加量达到1%时,二者表现为KGM占主导地位的相互作用。

图3 BKG,BG,KGM的G′,G″ 随角频率变化曲线
Fig.3 The curve of G′,G″ changing with ω of BKG,BG,KGM
2.3 凝胶的质构特性
硬度定义为达到变形所需要的力。根据感官分析,硬度是在咬第一口时咬合食物所需要的力[22]。如表3所示,BKG的硬度/凝胶强度与KGM添加量成反比,随着添加量的增加,硬度/凝胶强度显著下降。BG凝胶强度是由凝胶结构中的弹性网络连接区的数量决定,随浓度的增加而增加[23]。结果表明,随KGM添加量的增大,复合凝胶结构中的网络连接区的数量减少,导致凝胶刚性减弱。内聚性代表组成产品主体的内部纽带的强度,它与材料在机械作用下断裂的速率成反比[22]。BKG凝胶的内聚性与KGM添加量成正比,说明随添加量的增加,复合凝胶的柔性增强,在机械力的作用下不易断裂。弹性是食物在第二次压缩中的恢复高度与第一次压缩变形量的比值[21]。在BKG复合凝胶中,当KGM添加量>0.5%时,凝胶的弹性随添加量的增加而显著提升。胶着性用于表示咀嚼半固体食品至可吞咽时所需的能量。结果表明,随着KGM添加量的增加,BKG样品的胶着性显著下降,这意味着KGM的复合对凝胶样品的吞咽口感影响较大。上述结果表明,添加KGM可以改善单一凝胶刚性大、弹性低的问题,提高添加量可得到更顺滑和易吞咽的食用口感。
表3 不同存放时间下复合体系的质构特性
Table 3 Texture characteristics of composite system under different storage time
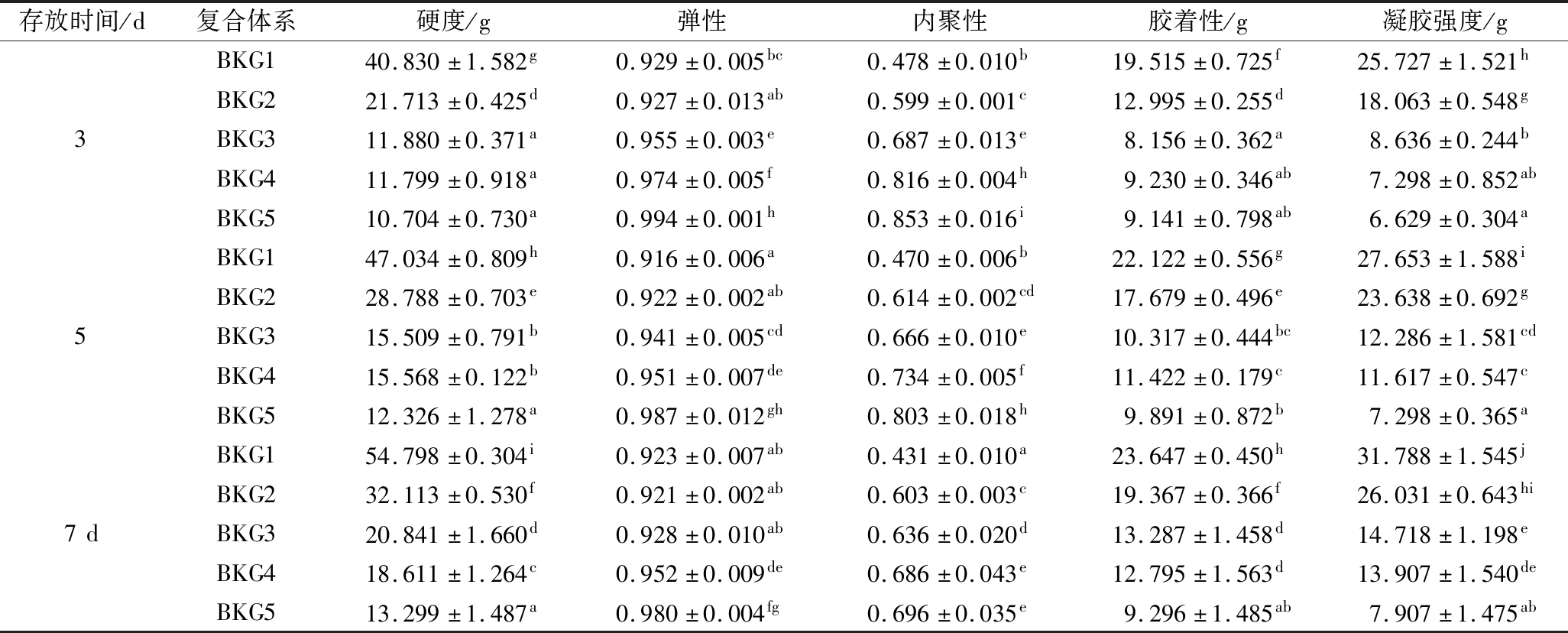
存放时间/d复合体系硬度/g弹性内聚性胶着性/g凝胶强度/gBKG140.830±1.582g0.929±0.005bc0.478±0.010b19.515±0.725f25.727±1.521hBKG221.713±0.425d0.927±0.013ab0.599±0.001c12.995±0.255d18.063±0.548g3BKG311.880±0.371a0.955±0.003e0.687±0.013e8.156±0.362a8.636±0.244bBKG411.799±0.918a0.974±0.005f0.816±0.004h9.230±0.346ab7.298±0.852abBKG510.704±0.730a0.994±0.001h0.853±0.016i9.141±0.798ab6.629±0.304aBKG147.034±0.809h0.916±0.006a0.470±0.006b22.122±0.556g27.653±1.588iBKG228.788±0.703e0.922±0.002ab0.614±0.002cd17.679±0.496e23.638±0.692g5BKG315.509±0.791b0.941±0.005cd0.666±0.010e10.317±0.444bc12.286±1.581cdBKG415.568±0.122b0.951±0.007de0.734±0.005f11.422±0.179c11.617±0.547cBKG512.326±1.278a0.987±0.012gh0.803±0.018h9.891±0.872b7.298±0.365aBKG154.798±0.304i0.923±0.007ab0.431±0.010a23.647±0.450h31.788±1.545jBKG232.113±0.530f0.921±0.002ab0.603±0.003c19.367±0.366f26.031±0.643hi7dBKG320.841±1.660d0.928±0.010ab0.636±0.020d13.287±1.458d14.718±1.198eBKG418.611±1.264c0.952±0.009de0.686±0.043e12.795±1.563d13.907±1.540deBKG513.299±1.487a0.980±0.004fg0.696±0.035e9.296±1.485ab7.907±1.475ab
注:不同小写字母表示差异显著(P <0.05)(下同)
在存放过程中,观察到BKG1,BKG2,BKG3,BKG4组的硬度/凝胶强度/胶着性随存放时间的延长而明显增加,即在贮藏过程中,凝胶继续形成交联结构区域,使得凝胶刚性增强。但时间因素对凝胶刚性的影响远低于KGM复合所带来的影响。当KGM添加量为1%时,凝胶硬度/凝胶强度/胶着性在存放过程中不发生显著变化,说明提高KGM添加量,样品表现出更优的贮藏稳定性。
2.4 凝胶的持水性
持水性是评价食品品质的重要指标,可以反映复合凝胶的结构的紧密性,是用作食品加工方面的重要参考依据。
图4显示了各复合体系分别在3、5、7 d时的持水性差异。当KGM添加量<0.5%时,随着存放时间的延长,复合体系的持水性提高,这是由于在存放过程中,复合体系逐渐形成稳定的凝胶网络结构,故而持水性增强;添加量>0.5%时,持水性提高至99.5%,且在存放周期内均表现出极好的持水性能。由于KGM分子中含有大量的亲水基团而表现出极强的吸水能力[10]。因此,由于KGM的作用,复合体系即可表现出良好的持水性能。
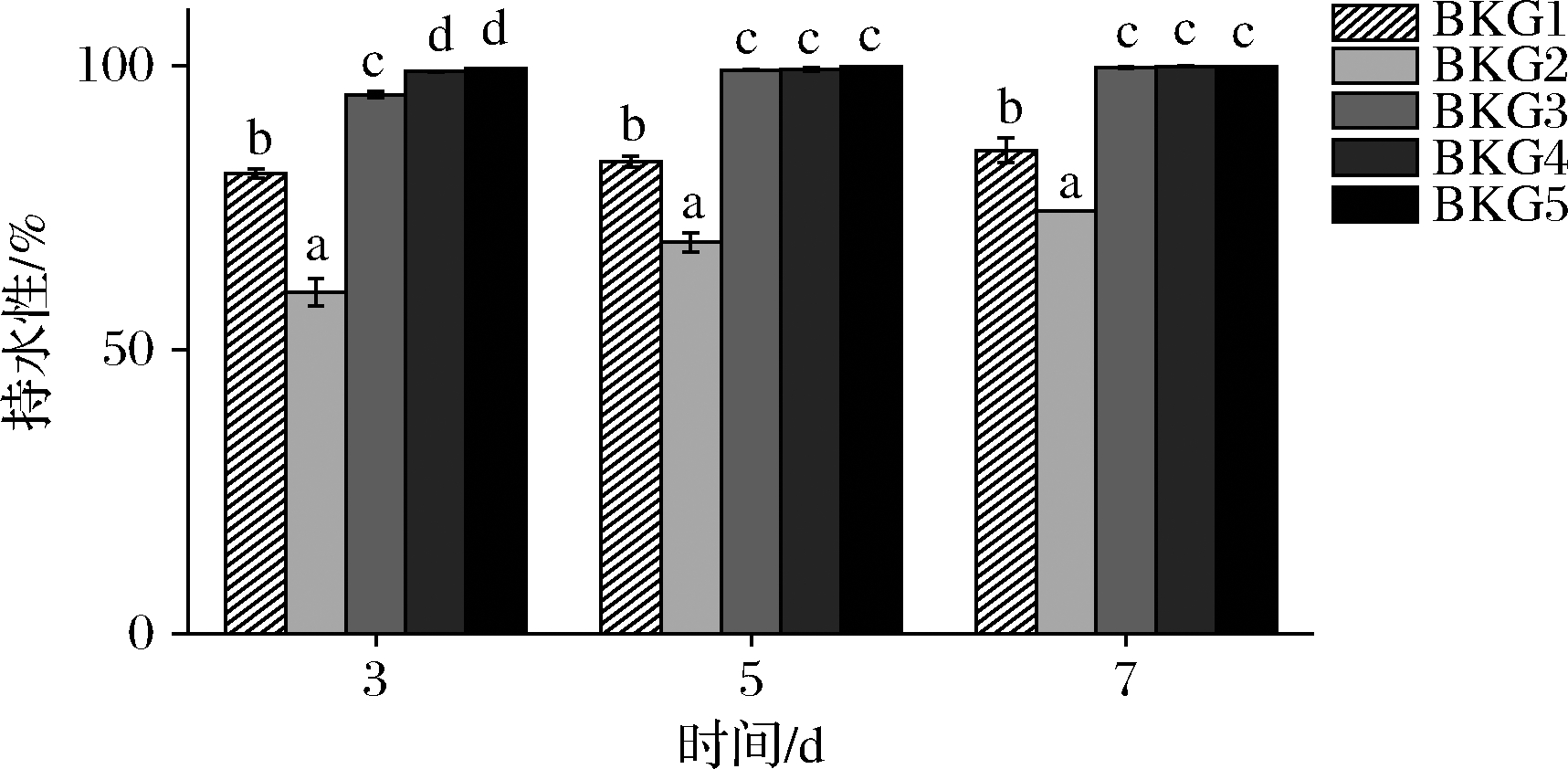
图4 不同存放时间下复合体系的持水性
Fig.4 Water holding capacity of composite system under different storage time
相同时间下,复合体系的持水性在BKG2处均出现最低点,整体呈现先下降后上升的趋势,这可能与凝胶结构的形成有关。上述流变学和质构特性表明,BKG2形成比BKG1更弱的凝胶体系,形成的凝胶网络不足以笼络住体系中的水分,加之体系中KGM浓度较低,不足以完全稳定住水分,故而持水性降低。
2.5 FTIR分析
3 340 cm-1左右出现的吸收峰宽带为分子间或分子内—OH的伸缩振动峰,证实了糖分子中存在明显的分子间氢键[24]。1 642 cm-1处的宽峰为缔合羟基C—O的拉伸,1 021 cm-1左右吸收峰是β-D-吡喃糖C—H的变角振动峰,表明分子中含有β-D-吡喃糖环,896 cm-1处的吸收峰指示了分子以β-糖苷键连结[25]。在KGM的FTIR谱图中,807 cm-1处为KGM甘露糖的特征吸收峰[26]。
KGM和BG的相互作用可以通过FTIR来分析,如图5所示,KGM和BG分别在3 330 cm-1和3 323 cm-1处出现宽峰,复合物BKG在此处的吸收峰向较高波数移动,表明BG与KGM发生相互作用,分子内氢键发生弯曲振动。BKG的FTIR图谱包含二者所有的特征峰,且峰减小,说明二者可能存在类似吸附的交互作用。BKG中1 723 cm-1处羰基伸缩峰减弱消失,而在1 642 cm-1处发生分子内氢键的拉伸偶联并向较低的波数轻微偏移,YE等[27]在研究KGM与壳聚糖的共混作用时观察到类似现象,表明BG与KGM分子在复合过程中发生新的氢键,二者可能通过氢键相互作用。
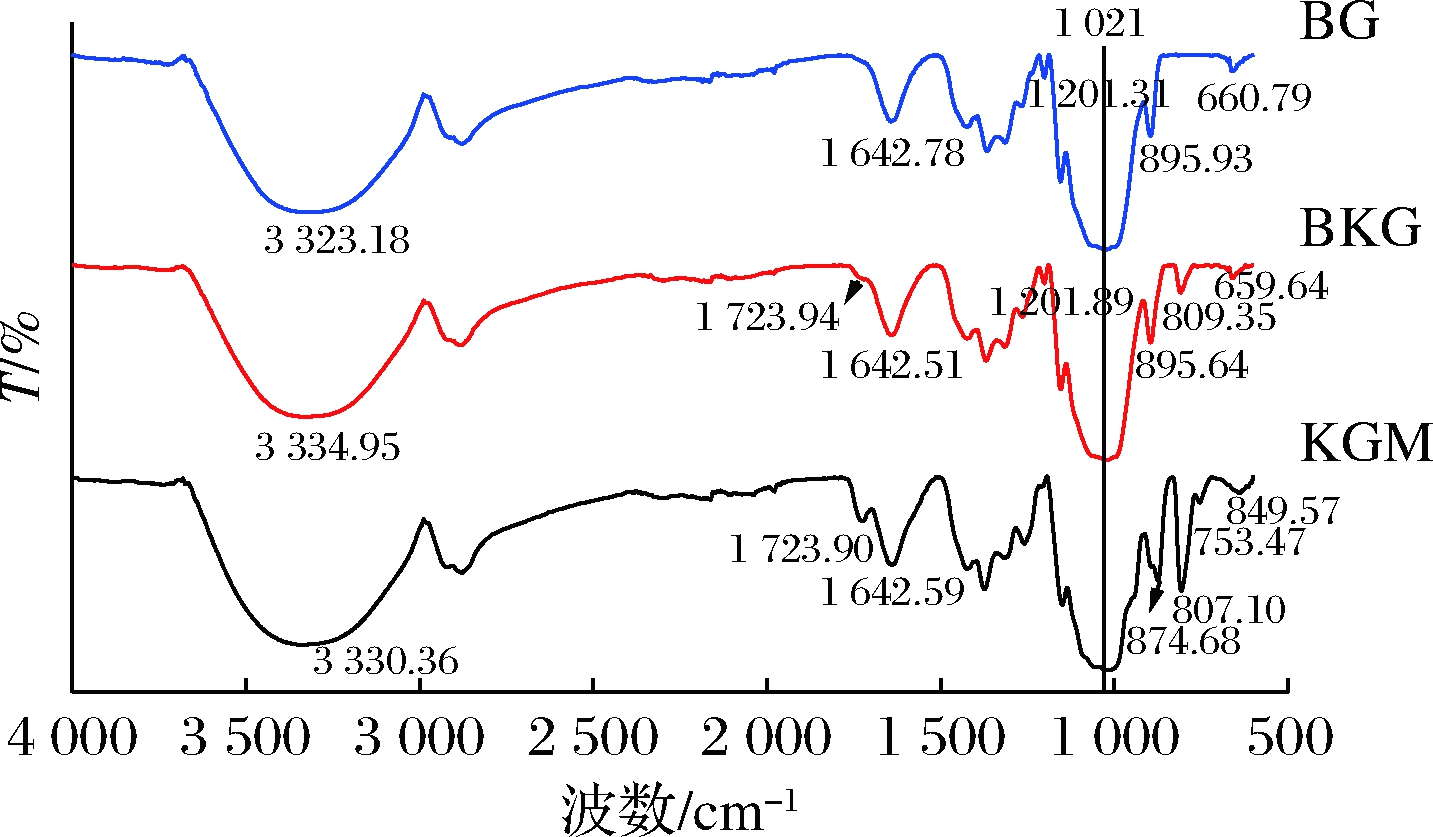
图5 BKG、BG和KGM的FTIR图谱
Fig.5 FTIR spectra of BKG,BG and KGM
2.6 凝胶的微观结构
图5中显示了两种完全不同类型的空间结构,一类是交联网络结构,另一类是规律的片层结构,这从微观结构上解释了复合体系的宏观性质。如图5-a,5%的β-葡聚糖在水溶液中逐渐形成紧密交联的弹性网络结构,图5-b~图5-e显示,随着KGM添加量的增加,复合体系的空间结构逐渐由交联网络过渡为片层结构,片层结构不稳定,在外界力的作用下易产生位移,从而表现出宏观的流动性。这合理解释了KGM添加量较高时,体系具有微流动性的原因。
对比图5-a~图5-c,BKG2,BKG3形成的弹性网络连接区的数量较BKG1明显减少;图5-d、图5-e显示BKG4,BKG5的凝胶呈明显的片层结构,与质量分数为1%的KGM胶体结构(图5-f)类似。纯KGM凝胶呈现表面光滑的片层结构,而复合组的结构片层较为粗糙,表面可观察到网络镶嵌,网络骨架镶嵌在片层表面或内部。这可以解释为二者存在吸附或包埋的相互作用:在KGM和BG复合体系中,大分子KGM吸水溶胀,通过氢键作用吸附包埋了水溶液中的BG分子,限制了溶液中BG分子的伸展、交联,溶液中可用作胶凝的BG分子减少,从而导致复合凝胶(图5-b、图5-c)的网络连接区较少,凝胶强度减弱,持水性下降。随着KGM复合比例上升,更多的KGM分子参与作用,BG分子被完全吸附或包埋,从而微观上表现为纯KGM凝胶的片层结构,宏观上表现为微流动性。
3 结论
本研究探讨了不同添加量的KGM及不同贮藏时间对KGM/BG复合凝胶性质的影响,并对凝胶机理进行了初步讨论,可以为BG在食品加工生产领域的应用提供一定的理论支撑。研究发现添加KGM可显著改变KGM/BG复合凝胶的性质,KGM添加量<0.5%时会对BG凝胶的形成产生不利影响,不利于凝胶食品的开发利用;当KGM添加量>0.5%时,复合体系将获得更好的持水性及流动性,适宜于涂抹性食品的开发利用。基于此,生产时可通过调配原料比例、控制添加量来拓宽BG在食品生产中的应用范围,这为产品开发提供了有效思路及数据基础。

a- BKG1;b- BKG2;c- BKG3;d- BKG4;e- BKG5;f- 1%KGM
图6 不同复合体系的扫描电镜图(2 000 X)
Fig.6 Scanning electron microscope images of different composite systems (2 000 X)
[1] MISHRA N.Cereal β glucan as a functional ingredient[M]//MISHRA P,MISHRA R R,ADETUNJI C O.Innovations in Food Technology:Current Perspectives and Future Goals.Singapore:Springer Singapore,2020:109-122.
[2] BAI J Y,REN Y K,LI Y,et al.Physiological functionalities and mechanisms of β-glucans[J].Trends in Food Science &Technology,2019,88:57-66.
[3] 杨成峻,陈明舜,戴涛涛,等.燕麦β-葡聚糖功能与应用研究进展[J].中国食品学报,2021(6):301-311.
YANG C J,CHEN M S,DAI T T,et al.Research advances in functional properties and application of oat β-Glucan[J].Journal of Chinese Institute of Food Science and Technology,2021(6):301-311.
[4] PI ERO M P,PARRA K,HUERTA-LEIDENZ N,et al.Effect of oat’s soluble fibre (β-glucan) as a fat replacer on physical,chemical,microbiological and sensory properties of low-fat beef patties[J].Meat Science,2008,80(3):675-680.
ERO M P,PARRA K,HUERTA-LEIDENZ N,et al.Effect of oat’s soluble fibre (β-glucan) as a fat replacer on physical,chemical,microbiological and sensory properties of low-fat beef patties[J].Meat Science,2008,80(3):675-680.
[5] LIU R,WANG N,LI Q,et al.Comparative studies on physicochemical properties of raw and hydrolyzed oat β-glucan and their application in low-fat meatballs[J].Food Hydrocolloids,2015,51:424-431.
[6] SKENDI A,BILIADERIS C G,LAZARIDOU A,et al.Structure and rheological properties of water soluble beta-glucans from oat cultivars of Avena sativa and Avena bysantina[J].Journal of Cereal Science,2003,38(1):15-31.
[7] 樊蕊,周丹,马培华,等.不同分子量的β-葡聚糖复合凝胶的制备及其凝胶特性的研究[J].食品研究与开发,2019,40(16):6-10.
FAN R,ZHOU D,MA P H,et al.Study on oat β-glucan mixed gels with different molecular weights and its properties[J].Food Research and Development,2019,40(16):6-10.
[8] WANG J J,ZHAO X,ZHOU C Y,et al.Effects of gellan gum and inulin on mixed-gel properties and molecular structure of gelatin[J].Food Science &Nutrition,2021,9(3):1 336-1 346.
[9] 庞杰,吴春华,温成荣,等.魔芋葡甘聚糖凝胶研究进展及其问题[J].中国食品学报,2011,11(9):181-187.
PANG J,WU C H,WEN C R,et al.Research advances in konjac glucomannan gel and its problem[J].Journal of Chinese Institute of Food Science and Technology,2011,11(9):181-187.
[10] TAKIGAMI S.Chapter 18 - Konjac Glucomannan[M]//PHILLIPS G O,WILLIAMS P A.Handbook of Hydrocolloids.3th ed.UK:Woodhead Publishing,2021:563-577.
[11] BEHERA S S,RAY R C.Nutritional and potential health benefits of konjac glucomannan,a promising polysaccharide of elephant foot yam,Amorphophallus konjac K.Koch:A review[J].Food Reviews International,2017,33(1):22-43.
[12] LI M Y,FENG G P,WANG H,et al.Deacetylated konjac glucomannan is less effective in reducing dietary-induced hyperlipidemia and hepatic steatosis in C57BL/6 mice[J].Journal of Agricultural and Food Chemistry,2017,65(8):1 556-1 565.
[13] 龙晓燕.天然大分子魔芋葡甘聚糖的凝聚态基础研究[D].北京:中国工程物理研究院,2013.
LONG X Y.Basic study on condensed state of natural macromolecule konjac glucomannan[D].Beijing:Chinese Academy of Engineering Physics,2013.
[14] LIU D,LI Z,FAN Z W,et al.Effect of soybean soluble polysaccharide on the pasting,gels,and rheological properties of kudzu and lotus starches[J].Food Hydrocolloids,2019,89:443-452.
[15] SHEN R L,LIU X Y,DONG J L,et al.The gel properties and microstructure of the mixture of oat β-glucan/soy protein isolates[J].Food Hydrocolloids,2015,47:108-114.
[16] WEE M S M,NURHAZWANI S,TAN K W J,et al.Complex coacervation of an arabinogalactan-protein extracted from the Meryta sinclarii tree (puka gum) and whey protein isolate[J].Food Hydrocolloids,2014,42(1):130-138.
[17] GRAESSLEY W W.The Entanglement Concept in Polymer Rheology[M].Berlin Heidelberg:Springer,2005.
[18] MA S P,ZHU P L,WANG M C.Effects of konjac glucomannan on pasting and rheological properties of corn starch[J].Food Hydrocolloids,2019,89:234-240.
[19] MORRIS E R,NISHINARI K,RINAUDO M.Gelation of gellan-A review[J].Food Hydrocolloids,2012,28(2):373-411.
[20] MAKELA N,MAINA N H,VIKGREN P,et al.Gelation of cereal β-glucan at low concentrations[J].Food Hydrocolloids,2017,73:60-66.
[21] KONTOGIORGOS V,VAIKOUSI H,LAZARIDOU A,et al.A fractal analysis approach to viscoelasticity of physically cross-linked barley β-glucan gel networks[J].Colloids and Surfaces B:Biointerfaces,2006,49(2):145-152.
[22] ABID M,YAICH H,HIDOURI H,et al.Effect of substituted gelling agents from pomegranate peel on colour,textural and sensory properties of pomegranate jam[J].Food Chemistry,2018,239:1 047-1 054.
[23] BRUMMER Y,DEFELICE C,WU Y,et al.Textural and rheological properties of oat beta-glucan gels with varying molecular weight composition[J].Journal of Agricultural and Food Chemistry,2014,62(14):3 160-3 167.
[24] SHAH A,GANI A,AHMAD M,et al.β-Glucan as an encapsulating agent:Effect on probiotic survival in simulated gastrointestinal tract [J].International Journal of Biological Macromolecules,2016,82:217-222.
[25] SYNYTSYA A,NOVAK M.Structural analysis of glucans [J].Annals of Translational Medicine,2014,2(2):17.
[26] LI B,LI J Y,XIA J,et al.Effect of gamma irradiation on the condensed state structure and mechanical properties of konjac glucomannan/chitosan blend films[J].Carbohydrate Polymers,2011,83(1):44-51.
[27] YE X,KENNEDY J F,LI B,et al.Condensed state structure and biocompatibility of the konjac glucomannan/chitosan blend films[J].Carbohydrate Polymers,2006,64(4):532-538.