随着近几年我国酒精类饮品的消耗不断增加,酒精产生的健康性问题日益突出。酒精性肝病是长期过量饮酒导致的酒精性脂肪肝、酒精性肝炎、肝纤维化及酒精性肝硬化的统称,目前我国酒精性肝病呈现迅速增长趋势[1]。
白酒是中国的国酒。随着我国国民经济的不断发展和人民生活质量的提高,人们对健康白酒的需求量日益增加。酱香型白酒作为中国白酒典型香型之一,因其独特的工艺,幽雅细腻的口感,含有多种有益健康的成分,以及较好的饮后舒适度,备受消费者的喜爱[2]。
近年来,多有针对酱香型白酒健康饮用功效的研究报道。陈蕊等[3]观察两种不同品质的白酒长期灌胃后对大鼠肝脏的病理学影响,发现优级白酒致肝脏损伤程度较一般白酒小。王川南等[4]通过将不同剂量的酱香型白酒对小鼠连续灌胃,结果表明低、中剂量的白酒对小鼠基本无肝损伤影响,甚至低剂量白酒对小鼠抗疲劳有一定的效果。赵雪珂等[5]通过观察高、中、低不同剂量的某酱香型白酒对酒精代谢相关酶表达的影响,来探讨酱香型白酒进入体内后代谢情况,研究结果表明该酱香型白酒对大鼠肝脏乙醇脱氢酶(alcohol dehydrogenase,ADH)的影响与纯食用酒精无显著差异,但可明显升高大鼠肝脏乙醛脱氢酶(acetaldehyde dehydrogenase,ALDH)活性,从而减轻乙醛对机体的毒害作用。罗强等[6]通过建立氧化损伤模型,证实了从酱香型白酒中分离出的活性成分对肝组织中相关氧化酶抗氧化基因表达有促进作用。
本实验旨在通过小鼠慢性酒精性肝损伤模型,对比分析长期饮用酱香型白酒与其他香型白酒后对酒精性肝损伤的影响差异性,并初步探讨其酒体微量成分的作用机制。
1 材料与方法
1.1 材料
1.1.1 实验酒样
实验组样品:A、B、C、D为本公司生产的4款酱香型白酒产品(分别标记GT-GB、GT-JJ、GT-15、GT-LJ),E、F、G分别为市售的某浓香型、清香型和酱香型白酒名优代表产品,各个酒样酒精度数均为53%vol。对照组样品:分别为食用酒精(伏特加,酒精度数调整为53%vol)对照组和安慰剂(生理盐水)对照组。
1.1.2 实验小鼠及环境要求
小鼠品系为C57/BL21,4月龄,雄性,平均体重为(20±2) g,购于北京斯贝福生物公司,喂养实验于北京卓凯生物技术公司清洁Ⅱ级环境[实验动物使用许可信息:SYXK(京)2021-0025]。
1.1.3 实验试剂
小鼠乙醇脱氢酶酶联免疫试剂盒(037245)、小鼠乙醛脱氢酶酶联免疫试剂盒(037243),上海酶联免疫生物科技有限公司;超氧化物歧化酶(superoximutase,SOD)测定试剂盒(A001-1-2)、还原型谷胱(glutathione,GSH)甘肽测定试剂盒(A006-1-1)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX)测定试剂盒(A005-1-2)、丙二醛(malondialdehyde,MDA)测定试剂盒(A003-1-2),南京建成生物工程研究所。
1.1.4 仪器与设备
SW-CJ-1F洁净工作台,苏州安泰空气技术有限公司;Milli-Q Gradien超纯水系统,美国Millipore公司;TE412-L精密电子天平,北京赛多利斯仪器系统有限公司;Scimtific Forna 900超低温冰箱、Multlskan FC酶标仪、Themo BR4i冷冻离心机,美国热电公司;SpectraMax® iD3多功能酶标仪,美国Molecular Devices 公司;DHG-9 162电热恒温培养箱,上海一恒科技有限公司;KIMBLE Dounce组织研磨仪,德国sigma公司。
1.2 动物喂养与样品采集
1.2.1 动物分组与处理
45只小鼠随机分为9组,每组5只。
根据《2019年美国肝病学会临床指南:酒精相关性肝病的诊断和治疗》[7]对酒精性肝病的人体每日酒精摄入最大剂量建议,同时结合我国饮酒人群的日常饮酒量统计学数据,以人体每日摄入纯酒精量90 g/kg单位体重为参照,与小鼠的等效药理学剂量折算出每只小鼠每日纯酒精摄入剂量为8 g/kg单位体重,根据所用酒样的酒精度(53%vol),计算出每只动物每天灌胃白酒和食用酒精剂量为0.25 mL。
连续灌胃21 d进行肝损伤病理模型造模,记录小鼠健康状况变化。
1.2.2 样本采集
将灌胃最后一天的小鼠禁食14 h,用乙醚轻微麻醉后,采用急性失血法颈椎脱臼处死小鼠后获得肝脏组织样本,置于-80 ℃超低温冰箱贮存待测,所有操作遵循程序符合实验动物伦理操作规范(备案号:ZKNJ-2021-011H)。
1.3 抗氧化指标测定
1.3.1 小鼠肝脏中ADH及ALDH含量测定
用4 ℃生理盐水冲洗肝脏组织,清除血液。滤纸吸干后,称取0.1 g肝组织,用PBS缓冲液(pH=7.2~7.4)制备10%组织匀浆,在4 ℃下以6 000 r/min离心15 min,收集上清液,按试剂盒说明书测定ADH和ALDH的含量。
1.3.2 SOD活性测定
黄嘌呤氧化酶法测定SOD活性。按照试剂盒的操作步骤,将每种试剂加入试管中,加入0.02 mL 10%肝组织匀浆,均匀混合,在37 ℃下温育20 min,在450 nm处用酶标仪测量OD值。
1.3.3 GSH含量测定
比色法测定GSH含量。按照试剂盒的操作步骤,将每种试剂加入试管,加入1.0 mL 10%肝组织匀浆,在420 nm和1 cm光径下用酶标仪测定OD值。
1.3.4 GSH-PX活性测定
比色法测定GSH-Px活性。按照试剂盒的操作步骤,将每种试剂加入试管,加入0.2 mL 10%肝组织匀浆,在412 nm处用酶标仪测定OD值。
1.3.5 MDA含量测定
硫代巴比妥酸法测定MDA含量。按照试剂盒的操作步骤,将每种试剂加入试管中,加入0.05 mL 10%肝组织匀浆,用旋涡混合器搅拌均匀,用保鲜膜固定试管口,用针头扎1个小孔,在95 ℃下沸水浴40 min,取出冷却,然后4 000 r/min 离心10 min,取上清液,在532 nm和1 cm光径下,用酶标仪测量OD值。
1.4 肝脏组织病理学苏木精伊红染色法 (hematoxylin-eosin,HE)观察
从肝左叶中部横切面取材,冷冻切片,苏丹Ⅲ进行HE染色,200倍显微镜下观察。
1.5 数据分析
实验结果采用Excel 2019、SPSS Statistics 26软件分析处理数据,图表由Origin 2017绘制。
2 结果与分析
2.1 肝脏中ADH及ALDH含量分析
ADH、ALDH是酒精在肝脏氧化代谢过程中主要的代谢酶,可以将乙醇代谢为乙醛,并将乙醛分解成乙酸,参与三羧酸循环,最终生成二氧化碳和水被排出体外[8],从而减少乙醛在体内的蓄积。本实验对灌胃21 d后小鼠肝组织匀浆中ADH、ALDH含量进行统计分析,结果见图1。与安慰剂组相比较,除了C酒样(酱香GT-15),其他实验组肝组织匀浆中ADH含量增加,其中E 组(某浓香)有显著性差异(P<0.05),G组(某酱香)差异极显著(P<0.01)。与食用酒精组相比较,除G组(某酱香)外,其他灌胃组小鼠肝组织匀浆ADH含量均减少,其中酱香GT样品B、C、D组差异显著(P<0.05)。分析肝组织匀浆中的ALDH含量,仅有A(酱香GT-GB)、C酒样(酱香GT-15)与安慰剂和食用酒精(伏特加)组相比有增加,但差异不显著。肝脏ADH表达水平提高说明该酒长期饮用可以促进对肝脏酒精的敏感性,提升酒精代谢转化为乙醛速率,但是如果乙醛脱氢酶表达水平并未提升,反而增加了乙醛积累量产生毒性。
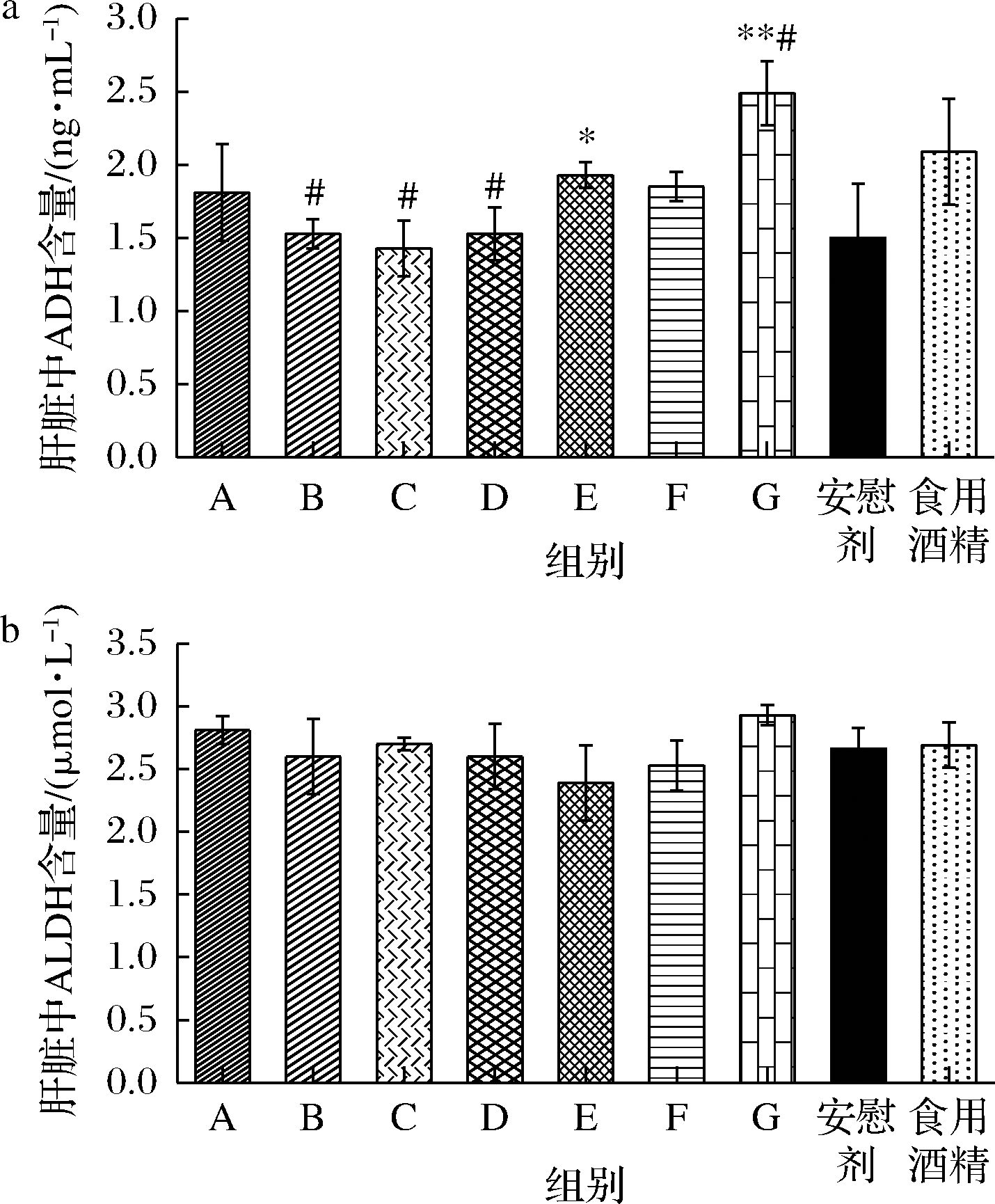
a-肝脏ADH含量;b-肝脏ALDH含量
图1 长期灌胃不同白酒样品小鼠肝脏中ADH、ALDH含量
Fig.1 Analyzing the content of ADH、ALDH in mice liver after Baijiu chronic administration
注:*表示与安慰剂组相比较有显著性差异(P<0.05),**表示与安慰剂组相比较有极显著性差异(P<0.01);#表示与食用酒精组相比较有显著性差异(P<0.05)(下同)
2.2 肝脏中SOD、GSH、GSH-Px含量分析
SOD在氧化和抗氧化的平衡中起着重要作用,可以降解并清除机体内活性氧自由基。GSH-Px是机体重要的抗氧化酶,能催化H2O2的分解,降低机体内羟自由基的水平,从而保护生物膜。GSH是一种重要的抗氧化剂和自由基清除剂,具有较强的还原作用,使肝细胞膜对氧自由基的耐受作用增强从而保护肝细胞。此外,肝细胞GSH的一个非常重要的生理功能是整合解毒功能,能与某些药物和毒素结合,参与生物转化,将体内有害毒物转化为无害物质并排出体外[9-10]。因此,分析酒精造模动物肝脏中SOD、GSH、GSH-Px的表达水平变化情况,可以清晰判断酒精性肝损伤的影响程度。连续长期灌胃不同酒样的小鼠肝组织匀浆中SOD活力、GSH含量和GSH-Px活力检测结果如图2所示。各灌胃酒样的实验组小鼠肝脏中SOD活力与灌胃安慰剂组相比较,均有所提升,但在统计学上仅有E酒样(某浓香白酒)有显著差异(P<0.05)。与灌胃食用酒精组相比较,各酒样灌胃组均无显著差异(P>0.05)。灌胃酱香GT酒样A、B、C、D组的小鼠肝脏SOD活力与灌胃酒样E(某浓香白酒)、F组(某酱香白酒)相比较有所升高,并无显著性差异。分析各灌胃酒样后小鼠肝组织匀浆中GSH-Px、GSH含量变化,结果发现,与灌胃安慰剂相比较,除G酒样(某酱香白酒)外,其余各酒样组小鼠肝组织匀浆中GSH-Px活力均有所增加,其中A(酱香GT-GB)、F(某清香白酒)组差异极显著(P<0.01);各灌胃组小鼠肝组织匀浆中GSH含量均增加,其中A(酱香GT-GB)、E(某浓香白酒)、F(某清香白酒)、G组(某酱香白酒)有显著性差异(P<0.05)。相对酒样A组(酱香GT-GB),灌胃酱香GT其他酒样B、C、D组小鼠肝组织匀浆中GSH含量显著下降(P<0.01),GSH-Px活力显著降低(P<0.05)。与灌胃G酒样(某酱香白酒)相比较,灌胃酱香GT酒样B、C、D酒样模型组小鼠肝脏GSH含量极显著性升高(P<0.05),而GSH-Px活力则极显著性下降(P<0.01)。与E(某浓香白酒)、F组(某酱香白酒)相比较,灌胃酒样A组(酱香GT-GB)的小鼠肝脏GSH含量及GSH-Px活力增加,差异显著(P<0.05),灌胃酱香GT酒样B、C、D组小鼠肝脏GSH-Px活力明显升高(P<0.05)。已有研究结果表明,长期灌胃酱香白酒的小鼠肝损伤程度较小,推测可能与其所含的SOD作为氧自由基清除剂有关[11-12]。本研究结果表明,除酱香型白酒外,清香型白酒和浓香型白酒也能在一定程度上缓解长期酒精摄入引起的小鼠肝脏抗氧化应激压力,降低酒精性肝损伤水平。另外,在酱香GT 4个酒样中,长期灌胃酱香GT-GB酒样的小鼠肝脏GSH-PX活力和GSH含量较其他酒样升高且差异极为显著(P<0.01),其他几类酱香GT白酒也可以显著提升小鼠肝脏GSH-Px和GSH表达水平。
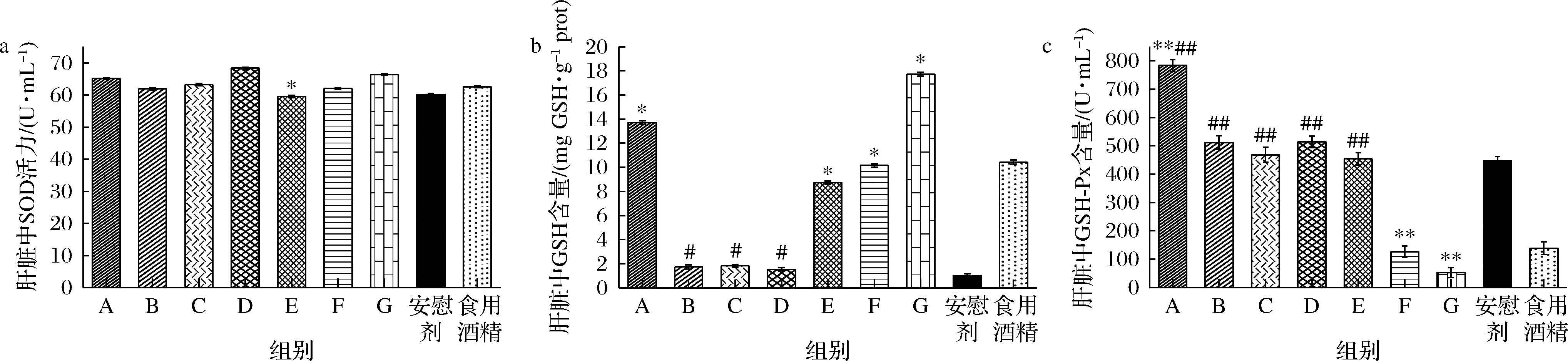
a-肝脏SOD 活力;b-肝脏GSH含量;c-肝脏GSH-Px活力
图2 长期灌胃不同白酒样品小鼠肝脏中SOD、GSH、GSH-Px含量和活力测定结果
Fig.2 Analyzing the content and activity of SOD、GSH、GSH-Px liver in mice livers after Baijiu chronic administration
注:##表示与食用酒精组相比较有极显著性差异(P<0.01)(下同)
2.3 肝脏中MDA含量分析
MDA为机体脂质过氧化的重要终产物,其表达水平可以反映脂质过氧化程度[13-14],间接反映肝细胞受损程度。如图3所示,灌胃酒样的实验组与安慰剂组相比较,除B组(酱香GT-JJ)和D组(酱香GT-LJ)外,其他各组小鼠肝脏中MDA含量上升,其中A组(酱香GT-GB)、E组(某浓香白酒)具有显著差异(P<0.05)。与食用酒精组相比较,各组灌胃酒样的小鼠肝脏中MDA含量均有所下降,其中B组(酱香GT-JJ)、D组(酱香GT-LJ)下降水平差异极显著(P<0.01)。酱香GT 4个酒样中,灌胃A、C、D后小鼠肝脏中MDA含量相对灌胃酒样B组有所增加,且A组升高较为显著(P>0.01)。与其他样品相比,灌胃酱香GT酒样B、C、D后小鼠肝脏中MDA含量相对灌胃酒样G组(某酱香白酒)有所减少,有显著差异(P<0.05)。研究结果表明,灌胃各酱香GT白酒后的小鼠肝组织匀浆MDA含量显著下降,酒精及其代谢产物形成的负面效应程度降低,酒精性肝损伤程度降低。
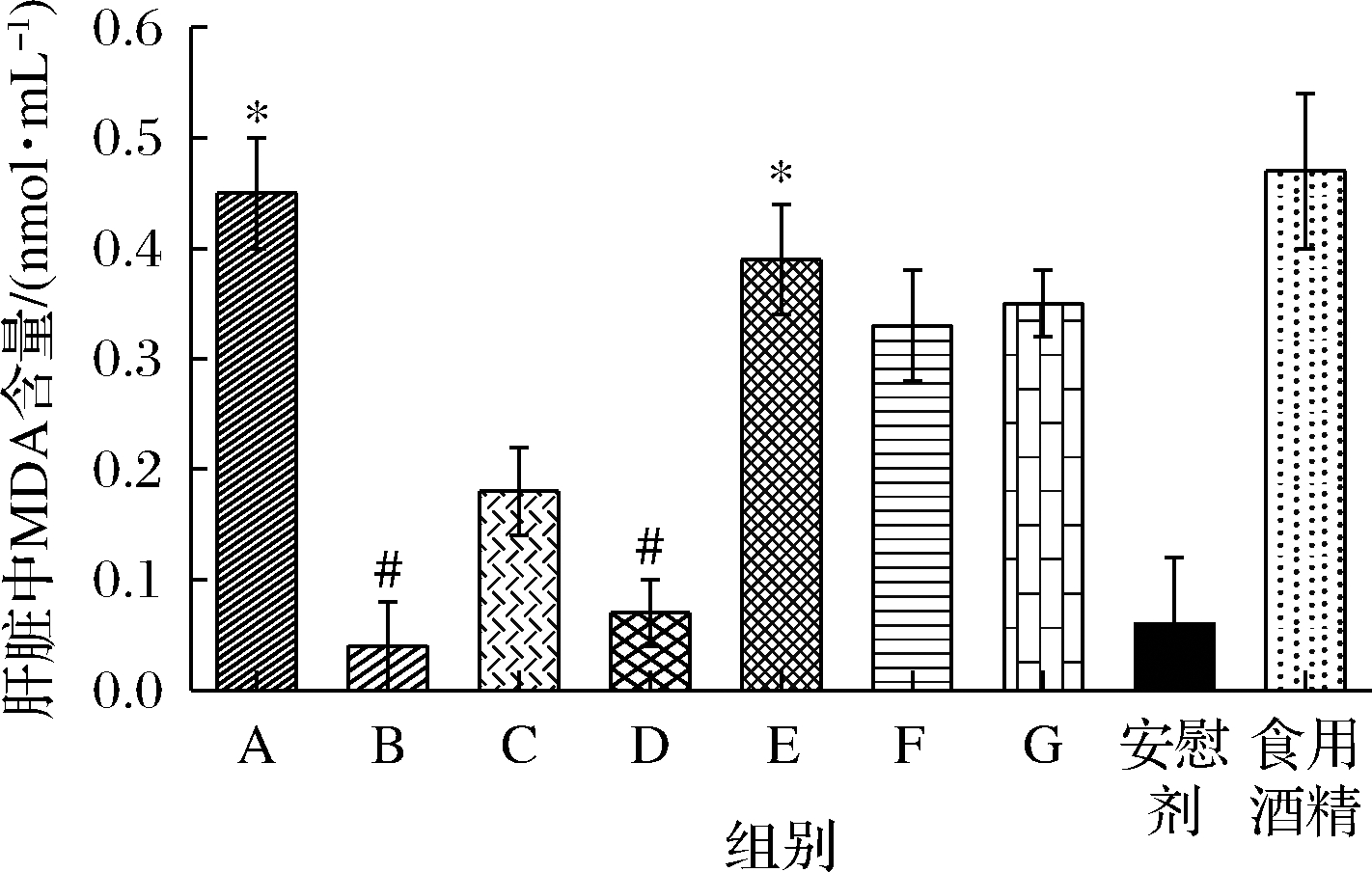
图3 长期灌胃不同白酒样品小鼠肝脏中MDA含量测定结果
Fig.3 Analyzing the content of SOD、GSH、GSH-Px in mice livers after Baijiu chronic administration
2.4 肝细胞HE染色形态学观察
肝细胞HE染色形态学观察结果图4所示。安慰剂组小鼠的肝小叶结构清晰、完整,肝细胞排列整齐、大小正常,胞浆均匀,无炎症细胞浸润,无明显的肝组织变性、水肿、坏死等现象。中央静脉内具有红细胞,肝汇管区的胆管上皮排列正常,门静脉分支正常,双核比例在正常范围(25%)。其他各香型白酒组、各酱香白酒组小鼠肝内血窦扩张,内有红细胞,肝门静脉内有红细胞,极少部分样品门静脉分支略扩张,内含大量红细胞,但是未见有炎症细胞浸润,未见明显肝组织变性、水肿、坏死等。
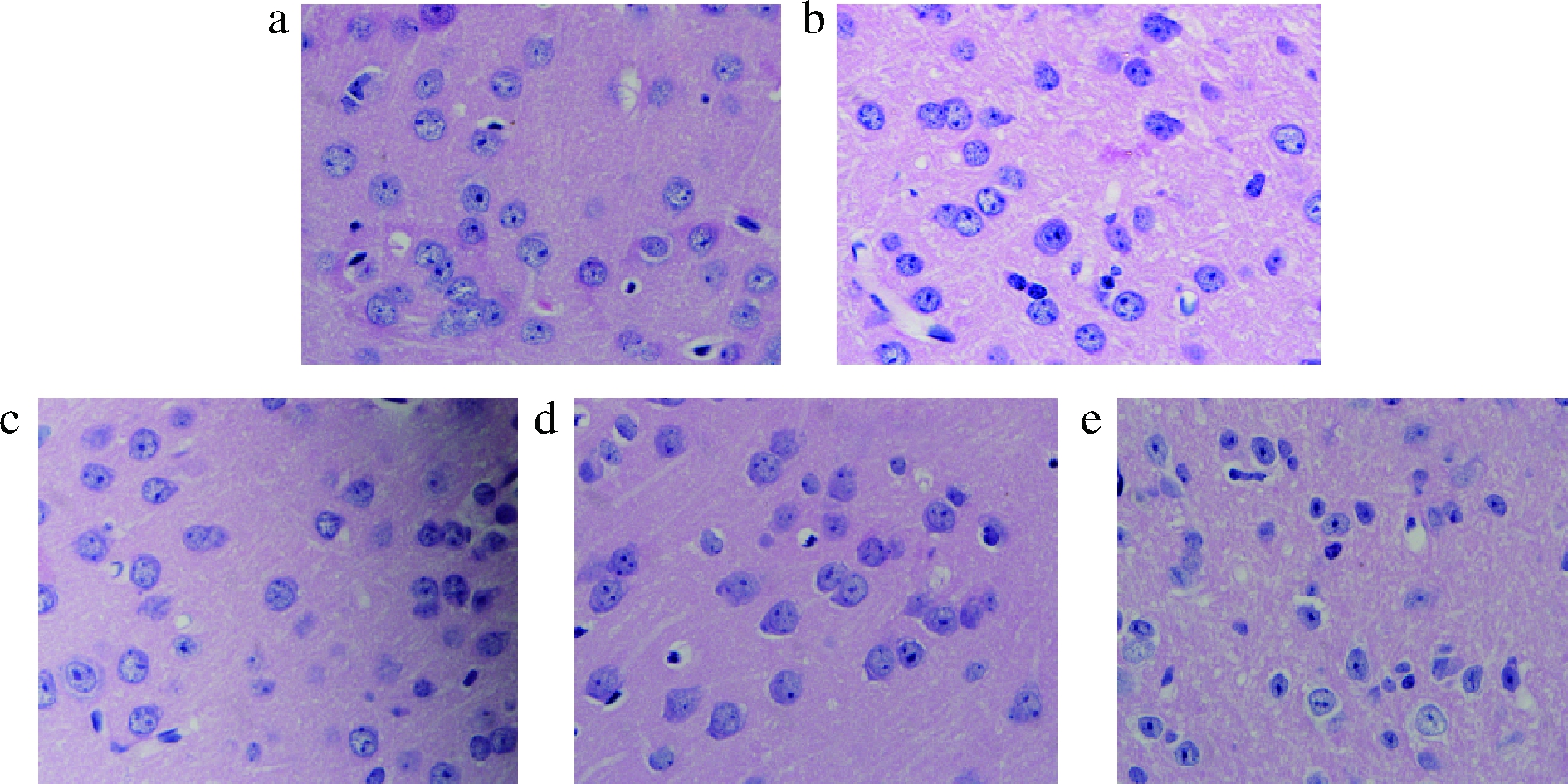
a-食用酒精组;b-安慰剂(生理盐水)组;c-浓香型白酒组;d-酱香型白酒组;e-清香型白酒组
图4 长期灌胃不同香型白酒的小鼠肝细胞HE染色形态学观察
Fig.4 Morphometric analysis of liver cells by HE staining after Baijiu chronic administration in mice
2.5 酒体风味成分分析
长期以来多数人认为,由于酱香白酒中富含丰富的四甲基吡嗪类活性成分可以提高细胞内抗氧化酶活力,降低酒精代谢对肝脏组织的危害[6]。但是本实验结果表明,并非所有酱香白酒长期饮用后都能提高肝脏细胞抗氧化水平,浓香型白酒和清香型白酒也可以增加肝脏抗氧化酶活力。而四甲基吡嗪类物质在浓香型白酒和清香型白酒酒体中少有检测出,推测在白酒中不是四甲基吡嗪类活性成分而是其他微量成分可以综合降低酒精的负性影响。因此,本实验通过定量测定所用酒样的主要风味骨架成分,并结合主成分分析(principal component analysis,PCA)对白酒中可能起主要作用的风味成分进行预测,结果如表1、图5 所示。在本实验所用浓香型白酒中,己酸、丁酸、己酸乙酯和丁酸乙酯起主要作用;在清香型白酒中,乙酸等有机酸、葵酸乙酯、月桂酸乙酯等酯类成分起主要作用;醇类和醛类成分在清香型和浓香型白酒样品中作用并不显著;在酱香型白酒中,酸类、醛类、醇类和大部分酯类成分起主要作用。
表1 白酒样品中主要风味物质含量 单位:mg/L
Table 1 Contents of main flavor compounds in Baijiu samples
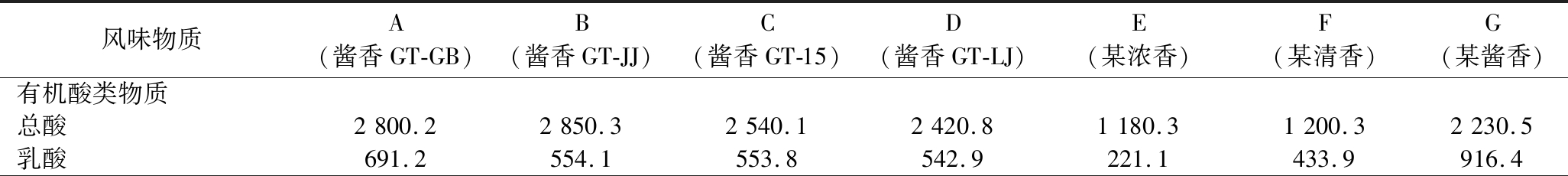
风味物质A(酱香GT-GB)B(酱香GT-JJ)C(酱香GT-15)D(酱香GT-LJ)E(某浓香)F(某清香)G(某酱香)有机酸类物质总酸2800.22850.32540.12420.81180.31200.32230.5乳酸691.2554.1553.8542.9221.1433.9916.4
续表1

风味物质A(酱香GT-GB)B(酱香GT-JJ)C(酱香GT-15)D(酱香GT-LJ)E(某浓香)F(某清香)G(某酱香)乙酸2249.92764.52043.92056.41085.71370.1908.7丙酸60.475.561.294.16.6N.D.48.6甲酸34.78.721.531.816.7N.D.3.5异丁酸4.84.2N.D.N.D.5.5N.D.16.1正丁酸42.347.640.938.7175.1N.D.25.1丙酮酸N.D.N.D.N.D.N.D.4.24N.D.49.3异戊酸N.D.N.D.N.D.N.D.7.55N.D.34.92-乙基丁酸N.D.N.D.N.D.N.D.N.D.N.D.14.5戊酸N.D.N.D.N.D.N.D.18.4N.D.N.D.氯离子N.D.N.D.N.D.N.D.1.656.4N.D.己酸20.1N.D.N.D.N.D.2083.4N.D.N.D.硫酸根63.967.563.553.2N.D.N.D.N.D.高级醇类物质甲醇166.5182.6154.5145.965.6114.0112.2仲丁醇62.390.250.2253.612.31.840.9正丙醇2389.62203.51194.71550.487.4140.31111.8异丁醇162.5164.4147.7146.724.0106.7169.42-戊醇4.08N.D.3.093.23.2N.D.3.8正丁醇126.0104.796.968.390.414.4285.2活性戊醇80.0091.180.583.514.756.294.9异戊醇264.1310.2263.3274.765.0260.7302.4正戊醇8.78.338.086.54.5N.D.4.6正己醇17.815.417.716.229.33.012.12,3-丁二醇(左消旋)53.959.467.890.110.618.0N.D.2,3-丁二醇(内消旋)35.842.235.740.35.26.01N.D.1,2-丙二醇144.1272.3171.1300.18.12.9115.2糠醇N.D.N.D.N.D.N.D.N.D.N.D.17.5β-苯乙醇15.915.315.517.92.14.718.7酯类物质甲酸乙酯53.555.852.642.8819.34.0543.8乙酸乙酯2934.63439.92699.32333.5949.11345.32329.1丁酸乙酯103.398.1107.793.25207.2N.D.47.9异戊酸乙酯8.149.810.411.92.48N.D.16.5乙酸异戊酯4.72.8N.D.2.20N.D.N.D.2.6戊酸乙酯18.820.818.217.929.1N.D.6.6己酸乙酯62.945.355.4059.81527.24.5623.4庚酸乙酯2.62.13.53.0012.61N.D.N.D.乳酸乙酯1293.51580.91090.21221.8500.31003.91336.5辛酸乙酯8.1610.31.64.1011.11.73.9己酸异戊酯N.D.N.D.1.4N.D.N.D.N.D.1.3癸酸乙酯N.D.N.D.N.D.N.D.N.D.1.5N.D.丁二酸二乙酯3.812.65.14.5N.D.9.9N.D.月桂酸乙酯3.064.13.33.7N.D.41.73.4十四酸乙酯1.022.2N.D.2.9N.D.N.D.N.D.棕榈酸乙酯30.733.730.434.8N.D.N.D.19.1油酸乙酯12.316.613.016.7N.D.N.D.12.2亚油酸乙酯17.922.721.325.4N.D.N.D.20.9醛类物质乙醛479.9593.8476.1529.7197.8179.717.5丙醛6.28.16.16.4N.D.N.D.461.1异丁醛17.716.713.210.03.0N.D.4.5乙缩醛332.0371.2342.6336.7112.8118.512.4异戊醛78.267.370.160.513.213.7305.2糠醛326.6262.6309.1285.113.11.670.5苯甲醛3.03.61.924.5N.D.N.D.36.3
注:N.D.表示未检出
酸在酱香白酒中有呈香和呈味的双重功效,同时又能起到调味解暴的作用,还是生成酯类的前驱物质,是酱香型白酒不可缺少的微量物质。有研究表明,白酒中乙酸、庚酸、辛酸等有机酸可以抑制胆固醇的合成,乳酸可以抑制吲哚、酚等有害物质生成,有效防止细胞老化,有一定的杀菌作用,酒石酸具有一定的消炎抗病毒的作用,亚麻酸等人体所必须的脂肪酸具有加快新陈代谢与兴奋中枢神经的作用,可以预防氧化应激、增加抗氧化能力[6]。近几年有研究人员利用小鼠模型探究白酒关键微量成分对醉度的影响,发现乙酸可以起到减弱白酒的醉酒度,而多元醇类成分可以增加白酒醉酒度[15]。本实验结果发现,酱香白酒总酸含量均高于浓香样品和清香样品,酱香GT的4个样品总酸含量高于另一个对照酱香型白酒样品,具体体现在乙酸、丙酸、甲酸、正丁酸、己酸和硫酸根离子的含量上,但是正丙醇、乙醛乙酯和主要醛类物质含量均高于对照酱香型白酒样品,推测有机酸成分可以缓解白酒中酒精、杂醇等醛类物质的负性影响。后期可重点探讨白酒中有机酸成分对降低酒精负性影响的协同增效机制。

a-醇类;b-醛类;c-酸类;d-酯类
图5 白酒样品中四类骨架风味成分PCA
Fig.5 Projection plot of principal component analysis of the main flavor in Baijiu
3 结论与讨论
在饮酒数分钟内,纯食用酒精(乙醇)即可通过胃肠吸收进入肝脏,使肝细胞受损,饮酒量越大,对肝脏的损伤越大。长期大量饮酒的负性作用较为显著,能使肝脏中过氧化物明显升高,而抗氧化物质SOD、GSH活性下降,内源性抗氧化能力减弱,清除自由基的能力下降,肝细胞膜发生脂质过氧化反应增强,从而导致酒精性肝损伤的发生。
与国外蒸馏酒相比,中国白酒传统酿造工艺采集了窖池、多粮、环境多维微生物、固态发酵、固态蒸馏、后期贮存等一系列策略,形成了具有丰富风味微量成分、风格饱满、气味和谐统一的酒体。酱香型白酒因为具有高温制曲、高温堆积、高温发酵、高温馏酒、生产周期长的特点,所以其风味构成庞杂丰富[16]。关于饮用酱香型白酒健康功效的研究在国内外期刊上多有报道[17],而且大部分研究对象都是茅台酒,但是中国酱香型白酒不光是茅台一支独秀。另外,关于中国各香型白酒的对于酒精性肝损伤的对比研究结果也不尽相同。特别值得一提的是,酒类生产企业不切实际的夸大了吡嗪类等含量极低的生物活性成分在白酒中的健康作用,不但误导消费者对于白酒的非理性消费,而且在酒体设计和品质提升上刻意强调了提升某一类功能性健康成分的工艺改进措施,反而忽视了对于醇醛酸酯这几大类主要微量骨架风味成分的平衡优化作用。
本实验通过小鼠慢性酒精性肝损伤模型研究,首次系统分析了长期灌胃酱香型白酒、浓香型白酒和清香型白酒的一些产品以及食用酒精(伏特加)对酒精性肝损伤的影响程度。研究结果表明,相对于纯食用酒精(伏特加),中国白酒无论是酱香型白酒、浓香型白酒和清香型白酒,长期灌胃小鼠后,均可以在一定程度上增加小鼠肝脏抗氧化酶活力,减弱由氧自由基堆积引起的脂质过氧化反应,降低酒精对肝脏的损害作用。在有机酸含量和种类水平上具有相对优势的酱香型白酒,肝脏产生的抗氧化物质SOD、GSH含量上升,而脂质过氧化的重要终产物MDA含量较低,推测酱香型白酒中通过自然发酵形成的较高含量的有机酸成分可以通过协同增效机制有效缓解酒精性肝病发生。本实验研究结果可为酱香型白酒消费者端品质表达以及高舒适度的酒体设计提供了基础研究数据。
[1] 许亚男,卿笃信.酒精性肝病线粒体损伤分子机制的研究进展[J].国际消化病杂志,2013,33(1):17-20.
XU Y N,QING D X.Molecular mechanism of mitochondrial injury in alcoholic liver disease[J].International Journal of Digestive Diseases,2013,33(1):17-20.
[2] WANG M Y,YANG J G,ZHAO Q S,et al.Research progress on flavor compounds and microorganisms of Maotai Flavor Baijiu[J].Journal of Food Science,2019,84(1):6-18.
[3] 陈蕊,叶正茂,鲁蕾,等.不同品质食用白酒致大鼠肝脏损伤差异分析[J].现代预防医学,2014,41(9):1 667-1 670.
CHEN R,YE Z M,LU L,et al.Comparison on the impairments of different kinds of Luzhou-flavor liquor on rats′ liver[J].Modern Preventive Medicine,2014,41(9):1 667-1 670.
[4] 王川南,吴天祥,雷露.不同年份酱香型白酒对小鼠抗疲劳及肝损伤试验的研究[J].酿酒科技,2019(10):36-40.
WANG C N,WU T X,LEI L.Experimental study of the anti-fatigue effects and liver injury in mice with intragastric feeding of jiangxiang Baijiu of different ages[J].Liquor-Making Science &Technology,2019(10):36-40.
[5] 赵雪珂,程明亮,张权,等.短期饮用某酱香型白酒对大鼠乙醇代谢的影响[J].广东医学,2013,34(24):3 695-3 700.
ZHAO X K,CHENG M L,ZHANG Q,et al.Effects of short term drinking Maotai-flavor liquor on the ethanol metabolism in rats[J].Guangdong Medical Journal,2013,34(24):3 695-3 700.
[6] 罗强,刘杰,刘志刚.酱香型白酒中活性成分的抗氧化活性[J].食品与发酵工业,2019,45(23):84-89.
LUO Q,LIU J,LIU Z G.Antioxidant activity of active components in Maotai-flavor liquor[J].Food and Fermentation Industries,2019,45(23):84-89.
[7] 孟巍,余良主,王利.大鼠酒精性肝损伤模型的建立[J].海南医学院学报,2012,18(10):1 364-1 367;1 371.
MENG W,YU L Z,WANG L.Establishment of alcohol-induced liver injury model in rats[J].Journal of Hainan Medical University,2012,18(10):1 364-1 367;1 371.
[8] ZAKHARI S.Overview:How is alcohol metabolized by the body?[J].Alcohol Research &Health.2006,29(4):245-254.
[9] CEDERBAUM A I,LU Y K,WU D F.Role of oxidative stress in alcohol-induced liver injury[J].Archives of Toxicology,2009,83(6):519-548.
[10] UCHIDA D,TAKAKI A,OYAMA A,et al.Oxidative stress management in chronic liver diseases and hepatocellular carcinoma[J].Nutrients,2020,12(6):1576.
[11] 石亚林,范文来,徐岩.白酒抗氧化性的初步研究[J].食品工业科技,2015,36(2):95-97;101.
SHI Y L,FAN W L,XU Y.Preliminary study on antioxidant activity of Chinese liquor[J].Science and Technology of Food Industry,2015,36(2):95-97;101.
[12] 张明珠,吴学凤,穆冬冬,等.不同香型白酒的风味物质及抗氧化作用分析[J].食品工业科技,2021,42(11):218-225.
ZHANG M Z,WU X F,MU D D,et al.Analysis of flavoring substances and antioxidant characteristics of different flavor Baijiu[J].Science and Technology of Food Industry,2021,42(11):218-225.
[13] KO OTA A,G
OTA A,G ABSKA D,OCZKOWSKI M,et al.Oxidative stress parameters in the liver of growing male rats receiving various alcoholic beverages[J].Nutrients,2020,12(1):158.
ABSKA D,OCZKOWSKI M,et al.Oxidative stress parameters in the liver of growing male rats receiving various alcoholic beverages[J].Nutrients,2020,12(1):158.
[14] GALICIA-MORENO M,ROSIQUE-ORAMAS D,MEDINA-AVILA Z,et al.Behavior of oxidative stress markers in alcoholic liver cirrhosis patients[J].Oxidative Medicine and Cellular Longevity,2016,2016:9370565.
[15] 谢佳,彭斌,何松贵,等.白酒关键微量成分对醉度及小鼠乙醇代谢和急性酒精性肝损伤的影响[J].中国酿造,2018,37(6):155-160.
XIE J,PENG B,HE S G,et al.Effects of key microconstituents of Baijiu on intoxicating degree,alcohol metabolism and alcohol-induced acute liver injury in mice[J].China Brewing,2018,37(6):155-160.
[16] WANG W H,XU Y Q,HUANG H Q,et al.Correlation between microbial communities and flavor compounds during the fifth and sixth rounds of sauce-flavor Baijiu fermentation[J].Food Research International,2021,12(150):110741.
[17] ZHOU W,CHEN Z Y,BAO H,et al.Systematic analysis of the pharmacological effects of alcoholic components in Maotai[J].Journal of Food Science,2019,84(7):1 949-1 956.