酸蚀症是指酸雾或酸酐作用于牙齿而造成的牙体硬组织的丧失,不涉及微生物[1]。年轻恒牙牙体硬组织矿化程度较成熟恒牙釉质低,萌出约2年才能进一步矿化,因此在牙齿新萌出2年内易发生脱矿[2]。在中国北京的179名年轻人中发现的患病率为46%[3]。有研究得出结论,酸蚀症可能影响全球约35%的青少年恒牙[4]。临床研究发现碳酸饮料,尤其是碳酸可乐饮料与酸蚀症的发生相关。几项体外研究通过使用不同的参数评估了可乐的脱矿潜力,如pH和缓冲能力、产品与牙齿表面的黏附性、钙、磷酸盐和氟化物浓度、牙齿脱矿和磨损;均表明可乐具有较强的脱矿能力[5-8]。特殊饮食,特别是富含水果和其他酸性食物的饮食,会增加牙齿侵蚀的风险[9]。一个国家内的不同地区在饮食和口味上有不同的偏好,其习俗和行为也不同,所有这些因素都会导致酸蚀症发生率的变化[9]。新疆地处中国西北,作为古丝绸之路上的重要一站,独特的地理位置及人文环境[10],使得新疆沙棘汁在当地颇受欢迎,考虑到儿童及青少年是新疆沙棘汁的主要消费者,为了研究沙棘汁对釉质的影响,进一步探讨沙棘汁与酸蚀症之间的关系,本实验通过在体外将新疆沙棘汁与已知的碳酸饮料(可乐)进行比较,探讨其脱矿能力,有利于优化饮食结构,为预防酸蚀症的发生提供理论基础。
1 材料与方法
1.1 材料、试剂和仪器
收集新鲜拔除的牛上颌切牙30颗(同龄牛),保存在0.1%(质量分数)百里香酚溶液中,置于4 ℃冰箱内保存备用。
主要试剂和仪器:0.1%(质量分数)麝香草酚、去离子水、钙磷离子检测试剂盒,上海碧云天生物技术有限公司;人造唾液(去离子水、NaCl、KCL、Na2SO4、NH4Cl、CaCl2·2H2O、NaH2PO4·2H2O、CN2H4O、NaF)(货号:A7990),北京索莱宝科技有限公司;显微硬度仪,Zwick(中国)有限公司;激光共聚焦,徕卡测量仪器(中国)有限公司;扫描电子显微镜,日本电子株式会社。选取市售可口可乐,中粮可口可乐饮料新疆有限公司;新疆沙棘汁(新疆惠华沙棘生物科技有限公司)作为实验溶液,均购于当地超市。
1.2 样本制备
流水下用低速打磨机以相同方向将牛切牙的牙冠制备成5 mm×5 mm×2 mm大小釉质块,在蒸馏水中,依次用800、1 200、2 400目的碳化硅砂纸磨平抛光釉质面,使用超声清洗机荡洗8 min。牙釉质面4 mm×4 mm作为暴露中心,其余部分涂布双层抗酸指甲油覆盖。去离子水冲洗后存于0.1%(质量分数)溴麝香草酚溶液中备用。
1.3 分组及处理
根据处理溶液的不同分为可乐组、沙棘汁组、去离子水组,每组10个样本。处理步骤如下所示:(1)将样本放入15 mL离心管,加入处理溶液(10 mL/样本)进行脱矿90 s,每天4次(时间为10∶00、12∶00、14∶00、16∶00),脱矿14 d,脱矿过程中样本置于恒温箱中(维持37 ℃以模拟口腔环境);(2)去离子水冲洗5 s后,其余时间浸入人工唾液(pH 6.8,10 mL/样本)进行再矿化,不搅拌(模拟口腔静息状态时),样品在人工唾液中放置过夜,完成24 h的循环。每天更换1次处理溶液及人工唾液。
1.4 表面硬度测量
使用显微维氏硬度仪测量样本的硬度。在每个样本釉质面开窗面测量5个点。在饮料脱矿前、脱矿7 d及脱矿后的14 d使用同样的方法测定其硬度值。
1.5 pH值及钙磷离子溶出量测定
实验溶液均在常温下开瓶,取10 mL使用pH计测量各实验溶液的pH值,重复测量3次,取平均值。在脱矿第14天,应用磷钼酸法检测处理溶液中的磷离子浓度,邻甲酚肽络合铜法检测钙离子浓度。各取200 μL处理溶液放入96孔板中,每组重复3次,依据标准溶液浓度计算磷钙离子浓度。
1.6 扫描电镜观察
脱矿前和脱矿后每组随机各选取2个样本,以2.5%(体积分数)戊二醛固定1 h,用50%、70%、80%、90%及100%(体积分数)叔丁醇依次进行梯度脱水,每种浓度脱水15 min,随后扫描电镜下观察样本实验区釉质表面形态。
1.7 激光共聚焦观察
随机选取处理后的样本,制备3~5片300 μm薄片,每组1个,用罗丹明B溶液避光下放入37 ℃恒温培养箱染色48 h,观察脱矿区荧光渗入情况,分析釉质荧光面积(area of the fluorescent lesion,A)、所测区域总荧光量(total fluorescent,TF)、所测区域平均荧光量(average fluorescent of the lesion,AF)数值。
1.8 统计学处理
采用SPSS 26.0软件及Image-Pro plus 6.0对所得数据进行统计学分析,计量资料以均数±标准差![]() 表示。符合正态分布的各组数据进行方差齐性检验,若方差齐选用最小显著差别(least significant difference,LSD)双侧检验;若方差不齐,则行Kruskal-Wallis秩和检验,检验水准α=0.05。
表示。符合正态分布的各组数据进行方差齐性检验,若方差齐选用最小显著差别(least significant difference,LSD)双侧检验;若方差不齐,则行Kruskal-Wallis秩和检验,检验水准α=0.05。
2 结果与分析
2.1 样本表面颜色变化
可乐组和沙棘汁组样本表面失去光泽,见色素沉着,可乐组牙面变为深棕色,从开窗面积中心到周边,颜色逐渐变深;沙棘汁组牙面为棕褐色,在开窗面积中,颜色分布均匀。在去离子水组观察到牙面变为白垩色。
2.2 表面显微硬度
如图1所示,样本初始硬度值和各组间初始显微硬度值无统计学差异;脱矿第7天,去离子水组釉质块硬度大于可乐组,二者均大于新疆沙棘汁组,组间比较均具有统计学差异;在脱矿第14天,去离子水组硬度值远大于可乐组和新疆沙棘汁组,组间比较差异具有统计学意义。
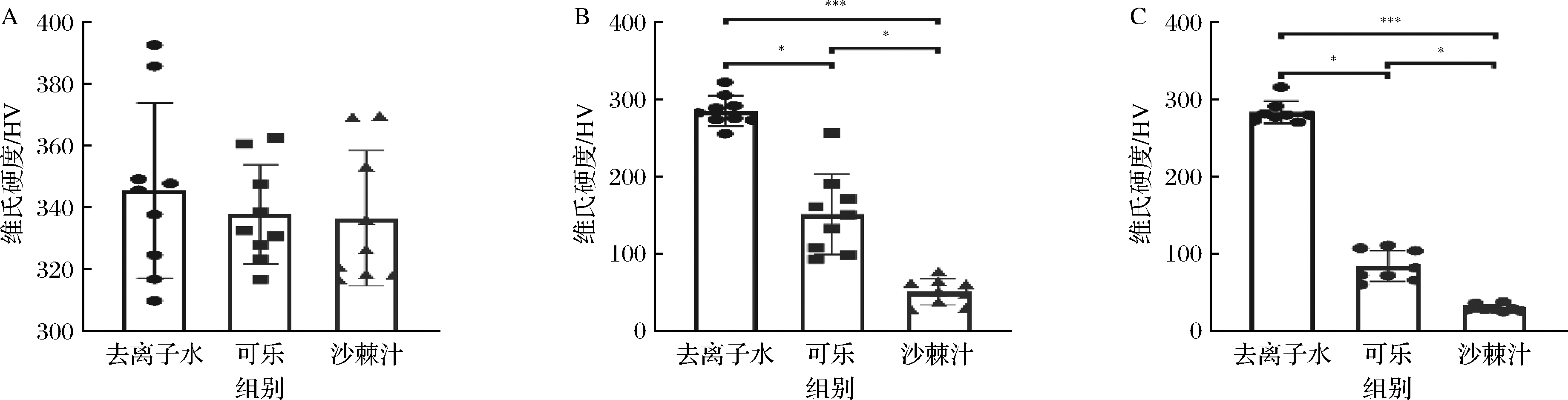
A-初始硬度值;B-第7天硬度值;C-第14天硬度值
图1 各组样本表面显微维氏硬度值
Fig.1 T Vickers hardness value of surface of samples in each group
注:*表示P<0.05,**表示P<0.01,***表示P<0.001(下同)
2.3 三种饮料pH值及钙、磷离子浓度情况
如表1所示,沙棘组中钙离子浓度大于可乐组,二者均大于去离子水组,差异均具有统计学意义(P<0.05);可乐组中磷离子浓度大于新疆沙棘汁组,二者均大于去离子水组,差异均具有统计学意义(P<0.05)。
表1 三种饮料pH值及钙、磷离子浓度情况![]()
Table 1 pH Value and concentration of calcium and phosphorus ions in three beverages
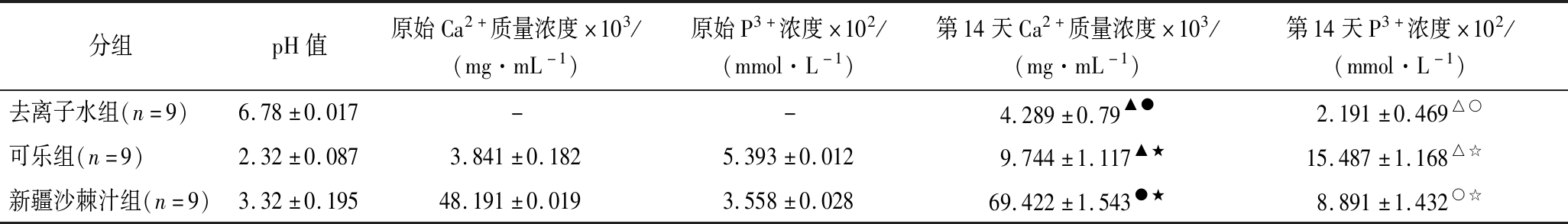
分组pH值原始Ca2+质量浓度×103/(mg·mL-1)原始P3+浓度×102/(mmol·L-1)第14天Ca2+质量浓度×103/(mg·mL-1)第14天P3+浓度×102/(mmol·L-1)去离子水组(n=9) 6.78±0.017--4.289±0.79▲●2.191±0.469△○可乐组(n=9) 2.32±0.0873.841±0.1825.393±0.0129.744±1.117▲★15.487±1.168△☆新疆沙棘汁组(n=9)3.32±0.19548.191±0.0193.558±0.02869.422±1.543●★8.891±1.432○☆
注:-表示无;▲●★表示钙离子浓度组间比较具有统计学差异;△○☆表示磷离子浓度组间比较具有统计学差异。▲△代表去离子水组与可乐组间比较,且P<0.01;●○代表去离子水与沙棘汁组比较,且P<0.01;★☆表示可乐组与沙棘汁组比较,且P<0.01
2.4 扫描电镜观察结果
可乐组釉质表面见较密集的小凹陷,部分区域连接成片,6 000倍下观察到釉柱不均匀断裂;去离子水组样本其表面结构未发现明显凹陷,仅见零星小凹陷;新疆沙棘汁组釉质呈蜂窝状结构,表面凹陷面积连接成片(图2)。

A、B-去离子水组;C、D-可乐组;E、F-新疆沙棘汁组
图2 各组样本扫描电镜图像
Fig.2 Scanning electron microscope images of samples in each group
注:A、C、E为3 000倍下图像;B、D、F为6 000倍下图像
2.5 激光共聚焦
由表2可知,新疆沙棘汁组A、TF、AF值最大,3组间比较中,新疆沙棘汁组与去离子水组和可乐组的AF值差异具有统计学意义(P<0.01);且新疆沙棘汁组荧光染料渗透深度连续均匀;可乐组荧光染料不连续,去离子水组中仅见到轻微荧光染料渗入(图3);表明新疆沙棘汁脱矿深度强于可乐组及去离子水组。
表2 各组样本激光共聚焦参数结果
Table 2 Confocal laser scanning microscope parameter results for each group of samples

分组A×103/μm2TF×104AF去离子水组0.88±0.29△0.26±0.07△3.03±1.01▲●可乐组2.56±0.614.40±0.1117.80±4.04▲★沙棘汁组12.10±0.83△52.03±0.40△43.17±2.84▲●
注:▲●★表示方差齐,选用LSD双侧检验;△○☆表示方差不齐,选用Kruskal-Wallis秩和检验;▲△代表去离子水组与可乐组间比较,且P<0.01;●○代表去离子水与沙棘汁组比较,且P<0.01;★☆表示可乐组与沙棘汁组比较,且P<0.01
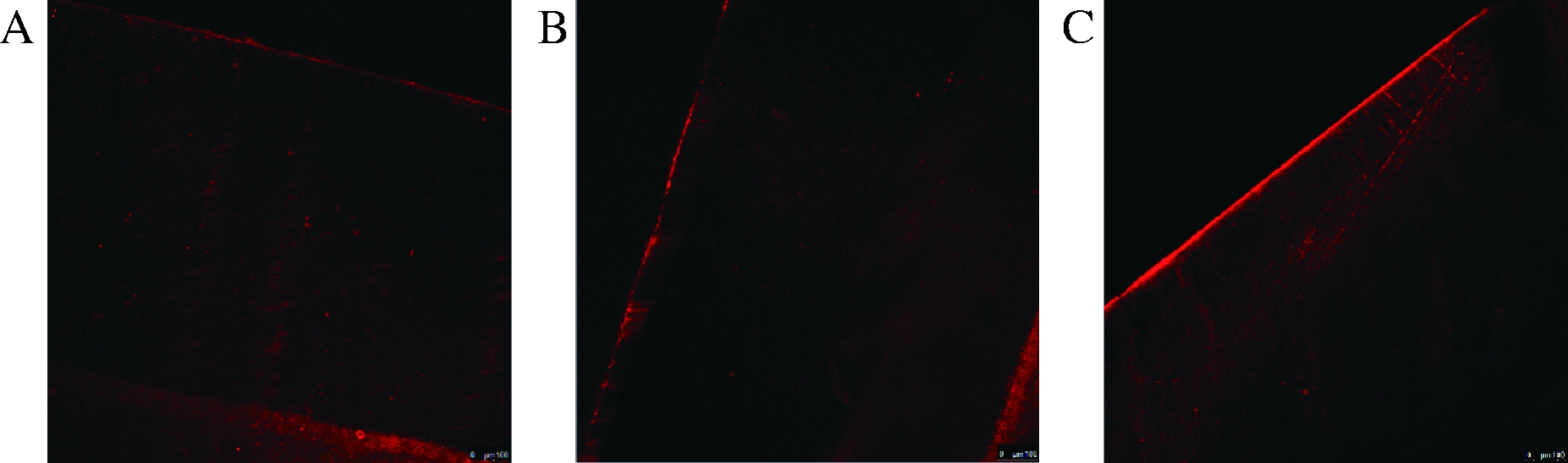
A-去离子水组;B-可乐组;C-新疆沙棘汁组
图3 各组溶液处理后样本的激光共聚焦图像
Fig.3 Confocal laser images of samples after treatment with each group of solutions
注:A、B、C均为100倍下图像
3 结论与讨论
楚金普等[11]通过实验证实与人牙具有相似化学组成的牛牙很适合代替人牙来检测脱矿和再矿化的效果,因此本体外研究以牛牙釉质为基质,研究了市售可乐、去离子水和新疆沙棘汁对牙釉质表面的影响。从硬度、钙磷离子溶出量、釉质表面结构及脱矿深度方面评价了可乐、去离子水和新疆沙棘汁对釉质表面的脱矿影响。
关于表面显微硬度变化,观察到随处理时间的增加,各组釉质块显微硬度值均降低,所有测试饮料均具有脱矿能力,其中新疆沙棘汁组硬度值变化最大,数值最低,其次为可乐组。前7 d观察到最强脱矿效果,在后7 d中的硬度值变化小于前7 d,可以确定釉质硬度值的降低与脱矿时间呈正相关,脱矿速率由快到慢,持续脱矿。此外,3组釉质的表面显微硬度损失均增加。此外,口腔环境复杂,微生物多样,实验所用人工唾液并不能完全模拟口腔微生态环境,人工唾液再矿化效果并不明显,因此观察到去离子水组具有一定程度的脱矿能力,后期应设计更为精细的体内实验进一步验证。
新疆沙棘汁组钙离子溶出量大于可乐组、去离子水组,而可乐组磷离子溶出量大于新疆沙棘汁组、去离子水组。饮料的酸蚀能力不仅受其摄入频率和持续时间的影响,还受到酸类型的影响[12]。可乐成分中有碳酸、磷酸、柠檬酸等,主要为碳酸,其次为磷酸。新疆沙棘汁中主要有机酸成分是草酸、苹果酸、抗坏血酸及柠檬酸,苹果酸占多数[13]。研究证实苹果酸脱矿能力大于碳酸[14],这一现象与唾液中碳酸酐酶VI(carbonic anhydrase VI,CA VI)的作用有关,CA VI是一种锌金属酶,可调节唾液环境中的pH稳态,在CO2+H2O←→![]() 过程中催化CO2的可逆水合。因此,可乐中碳酸的脱矿作用得到CA VI的调节,但在中强酸磷酸的作用下,同样观察到可乐组样本较强的釉质脱矿。这也可以解释沙棘汁组脱矿能力虽强于可乐组,但可乐组中磷离子溶出量大于沙棘汁组的现象。此外,钙和磷酸盐,以及碱性或中性环境是再矿化的先决条件。人工唾液中的钙和磷酸盐水平影响釉质中矿物质的溶解速率。实验发现沙棘汁组钙离子溶出量明显大于可乐组,进一步证实沙棘汁组釉质脱矿程度大于可乐组。研究表明,当pH值降低时,羟基磷灰石在牙釉质和牙本质中的溶解度均增加[15],但这并不是脱矿导致矿物溶解的唯一因素,酸蚀性饮料引起的脱矿还涉及饮料中可滴定酸的量、酸的缓冲能力,还应考虑未解离的有机酸[16]。因此,尽管可乐组pH值略低于沙棘汁组,但沙棘汁组脱矿能力强于可乐组。
过程中催化CO2的可逆水合。因此,可乐中碳酸的脱矿作用得到CA VI的调节,但在中强酸磷酸的作用下,同样观察到可乐组样本较强的釉质脱矿。这也可以解释沙棘汁组脱矿能力虽强于可乐组,但可乐组中磷离子溶出量大于沙棘汁组的现象。此外,钙和磷酸盐,以及碱性或中性环境是再矿化的先决条件。人工唾液中的钙和磷酸盐水平影响釉质中矿物质的溶解速率。实验发现沙棘汁组钙离子溶出量明显大于可乐组,进一步证实沙棘汁组釉质脱矿程度大于可乐组。研究表明,当pH值降低时,羟基磷灰石在牙釉质和牙本质中的溶解度均增加[15],但这并不是脱矿导致矿物溶解的唯一因素,酸蚀性饮料引起的脱矿还涉及饮料中可滴定酸的量、酸的缓冲能力,还应考虑未解离的有机酸[16]。因此,尽管可乐组pH值略低于沙棘汁组,但沙棘汁组脱矿能力强于可乐组。
釉质脱矿涉及棱镜核prism core(I型脱矿)或棱镜鞘prisms(Ⅱ型脱矿),也可以表现出2种类型的脱矿(Ⅲ型脱矿)[17]。最常见的被称为Ⅰ型脱矿,棱镜核心材料被优先去除,留下棱镜外围相对完整。在Ⅱ型脱矿中,棱镜的外围区域被优先去除,留下棱镜的核心部分相对不受影响。在Ⅲ型脱矿中,其中一些区域与Ⅰ型脱矿和Ⅱ型脱矿相对应,同时还有一些区域的蚀刻模式不能与棱镜形态相关[18]。釉柱的方向似乎决定了发生的脱矿模式[18]。扫描电镜分析显示新疆沙棘汁组表面出现明显的变化,表面釉柱断裂,孔隙率大于可乐组及去离子水组;在脱矿最深区域,观察到釉质表面呈锯齿状结构,部分区域形似火山口,大小不等、形状不同且部分连接成片,很难分辨正常釉质与受累釉质之间的边界;图2-E、图2-F可以看出沙棘汁组为Ⅱ型脱矿。相同处理时间下,可乐组表面观察到在脱矿累及处釉柱断裂,部分区域呈蜂窝状结构,部分连接成片,能分清正常釉质与受累釉质间的边界,图2-C、图2-D中看出可乐组为Ⅲ型脱矿。去离子水组仅见小面积釉柱断裂。合理推测,沙棘汁组脱矿程度强于可乐组,或许与饮料脱矿类型及牙齿表面存在无定形无棱柱釉质所致。
进行激光共聚焦测量的目的是评估荧光染料渗入釉质的能力,进一步评估不同实验溶液的脱矿能力。表2可以看出新疆沙棘汁组A、TF、AF值最大,3组间比较中,AF差异具有统计学意义(P<0.01)。新疆沙棘汁引起的釉质表面发生变化,除了与沙棘汁中酸的类型、可滴定酸含量的不同、缓冲能力有关外;还涉及到新疆沙棘汁的提取工艺,新疆沙棘汁的提纯工艺有限[19],在将沙棘果转为沙棘汁的过程中,植物纤维与果汁未完全分离,沙棘果汁中存在较多植物纤维,比起市售其他果汁,新疆沙棘汁更浓稠,更易黏附在样本表面,进一步造成牙齿的脱矿。值得注意的是,去离子水组观察到釉质表面硬度降低,溶液中钙磷离子浓度升高,且差异具有统计学意义;但从扫描电镜下观察,其表面结构未发现明显凹陷,仅见零星小凹陷。结果与AMORAS等[20]和REDDY等[21]所得结果一致。REDDY等[21]调查了379种市售软饮料的酸蚀潜力,确定39%具有极强酸蚀性能(pH<3),54%具有酸蚀性(pH=3~3.99),仅7%确定为轻微酸蚀性(pH≥4);普通起泡矿泉水即使其可滴定酸度较低,也具有较低的脱矿能力。众所周知,唾液的作用可显着减少因酸蚀而造成的牙齿结构损失,由于获得性薄膜、动态唾液流动和细菌以及温度变化的存在,在体外研究中复制口腔状况存在一些困难。尽管这项体外研究存在局限性,但提示在以后的研究中需要考虑温度控制、唾液流量、搅拌等因素。
综上所述,本实验中3种实验溶液均具有不同程度脱矿,暴露于实验溶液的时间越长,脱矿愈严重。新疆沙棘汁会造成严重的牙釉质脱矿,新疆沙棘汁脱矿能力强于可乐,且去离子水也存在脱矿。这提示需要对家长进行指导,为孩子提供不含过多酸性产物的饮食,有助于进一步优化饮食结构,研究结果为酸蚀症的早期诊断和预防提供了实验基础及理论依据。
[1] PRATIWI A N.Prevalence and risk factors of tooth erosion in children[J].Journal of Medical Sciences,2017,17(2):53-60.
[2] TAJI S,SEOW W.A literature review of dental erosion in children[J].British Dental Journal,2010,55(4):358-367.
[3] CHU C H,PANG K K L,LO E C M.Dietary behavior and knowledge of dental erosion among Chinese adults[J].BMC Oral Health,2010,10:13.
[4] SMALES R,KAIDONIS J.Definitions,Appearance,Prevalence and Aetiology[M].Panama:Jaypee Brothers Medical Paublishers P Ltd,2006:1-10.
[5] C NDIDO M,SILVEIRA J M,MATA A,et al.In vitro study of the demineralization induced in human enamel by an acidic beverage using X-ray fluorescence spectroscopy and Raman microscopy[J].X-Ray Spectrometry,2019,48:61-69.
NDIDO M,SILVEIRA J M,MATA A,et al.In vitro study of the demineralization induced in human enamel by an acidic beverage using X-ray fluorescence spectroscopy and Raman microscopy[J].X-Ray Spectrometry,2019,48:61-69.
[6] AHMED Y T,ALABBAD A,ALMOMIN L,et al.Assessment of enamel demineralization after exposure to sugar free vs.regular soft drinks:An in vitro study[J].Journal of Applied Dental and Medical Sciences,2019,5(4):1-7.
[7] MURTHY S P K S,LEELAVATHI L.Comparison of Coca cola and diet Coca cola on the surface enamel roughness[J].Indian Journal of Public Health Research &Development,2019,10(11):3 653-3 657.
[8] RIOS D,IONTA F Q,REBELATO R,et al.The effect of aspartame and pH changes on the erosive potential of Cola drinks in bovine enamel:An in vitro study[J].Journal of Clinical and Experimental Dentistry,2018,10(9):e933-e937.
[9] SCHLUETER N,LUKA B.Erosive tooth wear-a review on global prevalence and on its prevalence in risk groups[J].British Dental Journal,2018,224(5):364-370.
[10] DONG G H,WANG L B,ZHANG D D,et al.Climate-driven desertification and its implications for the ancient Silk Road trade[J].Climate of the Past,2021,17(3):1 395-1 407.
[11] 楚金普,郝玉庆,李继遥,等.两种脱矿体系制备人工龋损的病理学比较[J].中国比较医学杂志,2008,18(1):23-26.
CHU J P,HAO Y Q,LI J Y,et al.Pathological comparison of two type of demineralization solutions on the production of initial artificial enamel carious lesion[J].Chinese Journal of Comparative Medicine,2008,18(1):23-26.
[12] CARVALHO J C,SCARAMUCCI T,AIMÉE N R,et al.Early diagnosis and daily practice management of erosive tooth wear lesions[J].British Dental Journal,2018,224(5):311-318.
[13] DONG K,BINOSHA FERNANDO M A D W,DURHAM R,et al.Nutritional value,health-promoting benefits and food application of sea buckthorn[J].Food Reviews International,2021.DOI:10.1080/87559129.2021.1943429
[14] HANNIG C,HAMKENS A,BECKER K,et al.Erosive effects of different acids on bovine enamel:Release of calcium and phosphate in vitro[J].Archives of Oral Biology,2005,50(6):541-552.
[15] KALBARCZYK M,![]() A.Potential biomedical application of calcium phosphates obtained using eggshells as a biosource of calcium at different initial pH values[J].Ceramics International,2021,47(23):33 687-33 696.
A.Potential biomedical application of calcium phosphates obtained using eggshells as a biosource of calcium at different initial pH values[J].Ceramics International,2021,47(23):33 687-33 696.
[16] PARKAR S M,THAKKAR K,SHARMA A.Comparison of the erosive potential of commercially available beverages on human enamel:An in vitro study[J].Pesquisa Brasileira em Odontopediatria e Clínica Integrada,2018,18(1):1-10.
[17] TITLEY K C,TORNECK C D,SMITH D C,et al.Scanning electron microscopy observations on the penetration and structure of resin tags in bleached and unbleached bovine enamel[J].Journal of Endodontics,1991,17(2):72-75.
[18] CATE A T.Oral Histology:Development,Structure,and Function[M].Saint Louis:Mosby,2007:358-369.
[19] YU O Y,MEI M L,ZHAO I S,et al.Effects of fluoride on two chemical models of enamel demineralization[J].Materials(Basel Switzerland),2017,10(11):1245.
[20] AMORAS D R,CORONA S A M,RODRIGUES Jr A L,et al.Effect of beverages on bovine dental enamel subjected to erosive challenge with hydrochloric acid[J].Brazilian Dental Journal,2012,23(4):367-372.
[21] REDDY A,NORRIS D F,MOMENI S S,et al.The pH of beverages in the United States[J].The Journal of the American Dental Association,2016,147(4):255-263.