烟酰胺单核苷酸(nicotinamide mononucleotide,NMN)是人体内一种内源性物质,它参与细胞内烟酰胺腺嘌呤二核苷酸[(nicotinamide adenine dinucleotide,NAD+),细胞能量转化的重要辅酶]的合成[1],研究[2]发现人体的衰老过程伴随着体内NAD+含量的减少,作为人体NAD+合成的有效补救途径,服用NMN可以延缓细胞衰老的过程、从而实现抗衰老的效果。NMN作为新一代的抗衰老因子[3],市场上相继出现了相关的保健品、化妆品和加工食品等,其工业合成和产品开发过程中对于原料中NMN含量和杂质控制要求严格,在未来的实际生产中,一种高效的NMN含量检测方法对其质量控制具有重要意义。目前NMN的检测方法主要有定量核磁共振法[3]和液质联用法[4],但食品样品的基质与组成相当的复杂,在液质实际分析中存在很严重的基质效应[5-6],改善前处理方法纯化样品是最有效、最彻底消除基质效应的方法[7]。
固相萃取(solid-phase extraction,SPE)是目前最常用的样品前处理方法之一[8],但常规的固相萃取吸附剂主要依靠非特异性作用力吸附目标物,对复杂样品很难进行净化和富集。近年来,分子印迹聚合物(molecularly imprinted polymers,MIPs)因其预定性、实用性以及识别性等优点[9-13]而被广泛地应用到固相萃取领域[14-18]。以MIPs作为固相萃取的填料,制备分子印迹固相萃取(molecularly imprinted solid-phase extraction,MISPE)柱,该柱对模板分子有特异性识别能力,非常适合分离富集复杂样品中痕量分析物,提高仪器的灵敏度和准确度[19-22]。
目前,尚未发现有关NMN MIPs的相关研究。本实验以NMN为模板分子,α-甲基丙烯酸(methylacrylic acid,MAA)为功能单体,采用沉淀聚合法制备NMN MIPs微球,测定其吸附性和选择性,并利用MIPs对西兰花中的NMN进行固相萃取研究,实现了NMN的分离富集,为复杂样品中NMN的分析测定提供了新的样品前处理技术。
1 材料与方法
1.1 试剂与仪器
NMN标准品,上海源叶生物科技有限公司;乙二醇二甲基丙烯酸酯(ethylene dimethacrylate,EDGMA),深圳市丽晶生化科技有限公司;MAA,天津市福晨化学试剂厂;偶氮二异丁腈(2,2-azobisisobutyronitrile,AIBN),成都市科龙化工试剂厂;N,N′-亚甲基双丙烯酰胺,天津市科密欧化学试剂有限公司;实验试剂均为分析纯。
SPD-16高效液相色谱仪,日本岛津公司;DZF-6050型真空干燥箱,上海博讯实业有限公司;高速冷冻离心机,赛默飞世尔科技有限公司。
1.2 NMN MIPs的制备
取0.4 mmol NMN,溶于一定的溶剂中,然后加入0.8 mmol MAA,5 ℃下预聚合10 h,然后加入4 mmol N,N′-亚甲基双丙烯酰胺和50 mg AIBN,除氧、密封,60 ℃下反应7 h。聚合完成后,离心,弃上清液,得白色印迹聚合物。水洗去除未反应的NMN、MAA和N,N′-亚甲基双丙烯酰胺等,然后用甲醇乙酸(体积比9∶1)作为脱模液,去除印迹聚合物中的NMN,再用甲醇洗去残留的乙酸,真空干燥,得NMN MIPs。
非印迹聚合物(non-imprinted polymers,NIPs)的合成方法与MIPs合成方法一致,只是在合成时不加入NMN。
1.3 MIPs的吸附性能
1.3.1 标准曲线的绘制
以乙腈水为溶剂,配制质量浓度为3.125~100 μg/mL的NMN标准溶液,用HPLC仪测定不同浓度下NMN溶液的峰面积,平行测定3次,取平均值。从峰面积(F)-浓度(c)曲线图得到F-c关系式:F=7 810 934 129.353 2c-26 205.442 8,R2=0.997 4。
HPLC测定条件[4]:岛津Essentia LC-16色谱柱;紫外检测波长为261 nm;流动相A为2 mmol/L醋酸铵甲醇溶液、B为0.1%乙酸水溶液;泵的总流速=1 mL/min、泵A∶泵B=1∶4;柱温箱温度为室温。
1.3.2 静态等温吸附
准确称取2 mg MIPs和NIPs,加入2 mL不同浓度的NMN标准溶液,恒温振荡4 h,离心,上清液过0.45 μm滤膜,用HPLC测定其浓度,并绘制吸附等温线。吸附量(Q)的计算如公式(1)所示:
(1)
式中:Q为MIPs(或NIPs)对NMN的吸附量,mg/g;c0为溶液中NMN的初始质量浓度,mg/mL;ce为吸附平衡时NMN的质量浓度,mg/mL;V为NMN溶液的体积,mL;m为MIPs(或NIPs)的质量,g。
1.3.3 吸附动力学
分别称取2 mg MIPs和NIPs,加入2 mL 100 μg/mL的NMN标准溶液,恒温振荡不同时间,离心,上清液过0.45 μm滤膜,用HPLC测定其浓度。采用准一级动力学方程和准二级动力学方程研究MIPs对NMN的吸附速率和吸附机理,准一级动力学方程和准二级动力学方程如公式(2)、公式(3)所示:
ln(Qe-Qt)=lnQe-k1t
(2)
(3)
式中:Qe为MIPs(或NIPs)平衡时的吸附量,mg/g;Qt为测量时间为t时MIPs(或NIPs)的吸附量,mg/g;t为吸附时间,min;k1为一级动力学常数;k2为二级动力学常数。
1.3.4 选择性吸附
准确称取2 mg MIPs,加入2 mL一定浓度的NMN、烟酰胺、腺苷酸标准溶液,恒温振荡4 h,离心,上清液用0.45 μm滤头过滤,用HPLC测定其浓度。3种被测物结构如图1所示。

A-NMN;B-烟酰胺;C-腺苷酸
图1 NMN、烟酰胺和腺苷酸结构
Fig.1 The structure of NMN,nicotinamide and adenylate
印迹因子(imprinting factor,IF)、分离因子(α)和相对分离因子(β)的计算公式如公式(4)~公式(6)所示。IF值越大,说明制备的MIPs的印迹效果越好;α值越大说明印迹材料对NMN的选择和识别能力越强;β值越大说明与NIPs相比,MIPs对印迹分子NMN的特异性吸附能力越强。
(4)
(5)
(6)
式中:Qi为MIPs(或NIPs)对NMN的吸附量,mg/g;Qj为MIPs(或NIPs)对NMN结构类似物(腺苷酸、烟酰胺)的吸附量,mg/g;αM表明相比于NMN结构类似物,MIPs对NMN的吸附效果;αN表明相比于NMN结构类似物,NIPs对NMN的吸附效果。
1.4 MISPE
用MIPs作填充材料制备MISPE柱。准确称取一定质量的MIPs,装入1 mL的固相萃取柱(Agilent)中,用筛板压严实。用乙腈水对MISPE柱进行活化,然后加入一定体积的西兰花提取液吸附一定时间后,进行淋洗和洗脱,分别收集上样液和洗脱液,进行HPLC分析。
2 结果与分析
2.1 MIPs制备条件的优化
2.1.1 溶剂的用量
模板分子NMN与功能单体MAA的预聚合是利用氢键作用力,制备的MIPs属于非共价型,反应溶剂对氢键作用力以及MIPs的形态影响较大,且具有致孔作用。所用溶剂不仅要对NMN有较高的溶解度,还要能够促进NMN与MAA之间氢键的形成。NMN属于水溶性物质,在水中有较好的溶解度,且MAA和交联剂N,N′-亚甲基双丙烯酰胺在水中也有较好的溶解度,故选择水作为溶剂。但考虑到水会对氢键产生破坏,影响选择性空穴的形成,故采用混合溶剂,考虑到N,N′-亚甲基双丙烯酰胺在乙腈中也有较好的溶解度,且乙腈的极性与介电常数均低于水、对氢键的形成影响较小,乙腈与水可无限互溶,故溶剂选择乙腈水。此外,在MIPs的制备过程中,溶剂的用量也十分关键,当溶剂的量太少时,反应物黏度大、反应更趋向于本体聚合;当溶剂的量太大时,则无法形成微球沉淀。因此,溶剂的配比和用量至关重要,需对其进行优化。固定水的体积为3 mL,使得水与乙腈的体积比分别为1∶1、1∶2、1∶3、1∶4。结果如图2所示,当溶剂量为12 mL(即水3 mL,乙腈9 mL,水与乙腈的体积比为1∶3)时,MIPs吸附效果最好,可达到23.95 mg/g。
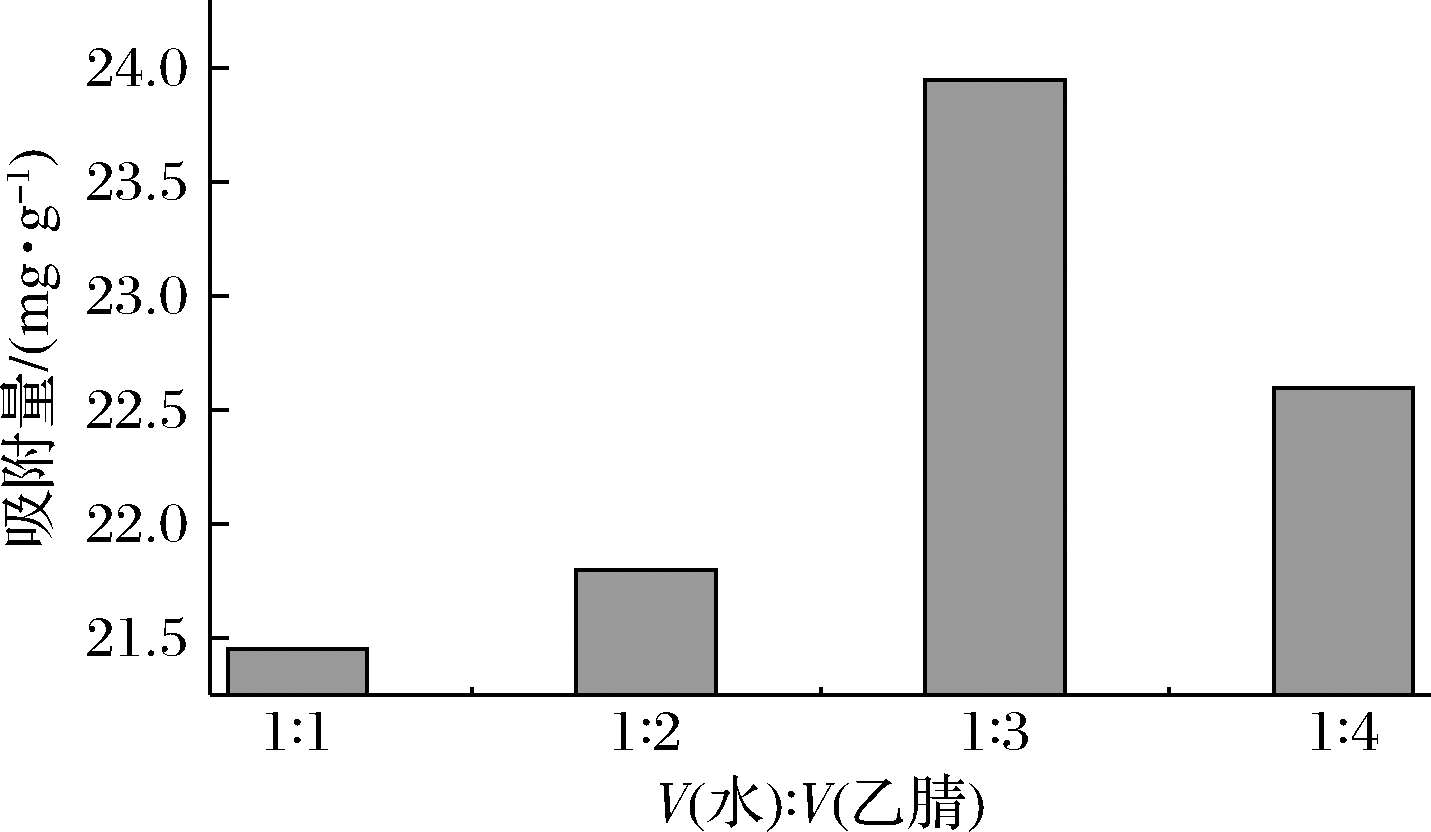
图2 溶剂用量的优化
Fig.2 Optimization of solvent usage
2.1.2 模板分子、功能单体和交联剂的用量
沉淀聚合法制备NMN MIPs主要分为2个阶段:首先,在一定溶剂中,NMN与MAA通过氢键作用形成预聚体;然后AIBN分解产生自由基引发聚合,N,N′-亚甲基双丙烯酰胺使预聚体形成高度交联、刚性的聚合物。因此,NMN、MAA和N,N′-亚甲基双丙烯酰胺的用量在MIPs的制备过程中至关重要。故对每个变量设置3个水平,研究其对MIPs吸附性能的影响。正交分析见表1,方差分析见表2。MIPs制备过程中影响聚合物吸附性能的各因素主次为B(功能单体MAA)>A(模板分子NMN)>C(交联剂N,N′-亚甲基双丙烯酰胺),说明在MIPs的制备过程中MAA的用量对MIPs的吸附性能影响最大,N,N′-亚甲基双丙烯酰胺的用量对其影响最小。根据各主次因素的最高水平,得出的最优MIPs的制备方案为A2B2C2,即模板分子NMN的用量为0.04 mmol、功能单体MAA的用量为0.08 mmol、交联剂N,N′-亚甲基双丙烯酰胺的用量为0.4 mmol(其摩尔比为1∶2∶10)为最优制备MIPs的条件组合。
表1 正交实验优化结果
Table 1 Orthogonal experiment optimization results

实验号A模板分子/mmolB功能单体/mmolC交联剂/mmolIF11(0.02)1(0.04)1(0.2)1.06212(0.08)2(0.4)1.29313(0.16)3(0.8)1.0242(0.04)121.3352231.4162311.2173(0.08)131.3383211.3793321.21k11.1231.241.213/k21.3171.3571.277/k31.3031.1471.253/极差R0.1940.210.064/因素主次B>A>C最优方案A2B2C2
表2 正交实验方差分析
Table 2 Orthogonal experiment analysis of variance
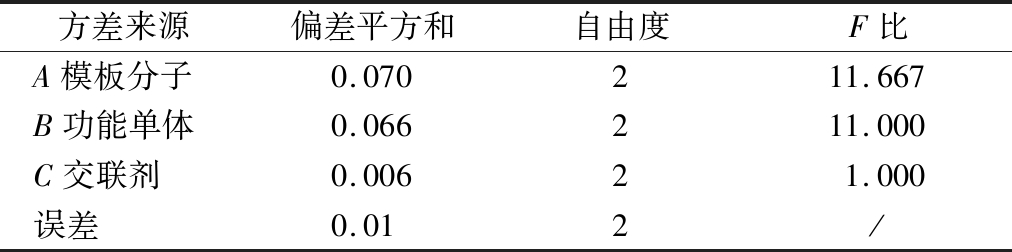
方差来源偏差平方和自由度F比A模板分子0.070211.667B功能单体0.066211.000C交联剂0.00621.000误差0.012/
2.2 聚合物吸附性能
2.2.1 静态吸附等温线
为考察聚合物对NMN的平衡吸附能力,绘制吸附量(Q)随NMN浓度(c)的变化曲线,结果如图3所示,在10~70 μg/mL,MIPs和NIPs的吸附量均随着NMN浓度的增大而增大;而在70 μg/mL以后,曲线逐渐趋于平稳。MIPs的整体吸附量均要大于NIPs,表明MIPs的吸附性能显著强于NIPs。
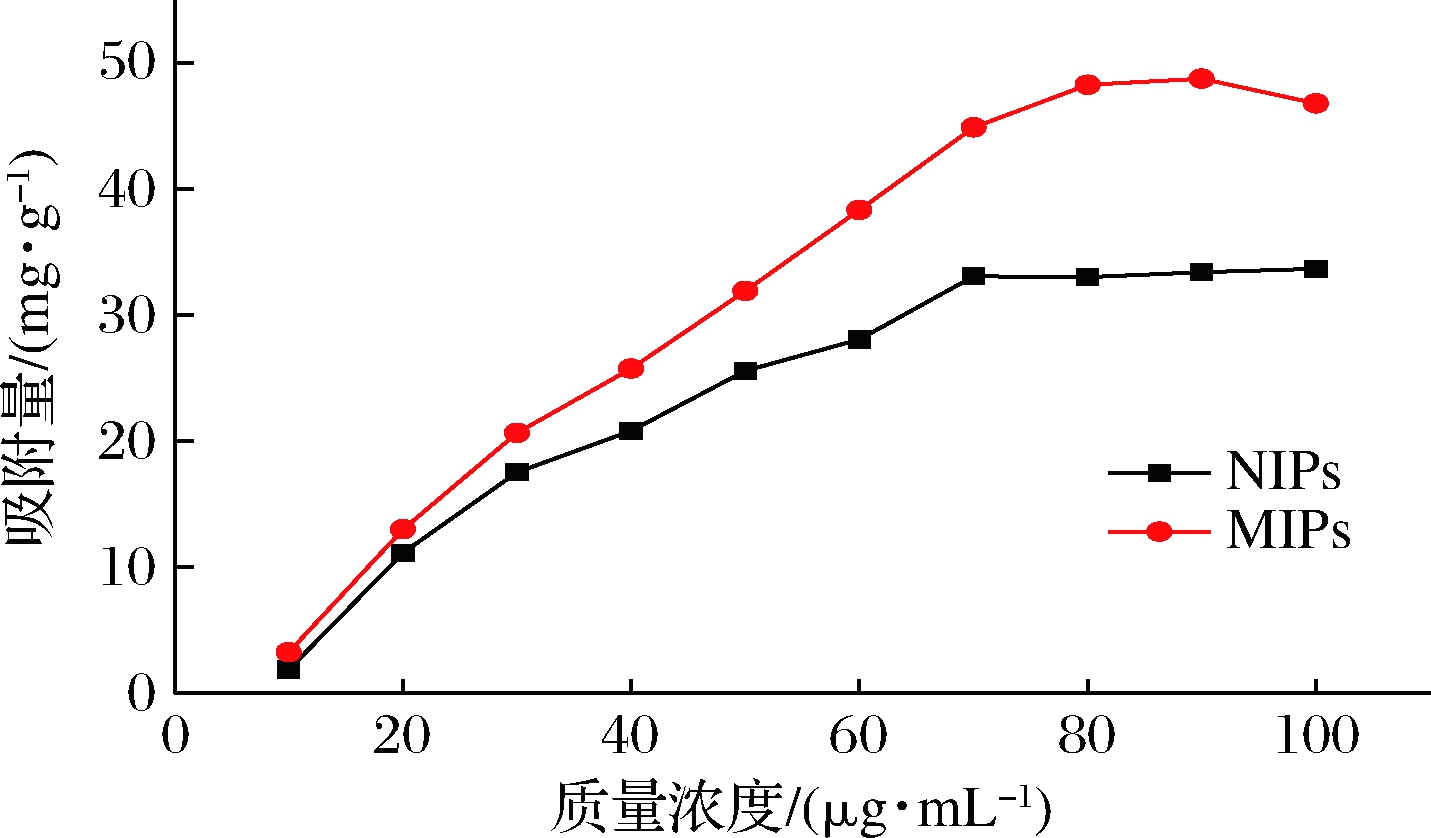
图3 MIPs和NIPs对NMN的静态吸附等温线
Fig.3 Static adsorption isotherms of MIPs and NIPs to NMN
2.2.2 吸附动力学
对NMN MIPs和NIPs进行动力学测试,绘制吸附量(Q)随吸附时间(t)的变化曲线,结果如图4所示。在0~60 min,MIPs与NIPs曲线均呈上升趋势,在60 min左右达到平衡;并且 MIPs的吸附量明显高于NIPs。这是因为MIPs的“空穴”被NMN成功印迹,随着吸附时间的增加,MIPs中的空穴逐渐被NMN填充,空间位阻增大、吸附速率降低,最终达到动态平衡。而NIPs没有特定的印迹空穴,所以只能依靠聚合物表面的非特异性吸附作用进行少量的吸附。
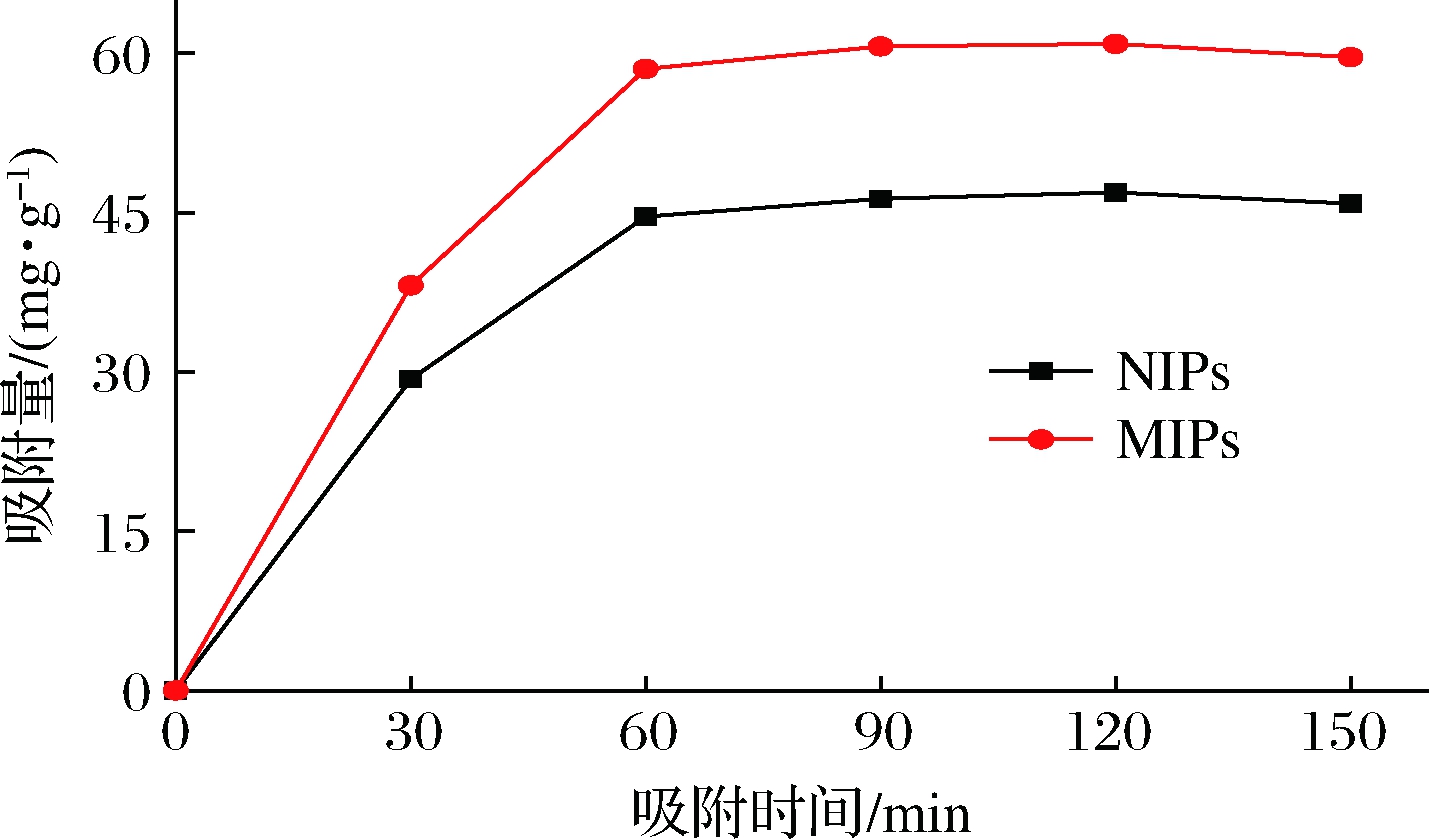
图4 MIPs、NIPs的动态吸附曲线
Fig.4 Dynamic adsorption curves of MIPs and NIPs
为了进一步探究MIPs和NIPs吸附过程的动力学机理,采取准一级动力学模型和准二级动力学模型进行拟合。准一级动力学方程和准二级动力学方程的拟合结果见表3,MIPs、NIPs的准二级动力学方程的拟合结果相关系数R2(0.983 5、0.984 8)均比准一级动力学方程的R2(0.929 8、0.939 7)更接近1,说明MIPs、NIPs对NMN的吸附过程更符合准二级动力学方程。
表3 动力学方程拟合参数
Table 3 Kinetic equation fitting parameters

聚合物准一级准二级k1/min-1Qe/(mg·g-1)R2k2/[g·(mg·min)-1]Qe/(mg·g-1)R2MIPs0.0357562.080.92989.149×10-468.120.9835NIPs0.0355147.640.93971.153×10-352.490.9848
2.2.3 选择性吸附
选取与NMN结构类似的腺苷酸和烟酰胺作为底物进行选择性吸附研究,结果见表4。IF为1.36,说明制备的MIPs具有较好的印迹效果;在有印迹分子结构类似物(腺苷酸、烟酰胺)的存在下,分离因子α均>1,说明印迹材料对NMN的选择和识别能力很好;此外,NMN与腺苷酸、烟酰胺的相对分离因子β(2.81、2.83)均>1,可见与NIPs相比,MIPs对NMN有着较强的特异性吸附能力。
表4 MIPs的选择性吸附
Table 4 Selective adsorption of molecularly imprinted polymers

底物IF分离因子αM分离因子αN相对分离因子βNMN 1.36///腺苷酸0.484.131.472.81烟酰胺0.4815.685.542.83
2.3 固相萃取柱的制备及其应用
研究了MISPE西兰花提取液中NMN的实际应用效能。取适量西兰花提取液加入到MISPE柱中,用乙腈作为淋洗液、甲醇乙酸(体积比9∶1)作为脱模液,收集洗脱液,采用HPLC分析其组成。西兰花提取液和过MISPE柱洗脱液的色谱图如图5所示,可以看出,NMN的色谱峰显著增高,杂质色谱峰显著降低或消失,说明该柱对NMN具有很好的选择性,可以从复杂基质中分离富集NMN。
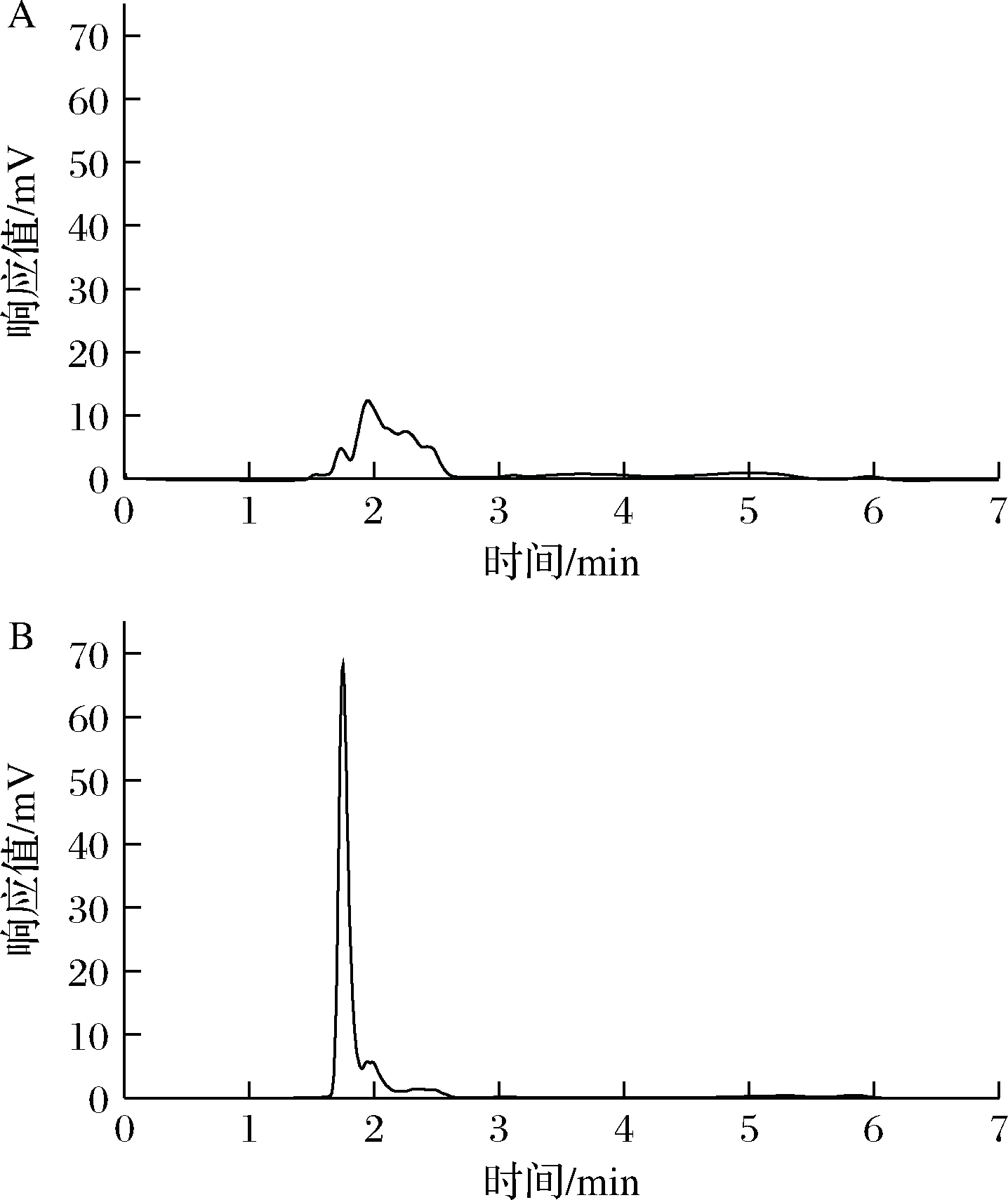
A-西兰花提取液;B-西兰花提取液经MISPE处理后的洗脱液
图5 MISPE西兰花样品吸附净化效果谱图
Fig.5 Spectrum of adsorption and purification effect of molecularly imprinted solid phase extraction broccoli sample
2.4 加标回收率和精密度
在1.4固相萃取条件下,采用加标回收法,在西兰花提取液中加入1 mL不同浓度的NMN标准液,旋匀,使其加标质量浓度分别为5、50、200 μg/mL,每个浓度水平测定5次,实验结果如表5所示,西兰花中NMN的回收率为89.52%~95.77%,相对标准偏差(relative standard deviation,RSD)(n=5)为1.08%~5.27%,实验结果表明该方法具有良好的准确度和精密度。
表5 西兰花中NMN的加标回收率和精密度
Table 5 Recoveries and RSD of NMN in broccoli
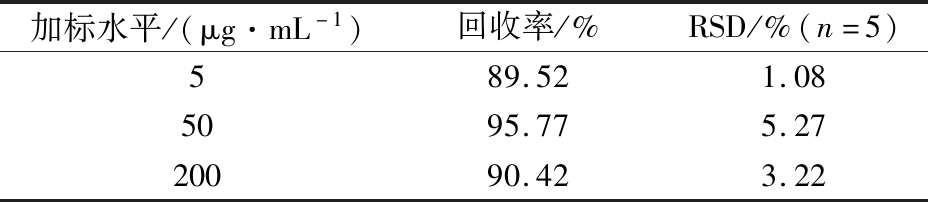
加标水平/(μg·mL-1)回收率/%RSD/%(n=5)589.521.085095.775.2720090.423.22
2.5 分子印迹的重复使用性能
分子印迹的重复使用性能是评价其实用性的一个重要指标。在5 mL 80 μg/mL的NMN溶液中,加入一定量的MIPs,吸附平衡后离心,HPLC测定上清液中NMN浓度,计算该MIPs的吸附量。然后用一定量的脱模液洗脱吸附在MIPs中的NMN,干燥后,将该MIPs再加入到5 mL 80 μg/mL的NMN溶液中,吸附平衡后测定其吸附量。按照相同的步骤重复测定7次,MIPs的吸附量如图6所示。可以看出MIPs重复使用多次后,吸附性能变化不大,该实验制备的MIPs可以反复多次使用。
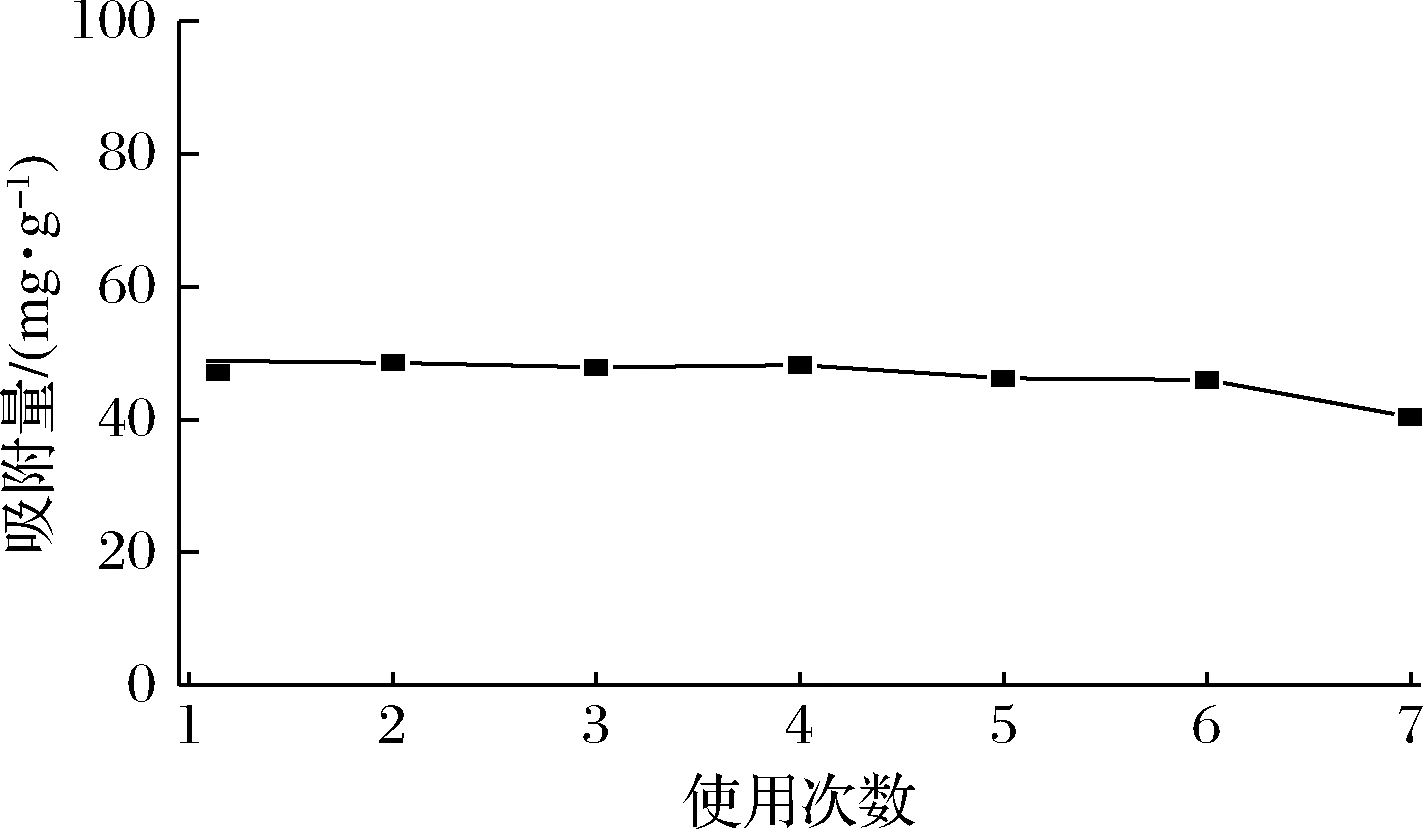
图6 多次使用后MIPs的吸附量
Fig.6 Adsorption capacity of MIPs toward NMN after seven recycles
3 结论
本研究首次以NMN为模板分子、乙腈水为致孔剂、MAA为功能单体、N,N′-亚甲基双丙烯酰胺为交联剂、AIBN为引发剂,采用沉淀聚合法制备了NMN MIPs,并且采用正交试验优化了聚合工艺。当NMN、MAA、N,N′-亚甲基双丙烯酰胺的摩尔比为1∶2∶10、致孔剂乙腈水用量12 mL、聚合温度60 ℃时,制备的MIPs吸附效果最好。静态吸附结果表明,所制得的MIPs对NMN有较强的吸附能力。动态吸附结果表明,该MIPs在60 min左右达到吸附平衡;MIPs和NIPs对NMN的吸附过程均符合准二级动力学方程。选择性吸附实验结果表明MIPs对NMN有很好的特异性吸附能力。该MIPs用于固相萃取西兰花提取液中的NMN时,展现了较高的应用性能,为植物中NMN的分离和纯化提供了新的方法。
[1] 王运,陈建生,李峰,等.含NMN的生物高分子纳米球及其制备方法与应用:中国,CN109364091A[P].2019-02-22.
WANG Y,CHEN J S,LI F,et al.NMN-containing biopolymer nanospheres and their preparation methods and applications:China,CN109364091A[P].2019-02-22.
[2] 李旺,郭文彬,王晓季.烟酰胺单核苷酸(NMN)的活性与化学制备的研究进展[J].江西科技师范大学学报,2020(6):112-115.
LI W,GUO W B,WANG X J.Progress of the activity and synthesis of nicotinamide mononucleotide(NMN)[J].Journal of Jiangxi Science &Technology Normal University,2020(6):112-115.
[3] 孟辰笑凝,郭中原,李春,等.定量核磁共振法测定β-烟酰胺单核苷酸的含量[J].中国药学杂志,2021,56(2):135-139.
MENG C X N,GUO Z Y,LI C,et al.Determination of nicotinamide mononucleotide by quantitative nuclear magnetic resonance method[J].Chinese Pharmaceutical Journal,2021,56(2):135-139.
[4] 李东芹.液质联用法测定蔬菜和水果中的烟酰胺单核苷酸[J].实验技术与管理,2019,36(9):57-59;72.
LI D Q.Determination of nicotinamide mononucleotides in vegetables and fruits by liquid chromatography-mass spectrometry[J].Experimental Technology and Management,2019,36(9):57-59;72.
[5] 周悦榕,李丹妮,吴剑平,等.超高效液相色谱-电喷雾电离-串联质谱法测定猪粪便中6种抗生素残留的基质效应研究[J].分析测试学报,2017,36(8):1 010-1 017.
ZHOU Y R,LI D N,WU J P,et al.Study on matrix effects in analysis of six antibiotics in swine manure by ultra performance liquid chromatography-electrospray ionization-tandem mass spectrometry[J].Journal of Instrumental Analysis,2017,36(8):1 010-1 017.
[6] 王立琦,贺利民,曾振灵,等.液相色谱-串联质谱检测兽药残留中的基质效应研究进展[J].质谱学报,2011,32(6):321-332.
WANG L Q,HE L M,ZENG Z L,et al.Progress in matrix effect of veterinary drug residues analysis by high-performance liquid chromatography tandem mass spectrometry[J].Journal of Chinese Mass Spectrometry Society,2011,32(6):321-332.
[7] 刘晓云,陈笑艳,钟大放.液相色谱-串联质谱生物分析方法的基质效应和对策[J].质谱学报,2017,38(4):388-399.
LIU X Y,CHEN X Y,ZHONG D F.Matrix effects and countermeasure of liquid chromatography-tandem mass spectrometry in bioanalysis[J].Journal of Chinese Mass Spectrometry Society,2017,38(4):388-399.
[8] 马润恬,师彦平.样品分析中分子印迹固相萃取的新技术进展[J].色谱,2016,34(3):223-225.
MA R T,SHI Y P.New technology development of molecularly imprinted solid phase extraction in sample analysis[J].Chinese Journal of Chromatography,2016,34(3):223-225.
[9] FOCKER M,VAN DER FELS-KLERX H.Economics applied to food safety[J].Current opinion in food science,2020,36:18-23.
[10] VIPHAM J L,AMENU K,ALONSO S,et al.No food security without food safety:Lessons from livestock related research[J].Global Food Security,2020,26:100382.
[11] 邱雯曦,钟辉云,王爱萍.食品安全现状及对策[J].食品界,2020(11):116-117.
QIU W X,ZHONG H Y,WANG A P.Food safety status and countermeasures[J].Food Industry,2020(11):116-117.
[12] 赵楠.样品中分子印迹固相萃取技术的最新应用进展[J].化学研究与应用,2020,32(5):696-706.
ZHAO N.Recent progress in the application of molecular imprinting solid phase extraction in samples[J].Chemical Research and Application,2020,32(5):696-706.
[13] 黄原飞,娄晓祎,周哲,等.分子印迹聚合物固相萃取超高效液相色谱串联质谱法检测水产品中11种氨基糖苷类药物残留[J].分析化学,2018,46(3):454-461.
HUANG Y F,LOU X Y,ZHOU Z,et al.Determination of 11 kinds of aminoglycosides in aquatic products by ultra performance liquid chromatography-tandem mass spectrometry with molecularly imprinted polymers solid phase extraction[J].Chinese Journal of Analytical Chemistry,2018,46(3):454-461.
[14] 苏立强,于亭亭,姜国强,等.喹乙醇分子印迹聚合物的制备及其应用[J].分析试验室,2020,39(7):806-810.
SU L Q,YU T T,JIANG G Q,et al.Preparation and application of olaquindox molecularly imprinted polymer[J].Chinese Journal of Analysis Laboratory,2020,39(7):806-810.
[15] FANDRICH P,WIEHEMEIER L,DIRKSEN M,et al.Acrylamide precipitation polymerization in a continuous flow reactor:An in situ FTIR study reveals kinetics[J].Colloid and Polymer Science,2021,299(2):221-232.
[16] 张瑜,陈梦婷,张瑞,等.分子印迹聚合物用于从食品基质中提取有害物质[J].分析试验室,2019,38(7):872-877.
ZHANG Y,CHEN M T,ZHANG R,et al.Application of molecularly imprinted polymers for extraction of contaminants from food matrices[J].Chinese Journal of Analysis Laboratory,2019,38(7):872-877.
[17] 张军杰,刘娜,高原,等.分子印迹磁性纳米材料对石榴皮中没食子酸的选择性富集和检测[J].分析试验室,2020,39(5):566-571.
ZHANG J J,LIU N,GAO Y,et al.Molecularly imprinted magnetic nanomaterials for selective enrichment and detection of gallic acid in pomegranate rind[J].Chinese Journal of Analysis Laboratory,2020,39(5):566-571.
[18] 祖广权,赵琪,谭策,等.分子印迹固相萃取-超高效液相色谱串联质谱法测定猪肉中磺胺二甲氧嗪[J].分析试验室,2017,36(3):292-296.
ZU G Q,ZHAO Q,TAN C,et al.Molecularly imprinted solid phase extraction-ultra performance liquid chromatography tandem mass spectrometry for the determination of sulfadimethoxine in pork[J].Chinese Journal of Analysis Laboratory,2017,36(3):292-296.
[19] 陈方方,师彦平.分子印迹固相萃取技术在天然产物有效成分分离分析中的应用进展[J].色谱,2013,31(7):626-633.
CHEN F F,SHI Y P.Application of molecularly imprinted solid phase extraction in the separation and determination of active constituents from natural compounds[J].Chinese Journal of Chromatography,2013,31(7):626-633.
[20] 张凯杰,秦思楠,赵春娟,等.莠去津分子印迹聚合物微球的制备及其吸附性能与在食品检测中的应用[J].食品科学,2019,40(20):338-345.
ZHANG K J,QIN S N,ZHAO C J,et al.Preparation,adsorption performance and application of molecularly imprinted polymer microspheres for detection of atrazine in foods[J].Food Science,2019,40(20):338-345.
[21] 李玲,苏学素,张耀海,等.辛弗林分子印迹聚合物的制备及其在固相萃取中的应用[J].食品科学,2020,41(8):45-51.
LI L,SU X S,ZHANG Y H,et al.Preparation and application of molecularly imprinted polymer in solid phase extraction of synephrine[J].Food Science,2020,41(8):45-51.
[22] 刘祺文,熊远福,王锦,等.分子印迹固相萃取技术研究新进展[J].环境科技,2015,28(5):63-67.
LIU Q W,XIONG Y F,WANG J,et al.New advance of studies on molecularly imprinted solid-phase extraction[J].Environmental Science and Technology,2015,28(5):63-67.