随着中国人口数量的增加和经济日益飞速发展,人们对肉品质的需求也不断上升,食用的肉制品种类也越来越多样化。在非洲、阿拉伯国家、蒙古、中国西北补等地区骆驼肉深受人们喜爱。根据粮农组织的统计数据,世界上伊斯兰国家驼肉数量约占肉类生产总量的8%[1-3]。骆驼肉色泽鲜艳且无膻味,还具有高水分、高蛋白、低脂肪、低胆固醇等特点[4],是许多亚洲和非洲国家人们最理想的肉食来源[5]。现如今,肉类的食用品质特性受到性别、不同年龄、不同部位、营养状况等诸多因素的影响[6]。因此,常采用pH值、挥发性盐基氮、水分含量、失水率、色差、质构、持水力等指标检验肉类品质。其中肉制品水分含量直接关系到成品的适口性、新鲜度、多汁性、口感、风味等食用品质[7-8],决定了肉品的质量和货架期,是肉品加工贮藏中的重要卫生、营养指标[9]。
近红外光谱技术是一种利用光谱学来检测物质成分的技术[10],因其快速、准确、高效无污染[11]等优点被广泛应用于食品检测中。近年来,近红外光谱技术在食品行业发挥了巨大的作用。赵钜阳等[12]在对冻藏猪肉在近红外光谱应用中的快速无损检测的研究中表明,利用近红外光谱技术建立新鲜肉和长期冻藏猪肉的预测模型,可以较好地判别新鲜猪肉与冻藏猪肉,达到了快速无损检测猪肉新鲜度的目的。谢安国[13]研究了不同形态猪肉近红外光谱的特征及蛋白和水分在猪肉光谱中的意义,更深入地了解光谱在各波段的生物学意义。PRIETO等[14]利用近红外光谱,预测了牛肉样品的成分,结果表明近红外光谱技术在肉制品的检测研究中具有很大的潜力。
目前,由于骆驼地域性较强,分布不广泛,所以对骆驼肉的研究并不算多,已有人对骆驼肉的营养成分以及肉制品进行了初步研究,但利用近红外光谱技术预测骆驼肉品质特性的研究还未见报道。因此,本研究利用近红外技术对阿拉善双峰驼不同部位肉基本营养成分进行检测,并建立预测模型,以期提供一种快速预测驼肉品质的模型。
1 材料与方法
1.1 材料
选取3~5岁龄阿拉善双峰驼胴体的辣椒条、骆驼霖、大黄瓜条、腹肉、腱子肉、里脊、米龙、上脑、臀肉、外脊、胸肉、小黄瓜条、眼肉等13个部位肉样,各部位肉切割成3 cm×2 cm×1 cm(长×宽×高)大约20 g的块状,标记后置于-20 ℃的冰箱进行保存,每个部位平行30个样品。13个不同部位的分布具体见表1。
表1 不同部位驼肉的名称
Table 1 The names of different parts of camel

部位名称胴体部位辣椒条(CH)位于里脊旁边,状似辣椒骆驼霖(CL)后腿部位大黄瓜条(DH)由臀骨二头肌等肌肉组成,位于骆驼后臀处,骆驼后腿骨外侧腹肉(F)骆驼腹部及靠近骆驼肋处的松软肌肉腱子肉(JZ)大腿上的肌肉,有肉膜包裹的,内藏筋里脊(LJ)脊椎骨内侧的条状嫩肉米龙(ML)臀部上侧靠近腰椎的肉上脑(SN)位于肩颈部靠后,脊骨两侧的肉臀肉(F)后腿近臀部的肉,外形呈圆滑状外脊(WJ)为背最长肌胸肉(X)胸口两肢前腿中间胸脯肉小黄瓜条(XH)骆驼后臀部位半腱肌眼肉(YR)一端与上脑相连,另一端与外脊相连
1.2 仪器与设备
Frontier近红外光谱分析仪,铂金埃尔默企业管理(上海)有限公司;DHG/50 Hz电热鼓风干燥箱,上海一恒科学仪器有限公司;Kjeltec 8100凯氏定氮仪、Soxtec TM2050脂肪测定仪,丹麦FOSS公司;EX224ZH电子天平,奥豪斯仪器(常州)有限公司;5810R高速冷冻离心机,Eppendorf公司。
1.3 实验方法
1.3.1 不同部位驼肉营养品质的测定
参照GB 5009.3—2016《食品中水分的测定》中的直接干燥法测定不同部位驼肉中的水分含量。
参照GB 5009.5—2016《食品中蛋白质的测定》中的凯氏定氮法测定不同部位驼肉中的蛋白质含量。
参照GB 5009.6—2016《食品中脂肪含量的方法测定》中的索氏抽提法测定不同部位驼肉中的脂肪含量。
1.3.2 采集近红外光谱
将样品从-20 ℃环境中取出,置于4 ℃冰箱中解冻12 h,使用绞肉机绞碎成肉糜,将制成的肉糜放入样品杯中,表面刮平使内部气泡流出。设定近红外光谱仪的参数为:分辨率8 cm-1,波数范围4 000~1 000 cm-1。每个样品重复扫描3次,取3次扫描的平均值作为每个样品的光谱。
1.3.3 光谱预处理与建模
对上述13个部位肉分别进行光谱扫描,共获得390份驼肉近红外原始光谱。将390个光谱数据以7∶3 的比例分为校正集和预测集[15]。用滤波平滑法(savitzky-golay,S-G)进行平滑滤波,可以提高光谱的平滑性,并降低噪音的干扰;标准正态变量转换法(standard normal variate,SNV)可以消除由样本颗粒大小、表面散射等对漫反射的影响;多元散射校正(multiplication scatter correction,MSC)主要的目的是消除由颗粒分布不均匀和颗粒大小引起的散射现象[16]。采用导数(derivative,Der)可以消除基线漂移或背景引起的干扰,区分出重叠峰,提高分辨率和灵敏度[17-18]。因此本研究选用S-G、一阶导数(1stDer)、二阶导数(2ndDer)、SNV、MSC等方法进行光谱预处理,采用偏最小二乘判别分析法(partial least square-discrimination analysis,PLS-DA)建立模型。以校正集决定系数Rc2、预测集决定系数Rp2、校正均方根误差(root mean square error of calibration,RMSEC)以及预测均方根误差(root mean square error of prediction,RMSEP)作为评价模型好坏。决定系数越接近于1,RMSEC和RMSEP越接近0时,表明预处理方法越好,模型的预测能力越高[19]。
1.4 统计分析
本实验数据用WPS Excel 2010录入,用IBM-SPSS Statistics 24.0对不同部位驼肉营养成分化学真值进行差异显著性分析。利用“The Unscrambler X 10.4”软件对13个不同部位驼肉的营养成分进行建模,并验证。
2 结果与分析
2.1 骆驼不同部位肉样营养成分测定结果
表2为双峰驼不同部位肉样的营养成分测定结果。由表2可知,骆驼肉中的含水量丰富,各部位均在70%以上,水分是评价肉品质的一个重要指标,辣椒条、骆驼霖、大黄瓜条、腹肉、腱子肉、里脊、米龙、上脑、臀肉、小黄瓜条、眼肉水分含量差异不显著(P>0.05),辣椒条、骆驼霖、大黄瓜条、腱子肉、眼肉均显著高于外脊和胸肉(P<0.05);大黄瓜条、腹肉、腱子肉、里脊、米龙、臀肉、胸肉蛋白质含量差异不显著(P>0.05),骆驼霖和上脑的蛋白质含量均显著高于外脊、上脑、眼肉(P<0.05);腹肉和外脊、胸肉脂肪含量差异不显著(P>0.05),外脊脂肪含量显著高于其他部位(P<0.05)。
表2 驼肉不同部位的水分、蛋白质和脂肪含量的统计情况
Table 2 Statistics of moisture,protein and fat content in different parts of camel meat
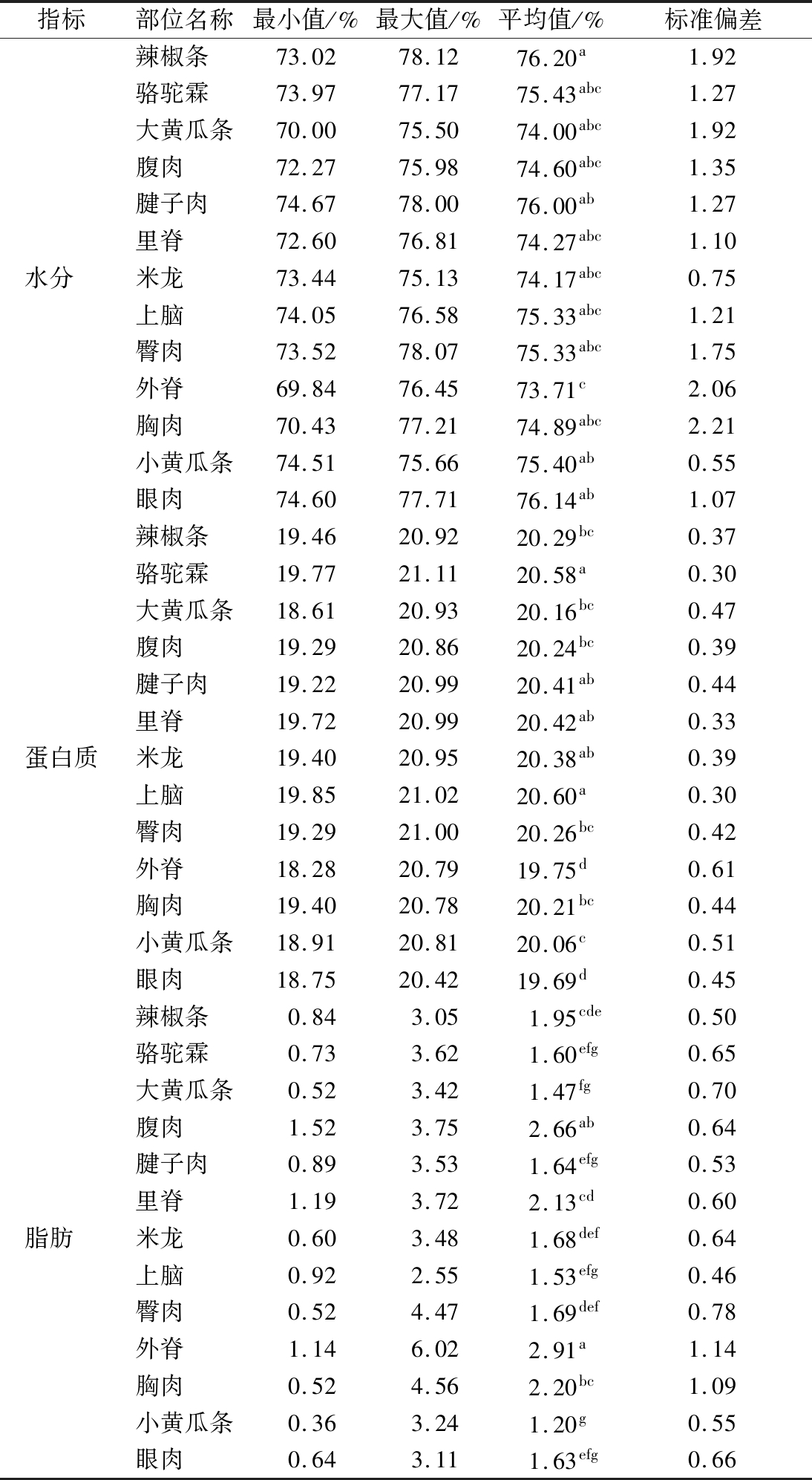
指标部位名称最小值/%最大值/%平均值/%标准偏差辣椒条 73.0278.1276.20a1.92骆驼霖 73.9777.1775.43abc1.27大黄瓜条70.0075.5074.00abc1.92腹肉 72.2775.9874.60abc1.35腱子肉 74.6778.0076.00ab1.27里脊 72.6076.8174.27abc1.10水分 米龙 73.4475.1374.17abc0.75上脑 74.0576.5875.33abc1.21臀肉 73.5278.0775.33abc1.75外脊 69.8476.4573.71c2.06胸肉 70.4377.2174.89abc2.21小黄瓜条74.5175.6675.40ab0.55眼肉 74.6077.7176.14ab1.07辣椒条 19.4620.9220.29bc0.37骆驼霖 19.7721.1120.58a0.30大黄瓜条18.6120.9320.16bc0.47腹肉 19.2920.8620.24bc0.39腱子肉 19.2220.9920.41ab0.44里脊 19.7220.9920.42ab0.33蛋白质米龙 19.4020.9520.38ab0.39上脑 19.8521.0220.60a0.30臀肉 19.2921.0020.26bc0.42外脊 18.2820.7919.75d0.61胸肉 19.4020.7820.21bc0.44小黄瓜条18.9120.8120.06c0.51眼肉 18.7520.4219.69d0.45辣椒条 0.843.051.95cde0.50骆驼霖 0.733.621.60efg0.65大黄瓜条0.523.421.47fg0.70腹肉 1.523.752.66ab0.64腱子肉 0.893.531.64efg0.53里脊 1.193.722.13cd0.60脂肪 米龙 0.603.481.68def0.64上脑 0.922.551.53efg0.46臀肉 0.524.471.69def0.78外脊 1.146.022.91a1.14胸肉 0.524.562.20bc1.09小黄瓜条0.363.241.20g0.55眼肉 0.643.111.63efg0.66
注:同指标同列平均值间标不同小写字母表示差异显著(P<0.05),标同一字母表示差异不显著(P>0.05)
2.2 骆驼不同部位肉样的近红外光谱特征
13个不同部位驼肉样的原始光谱如图1所示。根据2.1的实验结果可知,外脊部位脂肪含量较多,因此由图1可以看出外脊部位的光谱曲线均分布在最下方,与其他部位肉样的光谱曲线不一致,其余不同部位的驼肉样光谱曲线的变化基本处于一致。扫描图谱基本重合,说明光谱较为稳定,重复性较好。为进一步强化光谱特征,本研究对13个不同部位驼肉样的数据取了平均值(图2),可以明显看出13个不同部位驼肉样的平均光谱较好地区分开来,因此采用近红外光谱技术可有效鉴别不同部位驼肉。
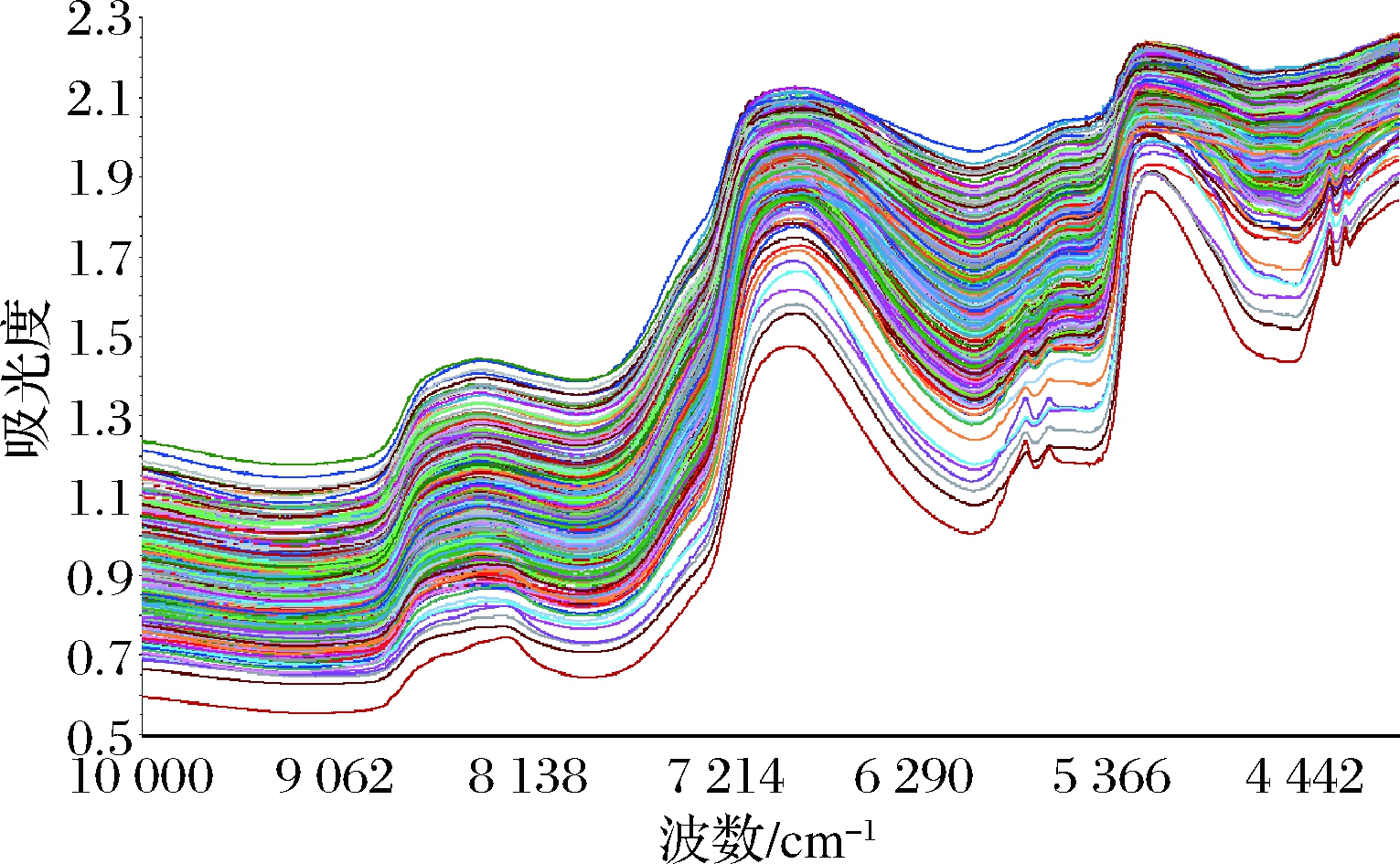
图1 不同部位驼肉样的390个原始光谱
Fig.1 390 original spectra of different parts of camel meat
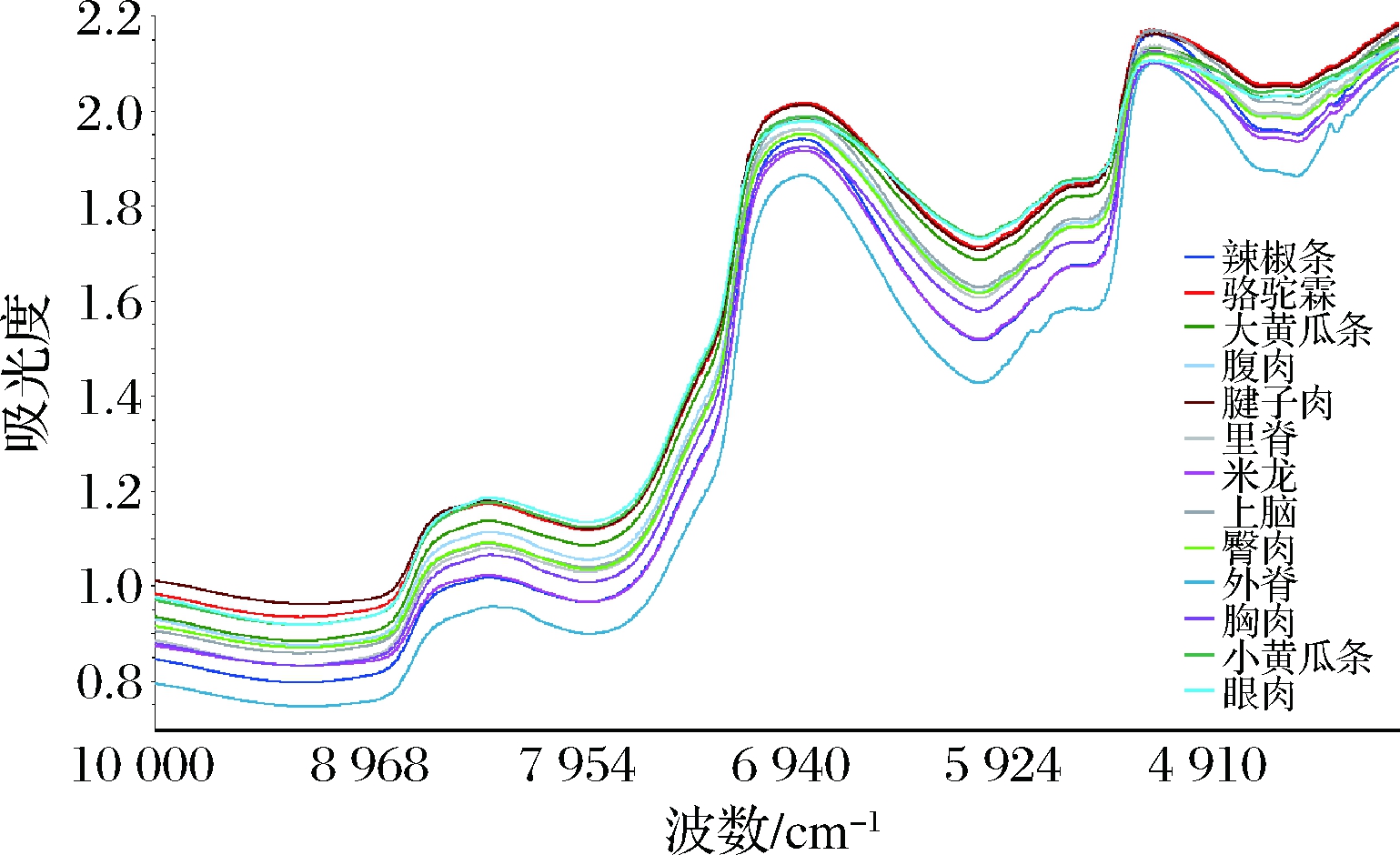
图2 不同部位驼肉样的平均光谱
Fig.2 Average spectra of different parts of camel meat
光谱在8 400、6 800、5 100 cm-1附近产生了明显的吸收峰,在4 200、5 700 cm-1光谱附近的噪音较大。6 900 cm-1处的宽带主要是由水引起的,是氢氧拉伸振动的第一泛音,5 000 cm-1处的吸收带主要与蛋白质有关,与脂肪含量相对应的吸收带主要出现在8 350、5 800~5 700和5 300~5 260 cm-1处[20-21]。
2.3 骆驼不同部位肉样的近红外光谱数据主成分分析
图3对13个不同部位驼肉样品原始光谱数据进行了主成分分析。如图3所示,利用样本的前2个主成分得分作图,获得PC1和PC2,当整个的样品集全部由PC1和PC2表示时,13个不同部位驼肉样品中外脊部位(WJ)呈现明显不同的分布特征。除个别部位如外脊、眼肉、小黄瓜条、臀肉等有区别于其他部位之外,其余样品均聚集在中间。

图3 不同部位驼肉样光谱的主成分分析图
Fig.3 Principal component analysis diagram of spectra of different parts of camel meat
2.4 骆驼不同部位肉样营养成分预处理与PLS-DA模型的建立
光谱采集过程中,无论人为操作多么精确,还是会无法避免一些客观因素产生系统误差影响近红外定量分析模型的信息,例如样品不均匀或受污染、样品受到其他组分的干扰、光谱采集不准确、光谱范围的选择不正确、光谱噪音大等而产生误差。因此在建模前,要对原始光谱进行预处理,进而不断优化所建立的模型。
由表3可知,营养成分不同适宜的预处理方法也有所不同,不同部位驼肉样的水分含量模型的最佳预处理方法为MSC,模型的决定系数R2、RMSEC分别是0.745 9和0.008 5;不同部位驼肉样的蛋白质含量模型的最佳预处理方法为SNV,模型的决定系数R2、RMSEC分别是0.660 2和0.287 9;不同部位驼肉样的脂肪含量模型的最佳预处理方法为S-G,模型的决定系数R2、RMSEC分别是0.988 5和0.086 3。由于近红外技术对化学指标的预测能力较强,水分、脂肪和蛋白质中的—CH和—OH基团具有强烈的近红外吸收[22],同时蛋白质和脂肪是肉中的主要成分,是引起光谱差异性的主要原因[23]。
表3 不同的预处理方法对建模效果的影响
Table 3 The influence of different preprocessing methods on the modeling effect
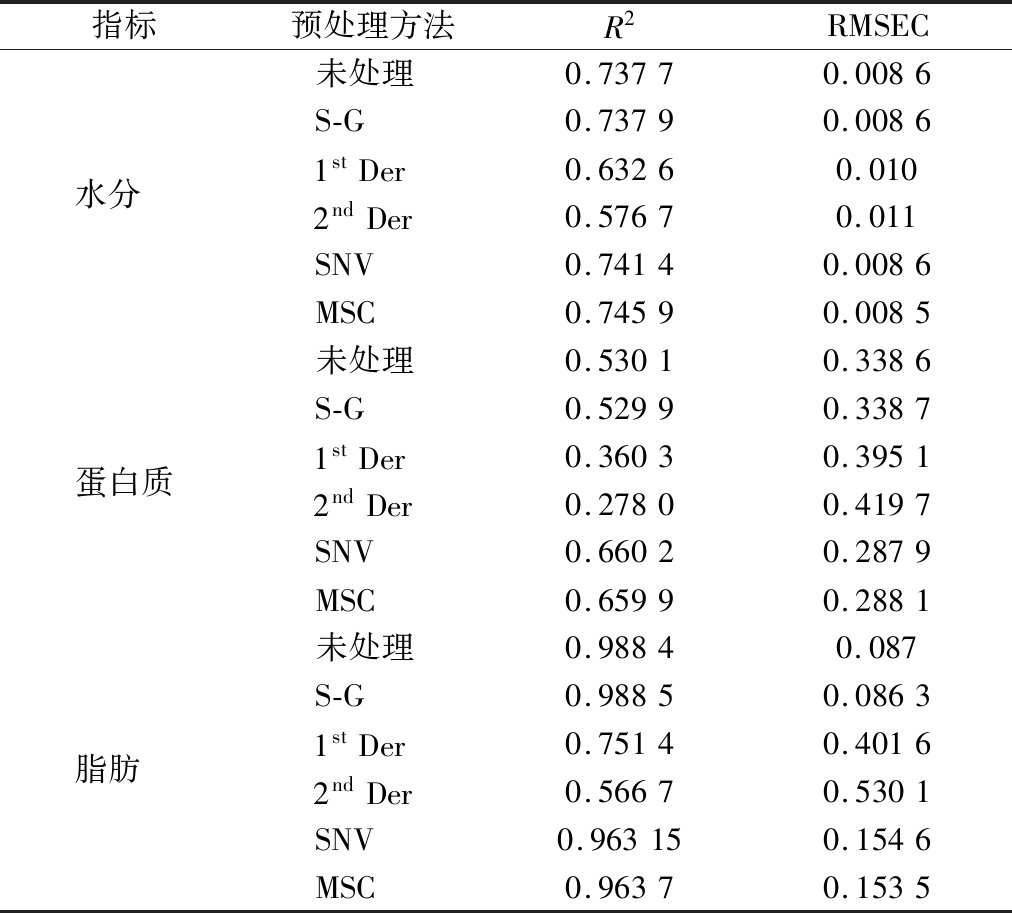
指标预处理方法R2RMSEC未处理0.73770.0086S-G0.73790.0086水分 1stDer0.63260.0102ndDer0.57670.011SNV0.74140.0086MSC0.74590.0085未处理0.53010.3386S-G0.52990.3387蛋白质1stDer0.36030.39512ndDer0.27800.4197SNV0.66020.2879MSC0.65990.2881未处理0.98840.087S-G0.98850.0863脂肪 1stDer0.75140.40162ndDer0.56670.5301SNV0.963150.1546MSC0.96370.1535
2.5 骆驼不同部位肉样营养成分模型的预测
(图4)将划分好的验证集数据对建立的模型进行了验证。由图4可知,不同部位驼肉样水分含量验证集决定系数RP2、RMSEP为0.774 1、0.013 4;蛋白质含量模型的决定系数Rp2、RMSEP为0.672 5、0.276 0;脂肪含量模型模型的决定系数Rp2、RMSEP为0.996 3、0.056 7。验证结果与校正集结果一致,说明利用近红外光谱技术对不同部位驼肉样的脂肪含量预测效果最好,水分含量的预测效果次之,蛋白质含量的预测效果最不理想。

a-水分含量模型的预测图;b-蛋白质含量模型的预测图;c-脂肪含量模型的预测图
图4 营养成分模型验证集的真实值与预测值的分布图
Fig.4 Distribution of true and predicted values of the nutrient content model validation set
3 结论
本研究以阿拉善双峰驼13个不同部位肉为实验样品,采用近红外光谱技术,结合PLS-DA,对驼肉中水分、蛋白质及脂肪含量进行了定性分析,建立了驼肉营养成分模型。结果表明,通过13个不同部位驼肉平均光谱不同这一特点可成功鉴别双峰驼不同部位的肉。与水分和蛋白质含量相比,近红外光谱技术更适合不同部位驼肉样脂肪含量的预测,模型的决定系数Rc2值最高、RMSEC值最小,模型预测能力较好。预测的水分和蛋白质含量的PLS-DA模型的性能有待进一步提高。因此,采用近红外光谱技术可以简便且准确地对不同部位驼肉样进行鉴别和营养成分的预测。
[1] 刘慧燕,方海田,纳文娟,等.阿拉善双峰驼宰后僵直前期肌肉物性变化及水分含量的研究[J].食品科技,2015,40(1):140-144.
LIU H Y,FANG H T,NA W J,et al.Water content and shear force of Alashan Bactrian camel muscle meat[J].Food science and Technology,2015,40(1):140-144.
[2] KURTU M Y.An assessment of the productivity for meat and the carcass yield of camels (Camelus dromedarius) and of the consumption of camel meat in the eastern region of Ethiopia[J].Tropical Animal Health &Production,2004,36(1):65-76.
[3] HERTRAMPF J W.The “ship of the desert”as a meat supplier[J].Fleisch wirtschaft Frankfurt,2004,84(12):111-114.
[4] 刘燕.双峰驼肉营养特性及可降解膜对驼肉保鲜效果的影响[D].呼和浩特:内蒙古农业大学,2017.
LIU Y.The nutrition characteristics and effect of biodegradable film on preservation of bactrian camel[D].Hohhot:Inner Mongolia Agricultural University,2017.
[5] 吉日木图,陈钢粮.骆驼产品与生物技术[M].北京:中国轻工业出版社,2014.
JI R M T.Camel Products and Biotechnology[M].Beijing:China Light Industry Press,2014.
[6] 金春爱,崔松焕,赵卉,等.不同部位梅花鹿鹿肉营养品质分析[J].食品工业科技,2020,41(14):276-286.
JIN C N,CUI S H,ZHAO H,et al.Nutritional quality analysis of different parts of sika deer venison[J].Science and Technology of Food Industry,2020,41(14):276-286.
[7] 孙永海,万鹏,于春生.基于BP神经网络的大米含水量近红外检测方法[J].中国粮油学报,2008,23(6):193-197.
SUN Y H,WAN P,YU C S.A near-infrared detection method of moisture content in rice based on BP neural network[J].Journal of The Chinese Cereals and Oils Association,2008,23(6):193-197.
[8] 王婉娇,王松磊,贺晓光,等.冷鲜羊肉冷藏时间和水分含量的高光谱无损检测[J].食品科学,2015,36(16):112-116.
WANG W J,WANG S L,HE X G,et al.Non-destructive detection of refrigerated time and moisture content in chilled mutton using hyperspectral imaging[J].Food Science,2015,36(16):112-116.
[9] GUPTA A,SHETH M.Chemical stability of cottonseed and groundnut oil used for frying bhajias and its sensory qualities[J].Journal of Microbiology,Biotechnology and Food Sciences,2015,4(3):198-202.
[10] 梁光月.近红外分析技术在食品检测中的应用进展[J].现代食品,2019(18):46-48.
LIANG G Y.Progress in the application of near-infrared analysis technology in food detection[J].Modern Food,2019(18):46-48.
[11] 谢玉荣,李强,王娇.红外光谱技术在食品检测中的应用[J].食品安全质量检测学报,2019,10(22):7 773-7 778.
XIE Y R,LI Q,WANG J.Application of infrared spectroscopy technology in food inspection[J].Journal of Food Safety and Quality Inspection,2019,10(22):7 773-7 778.
[12] 赵钜阳,姚恒喆,杨旻恪,等.冻藏猪肉在近红外光谱应用中的快速无损检测[J].肉类工业,2020(1):20-28.
ZHAO J Y,YAO H Z,YANG M K,et al.Rapid nondestructive testing of frozen pork by near-infrared spectroscopy[J] Meat Industry,2020(1):20-28.
[13] 谢安国.冷冻冷藏过程中猪肉的光谱特性研究及其品质的快速检测[D].广州:华南理工大学,2016.
XIE A G.Spectral characteristics of pork meat during the freezing process and cold storage and rapid detection of product quality[D].Guangzhou:South China University of Technology,2016.
[14] PRIETO N,ANDRÉS S,GIR LDEZ F J,et al.Potential use of near infrared reflectance spectroscopy (NIRS) for the estimation of chemical composition of oxen meat samples[J].Meat Science,2006,74(3):487-496.
LDEZ F J,et al.Potential use of near infrared reflectance spectroscopy (NIRS) for the estimation of chemical composition of oxen meat samples[J].Meat Science,2006,74(3):487-496.
[15] MABOOD F,JABEEN F,AHMED M,et al.Development of new NIR-spectroscopy method combined with multivariate analysis for detection of adulteration in camel milk with goat milk[J].Food Chemistry,2017,221:746-750.
[16] 冷拓.基于近红外和核磁共振技术的牛肉肉糜掺假和品质指标预测[D].南昌:南昌大学,2020.
LENG T.Beef meat adulteration and quality index prediction based on NIR and NMR technology[D].Nanchang:Nanchang University,2020.
[17] KAMRUZZAMAN M,MAKINO Y,OSHITA S,et al.Assessment of visible near-infrared hyperspectral imaging as a tool for detection of horsemeat adulteration in minced beef[J].Food and Bioprocess Technology,2015,8(5):1 054-1 062.
[18] ZHANG J,PAD R R,GAO W D,et al.Automatic detection of layout of color yarns of yarn-dyed fabric.Part 3:Double-System-mélange color fabrics[J].Color Research&Application,2017,42(2):250-260.
[19] 汪洋.双峰驼乳常规营养成分检测与NIR快速检测模型建立[D].呼和浩特:内蒙古农业大学,2020.
WANG Y.Determination on routine nutrients and establishing NIR rapid prediction model for bactrian camel milk[D].Hohhot:Inner Mongolia Agricultural University,2020.
[20] ![]() N,MART
N,MART NEZ-MAR
NEZ-MAR N A L,POLVILLO O,et al.Near infrared spectroscopy (NIRS) for the determination of the milk fat fatty acid profile of goats[J].Food Chemistry,2016,190:244-252.
N A L,POLVILLO O,et al.Near infrared spectroscopy (NIRS) for the determination of the milk fat fatty acid profile of goats[J].Food Chemistry,2016,190:244-252.
[21] SU REZ P L,SOLDADO A,GONZ
REZ P L,SOLDADO A,GONZ LEZ-ARROJO A,et al.Rapid on-site monitoring of fatty acid profile in raw milk using handheld near infrared sensor[J].Journal of Food Composition and Analysis,2018,70:1-8.
LEZ-ARROJO A,et al.Rapid on-site monitoring of fatty acid profile in raw milk using handheld near infrared sensor[J].Journal of Food Composition and Analysis,2018,70:1-8.
[22] 牛蕾.中国西门塔尔牛肉品质评定及其近红外快速检测方法研究[D].保定:河北农业大学,2011.
NIU L.Study on quality evaluation of Chinese simmental cattle and rapid determination of beef quality by near-infrared spectroscopy[D].Baoding:Hebei Agricultural University,2011.
[23] PEREIRA V D S,DE SOUSA FERNANDES D D,DE ![]() M C U,et al.Simultaneous determination of goat milk adulteration with cow milk and their fat and protein contents using NIR spectroscopy and PLS algorithms[J].LWT,2020,127:109427.
M C U,et al.Simultaneous determination of goat milk adulteration with cow milk and their fat and protein contents using NIR spectroscopy and PLS algorithms[J].LWT,2020,127:109427.