桑科植物桑Morus alba L.是常用的药食两用的植物,桑枝为桑的干燥嫩枝,味微苦,性平,归肝经[1]。桑枝是常用的中药材,常在春末夏初采收,去叶,晒干,或趁鲜切片后晒干。桑枝始载于《本草图经》,其中描述桑枝为“桑枝疗遍体风痒干燥,兼疗口干”;我国古代的其他本草著作中也有许多关于桑枝药用的典籍,如在《本草再新》中则记载桑枝“壮肺气,燥湿,滋肾水,通经”;在《本草备要》中记述桑枝“利关节,养津液,行水祛风”[2]。桑枝中含有丰富的生物活性物质,如生物碱类、黄酮类、核苷类,多糖类、挥发油类、氨基酸类[3-5]等。
众所周知,氨基酸是蛋白质的基本结构单元,是维持人体生命活动的重要营养成分,在人体生理病理过程中起到至关重要的作用,在人体激素以及酶类物质的合成过程中作为原料参与[6]。目前,对于桑枝的研究主要集中在黄酮类以及生物碱类等有效成分上,对于桑枝中氨基酸的研究鲜见报道。目前,氨基酸含量的检测方法有很多,主要有分光光度计法[7]、氨基酸自动分析仪法[8-10]、液相色谱-质谱串联法[11-13]、气相色谱法[14]以及高效液相色谱法[15],分光光度计法虽然操作简单方便,但是检测的氨基酸种类单一,只能检测单个类别的氨基酸,无法对氨基酸进行分离,具有一定的局限性[7]。氨基酸自动分析仪对氨基酸的测定具有专一性,但是分析时间长,价格昂贵,普及度不高。高效液相色谱法在几种测定方法中因具有高效、测定时间短、操作简单易上手、检测成本较低等特点,在实验室氨基酸检测中应用较为普遍。由于氨基酸本身没有发色基团,没有紫外吸收和荧光反应,需要对检测样品进行衍生化处理将其转化为具有紫外吸收和发射荧光的物质才能被仪器所检测到[16]。衍生化又分为柱前衍生和柱后衍生两种,柱前衍生是将样品在上机测定前进行衍生化,将氨基酸衍生化成适合超高效液相色谱所能检测的物质。柱后衍生是样品经过离子交换柱后分离,将分离后的氨基酸经过衍生化处理以便被仪器检测。目前柱前衍生以其方便快捷的优势被普遍使用,常用的衍生试剂有邻苯二甲醛、丹黄酰氯和异硫氰酸苯酯等[16-17]。
本研究以采自重庆不同区县的9个采样点、3个品种共计18批次的桑枝作为样本,参照黄小兰等[16]的实验方法,即异硫氰酸苯酯(phenyl isothiocyanate,PITC)柱前衍生,超高效液相色谱(ultra-high performance liquid chromatography,UPLC)法对这18批桑枝中17种氨基酸进行测定,并利用WPS、SPSS 26.0等软件进行氨基酸含量计算和主成分分析,以此比较出9个采样点、3个品种共计18批桑枝中氨基酸含量的差异,为桑枝的后期研究及利用提供理论数据依据及参考。
1 材料与方法
1.1 实验材料
桑枝分别采自重庆市不同区县的9个采样点、3个品种共计18批次,具体信息见表1。经重庆三峡学院生物与食品工程学院周浓教授鉴定为桑科植物。将采摘的新鲜桑枝洗净后切段,置于恒温鼓风干燥箱中45 ℃烘干至恒重,粉碎后过三号筛,备用。
表1 桑枝采样地点及品种信息
Table 1 Mulberry branch sampling location and variety information

序号品种采集地点序号品种采集地点S1华桑开州区临江镇 S10华桑云阳县双河镇 S2鸡桑开州区临江镇 S11鸡桑云阳县双河镇 S3鸡桑开州区大进镇 S12桑云阳县双河镇 S4鸡桑巴南区波澜镇 S13鸡桑北碚区西南大学 S5华桑巴南区波澜镇 S14鸡桑奉节县柏树村 S6鸡桑万州区分水镇 S15华桑奉节县柏树村 S7桑万州区分水镇 S16桑奉节县柏树村 S8鸡桑南岸区黄桷垭镇S17鸡桑万州区百安坝重庆三峡学院S9华桑南岸区黄桷垭镇S18桑万州区百安坝重庆三峡学院
1.2 实验试剂
盐酸、苯酚、冰醋酸(均为分析纯),成都科龙化工试剂厂;三乙胺(优级纯),成都科龙化工试剂厂;乙酸钠(分析纯),天津市光复科技发展有限公司;正己烷(色谱纯),天津市光复科技发展有限公司;PITC(纯度≥99%,蛋白测序级),上海麦克林生化科技有限公司;乙腈(色谱纯),德国麦克公司;实验用水,去离子超纯水。
氨基酸标准品为17种氨基酸混标,购于坛墨质检科技股份有限公司,具体信息如下:天冬氨酸(Asp)、谷氨酸(Glu)、丝氨酸(Ser)、甘氨酸(Gly)、组氨酸(His)、精氨酸(Arg)、苏氨酸(Thr)、丙氨酸(Ala)、脯氨酸(Pro)、酪氨酸(Tyr)、缬氨酸(Val)、甲硫氨酸(Met)、半胱氨酸(Cys)、异亮氨酸(Ile)、亮氨酸(Leu)、苯丙氨酸(Phe)、赖氨酸(Lys) (批号:BWT30 103-1-C-1,浓度:1.000 mmol/L)。
1.3 仪器与设备
BPG-9240A精密鼓风干燥箱,上海一恒科学仪器有限公司;3-30KS高速离心机,德国Sigma;MS 3 BS025涡旋混合器,德国IKA;Biotage Turbovap LV氮吹仪,瑞典Biotage;ME204T/02万分之一电子天平,梅特勒-托利多仪器有限公司;Waters UPLC ACQUITY CLASS UPLC超高效液相色谱仪,美国waters;Milli-Q Advantage A10超纯水机,美国Millipore。
1.4 实验方法
1.4.1 桑枝样品溶液的配制
1.4.1.1 桑枝样品的水解
本研究参照国家标准GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定方法》中的测定方法,准确称取制备好的桑枝样品粉末0.5 g(精确至0.000 1 g)于水解管中,加入6 mol/L盐酸溶液10 mL,向水解管中加入苯酚4滴并立即密封。将水解管放入110 ℃的电热鼓风恒温干燥箱内水解22 h后,取出,冷却至室温。打开水解管后,用纯水少量多次的冲洗残渣并转移至20 mL容量瓶中,加纯水定容,摇匀,离心后取上层桑枝水解液0.4 mL于氮吹管中,并于50 ℃水浴条件下氮吹至近干,加0.4 mL纯水复溶,备用。
1.4.1.2 氨基酸的衍生化处理
将1.4.1.1节复溶后的水解液全部转移至10 mL 离心管中,分别加入0.1 mol/L PITC-乙腈溶液和1.0 mol/L 三乙胺-乙腈溶液各0.2 mL,摇匀,于室温条件下静置1 h后,加入正己烷1 mL,涡旋振荡60 s,6 000 r/min冷冻离心5 min,萃取反应过剩的PITC,弃去上层正己烷,将下层溶液转移至2 mL容量瓶中,用纯水定容至刻度,经0.22 μm微孔水相滤膜过滤,待上机测定。
1.4.1.3 空白溶液的制备
取盐酸溶液(0.1 mol/L)0.4 mL置于10 mL离心管中,自“分别加入0.1 mol/L PITC-乙腈溶液和1.0 mol/L三乙胺-乙腈溶液各0.2 mL”起按照“1.4.1.2”进行衍生化处理,即得空白溶液。
1.4.2 标准溶液的配制
取17种混合氨基酸标准品储备液适量于10 mL离心管中,补充0.1 mol/L的盐酸至0.4 mL,与样品同法进行衍生化处理。
1.4.3 仪器方法
色谱柱:ACQUITY UPLC BEH C 18色谱柱(2.1 mm×150 mm,1.7 μm);检测波长:254 nm;柱温:40 ℃;进样量:1 μL;流速:0.2 mL/min;流动相:A为0.05 mol/L乙酸钠-乙腈(体积比为97∶3)溶液(冰醋酸调pH 6.5),B为80%的乙腈溶液,梯度洗脱,流动相梯度洗脱比例详见表2。
表2 梯度洗脱程序表
Table 2 Gradient elution program table
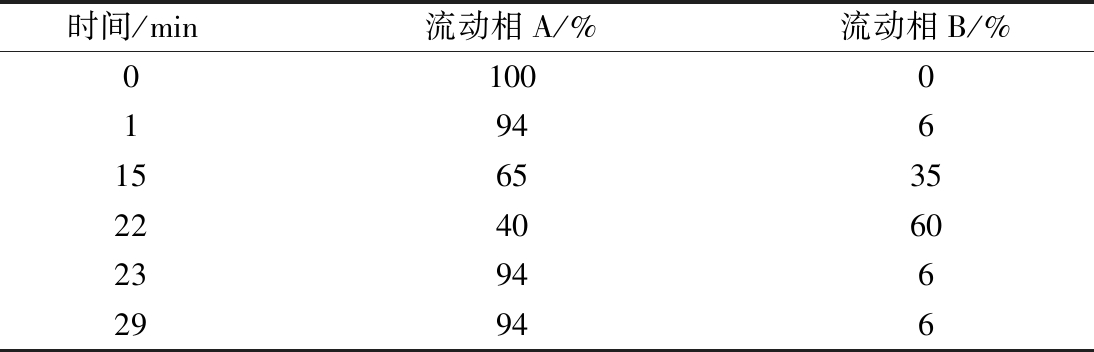
时间/min流动相A/%流动相B/%0100019461565352240602394629946
1.5 数据处理
采用WPS 表格软件对测得的数据进行处理,氨基酸含量以![]() 表示。采用SPSS 26.0软件对数据进行主成分分析。
表示。采用SPSS 26.0软件对数据进行主成分分析。
2 结果与分析
2.1 系统适用性
取衍生化后的标准品工作液和样品液,按照“1.4.3”中的仪器方法进行测定。结果表明,衍生化后的17种混合氨基酸标准品和样品的色谱峰峰形尖锐,分离度良好,如图1所示。可用于桑枝样品中氨基酸含量的测定。

1-天冬氨酸(Asp);2-谷氨酸(Glu);3-丝氨酸(Ser);4-甘氨酸(Gly);5-组氨酸(His);6-精氨酸(Arg);7-苏氨酸(Thr);8-丙氨酸(Ala);9-脯氨酸(Pro);10-酪氨酸(Tyr);11-缬氨酸(Val);12-甲硫氨酸(Mct);13-半胱氨酸(Cys);14-异亮氨酸(Ile);15-亮氨酸(Leu);16-苯丙氨酸(Phe);17-赖氨酸(Lys)
a-氨基酸标准品UPLC图谱;b-华桑(S1)UPLC图谱
图1 氨基酸标准品和华桑(S1)UPLC图谱
Fig.1 UPLC Chromatograms of amino acid standard and Warmulberry (S1)
2.2 氨基酸线性关系
取“1.4.2”中衍生化处理后的标准品系列工作液,过0.22 μm水相滤膜后按照“1.4.3”中的仪器方法进行含量的测定。以各个氨基酸标准品工作液的质量浓度(X)为横坐标,相应的峰面积(Y)为纵坐标,绘制标准曲线,得到线性回归方程,17种氨基酸的相关系数为0.997 9~0.999 9,结果表明,17种氨基酸在线性范围内线性关系良好,结果详见表3。
表3 17种氨基酸的标准曲线、线性范围、相关系数、仪器精密度和方法重复性
Table 3 Calibration curves,linear ranges,correlation coefficients,instrument precision and method repeatability for amino acids detected by UPLC
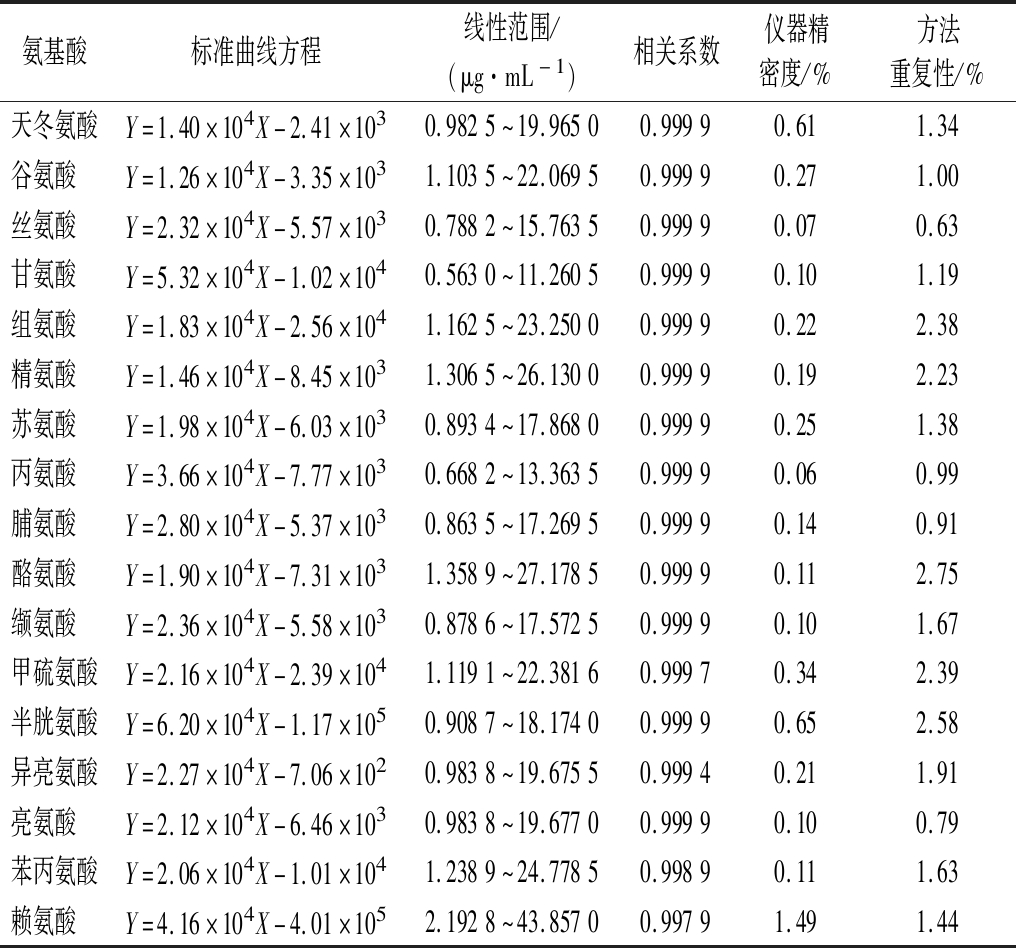
氨基酸标准曲线方程线性范围/(μg·mL-1)相关系数仪器精密度/%方法重复性/%天冬氨酸Y=1.40×104X-2.41×1030.9825~19.96500.99990.611.34谷氨酸 Y=1.26×104X-3.35×1031.1035~22.06950.99990.271.00丝氨酸 Y=2.32×104X-5.57×1030.7882~15.76350.99990.070.63甘氨酸 Y=5.32×104X-1.02×1040.5630~11.26050.99990.101.19组氨酸 Y=1.83×104X-2.56×1041.1625~23.25000.99990.222.38精氨酸 Y=1.46×104X-8.45×1031.3065~26.13000.99990.192.23苏氨酸 Y=1.98×104X-6.03×1030.8934~17.86800.99990.251.38丙氨酸 Y=3.66×104X-7.77×1030.6682~13.36350.99990.060.99脯氨酸 Y=2.80×104X-5.37×1030.8635~17.26950.99990.140.91酪氨酸 Y=1.90×104X-7.31×1031.3589~27.17850.99990.112.75缬氨酸 Y=2.36×104X-5.58×1030.8786~17.57250.99990.101.67甲硫氨酸Y=2.16×104X-2.39×1041.1191~22.38160.99970.342.39半胱氨酸Y=6.20×104X-1.17×1050.9087~18.17400.99990.652.58异亮氨酸Y=2.27×104X-7.06×1020.9838~19.67550.99940.211.91亮氨酸 Y=2.12×104X-6.46×1030.9838~19.67700.99990.100.79苯丙氨酸Y=2.06×104X-1.01×1041.2389~24.77850.99890.111.63赖氨酸 Y=4.16×104X-4.01×1052.1928~43.85700.99791.491.44
2.3 精密度实验
取同一浓度的混合标准品衍生液,按照“1.4.3”的仪器方法平行测定6次,记录17种氨基酸的峰面积,结果显示17种氨基酸峰面积的相对标准偏差RSD在0.06%~1.49%,均<2.00 %,表明仪器精密度良好,可用于本实验分析。
2.4 重复性实验
平行称取6份同一桑枝样品粉末(S2)0.5 g,按照“1.4.1”进行样品测试液的制备,制成6份样品测试液,按照“1.4.3”的仪器方法进行测定,记录17种氨基酸的峰面积,结果显示17种氨基酸峰面积对应的相对标准偏差在0.63%~2.75%,表明该方法的重复性较好,可用于桑枝样品中氨基酸的含量测定。
2.5 稳定性实验
取同一浓度的混合标准品衍生液,按照“1.4.3”的仪器方法每隔3 h测定1次,结果表明,17种氨基酸在24 h内的相对标准偏差在0.82 %~4.74 %,氨基酸衍生物在24 h内稳定性良好,超过24 h后,个别氨基酸相对标准偏差超过5.00 %,其中半胱氨酸降解较快,由此表明氨基酸的衍生物会随着时间的推移而发生降解,导致浓度下降。所以为了保证实验数据的准确性,建议桑枝样品在完成衍生化后的24 h内测定完毕。
2.6 桑枝中的17种氨基酸的含量测定
将18批桑枝样品按照“1.4.1”样品溶液的配制,每批样品平行3份,按照“1.4.3”中的仪器条件进行氨基酸含量测定,结果见表4。
表4 不同品种桑枝中的氨基酸含量(n=3) 单位:mg/g
Table 4 Amino acid content in mulberry branches of different varieties(n=3)

氨基酸S1S2S3S4S5S6S7S8S9S10S11S12S13S14S15S16S17S18平均值天冬氨酸4.86±0.0115.69±0.0065.14±0.0068.82±0.0095.04±0.0103.61±0.0126.17±0.0617.14±0.0367.30±0.0345.82±0.0165.63±0.0294.88±0.0115.12±0.0296.33±0.0654.45±0.0364.47±0.0145.85±0.0245.47±0.0185.66谷氨酸 6.11±0.0066.32±0.0166.22±0.0199.68±0.0135.75±0.0324.35±0.0077.65±0.0097.86±0.0246.65±0.0126.78±0.0176.34±0.0215.31±0.0125.50±0.0087.25±0.0065.41±0.0105.01±0.0066.43±0.0096.02±0.0106.37丝氨酸 3.03±0.0073.03±0.0133.04±0.0124.72±0.0122.93±0.0082.23±0.0283.67±0.0193.40±0.0102.97±0.0163.46±0.0073.01±0.0102.73±0.0092.73±0.0133.46±0.0302.63±0.0062.42±0.0203.18±0.0153.01±0.0043.09甘氨酸 2.41±0.0092.41±0.0112.46±0.0134.12±0.0072.33±0.0151.77±0.0153.22±0.0042.96±0.0042.47±0.0122.96±0.0062.51±0.0082.22±0.0092.65±0.0063.02±0.0112.19±0.0091.95±0.0182.67±0.0252.48±0.0152.60组氨酸 1.68±0.0081.73±0.0101.77±0.0112.93±0.0111.65±0.0171.28±0.0102.17±0.0101.97±0.0141.71±0.0021.93±0.0091.75±0.0161.49±0.0061.66±0.0152.04±0.0211.18±0.0201.16±0.0311.55±0.0321.36±0.0151.72精氨酸 3.770±0.0226.36±0.0137.72±0.01615.71±0.0133.94±0.0272.45±0.02710.37±0.01011.25±0.0227.77±0.0165.15±0.0125.65±0.0253.67±0.0243.96±0.0057.06±0.0143.04±0.0082.32±0.0193.55±0.0113.94±0.0095.98苏氨酸 2.56±0.0132.72±0.0092.76±0.0094.53±0.0062.53±0.0211.89±0.0103.47±0.0183.28±0.0122.79±0.0093.03±0.0102.71±0.0062.35±0.0112.32±0.0093.24±0.0102.21±0.0102.16±0.0152.77±0.0072.81±0.0092.78丙氨酸 2.81±0.0072.84±0.0073.02±0.0124.76±0.0122.65±0.0032.02±0.0063.68±0.0173.47±0.0143.22±0.0083.27±0.0182.87±0.0212.55±0.0022.84±0.0153.38±0.0102.46±0.0122.21±0.0102.92±0.0132.77±0.0142.99脯氨酸 8.17±0.0068.56±0.0117.86±0.01622.38±0.02411.44±0.0115.04±0.01119.81±.0117.66±0.0025.76±0.0089.27±0.0128.69±0.0098.62±0.01012.38±0.01013.66±0.0208.02±0.0059.25±0.00610.88±0.02211.44±0.01510.49酪氨酸 1.49±0.0051.48±0.0091.45±0.0112.66±0.0061.59±0.0091.04±0.0092.03±0.0091.78±0.0141.44±0.0111.79±0.0051.51±0.0081.35±0.0101.56±0.0031.84±0.0191.34±0.0141.23±0.0071.69±0.0051.58±0.0101.60缬氨酸 3.87±0.0043.86±0.0033.95±0.0096.47±0.0183.82±0.0072.87±0.0075.06±0.0104.52±0.0173.92±0.0144.54±0.0213.88±0.0163.52±0.0083.44±0.0244.43±0.0033.27±0.0103.03±0.0054.06±0.0093.80±0.0114.02甲硫氨酸0.26±0.0030.27±0.0250.28±0.0100.39±0.0070.26±0.0010.28±0.0010.34±0.0160.52±0.0180.27±0.0050.29±0.0110.29±0.0070.27±0.0090.81±0.0110.52±0.0060.42±0.0090.51±0.0110.55±0.0160.48±0.0110.39半胱氨酸0.43±0.0120.44±0.0100.43±0.0050.47±0.0090.47±0.0150.43±0.0120.46±0.0320.44±0.0130.44±0.0100.45±0.0300.47±0.0130.47±0.0130.44±0.0070.44±0.0090.45±0.0070.47±0.0170.47±0.0080.44±0.0030.45异亮氨酸3.13±0.0093.15±0.0053.21±0.0065.46±0.0383.34±0.0062.36±0.0244.31±0.0073.68±0.0193.23±0.0343.84±0.0293.22±0.0122.81±0.0092.97±0.0153.81±0.0252.75±0.0402.55±0.0113.42±0.0133.23±0.0163.36亮氨酸 5.67±0.0135.71±0.0065.84±0.0246.63±0.0155.83±0.0054.27±0.0207.56±0.0186.73±0.0155.84±0.0136.85±0.0085.81±0.0045.26±0.0155.86±0.0156.96±0.0115.11±0.0194.70±0.0036.33±0.0075.97±0.0215.94苯丙氨酸3.08±0.0043.13±0.0133.15±0.0075.32±0.0333.17±0.0102.29±0.0064.08±0.0193.64±0.0143.11±0.0153.61±0.0063.05±0.0122.79±0.0093.09±0.0103.65±0.0092.69±0.0082.52±0.0073.54±0.0183.22±0.0043.29赖氨酸 3.44±0.0183.81±0.0053.89±0.0096.65±0.0193.66±0.0312.92±0.0104.92±0.0124.37±0.0123.88±0.0074.23±0.0253.76±0.0373.46±0.0153.24±0.0253.31±0.0132.74±0.0252.72±0.0073.42±0.0063.18±0.0093.75总量 56.7861.5162.18111.7060.4041.0988.9674.6762.7667.2761.1653.7560.5574.3950.3748.7063.2961.1864.48
2.6.1 桑枝样品中氨基酸含量分析
对9个采样点、3个品种的18批桑枝进行氨基酸含量的检测后发现,在这18批桑枝样品中均检测出17种氨基酸,检测结果详见表4,由表得知,桑枝样品中氨基酸总量(total amino acid,TAA)为41.09~111.70 mg/g,平均含量为64.48 mg/g,18批桑枝样品在氨基酸总量上存在显著差异,其中氨基酸总量最多的为巴南区波澜镇的鸡桑,为111.70 mg/g,其次为万州区分水镇的桑,为88.96 mg/g,南岸区黄桷垭镇的鸡桑和奉节柏树村的鸡桑在氨基酸总量上结果相似,分别为74.67 mg/g和74.39 mg/g,氨基酸总量最低的为万州分水镇的鸡桑,只有41.09 mg/g。桑枝中测得的17种氨基酸中含量最高的为脯氨酸,为5.04~22.38 mg/g,平均含量为10.49 mg/g,占氨基酸总量的16.27%。其次为谷氨酸,含量为4.35~9.68 mg/g,平均含量为6.37 mg/g,占总氨基酸含量的9.88%;17种氨基酸中含量较低的氨基酸为半胱氨酸,含量为0.43~0.47 mg/g,平均含量为0.45 mg/g,仅占总氨基酸含量的0.70%。
桑枝中检测出7种人体必需氨基酸(essential amino-acid,EAA),必需氨基酸的总含量在16.88~35.45 mg/g,平均含量为23.53 mg/g。必需氨基酸含量由高到低为亮氨酸>缬氨酸>赖氨酸>异亮氨酸>苯丙氨酸>苏氨酸>甲硫氨酸,其中最高的亮氨酸平均含量为5.94 mg/g,占必需氨基酸总量高达25.24%,占氨基酸总量9.21%,在17种氨基酸中排第四。最低的甲硫氨酸含量为0.39 mg/g。占必需氨基酸总量的1.66 %,仅占氨基酸总量的0.60%。18批桑枝按必需氨基酸总量由高到低排序为S4、S7、S8、S10、S14、S17、S3、S9、S11、S18、S2、S5、S1、S13、S12、S15、S16、S6。18批桑枝样品中必需氨基酸总量占氨基酸总量(EAA/TAA)的31.74%~41.07%,平均值为36.92%。必需氨基酸总量与非必需氨基酸总量(EAA/NEAA)的百分比为46.50%~69.69%,平均值为58.70 %。与联合国粮食及农业组织/世界卫生组织标准中氨基酸理想模式的规定必需氨基酸与氨基酸总量比值为 40%和必需氨基酸与非必需氨基酸比值为60%[18]相差不大,结果表明桑枝中的氨基酸营养成分分布比较均匀。
18批桑枝中桑有4批,总氨基酸平均含量为63.15 mg/g,其中万州区分水镇的最高,为88.96 mg/g,奉节柏树村的最低,为48.70 mg/g;华桑有5批,总氨基酸平均含量为59.52 mg/g,其中云阳县双河镇的最高,为67.27 mg/g,奉节柏树村的最低,为50.37 mg/g;鸡桑有9批,总氨基酸平均含量为67.84 mg/g,其中巴南区波澜镇的最高,为111.70 mg/g,万州分水镇的最低,为41.09 mg/g。如表5所示,在这18批桑枝中,桑、鸡桑、华桑在17种氨基酸中,精氨酸、脯氨酸、甲硫氨酸这三种氨基酸之间含量存在较大差异,其余氨基酸差异不明显。结果显示三种品种桑枝虽然在总氨基酸含量上差别不大,均在60 mg/g左右,但是同一品种间根据采摘的地方不同而有较大的差异,这可能与采摘地的气候,土壤等有较大关系。
表5 不同品种桑枝氨基酸含量 单位:mg/g
Table 5 Amino acid content of mulberry branches of different varieties
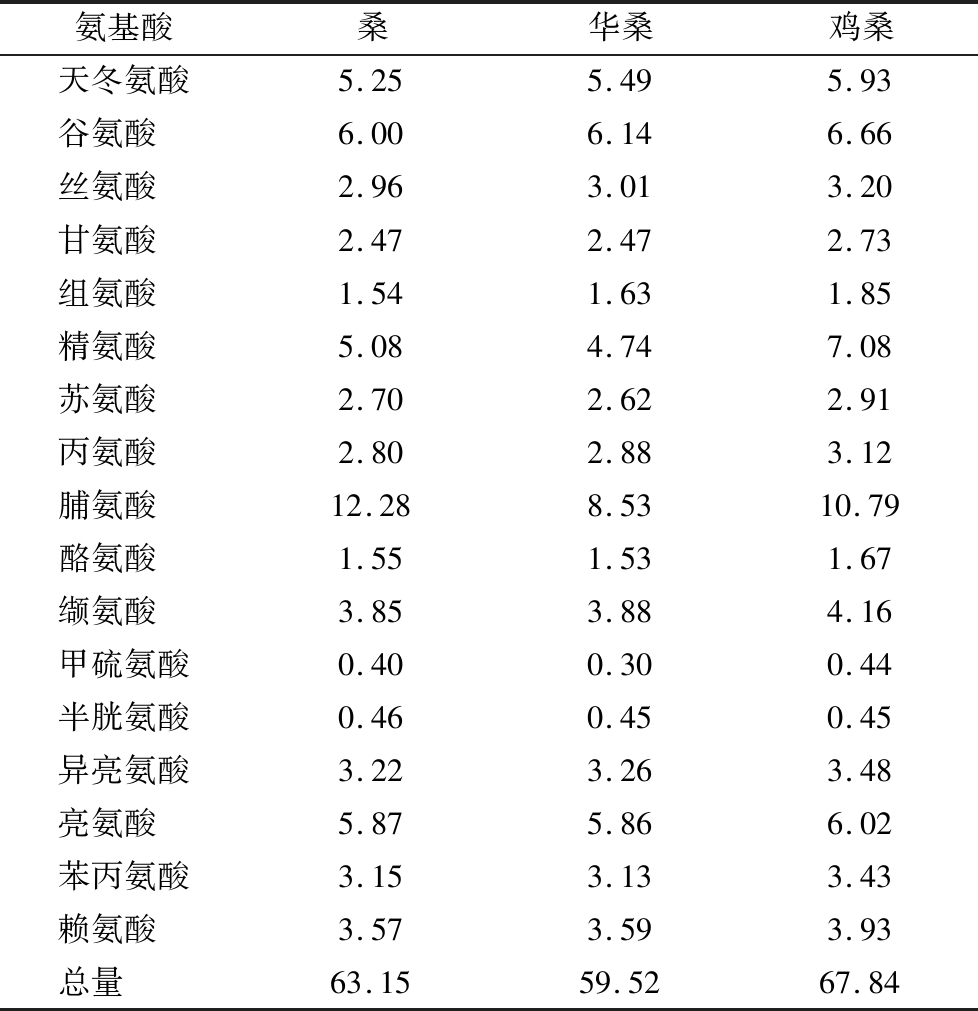
氨基酸桑华桑鸡桑天冬氨酸5.255.495.93谷氨酸 6.006.146.66丝氨酸 2.963.013.20甘氨酸 2.472.472.73组氨酸 1.541.631.85精氨酸 5.084.747.08苏氨酸 2.702.622.91丙氨酸 2.802.883.12脯氨酸 12.288.5310.79酪氨酸 1.551.531.67缬氨酸 3.853.884.16甲硫氨酸0.400.300.44半胱氨酸0.460.450.45异亮氨酸3.223.263.48亮氨酸 5.875.866.02苯丙氨酸3.153.133.43赖氨酸 3.573.593.93总量 63.1559.5267.84
桑枝中药用氨基酸种类丰富,有天冬氨酸、谷氨酸、甘氨酸、精氨酸、酪氨酸、甲硫氨酸、亮氨酸、苯丙氨酸和赖氨酸,总共9种。药用氨基酸总量在22.98~59.99 mg/g,平均含量为35.58 mg/g,占氨基酸总量的52.09%~61.94%,平均占比为55.21%,桑枝的药用氨基酸平均值与地参[16]一致。其中谷氨酸和精氨酸是桑枝中的主要药用氨基酸,分别占药用氨基酸总量的17.90%和16.81%。其中谷氨酸在人体内可与血氨作用解除人体内的氨毒,能起到保护肝脏的作用[19]。与此同时,谷氨酸在中枢神经中可以作为兴奋性的神经递质来介导神经信号的传导,能改善记忆和学习功能[20]。精氨酸能增加胰岛素的分泌,促进蛋白质的合成,使人体的免疫调节功能间接发挥作用,增强机体免疫功能[21]。所以,桑枝可作为药用氨基酸的补充剂,也可作为药用氨基酸提取的原料,增加了氨基酸提取原料的选择性。
2.6.2 主成分分析
采用SPSS 26.0 软件对18批桑枝中氨基酸组分进行主成分分析,特征值>1作为提取主成分的标准,从17种氨基酸组分中提取了3个主成分,特征值分别为13.496、1.211、1.097,方差贡献率为79.388%、7.124%、6.452%,累计贡献率为79.388%、86.512%、92.964%。结果详见表6。
表6 主成分分析
Table 6 Principal component analysis
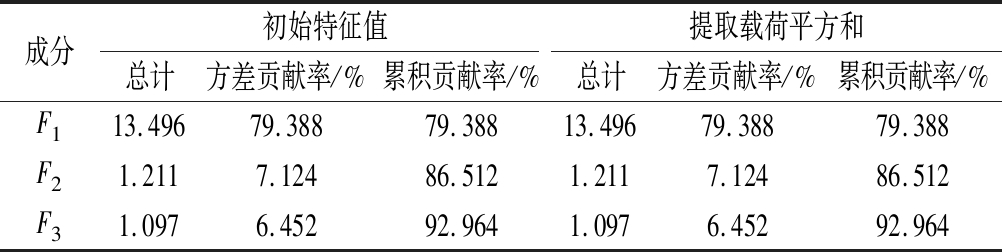
成分初始特征值提取载荷平方和总计方差贡献率/%累积贡献率/%总计方差贡献率/%累积贡献率/%F113.49679.38879.38813.49679.38879.388F21.2117.12486.5121.2117.12486.512F31.0976.45292.9641.0976.45292.964
将17种氨基酸的含量值标准化后所得到各个主成分的特征值进行开根号,将开根号所得到的值与表7中的系数向量值相乘,根据每个主成分对应的特征值占所提取主成分总特征值之和的比例作为权重得到主成分综合得分表达式为F=0.795F1+0.071F2+0.067F3,结合方程进行主成分综合得分计算,结果如表8所示。
表7 主成分系数向量值
Table 7 Vectors of principal components
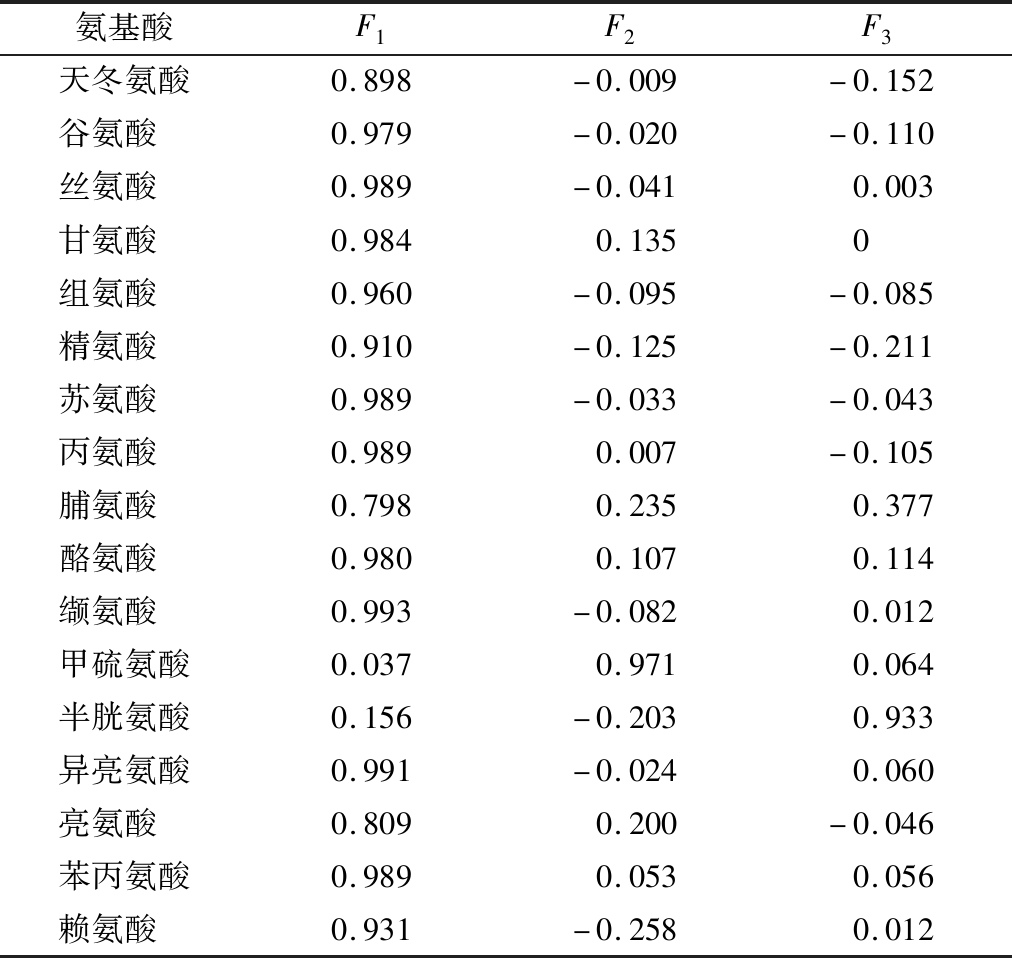
氨基酸F1F2F3天冬氨酸0.898-0.009-0.152谷氨酸 0.979-0.020-0.110丝氨酸 0.989-0.0410.003甘氨酸 0.9840.1350组氨酸 0.960-0.095-0.085精氨酸 0.910-0.125-0.211苏氨酸 0.989-0.033-0.043丙氨酸 0.9890.007-0.105脯氨酸 0.7980.2350.377酪氨酸 0.9800.1070.114缬氨酸 0.993-0.0820.012甲硫氨酸0.0370.9710.064半胱氨酸0.156-0.2030.933异亮氨酸0.991-0.0240.060亮氨酸 0.8090.200-0.046苯丙氨酸0.9890.0530.056赖氨酸 0.931-0.2580.012
表8 样品主成分得分和综合得分
Table 8 Principal component scores and comprehensive scores
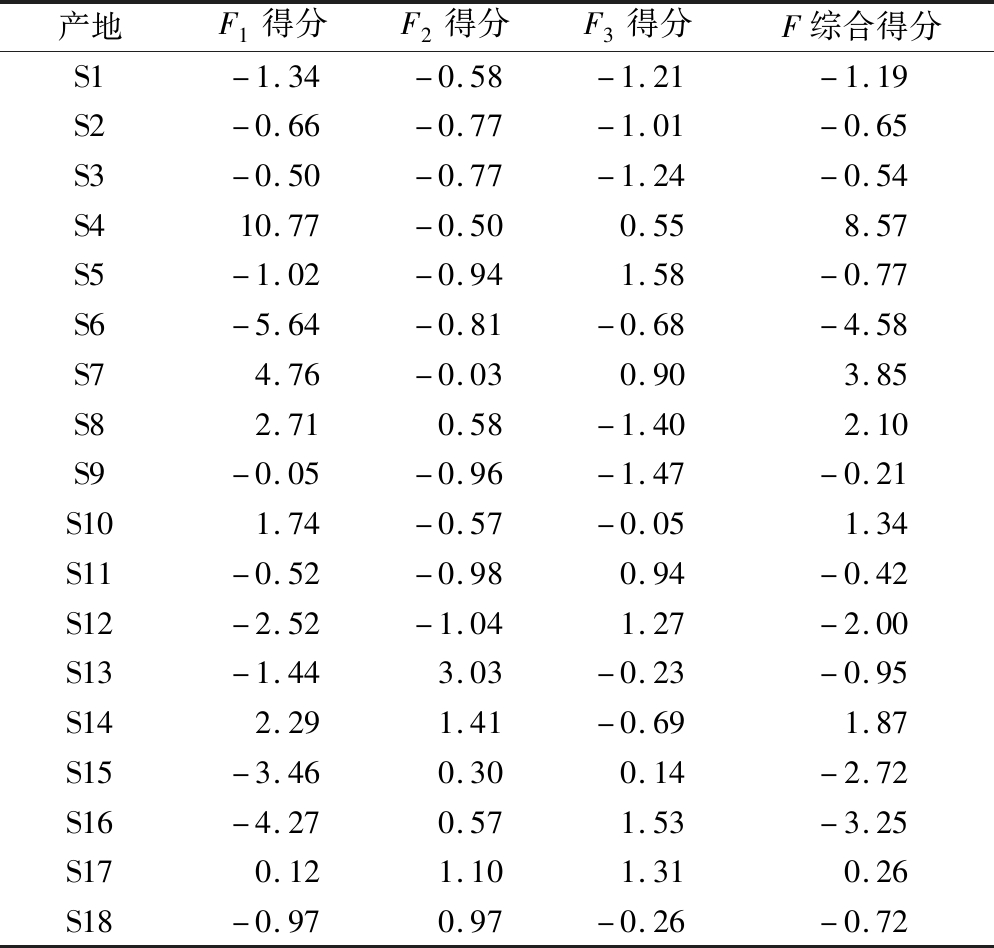
产地F1得分F2得分F3得分F综合得分S1-1.34-0.58-1.21-1.19S2-0.66-0.77-1.01-0.65S3-0.50-0.77-1.24-0.54S410.77-0.500.558.57S5-1.02-0.941.58-0.77S6-5.64-0.81-0.68-4.58S74.76-0.030.903.85S82.710.58-1.402.10S9-0.05-0.96-1.47-0.21S101.74-0.57-0.051.34S11-0.52-0.980.94-0.42S12-2.52-1.041.27-2.00S13-1.443.03-0.23-0.95S142.291.41-0.691.87S15-3.460.300.14-2.72S16-4.270.571.53-3.25S170.121.101.310.26S18-0.970.97-0.26-0.72
如表8所示,在第一主成分中,S4的得分最高;在第二主成分中,S13得分最高;在第三主成分中,S5得分最高。综合得分排序为S4>S7>S8>S14>S10>S17>S9>S11>S3>S2>S18>S5>S13>S1>S12>S15>S16>S6,其中最高的是巴南区波澜镇,综合得分有8.57,最低的为万州分水镇,综合得分为-4.58。表7中的F值表明,这18批桑枝中的氨基酸含量差异明显。
采用主成分分析法可用于区分不同品种桑枝氨基酸组分含量差异,可为桑枝中氨基酸评价及其开发提供理论基础。
3 结论与讨论
氨基酸作为蛋白质的基本组成单元,在人体中起着十分重要的作用,参与了多个代谢过程以及酶类物质的合成[6]。本试验采用超高效液相色谱仪法对采自重庆不同区县的3个品种、18批次桑枝的17种氨基酸含量进行测定,试验结果显示,18批桑枝样品中均检出17种氨基酸,总氨基酸平均含量为64.48 mg/g,表明桑枝中氨基酸含量较高。试验还发现,桑枝中药用氨基酸种类丰富,共含有9种药用氨基酸,平均总含量在35.58 mg/g,占氨基酸总量的52.09%~61.94%,平均占比55.21%,可用于制作氨基酸类药物。18批桑枝样品中必需氨基酸含量占氨基酸总含量的31.74%~41.07%,平均值为36.92%。必需氨基酸总量与非必需氨基酸总量的比值为46.50%~69.69%,平均值为58.70%,与联合国粮食及农业组织/世界卫生组织标准中氨基酸理想模式的规定必需氨基酸占氨基酸总量百分比40%和必需氨基酸与非必需氨基酸百分比60%[19]相差不大,表明桑枝中氨基酸成分分布比较均匀。对3个不同品种桑枝进行分析,结果显示3种品种桑枝虽然在总氨基酸含量上差别不大,均在60 mg/g左右,但同一品种间根据采样的地域不同而有较大的差异。在这18批桑枝中,桑、鸡桑、华桑3个品种中,精氨酸、脯氨酸、甲硫氨酸3种氨基酸含量存在较大差异,其余氨基酸差异不明显。桑树在三峡库区种植面积广泛,原料获取成本低。根据药用氨基酸的不同用量需求,提取氨基酸可选择不同品种的桑枝原料。
[1] 国家药典委员会.中华人民共和国药典——二部:2020年版[M].北京:中国医药科技出版社,2020:311.
Chinese Pharmacopoeia Commission.Chinese Pharmacopoeia[M].Beijing:China Medical:Science-Press,2020:311.
[2] 刘华瑜.桑皮粉添食对STZ诱导的糖尿病小鼠的预防和治疗作用[D].苏州:苏州大学,2016.
LIU H Y.In vivo preventive and hypoglycaemic effect of mulberry branch bark powder on STZ-induced diabetic mice[D].Suzhou:Soochow University,2016.
[3] 艾文,何厚洪,杜昕,等.桑枝化学成分的研究[J].中成药,2017,39(9):1 861-1 866.
AI W,HE H H,DU X,et al.Chemical constituents from the twigs of Morus alba[J].Chinese Traditional Patent Medicine,2017,39(9):1 861-1 866.
[4] 黎海灵,黄艳萍,周游,等.鸡桑、华桑和桑的根皮中7种核苷类成分的含量测定[J].食品工业科技,2021,42(19):298-306.
LI H L,HUANG Y P,ZHOU Y,et al.Determination of 7 nucleosides contents in cortex of Morus australis,Morus cathayana and Morus alba[J].Science and Technology of Food Industry,2021,42(19):298-306.
[5] 孙莲,赵岩,胡尔西丹·依麻木,等.气相色谱-质谱法分析桑枝挥发油的化学成分[J].国际药学研究杂志,2017,44(3):292-295.
SUN L,ZHAO Y,HUERXIDAN·Y M M,et al.Analysis of chemical composition of volatile oil in Ramulus Mori by GC-MS[J].Journal of International Pharmaceutical Research,2017,44(3):292-295.
[6] GUO M,SHI T,DUAN Y,et al.Investigation of amino acids in wolfberry fruit(Lycium barbarum) by solid-phase extraction and liquid chromatography with precolumn derivatization[J].Journal of Food Composition and Analysis,2015,42:84-90.
[7] 杨远帆,倪辉,吴黎明.茚三酮法测定蜂蜜及果葡糖浆中的氨基酸含量[J].中国食品学报,2013,13(2):171-176.
YANG Y F,NI H,WU L M.Determination of amino acid in honey and high fructose corn syrup(HFCS) by the method of ninhydrin colorization[J].Journal of Chinese Institute of Food Science and Technology,2013,13(2):171-176.
[8] 莫润宏,汤富彬,丁明,等.氨基酸分析仪法测定竹笋中游离氨基酸[J].化学通报,2012,75(12):1 126-1 131.
MO R H,TANG F B,DING M,et al.Determination of free amino acids in bamboo shoot by amino acids analyzer[J].Chemistry Bulletin,2012,75(12):1 126-1 131.
[9] 张苏平,邱伟强,卢祺,等.全自动氨基酸分析仪法测定4种贝类肌肉中谷胱甘肽和游离氨基酸含量[J].食品科学,2017,38(4):170-176.
ZHANG S P,QIU W Q,LU Q,et al.Determination of glutathione and free amino acids in muscles of four shellfish species by automatic amino acid analyzer[J].Food Science,2017,38(4):170-176.
[10] 苗雨田,杨悠悠,王浩,等.全自动氨基酸分析仪法测定不同年份黄酒中游离氨基酸的含量[J].食品安全质量检测学报,2015,6(4):1 154-1 161.
MIAO Y T,YANG Y Y,WANG H,et al.Determination of amino acids content in yellow rice wine of different years with automatic amino acid analyzer [J].Journal of Food Safety &Quality,2015,6(4):1 154-1 161.
[11] SONG C H,ZHANG S J,JI Z Y,et al.Accurate determination of amino acids in serum samples by liquid chromatography-tandem mass spectrometry using a stable isotope labeling strategy[J].Journal of Chromatographic Science,2015,53(9):1 536-1 541.
[12] 车兰兰.液相色谱及液质联用法测定三种山西特色食品中游离氨基酸[D].太原:山西大学,2013.
CHE L L.Determination of free amino acids in three kinds of special food in shanxi by liquid chromatography and liquid chromatography coupled to mass spectrometry[D].Taiyuan:Shanxi University,2013.
[13] 郭尚伟,周祥山,嵇传良,等.HPLC-MS/MS法测定阿胶、龟甲胶、鹿角胶中17种氨基酸含量[J].明胶科学与技术,2016,36(2):86-91.
GUO S W,ZHOU X S,JI C L,et al.The analysis of 17 amino acids in Colla cori asini,Colla carapacis et plastri testudinis,and Colla Cornus cervi by liquid chromatography tandem mass spectrometry[J].The Science and Technology of Gelatin,2016,36(2):86-91.
[14] KHUHAWAR M Y,MAJIDANO S A.GC analysis of amino acids using trifluoroacetylacetone and ethyl ychloroformate as derivatizing reagents in skin samples of psoriatic and arsenicsis patients[J].Chromatographia,2011,73(7-8):701-708.
[15] 唐翎,魏伟,赵勇.柱前衍生高效液相色谱测定猴头菌丝体中15种游离氨基酸的含量[J].中国药学杂志,2017,52(21):1 899-1 902.
TANG L,WEI W,ZHAO Y.Determination of free amino acids in Hericium erinaceus mycelium by HPLC with precolumn derivatization[J].Chinese Pharmaceutical Journal,2017,52(21):1 899-1 902.
[16] 黄小兰,何旭峰,杨勤,等.不同产地地参中17种氨基酸的测定与分析[J].食品科学,2021,42(2):255-261.
HUANG X L,HE X F,YANG Q,et al.Determination of 17 amino acids in the dried rhizome of Lycopus lucidus Turcz.var.hirtus regel from different habitats[J].Food Science,2021,42(2):255-261.
[17] ARRIET M P,PRATS-MOTA M S.Free amino acids and biogenic amines in Alicante Monastrell wines[J].Food Chemistry,2012,135(3):1 511-1 519.
[18] FAO/WHO.Energy and protein requirements[R].Geneva:World Health Organization,1973.
[19] CAULI O,RODRIGO R,LLANSOLA M,et al.Glutamatergic and gabaergic neurotransmission and neuronal circuits in hepatic encephalopathy[J].Metabolic Brain Disease,2009,24(1):69-80.
[20] 许凯,毕晶晶,张继昊.天然非蛋白氨基酸的生物活性机制研究进展[J].食品科学,2019,40(21):251-259.
XU K,BI J J,ZHANG J H.Bioactivity and mechanism of action of natural non-protein amino acids:A review of recent literature[J].Food Science,2019,40(21):251-259.
[21] 孙红暖,杨海明,王志跃,等.精氨酸对动物的营养生理及免疫作用[J].动物营养学报,2014,26(01):54-62.
SUN H N,YANG H M,WANG Z Y,et al.Nutrition physiological and immune functions of arginine in animals[J].Chinese Journal of Animal Nutrition,2014,26(1):54-62.