中国葡萄酒产业因地理位置和气候条件差异,目前已经形成了东北产区、山东产区、京津冀产区、新疆产区、河西走廊产区等十一大葡萄酒产区[1],不同产区的风土条件与所酿造葡萄酒的区域特色息息相关[2]。作为风土条件之一的微生物风土近年来受到越来越多研究者的重视[3-4],中国不同产区均开展了野生酵母资源的调查分析,并研究筛选优秀酵母菌株用于提升葡萄酒的风味特色[3,5-8]。目前已经商业化应用的中国本土野生酿酒酵母为CEC01和CECA,由刘延琳课题组筛选自宁夏和新疆葡萄酒产区。在产区野生酵母资源调查的基础上,进一步开发不同野生酵母资源对酿造中国不同产区特色葡萄酒具有重要意义。野生酵母资源商业化始于野生酵母资源的分离鉴定,需要全面分析其发酵特性(如糖代谢、乙醇代谢、絮凝性、嗜杀性和耐受性等)和酿造特色(如影响葡萄酒口感、香气、不良风味和安全性等的物质代谢),而优选的野生酵母完成商业化的最终分析因素为商业菌剂的加工研究[9-10],本文主要综述了野生酵母商业化研究需要分析的4个主要研究内容(图1),为中国优选野生酵母菌的商业化应用提供理论参考。

图1 野生酵母葡萄酒酿造商业化应用的分析因素
Fig.1 The factors involved in commercialization study of indigenous yeast applied in wine industry
1 野生酵母的分离鉴定研究
葡萄酒野生酵母大多分离自成熟葡萄果实或葡萄醪自然发酵过程中(图1),通过依赖于培养的分子鉴定技术可将分离出的野生酵母菌鉴定至菌种水平[3](如用WL培养基分离和初步鉴定酵母菌,并进一步采用26S rRNA基因序列分析和5.8S-ITS-RFLP分析开展菌种水平分子鉴定),通过不依赖于培养的高通量测序技术或实时定量PCR技术可快速获知不同酵母菌种(属)的相对丰度或菌群浓度[11]。部分研究采用特定筛选培养基分离获取目的野生酵母菌,如采用高乙醇培养基获取耐乙醇的酿酒酵母等。目前大部分野生酵母的显微形态和生理特征(主要指碳源同化和发酵能力、部分氮源同化和发酵能力、适宜培养温度等)已得到系统研究,分类鉴定序列特征(主要指26S rRNA的D1/D2基因序列和5.8S rRNA的ITS基因序列)较为清晰,倍性特征仅局限于酵母属酵母,非酵母属酵母的有性生殖数据相对较少[12-13]。依赖于培养的野生酵母分离鉴定研究是优良酵母菌商业化研究的首要步骤,为进一步筛选具有优良发酵特性和酿酒特色的野生酵母菌提供了丰富的酵母菌资源。
2 野生酵母的发酵特性研究
野生酵母的糖代谢能力和产酒精能力是其良好发酵力的保证,也是发酵特性研究中必要的筛选因素,而对嗜杀性和絮凝性等性能的研究有利于葡萄酒发酵过程中对不良微生物的控制以及葡萄酒的澄清,是满足葡萄酒质量的基本保证[14]。葡萄酒酒精发酵初期环境为高糖环境且大多进行了一定浓度的SO2处理,随着发酵的进行乙醇浓度逐渐提升,因此酒精发酵并非酵母菌最适宜的生长环境,具有优良发酵特性的酵母菌还需具备一定的发酵环境耐受性,从而更好地在发酵过程中发挥作用[15]。
2.1 糖代谢和产酒精能力研究
酵母菌的发酵力主要表征为糖代谢能力和产酒精能力,酿酒酵母主要将糖转化为乙醇,因此其糖代谢能力和产酒精能力相对一致,但对于非酵母属酵母而言,发酵完全主要表征为可将还原糖代谢至4 g/L以下,较高代谢副产物的生成导致其产酒精能力弱于酿酒酵母。
乙醇是葡萄酒中的重要成分,品尝时会带来灼热感,乙醇过高会掩盖葡萄酒的果香味,增强葡萄酒的干燥和粗糙感,乙醇过低则会使葡萄酒的口味不足,因此乙醇含量直接影响葡萄酒酒体结构的平衡。酵母菌产酒精能力可通过TTC培养基进行初步评价[14],大多数研究采用直接发酵并测量葡萄酒发酵液中乙醇含量的方式筛选具有优良产酒能力的酵母菌(密度瓶法、气相色谱法、酒精计法,GB 5009.225—2016)[16]。生物量生成、物质消耗和乙醇生成过程中热动力学参数的分析可为糖代谢和产酒精能力的评价提供定量化监测指标[17]。
全球气候变暖使部分产区成熟葡萄中糖含量升高,最终会导致葡萄酒中乙醇含量的提升,健康的生活理念以及某些国家以乙醇含量来定税使得葡萄酒降醇逐渐成为当今的研究热点。降醇策略一方面围绕酿酒酵母展开,通过筛选低产乙醇酿酒酵母(可降低1%vol及以上)或采用降低乙醇的发酵工艺如发酵初期通过短期通风促进酿酒酵母有氧呼吸作用等[18]。另一方面围绕非酵母属酵母展开,非酵母属酵母通过产生大量次级代谢产物和呼吸作用来降低葡萄酒中的乙醇含量[19],将非酿酒酵母与酿酒酵母共同接种发酵(同时接种或顺序接种)降低葡萄酒中乙醇的含量已成为一种战略性降醇手段[2]。
2.2 与发酵特性相关的絮凝性和嗜杀性等研究
1963年MAKOWER和BEVAN首次在酿酒酵母中发现了嗜杀因子,嗜杀因子是酵母菌分泌的蛋白质类抗菌化合物,可在发酵过程中部分代替SO2控制不良杂菌的生长。不同酵母菌分泌酵母毒素不同,因此对野生酵母的抑制具有菌株特异性[20],酿酒酵母嗜杀性多指其在美蓝培养基上表现出的对其他酿酒酵母产生的抑菌圈,近年来酿酒酵母还展现了其所产毒素对非酵母属酵母的生存抑制作用,但在美蓝培养基上酿酒酵母对非酵母属酵母大多不产生抑菌圈[20]。非酵母属酵母也可分泌毒素如假丝酵母中分离的CpKT1和CpKT2可抑制酒香酵母(Brettanomyces bruxellensis)的生长,但不影响酿酒酵母和乳酸菌的生长代谢[21]。酵母菌之间的相互抑制作用研究,有利于降低发酵过程中抑制杂菌所用SO2的添加量,从而促进健康、绿色葡萄酒的生产。
酵母菌在发酵中存在絮凝现象,主要是由酵母细胞表面存在的絮凝素与邻近酵母细胞壁上的甘露糖蛋白相互作用使细胞聚集造成的。具有絮凝性的酵母会在葡萄酒发酵过程中黏附成团沉降,絮凝性过高过早出现,会导致酵母菌因分散性差造成的发酵性能降低、糖消耗不完全和发酵时间延长等[22];絮凝性过低会导致发酵后期酵母细胞凝聚缓慢,不利于葡萄酒的过滤和澄清。酵母菌絮凝程度评价常根据Flo值的不同进行划分,当Flo在70%~100%时为低絮凝性,30%~70%属中絮凝性,而0~30%属高絮凝性,因此,具有合适絮凝性的优选酵母菌有利于葡萄酒酒精发酵的进行。
2.3 发酵环境耐受性研究
酵母菌在葡萄酒发酵过程中常需面对高糖、高乙醇、高SO2的环境挑战[23],如过高的糖浓度会抑制酵母菌的生长,且高渗环境会使细胞脱水[22],高酒精浓度会影响酵母菌的活性、发酵力和增殖速度等。酵母菌在胁迫环境下的生存能力和发酵力具有菌株差异,为保证葡萄酒发酵的顺利进行,常需筛选具有优良耐受性的酵母菌作为潜在商业酵母进行后续研究[15]。
葡萄醪中过高的糖浓度会通过阻遏作用抑制酵母菌生长,此外糖浓度较高时发酵液黏度较大,不利于CO2释放。目前研究报道中酿酒酵母具有较强的高糖耐受性,最高可耐受400~650 g/L的糖质量浓度。酵母的高糖耐受性研究主要通过检查含有不同葡萄糖浓度的YPD固体培养基上菌落生长情况、含有不同葡萄糖浓度的YPD液体培养基中细胞生长引起的OD值变化、或杜氏小管的产气量等方式开展[16]。目前暂未发现关于非酵母属酵母的高糖耐受性研究报道,但自然发酵初期的葡萄醪中往往存在大量的非酵母属酵母,间接证实了其高糖耐受性。
乙醇通过影响酵母细胞膜的流动性和对膜蛋白的毒性作用抑制酵母菌的发酵和生存[24],而在葡萄醪发酵过程中,乙醇浓度随发酵进行逐渐升高,因此优良酵母菌需具备一定浓度的乙醇耐受性。酵母菌的乙醇耐受性研究主要通过检查酵母菌在含有不同浓度乙醇的YPD液体培养基中的生长情况开展,通常认为在≥16%vol环境下能生存的菌株为乙醇耐受性良好的酵母菌。酿酒酵母的乙醇耐受性优于大部分非酵母属酵母,研究发现自然发酵早期存在的大部分非酵母属酵母具有较差的乙醇耐受性(<10%vol)。酵母菌的乙醇耐受性可通过环境适应性而增强,因此在筛选中若模拟酒精发酵过程逐渐增加乙醇浓度,非酵母属酵母可耐更高浓度的乙醇[25]。
在葡萄酒发酵过程中添加适量的SO2可起到抑菌、抗氧化、保护葡萄酒颜色等作用,其用量根据葡萄原料质量和所酿造葡萄酒类型而不同,葡萄质量较好时,添加量常为20~110 mg/L,葡萄质量较差时,添加量为70~150 mg/L。作为抑菌剂,一定浓度的SO2可杀死细菌和酵母菌等微生物,其中细菌对SO2最为敏感,其次是柠檬形克勒克酵母,抗性最强的为酿酒酵母[26]。目前报道的优良酿酒酵母对SO2耐受性高达300 mg/L[4]。
3 野生酵母的葡萄酒酿造特色研究
酵母菌通过对葡萄汁中主要营养成分(如糖和氮化合物)的代谢产生葡萄酒中丰富的风味物质(如高级醇、酯、有机酸、甘油、酮、硫挥发物等),影响葡萄酒的品质风格[7,9]。近年来非酵母属酵母对葡萄酒酿造特色塑造的积极作用逐渐被人们发掘和关注,通过控制酿酒酵母与非酵母属酵母的接种比例和接种顺序,验证了非酵母属酵母的葡萄酒酿造特色,如高产甘油、降低苹果酸等口感特性提升,增加香气复杂性,降低负面风味物质和有毒物质的生成等[2,27]。
3.1 口感特性研究
甘油是酵母菌酒精发酵的主要副产物之一,在葡萄酒中的含量为1~15 g/L,甜味阈值为5.2 g/L,研究表明甘油可改善葡萄酒的风味强度,增加黏度,抑制高乙醇含量带来的苦味、辣感和粗糙感,适当提高葡萄酒的甘油含量可使葡萄酒口感圆润,并增加口感复杂性[26]。甘油主要产生于酒精发酵前期,甘油的产生可平衡酵母细胞内的氧化还原电势,缓解高糖环境产生的渗透胁迫作用。目前酵母菌的产甘油能力研究主要通过检测发酵液中甘油含量的方式进行,甘油含量可通过试剂盒[28]、高锰酸钾褪色光度法、气相色谱法、变色酸法[29]、酶法、高效液相色谱法等方法检测。高产甘油的酵母菌发酵液中甘油含量应≥6 g/L[30],大部分酵母菌甘油产量随发酵温度升高而增加,因此进行甘油产量评价时需考虑不同发酵温度带来的影响[28]。
葡萄酒中主要的有机酸为酒石酸和苹果酸,来源于葡萄原料。葡萄酒酸度过低(<4.59 g/L,以酒石酸计),会使葡萄酒不清爽、不厚实、不稳定,且口感复杂性低等[31]。葡萄原料含酸量过低可选择产酸能力较好的酵母菌进行酒精发酵,马文瑞等[32]筛选出高产酸酵母菌Y6,酒精发酵过程中平均产酸量为1.69 g/L(以酒石酸计),主要产生的酸为酒石酸和苹果酸,可缓解新疆等产区葡萄原料高糖低酸的情况。葡萄酒酸度过高(主要是苹果酸含量过高),会带来酸涩、粗糙的不良口感,且苹果酸易被微生物利用,不利于葡萄酒稳定。裂殖酵母等降酸酵母可通过苹果酸酒精发酵分解75%~100%左右的苹果酸[33]。通过选择合适的酵母菌来酿葡萄酒,可适当增加或者降低葡萄酒的酸度。
3.2 香气复杂性研究
近年来相关研究表明酿酒酵母与非酵母属酵母的混合发酵可增加葡萄酒的香气复杂性,尤其是果味的增加,而与葡萄酒果味相关的香气化合物包含酯类、高级醇、挥发性硫醇等[34]。乙酸酯类化合物主要通过乙酰CoA与醇类物质在醇乙酰基转移酶的催化下形成,高级醇通过酵母菌的氨基酸代谢(Ehrlich途径)或糖代谢合成途径形成。乙酯类化合物主要通过酵母菌脂质代谢形成的中链脂肪酰CoA与乙醇在多种酰基转移酶的作用下由酶促酯化反应生成。酵母菌的产酯能力可初步通过酯酶培养基评价,但近年来相关研究大多直接研究发酵液中不同酯类物质的含量。由于发酵产生的乙酸乙酯、高级醇等香气化合物可在葡萄酒陈酿过程中进一步转化,因此不建议简单通过发酵液中香气物质含量筛选产香酵母。酵母菌分泌的酶(如糖苷酶和半胱氨酸裂合酶)还可促进葡萄浆果表皮中芳香前体物质的提取,使中性芳香化合物转变为活性芳香化合物,从而影响葡萄酒的香气结构[35]。糖苷酶可破坏萜类物质和葡萄糖间的共价键,从而将挥发性萜烯类化合物释放出来,增加葡萄酒香气;同样,半胱氨酸裂合酶将硫醇与半胱氨酸结合的形式中释放出来,赋予了葡萄酒西柚、柑橘等香气[9]。酵母菌产酶情况可通过定性和定量培养基进行初步筛选[35],近年来相关研究关注高产酶非酵母属酵母通过与酿酒酵母混合发酵对葡萄酒香气复杂性的影响[10,36]。
酵母自溶出现在发酵末期,是一个缓慢的过程,首先胞内结构发生重组,溶菌酶被激活,细胞的体积减小、黏度下降,然后胞内组分被水解并释放到胞外[23,37]。在水解酶的作用下,酵母菌的细胞质会释放出脂肪酸、多肽、氨基酸、核苷酸等物质,细胞壁会释放出甘露糖蛋白[9,38]。一些陈酿型白葡萄酒会通过酒泥陈酿方式获取酵母菌自溶释放的物质成分,从而增加风味复杂度[39]。酵母自溶释放的物质如多肽会影响起泡葡萄酒第二次发酵过程中的发泡特性,而甘露糖蛋白可抑制单宁的凝集、促进芳香化合物的保留、增加葡萄酒多糖成分、促进乳酸菌生长、抑制醋酸菌的生长、增加抗氧化性等。
3.3 风味缺陷研究
H2S是酒精发酵过程中常见的代谢副产物,在葡萄酒中的含量约为1 μg/L,具有臭鸡蛋气味、挥发性强、阈值低(11~80 μg/L),因此含量过高会造成葡萄酒风味缺陷[40],H2S还可衍生为其他挥发性硫化合物如乙硫醇等使葡萄酒呈现腐烂卷心菜、烧焦的橡皮、蒜臭味等其他不良气味。低产或不产H2S酵母菌可改善酒精发酵过程中硫代谢引起的不良风味。酵母菌的产H2S能力可通过发酵或液体培养中的硫化氢检测管、醋酸铅还原法等进行评价,BIGGY培养基也常用于表征酵母菌产H2S的能力[41]。目前研究报道的不产H2S野生酿酒酵母只有1株,为UCD932[40],因此筛选不产或低产H2S酿酒酵母是葡萄酒酿造酵母商业化应用的主要研究内容之一,目前尚无非酵母属酵母H2S代谢的相关报道。
3.4 降低毒素等安全研究
酵母菌的精氨酸代谢起始于精氨酸酶将精氨酸水解为尿素和鸟氨酸的过程(图2)。尿素可与乙醇反应生成氨基甲酸乙酯,氨基甲酸乙酯为致癌物质,1985年加拿大政府的卫生与福利组织规定佐餐葡萄酒中氨基甲酸乙酯含量不得超过30 μg/L[42],2002年联合国粮食及农业组织规定葡萄酒中氨基甲酸乙酯含量不得超过20 μg/L,食品中不得超过25 μg/L[43],中国目前未明确限制葡萄酒中氨基甲酸乙酯的含量,但明确了氨基甲酸乙酯的标准检测方法(GB 5009.223—2014)。由于尿素是酵母代谢产生氨基甲酸乙酯的主要前体物质[42],因此低产尿素酵母菌的筛选有益于降低葡萄酒中的氨基甲酸乙酯含量。部分非酵母属酵母具有脲酶活性,可将精氨酸代谢产生的尿素分解为二氧化碳和氨气,避免尿素生成氨基甲酸乙酯。研究表明,部分酿酒酵母能够生产氨基甲酸乙酯水解酶,可将氨基甲酸乙酯水解为乙醇和氨从而降低其含量[44]。由于尿素与乙醇反应生成氨基甲酸乙酯的过程可在陈酿过程中缓慢进行,因此发酵过程中氨基甲酸乙酯水解酶的作用相较于脲酶降低尿素的作用来说,后者更有利于降低葡萄酒中的氨基甲酸乙酯(图2)。
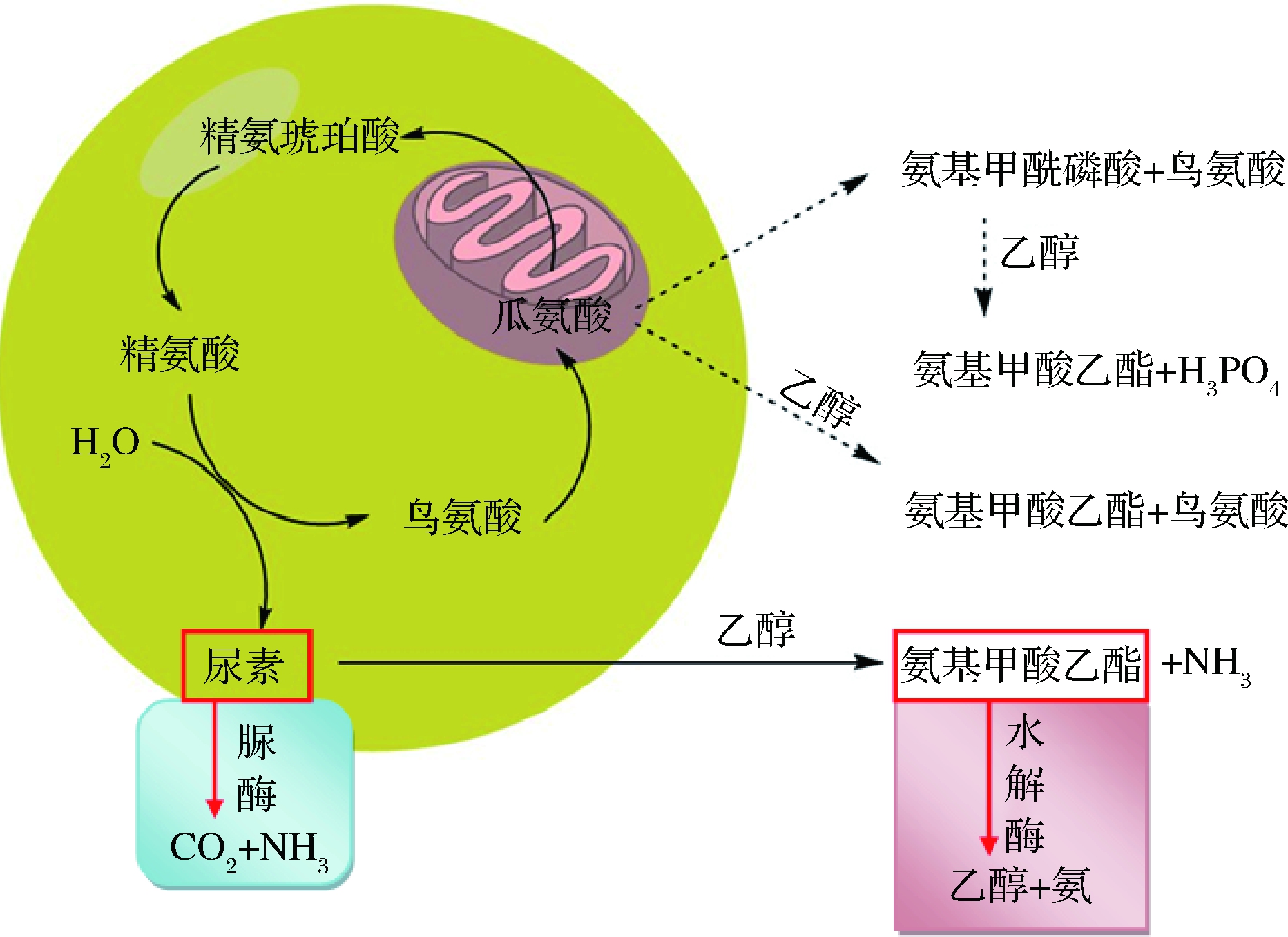
图2 氨基甲酸乙酯酵母菌合成和分解途径[43,45]
Fig.2 Ethyl carbonate synthesis and decomposition pathway in yeast
葡萄表面受败坏性真菌侵染会产生赭曲霉毒素等真菌毒素,这些真菌毒素可能伴随酿造过程进入葡萄酒中,赭曲霉毒素为致癌物质,欧盟委员会提议其在葡萄酒中的含量不应超过2 mg/L。相关研究表明部分酵母菌对赭曲霉毒素具有一定的去除作用,可通过筛选具有良好去除赭曲霉毒素效果的酵母菌作为发酵剂,减少葡萄酒中赭曲霉毒素的含量[42,46]。
4 酵母菌商业化生产的分析因素
野生酵母经分离鉴定、发酵特性分析、酿造特色分析后,所筛选的优良野生酵母还需分析其是否可通过商业菌剂的方式投入葡萄酒工业生产[9]。目前主要应用的商业菌剂为活性干酵母,自1964年起在美国开始应用于葡萄酒工业,80年代初期在中国应用于葡萄酒酿造行业中。加工成型的活性干酵母直径约为0.5~2 mm,通过真空包装方式可保持1年以上的酵母活性[47]。酵母菌在活性干酵母制备过程中,所用营养物质常为糖蜜,糖蜜中缺乏氮源和维生素,因此酵母菌需具有较强的营养底物适应性[48],酵母菌通过逐级扩大培养,最后转至发酵罐培养,经过离心收集、水洗、挤压成型、干燥等过程制成活性干酵母,葡萄酒酿造时经活化后应用于葡萄汁的发酵。活性干酵母制作过程需要酵母菌具有耐干燥(水分含量<5.5%)、耐饥饿、活性强、再吸水活化时发酵力强等特点[9,47],酵母细胞内碳水化合物(如海藻糖)和蛋白质的含量与酵母菌耐干燥和再吸水活化时的发酵力相关,一般蛋白质含量高则发酵力强,而碳水化合物含量高则耐干燥性能强[47]。研究表明,高温钝化培养方案适合活性干酵母的制作,具体指在13 h的培养周期中,从第9 h开始每小时增加2 ℃培养温度,最终可获取较高的酵母细胞生物量、干物质含量和胞内海藻糖含量[49]。部分非酵母属酵母加工耐受性弱于酿酒酵母,因此虽然商业化非酵母属酵母仍大多加工为活性干酵母,国际酵母市场也出现了膏状酵母、活性冷冻酵母和胶囊封装酵母等新型加工菌剂[50],如意大利BioEnologia公司开发的四种非酵母属酵母菌种(Starmerella bacillaris、Schizosaccharomyces pombe、Pichia kluyveri、Kazachastania servazzii)的膏状酵母、葡萄牙Proenol公司开发的S.pombe胶囊封装酵母。目前中国葡萄酒酿造市场暂无本土特色非酵母属酵母商业化产品和新型加工菌剂产品。
5 结语
由于全球气候变暖对葡萄酒行业的挑战和消费者观念的改变,当今葡萄酒更趋向具有区域特色化、风味复杂性、低醇、低硫和健康特色。酵母菌作为葡萄酒酿造风格质量的主导微生物,其代谢特点直接影响所产葡萄酒的风味。因此,筛选中国不同产区特有的酿酒酵母和非酵母属酵母,并进一步进行酿造特色和商业化菌剂加工因素分析,运用商业化中国特色酵母菌将成为酿造具有中国不同区域特色葡萄酒的主流趋势。除单一酵母菌种商业化制剂外,优选酿酒酵母与非酵母属酵母混合加工制剂的开发与应用,将为中国不同区域特色葡萄酒的酿造提供重要的发酵辅料来源。目前具有中国不同产区特色的野生酵母菌资源正在不断得到研究与挖掘,然而关于商业化菌剂加工的研究较少,膏状酵母等新型加工菌剂的采用可为更多优质葡萄酒酵母的商业化应用提供新的思路。
[1] 谢喜麟.中国葡萄酒产区分布及气候变化对其影响分析:以东北产区为例[D].杨凌:西北农林科技大学,2018.
XIE X L.Study on status of wine regions in China and impact of climate change on it-take north east for example[D].Yangling:Northwest A&F University,2018.
[2] COMITINI F,CAPECE A,CIANI M,et al.New insights on the use of wine yeasts[J].Current Opinion in Food Science,2017,13:44-49.
[3] WANG C X,WU C Y,QIU S Y.Yeast diversity investigation of Vitis davidii Föex during spontaneous fermentations using culture-dependent and high-throughput sequencing approaches[J].Food Research International,2019,126:108582.
[4] 杨金仙,吴成,王春晓,等.贵州紫云刺葡萄自然发酵中野生酿酒酵母基因型多样性分析[J].微生物学报,2021,61(11):3 431-3 443.
YANG J X,WU C,WANG C X,et al.Genotype diversity analysis of indigenous Saccharomyces cerevisiae during spontaneous fermentations of Vitis davidii Foex in Ziyun,Guizhou[J].Acta Microbiologica Sinica,2021,61(11):3 431-3 443.
[5] WANG C X,LIU Y L.Dynamic study of yeast species and Saccharomyces cerevisiae strains during the spontaneous fermentations of Muscat Blanc in Jingyang,China[J].Food Microbiology,2013,33(2):172-177.
[6] HAN X Y,QING X,YANG S Y,et al.Study on the diversity of non-Saccharomyces yeasts in Chinese wine regions and their potential in improving wine aroma by β-glucosidase activity analyses[J].Food Chemistry,2021,360:129886.
[7] ZHANG P Z,ZHANG R G,SIRISENA S,et al.Beta-glucosidase activity of wine yeasts and its impacts on wine volatiles and phenolics:A mini-review[J].Food Microbiology,2021,100:103859.
[8] HONG M N,LI J,CHEN Y W,et al.Impact of mixed non-Saccharomyces yeast during fermentation on volatile aroma compounds of Vidal blanc icewine[J].LWT,2021,145:111342.
[9] FLEET G H.Wine yeasts for the future[J].FEMS Yeast Research,2008,8(7):979-995.
[10] 闫兴敏,姜娇,高辉,等.优良本土酿酒酵母的酿酒特性及产香能力初析[J].食品与发酵工业,2022,48(4):62-68.
YAN X M,JIANG J,GAO H,et al.Oenological properties of superior indigenous Saccharomyces cerevisiae and preliminary investigation on their production of volatile compounds[J].Food and Fermentation Industries,2022,48(4):62-68.
[11] 吴成,王春晓,王晓丹,等.高通量测序技术在酿酒微生物多样性研究中的应用[J].食品科学,2019,40(3):348-355.
WU C,WANG C X,WANG X D,et al.A review of the application of high-throughput sequencing technology in analysis of the diversity of microbial communities involved in the fermentation of alcoholic beverages[J].Food Science,2019,40(3):348-355.
[12] MASNEUF-POMAREDE I,BELY M,MARULLO P,et al.The genetics of non-conventional wine yeasts:Current knowledge and future challenges[J].Frontiers in Microbiology,2016,6:1563.
[13] 梁树英,王春晓.基于倍性的葡萄酒相关酵母酿造特性研究进展[J].食品与发酵科技,2022,58(01):121-130.
LIANG S Y,WANG C X.Research progress in wine-making characteristic of wine-related yeast based on ploidy[J].Food and Fermentation Science &Technology,2022,58(01):121-130.
[14] 刘宁.本土酿酒酵母对葡萄酒质量的影响及优良菌株的筛选[D].杨凌:西北农林科技大学,2015.
LIU N.Effect of indigenous Saccharomyces cerevisiae strains on wine quality and strain selection[D].Yangling:Northwest A&F University,2015.
[15] FERREIRA D,GALEOTE V,SANCHEZ I,et al.Yeast multi-stress resistance and lag-phase characterization during wine fermentation[J].FEMS Yeast Research,2017,17(6).DOI:10.1093/femsyr/fox051.
[16] 凌云.昌黎葡萄酒产区酿酒葡萄果表酿酒酵母的分离及发酵性能[D].杨凌:西北农林科技大学,2016.
LING Y.Study on screening and fermentation characteristics of yeast strains from wine grape skin in Changli region[D].Yangling:Northwest A&F University,2016.
[17] NIETO-SARABIA V L,BALLINAS-CESATTI C B,MELGAR-LALANNE G,et al.Isolation,identification,and kinetic and thermodynamic characterization of a Pichia kudriavzevii yeast strain capable of fermentation[J].Food and Bioproducts Processing,2022,131:109-124.
[18] TRONCHONI J,GONZALEZ R,GUINDAL A M,et al.Exploring the suitability of Saccharomyces cerevisiae strains for winemaking under aerobic conditions[J].Food Microbiology,2022,101:103 893.
[19] QUIR S M,ROJAS V,GONZALEZ R,et al.Selection of non-Saccharomyces yeast strains for reducing alcohol levels in wine by sugar respiration[J].International Journal of Food Microbiology,2014,181:85-91.
S M,ROJAS V,GONZALEZ R,et al.Selection of non-Saccharomyces yeast strains for reducing alcohol levels in wine by sugar respiration[J].International Journal of Food Microbiology,2014,181:85-91.
[20] WANG C X,MAS A,ESTEVE-ZARZOSO B.The Interaction between Saccharomyces cerevisiae and non-Saccharomyces yeast during alcoholic fermentation is species and strain specific[J].Frontiers in Microbiology,2016,7:502.
[21] MEHLOMAKULU N N,SETATI M E,DIVOL B.Characterization of novel killer toxins secreted by wine-related non-Saccharomyces yeasts and their action on Brettanomyces spp.[J].International Journal of Food Microbiology,2014,188:83-91.
[22] 张仟伟.优良酿酒酵母菌株的筛选与培育[D].郑州:河南工业大学,2016.
ZHANG Q W.Screening and cultivation of fine Saccharomyces cerevisiae[D].Zhengzhou:Henan University of Technology,2016.
[23] ZUZUARREGUI A,DEL OLMO M.Analyses of stress resistance under laboratory conditions constitute a suitable criterion for wine yeast selection[J].Antonie Van Leeuwenhoek,2004,85(4):271-280.
[24] NOVO M,GONZALEZ R,BERTRAN E,et al.Improved fermentation kinetics by wine yeast strains evolved under ethanol stress[J].LWT -Food Science and Technology,2014,58(1):166-172.
[25] WANG C X,MAS A,ESTEVE-ZARZOSO B.Interaction between Hanseniaspora uvarum and Saccharomyces cerevisiae during alcoholic fermentation[J].International Journal of Food Microbiology,2015,206:67-74.
[26] 李华,王华,袁春龙,等.葡萄酒化学[M].北京:科学出版社,2005.
LI H,WANG H,YUAN C,et al.Wine Chemistry[M].Beijing:Science Press,2005.
[27] TORRES-GUARDADO R,ESTEVE-ZARZOSO B,REGUANT C,et al.Microbial interactions in alcoholic beverages[J].International Microbiology,2021,25(1):1-15.
[28] 周文亚,杨金仙,梁树英,等.酒精发酵温度对不同酿酒酵母菌株甘油产量的影响研究[J].食品与发酵科技,2022,58(1):15-22.
ZHOU W Y,YANG J X,LIANG S Y,et al.Study on the effect of alcohol fermentation temperature on glycerol yield of different Saccharomyces cerevisiae strains[J].Food and Fermentation Science &Technology,2022,58(1):15-22.
[29] 诸葛斌,钱秀梅,方慧英,等.甘油发酵液中甘油含量的快速测定方法[J].食品与发酵工业,2004,30(8):101-103.
ZHUGE B,QIAN X M,FANG H Y,et al.Study on quick determination of glycerol in fermented broth[J].Food and Fermentation Industries,2004,30(8):101-103.
[30] 宫雪,江璐,刘宁,等.高产甘油低产H2S葡萄酒优良酵母菌株筛选及其酿酒特性[J].食品科学,2015,36(19):132-136.
GONG X,JIANG L,LIU N,et al.Screening and evaluation of yeast strains for producing wine higher in glycerol and lower in hydrogen sulphide[J].Food Science,2015,36(19):132-136.
[31] 李华,王华,袁春龙,等.葡萄酒工艺学[M].北京:科学出版社,2007:48.
LI H,WANG H,YUAN C,et al.Wine Technology[M].Beijing:Science Press,2007:48.
[32] 马文瑞,魏玉洁,邹弯,等.新疆葡萄酒高产酸酿酒酵母菌的筛选和发酵条件优化[J].食品与发酵工业,2017,43(7):134-140.
MA W R,WEI Y J,ZOU W,et al.Screening of high-yielding acid yeast strains in Xinjiang wine producing regions and optimization of fermentation conditions[J].Food and Fermentation Industries,2017,43(7):134-140.
[33] 赵美,田秀,李敏,等.粟酒裂殖酵母与酿酒酵母共同接种发酵对“黑比诺”干红葡萄酒品质的影响[J].食品科学,2021,42(24):108-116.
ZHAO M,TIAN X,LI M,et al.Effect of mixed culture fermentation with Schizosaccharomyces pombe and Saccharomyces cerevisiae on the quality of‘pinot noir’dry red wine[J].Food Science,2021,42(24):108-116.
[34] RICHTER C L,DUNN B,SHERLOCK G,et al.Comparative metabolic footprinting of a large number of commercial wine yeast strains in Chardonnay fermentations[J].FEMS Yeast Research,2013,13(4):394-410.
[35] MATURANO Y P,RODR GUEZ ASSAF L A,TORO M E,et al.Multi-enzyme production by pure and mixed cultures of Saccharomyces and non-Saccharomyces yeasts during wine fermentation[J].International Journal of Food Microbiology,2012,155(1-2):43-50.
GUEZ ASSAF L A,TORO M E,et al.Multi-enzyme production by pure and mixed cultures of Saccharomyces and non-Saccharomyces yeasts during wine fermentation[J].International Journal of Food Microbiology,2012,155(1-2):43-50.
[36] 夏鸿川,张众,孙丽君,等.混菌发酵对贺兰山东麓‘赤霞珠’干红葡萄酒香气的影响[J/OL].食品科学,2022.https://kn s.cnki.net/kcms/detail/11.2206.TS.20210927.2304.024.html.
XIA H,ZHANG Z,SUN L,et al.Effects of mixed fermentation on the aroma compounds of‘Cabernet Sauvignon’dry red wine in eastern foothill of Helan mountain[J/OL].Food Science,2002.https://kn s.cnki.net/kcms/detail/11.2206.TS.20210927.2304.024.html.
[37] 刘晓燕,张小月,阿卜杜喀依尔·阿卜杜艾尼,等.混菌发酵、酒泥陈酿结合β-葡聚糖酶对赤霞珠干红葡萄酒有机酸含量的影响[J/OL].食品与发酵工业,2002.https://doi.org/10.13995/j.cnk i.11 -1802/ts.030073.
LIU X,ZHANG X,ABUDUOKAYIER A,et al.Effects of mixed fermentation,wine lees aging combined with β-glucanase on organic acid content of Cabernet Sauvignon dry red wine[J/OL].Food and Fermentation Industries,2022.https://doi.org/10.13995/j.cnk i.11 -1802/ts.030073.
[38] ECHEVERRIGARAY S,SCARIOT F J,MENEGOTTO M,et al.Anthocyanin adsorption by Saccharomyces cerevisiae during wine fermentation is associated to the loss of yeast cell wall/membrane integrity[J].International Journal of Food Microbiology,2020,314:108383.
[39] 朴美子,滕刚,李静媛.葡萄酒工艺学[M].北京:化学工业出版社,2020:82.
PU M Z,TENG G,LI J.Wine Technology[M].Beijing:Chemical Industry Press,2020:82.
[40] WANG C X,LIU M L,LI Y,et al.Hydrogen sulfide synthesis in native Saccharomyces cerevisiae strains during alcoholic fermentations[J].Food Microbiology,2018,70:206-213.
[41] ![]() grapes[J].World Journal of Microbiology &Biotechnology,2010,26(8):1 483-1 489.
grapes[J].World Journal of Microbiology &Biotechnology,2010,26(8):1 483-1 489.
[42] MECA G,BLAIOTTA G,RITIENI A.Reduction of ochratoxin A during the fermentation of Italian red wine Moscato[J].Food Control,2010,21(4):579-583.
[43] 刘洋,李运奎,韩富亮,等.葡萄酒中氨基甲酸乙酯的研究进展[J].食品科学,2019,40(7):289-295.
LIU Y,LI Y K,HAN F L,et al.Ethyl carbamate in wine:A review[J].Food Science,2019,40(7):289-295.
[44] 申鹏森,田争福,田晓菊,等.一株降解氨基甲酸乙酯酿酒酵母菌的筛选及鉴定[J].食品与发酵工业,2022,48(9):20-25.
SHEN P S,TIAN Z F,TIAN X J,et al.Screening and identification of a Saccharomyces cerevisiae strain degrading ethyl carbamate[J].Food and Fermentation Industries,2022,48(9):20-25.
[45] BENITO,CALDER N F,BENITO.The influence of non-Saccharomyces species on wine fermentation quality parameters[J].Fermentation,2019,5(3):54.
N F,BENITO.The influence of non-Saccharomyces species on wine fermentation quality parameters[J].Fermentation,2019,5(3):54.
[46] WANG B S,TAN F L,CHU R C,et al.The effect of non-Saccharomycesyeasts on biogenic amines in wine[J].Trends in Food Science &Technology,2021,116:1 029-1 040.
[47] 莫湘筠,黄玲,万宁.葡萄酒活性干酵母的研究Ⅰ.葡萄酒活性干酵母的生产和应用[J].食品与发酵工业,1989,15(5):22-32.
MO X Y,HUANG L,WAN N.Studies on active dry wine yeast Ⅰ.Production and application of active dry wine yeast[J].Food and Fermentation Industries,1989,15(5):22-32.
[48] MATALLANA E,ARANDA A.Biotechnological impact of stress response on wine yeast[J].Letters in Applied Microbiology,2017,64(2):103-110.
[49] 苏畅.葡萄酒活性干酵母的研究[D].天津:天津科技大学,2004.
SU C.Study on wine active dry yeast[D].Tianjin:Tianjin University of Science &Technology,2004.
[50] CASAS-GODOY L,ARELLANO-PLAZA M,KIRCHMAYR M,et al.Preservation of non-Saccharomyces yeasts:Current technologies and challenges[J].Comprehensive Reviews in Food Science and Food Safety,2021,20(4):3 464-3 503.