肉类是一种营养丰富的食物,可提供高生物价值的蛋白质和锌、硒、铁和磷等矿物质,在人类饮食中一直占据重要地位。尽管其营养丰富,但食用高脂肪加工肉制品与心血管疾病及癌症风险增加有关,这促使消费者更倾向于选择低脂健康的功能性肉制品[1]。研究者们常在肉制品中加入有益健康的天然功能性成分,在丰富产品营养的同时增加有益的生理功能[2]。
菊粉作为一种富集益生元成分的膳食纤维,已被世界40多个国家批准为食品的营养增补剂,一方面具有改善肠道微环境、抗氧化作用和抗菌作用等生理功能,另一方面菊粉主要用于替代脂肪或糖类以改善低脂食物的质地[3]。本文重点综述了菊粉的功能特性及其在肉制品中的应用研究,以期为提高菊粉的利用价值和开发功能性肉制品提供理论依据。
1 菊粉概述
1.1 菊粉的来源
菊粉广泛存在于水果和蔬菜中,主要来源于单子叶和双子叶科,如百合科、石蒜科和菊科,常见来源为菊苣、菊芋、韭菜、洋葱、大蒜、芦笋和香蕉等植物[4]。其中菊苣中的菊粉含量很高,是提取菊粉的重要来源,一般鲜菊苣含菊粉68%,干菊苣中菊粉含量高达98%[5]。菊苣是一种高产药食两用植物,隶属菊科,大多种植于温带地区,广泛分布于亚洲和欧洲,因其含有如生物碱、香豆素、类黄酮、菊粉、不饱和甾醇和维生素等营养物质,具有很高的药用价值[6]。菊苣因其高菊粉含量、对季节不敏感和易种植等特性成为工业生产中最主要的菊粉来源[7]。不同植物来源的菊粉含量见表1[4-5]。
表1 不同植物源的菊粉含量
Table 1 Inulin content of different plant sources
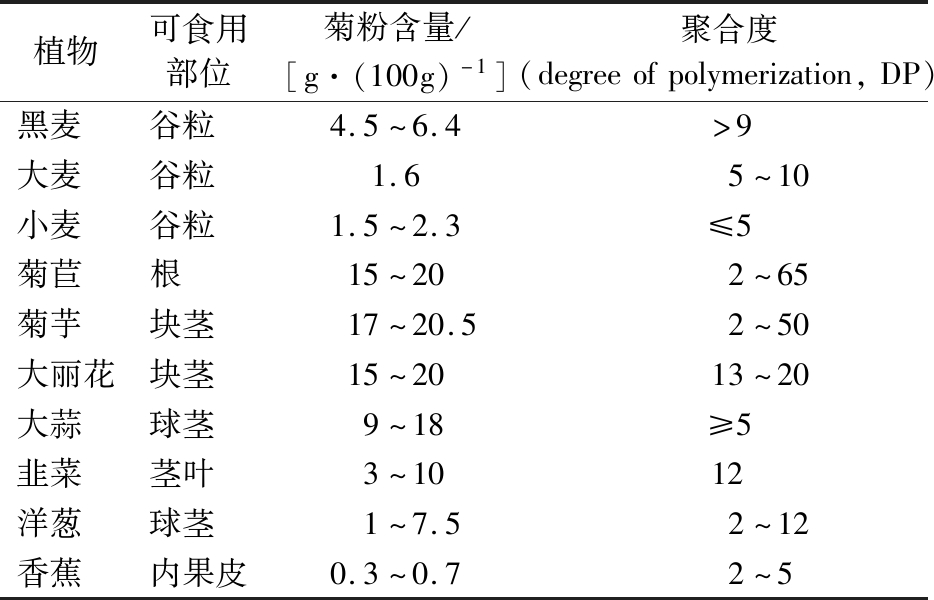
植物可食用部位菊粉含量/[g·(100g)-1]聚合度(degreeofpolymerization,DP)黑麦 谷粒 4.5~6.4>9大麦 谷粒 1.65~10小麦 谷粒 1.5~2.3≤5菊苣 根 15~202~65菊芋 块茎 17~20.52~50大丽花块茎 15~2013~20大蒜 球茎 9~18≥5韭菜 茎叶 3~1012洋葱 球茎 1~7.52~12香蕉 内果皮0.3~0.72~5
1.2 菊粉的结构
菊粉分子是由D-呋喃果糖分子以β(2→1)键连接而成的线性直链多糖,葡萄糖分子常位于每个果糖链的末端[8]。菊粉的DP为2~60,根据聚合度大小分为短链菊粉(DP 2~5)、中链菊粉(DP 6~10)和长链菊粉(DP 11~60)[9]。菊粉的分子式表示为GFn,其中G代表终端葡萄糖单元,F代表果糖分子,n代表果糖单元数。菊糖的一般分子结构如图1所示。
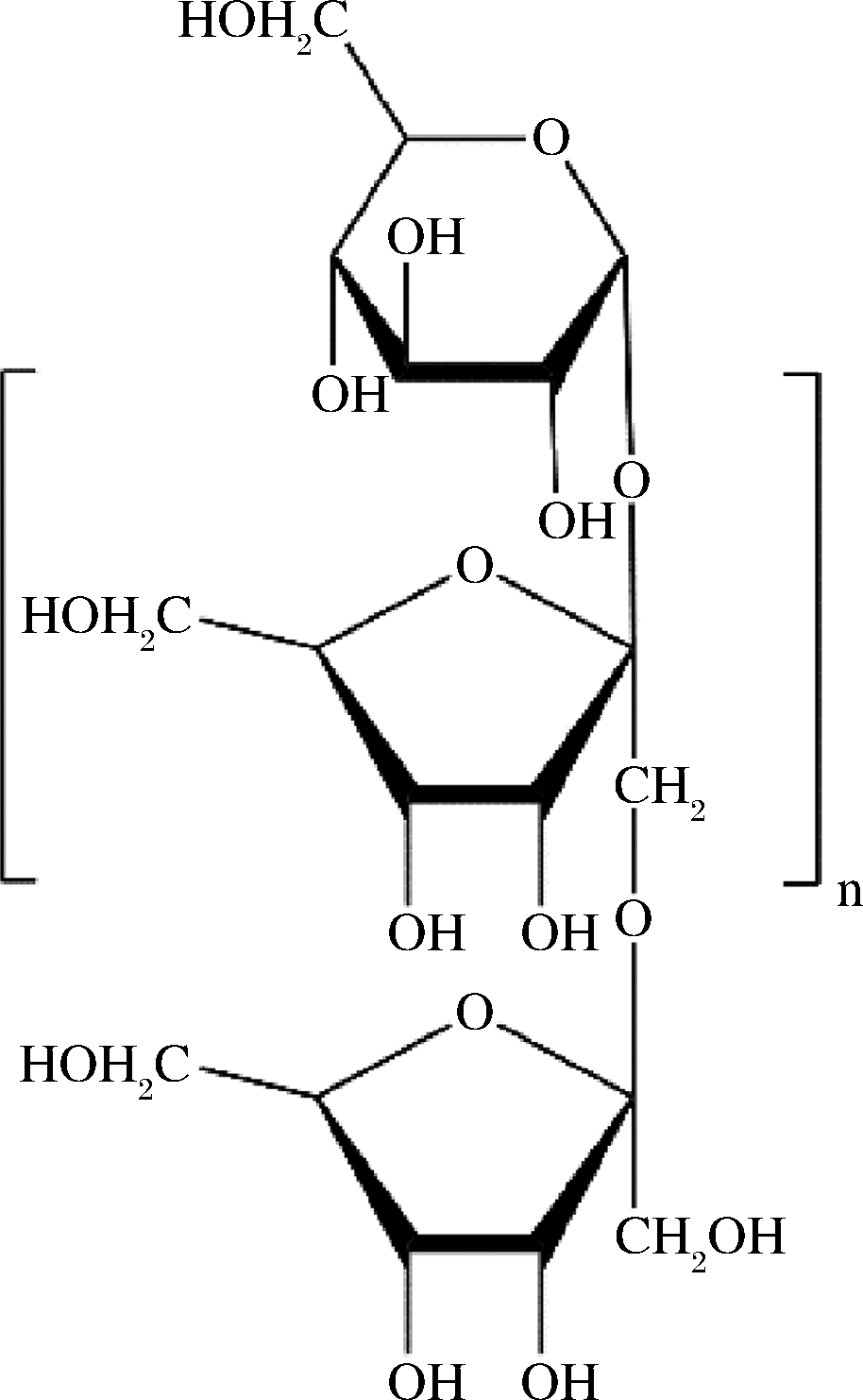
图1 菊粉的结构(n=2~60)
Fig.1 Structure of inulin(n=2-60)
根据DP的不同,菊粉型果聚糖基本上可分为低聚果糖和菊糖两大类,其聚合度分别为3~10和11~60[9]。DP和分支的存在是影响菊粉功能性的重要属性,包括溶解性、热稳定性、甜度和益生菌活性[7]。长链菊粉DP高,比天然菊粉耐热难溶,黏性更大;高度支化的菊糖聚合物更易溶于水,会形成奶油般光滑的凝胶,改变食品质地,并提供脂肪般的口感[10]。由于果糖单体中β(2→1)键的存在,菊粉多糖可以抵抗人体消化道中消化酶的水解,不会像典型的碳水化合物一样被消化[1]。因此,菊粉型果聚糖是不可消化的碳水化合物,可用作脂肪替代物。
1.3 菊粉的生产工艺
由于菊粉在食品、医药等行业应用广泛,对其提取分离的研究一直受到广泛关注。菊粉生产的主要原材料是菊苣和菊芋,主要流程包括提取、纯化和干燥[8]。图2详细说明了生产菊粉的主要流程[9]。

图2 生产菊粉的主要流程
Fig.2 Main process of inulin production
1.3.1 提取
菊粉可溶于水,其溶解度随着温度的升高而增加。热水扩散萃取法因其操作简单和产量高而广受欢迎,因此工业上常采用热水浸提的方法提取菊粉[11]。萃取过程中的提取温度、时间和溶液pH是影响提取率的主要因素,特别是pH的控制,当pH降到约6.0时,菊粉对酸性水解很敏感[12]。但普遍的热水提取法需要较高的提取温度和较长的提取时间,为克服这些问题,研究者们引入了非常规的菊粉提取方法,如酶辅助提取、超声波辅助提取、微波辅助提取、超临界流体提取和脉冲电场辅助提取等,使得菊粉提取过程具有更短的浸提时间、更高的产量和纯度[11]。
酶辅助提取的目的是降解植物细胞壁,以促进扩散过程,加快整个提取进程。NI等[13]使用具有高热稳定性的新型菊糖蔗糖酶JV-V16处理蔗糖,显示出高转果糖基化能力,在优化条件pH 6.0和45 ℃情况下,600 g/L蔗糖可以得到278.4 g/L菊粉,其提取率为46%。酶辅助提取虽然能够提高提取率,但其处理温度一般较高,因此对酶的热稳定性要求较高而具有一定的局限性。而超声波辅助提取是利用超声波在液体介质中的压力波动引起的空化现象,加速植物细胞壁的破坏,达到在不加热的前提下也能够加强萃取、加强传质、减少处理时间的效果[11]。MORO等[14]对牛蒡根辅助超声波处理发现增加超声振幅和时间可以提高菊粉提取效率。新型萃取技术的应用大大缩短了菊粉处理时间,提升了菊粉的生产效率。
1.3.2 纯化
菊粉提取的过程中会产生大量杂质,使其进一步的纯化变得必不可少,纯化过程包括澄清过滤、脱盐和脱色[8]。首先,粗提取物通过细布过滤以除去不溶性残留物,然后通过脱盐和脱色去除小分子杂质。脱盐主要是使用离子交换树脂去除菊粉糖浆中的矿物质,如钠离子、钾离子和镁离子[7]。脱色过程主要是用活性炭完成,EI-KHOLY等[15]将木炭粉加入到菊粉滤液中,并用玻璃棒在60 ℃下搅拌15~30 min以除去着色物质。但活性炭孔径较大,通常会导致过多的样品损失,而大孔树脂脱色法因其脱色损失小、处理量大和脱色效率高而逐渐受到重视[16]。
1.3.3 干燥
纯化后要使菊粉从溶液中析出。由于菊粉不溶于有机试剂,实验室通常使用一些有机试剂来沉淀菊粉,如乙醇、丙醇、丙酮和乙腈等[8]。有机试剂沉淀菊粉会保留菊粉的天然结构,但成本过高且不环保,因此寻找天然环保的低成本沉淀剂尤为重要[17]。沉淀析出后开始菊粉的回收,将沉淀的菊粉置于真空干燥箱中去除多余溶剂,然后在冷冻干燥机中干燥24 h后研磨成粉即可[15]。也可以通过将纯化后的菊粉精制液降膜蒸发浓缩后进行喷雾干燥而得到较高纯度的菊粉[18]。
2 菊粉的功能特性
2.1 菊粉作为膳食纤维的作用
膳食纤维是改善人类健康的关键成分,它的基本特征是:不被小肠内源酶水解的碳水化合物,对人体消化酶的水解和小肠的吸收具有抵抗力,但部分会被结肠中的有益菌发酵[19]。菊粉作为一种水溶性膳食纤维进入大肠后,在上肠粘膜没有发生任何消化作用,但在结肠中会被有益微生物发酵产生短链脂肪酸,如醋酸盐、丙酸盐和丁酸盐,抑制糖的异生作用,减少血浆中的游离脂肪酸含量,增强胰岛素抗性,不会影响血液中的血糖和胰岛素含量[20]。ZOU等[21]研究发现富含菊粉但不含其他纤维素的饮食可有效预防链脲佐菌素诱发的糖尿病,并能使胰腺功能正常化,显著增强胰岛素敏感性。AVIRINENI等[22]研究了蛋白质与纤维素或益生元菊粉对能量平衡和肠道微生物群的影响,发现富含菊粉的饮食部分通过胆囊收缩素促进饱腹感,并控制血糖和减少体重增加。而肉制品本身缺乏膳食纤维,因此,在今后的研究中可以通过将菊粉添加到肉类产品中来提高肉制品的膳食纤维和实现菊粉的功能价值。
2.2 菊粉作为益生元的作用
益生元是一种不可消化的食品成分,它通过选择性地刺激有限数量的已存在于结肠中的细菌而提高其生长活性,对宿主产生有益影响,从而改变宿主的健康[23]。一种物质要被视为具有益生元效应,其成分必须满足以下特定要求:(1)对胃酸的耐受性;(2)通过胃肠道微生物群发酵的能力;(3)选择性刺激与健康有关的肠道细菌生长的能力[19]。菊粉就是一种能够抗胃酸和防止上消化道吸收的碳水化合物,它可以通过增加乳酸杆菌和双歧杆菌的数量和代谢活性来改善肠道微生物平衡,从而抑制病原微生物的生长[24]。菊粉还会通过厌氧肠道微生物群发酵产生短链脂肪酸被结肠粘膜捕获,为宿主提供重要的能量补充,如醋酸盐、丙酸盐和丁酸盐[25]。醋酸盐通常在肾脏、心脏、大脑和肌肉中代谢;丙酸盐作为葡萄糖生成的前体,阻止胆固醇合成并被肝脏清除;丁酸盐作用于结肠上皮细胞,在细胞分化和调节中起着重要作用[26]。菊粉满足作为益生元的上述3种要求,因此在本质上是一种益生元。AVIRINENI等[22]研究发现菊粉益生元会改变肠道微生物群组成,增加短链脂肪酸的产生和饱腹感激素的分泌,包括胆囊收缩素、胰高血糖素样肽-1和肽YY激素等。HOFFMAN等[27]研究发现喂食富含8%菊粉饮食的高血脂症小鼠会减轻促炎性疾病的严重程度,菊粉通过调节肠道微生物使小鼠免受3,3,4,4,5-五氯联苯的促炎毒性作用。
2.3 菊粉的抗氧化作用
氧化作用是一个重要的为身体提供能量的生物过程,然而人体正常代谢过程中不可避免地会产生一系列活性氧,主要以超氧阴离子自由基、羟自由基及其活性衍生物等自由基的形式存在[28]。抗氧化剂是一类直接或间接减少自由基和抑制氧化的化学物质。菊粉作为一种植物多糖具有很好的抗氧化活性,其发酵产物短链脂肪酸可以诱导谷胱甘肽硫转移酶来抗氧化应激,因此菊粉可以清除活性氧并预防与其相关的疾病[29]。YANG等[30]研究发现含有菊粉的饮食通过抑制血清丙氨酸转氨酶、天冬氨酸转氨酶和γ-谷氨酰转氨酶的活性显示出保肝作用,并同时发挥降低胆固醇的作用。菊粉对抗氧化反应的调节是激活核因子E2相关因子2信号通路并上调抗氧化基因的表达,同时抑制了Toll样受体4的信号通路和促炎细胞因子的转录水平[30]。因此,含有菊粉的饮食可以通过提高抗氧化能力、抑制炎症反应和增强肠道屏障功能对动物的健康产生有益的影响。
菊粉因其无毒、生物可降解等良好特性而受到广泛关注,然而菊粉的低生物活性限制了其应用,化学修饰是提高其生物活性的有效方法。WEI等[28]利用铜(I)催化的叠氮-炔环加成法合成了含1,2,3-三唑和磷酸二苯酯的菊粉衍生物并在体外评估了其抗氧化活性,结果显示1.6 mg/mL菊粉衍生物对羟自由基和超氧阴离子自由基的清除率分别为98.2%和95.4%,表现出更强的自由基清除能力。MI等[31]通过在羧甲基菊粉上引入氨基杂环部分合成了一系列新型菊粉衍生物,带有杂环部分的菊粉衍生物在抗氧化和抗真菌活性方面均有显著改善。这些合成方法为制备新型菊粉衍生物提供了有效途径,在生物材料、食品和医药等领域具有广阔的应用前景。
2.4 菊粉的抗菌作用
菊粉作为一种有机多糖,通过席夫碱反应可以增强其抗菌活性[32]。CHEN等[32]通过席夫碱化学法开发了6种菊粉衍生物,发现它们对芦笋茎枯病菌、灰霉病菌和尖孢镰刀菌均显示出较强的降解真菌的潜力,其抑菌率分别为82%、93%和83%。菊粉衍生物还可以通过季膦盐化学修饰而成。三苯基膦修饰菊粉衍生物在1.0 mg/mL时表现出良好的抗真菌活性,对芦笋拟青霉、炭疽病菌和尖孢镰刀菌的抑制率分别为78.8%、80.0%和87.4%[33]。同样,辛烯基琥珀酸酐-菊粉衍生物也被用于提高抗菌能力,其抑制指数随着物质浓度增加而增加,对大肠杆菌的最低抑菌浓度约为0.5%,对金黄色葡萄球菌的最小抑菌浓度约为1%[17]。LI等[34]合成了三唑菊粉衍生物并验证了它们对植物病原菌拉格纳菌和赤霉菌的抑制作用,其最高抑菌率分别为57.93%和82.56%。三唑菊粉衍生物的实质作用是其阳离子与真菌细胞壁上的阴离子相互作用的结果,这很大程度上归因于1,2,3-三唑集团的烷基化作用[28]。因此,利用菊粉的抗菌特性可以开发保鲜剂或抑菌涂膜,在食品保鲜方面有广阔的发展前景。
2.5 菊粉改善便秘的作用
便秘作为一种常见的健康隐患,其症状主要表现为排便次数减少、大便量减少、大便干燥、排便费力等[35]。缺乏体力活动、膳食纤维和水分摄入量会增加便秘的风险。作为膳食纤维的菊粉进入胃部后,易吸水膨胀形成一种由消化道中的细菌发酵而成的凝胶状物质,使食用者产生饱腹感,胃的排空时间相应延长[1]。WATSON等[36]研究发现健康中年人每天摄入10 g天然菊苣粉可以增加排便频率,通过增加大便重量和大便软度从而改善排便情况,这被称之为膨胀效应。这些改善可能与肠道微生物区系的改变,特别是结肠中双歧杆菌和乳杆菌的变化以及菊糖产生单链脂肪酸的能力有关[9]。LE等[37]研究发现菊粉会降低肠道pH并显著改善肠道功能,但它并不能改善腹胀和疼痛,其作用原理也是因为菊粉的摄入会增加结肠中微生物数量,增加双歧杆菌、粪杆菌和乳杆菌的相对丰度,并降低了类杆菌、厌氧菌和肠球菌数量。因此,利用菊粉开发能够疏通肠道、改善便秘的功能性食品可作为菊粉未来的研究方向之一。
3 菊粉在肉制品中的应用
3.1 菊粉作为脂肪替代品和品质改良剂对肉制品的影响
脂肪在肉制品中起着重要作用,是影响食品风味、色泽、质地、口感和整体感官特性的重要成分之一。肉制品脂肪含量较高容易产生心血管疾病、肥胖症等疾病,但肉制品中脂肪含量的显著降低又会影响肉制品质地和感官特性,因此寻找既能降低肉制品中脂肪含量还能保持产品质量的脂肪替代物意义重大[1]。而膳食纤维具有改善产品蒸煮损失、水分流失和质地松散等特性,可以用作脂肪替代品[19]。菊粉就是一种具有多种用途的膳食纤维,它的长链结构与水作用时会形成稳定的凝胶网络,并增强肉制品滑嫩多汁的口感[1]。
DOS等[38]使用菜籽油、竹纤维和菊粉制成的猪皮乳液凝胶用于鸡肉香肠中,可以代替其中50%的猪背脂肪,由于菊粉对肉糜成分的粘结作用和竹纤维的保水能力,处理组产生更加均匀和紧密的蛋白质网络,香肠孔隙比对照组更小。由此可见菊粉有助于在乳化肉制品中产生更致密的微观结构。菊粉替代产品中脂肪的同时,还会影响其口感和质地。GLISIC等[39]发现在干发酵香肠中用菊粉凝胶悬浮液取代16%的猪肉背脂,降低了香肠的弹性、咀嚼性和硬度,增加了香肠的黏附性。此外,菊粉还是一种重要的食品营养增补剂,添加到肉制品中可以增加产品的营养价值。DE等[40]探讨了菊粉基乙二醇作为脂肪替代品在减脂降盐肉制品中的潜在用途,发现用含有菊粉的高纤维乳胶替代猪背脂肪后可以得到纤维含量更高、脂肪酸组成较好和不饱和脂肪酸含量较高的产品,新配方产品的脂肪和钠含量分别降低了11%~34%和35%~45%。由此可见菊粉是一种良好的潜在脂肪替代品,可用于开发更健康低脂的肉制品。
3.2 菊粉对肉制品理化品质特性的影响
菊粉作为一种具有多种用途的膳食纤维加入到肉制品中,对食品的理化品质有很大的影响,包括含水量、灰分、pH、色泽和蒸煮损失等。EL等[41]发现添加菊粉的低脂牛肉汉堡的含水量为75%,显著高于对照组的汉堡,这可能归因于菊粉的长链分子结构在烹饪过程中会与水结合会发生凝胶作用而锁住水分。除了水分,菊粉的添加还会影响产品的灰分和pH值。有研究表明,添加了菊粉的牛肉汉堡[41]、鸡肉香肠[42]和乳化型香肠[43]中的灰分含量都有所提升。肉制品灰分含量的增加可能反映了产品中菊粉添加量的高低,然而BERIZI等[43]发现乳化型香肠的灰分含量不随菊粉用量的增加而变化,因此菊粉对肉制品灰分含量的影响还需进一步研究。GLISIC等[39]研究发现菊粉能显著提高干发酵香肠的可滴定酸度,香肠发酵过程中对照组的乳酸菌数量增加了1.59 lgCFU/g,而处理组的乳酸菌数量增加了1.85 lgCFU/g,可能是由于菊粉能够促使乳酸发酵而使pH降低。
肉制品中的脂肪含量减少会降低脂肪提供的光泽感,所以低脂肉制品的颜色通常较深且无光泽,但适量的菊粉能提高产品的亮度从而对低脂肉制品的色泽产生有益的影响[44]。DE等[40]研究发现将菊粉乳胶加入到腊肠中会使产品的L*提高,这与SADEGHI等[45]的研究结果一致,当菊粉代替鱼肉香肠中的部分脂肪后,样品在贮存期间损失的水分较少,同时增加了香肠的亮度和红色并显示出更高的硬度。MAHDAVI等[46]研究发现菊粉能够降低鲢鱼火腿的蒸煮损失,处理组的蒸煮损失值为1.62%,对照组为2.09%。并且火腿中的菊粉纤维在油炸过程中会迅速与水分子形成氢键,从而防止水分外流。ÖZER等[47]研究了菊粉对发酵香肠品质特性变化的影响,研究表明在低脂发酵香肠生产中添加25%的菊粉可降低牛肉脂肪和能量值,丰富膳食纤维,提高香肠货架期。因此,适量的菊粉不仅能降低肉制品脂肪含量,还可以改善产品的理化品质特性,在开发高品质、高纤维的低脂肉制品等方向具有重要的应用价值。
3.3 菊粉对肉制品感官特性的影响
菊粉中含有丰富的矿物质元素和膳食纤维,营养价值很高,且菊粉遇水会相互凝结形成类似脂肪的口感[44]。因此,菊粉作为脂肪替代品添加到肉制品中,既能增加营养价值又可以改善产品的口感。ZHU等[48]研究了菊粉对哈尔滨干香肠弹性口感的影响,通过扫描电镜发现含有高菊粉含量的香肠中形成了致密均匀的凝胶网络,且低场核磁共振结果表明改良香肠的保水能力有所提高,感官评价中改良香肠的咀嚼感也更好。由此可见,菊粉可以改变肉制品的结构特性从而提高产品的弹性、质地和保水能力。但菊粉的含量并非越多越好,含量过多可能会产生负面的影响。![]() 等[2]研究发现鸡肉腊肠中以3%菊粉和3%燕麦纤维复配添加量的感官最佳,菊粉含量增加时产品的口感下降,咀嚼性降低。DP也是影响产品感官特性的重要因素。ALAEI等[42]使用DP较高的长链菊粉配制的鸡肉香肠在颜色、外观和质地等感官特性方面均获得了更高的分数,而菊粉的DP降低会对产品的感官参数产生不利的影响,且当菊粉添加量超过25%时,产品的硬度和黏聚性均降低。因此,研究菊粉在肉制品中的应用时,其含量、DP以及与其他物质的复配等是开发美味、营养、健康产品的重点考虑因素。
等[2]研究发现鸡肉腊肠中以3%菊粉和3%燕麦纤维复配添加量的感官最佳,菊粉含量增加时产品的口感下降,咀嚼性降低。DP也是影响产品感官特性的重要因素。ALAEI等[42]使用DP较高的长链菊粉配制的鸡肉香肠在颜色、外观和质地等感官特性方面均获得了更高的分数,而菊粉的DP降低会对产品的感官参数产生不利的影响,且当菊粉添加量超过25%时,产品的硬度和黏聚性均降低。因此,研究菊粉在肉制品中的应用时,其含量、DP以及与其他物质的复配等是开发美味、营养、健康产品的重点考虑因素。
4 展望
如今人们越来越饮食对人体健康的重要性,食用高脂肪加工肉制品会增加心血管疾病、癌症和代谢性疾病的发病率,因此,消费者对健康低脂食品的需求不断增加。在肉制品中添加膳食纤维有助于开发具有保水性、乳化稳定性、润滑性、质地改性和低脂肪等特性的产品。菊粉作为一种具有益生元效应的膳食纤维,将其添加到肉制品中可以丰富产品的营养,改善肉制品的功能和健康特性。然而关于菊粉作为功能性成分在肉制品中的作用研究仍较少,富含菊粉的功能性肉制品的开发还需要进一步的研究。因此,为开发出健康低脂的功能性肉制品,未来亟需发展的方向为:
(1)菊粉替代肉制品中的部分动物脂肪会对产品原有的口感、色泽、风味等产生不良影响,因此需对菊粉替代脂肪的工艺参数进行改进优化,使其保持低脂肪的同时具有良好的口感和质地等。
(2)菊粉含有丰富的有益生理功能,如调节肠道微生物、抗氧化作用、防止便秘等,但利用其活性成分研发功能性肉制品以及其他保健品的研究主要停留在实验室阶段,应当重视临床实验及产业化生产方向。
(3)对菊粉功能活性的研究还不够深入,仍需进一步探明肉制品中添加菊粉对人体消化吸收及健康的潜在作用机制。
[1] MAN S L,LIU T H,YAO Y,et al.Friend or foe?The roles of inulin-type fructans[J].Carbohydrate Polymers,2021,252:117155.
[2] ![]() M,et al.Development of low-fat chicken bologna sausages enriched with inulin,oat fibre or Psyllium[J].International Journal of Food Science &Technology,2021,56(4):1 818-1 828.
M,et al.Development of low-fat chicken bologna sausages enriched with inulin,oat fibre or Psyllium[J].International Journal of Food Science &Technology,2021,56(4):1 818-1 828.
[3] 赵孟良,任延靖.菊粉及其调节宿主肠道菌群机制的研究进展[J].食品与发酵工业,2020,46(7):271-276.
ZHAO M L,REN Y J.Research progress of inulin and its regulation mechanism in regulating host intestinal flora [J].Food and Fermentation Industries,2020,46(7):271-276.
[4] GUPTA D,CHATURVEDI N.Prebiotic potential of underutilized Jerusalem artichoke in human health:A comprehensive review[J].International Journal of Environment,Agriculture and Biotechnology,2020,5(1):97-103.
[5] ![]() J,et al.Chicory (Cichorium intybus L.) as a food ingredient-Nutritional composition,bioactivity,safety,and health claims:A review[J].Food Chemistry,2021,336:127676.
J,et al.Chicory (Cichorium intybus L.) as a food ingredient-Nutritional composition,bioactivity,safety,and health claims:A review[J].Food Chemistry,2021,336:127676.
[6] TWAROGOWSKA A,VAN POUCKE C,VAN DROOGENBROECK B.Upcycling of Belgian endive (Cichorium intybus var.foliosum) by-products.Chemical composition and functional properties of dietary fibre root powders[J].Food Chemistry,2020,332:127444.
[7] REDONDO-CUENCA A,HERRERA-V ZQUEZ S E,CONDEZO-HOYOS L,et al.Inulin extraction from common inulin-containing plant sources[J].Industrial Crops and Products,2021,170:113726.
ZQUEZ S E,CONDEZO-HOYOS L,et al.Inulin extraction from common inulin-containing plant sources[J].Industrial Crops and Products,2021,170:113726.
[8] WAN X H,GUO H,LIANG Y Y,et al.The physiological functions and pharmaceutical applications of inulin:A review[J].Carbohydrate Polymers,2020,246:116589.
[9] ILLIPPANGAMA A U,JAYASENA D D,JO C,et al.Inulin as a functional ingredient and their applications in meat products[J].Carbohydrate Polymers,2022,275:118706.
[10] RUBEL I A,IRAPORDA C,MANRIQUE G D,et al.Inulin from Jerusalem artichoke (Helianthus tuberosus L.):From its biosynthesis to its application as bioactive ingredient[J].Bioactive Carbohydrates and Dietary Fibre,2021,26:100281.
[11] CASTELLINO M,RENNA M,LEONI B,et al.Conventional and unconventional recovery of inulin rich extracts for food use from the roots of globe artichoke[J].Food Hydrocolloids,2020,107:105975.
[12] TRIPODO G,MANDRACCHIA D.Inulin as a multifaceted (active) substance and its chemical functionalization:From plant extraction to applications in pharmacy,cosmetics and food[J].European Journal of Pharmaceutics and Biopharmaceutics,2019,141:21-36.
[13] NI D W,CHEN Z W,XU W,et al.Efficient production of inulin and oligosaccharides using thermostable inulosucrase from Lactobacillus jensenii[J].International Journal of Biological Macromolecules,2020,165:1 250-1 257.
[14] MORO T M A,T.P.S.CLERICI M.Burdock (Arctium lappa L) roots as a source of inulin-type fructans and other bioactive compounds:Current knowledge and future perspectives for food and non-food applications[J].Food Research International,2021,141:109889.
[15] EL-KHOLY W M,AAMER R A,ALI A N A.Utilization of inulin extracted from chicory (Cichorium intybus L.) roots to improve the properties of low-fat synbiotic yoghurt[J].Annals of Agricultural Sciences,2020,65(1):59-67.
[16] CASTRO-MU OZ R,CORREA-DELGADO M,C
OZ R,CORREA-DELGADO M,C RDOVA-ALMEIDA R,et al.Natural sweeteners:Sources,extraction and current uses in foods and food industries[J].Food Chemistry,2022,370:130991.
RDOVA-ALMEIDA R,et al.Natural sweeteners:Sources,extraction and current uses in foods and food industries[J].Food Chemistry,2022,370:130991.
[17] USMAN M,ZHANG C N,PATIL P J,et al.Potential applications of hydrophobically modified inulin as an active ingredient in functional foods and drugs - A review[J].Carbohydrate Polymers,2021,252:117176.
[18] 李烜,罗登林,向进乐,等.菊粉的性质、功能及在食品中的应用进展[J].中国粮油学报,2021,36(4):185-192.
LI X,LUO D L,XIANG J L,et al.Physicochemical properties,functions and applications of inulin in food:A review[J].Journal of the Chinese Cereals and Oils Association,2021,36(4):185-192.
[19] REZENDE E S V,LIMA G C,NAVES M M V.Dietary fibers as beneficial microbiota modulators:A proposed classification by prebiotic categories[J].Nutrition,2021,89:111217.
[20] 朱峰,陈景垚,蓝蔚青.菊粉的功能特性与开发利用研究进展[J].包装工程,2019,40(1):34-39.
ZHU F,CHEN J Y,LAN W Q.Research progress on the functional properties and utilization of inulin[J].Packaging Engineering,2019,40(1):34-39.
[21] ZOU J,REDDIVARI L,SHI Z D,et al.Inulin fermentable fiber ameliorates type I diabetes via IL22 and short-chain fatty acids in experimental models[J].Cellular and Molecular Gastroenterology and Hepatology,2021,12(3):983-1 000.
[22] AVIRINENI B S,SINGH A,ZAPATA R C,et al.Dietary whey and egg proteins interact with inulin fiber to modulate energy balance and gut microbiota in obese rats[J].The Journal of Nutritional Biochemistry,2022,99:108860.
[23] BACHMANN M,GLATTER M,BOCHNIA M,et al.Degradation of monosaccharides,disaccharides,and fructans in the stomach of horses adapted to a prebiotic dose of fructooligosaccharides and inulin[J].Journal of Equine Veterinary Science,2021,105:103731.
[24] WILSON B,WHELAN K.Prebiotic inulin-type fructans and galacto-oligosaccharides:Definition,specificity,function,and application in gastrointestinal disorders[J].Journal of Gastroenterology and Hepatology,2017,32:64-68.
[25] ÖNAL DARILMAZ D,SÖNMEZ  ,BEYATLI Y.The effects of inulin as a prebiotic supplement and the synbiotic interactions of probiotics to improve oxalate degrading activity[J].International Journal of Food Science &Technology,2019,54(1):121-131.
,BEYATLI Y.The effects of inulin as a prebiotic supplement and the synbiotic interactions of probiotics to improve oxalate degrading activity[J].International Journal of Food Science &Technology,2019,54(1):121-131.
[26] CHENG W Y,LAM K L,PIK-SHAN KONG A,et al.Prebiotic supplementation (beta-glucan and inulin) attenuates circadian misalignment induced by shifted light-dark cycle in mice by modulating circadian gene expression[J].Food Research International,2020,137:109437.
[27] HOFFMAN J B,PETRIELLO M C,MORRIS A J,et al.Prebiotic inulin consumption reduces dioxin-like PCB 126-mediated hepatotoxicity and gut dysbiosis in hyperlipidemic Ldlr deficient mice[J].Environmental Pollution,2020,261:114183.
[28] WEI L J,SUI H S,ZHANG J J,et al.Synthesis and antioxidant activity of the inulin derivative bearing 1,2,3-triazole and diphenyl phosphate[J].International Journal of Biological Macromolecules,2021,186:47-53.
[29] MU Y W,GAO W T,LV S Q,et al.The antioxidant capacity and antioxidant system of Jerusalem artichoke (Helianthus tuberosus L.) tubers in relation to inulin during storage at different low temperatures[J].Industrial Crops and Products,2021,161:113229.
[30] YANG G,QIU H M,YU R H,et al.Dietary supplementation of β-glucan,inulin and emodin modulates antioxidant response and suppresses intestinal inflammation of grass carp (Ctenopharyngodon idellus)[J].Animal Feed Science and Technology,2021,272:114789.
[31] MI Y Q,ZHANG J J,HAN X R,et al.Modification of carboxymethyl inulin with heterocyclic compounds:Synthesis,characterization,antioxidant and antifungal activities[J].International Journal of Biological Macromolecules,2021,181:572-581.
[32] CHEN Y,MI Y Q,LI Q,et al.Synthesis of Schiff bases modified inulin derivatives for potential antifungal and antioxidant applications[J].International Journal of Biological Macromolecules,2020,143:714-723.
[33] CHEN Y,TAN W Q,LI Q,et al.Synthesis of inulin derivatives with quaternary phosphonium salts and their antifungal activity[J].International Journal of Biological Macromolecules,2018,113:1 273-1 278.
[34] LI Q,QIU L,TAN W Q,et al.Novel 1,2,3-triazolium-functionalized inulin derivatives:Synthesis,free radical-scavenging activity,and antifungal activity[J].RSC Advances,2017,7(67):42 225-42 232.
[35] WONG M Y W,HEBBARD G,GIBSON P R,et al.Chronic constipation and abdominal pain:Independent or closely interrelated symptoms?[J].Journal of Gastroenterology and Hepatology,2020,35(8):1 294-1 301.
[36] WATSON A W,HOUGHTON D,AVERY P J,et al.Changes in stool frequency following chicory inulin consumption,and effects on stool consistency,quality of life and composition of gut microbiota[J].Food Hydrocolloids,2019,96:688-698.
[37] LE BASTARD Q,CHAPELET G,JAVAUDIN F,et al.The effects of inulin on gut microbial composition:A systematic review of evidence from human studies[J].European Journal of Clinical Microbiology &Infectious Diseases:Official Publication of the European Society of Clinical Microbiology,2020,39(3):403-413.
[38] DOS SANTOS M,MUNEKATA P E S,PATEIRO M,et al.Pork skin-based emulsion gels as animal fat replacers in hot-dog style sausages[J].LWT,2020,132:109845.
[39] GLISIC M,BALTIC M,GLISIC M,et al.Inulin-based emulsion-filled gel as a fat replacer in prebiotic- and PUFA-enriched dry fermented sausages[J].International Journal of Food Science &Technology,2019,54(3):787-797.
[40] DE SOUZA PAGLARINI C,VIDAL V A,RIBEIRO W,et al.Using inulin-based emulsion gels as fat substitute in salt reduced Bologna sausage[J].Journal of the Science of Food and Agriculture,2021,101(2):505-517.
[41] EL ZENY T,ESSA R Y,BISAR B A,et al.Effect of using chicory roots powder as a fat replacer on beef burger quality[J].Slovenian Veterinary Research,2019,56(22-Suppl):509-523.
[42] ALAEI F,HOJJATOLESLAMY M,HASHEMI DEHKORDI S M.The effect of inulin as a fat substitute on the physicochemical and sensory properties of chicken sausages[J].Food Science &Nutrition,2018,6(2):512-519.
[43] BERIZI E,SHEKARFOROUSH S S,MOHAMMADINEZHAD S,et al.The use of inulin as fat replacer and its effect on texture and sensory properties of emulsion type sausages[J].Iranian Journal of Veterinary Research,2017,18(4):253-257.
[44] AHMED W,RASHID S.Functional and therapeutic potential of inulin:A comprehensive review[J].Critical Reviews in Food Science and Nutrition,2019,59(1):1-13.
[45] SADEGHI A,HAKIMZADEH V,SALEHI E,et al.Investigation of the physicochemical,organoleptic and dietary properties of trout fermented sausages through probiotic strains and fat replacer[J].Food Science and Technology,2021,15(1).
[46] MAHDAVI E,ARIAII P.Characterization of functional fish ham produced from Silver carp (Hypophthalmichthys molitrix) surimi enriched with natural antioxidant and vegetable fiber[J].Italian Journal of Food Science,2021,33(SP1):127-136.
[47] ÖZER C.Utilization of Jerusalem artichoke powder in production of low-fat and fat-free fermented sausage[J].Italian Journal of Food Science,2019,31(2):301-310.
[48] ZHU Y L,GUO L P,TANG W T,et al.Beneficial effects of Jerusalem artichoke powder and olive oil as animal fat replacers and natural healthy compound sources in Harbin dry sausages[J].Poultry Science,2020,99(12):7 147-7 158.