青稞酒作为承接古老传统生产工艺的清香型白酒之一,是以青稞为主要原料酿造而成[1-2]。目前研究发现,青稞酒中含有丰富的醇、醛、酸、酯等成分[3-4]。刘志鹏等[5]通过全二维飞行质谱鉴定出青稞酒中含有的448种挥发性化合物,其中包括呋喃类、内酯类和萜烯类。萜烯类化合物是最大的天然产物之一,现已知3 000多种[6],萜烯类化合物是以异戊二烯为结构单位倍数的烃类及其含氧衍生物,其中包括单萜烯类、倍半萜烯类以及二萜烯类化合物等[7]。近几年相关研究显示,青稞酒中含有α-蒎烯、香茅醇、β-石竹烯、月桂烯、罗勒烯、柠檬烯、β-紫罗酮等多种萜烯类成分[5,8-9]。据报道,α-蒎烯具有神经保护性、抗氧化性、抗癌及抗炎的功能[10-12];香茅醇具有抗凋亡、抗炎的功能[13-15];β-石竹烯具有抗氧化、抗炎、抗凋亡、镇痛及促进创伤修复的功效[16-19];月桂烯具有抗氧化、抗炎、抗衰老的功效[20-22];而罗勒烯的功效尚未清楚;柠檬烯具有抗炎、抗氧化、抗病毒及抗糖尿病等功效[23-24];β-紫罗酮是一种抗癌活性剂,并具有抗氧化及抗炎的功效[25-28]。但目前青稞酒中独特风味成分的功能性尚未清楚。
细胞自噬是一种细胞内的“自我吞噬”的机制,主要借助膜结构对错误折叠的蛋白和受损的细胞器进行降解再利用[29]。酒精的过量摄入会导致过量活性氧(reactive oxygen species,ROS)的堆积,ROS会氧化和破坏线粒体所产的脂质、核酸和氨基酸前体等,导致线粒体功能障碍,从而诱导细胞自噬[30]。氧化应激和细胞自噬相互调控,作用关系复杂。据报道,α-蒎烯可提高超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)和谷胱甘肽过氧化物酶(glutathione,GSH)的功能,并降低丙二醛(malondialdehyde,MDA)、一氧化氮和白介素-6(interleukin-6,IL-6)的含量,实现抗氧化和抗炎的作用[10]。同时香茅醇、β-石竹烯、月桂烯、罗勒烯、柠檬烯、β-紫罗酮等均具有一定的抗氧化性,但包括α-蒎烯在内的物质对细胞自噬的影响尚未明确,并且有关的报道较少。因此,本研究选取上述7种萜烯类成分开展对细胞自噬影响作用研究及功能评价。
通过用不同浓度萜烯类化合物处理人源正常肝细胞,采用蛋白免疫印迹法(Western blotting)、实时荧光定量(real time quantitative PCR,RT-qPCR)和免疫荧光等方法,分析了α-蒎烯、香茅醇、β-石竹烯、月桂烯、罗勒烯、柠檬烯、β-紫罗酮对细胞自噬的影响。
1 材料与方法
1.1 材料与试剂
α-蒎烯、罗勒烯、β-紫罗酮,美国Thermo公司;香茅醇,美国Acros organics公司;柠檬烯,江西环球天然香料有限公司;β-石竹烯、月桂烯,上海麦克林公司;RPMI-1640培养基,美国Gibco公司;BCA蛋白浓度测定试剂盒,北京索莱宝科技有限公司;胎牛血清、胰蛋白酶、链霉素、青霉素,美国Hyclone公司;兔抗微管相关蛋白轻链3(microtubule-associated proteins 1A/1B light chain 3,LC3)、P62/SQSTM1,日本Medical &Biological Laboratories公司;GAPDH、辣根过氧化物酶标记的山羊抗兔、594抗兔lgG二抗,美国Cell Signaling Technology公司。
1.2 仪器与设备
LDZX-50KBS高压灭菌锅,上海申安医疗器械厂;SpectraMax® iD3多功能酶标仪,美国Molecular Devices公司;Micro 21R小型台式离心机,美国Thermo公司;2-16N高速微量离心机,湖南恒诺仪器设备有限公司;ChenmiScope 6200 Touch化学发光成像系统,上海勤翔科学仪器有限公司;THUNDER Imager 3显微成像系统,德国Leica公司。
1.3 实验方法
1.3.1 细胞培养
L02细胞采用高糖 RPMI-1640培养基培养,并添加质量分数10%的胎牛血清,100 U/mL 青霉素和100 μg/mL链霉素,培养条件为 37 ℃、5% CO2。当细胞生长至85%左右融合度时,使用质量分数0.25%胰蛋白酶消化细胞,进行传代处理,试验所用细胞均为3~15代。
1.3.2 细胞存活率试验
以2.0×104/孔接种LO2细胞于96孔微孔板中,放置细胞培养箱中培养24 h后,用不同的萜烯类化合物处理24 h。使用细胞增殖检测试剂盒8(cell counting kit 8,CCK-8)法检测细胞增殖能力:在培养板的每孔细胞中滴加CCK-8溶液10 μL,放置细胞培养箱中孵育2 h。使用酶标仪测定细胞在450 nm处吸光度值,各组细胞的存活率计算如公式(1)所示:
细胞存活率![]()
(1)
式中:A1为不同萜烯类化合物测定的吸光度;A2为正常培养基测定的吸光度。
1.3.3 RT-qPCR法
使用Invitrogen试剂盒提取LO2细胞总RNA,并根据LC3、P62基因mRNA序列设计 PCR引物。LC3引物(上游5′-TGCTGTCCCGAATGTCTCCTG-3′、下游5′-GCTAACCAAGCCTTCTTCCTCC-3′);P62引物(上游5′-TGCCCAGACTACGACTTGTG-3′、下游 5′-AGTGTCCGTGTTTCACCTTCC-3′);内参采用GAPDH,引物为 (上游5′-CTCAACTACATGGTCTACATGTTCCA-3′、下游5′-TCACACACCAGCAGGTTATCATC-3′。引物合成由上海生工生物技术公司完成。RT-qPCR 反应体系严格按照Vazyme试剂盒说明书进行。总反应体系为20 μL,反应条件为:95 ℃ 5 min;95 ℃ 10 s,60 ℃ 30 s,40个循环。反应结束仪器自动生成循环阈 (cycle threshold,Ct) 值,用各组mRNA与内参基因的Ct值的差值 (ΔCt),最后用 (2-ΔΔCt)表示各组mRNA的相对表达量。
1.3.4 Western blotting试验
以1.6×105/孔接种LO2细胞于6孔板中,药物处理24 h后,PBS洗3次,用含有蛋白酶抑制剂混合物的蛋白质提取液A裂解LO2细胞,并在4 ℃下以12 000 ×g离心15 min,吸出细胞上清液。用BCA蛋白质测定试剂盒测定上清液中的总蛋白质浓度。取100 μL细胞上清液加入25 μL的5×样品缓冲液混匀。样品在98 ℃下加热10 min,然后以13 800×g离心1 min。将10 μL上清液加到10%SDS-PAGE凝胶上。电泳后,将蛋白质转移到聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜上,并在封闭缓冲液(5%脱脂奶,20 mmol/L Tris-HCl,pH 7.4,150 mmol/L NaCl,0.1% Tween-20)中室温封闭1 h,在4 ℃下分别与抗兔LC3和P62一抗孵育过夜。用TBST洗膜3次,每次5 min,辣根过氧化物酶标记的山羊抗兔二抗孵育40 min后,进行显色和拍照。用ImageJ软件进行定量分析和比较。
1.3.5 免疫荧光法
LO2细胞计数,以1.6×105/孔接种于6孔板中,分组处理24 h后,PBS洗2次,4%多聚甲醛室温固定15 min,PBS洗3次,用含有0.3% Triton X-100和1% BSA的PBS室温封闭1 h,分别加兔抗LC3和P62抗体(1∶1 000),避光孵育1 h,PBS洗3次,加入594抗兔lgG二抗(1∶1 000)室温孵育40 min,PBS洗3次,用含有4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)的抗荧光淬灭剂封片,荧光显微镜下观察LC3和P62的表达强度及定位。
1.3.6 数据统计与分析
用SPSS 23.0分析处理数据,所有实验数据均为3次平行试验的平均值,用平均值±标准误(SE± Mean)表示;图表由Origin 2018绘制。
2 结果与分析
2.1 萜烯类化合物对LO2细胞存活率的影响
利用CCK-8方法观察萜烯类化合物对LO2细胞存活率的影响,如图1所示。与对照组相比,α-蒎烯处理组的细胞在0.05、0.1、0.2、0.4 mg/mL 4个不同质量浓度下,细胞存活率均明显增加(P<0.001);香茅醇处理组的细胞,在质量浓度为0.05 mg/mL时,细胞存活率增加(P<0.001),当质量浓度>0.4 mg/mL时,细胞存活率明显降低;β-石竹烯处理组的细胞,在质量浓度<0.2 mg/mL时,细胞存活率明显增加(P<0.001),但高于此质量浓度范围,细胞存活率则低于对照组;月桂烯处理组的细胞,在质量浓度<0.2 mg/mL时能够正常存活,在质量浓度为0.05 mg/mL时细胞存活率显著升高(P<0.001);柠檬烯处理组的细胞在5种不同质量浓度中的存活率无明显差异;罗勒烯处理组的细胞,在质量浓度>0.1 mg/mL时,细胞存活率就开始呈下降趋势;β-紫罗酮处理组的细胞,在质量浓度为0.4 mg/mL时就开始大量死亡。结合上述实验结果,在保证细胞存活率无显著性差异的情况下,针对α-蒎烯选取质量浓度为0.1、0.2、0.4 mg/mL;香茅醇选取0.05、0.1、0.2 mg/mL;β-石竹烯选取0、0.1、0.2 mg/mL;月桂烯选取0、0.05、0.1、0.2 mg/mL;柠檬烯选取0、0.05、0.1、0.2 mg/mL;罗勒烯选取0、0.05、0.1、0.2、0.4 mg/mL;β-紫罗酮选取0、0.05、0.1、0.2 mg/mL进行后续实验。

a-α-蒎烯;b-β-石竹烯;c-香茅醇;d-月桂烯;e-罗勒烯;f-柠檬烯;g-β-紫罗酮
图1 七种萜烯类化合物对LO2细胞存活率的影响
Fig.1 Effects of terpenes on the survival rate of LO2 cells
注:图中*代表有显著差异,*表示(P<0.05),**表示(P<0.01),***表示(P<0.001)(下同)
2.2 萜烯类化合物对细胞自噬的影响
能量调节因子腺苷酸活化蛋白激酶(AMP- activated protein kinase,AMPK)与自噬相关蛋白哺乳动物雷帕霉素靶蛋白复合物1(mammalian target of rapamycin complex 1,mTORC1)在细胞自噬中起着重要的调节作用。在营养条件下,自噬相关蛋白mTORC1被激活,自噬处于低活性状态。当细胞处于饥饿条件下,AMPK蛋白被激活,从而抑制mTORC1蛋白,导致自噬被激活[31]。本研究用7种萜烯类化合物分别处理细胞24 h后,在营养与饥饿的条件下,观察其对于细胞自噬的影响作用。如图2所示,经α-蒎烯处理后的细胞,在营养条件下,LC3蛋白表达水平以浓度依赖的形式增加,并与饥饿条件下表达水平一致;香茅醇处理后的细胞,在营养和饥饿条件下的蛋白表达水平无明显差异;罗勒烯处理后,在0.4 mg/mL时,LC3蛋白表达水平增加;经β-石竹烯、月桂烯、柠檬烯和β-紫罗酮处理后的细胞,两种条件下的LC3蛋白表达水平也均无明显差异。实验结果显示,α-蒎烯处理后,自噬相关蛋白LC3的表达水平呈浓度依赖性增加,可能对细胞自噬具有促进作用;而罗勒烯在0.2 mg/mL时呈现抑制自噬的作用,当质量浓度在0.4 mg/mL时,LC3表达量增加,此结果提示罗勒烯对自噬可能存在抑制作用,所以不在后续实验中展开研究;而其他5种萜烯类化合物在细胞自噬方面无显著性作用。终上所述,根据实验结果提示α-蒎烯对自噬的影响较显著,所以选取α-蒎烯进行后续的试验。

a~c-α-蒎烯;d~f-香茅醇;g~i-β-石竹烯;j~l-月桂烯;m~o-柠檬烯;p~r-罗勒烯;s~u-β-紫罗酮
图2 七种萜烯类化合物对LC3蛋白表达的影响
Fig.2 The effect of terpenes on the expression of LC3 protein
2.3 α-蒎烯对细胞自噬mRNA水平的影响
为了进一步证明α-蒎烯对细胞自噬的影响,检测了α-蒎烯对自噬相关蛋白LC3和P62 mRNA相对表达水平的影响。如图3所示,经α-蒎烯处理后,营养条件和饥饿条件下的LC3蛋白表达水平都以浓度依赖的形式增加,而P62的表达水平有所降低。在典型情况下,P62是一种泛素化蛋白,会随着自噬流量的上调而减少[32]。LC3蛋白的mRNA表达水平与Western blotting的结果相一致。结合实验结果提示,α-蒎烯可能对细胞自噬具有促进作用。
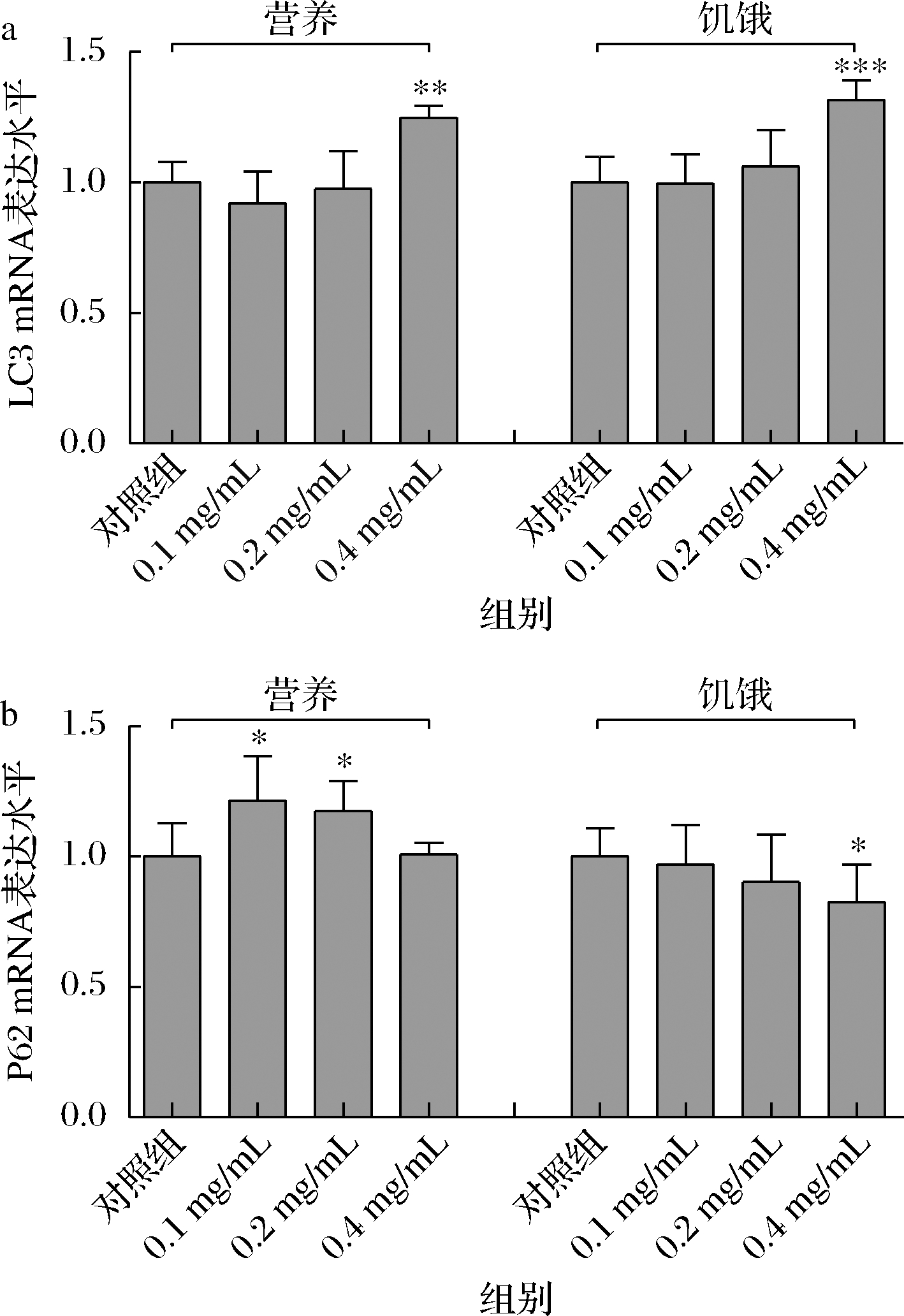
a-LC3 mRNA表达水平;b-P62 mRNA表达水平
图3 α-蒎烯对LC3和P62 mRNA表达水平的影响
Fig.3 The effect of α-pinene on the mRNA expression level of LC3 and P62
2.4 α-蒎烯加入自噬阻断剂对细胞自噬的影响
巴弗洛霉素A1(Bafilomycin A1,BafA1)是一种自噬末期阻断剂,通过阻断自噬体与溶酶体的融合,并抑制溶酶体中pH值和蛋白质降解阻断自噬[33]。由于在图2-a、图2-b中,在营养条件下α-蒎烯处理后LC3的蛋白表达强度较弱,这可能是由于自噬流量过大导致的。为了更确切地观察α-蒎烯对细胞自噬的影响,在接下来的实验中,加入自噬末期阻断剂BafA1。BafA1可以阻断自噬末期,抑制LC3在自噬溶酶体中的重利用或降解。结果如图4所示,经对照组和α-蒎烯处理后的细胞中LC3蛋白表达水平均有所增加。使用BafA1处理2 h后,α-蒎烯处理组的LC3表达水平显著上调,这是由于BafA1通过抑制自噬末期,阻断LC3的降解[34]。因此,可以进一步判定α-蒎烯可能对细胞自噬具有促进作用。

a-α-蒎烯Western blotting结果;b-α-蒎烯灰度值分析
图4 加入bafA1观察α-蒎烯对细胞自噬的影响
Fig.4 Observe the effect of α-pinene on autophagy through adding bafA1
YIN等[35]通过免疫荧光方法分析了血管生成素2(angiopoietin 2,Ang2)对LC3和P62对细胞自噬的影响。研究表明,Ang2能提高LC3蛋白的荧光点数并减弱P62的荧光点数,诱导自噬。为了进一步验证α-蒎烯对细胞自噬的影响,通过免疫荧光法分析了α-蒎烯对 LC3和P62蛋白表达水平的影响。2.1中的实验结果显示,α-蒎烯在质量浓度为0.4 mg/mL时,对细胞自噬的影响最大,差异显著,因此选取0.4 mg/mL的质量浓度进行免疫荧光分析。结果如图5所示,使用α-蒎烯处理24 h后,细胞内形成大量自噬体,LC3蛋白被招募至自噬体表面。红色LC3蛋白多于绿色荧光蛋白,显示自噬被充分诱导,且完成了自噬体成熟并与溶酶体融合成为自噬溶酶体的整个过程[36],且P62蛋白表达水平随着自噬流量的增加而降低,这与以前的研究结果相一致。该结果进一步显示,α-蒎烯在营养及饥饿条件下,均可明显诱导细胞自噬发生、发展并成熟。
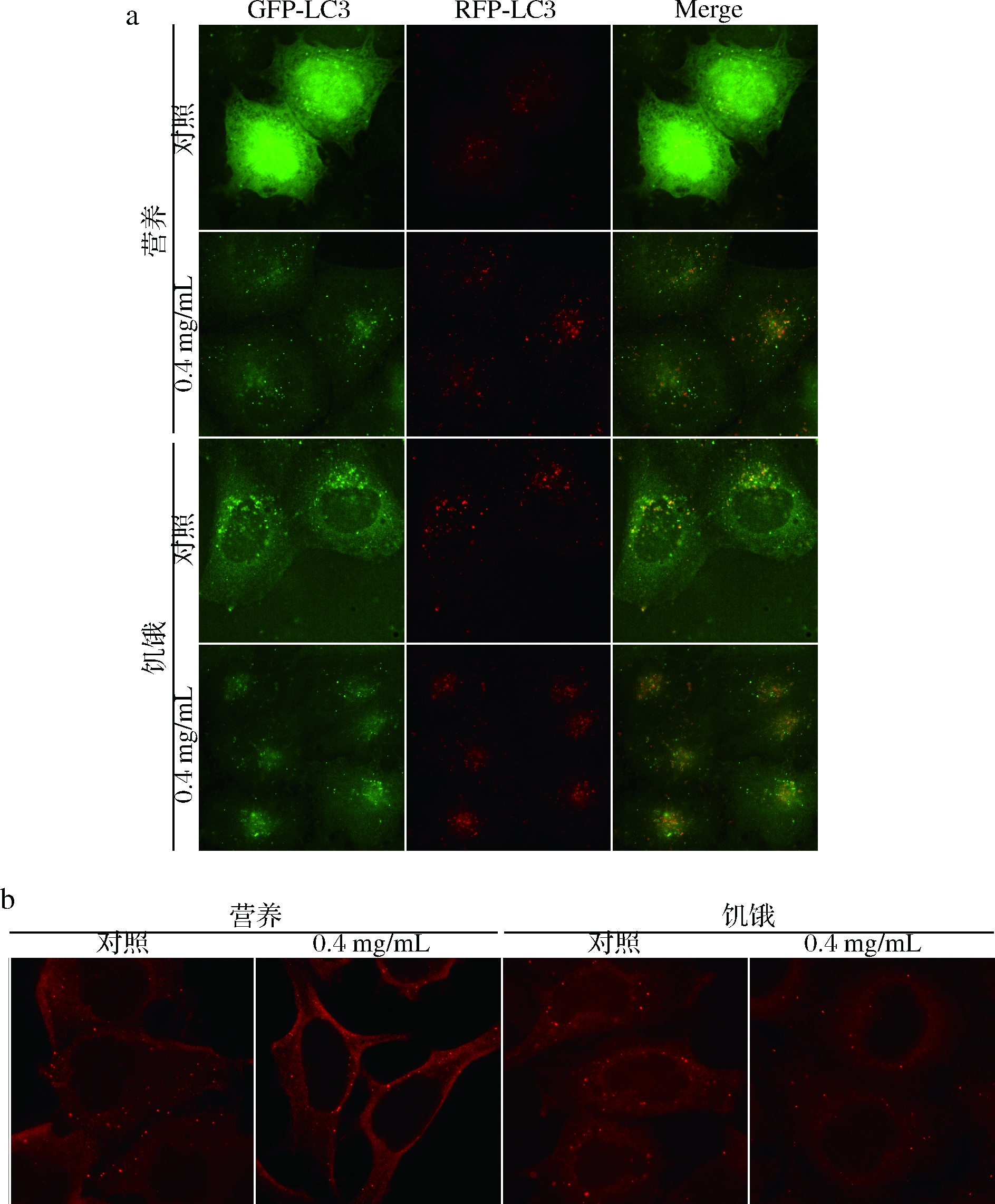
a-LC3荧光强度;b-P62荧光强度
图5 免疫荧光分析α-蒎烯对LC3蛋白表达水平的影响
Fig.5 Immunofluorescence analysis of the effect of α-pinene on the expression of LC3 protein
3 结论
本研究通过用不同浓度的萜烯类化合物处理细胞,利用 Western blot分析观察了7种萜烯类化合物对细胞自噬的影响,结果表明,经香茅醇、β-石竹烯、月桂烯、罗勒烯、柠檬烯、β-紫罗酮处理后,细胞的LC3蛋白表达水平均无明显变化,而α-蒎烯处理后的LC3蛋白表达水平以浓度依赖性的水平上调。为了进一步探究α-蒎烯对细胞自噬的影响作用,通过 RT-qPCR检测了α-蒎烯处理组在营养及饥饿条件下LC3和P62 mRNA表达水平变化,结果显示,α-蒎烯处理后,LC3 mRNA表达水平上调,P62 mRNA表达水平降低。此外,免疫荧光分析结果也显示了α-蒎烯对细胞自噬的促进作用。
综合所有实验结果表明,相较于青稞酒中的其他6种萜烯类化合物,α-蒎烯在一定浓度内可能对LO2细胞具有一定的促进细胞自噬的作用。这为接下来的自噬相关研究提供了参考,也为减弱肝损伤治疗方案提供了有效参考。
[1] 张芬军,解成玉,叶晖春,等.青稞清香型白酒与部分典型清香型白酒的微量成份对比研究[J].酿酒,2019,46(5):61-67.
ZHANG F J,XIE C Y,YE H C,et al.A comparative study on trace ingredients of highland barley Baijiu and some representative light-flavor Baijiu[J].Liquor Making,2019,46(5):61-67.
[2] 尹建军,安红梅,张晓磊,等.酿酒原料青稞中挥发性化合物的研究[J].酿酒,2011,38(6):16-20.
YIN J J,AN H M,ZHANG X L,et al.Research on volatile compounds in hullessbarley material of liquor-making[J].Liquor Making,2011,38(6):16-20.
[3] 杜木英,伍怡郦,阚建全,等.传统青稞酒发酵过程中化学成分动态变化的研究[J].食品工业科技,2007,28(9):94-98.
DU M Y,WU Y L,KAN J Q,et al.Study on the dynamic changes of chemical composition in the fermentation process of traditional highland barley wine[J].Science and Technology of Food Industry,2007,28(9):94-98.
[4] 王晓芹,代宇,张宿义,等.青稞酒酿造研究进展[J].酿酒科技,2015(3):102-104.
WANG X Q,DAI Y,ZHANG X Y,et al.Research progress in highland barley wine production[J].Liquor-making Science &Technology,2015(3):102-104.
[5] 刘志鹏,车富红,李善文,等.全二维气相色谱-飞行时间质谱法分析不同季节酿造的青稞酒挥发性组分特征[J].食品与发酵工业,2019,45(15):218-226.
LIU Z P,CHE F H,LI S W,et al.Volatile profile of highland barley (Qingke) Baijiu characterized by comprehensive two-dimensional gas chromatography/time-of-flight mass spectrometry[J].Food and Fermentation Industries,2019,45(15):218-226.
[6] SACCHETTINI J C,POULTER C D.Creating isoprenoid diversity[J].Science,1997,277(5 333):1 788-1 789.
[7] 付佳,李锋华,李常康,等.天然来源单环倍半萜类化合物的结构及其药理活性研究进展[J].中国中药杂志,2019,44(17):3 672-3 683.
FU J,LI F H,LI C K,et al.Reviews on natural monocyclic sesquiterpenoids and their bioactivities[J].China Journal of Chinese Materia Medica,2019,44(17):3 672-3 683.
[8] 车富红,冯声宝,李善文,等.不同青稞品种与高粱中结合态风味成分和萜烯类物质的对比研究[J].酿酒科技,2019(12):119-125;129.
CHE F H,FENG S B,LI S W,et al.Comparative study of the flavoring compounds and terpenes in different species of highland barley and sorghum[J].Liquor-making Science &Technology,2019(12):119-125;129.
[9] 高文俊.青稞酒重要风味成分及其酒醅中香气物质研究[D].无锡:江南大学,2014.
GAO W J.The important odorants of Qingke liquor and the aroma compounds in its fermented grains[D].Wuxi:Jiangnan University,2014.
[10] KHOSHNAZAR M,BIGDELI M R,PARVARDEH S,et al.Attenuating effect of α-pinene on neurobehavioural deficit,oxidative damage and inflammatory response following focal ischaemic stroke in rat[J].Journal of Pharmacy and Pharmacology,2019,71(11):1 725-1 733.
[11] XU H,WANG E,CHEN F,et al.Neuroprotective phytochemicals in experimental ischemic stroke:Mechanisms and potential clinical applications[J].Oxidative Medicine and Cellular Longevity,2021.DOI:10.1155/2021/6687386.
[12] LI X J,YANG Y J,LI Y S,et al.α-Pinene,linalool,and 1-octanol contribute to the topical anti-inflammatory and analgesic activities of frankincense by inhibiting COX-2[J].Journal of Ethnopharmacology,2016,179:22-26.
[13] RAJENDRAN J,PACHAIAPPAN P,THANGARASU R.Citronellol,an acyclic monoterpene induces mitochondrial-mediated apoptosis through activation of proapoptotic factors in MCF-7 and MDA-MB-231 human mammary tumor cells[J].Nutrition and Cancer,2021,73(8):1 448-1 458.
[14] JAYAGANESH R,PUGALENDHI P,MURALI R.Effect of citronellol on NF-κB inflammatory signaling molecules in chemical carcinogen-induced mammary cancer in the rat model[J].Journal of Biochemical and Molecular Toxicology,2020,34(3):e22441.
[15] SANTOS P L,MATOS J P S,PICOT L,et al.Citronellol,a monoterpene alcohol with promising pharmacological activities-A systematic review[J].Food and Chemical Toxicology,2019,123:459-469.
[16] FIDYT K,FIEDOROWICZ A,STRZ![]() DA
DA A L,et al.β-caryophyllene and β-caryophyllene oxide—natural compounds of anticancer and analgesic properties[J].Cancer medicine,2016,5(10):3 007-3 017.
A L,et al.β-caryophyllene and β-caryophyllene oxide—natural compounds of anticancer and analgesic properties[J].Cancer medicine,2016,5(10):3 007-3 017.
[17] SCANDIFFIO R,GEDDO F,COTTONE E,et al.Protective effects of (E)-β-caryophyllene (BCP) in chronic inflammation[J].Nutrients,2020,12(11):3 273.
[18] AL-TAEE H,AZIMULLAH S,MEERAN M F N,et al.β-caryophyllene,a dietary phytocannabinoid attenuates oxidative stress,inflammation,apoptosis and prevents structural alterations of the myocardium against doxorubicin-induced acute cardiotoxicity in rats:An in vitro and in vivo study[J].European Journal of Pharmacology,2019,858:172467.
[19] KOYAMA S,PURK A,KAUR M,et al.Beta-caryophyllene enhances wound healing through multiple routes [J].PLoS One,2019,14(12):e0216104.
[20] ISLAM A U S,HELLMAN B,NYBERG F,et al.Myrcene attenuates renal inflammation and oxidative stress in the adrenalectomized rat model[J].Molecules,2020,25(19):4 492.
[21] BURCU G B,OSMAN C,ASL C,et al.The protective cardiac effects of Β-myrcene after global cerebral
C,et al.The protective cardiac effects of Β-myrcene after global cerebral  schemia/reperfusion in C57BL/J6 mouse1[J].Acta cirurgica brasileira,2016,31(7):456-462.
schemia/reperfusion in C57BL/J6 mouse1[J].Acta cirurgica brasileira,2016,31(7):456-462.
[22] HWANG E,NGO H T,PARK B,et al.Myrcene,an aromatic volatile compound,ameliorates human skin extrinsic aging via regulation of MMPs production[J].The American journal of Chinese medicine,2017,45(5):1 113-1 124.
[23] VIEIRA A J,BESERRA F P,SOUZA M C,et al.Limonene:Aroma of innovation in health and disease[J].Chemico-Biological Interactions,2018,283:97-106.
[24] CHI G F,WEI M M,XIE X X,et al.Suppression of MAPK and NF-κB pathways by limonene contributes to attenuation of lipopolysaccharide-induced inflammatory responses in acute lung injury[J].Inflammation,2013,36(2):501-511.
[25] DE MOURA ESP NDOLA R,MAZZANTINI R P,ONG T P,et al.Geranylgeraniol and β-ionone inhibit hepatic preneoplastic lesions,cell proliferation,total plasma cholesterol and DNA damage during the initial phases of hepatocarcinogenesis,but only the former inhibits NF-κB activation[J].Carcinogenesis,2005,26(6):1 091-1 099.
NDOLA R,MAZZANTINI R P,ONG T P,et al.Geranylgeraniol and β-ionone inhibit hepatic preneoplastic lesions,cell proliferation,total plasma cholesterol and DNA damage during the initial phases of hepatocarcinogenesis,but only the former inhibits NF-κB activation[J].Carcinogenesis,2005,26(6):1 091-1 099.
[26] ASOKKUMAR S,NAVEENKUMAR C,RAGHUNANDHAKUMAR S,et al.Antiproliferative and antioxidant potential of beta-ionone against benzo (a) pyrene-induced lung carcinogenesis in Swiss albino mice[J].Molecular and cellular biochemistry,2012,363(1):335-345.
[27] KANG C H,JAYASOORIYA R G P T,CHOI Y H,et al.β-Ionone attenuates LPS-induced pro-inflammatory mediators such as NO,PGE2 and TNF-α in BV2 microglial cells via suppression of the NF-κB and MAPK pathway[J].Toxicology in Vitro,2013,27(2):782-787.
[28] ANSARI M,EMAMI S.β-Ionone and its analogs as promising anticancer agents[J].European Journal of Medicinal Chemistry,2016,123:141-154.
[29] WANG Y,LIU Z W,SHU S Q,et al.AMPK/mTOR signaling in autophagy regulation during cisplatin-induced acute kidney injury[J].Frontiers in Physiology,2020,11:619730.
[30] LI L,TAN J,MIAO Y,et al.ROS and autophagy:Interactions and molecular regulatory mechanisms[J].Cellular and Molecular Neurobiology,2015,35(5):615-621.
[31] ZHENG J,HU S S,WANG J X,et al.Icariin improves brain function decline in aging rats by enhancing neuronal autophagy through the AMPK/mTOR/ULK1 pathway[J].Pharmaceutical Biology,2021,59(1):183-191.
[32] KOMATSU M,KUROKAWA H,WAGURI S,et al.The selective autophagy substrate p62 activates the stress responsive transcription factor Nrf2 through inactivation of Keap1[J].Nature Cell Biology,2010,12(3):213-223.
[33] MAUVEZIN C,NEUFELD T P.Bafilomycin A1 disrupts autophagic flux by inhibiting both V-ATPase-dependent acidification and Ca-P60A/SERCA-dependent autophagosome-lysosome fusion[J].Autophagy,2015,11(8):1 437-1 438.
[34] YAN Y M,JIANG K,LIU P,et al.Bafilomycin A1 induces caspase-independent cell death in hepatocellular carcinoma cells via targeting of autophagy and MAPK pathways[J].Scientific Reports,2016,6(1):37052.
[35] YIN J,GONG G,SUN C,et al.Angiopoietin 2 promotes angiogenesis in tissue-engineered bone and improves repair of bone defects by inducing autophagy[J].Biomedicine &Pharmacotherapy,2018,105:932-939.
[36] LI W,LI S ,LI Y ,et al.Immunofluorescence staining protocols for major autophagy proteins including LC3,P62,and ULK1 in mammalian cells in response to normoxia and hypoxia[J].Methods in Molecular Biology,2019,1 854:175-185.