麻保沙星(marbofloxacin,Mab)作为一种用于治疗动物皮肤感染、尿路感染和呼吸道感染的专用新型氟喹诺酮类抗菌药,具有抗菌谱广、抗菌活性强、毒性低且对其他抗菌药无交叉耐药性的优点[1-2]。然而,Mab在养殖业中的长期滥用,导致其在动物性食品中的残留超标,通过食物链进入机体,可能会伤害中枢神经系统,引起心血管疾病等[3]。为了更好地监管动物性食品中Mab残留,欧盟规定了Mab在牛奶和食用动物组织中的最大残留限量为30和150 μg/kg[4],我国食品质量管理标准GB/T 22985—2008 《牛奶和奶粉中恩诺沙星、达氟沙星、环丙沙星、沙拉沙星、奥比沙星、二氟沙星和麻保沙星残留量的测定 液相色谱-串联质谱法》中规定牛奶和奶粉中Mab限量为1 μg/kg。
目前检测Mab残留的方法有液相色谱法[5-6]、高效液相色谱-质谱法[7]、毛细管电泳法[8]、微生物法[9]、酶联免疫分析法[10-12]和胶体金试纸条法[13]。其中这些仪器分析方法大都存在样品前处理复杂、检测成本高、依赖专业的操作人员的缺点,酶联免疫分析方法和微生物法存在检测时间相对长的不足,胶体金免疫层析法的灵敏度低。而电化学免疫传感器具有灵敏、简便和快速的优势,能更好地满足Mab的快速检测需求。
氧化石墨烯(graphene oxide,GO)是一种二维碳纳米材料,其表面含有大量的羟基、羰基、羧基等含氧基团,这些官能团为固定抗体提供了大量的活性位点[14]。同时,GO还具有良好的生物相容性和巨大的比表面积,这些优良特性使其能够广泛用于电化学传感器[15-16]。壳聚糖(chitosan,CS)作为一种天然多糖,具有良好的成膜能力和生物相容性[17],其表面的氨基可与GO表面的羧基反应形成GO-CS复合膜,大大增加了抗体的结合面。该复合膜经电化学还原后,可大大提高电极的导电性能,从而提高Mab电化学免疫传感器的灵敏度。因此,本研究建立基于GO-CS复合膜修饰电极的Mab电化学免疫传感器。
1 材料与方法
1.1 材料与试剂
GO,上海源叶生物有限公司;CS、Mab标准品、氧氟沙星标准品、诺氟沙星标准品、环丙沙星标准品,阿拉丁;Mab抗体,实验室自制;铁氰化钾,天津市德华化学试剂有限公司;亚铁氰化钾、氯化钾、磷酸二氢钠、磷酸氢二钠、氢氧化钠、氧化铝粉末,天津市德恩化学试剂有限公司。试验中所用试剂均为分析纯,实验用水为二次去离子水。
1.2 仪器与设备
CHI610E电化学工作站、三电极体系CHI104型玻碳电极(工作电极)、R0302型AgCl电极(参比电极)、CHI115型铂丝电极(辅助电极),上海辰华仪器有限公司;KQ-50超声清洗仪,昆山市超声仪器有限公司;TM 3030 plus台式扫描电镜,日本日立公司。
1.3 实验方法
1.3.1 GO-CS复合膜的制备
称取5.0 mg CS溶于5.0 mL 0.05 mol/L的HCl溶液中,搅拌溶解后,用0.1 mol/L的NaOH溶液调节pH值至7.0,配制成质量浓度为1.0 mg/mL的CS溶液,4 ℃保存,备用。
称取2.0 mg GO加入到l.0 mL l.0 mg/mL CS溶液中,超声分散1 h,得到均匀分散的GO-CS混合体系,GO质量浓度为2.0 mg/mL,4 ℃保存,备用。
采用扫描电子显微镜(scanning electron microscope,SEM)表征GO和GO-CS复合膜的表面形貌。
1.3.2 免疫传感器的制备和Mab检测
(1)免疫传感器的制备
将直径为3 mm的裸玻碳电极(glassy carbon electrode,GCE)表面依次用1.0、0.3和0.05 μm的氧化铝粉末抛光,再分别用硝酸水溶液(1∶1,体积比)、无水乙醇和超纯水超声清洗,氮气吹干。随后进行循环伏安法(cyclic voltammetry,CV)扫描,出现稳定的氧化还原峰,且电位差在90 mV左右时,准确量取10 μL GO-CS复合膜溶液,垂直滴涂于GCE表面,室温下自然晾干。然后将电极置于pH 7.0 0.1 mol/L 磷酸盐缓冲液中,在(+0.2)~(-1.7) V的电位范围内利用CV法将GO-CS复合膜还原,得到还原氧化石墨烯-壳聚糖(reduced graphene oxide-chitosan,rGO-CS)复合膜。量取10 μL稀释好的Mab抗体,垂直滴涂于rGO-CS/GCE表面,置于生化培养箱中,37 ℃下温育1 h。再移取10 μL 5%牛血清白蛋白(bovine serum albumin,BSA)溶液,垂直滴涂于电极表面,37 ℃下温育l h,得到BSA/anti-Mab/rGO-CS/GCE,用CV法对修饰电极进行表征。
(2)Mab检测
量取10 μL Mab标准品溶液(或样品溶液)垂直滴涂在BSA/anti-Mab/rGO-CS/GCE表面,37 ℃温育1 h。然后在0.1 mol/L KCl+10 mmol/L K3Fe(CN)6+0.1 mol/L磷酸盐缓冲液测试底液中用CV法和差分脉冲伏安法(differential pulse voltammetry,DPV)扫描电极,并记录峰值电流。
1.3.3 电化学检测
采用CV和DPV方法进行电化学检测。在电化学工作站中,采用三电极体系,以BSA/anti-Mab/rGO-CS/GCE为工作电极,铂丝电极为辅助电极,AgCl电极为参比电极。在电化学测试时,测试底液为0.1 mol/L KCl+10 mmol/L K3Fe(CN)6+0.1 mol/L 磷酸盐缓冲液(pH=7.0),GO-CS复合膜还原时CV测试电位范围为(+0.2)~(-1.7) V,其余测试电位范围为(-0.2)~(+0.6) V,扫描速率为50 mV/s,DPV检测的电位范围为0~(+0.6) V,脉冲振幅为50 mV。
1.3.4 样品预处理
猪肉样品预处理:将猪肉样品切碎,准确称取2.0 g样品转移至50 mL离心管中,然后向该离心管中加入pH 7.0 0.5 mol/L乙二胺四乙酸和15.0 mL二氯甲烷,避光振荡10 min,离心(4 000 r/min,10 min),取上清液,重复提取2次,合并有机相,减压蒸发至近干,将残余物复溶在含10%甲醇的磷酸盐缓冲液(0.01 mol/L,pH=7.2)中,4 ℃保存,备用。
牛奶样品前处理:准确量取2.0 mL的牛奶转移至50 mL离心管中,加入4.0 mL乙腈,充分涡旋混匀,振荡10 min,离心(13 000 r/min,5 min),取上清液,加入5.0 mL的正己烷脱脂,涡旋1.0 min,静置,保留下层液体于圆底烧瓶中,重复2次,合并有机相,减压蒸发浓缩至近干,用1.0 mL 0.01 mol/L 磷酸盐缓冲液(pH=7.2)复溶,4 ℃保存,备用。
2 结果与分析
2.1 GO-CS复合物的表征
分别取1.0 mL的GO溶液和GO-CS溶液至玻璃皿表面,挥发至干,得到GO粉末和GO-CS复合膜,取少量粉末置于载物台上,放到SEM中,调节放大倍数和焦距,结果见图1。

a-GO;b-GO-CS
图1 GO和GO-CS的扫描电镜图(×1 000)
Fig.1 The SEM of GO and GO-CS (×1 000)
GO为均匀的片状结构,由于溶液干燥成粉末时发生了皱褶,故在SEM下观察的结果如图1-a所示。CS具有良好的分散性和成膜性,将GO和CS结合,形成一层均匀的导电薄膜(图1-b),提高了GO的分散性,增大了抗体的固定表面积。
2.2 电化学rGO-CS复合膜
在pH 7.0 0.1 mol/L 磷酸盐缓冲液中,以50 mV/s的扫描速率,在(+0.2)~(-1.7) V的电位范围内用电化学还原法对GCE上的GO-CS复合膜进行还原,结果见图2。
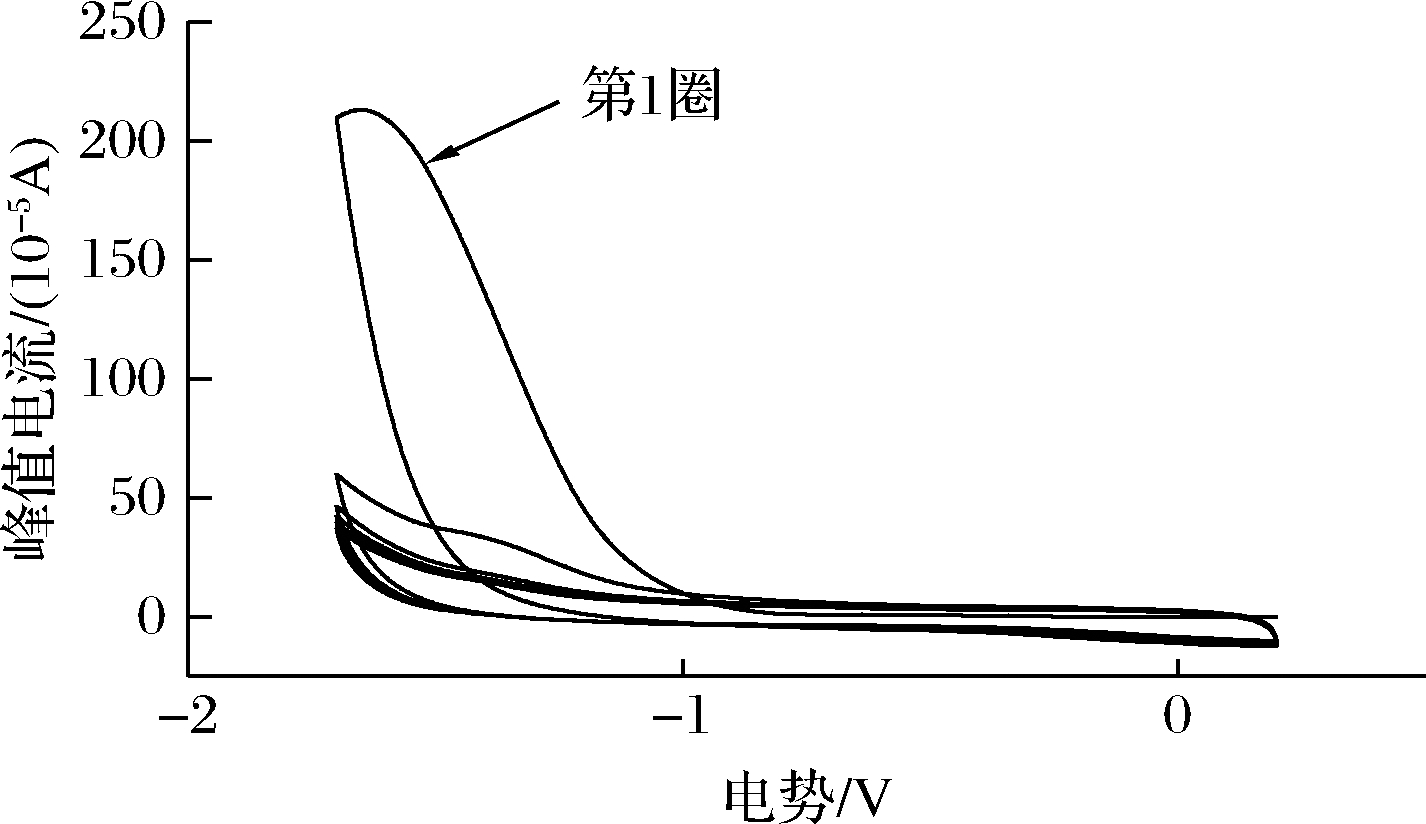
图2 GO-CS/GCE修饰电极在0.1 mol/L 磷酸盐溶液中的CV图
Fig.2 Cyclic voltammograms of GO-CS/GCE modified electrodes in 0.1 mol/L PBS
由图2可知,第1圈CV扫描时在-1.6 V处出现了一个较宽的还原峰,这是由GO上含氧官能团的还原所导致。随着电化学还原过程的发生,GO上的含氧官能团数量会越来越少,故在随后的扫描图中,还原电流变化越来越小,还原结果与文献中的报道一致[18-19]。经过12圈扫描后,滴涂在玻碳电极上的GO被不可逆地还原成rGO,得到rGO-CS复合膜。据文献报道[20],GO上含氧官能团的存在,会导致GO的导电性变差,所以,当GO被还原后,含氧官能团数量会大大减少,rGO的导电性增强,因此rGO-CS复合膜的导电性随之提高,进而提高免疫传感器的灵敏度。
2.3 不同修饰过程电极的表征
采用CV法对不同修饰过程电极表面的电化学行为进行表征,结果见图3。

a-GCE;b-GO-CS/GCE;c-rGO-CS/GCE;d-anti-Mab/rGO-CS/GCE;e-BSA/anti-Mab/rGO-CS/GCE
图3 不同修饰电极的CV图
Fig.3 Cyclic voltammograms of different modified electrodes in detection solution
由图3可知,GCE裸电极(图3中的a)经过抛光打磨处理后,出现了一对可逆的氧化还原峰,这是由六氰合铁(III)配离子的可逆的氧化还原行为形成的。当GCE表面修饰GO-CS后,峰值电流会减小(图3中的b),这是因为GO导电性不高,所以用GO-CS修饰GCE后会引起峰值电流减小;而将GO还原后,GCE的导电性会明显增强,故峰值电流显著增大(图3中的c),说明rGO的导电性较强。在电极上修饰anti-Mab后,峰值电流降低(图3中的d),这是因为蛋白质具有绝缘性,滴加在电极上,会阻碍电极表面的电子传递,所以当anti-Mab成功修饰在电极上,会引起峰值电流减小。用5%BSA溶液封闭1 h后,峰值电流会进一步减小(图3中的e),因为BSA会阻碍电极表面的电子传递,使得峰值电流进一步减小。
2.4 扫描速率的影响
在保持其他条件不变的情况下,考察扫描速率(10、20、30、40、50、60、70、80、90、100、110、120、130 mV/s)对免疫传感器的影响,结果见图4。

图4 不同扫描速率下BSA/anti-Mab/rGO-CS/GCE在测试底液中的CV图
Fig.4 Cyclic voltammograms of BSA/anti-Mab/rGO-CS/GCE in detection solution at different scan rates
注:插图为氧化还原峰值电流与扫描速率平方根的线性拟合图
如图4所示,在扫描速率为10~130 mV/s时,随着扫描速率的增加,氧化峰的电流值在增大,还原峰的电流值在逐渐减小,峰值电流与扫描速率平方根呈现出良好的线性关系,回归方程为:Ipa=1.756 64-1.591 74x,相关系数r=0.997 5和Ipc=-1.853 96+1.609 3x,相关系数r=0.997 3,说明电极反应受扩散过程控制。
2.5 检测条件的优化
本研究分别对抗体质量浓度(10、20、30、40、50、60、70、80、90、100 μg/mL)、测试底液中K3Fe(CN)6浓度(0、5、10、15、20 mmol/L)、测试底液pH(5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0)进行优化,结果见图5。
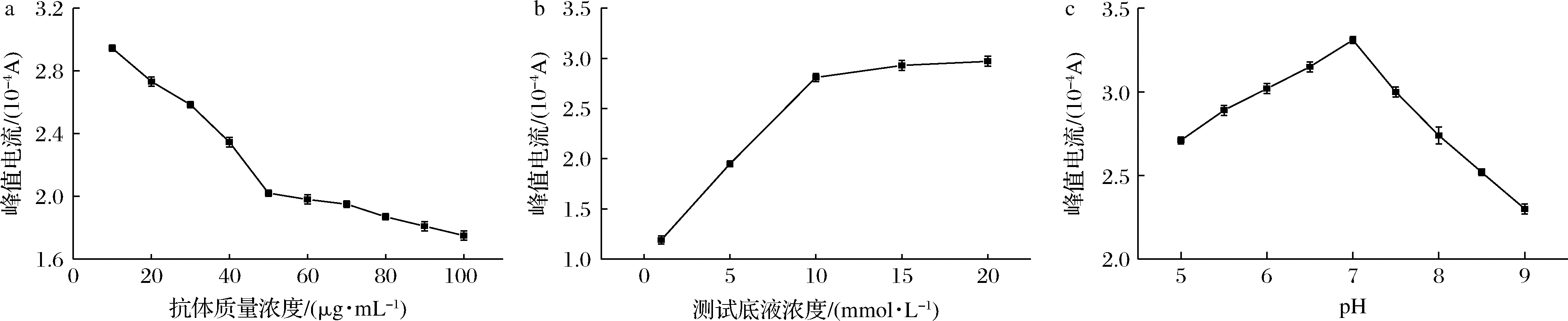
a-抗体浓度;b-K3Fe(CN)6浓度;c-测试底液pH
图5 抗体浓度、测试底液中浓度和pH的优化
Fig.5 Optimization of antibody concentration,K3Fe(CN)6 concentration and pH of detection solution
注:a:测试底液中K3Fe(CN)6浓度10 mmol/L,测试底液的pH 7.0;b:抗体质量浓度50 μg/mL,测试底液pH 7.0;c:抗体质量浓度50 μg/mL,测试底液中K3Fe(CN)6浓度10 mmol/L
由图5-a可知,在质量浓度为0~50 μg/mL时,随着抗体浓度的增加,固定到免疫传感器上的anti-Mab量会增多,使电极表面的阻抗增加,从而使峰值电流减小;当抗体质量浓度高于50 μg/mL时,随着抗体浓度的增大,峰值电流的减小变缓,说明此时抗体在电极表面的固定量接近饱和,因此,选择50 μg/mL为Mab抗体的最佳修饰质量浓度。由图5-b可知,随着测试底液中K3Fe(CN)6浓度的增大,免疫传感器的电流响应值迅速增大,当K3Fe(CN)6浓度达到10 mmol/L时,电化学免疫传感器电流响应值达到最大值2.81×10-4 A,此后,随着K3Fe(CN)6浓度进一步增大,电流响应值增加明显变慢,因此,选择K3Fe(CN)6浓度为10 mmol/L。测试底液的pH值对免疫传感器的性能也有重要影响,如图5-c所示,峰值电流随测试底液pH的升高先增大后减小,当pH为7.0时,峰值电流达到最大值3.31×10-4 A。这是因为酸性(或碱性)环境对抗体蛋白的活性和抗体在电极表面固定量有影响。因此,选用测试底液的pH为7.0。
2.6 Mab标准曲线的建立
电化学传感器的有效响应范围是传感器在实际应用中最重要的参数。按照1.3.2的方法测定Mab一系列不同质量浓度(2、5、10、15、20、25、30、35、40 ng/mL)的峰值电流,以Mab质量浓度为横坐标,以峰值电流为纵坐标,用Origin软件进行线性拟合,结果见图6。
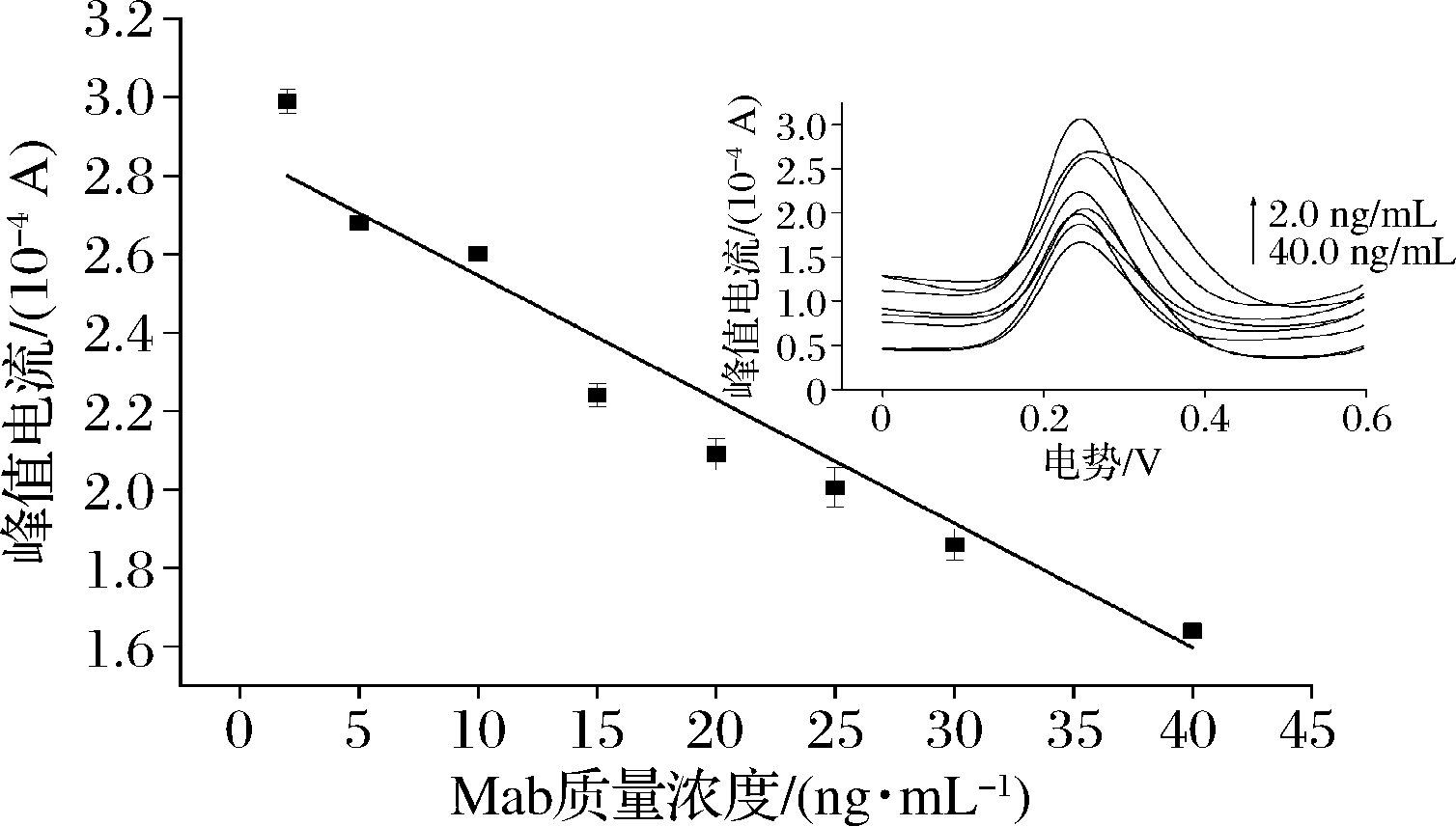
图6 DPV的峰值电流对不同质量浓度Mab的线性拟合图
Fig.6 Linear fitting graph of peak currents of DPV towards different Mab concentrations
注:插图为免疫传感器对不同质量浓度Mab的DPV图
由图6可知,在2.0~40.0 ng/mL,DPV峰值电流随着Mab质量浓度增大而减小,呈现良好的线性关系,回归方程为y=2.863-0.032x,相关系数r=-0.98,检测限为0.08 ng/mL,远低于国家规定Mab最大残留限量。结果表明,该电化学免疫传感器在Mab质量浓度在2.0~40.0 ng/mL范围内的测定结果较准确。
2.7 特异性和稳定性
在Mab标品溶液中分别添加100倍质量浓度的氧氟沙星、诺氟沙星、环丙沙星,相同条件孵育后,只含Mab标品和加入干扰物后,DPV检测峰值电流分别为2.53×10-4、2.58×10-4、2.61×10-4、2.64×10-4 A,表明在加入干扰物后,电流分别增加1.98%、3.16%、4.35%,这说明所构建的Mab电化学免疫传感器具有良好特异性。
将电化学免疫传感器置于4 ℃阴凉干燥处,保存25 d,每隔5 d测定1次相同电极的DPV峰值电流。结果表明,随着保藏时间的延长,传感器的峰值电流在缓慢下降,25 d后传感器的峰值电流相较第1天降低约16.9%,由此得出传感器具有较好的稳定性。
2.8 添加回收试验
2.8.1 校正曲线
分别用猪肉样和牛奶样阴性样品处理液将Mab标品稀释成一系列质量浓度(5、10、15、20、25、30、35、40 ng/mL),用DPV检测,分别以Mab质量浓度为横坐标,以峰值电流为纵坐标,用Origin软件进行线性拟合得到样品中Mab检测的校正曲线。结果表明,Mab在5.0~40.0 ng/mL的质量浓度与峰值电流呈现良好的线性关系,猪肉样回归方程为y=2.475-0.026x,相关系数r=-0.989,检测限为0.11 ng/mL,牛奶样回归方程为y=2.839-0.035x,相关系数r=-0.992,检测限为0.097 ng/mL。
2.8.2 添加回收试验
按照1.3.4方法处理猪肉样和牛奶样,在猪肉样中Mab加标量为5、20、40 ng/g,在牛奶样中Mab加标量为5、20、40 ng/mL,每种样品重复处理3次,用DPV检测,用校正曲线的回归方程计算Mab浓度,结果见表1。
表1 添加回收试验结果(n=3)
Table 1 The results of spiked test (n=3)

样品加标量测定量回收率/%相对标准偏差/%5ng/g(4.22±0.47)ng/g84.406.17猪肉20ng/g(17.55±1.83)ng/g87.750.6040ng/g(37.42±1.62)ng/g93.562.475ng/mL(4.32±1.47)ng/mL86.405.86牛奶20ng/mL(17.99±2.07)ng/mL89.950.7940ng/mL(38.56±2.13)ng/mL96.362.27
由表1可知,猪肉样添加回收率为84.40%~93.56%,相对标准偏差为0.60%~6.17%,牛奶样添加回收率为86.40%~96.36%,相对标准偏差为0.79%~5.86%。说明本方法构建的电化学免疫传感器可用于猪肉和牛奶中Mab残留检测。
3 结论
本研究基于GO-CS复合膜构建了检测Mab的电化学免疫传感器。为了证实电化学免疫传感器的实用性,选择猪肉和牛奶的阴性样品进行添加回收试验,结果表明,制备的Mab/BSA/anti-Mab/rGO-CS/GCE电化学免疫传感器,在Mab质量浓度为2.0~40.0 ng/mL与电极峰值电流呈良好的线性关系,检测限为0.08 ng/mL,特异性和稳定性良好。添加回收试验表明,回收率为84.40%~96.36%,相对标准偏差为0.60%~6.17%。本研究所构建的基于GO-CS复合膜的电化学免疫传感器可用于动物性食品中Mab的检测。
[1] DUBREUIL L,HOUCKE I,LEROY I.In vitro activity of a new fluoroquinolone,marbofloxacin (RO 09-1168) against strictly anaerobic bacteria and some bacteria from human fecal flora[J].Pathologie-Biologie,1996,44(5):333-336.
[2] HEINEN E.Comparative serum pharmacokinetics of the fluoroquinolones enrofloxacin,difloxacin,marbofloxacin,and orbifloxacin in dogs after single oral administration[J].Journal of Veterinary Pharmacology and Therapeutics,2002,25(1):1-5.
[3] 陈勤勤.基于高效液相色谱法的马波沙星安全性研究[D].杭州:浙江农林大学,2020.
CHEN Q Q.Analyzing the safety of marbofloxacin by HPLC[D].Hangzhou:Zhejiang Agriculture &Forestry University,2020.
[4] TARANOVA N A,BERLINA A N,ZHERDEV A V,et al.Traffic light immunochromatographic test based on multicolor quantum dots for the simultaneous detection of several antibiotics in milk[J].Biosensors and Bioelectronics,2015,63:255-261.
[5] SEYHAN BOZKURT S,ERDOGAN D,ANTEP M,et al.Use of ionic liquid based chitosan as sorbent for preconcentration of fluoroquinolones in milk,egg,fish,bovine,and chicken meat samples by solid phase extraction prior to HPLC determination[J].Journal of Liquid Chromatography &Related Technologies,2016,39(1):21-29.
[6] 王想,谭艾娟,吕世明,等.猪排泄物中麻保沙星和盐酸沙拉沙星HPLC方法的建立[J].现代畜牧兽医,2019(1):7-11.
WANG X,TAN A J,LYU S M,et al.Establishment of HPLC method for mabofloxacin and sarafloxacin hydrochloride in pig excrement[J].Modern Journal of Animal Husbandry and Veterinary Medicine,2019(1):7-11.
[7] BARRETO F,RIBEIRO C B D,HOFF B R,et al.Development and validation of a high-throughput method for determination of nine fluoroquinolones residues in muscle of different animal species by liquid chromatography coupled to tandem mass spectrometry with low temperature clean up[J].Journal of Chromatography A,2017,1 521:131-139.
[8] WANG N,SU M,LIANG S X,et al.Sensitive residue analysis of quinolones and sulfonamides in aquatic product by capillary zone electrophoresis using large-volume sample stacking with polarity switching combined with accelerated solvent extraction[J].Food Analytical Methods,2016,9(4):1 020-1 028.
[9] 陈秀金,任国艳,许凯旋,等.牛奶中残留麻保沙星的微生物学检测方法[J].食品与生物技术学报,2018,37(1):107-111.
CHEN X J,REN G Y,XU K X,et al.Determination of marbofloxacin residues in milk by microbiological method[J].Journal of Food and Biotechnology,2018,37(1):107-111.
[10] SHEN G W,XIA X F,WEI K Y,et al.Determination of marbofloxacin residues in beef and pork with an enzyme-linked immunosorbent assay[J].Journal of Agricultural and Food Chemistry,2009,57(13):5 971-5 975.
[11] CHEN X J,LI Z Z,GUO J Y,et al.Simultaneous screening for marbofloxacin and ofloxacin residues in animal-derived foods using an indirect competitive immunoassay[J].Food and Agricultural Immunology,2017,28(3):489-499.
[12] 赵贵山,林梦舟,李辛洁,等.马波沙星单克隆抗体的制备及ELISA检测方法的初步建立[J].畜牧与兽医,2019,51(7):100-106.
ZHAO G S,LIN M Z,LI X J,et al.Preparation of monoclonal antibodies against marbofloxacin and establishment of an ELISA test method[J].Animal Husbandry &Veterinary Medicine,2019,51(7):100-106.
[13] 宗婧婧,张小军,严忠雍,等.胶体金免疫层析法检测水产品中15种喹诺酮类药物[J].理化检验(化学分册),2018,54(5):591-595.
ZONG J J,ZHANG X J,YAN Z Y,et al.Detection of 15 quinolones in aquatic products by colloidal gold immunochromatography[J].Physical Testing and Chemical Analysis Part B:Chemical Analysis,2018,54(5):591-595.
[14] MKHOYAN K A,CONTRYMAN A W,SILCOX J,et al.Atomic and electronic structure of graphene-oxide[J].Nano Letters,2009,9(3):1 058-1 063.
[15] MAZAHERI M,AASHURI H,SIMCHI A.Three-dimensional hybrid graphene/nickel electrodes on zinc oxide nanorod arrays as non-enzymatic glucose biosensors[J].Sensors and Actuators B:Chemical,2017,251:462-471.
[16] KHAN A,KHAN A A P,ASIRI A M,et al.Facial synthesis,characterization of graphene oxide-zirconium tungstate (GO-Zr(WO4)2) nanocomposite and its application as modified microsensor for dopamine[J].Journal of Alloys and Compounds,2017,723:811-819.
[17] 王贝贝,籍雪平,李献锐,等.基于纳米复合材料/壳聚糖膜的葡萄糖生物传感器研究[J].分析试验室,2013,32(6):20-23.
WANG B B,JI X P,LI X R,et al.Glucose biosensor based on nanocomposite/chitosan membrane[J].Chinese Journal of Analysis Laboratory,2013,32(6):20-23.
[18] MANI V,DEVADAS B,CHEN S M.Direct electrochemistry of glucose oxidase at electrochemically reduced graphene oxide-multiwalled carbon nanotubes hybrid material modified electrode for glucose biosensor[J].Biosensors and Bioelectronics,2013,41:309-315.
[19] CHIU N F,YANG C D,CHEN C C,et a1.Stepwise control of reduction of graphene oxide and quantitative real-time evaluation of residual oxygen content using EC-SPR for a label-free electrochemical immunosensor[J].Sensors and Actuators B:Chemical,2018,258:98l-990.
[20] 李垚桦,郝润芳,桑胜波,等.基于银纳米颗粒/还原氧化石墨烯的复合物修饰玻碳电极对对硝基苯酚的电化学检测[J].科学技术与工程,2018,18(5):7-12.
LI Y H,HAO R F,SANG S B,et al.A sensor for detection of 4-nitrophenol based on a glassy carbon electrode modified with Ag nanoparticles/reduced graphene oxide[J].Science Technology and Engineering,2018,18(5):7-12.