吡咯喹啉醌(pyrroloquinoline quinone,PQQ)是继黄素核苷酸(FMN/FAD)和吡啶核苷酸(NAD/NADP)之后被发现的第三种氧化还原酶的辅因子并且PQQ可以参与氧化还原过程[1]。PQQ可作为辅酶参与电子传递并表现出很强的抗氧化性[2-3],具有防护肝损伤[4-7]、促进生物体生长[8]、加快神经生长因子合成速率[9]、增强细菌对一些极端条件的耐受性[10-11]、清除氮自由基[12]等功能。在食品、医药和化妆品领域都有重要的应用价值。
目前,主要采用化学合成法和微生物发酵法合成PQQ。其中,化学合成法合成PQQ产量较高,但是存在的问题有合成步骤复杂、生产成本较高、副产物处理困难和产物回收率低。微生物发酵法生产PQQ成本低,主要采用以甲醇为碳源及其他无机盐培养基,反应条件温和、易于建立发酵控制策略及放大培养,因此微生物发酵法成为最有前景的工业化生产路线[13]。然而,能合成PQQ的菌株只有部分的革兰氏阴性菌[14-16],其中甲基营养菌合成PQQ的能力较强,目前研究最多的甲基营养菌是扭脱甲基杆菌(Methylobacterium extorquens)、脱氮生丝微菌(Hyphomicrobium denitrificans)及氧化葡萄糖酸杆菌(Gluconobacter oxydans)等。现阶段关于PQQ完整的代谢合成途径尚未完全阐明,通过代谢工程改造方法来提高PQQ产量仍然存在很多限制。因此目前提高PQQ产量的方法以筛选高产菌株为主,如柯崇榕[17]针对Hyphomicrobium denitrificans通过紫外诱变结合NTG诱变相结合的方式并对菌株进行一定的定向驯化筛选到了两株高产菌株;李红月等[18]以Methylobacterium extorquens I-F2为研究对象,通过ARTP诱变、流式分选的高通量筛选策略,并进一步对样品制备条件和流式分选过程进行优化,最终筛选出一株PQQ高产突变菌株。
本研究以Hyphomicrobium denitrificans CGMCC 1.12893为出发菌,采用常压室温等离子体(atmospheric and room temperature plasma,ARTP)诱变原始菌株,并结合光谱法和高效液相色谱法对突变株进行初筛及复筛,获得一株高产PQQ的诱变菌株。对筛选得到的高产突变菌株进行发酵培养基优化然后在5 L发酵罐上进行验证培养,进一步提高PQQ产量。
1 材料与方法
1.1 材料
1.1.1 菌株
脱氮生丝微菌CGMCC 1.12893,购于武汉微生物菌种保藏中心。
1.1.2 培养基
培养基:甲醇25 mL/L、(NH4)2SO4 2 g/L、Na2HPO4·12H2O 5 g/L、MgSO4·7H2O 1 g/L、KH2PO4 1.4 g/L。
微量元素(g/L):ZnSO4·7H2O 5.75;MnCl2·4H2O 0.32;CoCl2·6H2O 0.47;NaMoO4·2H2O 0.48;CaCl2·2H2O 2.9;FeSO4·7H2O 2.8。
维生素(g/L):生物素 0.05;泛酸钙 1;烟酸 1;肌醇 25;硫胺素HCl 1;吡哆醛盐酸盐 1;对氨基苯甲酸 0.02。
1.1.3 主要试剂
甲醇、(NH4)2SO4、Na2HPO4、MgSO4·7H2O、KH2PO4、ZnSO4·7H2O、MnCl2·4H2O、CoCl2·6H2O、NaMoO4·2H2O、CaCl2·2H2O、FeSO4·7H2O、泛酸钙,国药集团化学试剂有限公司;核黄素、生物素、维生素B1、对氨基苯甲酸,生工生物(上海)有限公司;烟酸、肌醇、吡哆醛盐酸盐,上海麦克林生化科技有限公司,PQQ,上海阿拉丁生化科技有限公司。
1.1.4 仪器与设备
ZQZY-CF8摇床,上海知楚仪器有限公司;CBM-20A高效液相色谱仪,日本Shimadzu 公司;Nanodrop ND-ONE分光光度计,美国Thermo公司;Eppendorf-5245离心机,美国Eppendorf公司;ARTP-IIS常压室温等离子体诱变仪,无锡源清天木生物科技有限公司;Synergy H1酶标仪,南京拜尔沃克智能科技有限公司;T&J-Atype 5 L发酵罐,迪必尔生物工程(上海)有限公司。
1.1.5 摇瓶培养条件
将安瓿管中菌粉用培养基混匀后30 ℃,220 r/min振荡培养,待菌株长至对数期进一步平板划线进行活化,30 ℃培养5 d。挑取单菌落接种至5 mL液体培养基,菌株长至对数期后按10% (体积分数)接种量转接至25 mL装液量的250 mL摇瓶中,30 ℃,220 r/min振荡培养。
1.2 实验方法
1.2.1 ARTP诱变处理
本研究采用ARTP诱变对出发菌株进行处理,将菌株接种于培养基中生长至对数期,然后稀释菌液使其OD650值在0.5~0.6。取1 mL菌液于1.5 mL的无菌EP管中,离心弃去上清液,用 pH=7的PBS缓冲液洗涤2次后,再加入1 mL缓冲液使菌体混合均匀。吸取10 μL菌悬液涂布于无菌的ARTP载片表面,然后用ARTP进行诱变,分别照射0、50、100、150、200、250、280、300 s。样品处理完毕,载片自动掉落至装有1 mL含有5%甘油的PBS缓冲液中,持续充分振荡1 min,将诱变后菌体充分洗脱形成菌液,然后稀释10-1~10-3倍数进行涂板,观察平板上菌落的生长情况并计算致死率。计算如公式(1)所示:
致死率![]()
(1)
式中:A表示未经ARTP处理的空白对照平板上长出的单菌落个数;B表示经过ARTP诱变处理后的平板上长出的单菌落个数。
1.2.2 高通量筛选方法
在30 ℃、220 r/min条件下将诱变后的单菌落接于48孔深孔板中培养10 d,离心后取200 μL上清液至96孔浅孔板中,用酶标仪分别检测326 nm处与400 nm处的吸光值,并计算OD326值与OD400值的差值,同时将培养基以同样的条件处理和检测,从而扣除培养基吸光值。简言之,利用PQQ在固定波长247 nm和330 nm处的特征吸收峰,并排除其他物质的干扰,选择326 nm和400 nm为检测波长以减少系统误差[19]。PQQ含量越高差值越高,然后进行复筛验证。
1.2.3 PQQ检测方法
采用高效液相色谱法对PQQ含量进行检测。将发酵液8 000 r/min离心5 min,取上清液用0.22 μm的水系膜过滤。HPLC条件:色谱柱Sun Fire C18 4.6 mm×250 mm (5 μm)。检测波长254/330 nm、柱温40 ℃,流动相为V(水+1‰ TFA)∶V(乙腈+1‰ TFA)=85∶15、流速为0.5 mL/min。
1.2.4 摇瓶发酵培养基条件优化
首先采用单因素试验确定碳源、氮源、金属离子及维生素的最佳组合。碳源:甲醇、乙醇、甘油,含量分别为25 mL/L,葡萄糖质量浓度为20 g/L,V(甲醇)∶V(乙醇)=1∶1、1∶4、4∶1;氮源:硫酸铵、尿素、蛋白胨、硝酸钠,质量浓度分别为2.0 g/L,氨水含量为2.0 mL/L;金属离子:Mg2+(1.0、2.0、3.0、4.0、5.0 g/L)、Fe2+(1.0、5.0、10.0、15.0、20.0 g/L)、Ca2+(0.01、0.1、0.2、0.4、0.6 g/L);维生素:核黄素(0.5、1.0、2.0 g/L)、对氨基苯甲酸(0.02、0.05、0.1、0.2 g/L)。为了进一步确定各因素(甲醇、硫酸铵、Mg2+、Ca2+、核黄素、对氨基苯甲酸)的最佳含量,在单因素实验的基础上进行六因素三水平的正交实验,如表1所示,进一步优化培养基。
表1 正交试验表
Table 1 Orthogonal experiment table
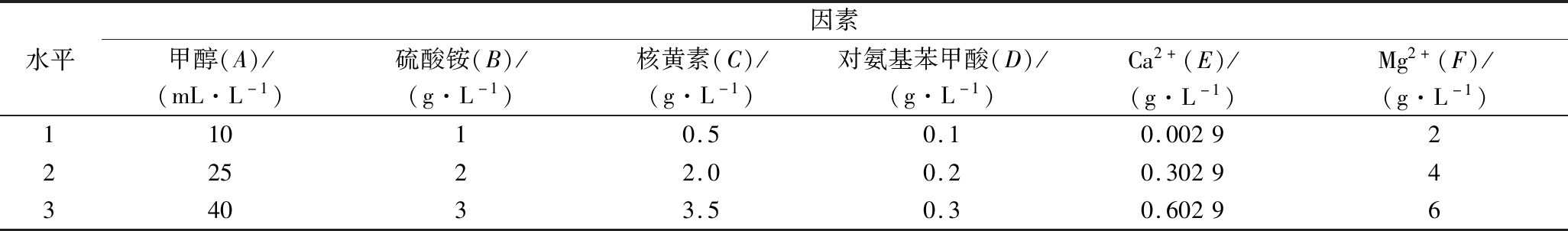
因素水平甲醇(A)/(mL·L-1)硫酸铵(B)/(g·L-1)核黄素(C)/(g·L-1)对氨基苯甲酸(D)/(g·L-1)Ca2+(E)/(g·L-1)Mg2+(F)/(g·L-1)11010.50.10.0029222522.00.20.3029434033.50.30.60296
1.2.5 5 L发酵罐培养条件
在正交试验得出的最优培养基的基础上,在5 L发酵罐上进行验证培养。5 L发酵罐装液量为 2.5 L,以恒速流加的方式进行补料,控制发酵罐内的甲醇含量在0~5 g/L,用氨水维持pH为7.0,菌体生长阶段溶氧控制在70%~80%,PQQ产生阶段溶氧控制在20%~30%。观察在发酵过程中菌株的生长情况及PQQ的产生情况。
2 结果与分析
2.1 ARTP诱变致死曲线的绘制
ARTP诱变的原理是通过控制产生的等离子体射流的强度引起其基因损伤,进而使生物特性有一定的改变,较高的致死率可以获得有效的突变率,研究结果表明致死率在90%以上时效果较佳[20]。菌株ARTP诱变的致死曲线如图1所示,在10-1的梯度下,照射时间为0~150 s时,致死情况较不明显;当照射时间为150~250 s时,致死率持续增长,280 s时致死率达到95%。一般认为致死率越高,诱变效果越好,但保持相对较低的致死率又有利于正突变的产生,所以本研究选择的诱变时间为250~280 s。
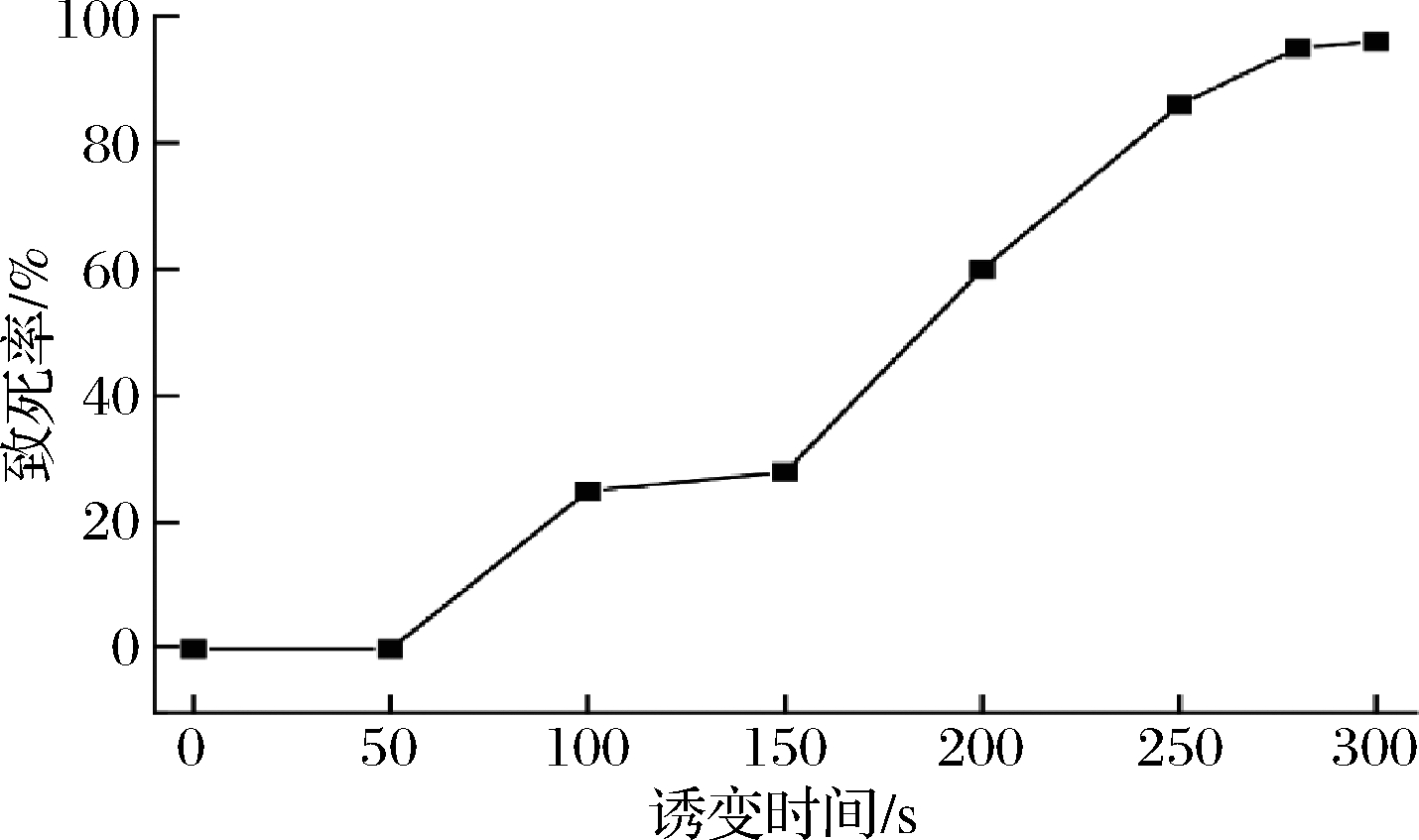
图1 致死曲线
Fig.1 The lethality curve
2.2 高通量筛选方法
目前,PQQ的检测方法主要有重组酶法、光谱法和高效液相色谱法[19]。重组酶法操作简单但是重复性不佳;光谱法精密度较好,但存在只适合检测纯度较高的PQQ的缺点;高效液相色谱法可定性定量的检测PQQ。本研究采用光谱法初筛和高效液相色谱法复筛的高通量筛选方法,设置了不同质量浓度(0、5、10、25、50、100、200 mg/L)的PQQ标准品,酶标仪检测发现其线性关系较好,标准曲线如图2-a所示。PQQ标准品的出峰时间如图2-b所示,在8 min左右时,254 nm和330 nm处均有峰出现。
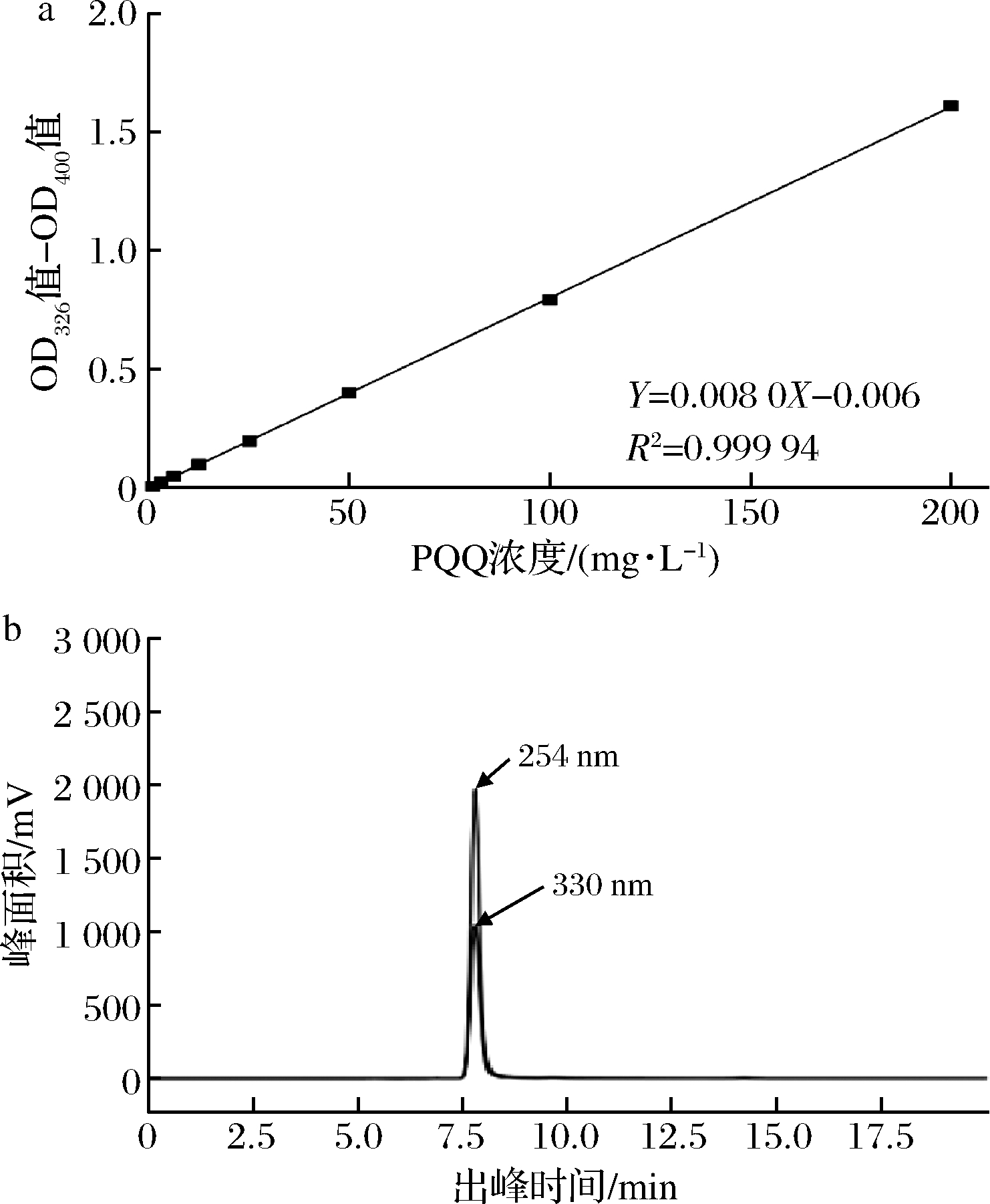
a-光谱法检测PQQ的标准曲线;b-PQQ标品HPLC图
图2 光谱法检测PQQ的标准曲线
Fig.2 Standard curve for detecting PQQ by spectroscopy
2.3 吡咯喹啉醌高产菌株的获得
将活化好的菌株进行ARTP诱变处理250~280 s,再进行孔板发酵。基于光谱法采用酶标板进行初筛(图3-a),选择孔板产量较高的39株菌株继续进行摇瓶复筛,复筛结果如图3-b所示。诱变后菌株的PQQ产量和对照组(编号为0)相比,大部分产量明显提高。在PQQ产量提高的菌种中,34号菌株的PQQ产量提高的最多,PQQ产量为48.4 mg/L,相比对照菌株(31.4 mg/L)提升了54.1%。对突变株34进行连续传代6代培养,并检测PQQ产量,如表2所示,PQQ产量保持稳定。
表2 突变菌株遗传稳定性
Table 2 The genetic stability of mutant strains
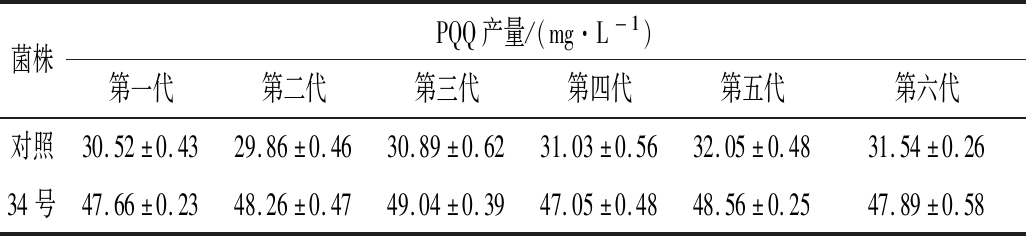
菌株PQQ产量/(mg·L-1)第一代第二代第三代第四代第五代第六代对照30.52±0.4329.86±0.4630.89±0.6231.03±0.5632.05±0.4831.54±0.2634号47.66±0.2348.26±0.4749.04±0.3947.05±0.4848.56±0.2547.89±0.58
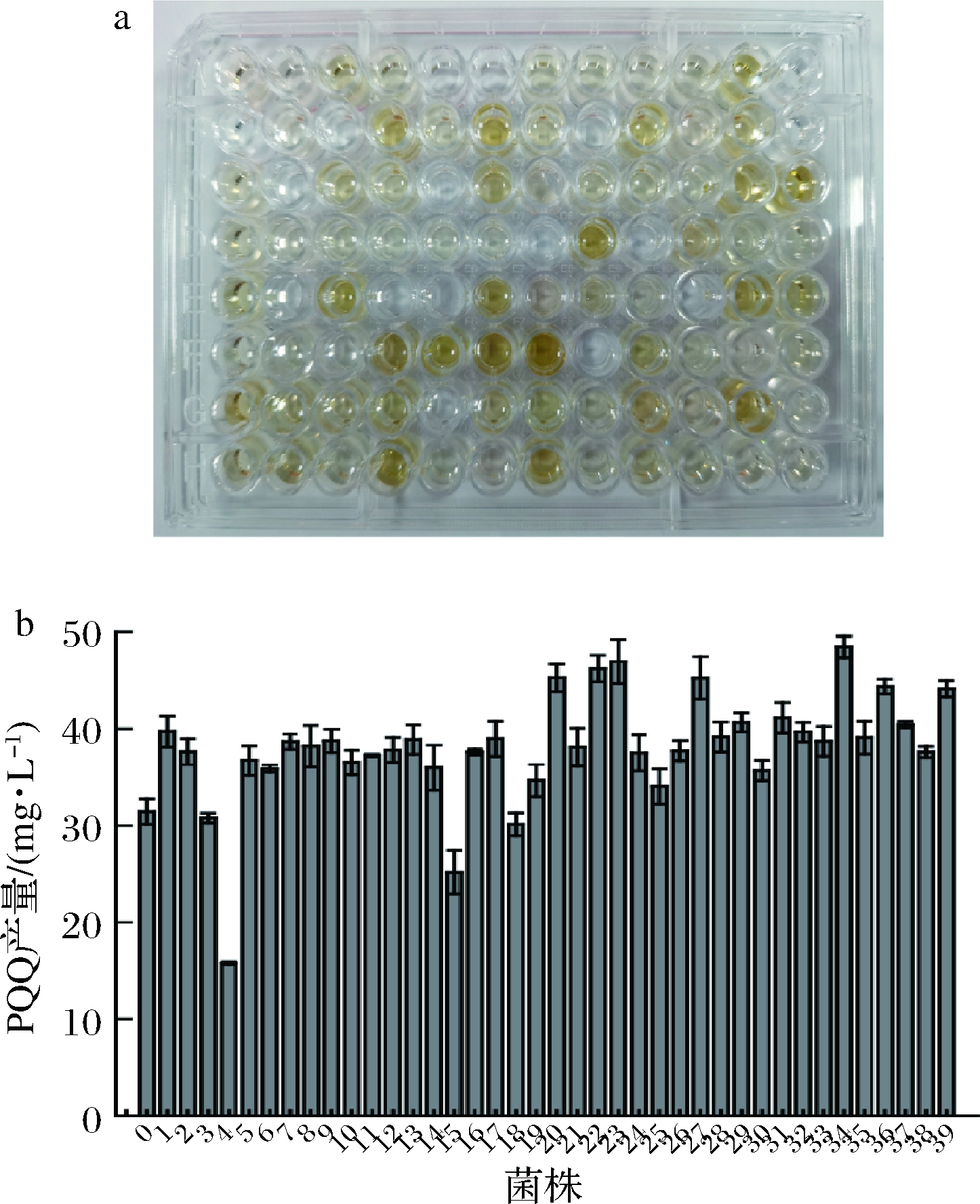
a-PQQ高产菌株初筛;b-PQQ高产菌株复筛
图3 PQQ高产菌株的初筛及复筛
Fig.3 Preliminary screening and re-screening of PQQ high-yield strains
2.4 摇瓶发酵培养基成分的优化结果
2.4.1 不同碳源条件下对PQQ的影响
研究不同碳源对生物量和PQQ产量的影响,结果如图4所示。当碳源是甲醇、乙醇和甘油时,可促进菌株的生长(图4-a);甲醇和乙醇为碳源时PQQ产量较高,分别在216 h和240 h达到最大值,为47.4 mg/L和47.9 mg/L(图4-b)。综上,当甲醇和乙醇为碳源时发酵结果较好。
又进一步研究了甲醇和乙醇为混合碳源时对其的影响。当V(甲醇)∶V(乙醇)=1∶4时,OD650值达到最大值2.0(图4-c),PQQ产量在192 h达到最高值51.8 mg/L(图4-d)。但据文献报道,生丝微菌属于兼性甲基营养菌,其不能利用甲烷,但可以利用甲醇等其他一碳化合物进行生长[17]。虽然在甲醇乙醇为混合碳源的情况下产量提高了4.4 mg/L,但其结果有待进一步验证,因此在后续的实验中选择了甲醇为单一碳源。
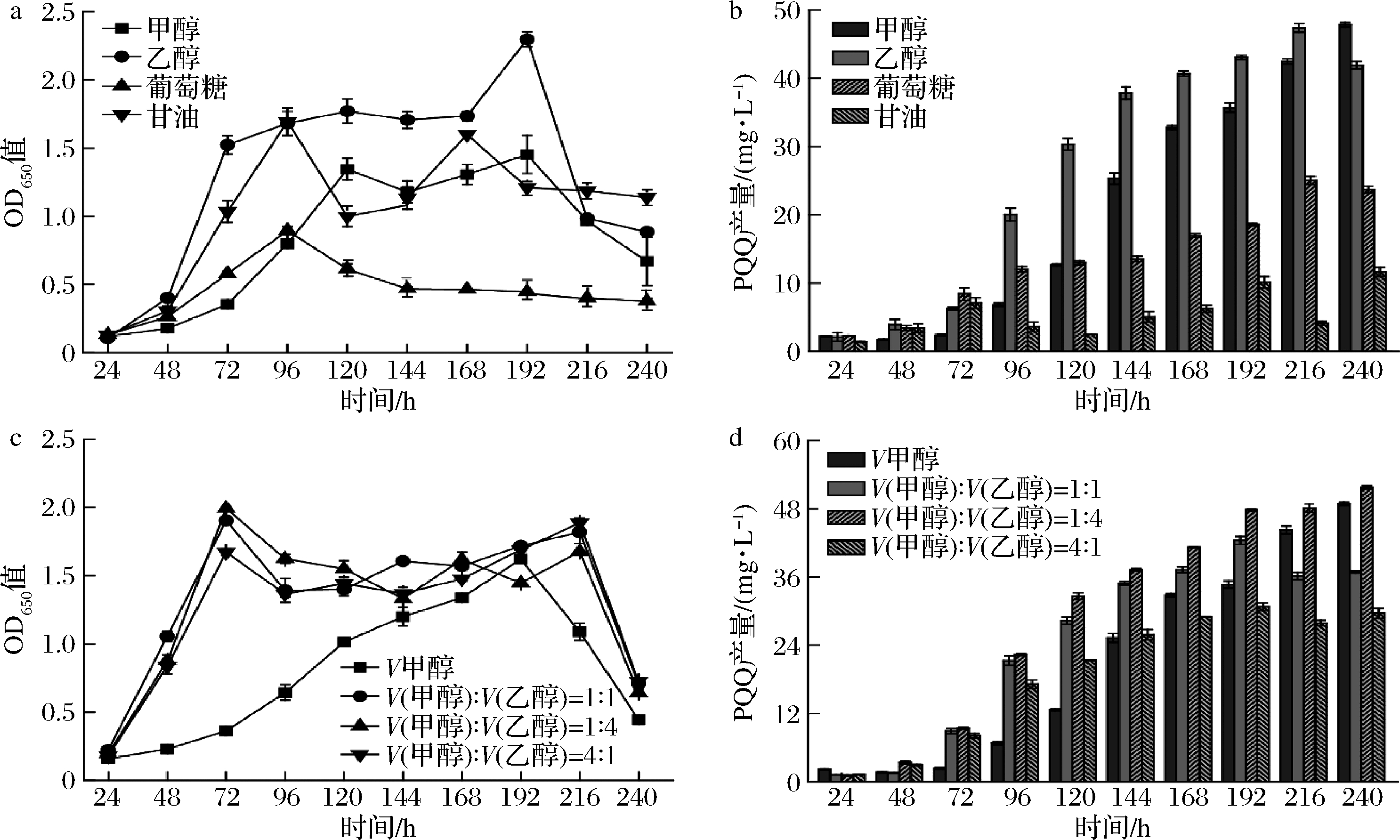
a-不同碳源的OD650值;b-不同碳源的PQQ产量;c-甲醇和乙醇不同比例下的OD650值;d-甲醇和乙醇不同比例下的PQQ产量
图4 不同碳源对生物量和PQQ产量的影响
Fig.4 Effect of different carbon sources on biomass and PQQ yield
2.4.2 不同氮源条件下对PQQ的影响
考察不同氮源对生物量和PQQ合成的影响。当氮源是氨水和硝酸钠时,对菌株的生长有明显的促进作用,在192 h时OD650值达到了最大值分别为3.0和2.7 (图5-a)。以硫酸铵、氨水和硝酸钠为氮源时PQQ产量相对较高,分别为47.7、45.7、52.5 mg/L(图5-b),考虑到安全和成本问题,选择硫酸铵为氮源。
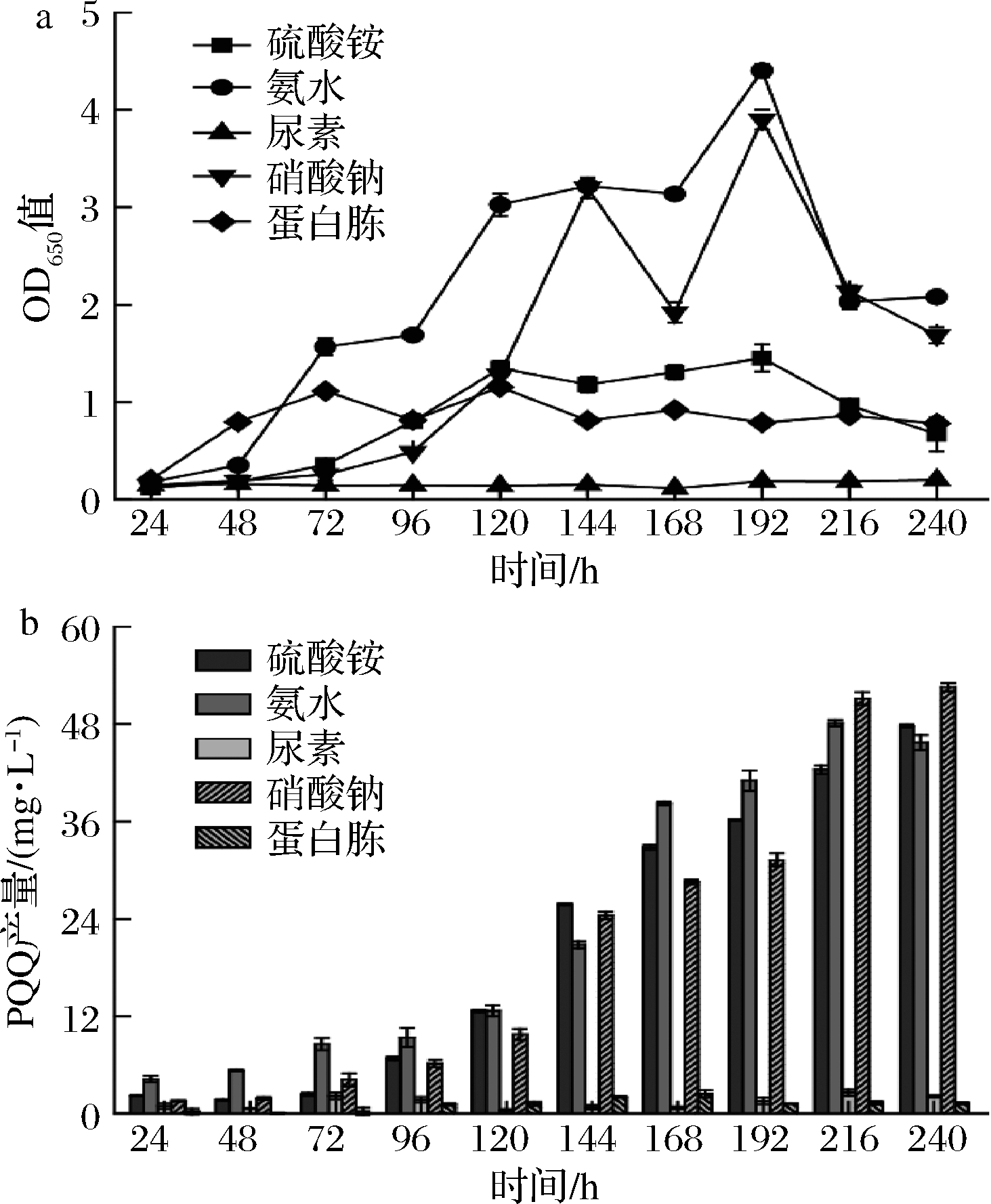
a-不同氮源的OD650值;b-不同氮源的PQQ产量
图5 不同氮源对生物量和PQQ产量的影响
Fig.5 Effect of different nitrogen sources on biomass and PQQ yield
2.4.3 不同浓度的金属离子对PQQ的影响
分别考察了Mg2+、Fe2+及Ca2+对生物量和PQQ合成的影响。结果表明,不同浓度的Mg2+对菌株生长的影响情况大致相同(图6-a),当Mg2+质量浓度为3.0、4.0 g/L时,在发酵240 h达到最大值,分别为62.6 mg/L和62.9 mg/L (图6-b);当Fe2+质量浓度为0.015 g/L时,其OD650的最大值为2.0 (图6-c)并且在Fe2+质量浓度为0.002 8 g/L时PQQ产量最高,为47.8 mg/L(图6-d);当Ca2+质量浓度为0.01 g/L时,OD650值在发酵240 h时达到最大值2.0(图6-e);在发酵240 h,Ca2+质量浓度为0.6 g/L时PQQ产量最高,为58.8 mg/L(图6-f),均高于对照组47.7 mg/L (图6-b)。
2.4.4 不同浓度的维生素对PQQ的影响
考察了核黄素及对氨基苯甲酸对生物量及PQQ合成的影响。结果表明,核黄素的质量浓度为1.0 g/L时,在发酵240 h时OD650值达到了最大值,为2.4(图7-a);核黄素质量浓度为2.0 g/L时,PQQ产量达到最大值,为66.4 mg/L (图7-b);由图7-c可知,较高浓度的对氨基苯甲酸对菌体的生长和PQQ产量都有一定的促进作用,当对氨基苯甲酸质量浓度为0.2 g/L时,OD650值达到1.7,PQQ产量最高达53.3 mg/L(图7-d)。
2.4.5 正交试验结果
基于上述单因素试验结果,采用L53(36)正交试验表进行正交优化试验。正交实验的53组实验结果如表3所示,第2、6、10、41、51组PQQ产量和对照相比都有相应的提升,第51组PQQ产量提升的最高,达到105.8 mg/L,提升了118.7%。因此,优化后的培养基配方为:甲醇25 mL/L、(NH4)2SO4 3 g/L、Na2HPO4 5 g/L、MgSO4·7H2O 2 g/L、KH2PO4 1.4 g/L、核黄素2 g/L、对氨基苯甲酸0.2 g/L。重复实验验证结果表明,PQQ平均产量为105.2 mg/L。
表3 正交试验表
Table 3 Orthogonal test table
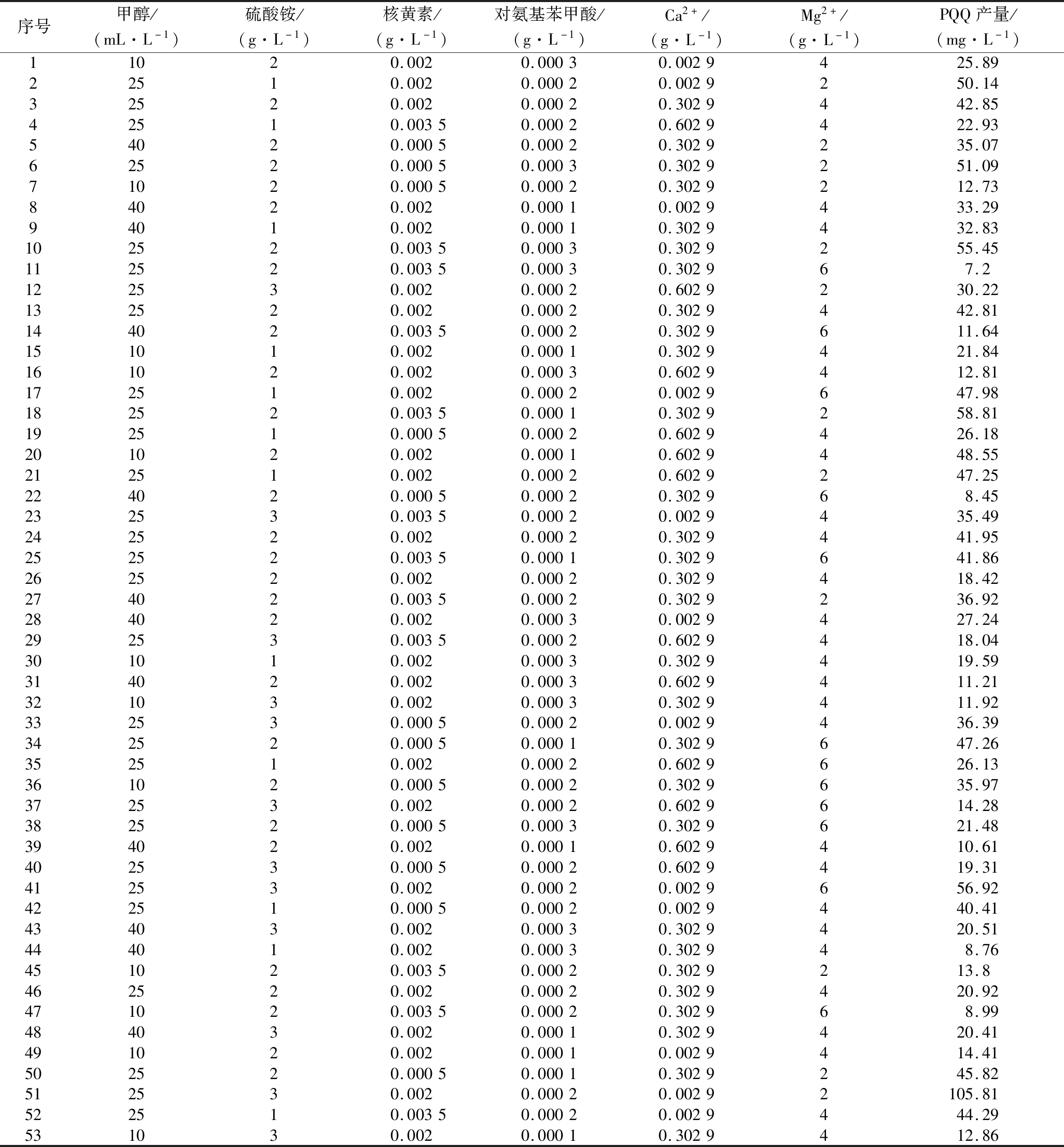
序号甲醇/(mL·L-1)硫酸铵/(g·L-1)核黄素/(g·L-1)对氨基苯甲酸/(g·L-1)Ca2+/(g·L-1)Mg2+/(g·L-1)PQQ产量/(mg·L-1)11020.0020.00030.0029425.8922510.0020.00020.0029250.1432520.0020.00020.3029442.8542510.00350.00020.6029422.9354020.00050.00020.3029235.0762520.00050.00030.3029251.0971020.00050.00020.3029212.7384020.0020.00010.0029433.2994010.0020.00010.3029432.83102520.00350.00030.3029255.45112520.00350.00030.302967.2122530.0020.00020.6029230.22132520.0020.00020.3029442.81144020.00350.00020.3029611.64151010.0020.00010.3029421.84161020.0020.00030.6029412.81172510.0020.00020.0029647.98182520.00350.00010.3029258.81192510.00050.00020.6029426.18201020.0020.00010.6029448.55212510.0020.00020.6029247.25224020.00050.00020.302968.45232530.00350.00020.0029435.49242520.0020.00020.3029441.95252520.00350.00010.3029641.86262520.0020.00020.3029418.42274020.00350.00020.3029236.92284020.0020.00030.0029427.24292530.00350.00020.6029418.04301010.0020.00030.3029419.59314020.0020.00030.6029411.21321030.0020.00030.3029411.92332530.00050.00020.0029436.39342520.00050.00010.3029647.26352510.0020.00020.6029626.13361020.00050.00020.3029635.97372530.0020.00020.6029614.28382520.00050.00030.3029621.48394020.0020.00010.6029410.61402530.00050.00020.6029419.31412530.0020.00020.0029656.92422510.00050.00020.0029440.41434030.0020.00030.3029420.51444010.0020.00030.302948.76451020.00350.00020.3029213.8462520.0020.00020.3029420.92471020.00350.00020.302968.99484030.0020.00010.3029420.41491020.0020.00010.0029414.41502520.00050.00010.3029245.82512530.0020.00020.00292105.81522510.00350.00020.0029444.29531030.0020.00010.3029412.86
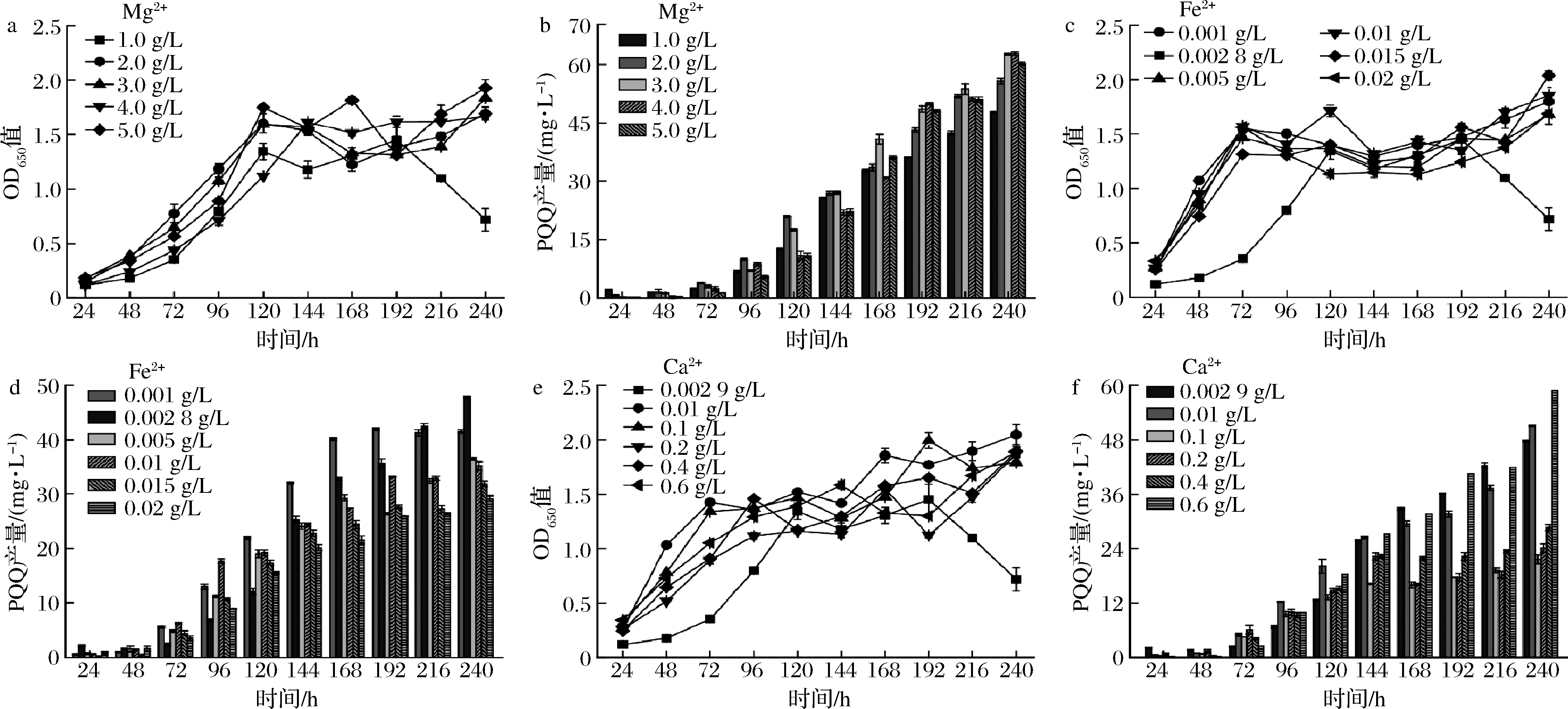
a-不同Mg2+浓度的OD650值;b-不同Mg2 +浓度的PQQ产量;c-不同Fe2+浓度的OD650值;d-不同Fe2+浓度的PQQ产量;e-不同Ca2+浓度的OD650值;f-不同Ca2+浓度的PQQ产量
图6 不同浓度金属离子对生物量和PQQ产量的影响
Fig.6 Effect of different metal ions concentration on biomass and PQQ yield
其结果的显著性分析如表4所示,发现金属元素中Ca2+P值<0.01,Mg2+的P值<0.05,Ca2+和Mg2+对PQQ产量有显著的影响,其余因素如甲醇、硫酸铵、核黄素和对氨基苯甲酸等对PQQ产量影响不显著。
表4 显著性分析
Table 4 Significance analysis

因素低水平高水平F值P值显著性甲醇/(mL·L-1)10400.04700.8293硫酸铵/(g·L-1)130.00580.9397核黄素/(g·L-1)0.53.50.09310.7617对氨基苯甲酸/(g·L-1)0.10.32.020.1615Ca2+/(g·L-1)0.00290.60298.100.0066∗∗Mg2+/(g·L-1)267.030.0110∗
注:*代表差异显著(P<0.05);**代表差异极显著(P<0.01)
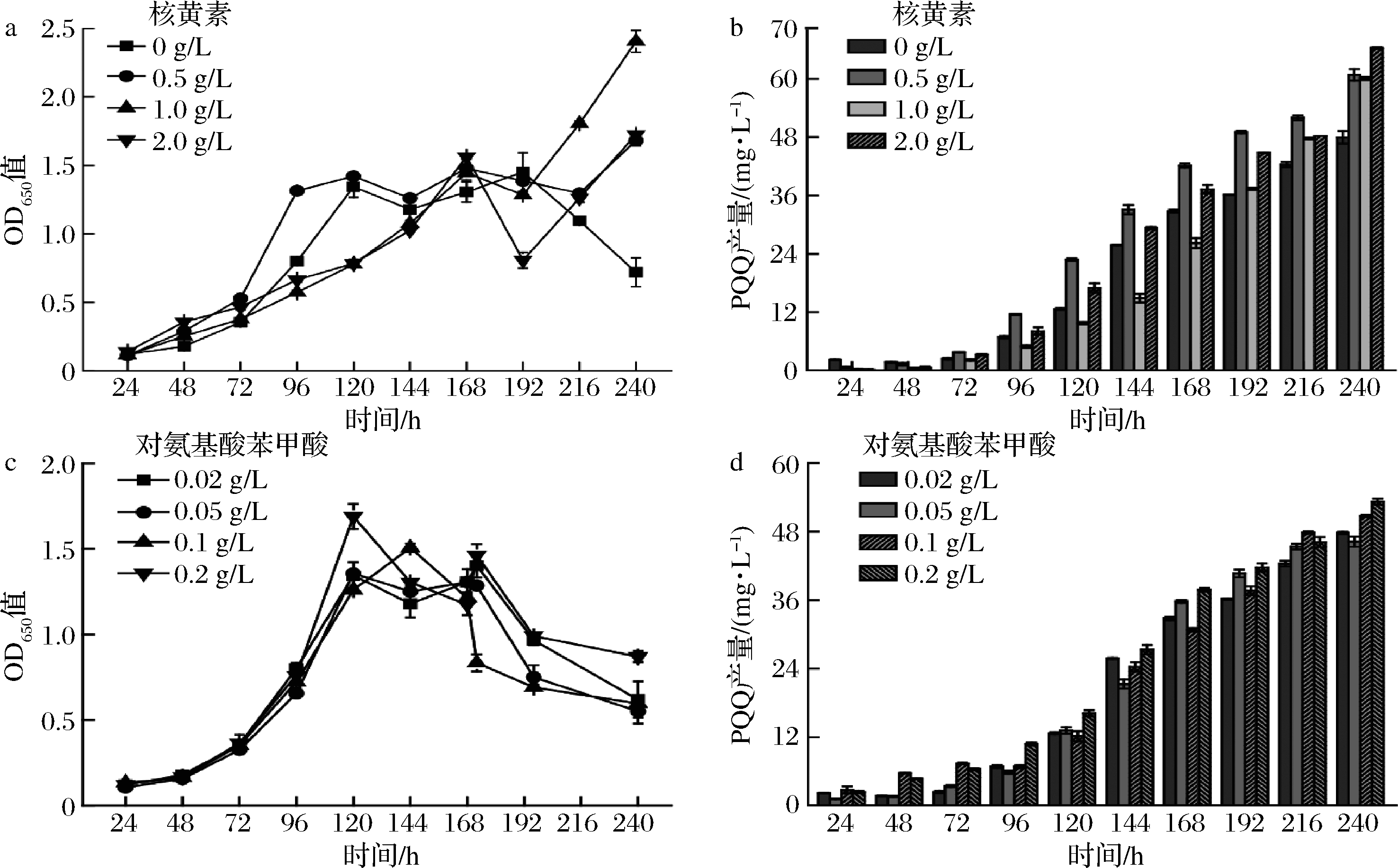
a-不同质量浓度核黄素的OD650值;b-不同质量浓度核黄素的PQQ产量;c-不同质量浓度对氨基苯甲酸的OD650值;d-不同质量浓度对氨基苯甲酸的PQQ产量
图7 不同浓度维生素对生物量和PQQ产量的影响
Fig.7 Effect of different vitamins concentration on biomass and PQQ yield
2.5 5 L发酵罐验证培养
基于摇瓶水平优化的培养基的配方,继续在5 L罐上对突变菌株和培养基进行验证培养。结果如图8所示,菌株的延滞期较长,在前48 h菌株生长较为缓慢,在发酵240 h时菌株的OD650值达到最大为83,甲醇在发酵前期消耗缓慢,48 h后消耗较快,发酵后期通过补料维持甲醇含量在0~5 g/L内,PQQ在72 h 后PQQ逐渐积累,240 h积累量达349.8 mg/L。相比摇瓶水平,在发酵罐上PQQ的产量明显提高,提高了2.3倍。

图8 5 L罐上发酵过程曲线
Fig.8 Process curve of fermentation on 5 L bioreactor
3 讨论
PQQ作为一种氧化还原酶的辅因子,在食品、医药和化妆品等领域具有重要的应用价值。虽然目前在基因工程方面取得了一定的进展,如ZHAO等[21]通过比较基因组学分析了诱变前后菌株基因组的差异及甲基杆菌PQQ过量产生的机制;WANG等[22]利用前体肽pqqA转化成了PQQ,但是PQQ的合成机理尚未得到清晰阐明,通过基因工程来获得PQQ高产菌株相对比较困难。目前,主要通过诱变育种和发酵工艺优化的方法来提高PQQ产量,并且在国内外研究中筛选得到的PQQ高产菌株主要是甲基营养型菌。如廖灿[23]、李慧芝等[24]分别对菌株Hyphomicrobium denitrificans FJNU-6和Methylobacterium extorquens AM1进行诱变并筛选得到的正突变株,获得较高产量的PQQ生产菌株;随后,LIU等[25]通过对Hyphomicrobium denitrificans FJNU-6两阶段控氧发酵工艺优化将PQQ产量提高至1 070 mg/L。郑玲辉等[26]利用NTG对Hyphomicrobium sp.1112进行诱变,获得了一株在80 T发酵罐中培养240 h,PQQ产量高达1 783 mg/L高产诱变菌株。
本研究以一株能积累PQQ的甲基营养菌脱氮生丝微菌CGMCC 1.12893为出发菌株,其初始产量为31.4 mg/L。根据PQQ在固定波长下具有特征吸收峰的特点,采用光谱法结合液相色谱法筛选获得了一株ARTP诱变后的高产菌株。针对筛选得到的高产菌株在摇瓶水平对碳源、氮源、金属离子及维生素成分进行了优化,PQQ产量提高至105.2 mg/L,相对于初始菌株提高了3.4倍。将突变菌株和优化后的培养基在5 L发酵罐上放大培养,发酵240 h后PQQ产量达到349.8 mg/L。PQQ合成和甲醇脱氢酶的合成是一个相互协调的过程,通过诱变育种及发酵优化的方法使PQQ产量相对于初始菌株得到了很大的提升,但是远未达到工业生产水平,依然面临很大的挑战。柯崇榕[27]针对Hyphomicrobium denitrificans FJNU-6 经过10轮适应性驯化获得了一株摇瓶稳定产量达65 mg/L的高产菌株FJNU-8,5 L发酵罐分批发酵PQQ产量达到1 087 mg/L。因此,在今后的研究中可以采用多种诱变相结合的方式对菌株进行诱变,并结合微流控技术筛选得到PQQ产量更高的突变株,以及在发酵罐上对不同发酵时期的溶氧、pH、补料方式及罐内甲醇含量等条件进行优化,以期进一步提高PQQ的产量。
[1] MISRA H S,RAJPUROHIT Y S,KHAIRNAR N P.Pyrroloquinoline-quinone and its versatile roles in biological processes[J].Journal of Biosciences,2012,37(2):313-325.
[2] 王子腾,郭勇,陈余,等.吡咯喹啉醌对动物抗氧化性能影响的研究进展[J].安徽农业科学,2020,48(15):28-30;34.
WANG Z T,GUO Y,CHEN Y,et al.Research progress on the effects of pyrroloquinoline quinone on animal antioxidant properties[J].Journal of Anhui Agricultural Sciences,2020,48(15):28-30;34.
[3] QIU K,ZHAO Q,WANG J,et al.Research progress on the effects of pyrroloquinoline quinone on animal antioxidant properties[J].International Journal of Molecular Sciences,2021,22(3):1 458.
[4] KIM J,KOBAYASHI M,FUKUDA M,et al.Pyrroloquinoline quinone inhibits the fibrillation of amyloid proteins[J].Prion,2010,4(1):26-31.
[5] KOBAYASHI M,KIM J,KOBAYASHI N,et al.Pyrroloquinoline quinone (PQQ) prevents fibril formation of alpha-synuclein[J].Biochemical and Biophysical Research Communications,2006,349(3):1 139-1 144.
[6] SCANLON J M,AIZENMAN E,REYNOLDS I J.Effects of pyrroloquinoline quinone on glutamate-induced production of reactive oxygen species in neurons[J].European Journal of Pharmacology,1997,326(1):67-74.
[7] SODE K,SANO H.Glu742 substitution to Lys enhances the EDTA tolerance of Escherichia coli PQQ glucose-dehydrogenase[J].Biotechnology Letters,1994,16(5):455-460.
[8] MING D X,HUANG C Y,WANG W H,et al.Effects of diet supplemented with excess pyrroloquinoline quinone disodium on growth performance,blood parameters and redox status in weaned pigs[J].Animals,2021,11(2):359.
[9] LIU S Q,LI H H,YANG J O,et al.Enhanced rat sciatic nerve regeneration through silicon tubes filled with pyrroloquinoline quinone[J].Microsurgery,2005,25(4):329-337.
[10] JOHNSON H A,TEBO B M.In vitro studies indicate a quinone is involved in bacterial Mn(II) oxidation[J].Archives of Microbiology,2008,189(1):59-69.
[11] TRCEK J,JERNEJC K,MATSUSHITA K.The highly tolerant acetic acid bacterium Gluconacetobacter europaeus adapts to the presence of acetic acid by changes in lipid composition,morphological properties and PQQ-dependent ADH expression[J].Extremophiles,2007,11(4):627-635.
[12] 马科,吴贞贞,杨雪鹏.还原态吡咯喹啉醌清除氮自由基能力研究[J].食品与机械,2021,37(5):6-9;46.
MA K,WU Z Z,YANG X P.The research on scavenging nitrogen radical ability of reduced pyrroloquinoline quinone[J].Food and Machinery,2021,37(5):6-9;46.
[13] SI Z J,ZHU J Z,WANG W G,et al.Novel and efficient screening of PQQ high-yielding strains and subsequent cultivation optimization[J].Applied Microbiology and Biotechnology,2016,100(24):10 321-10 330.
[14] MATSUTANI M,YAKUSHI T.Pyrroloquinoline quinone-dependent dehydrogenases of acetic acid bacteria[J].Applied Microbiology and Biotechnology,2018,102:9 531-9 540.
[15] AKAGAWA M,NAKANO M,IKEMOTO K.Recent progress in studies on the health benefits of pyrroloquinoline quinone[J].Bioscience,Biotechnology,and Biochemistry,2016,80(1):13-22.
[16] KELTJENS J T,POL A,REIMANN J,et al.PQQ-dependent methanol dehydrogenases:rare-earth elements make a difference[J].Applied Microbiology and Biotechnology,2014,98:6 163-6 183.
[17] 柯崇榕.吡咯喹啉醌的高产菌株选育、发酵制备及生物合成途径的研究[D].福州:福建师范大学,2016.
KE C R.Breeding,breeding,preparation and biosynthetic pathway analysis of pyrroroloquinoline quinone[D].Fuzhou:Fujian Normal University,2016.
[18] 李红月,曾伟主,周景文.高产吡咯喹啉醌扭脱甲基杆菌的高通量选育[J].生物工程学报,2018,34(5):794-802.
LI H Y,ZENG W Z,ZHOU J W.High-throughput screening of Methylobacterium extorquens for high production of pyrroloquinoline quinone[J].Chinese Journal of Biotechnology,2018,34(5):794-802.
[19] 杨延新,熊向华,游松,等.3种检测吡咯喹啉醌的方法比较[J].生物技术通讯.2011,22(4):544-547.
YANG Y X,XIONG X H,YOU S,et al.Comparing three kinds of pyrroloquinoline quinone detection methods[J].Letters in Biotechnology,2011,22(4):544-547.
[20] SCHUBERT W W,BEAUDET R A.Determination of lethality rate constants and D-values for heat-resistant Bacillus spores ATCC 29669 exposed to dry heat from 125 ℃ to 200 ℃[J].Astrobiology,2011,11(3):213-223.
[21] ZHAO C L,WAN Y P,CAO X J,et al.Comparative genomics and analysis of the mechanism of PQQ overproduction in Methylobacterium[J].World Journal of Microbiology &Biotechnology,2021,37(6):100.
[22] WANG G L,ZHOU Y F,MA K,et al.Bioconversion of recombinantly produced precursor peptide pqqA into pyrroloquinoline quinone (PQQ) using a cell-free in vitro system[J].Protein Expression and Purification,2021,178:105777.
[23] 廖灿.定向驯化选育高产吡咯喹啉醌脱氮生丝微菌[D].福州:福建师范大学,2016.
LIAO C.Directional domesticating breeding high-yielding pyrroloquinoline quinone producing Hyphomicrobium denitrificans[D].Fuzhou:Fujian Normal University,2016.
[24] 李慧芝,康振,李江华,等.常压室温等离子体诱变扭脱甲基杆菌AM1高产吡咯喹啉醌[J].生物工程学报,2016,32(8):1 145-1 149.
LI H Z,KANG Z,LI J H,et al.Mutagenesis of Methylobacterium extorquens AM1 for increasing pyrroloquinoline quinone production by atmospheric and room temperature plasma[J].Chinese Journal of Biotechology,2016,32(8):1 145-1 149.
[25] LIU M S,YANG X W,REN Y,et al.Two-stage oxygen supply strategy for enhancing fed-batch production of pyrroloquinoline quinone in Hyphomicrobium denitrificans FJNU-6[J].Applied Microbiology and Biotechnology,2020,104(15):6 615-6 622.
[26] 郑玲辉,杜敏娜,朱小容,等.一种生丝微菌和吡咯喹啉醌的制备方法:中国,CN106282044B[P].2019-10-29.
ZHENG L H,DU M N,ZHU X R,et al.A preparation method of Hyphomicrobium and pyrroloquinoline quinone:China,CN106282044B[P].2019-10-29.
[27] 柯崇榕.适应性驯化选育高产吡咯喹啉醌的生丝微菌突变株[J].生物工程学报,2020,36(1):152-161.
KE C R.Breeding of Hyphomicrobium denitrificans for high production of pyrroloquinoline quinone by adaptive directed domestication[J].Chinese Journal of Biotechology,2020,36(1):152-161.