二十二碳六烯酸(docosahexaenoic acid, DHA),俗称脑黄金,是一种对人体非常重要的omega-3多不饱和脂肪酸[1]。研究表明,DHA是作用于神经系统细胞生长及维持的一种主要元素,是大脑和视网膜的重要构成脂肪酸,对婴儿智力和视力发育均具有至关重要的作用[2]。传统的DHA生产途径主要是通过以深海鱼油为原料进行大规模提取[3]。然而,此种生产方式所获得的DHA产品的质量和产量均无法满足市场需求[3]。因此,开发与之相适应的新型DHA生产工艺变的尤为重要。
大量研究表明,利用裂殖壶菌(Schizochytrium sp.)通过微生物工业发酵法大规模制备DHA是解决其质量和产量不足的有效方法[4]。作为一种典型的好氧型产油微生物,裂殖壶菌生产DHA过程,需维持溶解氧浓度(dissolved oxygen concentration, DO)在充足水平,进而实现促进细胞生长和DHA积累的目的[5]。然而,好氧微生物若长期处于DO充足(过量)状态下,胞内活性氧(reactive oxygen species, ROS)易发生大量积累,进而损害其生物量和目标产物的生产[6-8]。因此,如何解决裂殖壶菌发酵生产DHA过程DO充足与ROS积累的矛盾已成为限制DHA大规模生产的主要瓶颈之一。在适应性实验室进化中,若微生物细胞长期处于某一培养环境导致毒性物质的积累,可通过切换至与其相反的培养环境进行恢复处理,实现有效地缓解环境压力(毒害)的目的[9]。基于此,本文拟构建一种新型的周期切换DO控制策略,即将培养(流加)阶段等分为若干阶段,每个阶段的前期维持DO于充足水平以满足细胞生长和DHA生产的供氧需求,后期维持DO于受限状态以实现抑制ROS积累的目的,最终实现裂殖壶菌高效生产DHA。
1 材料与方法
1.1 实验菌种
裂殖壶菌Schizochytrium sp.S31购自美国菌种收藏中心(ATCC)。
1.2 培养基
固体活化培养基(g/L):葡萄糖5,蛋白胨1,酵母粉1,海盐40,琼脂20,pH自然。
种子培养基(g/L):葡萄糖5,蛋白胨1,酵母提取物1,海盐40,pH自然。
分批培养基(g/L):葡萄糖100,酵母菌粉10,其他组分参照文献[10]。
葡萄糖流加培养基:葡萄糖500 g/L。
1.3 裂殖壶菌的分批补料生产DHA过程
将保藏于甘油管(-80 ℃)中的裂殖壶菌菌种转接至固体活化培养基,并在28 ℃的条件下培养3 d。之后,挑选单菌落接种于装有种子培养基的摇瓶中,在28 ℃、220 r/min的条件下培养36 h。在此基础上,将种子液按照13%的接种量转接至5 L搅拌式发酵罐进行分批补料发酵,初始体积为2.0 L,通气量2 L/min。培养温度控制于28 ℃,通过流加磷酸或NaOH将pH全程控制于7.0。同时,待分批发酵液中葡萄糖质量浓度逐渐消耗至40 g/L时,通过脉冲流加葡萄糖的方式,维持其质量浓度为40 g/L左右。培养过程中的DO控制方法分别按照下列方式:
DO充足控制:在培养阶段通过不断提高搅拌转速(≤800 r/min)维持DO>10%。如搅拌水平达到最大值时,DO仍不能控制于10%以上,则通入纯氧将DO全程控制于充足水平。
周期DO控制:以通入纯氧时为起始时刻,将培养阶段等分为10个10 h阶段,每个阶段的前8 h通纯氧维持DO于充足水平(≥10%),后2 h通过切换至空气供氧模式维持DO于受限水平(接近于零)。
1.4 细胞干重、葡萄糖浓度和ROS浓度的测定
细胞干重(dry cell weight, DCW)采用真空冷冻干燥法进行测定,具体操作流程与文献[2]相同。葡萄糖浓度则采用DNS法[11]进行测定。胞内ROS浓度的测定方法与参考文献[12]所报道的方法相同,其单位定义为荧光强度(fluorescence intensity, FI)/g DCW。
1.5 柠檬酸裂解酶(citrate lyase, ACL)、苹果酸酶(malic enzyme, ME)和葡萄糖-6-磷酸脱氢酶(glucose 6 phosphate dehydrogenase, G6PDH)酶活性的测定
利用超声波破碎仪对裂殖壶菌细胞进行破壁处理,之后离心取上清液进行ACL、ME和G6PDH酶活性的测定,其测定方法参照参考文献[13]。酶活力单位定义:1 min内NADPH的生成量,其数值等同于在340 nm波长下吸光值A增加0.001。比酶活力:酶活力单位/mg 可溶性蛋白。其中,可溶性蛋白采用Bradford方法进行测量[10]。
1.6 油脂提取及其各脂肪酸组分测定
油脂提取和甲酯化过程与文献[14]相同,内标选用十九烷酸。采用气相色谱分析法与内标法测定并计算油脂中各组分脂肪酸的含量[2]。
1.7 葡萄糖比消耗速度和维持代谢系数的确定
葡萄糖比消耗速度的计算方法:以葡萄糖消耗量(g/L)为纵坐标、独立培养时间(t)为横坐标进行多项式(二次)的线性拟合。基于此,通过葡萄糖消耗量对培养时间进行微分计算,即可确定葡萄糖比消耗速度。需要指出,分批培养阶段的葡萄糖消耗量由公式(1)计算得出,葡萄糖流加阶段的葡萄糖消耗量则由公式(2)计算得出:

(2)
式中:T和T-1分别代表当前及上一个取样的时刻,h;cGlu(T/T-1)代表T和T-1时刻之间的葡萄糖消耗量,g/L;m(T)和m(T-1)分别代表T和T-1时刻的葡萄糖流加瓶的质量,g;cGlu(T)和cGlu(T-1)分别代表T和T-1时刻的发酵液中葡萄糖质量浓度,g/L;V代表发酵液体积,L。
对于葡萄糖脉冲流加阶段,通过每隔2 h读取葡萄糖流加瓶质量的变化计算得出葡萄糖的流加量(g)。另一方面,通过采用适当调节取样次数(基准为间隔4 h)和取样体积的方法以实现维持发酵液体积(V)于恒定状态的目的。此时,由于发酵液体积的恒定,采用公式(2)对葡萄糖消耗量(g/L)进行计算,过程得到了简化。
维持代谢的确定:对于无胞外产物生成的细胞反应,其维持代谢系数可由公式(3)[15-16]计算得出:
(3)
式中:qGlu、YX/S、μ和m分别表示葡萄糖比消耗速度(1/h)、裂殖壶菌细胞对葡萄糖的得率系数、细胞比生长速度(1/h)和维持代谢系数(1/h)。
1.8 数据分析
所有实验重复3次,通过采用Excel和Origin 9软件对数据进行统计分析和绘图。
2 结果与分析
2.1 “葡萄糖充足-DO周期”组合控制策略抑制胞内ROS积累、强化裂殖壶菌生物量及DHA的积累
利用裂殖壶菌生产DHA的发酵过程普通认为维持碳源(葡萄糖)浓度于高水平可有效增强DHA的积累。因此,在5 L发酵罐中开展了初始葡萄糖质量浓度为100 g/L的裂殖壶菌分批发酵培养。如图1-a所示,在采用该发酵条件时,在葡萄糖充足条件下,由于裂殖壶菌高密度发酵过程的高耗氧特性导致DO在培养16 h时迅速降至接近于零的水平。然而,作为典型的好氧产DHA微生物,裂殖壶菌细胞若长期处于DO接近于零的水平会严重影响细胞生长及DHA的生产。如图1-c所示,当细胞长期处于DO受限条件下,在培养60 h时细胞浓度发生了明显下降,最终细胞浓度和DHA产量仅达到42.88 g/L和3.92 g/L 的较低水平。

a-DO;b-ROS浓度;c-细胞干重和DHA产量
图1 “葡萄糖充足-DO受限”控制策略下,裂殖壶菌生产DHA过程中DO、ROS浓度、细胞干重和DHA产量的变化模式
Fig.1 Variations of DO, ROS concentration, dry cell weight and DHA concentration in the process of DHA production by Schizochytrium sp.S31when using the control strategy of “glucose sufficient-DO limitation”
为此,本文采用了切换至纯氧供氧的模式解决了传统空气供氧模式不能实现将DO控制于充足水平的难题。同时,采用脉冲式流加葡萄糖的方式将发酵液中葡萄糖质量浓度全程维持于40 g/L左右的高水平状态,最终将培养过程维持在“葡萄糖充足-DO充足”的水平。图2显示了“葡萄糖充足-DO充足”条件下的裂殖壶菌生产DHA的发酵性能。如图2-c所示,在采用该控制策略下,细胞干重和DHA的积累均得到了一定程度地强化,分别达到了83.85 g/L和9.76 g/L的较高水平。
然而,微生物细胞若长期处于高DO状态,胞内ROS易发生大量积累[7]。此时,胞内积累的ROS又会与蛋白质、核酸等发生非特异性反应,诱导细胞死亡,严重破坏目标产物的生产性能[6, 15]。如图2-b所示,当裂殖壶菌细胞长期处于DO充足状态下,胞内ROS的积累量达到了209.37 FI/g DCW的极高水平,进而导致发酵后期裂殖壶菌生物量和DHA产量的积累速度减缓(图2-c)。

a-DO;b-ROS浓度;c-细胞干重和DHA产量
图2 “葡萄糖充足-DO充足”控制策略下,裂殖壶菌生产DHA过程中DO、ROS浓度、细胞干重和DHA产量的变化模式
Fig.2 Variations of DO, ROS concentration, dry cell weight and DHA concentration in the process of DHA production by Schizochytrium sp.S31when using the control strategy of “glucose sufficient-DO sufficient”
基于对采用“葡萄糖充足-DO受限”和“葡萄糖充足-DO充足”控制策略下,发酵性能的分析可知,DO充足状态可一定程度强化裂殖壶菌生产DHA过程中细胞生长及DHA积累,但存在胞内ROS易发生严重积累的难题。另一方面,虽然DO受限状态严重影响细胞的生长及DHA的积累,但此时ROS积累可得到一定程度地缓解。基于此,本论文提出一种新型的“葡萄糖充足-DO周期”组合控制策略,即以通入纯氧时为起始时刻,将培养阶段等分为10个10 h阶段,每个阶段的前8 h通纯氧维持DO于充足水平(≥10%),后2 h切换成空气供氧维持DO于受限状态(接近于零);同时,葡萄糖质量浓度在整个培养阶段全程维持40 g/L左右的高浓度水平。图3显示了“葡萄糖充足-DO周期”组合控制策略下裂殖壶菌生产DHA的发酵性能。如图3所示,采用该新型控制策略时,在有效保证氧气供应水平的同时,胞内的ROS积累也得到一定程度地缓解(209.37 FI/g DCW vs 146.38 FI/g DCW)。最终,裂殖壶菌细胞浓度和DHA的产量分别达到了100.88 g/L和13.69 g/L的最高水平(图3-c)。其中,DHA产量相比于对照两批次的3.92 g/L(葡萄糖充足-DO受限)和9.76 g/L(葡萄糖充足-DO充足),分别提高了256.1%和40.3%。
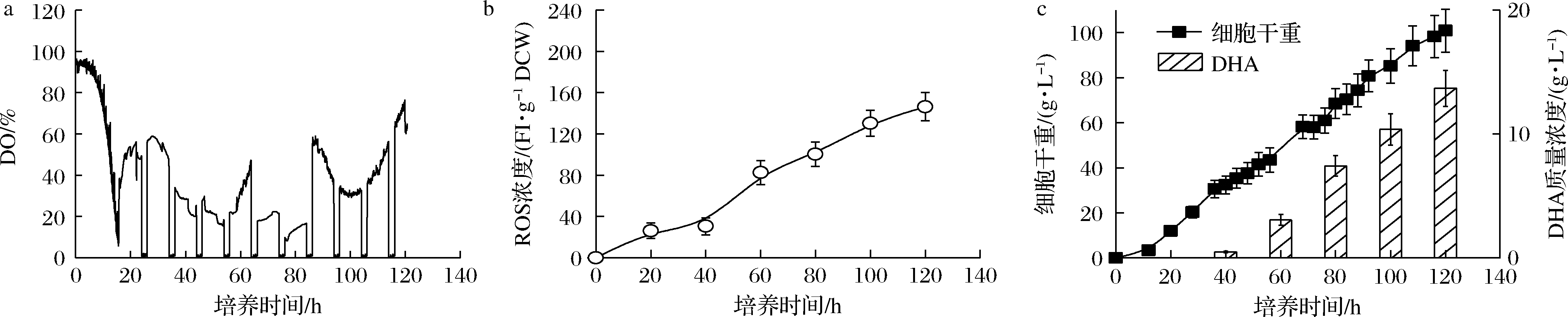
a-DO;b-ROS浓度;c-细胞干重和DHA产量
图3 “葡萄糖充足-DO周期”组合控制策略下,裂殖壶菌生产DHA过程中DO、ROS浓度、细胞干重和DHA浓度的变化模式
Fig.3 Variations of DO, ROS concentration, dry cell weight and DHA concentration in the process of DHA production by Schizochytrium sp.S31when using the combinational control strategy of “glucose sufficient-periodic DO operation”
2.2 “葡萄糖充足-DO周期”组合控制策略降低细胞维持代谢系数
大量研究表明,胞内ROS积累会与蛋白质、核酸等大分子物质非特异性反应,诱导其变性甚至造成细胞死亡[8, 17]。在此条件下,裂殖壶菌细胞不得不强化葡萄糖流向维持代谢途径的碳流量,以实现消除胞内ROS积累胁迫的影响。裂殖壶菌生产DHA过程在不同控制策略下的葡萄糖流向维持代谢途径的碳流量可通过公式(3)进行计算。图4显示了不同控制策略下,裂殖壶菌生产DHA过程中细胞比生长速度、葡萄糖比消耗速度和维持代谢系数的变化情况。如图4所示,当采用“葡萄糖充足-DO周期”组合控制策略时:(1)细胞比生长速度和葡萄糖比消耗速度均得到明显增强(图4-a和4-b);(2)葡萄糖流向维持代谢部分的碳流由0.026 6 1/h降至0.021 2 1/h的较低水平(图4-c)。最终,采用该最优控制策略时裂殖壶菌细胞浓度和DHA的产量分别达到了100.88 g/L和13.69 g/L的最高水平(图3-c)。

a-细胞比生长速度;b-葡萄糖比消耗速度;c-维持代谢系数计算
图4 不同控制策略下,裂殖壶菌生产DHA过程中葡萄糖消耗模式
Fig.4 Glucose consumption pattern in the process of DHA production by Schizochytrium sp.S31when using different control strategies
2.3 “葡萄糖充足-DO周期”组合控制策略强化细胞代谢活性
一般而言,利用裂殖壶菌生产脂肪酸的合成过程主要包含以下两类途径:脂肪酸合成酶(fatty acid synthase, FAS)途径和聚酮合成酶(polyketide synthase, PKS)途径。然而,无论采用FAS亦或是PKS脂肪酸合成途径,所需要的前体物质均为乙酰辅酶A(acetyl-CoA)和辅因子NADPH[18]。因此,解析乙酰辅酶A和NADPH的合成途径并对其合成过程中的关键酶活力进行比较分析,是阐明采用“葡萄糖充足-DO周期”组合控制策略时,可有效强化DHA生产的又一有效抓手。研究表明,ME途径和磷酸戊糖途径(pentose phosphate pathway,PPP)是裂殖壶菌生产脂肪酸过程细胞质中辅因子NADPH的主要来源[18-20]。另一方面,虽然线粒体中的糖酵解(glycolysis)途径、支链氨基酸分解代谢和脂肪酸β氧化途径可产生大量供脂肪酸合成所需的前体物质乙酰辅酶A,但是,通过FAS途径和/或PKS途径合成脂肪酸的过程主要发生于细胞质中,同时,线粒体内膜不允许乙酰辅酶A的穿透,因此,糖酵解途径、支链氨基酸分解代谢和脂肪酸β氧化途径产生的乙酰辅酶A无法直接为细胞质中脂肪酸的合成提供有效的前体物质[18]。之后,CHEN等[21]研究阐明了可为脂肪酸合成直接提供前体乙酰辅酶A的代谢途径为细胞质中ACL所催化的柠檬酸转化过程。同时,图5系统总结了裂殖壶菌中供给脂肪酸合成的前体物质乙酰辅酶A和辅因子NADPH主要来源的代谢简图[20]。

图5 裂殖壶菌生产DHA过程中的葡萄糖代谢简图
Fig.5 The simple map of glucose metabolisms in DHA production by Schizochytrium sp.S31
为此,本文系统比较了不同控制策略下裂殖壶菌生产DHA过程中关键酶——ACL、ME和G6PDH活性的变化情况。其中,ACL的功能是催化柠檬酸生成草酰乙酸和乙酰辅酶A,为脂肪酸的合成提供前体物质乙酰辅酶A;ME可催化L-苹果酸转变为丙酮酸,并为脂肪酸的合成提供前体物质NADPH;G6PDH催化葡萄糖-6-磷酸经代谢产生NADPH和核糖-5-磷酸,可为脂肪酸的合成提供前体物质NADPH。如图6所示,在采用“葡萄糖充足-DO周期”组合控制策略时,3种关键酶(ACL,ME和G6PDH)活性均得到了一定程度的增强。故此,在采用该最优控制策略时,可为脂肪酸(DHA)的合成提供充足的前体物质NADPH和乙酰辅酶A。最终,在此优化控制策略下,DHA的产量达到了13.69 g/L的最高水平,相较于对照两批次的3.92 g/L(葡萄糖充足-DO受限)和9.76 g/L(葡萄糖充足-DO充足),分别提高了256.1%和40.3%。
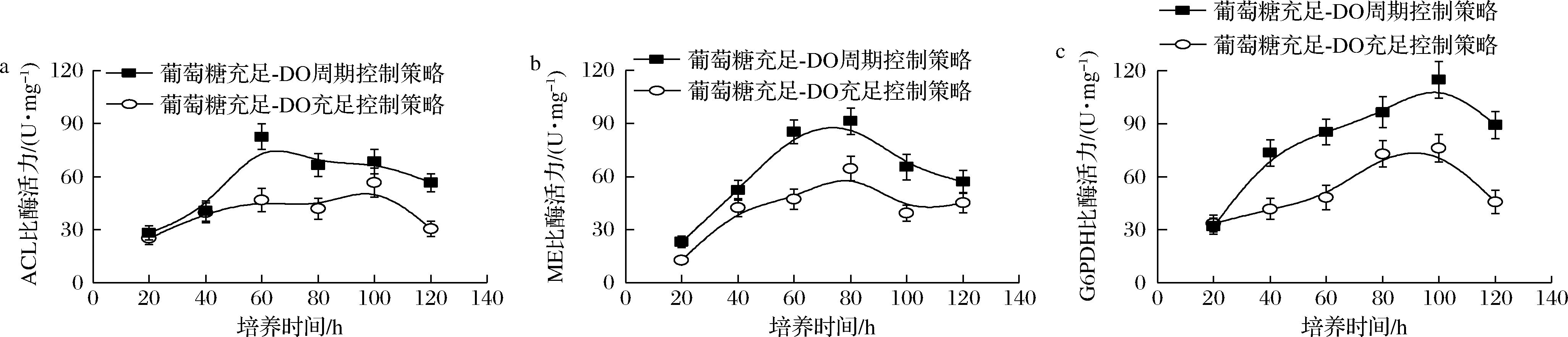
a-ACL比酶活力;b-ME比酶活力;c-G6PDH比酶活力
图6 不同控制策略下裂殖壶菌生产DHA过程中关键酶-ACL、ME和G6PDH酶活性的变化情况
Fig.6 Variations of enzymes activities of ACL, ME and G6PDH in DHA production by Schizochytrium sp.S31 when using different control strategies
3 结论
针对传统“葡萄糖充足-DO充足”控制策略下,裂殖壶菌生产DHA过程有毒物质ROS易发生大量积累胁迫其发酵性能的难题,本文提出了一种新型的“葡萄糖充足-DO周期”组合控制策略,即将培养阶段等分为10个10 h阶段,每个阶段的前8 h维持DO于充足水平,后 2 h 维持DO于受限状态,同时,全程维持葡萄糖于充足状态。结果表明,采用该新型组合控制策略时,在有效保证氧气供应水平的同时,胞内的ROS积累也得到一定程度地缓解(209.37 FI/g DCW vs 146.38 FI/g DCW)。最终,裂殖壶菌细胞浓度和DHA的产量分别达到了100.88 g/L和13.69 g/L的最高水平。其中,DHA产量相比于对照两批次的3.92 g/L(葡萄糖充足-DO受限)和9.76 g/L(葡萄糖充足-DO充足),分别提高了256.1%和40.3%。
[1] WANG Q, HAN W, JIN W B, et al.Docosahexaenoic acid production by Schizochytrium sp.:Review and prospect[J].Food Biotechnology, 2021, 35(2):111-135.
[2] CHEN W, ZHOU P P, ZHU Y M, et al.Improvement in the docosahexaenoic acid production of Schizochytrium sp.S056 by replacement of sea salt[J].Bioprocess and Biosystems Engineering, 2016, 39(2):315-321.
[3] XU X D, HUANG C Y, XU Z X, et al.The strategies to reduce cost and improve productivity in DHA production by Aurantiochytrium sp.:From biochemical to genetic respects[J].Applied Microbiology and Biotechnology, 2020, 104(22):9 433-9 447.
[4] PATIL K P, GOGATE P R.Improved synthesis of docosahexaenoic acid (DHA) using Schizochytrium limacinum SR21 and sustainable media[J].Chemical Engineering Journal, 2015, 268:187-196.
[5] JAKOBSEN A N, AASEN I M, JOSEFSEN K D, et al.Accumulation of docosahexaenoic acid-rich lipid in thraustochytrid Aurantiochytrium sp strain T66:Effects of N and P starvation and O2 limitation[J].Applied Microbiology and Biotechnology, 2008, 80(2):297-306.
[6] REN L J, SUN X M, JI X J, et al.Enhancement of docosahexaenoic acid synthesis by manipulation of antioxidant capacity and prevention of oxidative damage in Schizochytrium sp.[J].Bioresource Technology, 2017, 223:141-148.
[7] XIAO A F, ZHOU X S, ZHOU L, et al.Improvement of cell viability and hirudin production by ascorbic acid in Pichia pastoris fermentation[J].Applied Microbiology and Biotechnology, 2006, 72(4):837-844.
[8] SCHIEBER M, CHANDEL N S.ROS function in redox signaling and oxidative stress[J].Current Biology, 2014, 24(10):R453-R462.
[9] REYES L H, GOMEZ J M, KAO K C.Improving carotenoids production in yeast via adaptive laboratory evolution[J].Metabolic Engineering, 2014, 21:26-33.
[10] 常桂芳. 氧对裂壶藻利用甘油产DHA影响机制及其高密度发酵控制策略的研究[D].无锡:江南大学, 2013.
CHANG G F.The influence mechanism of oxygen on DHA production by Schizochytrium sp.with high cell density cultivation on glycerol[D].Wuxi:Jiangnan University, 2013.
[11] 廖祥兵, 陈晓明, 肖伟, 等.DNS法定量测定还原糖的波长选择[J].中国农学通报, 2017, 33(15):144-149.
LIAO X B, CHEN X M, XIAO W, et al.The wavelength selection of reducing sugar quantitatively determined by DNS method[J].Chinese Agricultural Science Bulletin, 2017, 33(15):144-149.
[12] LI X, HU H Y, ZHANG Y P.Growth and lipid accumulation properties of a freshwater microalga Scenedesmus sp under different cultivation temperature[J].Bioresource Technology, 2011, 102(3):3 098-3 102.
[13] REN L J, HUANG H, XIAO A H, et al.Enhanced docosahexaenoic acid production by reinforcing acetyl-CoA and NADPH supply in Schizochytrium sp HX-308[J].Bioprocess and Biosystems Engineering, 2009, 32(6):837-843.
[14] 周莉君, 刘静, 王艳芹, 等.12株油茶种仁含油率及脂肪酸组成分析[J].中国油脂, 2017, 42(5):132-135.
ZHOU L J, LIU J, WANG Y Q, et al.Analysis of kernel oil content and fatty acid composition of twelve Camellia oleifera Abel[J].China Oils and Fats, 2017, 42(5):132-135.
[15] BLANCH H W, CLARK D S.Biochemical Engineering[M].New York:Marcel Dekker, 1996:200-201.
[16] RAHIMI A, HOSSEINI S N, JAVIDANBARDAN A, et al.Continuous fermentation of recombinant Pichia pastoris Mut+ producing HBsAg:Optimizing dilution rate and determining strain-specific parameters[J].Food and Bioproducts Processing, 2019, 118:248-257.
[17] FINKEL T.Signal transduction by reactive oxygen species[J].The Journal of Cell Biology, 2011, 194(1):7-15.
[18] 李思杰. 基于辅因子合成及分配的裂殖壶菌产DHA的代谢调控研究[D].汕头:汕头大学, 2021.
LI S J.Metabolic regulation of Aurantiochytrium limacinum ATCC MYA 1381 DHA production based on the synthesis and distribution of cofactors[D].Shantou:Shantou University, 2021.
[19] CUI G Z, MA Z X, LIU Y J,et al.Overexpression of glucose-6-phosphate dehydrogenase enhanced the polyunsaturated fatty acid composition of Aurantiochytrium sp SD116[J].Algal Research, 2016, 19:138-145.
[20] CUI G Z, WANG Z J, HONG W, et al.Enhancing tricarboxylate transportation-related NADPH generation to improve biodiesel production by Aurantiochytrium[J].Algal Research-Biomass Biofuels and Bioproducts, 2019, 40:101505.
[21] CHEN W, ZHOU P P, ZHANG M, et al.Transcriptome analysis reveals that up-regulation of the fatty acid synthase gene promotes the accumulation of docosahexaenoic acid in Schizochytrium sp S056 when glycerol is used[J].Algal Research-Biomass Biofuels and Bioproducts, 2016, 15:83-92.