琼脂是来源于江蓠等海洋红藻中的以半乳糖为主要成分的一种高分子功能性多糖,具有多种陆地来源的多糖所不具备的优异性质如优异的溶胶凝胶特性,被广泛用于食品、医药、日用化工、生物工程等领域,是海洋藻类功能性多糖中不可或缺的重要成员[1-3]。随着琼脂研究的深入,琼脂的生物活性和应用被不断拓展,但琼脂在水中的溶解性较差,对溶解条件要求较为严苛,限制了琼脂的广泛使用。因此,对琼脂进行改性进而提高其在水中的溶解性成为琼脂研究的一个新方向。有学者采用超声处理、高压均质处理、加入助溶剂、酸解法、衍生化法等不同的手段对琼脂进行改性,取得了一定的成果[4-8]。高压均质处理和加入助溶剂的方法工艺简单灵活,对琼脂结构影响小,但其改性效果较有限,无法实现工业化;超声处理与酸处理法的使用成本低、操作简便,但会导致琼脂降解。衍生化法改善琼脂溶解性效果显著,根据需要还可对多糖黏度、凝胶透明度、凝胶溶胶温度等性质进行针对性调控,是一种极具潜力的琼脂改性方法。改善琼脂溶解性,获得一种简单、稳定的工艺是实现速溶琼脂工业化的重要前提。目前,多糖等高分子的改性方法主要有均相改性法和非均相改性法[9-11],前者需要将多糖溶解后再进行反应,其工艺复杂、操作繁琐,故多糖改性工艺更多使用的是非均相法体系,反应结束后通过简单的后处理即可实现产物分离,避免了溶解、醇沉等冗杂步骤,生产效率高。
本文旨在探究不同改性手段对提高琼脂溶解性的基础上,筛选出合适的改性方法,并对琼脂改性工艺进行进一步优化,以期获得一种工艺简单的高品质速溶琼脂改性工艺。
1 材料与方法
1.1 材料与试剂
食品级琼脂,绿新(福建)食品有限公司;过氧化氢、一氯乙酸、环氧丙烷、氢氧化钠,国药集团化学试剂有限公司;次氯酸钠、无水乙醇和冰醋酸,西陇化工有限公司。
1.2 仪器与设备
HWCL-5型恒温磁力搅拌浴,郑州长城科工贸有限公司;WD-1型凝胶强度仪,泉州万达实验仪器设备有限公司;WSB-3A型白度计,上海昕瑞仪器仪表有限公司;XMTD-8222型电热鼓风干燥箱,上海精宏实验设备有限公司;Pilot-5-8M型真空冷冻干燥机,北京博医康实验仪器有限公司;MS7-H550-PRO型加热磁力搅拌器,大龙兴创实验仪器(北京)有限公司;FTIR-84红外光谱仪, 日本Shimadzu公司;AVANCE III 850 MHz核磁共振仪,德国Bruker BioSpin Corp公司。
1.3 实验方法
1.3.1 琼脂衍生化方法比较
1.3.1.1 氧化琼脂的制备
称取琼脂10 g,置于250 mL的烧杯中,加入200 mL去离子水,搅拌分散琼脂。加入适量氢氧化钠调节pH至10,加入1.5 mL过氧化氢或2 mL次氯酸钠溶液,将烧杯置于30 ℃水浴锅中恒温反应4 h。抽滤,去离子水洗涤至中性,冷冻干燥,得氧化琼脂。
1.3.1.2 羧甲基化琼脂的制备
称取琼脂10 g,置于250 mL的烧杯中,加入70 mL 80%(体积分数)的乙醇溶液,搅拌分散,加入1.0 g氢氧化钠,将烧杯置于36 ℃水浴锅中保温碱化1 h。称取1.0 g氯乙酸溶于10 mL乙醇中配成氯乙酸-乙醇溶液,碱化完成后使用恒流泵在30 min内将氯乙酸-乙醇溶液缓慢泵入烧杯中,在50 ℃条件下反应3 h。反应完成后用30%乙酸溶液,将反应体系pH调至7,过滤,并用40%(体积分数)乙醇溶液洗涤2次,冷冻干燥,得羧甲基化琼脂。
1.3.1.3 羟丙基化琼脂的制备
称取琼脂10 g,置于250 mL的烧杯中,加入80 mL 80%(体积分数)的乙醇溶液,搅拌分散,加入2.0 g氢氧化钠,将烧杯置于36 ℃水浴锅中恒温水浴碱化1 h。碱化完成后加入12 mL 1, 2-环氧丙烷,升温至50 ℃,恒温反应3 h。反应结束后用30%(体积分数)的乙酸溶液将反应体系pH调至7,将产物过滤,并用40%乙醇洗涤2次、产物经干燥后制得羟丙基化琼脂。
1.3.2 羟丙基琼脂制备的单因素实验考察
拟对羟丙基化琼脂制备工艺中的氢氧化钠用量、反应温度和1, 2-环氧丙烷用量3个因素进行考察,研究其对改性琼脂性能指标的影响。
1.3.2.1 氢氧化钠单因素实验
以80 mL 80%(体积分数)的乙醇溶液作为反应液相,碱化温度为36 ℃,碱化时间为1 h,反应温度50 ℃,环氧丙烷用量为琼脂质量的12.5%。考察碱化氢氧化钠用量为琼脂质量的0%、5%、10%、15%、20%时对产品性能的影响。
1.3.2.2 反应温度单因素实验
以80 mL 80%(体积分数)的乙醇溶液作为反应液相,碱化温度为36 ℃,碱化时间为1 h,环氧丙烷用量为琼脂质量的12.5%,碱化氢氧化钠量为琼脂质量的10%。考察反应温度为30、40、50、60、70 ℃时对产品性能的影响。
1.3.2.3 环氧丙烷单因素实验
以80 mL 80%(体积分数)的乙醇溶液作为反应液相,碱化温度为36 ℃,碱化时间为1 h,反应温度为50 ℃,碱化氢氧化钠量为琼脂质量的10%。考察环氧丙烷用量为琼脂质量的2.5%、7.5%、12.5%、17.5%、22.5%时对产品性能的影响。
1.3.3 Box-Behnken响应面优化羟丙基琼脂制备工艺
根据单因素实验确定的最优条件范围,以氢氧化钠用量(A),反应温度(B),溶剂乙醇体积分数(C)为实验变量,以凝胶强度、溶解温度和白度为响应值,设计3因素3水平实验,以Box-Behnken响应面优化羟丙基琼脂制备工艺,实验方案见表1。除去所考查的3个变量,其余反应条件为:溶剂体积为60 mL、碱化温度为36 ℃、碱化时间1 h、环氧丙烷用量为琼脂质量的10%、反应时间为6 h。
表1 Box-Behnken响应面实验设计
Table 1 Box-Behnken response surface design
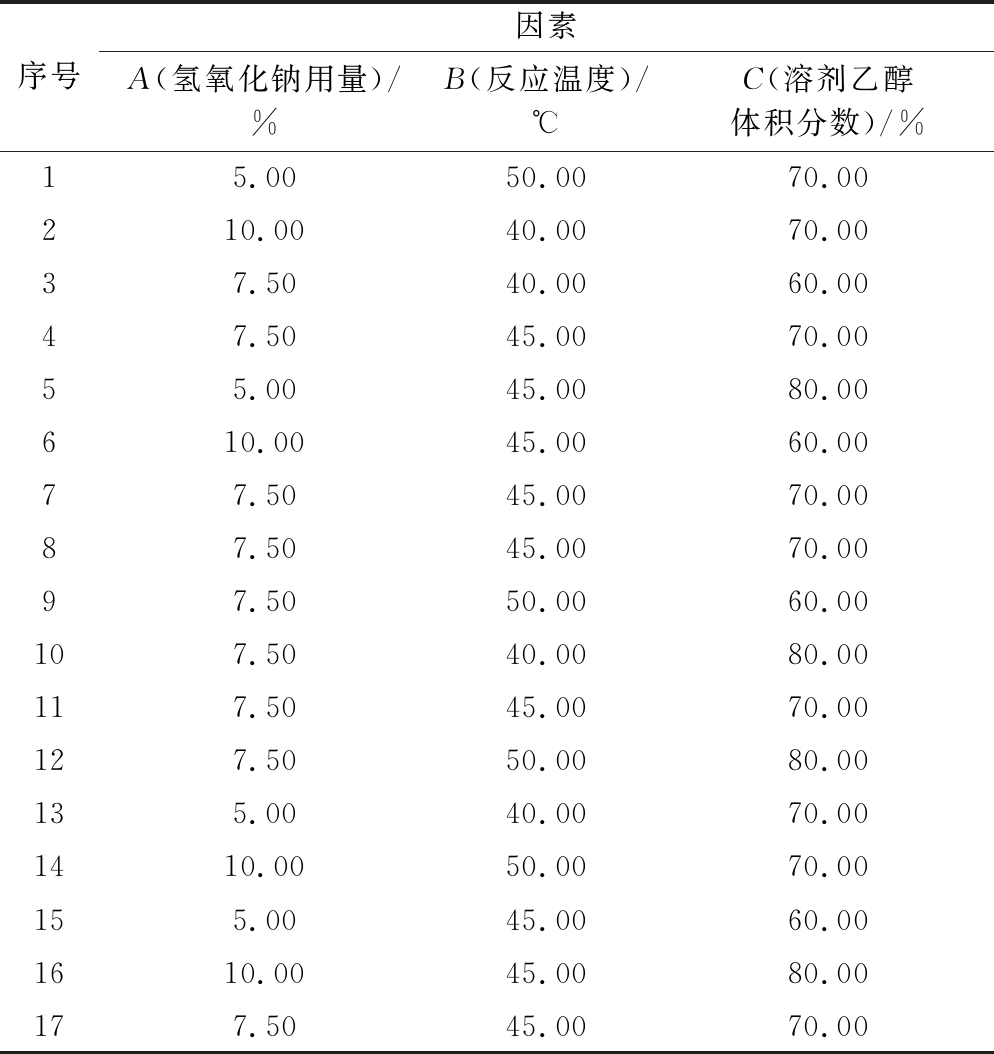
序号因素A(氢氧化钠用量)/%B(反应温度)/℃C(溶剂乙醇体积分数)/%15.0050.0070.00210.0040.0070.0037.5040.0060.0047.5045.0070.0055.0045.0080.00610.0045.0060.0077.5045.0070.0087.5045.0070.0097.5050.0060.00107.5040.0080.00117.5045.0070.00127.5050.0080.00135.0040.0070.001410.0050.0070.00155.0045.0060.001610.0045.0080.00177.5045.0070.00
1.3.4 衍生化琼脂性能检测方法
1.3.4.1 凝胶强度测定
配制100 mL 1%琼脂溶液,将琼脂溶液倒入凝胶强度测定杯中,每个测定杯中约25 mL,待形成稳定凝胶后,置于凝胶强度仪上测试凝胶强度,每个样品平行测定3份取平均值[12]。
1.3.4.2 溶解温度测定
改性琼脂溶解温度的测试参照CAO等[13]的方法并在其基础上进行适当改进。取0.5 g样品置于100 mL锥形瓶中,加入50 mL去离子水,搅拌使其充分吸水溶胀后,用带有温度计的软木塞塞住瓶口,使温度计水银球没入样品中,1 ℃/min速率匀速升温加热样品,待样品完全溶解后,记录此时温度,即为样品溶解温度,测量3次取平均值。
1.3.4.3 白度测定
将改性琼脂粉末搅拌均匀后置于白度仪样品池中,样品铺平后压实,置于白度仪测试台上测试,测量3次取平均值。
1.3.5 羟丙基琼脂的表征
1.3.5.1 傅立叶红外光谱(Fourier transform infrared spectroscopy, FTIR)表征
准确称量2 mg 干燥羟丙基琼脂,以质量比1∶150将干燥后的待测样品与溴化钾混合均匀、压制成片。将薄片置于红外光谱仪样品池中,记录样品在4 000~400 cm-1范围内的红外光谱图。
1.3.5.2 核磁共振表征(nuclear magnetic resonance, NMR)
分别称取20 mg琼脂和羟丙基琼脂样品,加入0.5 mL氘代二甲基亚砜,微热,振摇,使其充分溶解,转移至核磁管中,置于核磁共振仪中测定1H NMR和13C NMR谱图。
1.3.6 羟丙基琼脂对饮用型酸奶稳定性的影响
1.3.6.1 酸奶生产工艺流程
发酵流程[14-15]为:
脱脂奶粉10%、蔗糖5%、净化水40%(均为质量分数)→原料混合(50~60 ℃,30 min)→水合(1 h)→均质(60~65 ℃,20 MPa)→加热灭菌(95 ℃,5 min)→冷却→接种发酵剂(添加量0.08‰,质量分数)→发酵(41~43 ℃,9 h)→冷却至18 ℃左右→发酵基料
调配流程[14]为:
上述发酵基料+果胶0.3%+琼脂/羟丙基琼脂(0.08%,质量分数)+纯净水5%(质量分数)→原料混合→20 MPa均质→冷藏(4 ℃,24 h)→产品评价
1.3.6.2 持水力的测定[16]
取均匀酸奶样品,置于已称定质量的100 mL离心管(m1)中,称定样品和离心管质量m0,以4 000 r/min离心15 min后,取出,静置10 min。除去管中上清液,并测量残余样品质量m,持水力通过公式(1)计算:
持水力![]()
(1)
1.3.4 黏度的测定[17]
采用BROOKFIELD 黏度计在室温25 ℃条件下进行测量,选用2# 转子,设置转速为30 r/min,样品测量时间为30 s,平行测定3次取平均值。
2 结果与分析
2.1 不同改性方法对琼脂性质的影响
由图1可知,羧甲基化改性后,琼脂溶解温度由98 ℃降至82 ℃左右,溶解性显著改善,这是由于羧甲基优异的亲水性导致的,而氧化琼脂溶解温度只降至95 ℃,这可能是由于琼脂上可进行氧化反应的位点较少,侧链氧化提高溶解性的程度较低[18];羟丙基化法则可将琼脂溶解温度降至86 ℃左右,说明羟丙基亲水性良好,可能是其基团的空间位阻作用降低了琼脂分子链缠绕程度,让侧链上更多的亲水性羟基暴露与水接触,提高琼脂溶解性。

图1 不同衍生化琼脂的性质
Fig.1 The properties of different derivatized agars
琼脂在溶解后由于侧链羟基之间的相互交联作用形成凝胶,其凝胶化能力与羟基的数量和暴露程度有很大关系[19]。衍生化改性是将琼脂链上的羟基活化后进行亲电反应得以实现,这个过程以破坏羟基结构为前提,势必会对琼脂原有的凝胶强度造成一定的影响。由图1可以看出,羧甲基琼脂的凝胶强度最低,为445 g/cm2,其次为羟丙基琼脂,其强度为590 g/cm2,这可能是由于羧甲基之间形成的氢键强度与稳定性低于羟基之间氢键强度导致,另一方面,羟丙基基团的大空间位阻使羟基之间的交联作用弱化,凝胶强度下降。而氧化琼脂由于氧化程度较低、氧化位点少,其侧链羟基所受影响较小,故凝胶强度能维持在708 g/cm2的较高水平。
羧甲基琼脂与羟丙基琼脂反应后所得样品白度分别为32.58%与41.23%,均低于琼脂原有的白度(56.44%),因碱性条件下,琼脂由末端羟基出现“剥皮”反应,糖单元逐个被剥离,造成琼脂分子质量轻微下降,同时样品白度降低[20]。氧化法由于使用氧化剂本身具有漂白作用,在一定浓度范围内可破坏琼脂的发色基团和色素,使琼脂样品白度提高[21]。氧化琼脂白度为77.29%。
由上述实验可看出,氧化法虽然在提高琼脂白度上具有较好的效果,但对提高琼脂溶解性的改性效果不好;羧甲基化和羟丙基化法均对提高琼脂溶解性能有较好的效果,但羟丙基化琼脂的凝胶强度和白度指标均较羧甲基化琼脂好。综上,实验选择羟丙基化作为改善琼脂溶解性的主要手段,并对其制备工艺进行进一步优化。
2.2 单因素实验考察
2.2.1 氢氧化钠用量对羟丙基琼脂性质影响
NaOH用量与羟丙基琼脂性能的关系如图2所示。由图2可以看出,反应不加氢氧化钠时,羟丙基琼脂取代度接近0,随着NaOH用量的升高,取代度逐渐增加;而凝胶强度则先下降后趋于稳定,溶解温度却随着碱用量的增大而降低,说明提高碱用量对降低琼脂的溶解温度有较好的效果。样品的白度随着碱用量的增加先下降,当NaOH用量大于10%后,白度呈上升趋势,说明较高用量的碱对琼脂的凝胶强度和白度有保护作用[22]。综合考虑改性琼脂性能及生产成本,实验选择氢氧化钠的用量为琼脂质量的5%~15%为宜,后续实验条件优化中选择氢氧化钠用量6%。
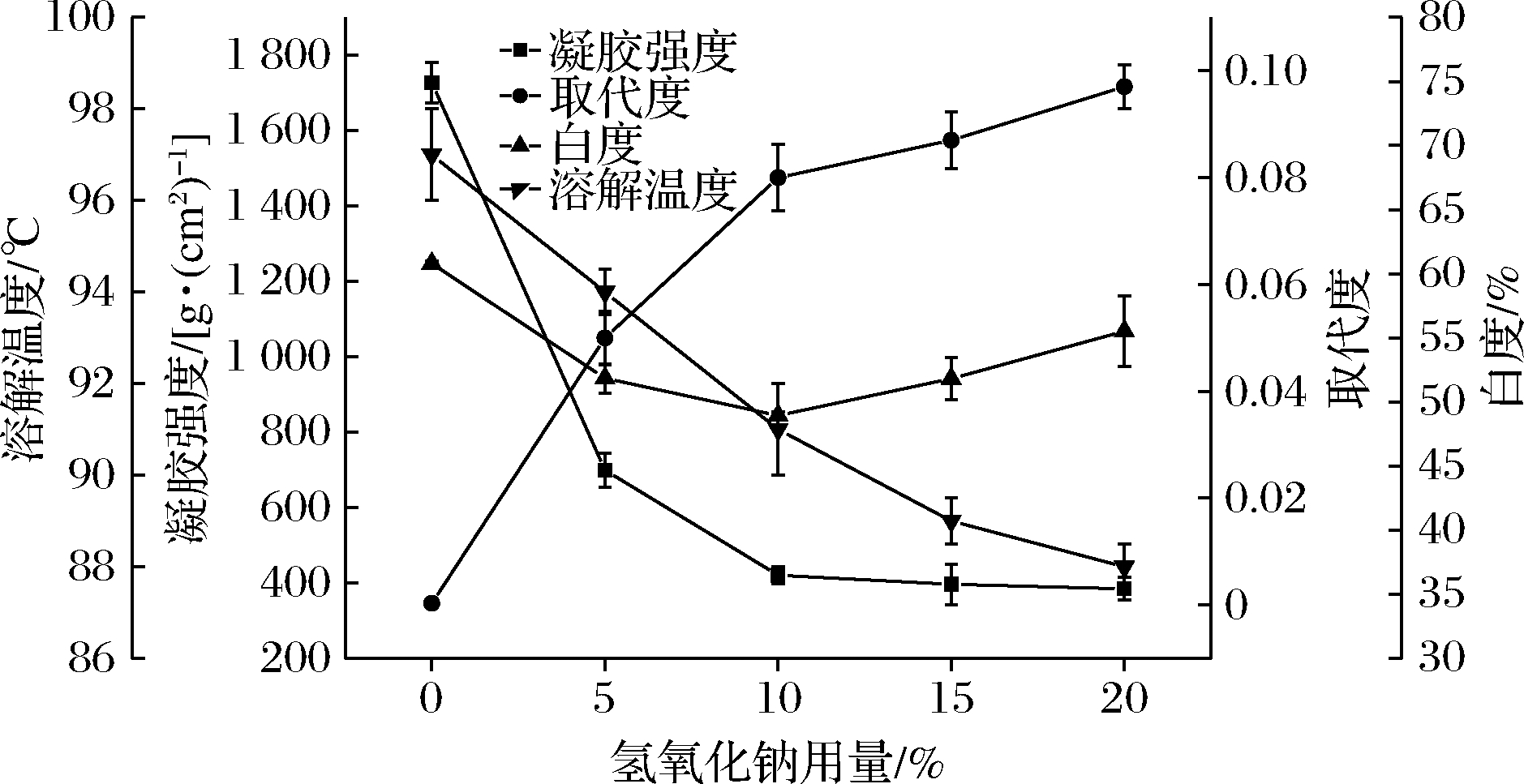
图2 氢氧化钠用量对羟丙基琼脂性质的影响
Fig.2 The effect of the amount of sodium hydroxide on the properties of hydroxypropyl agar
2.2.2 反应温度对羟丙基琼脂性质的影响
反应温度与羟丙基琼脂性能的关系如图3所示。羟丙基琼脂的取代度随反应温度的升高而升高,说明温度越高,对羟丙基化反应越有利,而且取代度越高,羟丙基琼脂的溶解温度越低。凝胶强度随取代度的增加而显著降低,当反应温度在60 ℃以上时,羟丙基琼脂凝胶强度低于200 g/cm2,应用价值较低。此外,随着反应温度的升高,羟丙基琼脂白度下降,说明温度对琼脂的白度影响较显著,这可能是因为高温环境使琼脂侧链羟基氧化成酮,样品发生变色,与羧甲基化反应结果一致。因此,羟丙基化反应应该控制在较低的反应温度(40~50 ℃)下进行。

图3 反应温度对羟丙基琼脂性质的影响
Fig.3 The effect of reaction temperature on the properties of hydroxypropyl agar
2.2.3 环氧丙烷用量对羟丙基琼脂性质的影响
环氧丙烷用量与羟丙基琼脂性能的关系如图4所示。随着环氧丙烷用量的增加,使琼脂与环氧丙烷的有效接触增强,羟丙基琼脂的取代度提高。同时,羟丙基琼脂的溶解温度和凝胶强度随着取代度的提高而降低,样品的白度随着醚化剂用量的增加而提高,但低用量环氧丙烷条件下羟丙基琼脂的白度远低于琼脂,这是由于低用量时琼脂支链上的活性羟基不能及时接枝,在碱性条件下末端羟基发生了“剥皮”反应[20]。“剥皮”反应对琼脂有降解作用,使琼脂的白度降低。综合考虑各因素,环氧丙烷用量选择为7.5%~15%。
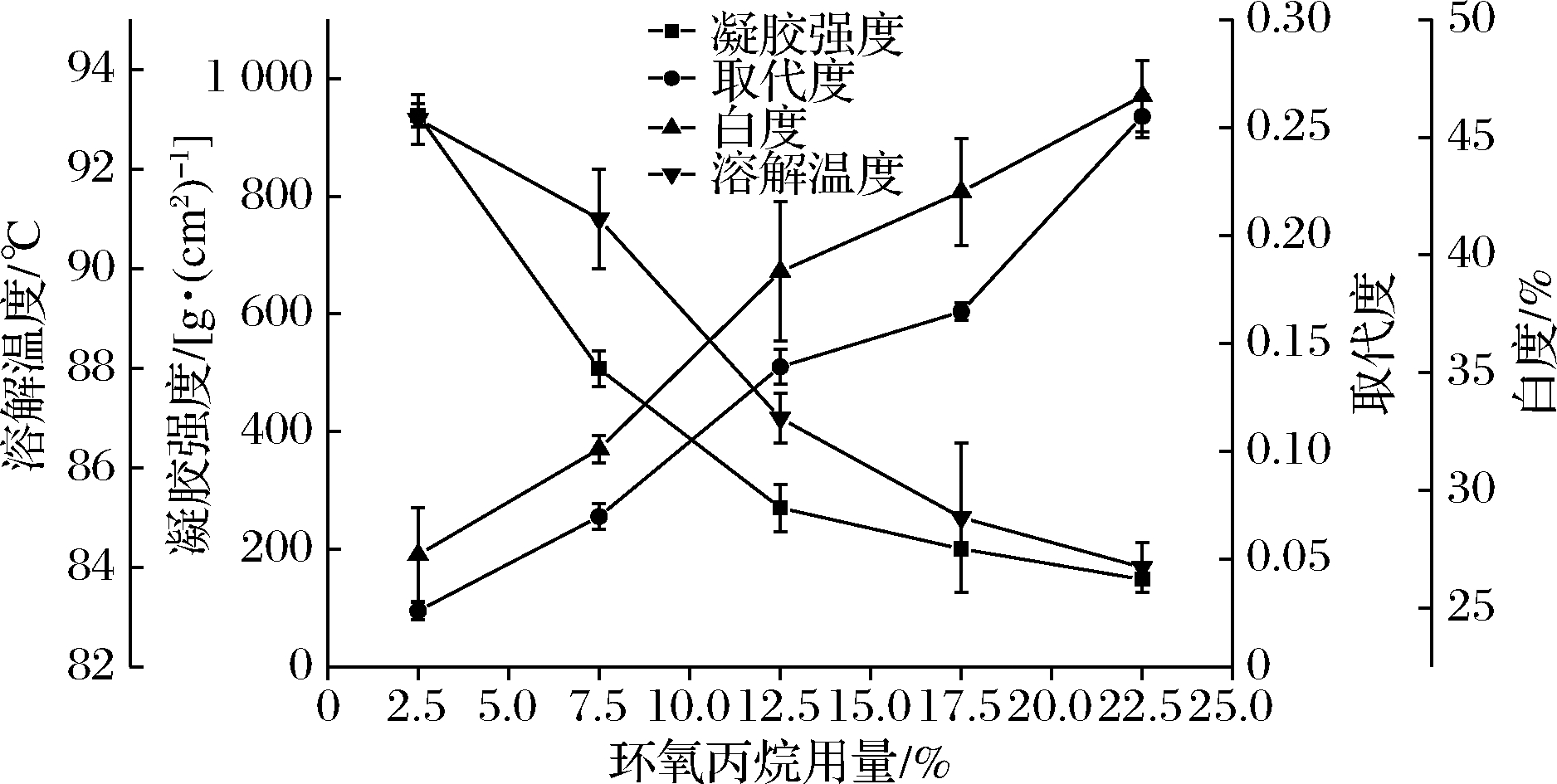
图4 环氧丙烷用量对羟丙基琼脂性质的影响
Fig.4 The effect of the amount of propylene oxide on the properties of hydroxypropyl agar
2.3 响应面优化结果
2.3.1 回归方程的建立及方差分析
采用Design-Expert软件对表2的结果进行多元回归拟合,得到二项式拟合方程如下:
表2 响应面优化因素与响应值结果
Table 2 Factors of response surface analysis and results of response value
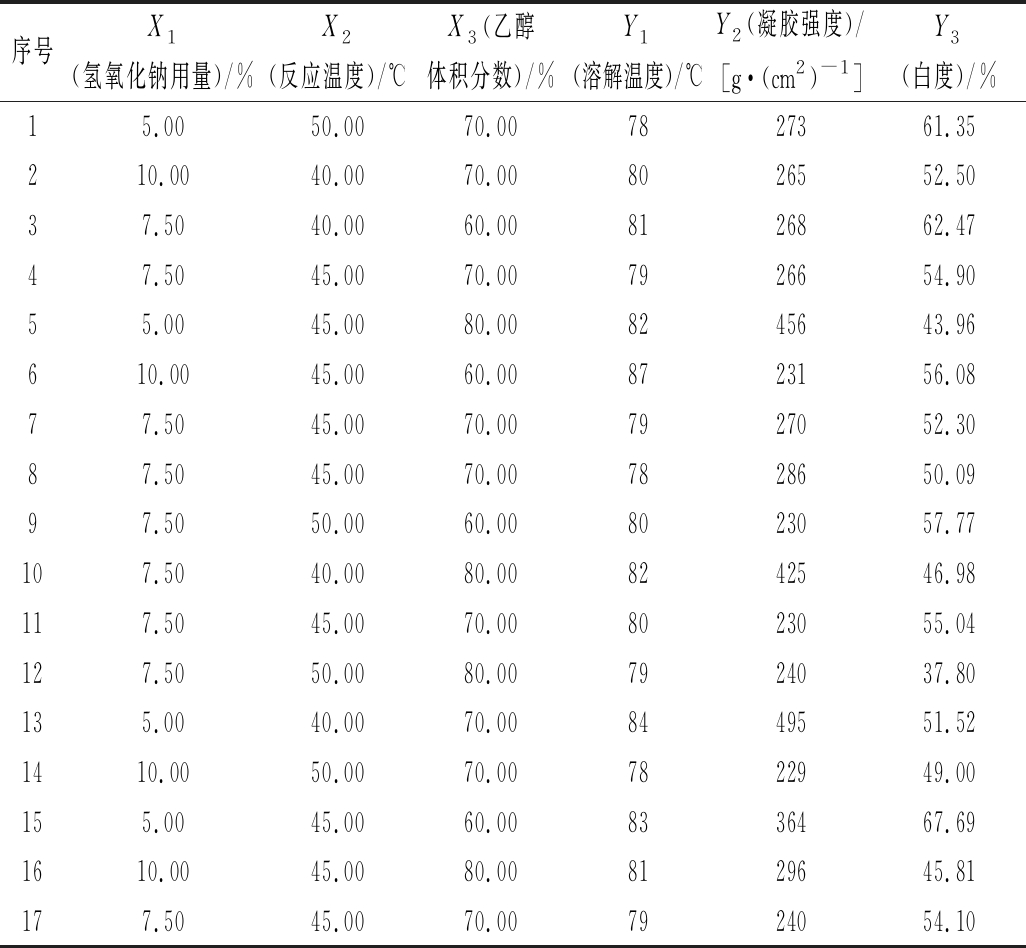
序号X1(氢氧化钠用量)/%X2(反应温度)/℃X3(乙醇体积分数)/%Y1(溶解温度)/℃Y2(凝胶强度)/[g·(cm2)-1]Y3(白度)/%15.0050.0070.007827361.35210.0040.0070.008026552.5037.5040.0060.008126862.4747.5045.0070.007926654.9055.0045.0080.008245643.96610.0045.0060.008723156.0877.5045.0070.007927052.3087.5045.0070.007828650.0997.5050.0060.008023057.77107.5040.0080.008242546.98117.5045.0070.008023055.04127.5050.0080.007924037.80135.0040.0070.008449551.521410.0050.0070.007822949.00155.0045.0060.008336467.691610.0045.0080.008129645.81177.5045.0070.007924054.10
Y1=79.00-1.5X1-0.12X2-0.87X3+X1X2-0.5X1X3-1.25X2X3-0.88X12+1.87X22+2.38X32
Y2=258.40-60.12X1-70.87X2+40.50X3+46.50X1X2-36.75X1X3-6.75X2X3+5.55X12+51.55X22+26.88X32
Y3=53.18-0.94X1-2.64X2-8.68X3-3.33X1X2-1.12X1X3-3.37X2X3-0.86X12+1.27X22-1.07X32
由表3可知,以溶解温度为响应值时,模型的F值为3.73,失拟项为0.057 2,试验模型显著,失拟项不显著,变异系数1.89%,表明数据集中,离散程度小,拟合方程满足响应面分析的要求。模型的![]() 说明该模型能解释90.53%响应值的变化,R2=0.927 3,说明该模型拟合程度较好,可用于模型分析和预测羟丙基琼脂的溶解温度。一次项中反应温度对溶解温度的线性效应显著;二次项中反应温度和乙醇体积分数对溶解温度的曲面效应显著。方程对试验拟合较好,可用于羟丙基琼脂制备试验进行分析和预测。由F检验得到因素影响大小顺序为:反应温度>乙醇体积分数>氢氧化钠用量。
说明该模型能解释90.53%响应值的变化,R2=0.927 3,说明该模型拟合程度较好,可用于模型分析和预测羟丙基琼脂的溶解温度。一次项中反应温度对溶解温度的线性效应显著;二次项中反应温度和乙醇体积分数对溶解温度的曲面效应显著。方程对试验拟合较好,可用于羟丙基琼脂制备试验进行分析和预测。由F检验得到因素影响大小顺序为:反应温度>乙醇体积分数>氢氧化钠用量。
表3 回归方程各项方差分析
Table 3 The variance analysis of the regression mode

注:**表示差异极显著(P<0.01);*表示差异显著(P<0.05)
方差来源溶解温度凝胶强度白度F 值P 值显著性F 值P 值显著性F 值P 值显著性模型3.730.048 4*37.62< 0.000 1**8.600.004 9**X10.050.823 1121.78< 0.000 1**5.570.050 3X27.750.027 1*87.64< 0.000 1**0.710.426 8X32.640.148 339.760.000 4**60.230.000 1**X1X21.720.230 726.210.001 4**4.440.073 2X1X30.430.532 616.370.004 9**0.500.501 9X2X32.690.144 80.550.481 64.520.071 0X121.390.277 10.390.550 60.310.595 0X226.380.039 5*33.910.000 6**0.680.436 9X3210.230.01 51*9.160.019 2*0.480.511 6失拟项9.500.057 20.130.934 93.730.117 9
以凝胶强度为响应值时,模型的F值为37.62,失拟项为0.13,试验模型显著,失拟项不显著,模型的R2=0.979 7,调整决定系数![]() 说明该模型能解释95.37%响应值的变化,能对不同反应条件下羟丙基琼脂的凝胶强度进行预测,模型可用。一次项中氢氧化钠用量,反应温度和乙醇体积分数对凝胶强度的线性效应极显著;二次项中反应温度和乙醇体积分数对溶解温度的曲面效应极显著;交互项中,氢氧化钠用量方和反应温度以及氢氧化钠用量方和乙醇体积分数有极显著效应。方程对试验拟合较好,可用于羟丙基琼脂制备试验进行分析和预测。根据F值和P值确定影响凝胶强度的主要因素为氢氧化钠体积分数>反应温度>乙醇体积分数>氢氧化钠体积分数与反应温度的交互作用>氢氧化钠用量与乙醇体积分数的交互作用。
说明该模型能解释95.37%响应值的变化,能对不同反应条件下羟丙基琼脂的凝胶强度进行预测,模型可用。一次项中氢氧化钠用量,反应温度和乙醇体积分数对凝胶强度的线性效应极显著;二次项中反应温度和乙醇体积分数对溶解温度的曲面效应极显著;交互项中,氢氧化钠用量方和反应温度以及氢氧化钠用量方和乙醇体积分数有极显著效应。方程对试验拟合较好,可用于羟丙基琼脂制备试验进行分析和预测。根据F值和P值确定影响凝胶强度的主要因素为氢氧化钠体积分数>反应温度>乙醇体积分数>氢氧化钠体积分数与反应温度的交互作用>氢氧化钠用量与乙醇体积分数的交互作用。
同理,白度模型的R2=0.917 0,调整决定系数![]() 值<0.05, 失拟项为3.73。一次项中乙醇浓度对白度的线性效应显著,说明影响白度的主要因素为乙醇体积分数。
值<0.05, 失拟项为3.73。一次项中乙醇浓度对白度的线性效应显著,说明影响白度的主要因素为乙醇体积分数。
综合考虑溶解温度、凝胶强度和白度,对响应面二次回归方程、三维响应面图及等高线图进行综合分析,得出最佳工艺条件为:反应温度为40 ℃,氢氧化钠用量为5.97%,乙醇体积分数为61.15%,考虑实际操作,最终取优化条件:反应温度为40 ℃,氢氧化钠体积分数为6.0%,乙醇体积分数为60%,通过3 组重复实验得到的实验值为样品溶解温度为(81±1) ℃,凝胶强度为(408±20) g/cm2,白度为(54.13±0.4)%,响应面模型预测值分别为81 ℃,418 g/cm2和56.31%,实测值与预测值非常接近,说明响应面优化得到的提取条件可行有效。
2.4 羟丙基琼脂的结构表征
2.4.1 FTIR光谱表征
原琼脂和羟丙基琼脂的FTIR光谱如图5所示。3 440 cm-1处的吸收峰归属于羟基的O—H振动,2 900 cm-1处为多糖甲基和亚甲基的C—H键振动。1 375 cm-1处出现的信号是由于琼脂侧链中硫酸酯基![]() 键的不对称振动产生。1 160和1 078 cm-1处的峰则归属于琼脂上糖苷键的吸收振动[23]。对比上述特征峰可以看出,琼脂与改性琼脂吸收峰的出峰位置与峰的类型没有明显差异,说明衍生化对琼脂的结构基本没有改变,羟丙基琼脂由于引入羟丙基基团的振动吸收与原琼脂所具有的基团重叠,所以其特征峰未发生明显改变,而由于羟丙基上亚甲基等基团的存在,C—H键的振动峰强度增加,说明甲基含量提高。
键的不对称振动产生。1 160和1 078 cm-1处的峰则归属于琼脂上糖苷键的吸收振动[23]。对比上述特征峰可以看出,琼脂与改性琼脂吸收峰的出峰位置与峰的类型没有明显差异,说明衍生化对琼脂的结构基本没有改变,羟丙基琼脂由于引入羟丙基基团的振动吸收与原琼脂所具有的基团重叠,所以其特征峰未发生明显改变,而由于羟丙基上亚甲基等基团的存在,C—H键的振动峰强度增加,说明甲基含量提高。
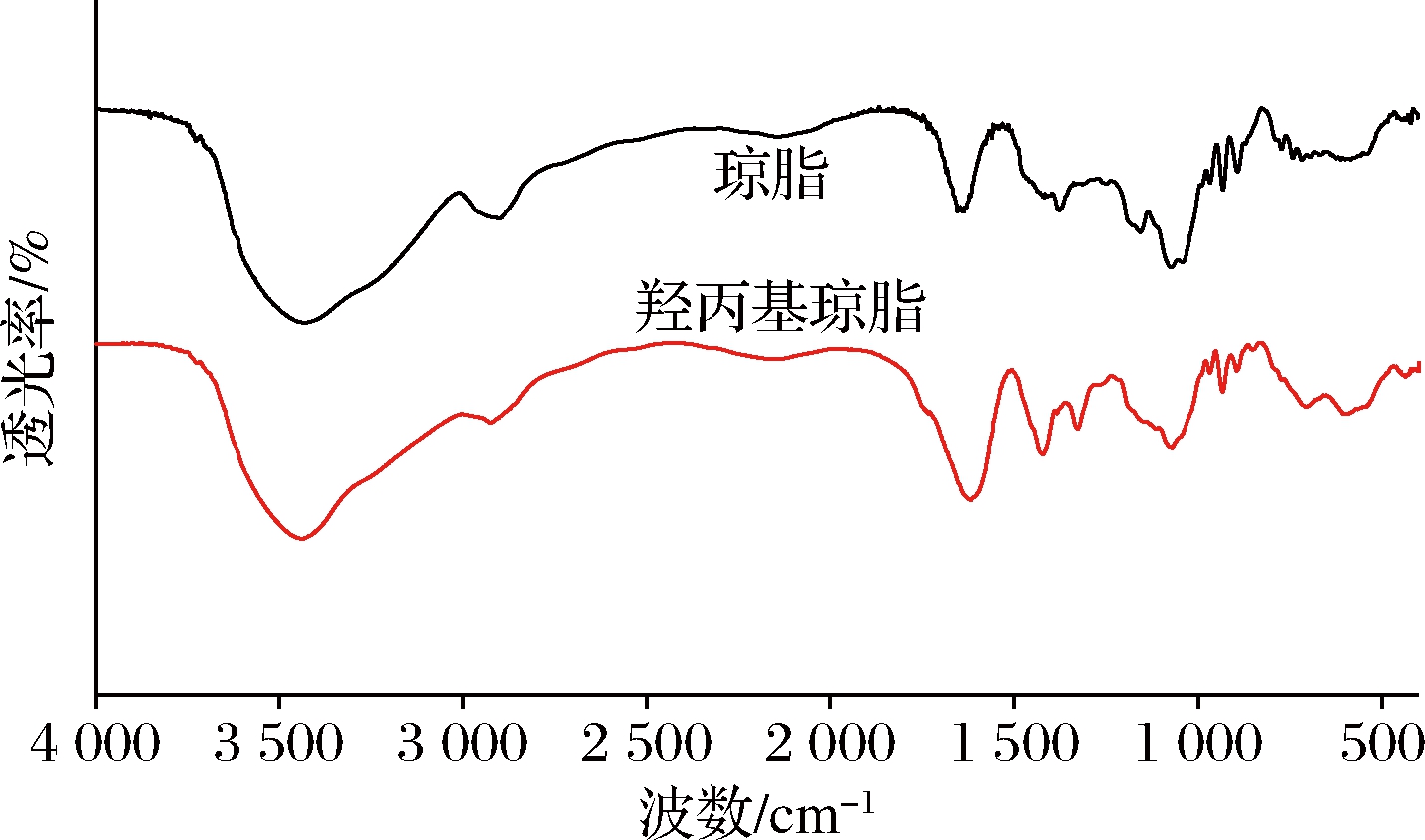
图5 琼脂及羟丙基琼脂的红外光谱图
Fig.5 Infrared spectra of agar and hydroxypropyl agar
2.4.2 NMR分析
由于羟丙基琼脂与琼脂在红外谱图上区别不明显,还需通过NMR技术进一步阐明其结构,琼脂和羟丙基琼脂的1H NMR如图6-a所示。由图6可以看出,δH 3.0~5.5处的峰归属于琼脂结构中糖单元C1~C5位的氢[24],且该范围内所有峰的化学位移在琼脂和羟丙基琼脂的1H NMR中变化不大,表明羟丙基化后糖单元的氢类型不变。与琼脂的氢谱相比,羟丙基琼脂在δH 1.10处新增1个多重峰,归属为羟丙基上的甲基信号。对比琼脂与衍生化琼脂的13C NMR(图6-b)可发现,羟丙基琼脂较琼脂新增了2个峰,分别为δC 20处的甲基和δC 56处的次甲基,而羟丙基上亚甲基信号与糖单元上亚甲基信号重叠,无法区分。由此可见,羟丙基已成功接入琼脂分子链,这与ZHANG等[11]的所报道的结果相一致,经与文献对比得知,羟丙基基团主要接入琼脂上1, 3-β-D-半乳糖单元上的C6位。
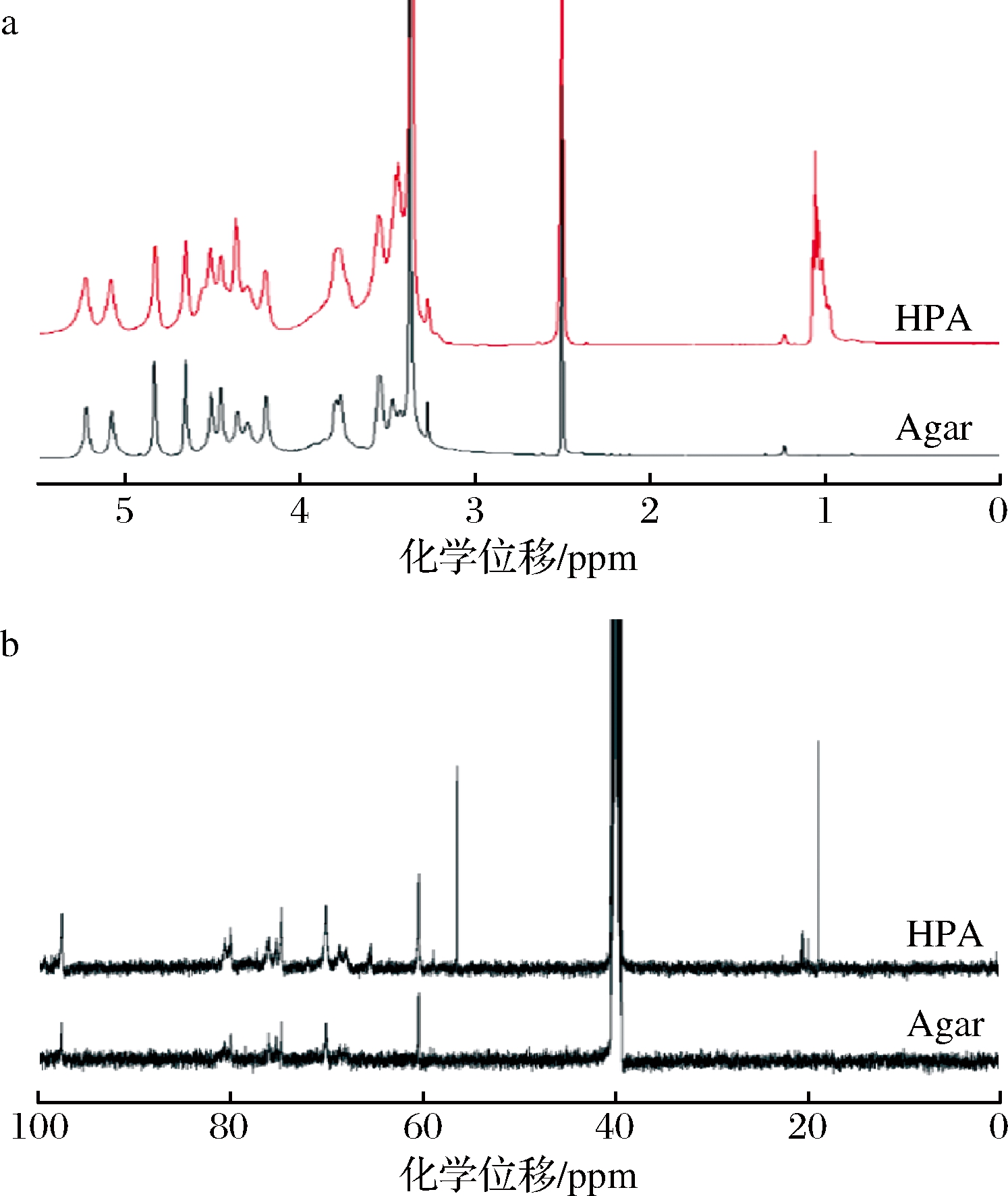
a-1H NMR谱图;b-13C NMR谱图
图6 琼脂(Agar)及羟丙基琼脂(HPA)的核磁共振谱图
Fig.6 NMR spectra of agar (Agar) and hydroxypropyl agar (HPA)
2.5 羟丙基琼脂对饮用型酸奶稳定性的影响
对比琼脂和羟丙基琼脂作为稳定剂在饮用型酸奶中的稳定性效果(表4),结果表明,发酵后添加琼脂和羟丙基琼脂均可以提高酸奶的持水力,改善乳清析出现象,产品口感细腻饱满。其中,羟丙基琼脂作为稳定剂可以使酸奶具有更高的持水力,而琼脂作为稳定剂,酸奶的表观黏度更高,说明羟丙基琼脂对提高酸奶的稳定性作用更好。
表4 琼脂/羟丙基琼脂对饮用型酸奶稳定性的影响
Table 4 Effect of agar/hydroxypropyl agar on the stability of yogurt

稳定剂持水力/%黏度/(mPa·s)琼脂 94.81±1.22870±45羟丙基琼脂98.25±1.13805±35
3 结论
本研究在单因素的基础上,采用响应面法优化羟丙基琼脂的合成工艺,得到最优制备工艺条件为:反应温度为40 ℃,氢氧化钠用量为6.0%,乙醇体积分数为60%。通过3 组重复实验得到的实验值分别为样品溶解温度(81±1) ℃,凝胶强度为(408±20) g/cm2,白度为(54.13±0.4)%,与预测值非常接近,实验所评价的试验因素和优化的试验参数准确可靠,确定的各因素较优水平范围真实有效,可用于实际操作。本研究旨在优化羟丙基琼脂提取方法,可为开发一种简单的高品质速溶琼脂改性工艺提供理论依据。
[1] ARMISEN R.World-wide use and importance of Gracilaria[J].Journal of Applied Phycology, 1995, 7(3):231-243.
[2] RENN D W.Agar and agarose:Indispensable partners in biotechnology[J].Industrial & Engineering Chemistry Product Research and Development, 1984, 23(1):17-21.
[3] KHOLIYA F, CHATTERJEE S, BHOJANI G, et al.Seaweed polysaccharide derived bioaldehyde nanocomposite:Potential application in anticancer therapeutics[J].Carbohydrate Polymers, 2020, 240:116282.
[4] MUHAMMAD SARFRAZ R M, BASHIR S, MAHMOOD A, et al.Application of various polymers and polymers based techniques used to improve solubility of poorly water soluble drugs:A review[J].Acta Poloniae Pharmaceutica, 2017, 74(2):347-356.
[5] 董晓, 吕广, 杨晓光.一种低温速溶琼脂的制备方法:中国, CN106107924A[P].2016-07-21.
DONG X, LV G, YANG X G.A preparation method of low temperature fast soluble agar:China, CN106107924A[P].2 016-07-21.
[6] LII C Y, CHEN C H, YEH A I, et al.Preliminary study on the degradation kinetics of agarose and carrageenans by ultrasound[J].Food Hydrocolloids, 1999, 13 (6):477-481.
[7] ZHANG C, AN D, XIAO Q, et al.Preparation, characterization, and modification mechanism of agar treated with hydrogen peroxide at different temperatures[J].Food Hydrocolloids, 2020, 101:105527.
[8] GE H C, LUO D K.Preparation of carboxymethyl chitosan in aqueous solution under microwave irradiation[J].Carbohydrate Research, 2005, 340 (7):1 351-1 356.
[9] ![]() S.Synthesis of carboxymethyl starch[J].Starch-Stärke, 2000, 52(11):413-419.
S.Synthesis of carboxymethyl starch[J].Starch-Stärke, 2000, 52(11):413-419.
[10] ZHOU J P, QIN Y, LIU S L, et al.Homogenous synthesis of hydroxyethylcellulose in NaOH/urea aqueous solution[J].Macromolecular Bioscience, 2006, 6(1):84-89.
[11] ZHANG N, WANG J L, YE J, et al.Oxyalkylation modification as a promising method for preparing low-melting-point agarose[J].International Journal of Biological Macromolecules, 2018, 117:696-703.
[12] 谢杉玉, 梁懿, 邬应龙, 等.热溶胶结合高温干燥降低琼脂溶胶温度的研究[J].食品科技, 2021, 46(1):245-250.
XIE S Y, LIANG Y, WU Y L, et al.Study on reducing agar sol temperature by hot sol combined with high temperature drying[J].Food Science & Technology, 2021, 46(1):245-250.
[13] CAO M Z, LIU X, LUAN J M, et al.Characterization of physicochemical properties of carboxymethyl agar[J].Carbohydrate Polymers, 2014, 111(10):449-455.
[14] GRAU R, ALBARRAC N W, PÉREZ M T, et al.Use of simultaneous brine thawing/salting in dry-cured Iberian ham production[J].Journal of Food Engineering, 2011, 104(2):316-321.
N W, PÉREZ M T, et al.Use of simultaneous brine thawing/salting in dry-cured Iberian ham production[J].Journal of Food Engineering, 2011, 104(2):316-321.
[15] BHASKAR G V,SINGH H,BLAZEY N D.Milk protein products and processes.US7157108 B2[P].2007-01-02.
[16] HASSAN A N, FRANK J F, SCHMIDT K A, et al.Textural properties of yogurt made with encapsulated nonropy lactic cultures[J].Journal of Dairy Science, 1996, 79(12):2 098-2 103.
[17] 李向东, 乔成亚, 王荫榆.复配稳定剂在搅拌型酸奶加工中的应用研究[J].食品工业科技, 2009, 30(12):323-325;331.
LI X D, QIAO C Y, WANG Y Y.Application of stabilizer blends in stirred yoghurt production [J].Science and Technology of Food Industry, 2009, 30(12):323-325;331.
[18] XIAO Q, AN D, ZHANG C, et al.Agar quality promotion prepared by desulfation with hydrogen peroxide[J].International Journal of Biological Macromolecules, 2020, 145:492-499.
[19] 廖振胜, 张娜, 杨宇成, 等.多糖溶解性改善方法研究进展[J].食品与发酵工业, 2020, 46(24):292-299.
LIAO Z S, ZHANG N, YANG Y C, et al.Methods to enhance the solubility of polysaccharides[J].Food and Fermentation Industries, 2020, 46(24):292-299.
[20] YONEDA Y, KRAINZ K, LIEBNER F, et al.“Furan endwise peeling” of celluloses:Mechanistic studies and application perspectives of a novel reaction[J].European Journal of Organic Chemistry, 2008, 2008(3):475-484.
[21] 李晓文, 熊兴耀.双氧水在超细化马铃薯淀粉漂白工艺中的应用[J].食品科技, 2007, 32(7):54-57.
LI X W, XIONG X Y.Study on bleach technics for micronization potato starch by using H2O2[J].Food Science & Technology, 2007, 32(7):54-57.
[22] FREILE-PEGR N Y, ROBLEDO D.Influence of alkali treatment on agar from Gracilaria cornea from Yucatán, México[J].Journal of Applied Phycology, 1997, 9(6):533-539.
N Y, ROBLEDO D.Influence of alkali treatment on agar from Gracilaria cornea from Yucatán, México[J].Journal of Applied Phycology, 1997, 9(6):533-539.
[23] GARCIA R B, VIDAL R R L, RINAUDO M.Preparation and structural characterization of O-acetyl agarose with low degree of substitution[J].Polímeros, 2000, 10(3):155-161.
[24] JI M H, LAHAYE M, YAPHE W.Structure of agar from Gracilaria spp (rhodophyta) collected in the People′s Republic of China[J].Botanica Marina, 1985, 28(2):521-528.