玉米加工过程中最主要的副产物就是玉米麸质,约占玉米产量的14%~20%,其中含有大量的纤维素、淀粉、半纤维素、多糖、酚酸等物质,阿拉伯木聚糖(arabinoxylan, AX)在玉米麸质中含量较大[1-2]。AX由主链木聚糖、侧链阿拉伯呋喃糖连接而成,还有一定量的羟基肉桂酸(hydroxycinnamic acid, HA),如阿魏酸(ferulic acid, FA)或对香豆酸(p-coumaric acid, p-CA)通过酯键连接在阿拉伯呋喃糖的C(O)-5位上[3-4]。AX的提取方法很多,由于AX的结构特点,易与其他细胞壁物质间存在物理交联或化学结合[5]。AX与玉米麸质中的纤维素和木素以氢键和酯键连接,非常紧密,很难溶出,碱液可以破坏细胞壁间与AX的交联和结合,使AX游离出来的同时不降低相对分子质量[6-8]。因此,通常采用碱液提取AX。虽然碱提取AX的提取率较高,但是同时会降低FA和p-CA含量。FA和p-CA在AX中含量虽少,但却是AX的重要组成部分,它们的存在极大地影响了AX的性能,不仅改变AX本身的物化性能,包括黏度、溶解性、氧化凝胶性等,还使AX具有一定的生物活性[9-10]。
HA属于酚酸类,除了FA、p-CA之外,主要还包括芥子酸(sinapic acid, SA)、咖啡酸(caffeic acid, CA)等。芥子酸广泛存在于各种植物中[11]。近年来,国内外对SA的研究越来越多,研究发现芥子酸及其衍生物具有多种生物活性,可应用于化妆品、食品、保健品、制药等多个领域[12]。
有研究报道,芥子酸衍生物的结构和生物活性都比游离的SA高[13-14],因此芥子酸衍生物的应用前景更为广阔,开发芥子酸衍生物更具有实际意义。本文用SA对玉米麸质中提取的阿拉伯木聚糖(corn arabinoxylan, CAX)进行化学改性,得到芥子酸衍生物玉米麸质阿拉伯木聚糖芥子酸酯(SA-CAX),从而提高CAX的酚酸含量进而改变CAX的物理化学性质和生物活性等。
1 材料与方法
1.1 材料与试剂
根据文献[15]中的方法从玉米麸质中提取并分级出阿拉伯木聚糖(CAX);6-羟基-2,5,7,8-四甲基色烷-2-羧酸(6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid,trolox)、D2O (AR),北京百灵威科技有限公司;2,2′-偶氮双(2-脒基丙烷)二盐酸盐(2,2′-azobis-2-methyl-propanimidamide, dihydrochloride,AAPH) (分析纯),美国Sigma公司;SA、二甲基亚砜(dimethyl sulfoxide,DMSO)、NaOH、乙醇、LiCl、吡啶、SOCl2、四氢呋喃(tetrahydrofuran,THF)等 (AR),上海易恩化学技术有限公司;荧光素钠盐(AR),上海麦克林生化科技有限公司。
1.2 仪器与设备
OMNISEC凝胶渗透色谱仪,英国马尔文仪器有限公司;Frontier Near/Mid-IR Std傅里叶红外、Varioskan LUX多功能酶标仪、Haake MARS iQ流变仪,美国赛默飞世尔科技公司;LC 1100高效液相色谱,美国安捷伦公司;Bruker DRX 400核磁共振,德国布鲁克公司;UV5紫外可见分光光度计,瑞士梅特勒托利多。
1.3 实验方法
1.3.1 SA-CAX的制备
用50 mL绝干THF溶解0.5 g (2.2 mmol)芥子酸,加入到三口烧瓶中,Ar保护,用10 mL绝干THF稀释0.32 mL(4.4 mmol) SOCl2,加入到恒压滴液漏斗中,0~5 ℃下,30 min内逐滴滴加SOCl2,70 ℃反应6 h,旋蒸除去THF和过量的SOCl2,得到中间体芥子酸酰氯,无需进一步纯化,干燥密封保存待用。
取1 g CAX和30 mL含4%(质量分数)LiCl的绝干DMSO溶剂于250 mL三口烧瓶中,N2保护,加热至80 ℃待CAX溶解后冷却至室温,向反应液中加入一定量吡啶(吡啶的用量为芥子酸酰氯摩尔量的1.5倍),分别将不同量的芥子酸酸酰氯溶解在DMSO中,在冰浴下用恒压滴液漏斗逐滴滴入反应液,撤除冰浴,缓慢升温至100 ℃持续反应14 h,反应结束,冷却至室温,向反应液中缓慢加入4倍量体积的无水乙醇,大量白色絮状物析出,室温下静置24 h,过滤,固体冷冻干燥得到SA-CAX。
1.3.2 SA-CAX的芥子酸取代度测试
精确称量1 g SA-CAX,加入25 mL 1 mol/L NaOH溶液和30 mg无水Na2SO3,室温搅拌2 h,用HCl (1 mol/L)调节溶液pH使pH=3,过滤,滤液用乙酸乙酯萃取,定容。用高效液相色谱检测SA的含量,色谱条件参照文献[15]进行。将不同浓度的芥子酸标准品绘制出标准曲线,然后按照公式(1)计算取代度(n),SA-CSX用SA-CAX-n表示。
(1)
式中:m为SA的质量,M为SA的分子质量,m′为SA-CAX的质量,MX为木糖的分子质量,MA为阿拉伯糖的分子质量,A/X为指阿拉伯糖和木糖的比值。
1.3.3 分子质量分布测试
将CAX和SA-CAX-n配制成1.0%(质量分数)水溶液,标样为普鲁兰,测试方法参照文献[15]。
1.3.4 红外光谱检测
测试方法参照文献[15]进行。
1.3.5 核磁共振
测试方法参照文献[15]进行。
1.3.6 紫外吸收性能测试
将纯化后的CAX和SA-CAX-n配制成1 mg/mL的水溶液,在200~400 nm波长范围内进行紫外扫描。
1.3.7 水溶液流变性能测定
将CAX和SA-CAX-n分别配制为20 mg/mL的溶液,然后在DHR-2型流变仪上测定其水溶液的流变性能。在25 ℃时,测定0~1 000 s-1的剪切速率范围内的黏度;0.1~10 Hz频率范围内测定储能模量(G′)和损失模量(G″)。
1.3.8 抗氧化能力指数(oxygen radical antioxidant capacity,ORAC)的测定
测试方法参考文献[16],配制75 mmol/L的磷酸盐缓冲溶液(pH=7.2),用缓冲溶液分别配制63 nmol/L的荧光素钠盐、20 μmol/L的trolox、153 mmol/L的AAPH溶液以及不同质量浓度的CAX和SA-CAX-n(0.25、0.5、1、2 mg/mL)。先向96微孔板中各加入25 μL不同质量浓度的待测液体CAX、SA-CAX-n和空白对照样缓冲液、对照样trolox,重复3次;再向各孔加入150 μL荧光素钠溶液,中速振摇1 min,置于37 ℃孵育15 min;再同时向各孔中加入25 μL AAPH溶液启动反应。将微孔板放入酶标仪中进行测试,测试条件为:激发波长485 nm,发射波长538 nm,每2 min测定1次各孔的荧光强度,荧光衰减呈基线后停止。
实验中各孔不同时间点的绝对荧光强度数据与初始时间的荧光强度相比为相对荧光强度f,以相对荧光强度计算荧光衰退曲线下面积(area under curve,AUC),AUC按公式(2)计算:
AUC=2×(f0+f1+f2+…+fn-1+fn)-f0-fn
(2)
式中:fn为第n个测试点的相对荧光强度。
测试结果用ORAC值表示,可根据公式(3)计算:
ORAC值![]()
(3)
式中:Ctrolox 是标准品trolox的浓度,μmol/L;C样品是样品的质量浓度,g/L。
1.4 数据处理
采用Origin软件进行数据作图处理,采用SPSS软件对数据进行方差分析,显著性差异选用P<0.05。每组实验重复3次,结果采用![]() 表示。
表示。
2 结果与分析
2.1 SA-CAX的制备及表征
本文通过对玉米麸质阿拉伯木聚糖进行改性得到SA-CAX,其合成路线如图1所示。
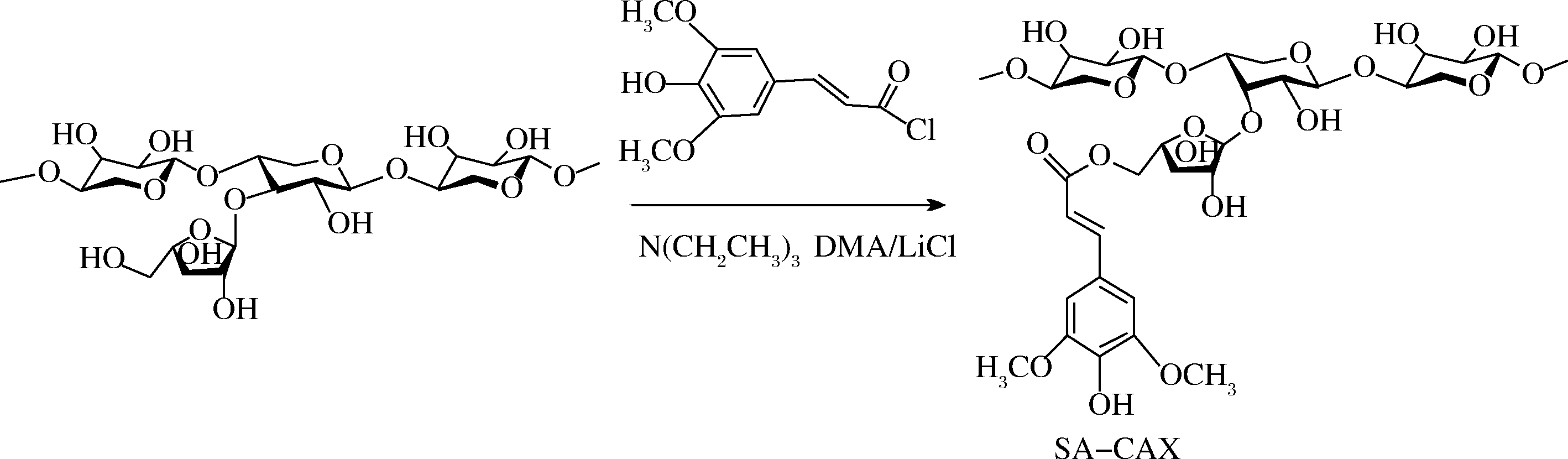
图1 SA-CAX的合成路线
Fig.1 Synthesis of SA-CAX
多糖的取代度用n表示,不同取代度的SA-CAX可表示为SA-CAX-n。原料CAX中并不含有SA,仅含少量FA。SA用量与CAX的糖苷键的摩尔比以及SA-CAX-n的取代度与产率如表1所示。改性后多糖SA-CAX-n的取代度随SA的用量的增多而增加,合成的产率较高,均在90%以上。多糖支链的分子质量、极性和分支程度对多糖的物理和化学性质影响较大,如黏度、水溶性等[1],SA本身水溶性差,接枝到CAX使CAX的分支程度增大,会降低在水中的溶解度。因此,本文选SA-CAX-0.27、SA-CAX-0.31和SA-CAX-0.36这3个样品进行性能研究。
表1 SA-CAX-n合成的产率和取代度
Table 1 The yield and graft degree of SA-CAX-n

注:R是SA与CAX的糖苷键的摩尔比
RSA/(mg·g-1)产量/%n1∶518.77±0.0690.7±1.420.21±0.011∶424.13±0.0391.0±0.790.27±0.021∶327.70±0.0491.9±0.650.31±0.011∶232.17±0.0690.3±1.230.36±0.011∶134.89±0.1192.1±0.810.39±0.03
2.2 CAX与SA-CAX-n的分子质量分布
CAX的分子质量分布如文献[17],改性产物SA-CAX-n的分子质量的分布如图2所示,CAX与SA-CAX-n的重均分子质量(Mw)、数均分子质量(Mn)如表2所示。显示CAX与SA-CAX-n的分子质量都只有一个峰,表明改性前后的多糖的分子质量均一性较好。原料CAX分子质量为3.06×105 g/mol,分散系数(Mw/Mn)为3.21;改性后SA-CAX-0.27、SA-CAX-0.31和SA-CAX-0.36的分子质量分别为3.37×105、3.59×105和3.85×105 g/mol,与此同时分散系数分别为3.52、3.64和3.52。改性后多糖的取代度的增加,SA-CAX-n的分子质量和分散系数均随之增大,表明改性后分子质量变大,分布也变宽。
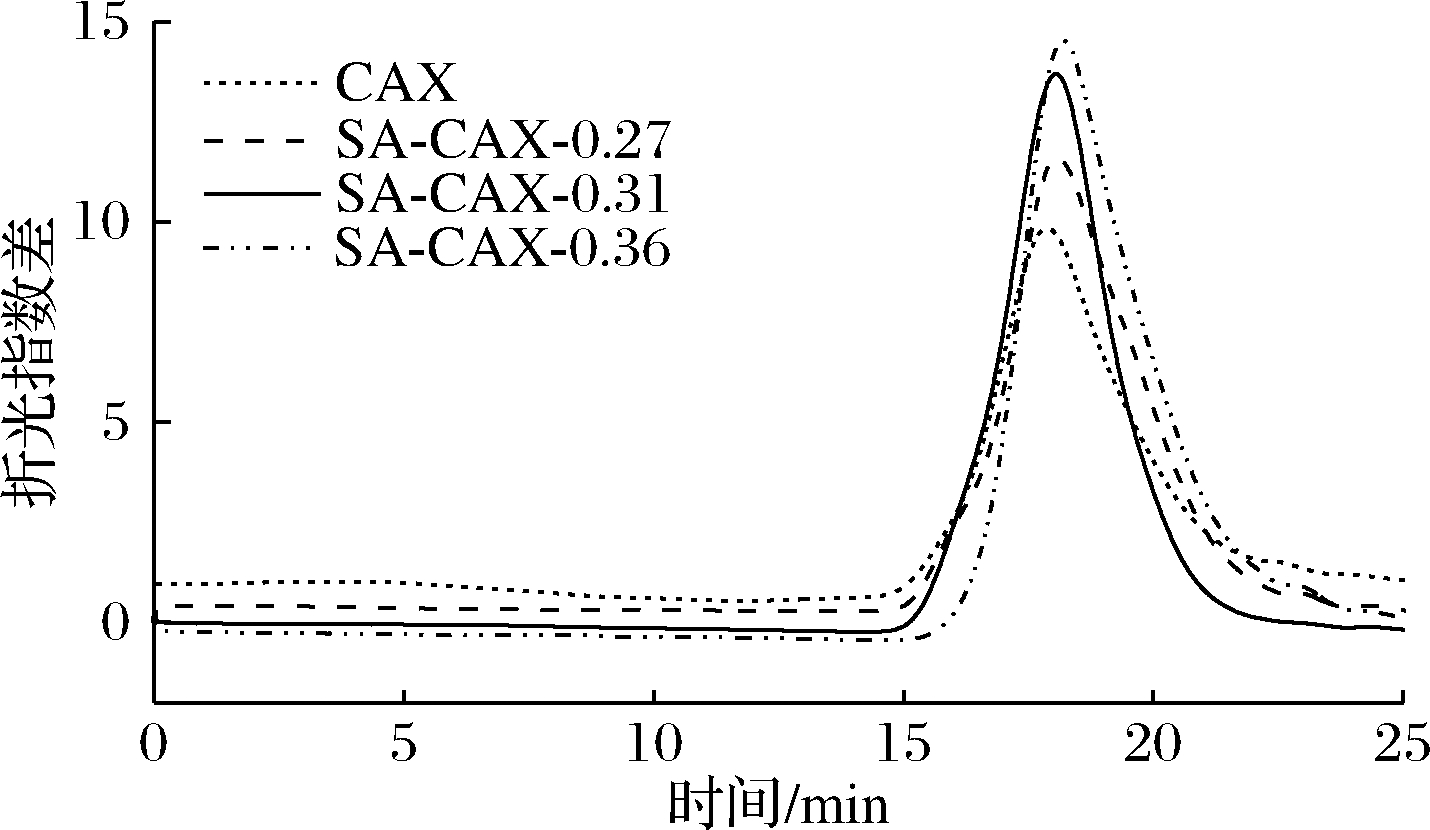
图2 SA-CAX-n的相对分子质量分布
Fig.2 Relative molecular weight distribution of SA-CAX-n
表2 CAX和SA-CAX-n的分子质量分布
Table 2 The molecular weight of CAX and SA-CAX-n
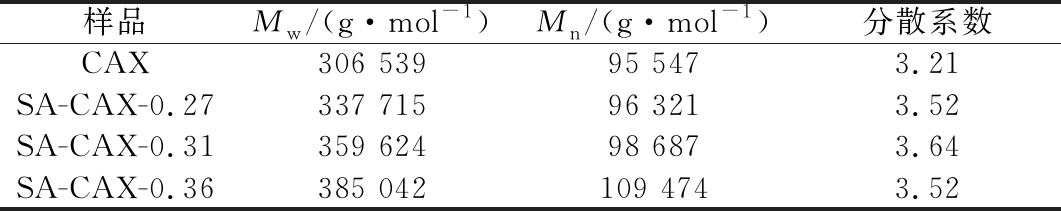
样品Mw/(g·mol-1)Mn/(g·mol-1)分散系数CAX306 53995 5473.21SA-CAX-0.27337 71596 3213.52SA-CAX-0.31359 62498 6873.64SA-CAX-0.36385 042109 4743.52
2.3 红外光谱分析
改性产物SA-CAX-0.27、SA-CAX-0.31和SA-CAX-36的红外图谱如图3所示。原料CAX的红外如文献[17],CAX多糖的特征峰在897、1 191、1 045、1 415、1 634、2 854、3 413 cm-1,图3中不同取代度的SA-CAX-n都保留CAX的特征峰,在1 760 cm-1处均出现1个新的吸收峰,代表SA苯环上的酯键上的羰基峰,证明SA和CAX以酯键形式连接,SA含量越多吸收峰越明显。
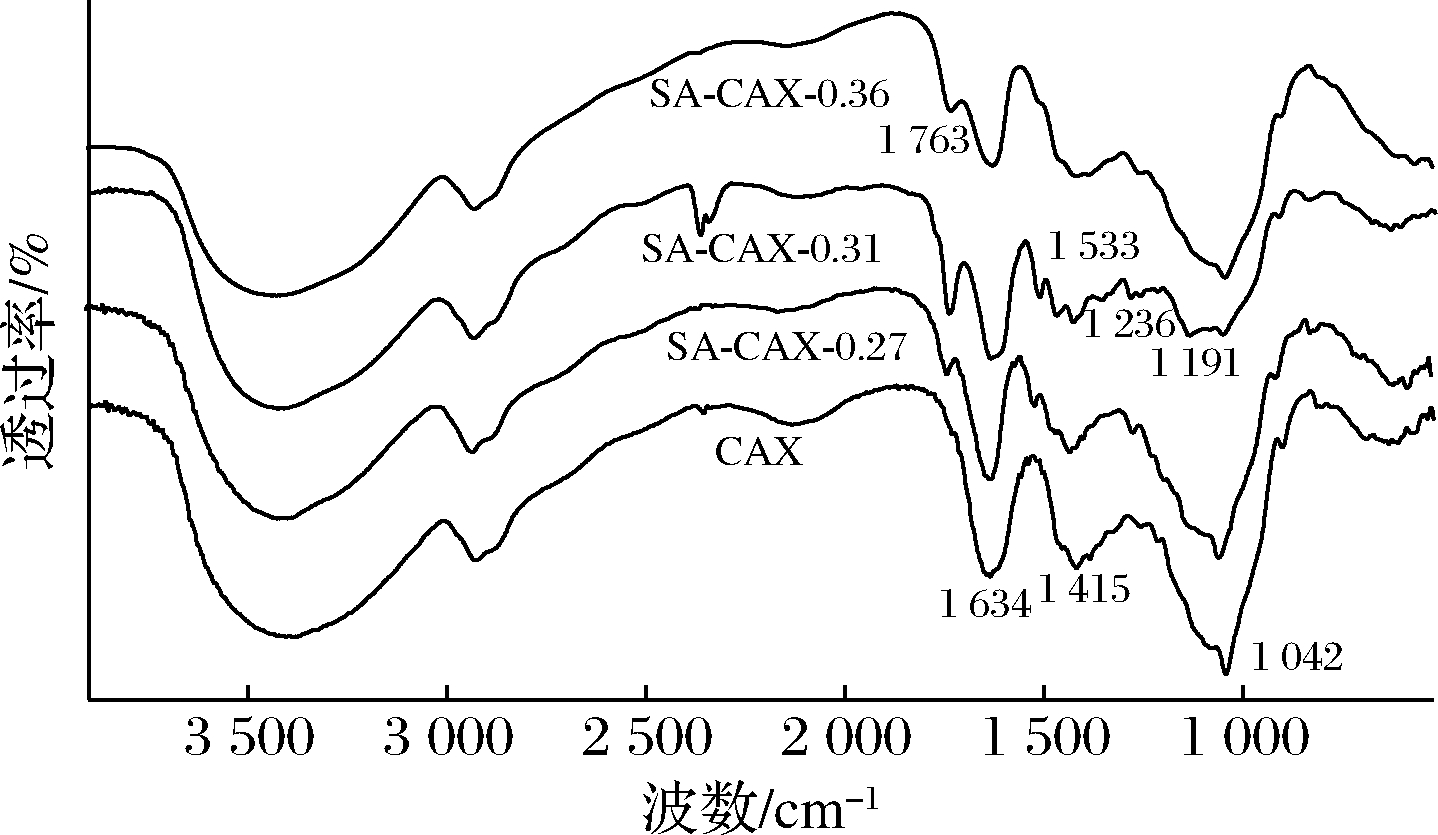
图3 SA-CAX-n的红外图谱
Fig.3 FT-IR spectra of SA-CAX-n
2.4 核磁谱图分析
改性产物SA-CAX-0.27、SA-CAX-0.31和SA-CAX-36的核磁氢谱如图4-A所示,核磁碳谱如图4-B所示。
在氢谱图4-A中,化学位移5.4~5.9 ppm是侧链阿拉伯糖的峰,4.7~5.3 ppm是主链木糖的峰[18],与原料CAX的核磁氢谱比较,SA-CAX-n均出现4个新的特征峰,δ 6.94 ppm表示SA的苯环峰,δ 6.46和 7.35 ppm表示SA的C![]() C,δ 3.4 ppm表示SA的甲氧基。在碳谱图4-B中,δ 60~110 ppm是原料CAX的特征峰[18],SA-CAX-n均在δ 174 ppm处出现1个新的峰,表示是SA和CAX连接的C
C,δ 3.4 ppm表示SA的甲氧基。在碳谱图4-B中,δ 60~110 ppm是原料CAX的特征峰[18],SA-CAX-n均在δ 174 ppm处出现1个新的峰,表示是SA和CAX连接的C![]() O。
O。

A-氢谱图;B-碳谱图
图4 SA-CAX-n的NMR谱图
Fig.4 NMR spectra of SA-CAX-n
综合分子质量分布、红外、核磁氢谱和碳谱,证明芥子酸已成功连接到CAX上。
2.5 CAX和SA-CAX-n的紫外吸收
由CAX和SA-CAX-n的紫外吸收光谱(图5)可知,CAX在紫外下无吸收峰,表明原料CAX纯度较高,无核酸(260 nm)、多肽和蛋白质(280 nm)[18]。改性后SA-CAX-n在250~380 nm波段内具有吸收,并且在320 nm左右处紫外吸收最强,表明SA-CAX-n对UVB波段的紫外线有一定的屏蔽作用。SA含有肉桂酸基团,具有π-π*电子跃迁,对光具有反应活性,SA连接在CAX上也可以屏蔽紫外光[19-20],而且同样浓度下SA的取代度越高,其紫外吸收作用越强。

图5 CAX和SA-CAX-n的紫外图谱
Fig.5 UV spectra of CAX and SA-CAX-n
2.6 流变性能
25 ℃时,剪切速率不同对SA-CAX-n和CAX水溶液黏度的影响如图6所示。CAX是以线性结构的形式存在于水溶液中,CAX在水中旋转,分子间彼此碰撞,产生摩擦,因此CAX的黏度较大[21]。由图6可以看出,相同质量浓度(20 mg/mL)和剪切速率下,SA-CAX-n的黏度比CAX的黏度大得多,主链结构相同的情况下,支链程度越高,SA-CAX-n在水溶液中旋转时所需要的空间更大,分子间碰撞的几率更高,因此SA-CAX-n水溶液黏度增加,而且随着取代度增加,SA-CAX-n的支链程度提高,因此其水溶液黏度也随之增大。SA-CAX-0.36的黏度大幅度提高,甚至形成凝胶(图7),图7是质量浓度为20 mg/mL的SA-CAX-n和CAX水溶液。

图6 25 ℃时CAX和SA-CAX-n水溶液黏度随剪切速率的变化
Fig.6 The relationship between viscosity and concentration of CAX and SA-CAX-n solution

图7 CAX 和 SA-CAX-n的水溶液照片
Fig.7 The photos of aqueous solutions CAX and SA-CAX-n
图8是CAX和SA-CAX-n水溶液的储能模量(G′)和耗能模量(G″)随频率的变化曲线,图9是SA-CAX-0.36溶液在频率为1 Hz时的G′和损耗角(tan δ=G′/G″)随浓度的变化曲线。CAX和所有SA-CAX-0.36水溶液的G′和G″均随频率的增加而逐渐增加,在所有频率范围内,G′>G″,并且tan δ<1;SA-CAX-0.36溶液的G′在1 Hz时随浓度的增加而增加,tan δ随浓度的增加而降低,表明SA-CAX-n水溶液具有一定的弱凝胶性质;其凝胶性能随着取代度的增加而增加,和图7结果一致,并且SA-CAX-n的黏度和黏弹性结果相互吻合。

图8 SA-CAX-0.36水溶液的G′和G″随频率的变化曲线
Fig.8 Variation curve of SA-CAX-0.36′s G′ and G″ with frequency

图9 SA-CAX-0.36的储能模量G′和损耗角tan δ在1 Hz时随浓度的变化曲线
Fig.9 Storage modulus G′ and loss angle tan δ of SA-CAX-0.36
2.7 ORAC的测定
ORAC测定方法是AAPH产生过氧自由基,过氧自由基会使荧光素钠的荧光特性消失,加入抗氧化剂,可以阻止或延缓荧光衰减,因此抗氧化性越强,荧光衰退越慢[22]。本实验以无抗氧化剂存在时的自由基(Blank)作为对照(图10-A),14 min时荧光消退至基线,标准抗氧化物质(trolox)的荧光在38 min消失,原料CAX用量在0.25~2 mg/mL荧光在20~25 min消失。加入改性后的多糖SA-CAX-n荧光消失的时间逐渐延长(图10-B~图10-D)。相同质量浓度下,取代度增加荧光消退时间延长;取代度相同时,荧光消退时间随质量浓度增加而延长。多糖的抗氧化性可以用抗氧化能力指数(ORAC值)表示[16]。

A-CAX和对照样品的荧光衰减曲线;B-SA-CAX-0.27的荧光衰减曲线;C-SA-CAX-0.31的荧光衰减曲线;D-SA-CAX-0.36的荧光衰减曲线
图10 CAX和SA-CAX-n作用的荧光衰退曲线
Fig.10 Fluorescence decay curve of CAX and SA-CAX-n
由表3可以看出,SA-CAX-n的ORAC值随质量浓度的增大和取代度的增大而增大,即抗氧化性增大。SA连接到CAX可以增强CAX的抗氧化能力,取代度越高抗氧化能力越强。SA属于羟基肉桂酸,酚羟基是供氢体,与自由基结合,氧原子上不成对单电子与苯环上的π电子云作用发生共轭效应,使成电子部分分布到苯环上,自由基能力降低,因此自由基不再引发链式反应,因此改性后多糖的抗氧化性主要受SA含量的影响,SA含量越高,改性多糖的抗氧化性越强[23]。
表3 CAX和SA-CAX-n的相对ORAC值
Table 3 The relative ORAC values of CAX and SA-CAX-n
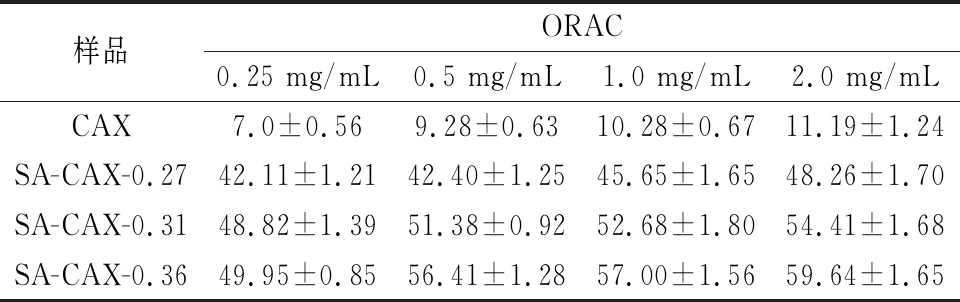
样品ORAC0.25 mg/mL0.5 mg/mL1.0 mg/mL2.0 mg/mLCAX7.0±0.569.28±0.6310.28±0.6711.19±1.24SA-CAX-0.2742.11±1.2142.40±1.2545.65±1.6548.26±1.70SA-CAX-0.3148.82±1.3951.38±0.9252.68±1.8054.41±1.68SA-CAX-0.3649.95±0.8556.41±1.2857.00±1.5659.64±1.65
3 结论
本文从玉米麸质中提取出CAX,并与SA进行酯化反应,得到SA-CAX-n,液相分析确定了取代度,综合了红外光谱、核磁氢谱和碳谱确定其结构,用高效液相分析确定了改性多糖的取代度,用凝胶渗透色谱测试不同取代度的多糖的分散性和分子质量分布。然后对不同取代度多糖(SA-CAX-0.27、SA-CAX-0.31、SA-CAX-0.36)的性能进行了研究,发现原料CAX无紫外吸收,改性后SA-CAX-n在UVB波段具有紫外吸收,紫外吸收随着SA取代度的增加而增强;SA-CAX-n水溶液的黏度较CAX有明显增大,且具有一定的黏弹性,随取代度增加而增加;SA-CAX-n的抗氧化能力比原料CAX强,并且随着取代度的增加和质量浓度的增加,其抗氧化力随之增强。因此SA-CAX在化妆品、食品、保健品等领域具有广阔的应用前景。
[1] COURTIN C M, DELCOUR J A.Physicochemical and bread-making properties of low molecular weight wheat-derived arabinoxylans[J].Journal of Agricultural and Food Chemistry, 1998, 46(10):4 066-4 073.
[2] LU Z X, WALKER K Z, MUIR J G, et al.Arabinoxylan fibre improves metabolic control in people with Type Ⅱ diabetes[J].European Journal of Clinical Nutrition, 2004, 58(4):621-628.
[3] 姜玉莹, 于雷, 郎双梅, 等.阿拉伯木聚糖功能特性研究进展[J].粮食与油脂, 2021, 34(2):18-20;42.
JIANG Y Y, YU L, LANG S M, et al.Research progress on functional characteristics of arabinoxylan[J].Cereals & Oils, 2021, 34(2):18-20;42.
[4] 王立, 司晓静, 钱海峰, 等.阿拉伯木聚糖对谷物食品的品质影响研究进展[J].食品与生物技术学报, 2020, 39(7):12-20.
WANG L, SI X J, QIAN H F,et al.Research progress of effects of arabinoxylan on the quality of cereals[J].Journal of Food Science and Biotechnology, 2020, 39(7):12-20.
[5] CAO L, LIU X Z, QIAN T X, et al.Antitumor and immunomodulatory activity of arabinoxylans:A major constituent of wheat bran[J].International Journal of Biological Macromolecules, 2011, 48(1):160-164.
[6] MENDIS M, SIMSEK S.Arabinoxylans and human health[J].Food Hydrocolloids, 2014, 42:239-243.
[7] ZHOU S M, LIU X Z, GUO Y, et al.Comparison of the immunological activities of arabinoxylans from wheat bran with alkali and xylanase-aided extraction[J].Carbohydrate Polymers, 2010, 81(4):784-789.
[8] CICCORITTI R, SCALFATI G, CAMMERATA A, et al.Variations in content and extractability of durum wheat (Triticum turgidum L.var durum) arabinoxylans associated with genetic and environmental factors[J].International Journal of Molecular Sciences, 2011, 12(7):4 536-4 549.
[9] 潘海晓, 刘海顺, 王静, 等.玉米麸皮中阿魏酰低聚糖的制备[J].北京工商大学学报(自然科学版),2011,29(3):33-37.
PAN H X, LIU H S, WANG J, et al.Preparation of feruloyl oligosaccharides from maize bran[J].Journal of Beijing Technology and Business University (Natural Science Edition), 2011, 29(3):33-37.
[10] SMITH M M, HARTLEY R D.Occurrence and nature of ferulic acid substitution of cell-wall polysaccharides in graminaceous plants[J].Carbohydrate Research, 1983, 118:65-80.
[11] 马丛丛, 许继取, 韩领, 等.芥子酸及其生物活性研究进展[J].中国油脂, 2016, 41(5):75-79.
MA C C, XU J Q, HAN L, et al.Advance in sinapic acid and its biological activities[J].China Oils and Fats, 2016, 41(5):75-79.
[12] THIYAM U, STÖCKMANN H, ZUM FELDE T, et al.Antioxidative effect of the main sinapic acid derivatives from rapeseed and mustard oil by-products[J].European Journal of Lipid Science & Technology,2006, 108(3):239-248.
[13] QIAO H Y, DAHIYA J P, CLASSEN H L.Nutritional and physiological effects of dietary sinapic acid (4-hydroxy-3,5-dimethoxy-cinnamic acid) in broiler chickens and its metabolism in the digestive tract[J].Poultry Science,2008, 87(4):719-726.
[14] KOSKI A, PEKKARINEN S, HOPIA A, et al.Processing of rapeseed oil:Effects on sinapic acid derivative content and oxidative stability[J].European Food Research and Technology, 2003, 217(2):110-114.
[15] LI Y, YANG C.Synthesis and properties of feruloyl corn bran arabinoxylan esters[J].International Journal of Cosmetic Science,2016, 38(3):238-245.
[16] OU B X, HAMPSCH-WOODILL M, PRIOR R L.Development and validation of an improved oxygen radical absorbance capacity assay using fluorescein as the fluorescent probe[J].Journal of Agricultural and Food Chemistry, 2001, 49(10):4 619-4 626.
[17] LI Y, ZHU Y, LIANG R, et al.Synthesis and antioxidant properties of caffeic acid corn bran arabinoxylan esters[J].International Journal of Cosmetic Science.2017, 39(4):402-410.
[18] 李颜利,骆正哲,何彤,等.玉米麸质阿拉伯木聚糖对香豆酸酯的制备及性能研究[J].日用化学工业, 2018,48(2):82-87.
LI Y L, LUO Z Z, HE T, et al.Preparation and property of corn gluten arabinoxylan p-coumarate[J].China Surfactant Detergent & Cosmetics, 2018, 48(2):82-87.
[19] FANG J M, SUN R C, FOWLER P, et al.Esterification of wheat straw hemicelluloses in the n,n-dimethylformamide/lithium chloride homogeneous system[J].Journal of Applied Polymer Science, 1999, 74(9):2 301-2 311.
[20] TOSH B, SAIKIA C N, DASS N N.Homogeneous esterification of cellulose in the lithium chloride-n,n-dimethylacetamide solvent system:Effect of temperature and catalyst[J].Carbohydrate Research, 2000, 327(3):345-352.
[21] 何静, 倪军, 耿罗斌.多糖胶水溶液黏度影响因素比较[J].非常规油气, 2017, 4(2):109-113.
HE J, NI J, GENG L B.Comparison of influencing factors on viscosity of polysaccharide gum solution[J].Unconventional Oil & Gas, 2017, 4(2):109-113.
[22] 韩绍聪, 黄蓉萍, 闫昌誉, 等.ORAC法比较5种食源性肽的抗氧化能力[J].广东化工, 2021, 48(21):15-16;36.
HAN S C, HUANG R P, YAN C Y, et al.Comparative study on antioxidant activity of five food-derived bioactive peptides by ORAC method[J].Guangdong Chemical Industry, 2021, 48(21):15-16;36.
[23] 单旺, 陈永生, 梁晓为, 等.羟基肉桂酸衍生物的合成及其抗氧化构效关系[J].食品工业科技, 2017, 38(12):287-291;332.
SHAN W, CHEN Y S, LIANG X W, et al.Synthesis and antioxidant structure-activity relationships of hydroxycinnamic acid derivatives[J].Science and Technology of Food Industry, 2017, 38(12):287-291;332.