魔芋,天南星科魔芋属多年生草本植物,又名磨芋、鬼芋、蒟蒻[1],是我国的一种重要的资源植物,具有药用、食用及工业价值[2]。魔芋经洗涤、去皮、干燥、粉碎、过筛得到的魔芋粉,具有增稠、成膜和降血糖等功效[1],在食品、医药和化工等领域得到广泛应用[2]。魔芋粉的主要功能成分为魔芋葡甘聚糖(konjac glucomannan,KGM),含量不低于50%,依纯化精制程度而不同。KGM是一种天然高分子多糖,在适宜的碱性条件加热,KGM分子发生脱乙酰基作用,形成稳定的热不可逆凝胶[3](以下简称魔芋凝胶),见图1。商业魔芋凝胶食品(仿生食品)通常采用氢氧化钙和碳酸钠为凝固剂,在pH值为11~13的碱性条件,魔芋精粉浓度高于30 g/L且在水溶液中充分溶胀加热生成[4]。魔芋仿生食品质量受魔芋精粉与水比例、加碱(凝固剂)种类、加碱量、凝固时间、加热温度等多因素影响,使用不同的碱性凝固剂生成的魔芋凝胶口感、弹性、色泽、气味等方面都存在差异[5],因此筛选更适宜的凝固剂制作魔芋凝胶,一直受到理论研究和生产应用的重视。
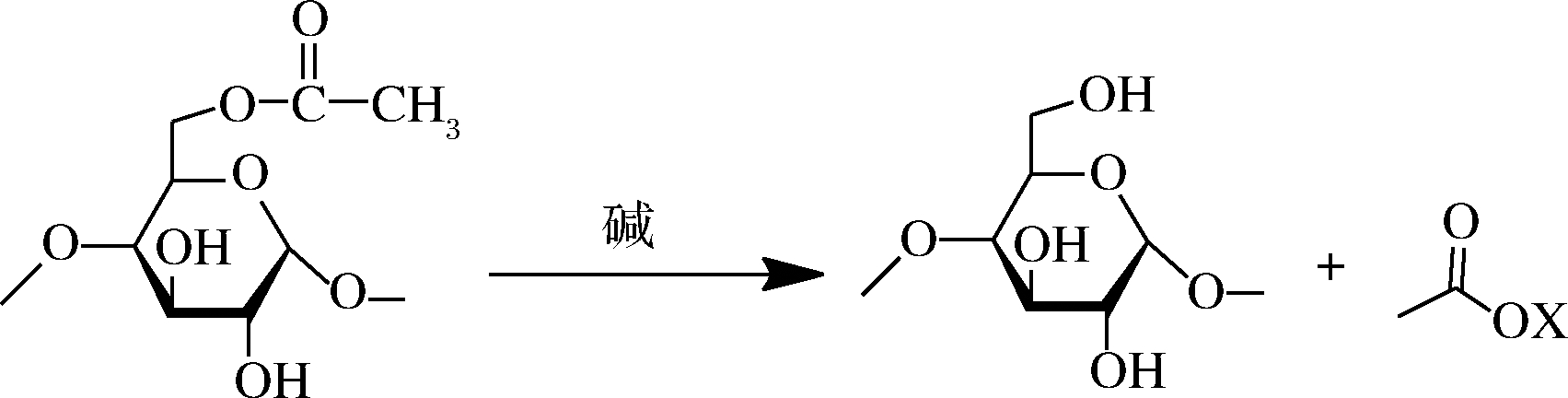
图1 KGM在碱性条件下脱乙酰基反应
Fig.1 Deacetylation of KGM under alkaline conditions
注:X表示离子的元素符号
碱性电解水(alkaline electrolyzed water,AEW)是通过电解盐溶液获得的,产生于电解槽的阴极端,具有高pH、低氧化还原电位(oxidation-reduction potential,ORP)性质[6]。其碱性特质,具备了魔芋凝胶制作工艺中所需条件。此外,AEW含有的活性成分不稳定,可逐渐恢复为普通水,对环境污染小[7],较使用氢氧化钙、碳酸钠更加绿色、安全。同时,AEW制取装置结构简单,与生产传统化学试剂相比成本低廉[8],利于在食品加工中推广应用。由于其呈现的碱性和食用安全性,因此设想将AEW作为凝固剂,制作魔芋凝胶,为此开展本文的研究验证。目前,尚无利用AEW制作魔芋凝胶相关研究报道。
1 材料与方法
1.1 材料与试剂
魔芋精粉[葡甘聚糖含量(以干基计)为(72.62±1.73)%,符合NY/T 494—2010 《魔芋粉》标准要求],四川省江油市新保魔芋制品有限公司;碱性电解水由电解饱和K2CO3电解质水溶液电解得到氢氧化钙、碳酸钠、碳酸钾(AR),成都市科隆化学品有限公司。
1.2 仪器与设备
XK-A7型电解水机,广东鑫康科技有限公司;FD-C20002电子天平,昆山优科维特电子科技有限公司;HCJ-4C磁力搅拌水浴锅,常州恩培仪器制造有限公司;SY-10真空冷冻干燥机,北京松源华兴科技有限公司;5804R离心机,德国Eppendorf公司;CM-5色差仪,日本柯尼卡美能达公司;TA.XT Plus质构仪,英国Stable Micro System公司;MCR302模块化旋转与界面流变仪,奥地利安东帕有限公司;Phenom Pro扫描电镜,荷兰Phenom World公司。
1.3 实验方法
1.3.1 碱性电解水制备
将配制的饱和碳酸钾溶液加入电解水机,按照该机操作手册指示工作,电解6 min,获得碱性电解水(pH:12.65±0.01,ORP:-646 mV)。
1.3.2 魔芋凝胶制备方法
1.3.2.1 氢氧化钙、碳酸钠制备魔芋凝胶
参考李晓飞等[9]的方法并适当修改:分别准确称取1.00 g魔芋精粉均匀分散于30 mL纯水中,搅拌至魔芋精粉充分吸水溶胀为魔芋溶胶,置于70 ℃的水浴锅加热1 h,取出冷却至室温。另分别称取0.3%(占纯水质量,下同)氢氧化钙和碳酸钠,用少量水分别溶解(氢氧化钙溶液pH:12.49±0.03,碳酸钠溶液pH:11.46±0.11),加入到魔芋溶胶中,快速搅拌均匀,用保鲜膜密封,静置1 h,于95 ℃水浴1 h,取出冷却至室温即得到魔芋凝胶。
1.3.2.2 AEW制备魔芋凝胶
准确称取1.00 g魔芋精粉,加入30 mL AEW(pH:12.65±0.01,ORP:-646 mV),搅拌均匀,室温充分溶胀3 h。95 ℃水浴1 h,取出冷却至室温,即得魔芋凝胶。
氢氧化钙、碳酸钠、AEW为凝固剂制作的魔芋凝胶分别记为GCa、GNa和GAEW,制备的魔芋凝胶经取样器制样为直径5 cm的圆柱体。
1.3.3 色度测定
色泽是影响食品感官品质的重要因素。不同凝固剂制作的魔芋凝胶色泽差异用L*(亮度值)、a*(红度值)和b*(黄度值)表示[10]。将1.3.2.1和1.3.2.2 制作的魔芋凝胶均匀切片(直径5 cm,厚1 cm)。色度仪经校正后,分别测定不同凝固剂制备的魔芋凝胶色度,记录L*、a*和b*值,重复测定5次。
1.3.4 持水性测定
参考王鑫等[11]的方法并适当修改。将1.3.2.1和1.3.2.2制作的魔芋凝胶均匀切片(直径5 cm,厚1 cm),置于50 mL离心管,在4 000 r/min离心15 min,除去分离的水并称量,质量记为m2。持水性(water holding capacity,WHC)计算如公式(1)所示:
(1)
式中:WHC为魔芋凝胶持水性,%;m1为原魔芋凝胶质量,g;m2为离心后魔芋凝胶质量,g。
1.3.5 凝胶强度测定
将1.3.2.1和1.3.2.2制作的魔芋凝胶切片(同上),用质构仪测定魔芋凝胶强度[9]。设定质构仪测定参数:质构分析(texture profile analysis,TPA)压缩模式,探头P/0.5(直径0.5英寸的圆柱状平头探头),测试前速度1.5 mm/s,测试速度1.0 mm/s,测试后速度1.0 mm/s,感应力2 g,循环次数1次。重复测定5次。
1.3.6 冻融稳定性
魔芋凝胶在-20 ℃冷冻12 h,室温下解冻6 h[12],作为1个冻融循环,重复5个冻融循环。每次循环后测定凝胶析水率。具体操作如下:每次冻融前准确称取凝胶的质量记为m1,将样品在4 000 r/min离心15 min,去除分离的水并称量,质量记为 m2。每个样品重复3次。析水率计算如公式(2)所示:
析水率![]()
(2)
式中:m1,原魔芋凝胶质量,g;m2,冻融循环离心后魔芋凝胶质量,g。
1.3.7 质构测定
魔芋凝胶使用质构仪进行TPA测试[13]。根据样品的性质,选择硬度、弹性、内聚性、咀嚼性和回复性作为研究参数,测前和测中速度为3 mm/s,测后速度为1 mm/s,触发力为5 g,测试样品应变量50%,重复测定5次。
1.3.8 流变学特性测定
使用流变仪测试魔芋凝胶的流变学特性。采用直径为25 mm的转子,平行板间隙设置为3 mm,应变为1%,频率为1 Hz,在转子边缘涂抹低密度硅油,防止试验过程中水的蒸发,每次扫描时,将样品加载到流变仪的平行板上[14]。
频率扫描:可以用来说明样品的结构完整性和机械强度;温度设定25 ℃,该温度下平衡5 min后,在1~100 rad/s 频率进行频率扫描,观察G′和G″与角频率之间的相关性。
温度扫描:反映样品的热稳定性;温度从20 ℃升至100 ℃,升温速率为2 ℃/min,监测G′和G″的变化趋势。
时间扫描:反映凝胶强度随时间的变化;将复配凝胶切成薄片,温度设定为90 ℃,时间为2 h,监测G′和G″的变化趋势。
1.3.9 凝胶表面形貌观察
将魔芋凝胶制成边长约为3 mm的方块,放入-80 ℃ 的冰箱中,冷冻12 h,立刻转移至真空冷冻干燥机,冻干48 h。将冻干的凝胶用导电双面胶固定到样品台,断面朝上,喷金,抽真空,扫描电镜观察凝胶断面形貌。
1.3.10 数据处理
采用Excel处理数据,结果以“平均值±标准差”表示,采用SPSS 20.0软件对试验数据进行统计分析,不同小写字母表示样品间存在显著性差异(P<0.05),采用Origin 2019b 软件作图。未注明的,重复试验3次。
2 结果与分析
2.1 色度测定
L*指明暗程度,值越大表明样品的表观白度越白;a*,正值表示颜色偏向红色,负值表示偏向绿色;b*,正值表示颜色偏向黄色,负值表示偏向蓝色[10]。3种凝固剂制作的魔芋凝胶外观和色度检测结果见图2和图3。如图2所示,GCa偏黄。由图3可以看出,3种样品的L*、a*、b*均为正值。其中,GCa的b*值最高,与图2观察结果相符。GAEW白度最佳,其L*值为77.27,远大于GCa(72.66)和GNa(75.62)(P<0.05),且a*和b*都较低。由此可见,使用AEW制作的魔芋凝胶,其色泽相对使用氢氧化钙和碳酸钠为凝固剂制作的样品有所改善,有利于色泽的调整,添加增白剂的用量可以减少。

图2 三种魔芋凝胶外观对比
Fig.2 Appearance comparison of three konjac gels

图3 三种魔芋凝胶的色度
Fig.3 The chromaticty of three konjac gels
注:图中小写字母不同表示显著性差异(P<0.05)(下同)
2.2 持水性测定
魔芋凝胶保持水分的能力可用持水性来评价,高持水性表明在外力作用下丢失的水分较少,表明魔芋凝胶网络结构对水分子的束缚能力强,弹性和凝胶强度大[15]。3种凝固剂制作的魔芋凝胶持水性大小如图4所示,均在90%以上,都表现出良好的持水性。由图4可知,GAEW与GCa持水性无显著差异,显著大于GNa(P<0.05)。可能是由于盐离子诱导凝胶形成作用增强,同时阳离子填充量增加,魔芋凝胶网络结构更为致密,彼此缠结聚集形成更为紧密的三维网络结构,因此可充分锁住水分子防止其流失,从而提高魔芋凝胶的持水性[16]。所用AEW由钾盐电解得到,含有一定量的K+,而不同种类的盐形成的凝胶网络结构略有不同,从而导致3种魔芋凝胶持水性出现差异[17]。

图4 三种魔芋凝胶的持水性
Fig.4 Water-holding capacity of three konjac gels
2.3 凝胶强度
凝胶强度指凝胶崩裂或断裂时单位面积所受的力,是反映凝胶内部网络结构坚实程度的重要参数[18]。如图5所示,GAEW的强度最高,其次是GCa,GNa强度最低,且表现出显著差异(P<0.05)。可能是因为AEW由钾盐电解得到,含有一定程度的K+,使魔芋分子间缠结聚集形成更为紧密的三维网络结构,而不同种类的盐离子对凝胶强度的增强效果依次为:K+>Ca2+>Na+[19],因而GAEW内部结构更为坚实,强度更大,持水性也更强。

图5 三种魔芋凝胶的强度
Fig.5 Strength of three konjac gels
2.4 冻融稳定性
冻融稳定性分析是通过测定冷冻-解冻-离心循环的析水率大小,评价在冻融过程中,食品抵抗不良物理变化能力的重要指标[20]。本实验采用离心法[20]测定5个冷冻-解冻-离心循环后的析水率,评价魔芋凝胶的冻融稳定性。析水率结果如表1所示。总体上,由于凝胶网络中含有大量的水,经冷冻形成冰晶破坏魔芋凝胶的网络结构,因此经过反复冷冻解冻循环,魔芋凝胶析水率较大[21]。结果表明,在一定条件下,魔芋凝胶析水率与冻融循环次数之间存在典型的正相关。在第2~5个冻融循环中,3个样品的析水率均无显著差异。经过5个冷冻周期后GCa、GNa、GAEW的析水率分别为72.29%、72.05%和72.00%。总体上,经反复冻融,使用AEW制作的魔芋凝胶的冻融稳定性与氢氧化钙和碳酸钠的无显著性差异(P>0.05)。
表1 三种魔芋凝胶的冻融稳定性 单位:%
Table 1 Freeze-thaw stability of three konjac gels
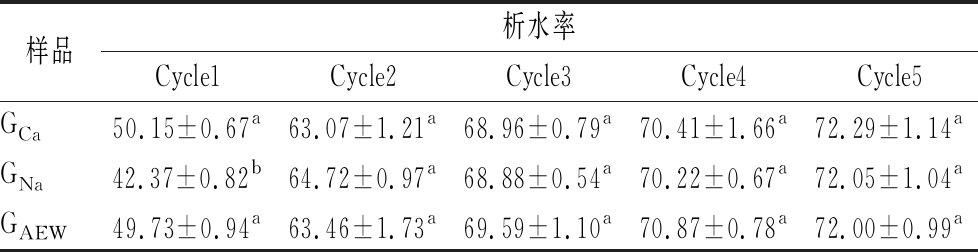
注:同列小写字母不同表示有显著性差异(P<0.05)(下同)
样品析水率Cycle1Cycle2Cycle3Cycle4Cycle5GCa50.15±0.67a63.07±1.21a68.96±0.79a70.41±1.66a72.29±1.14aGNa42.37±0.82b64.72±0.97a68.88±0.54a70.22±0.67a72.05±1.04aGAEW49.73±0.94a63.46±1.73a69.59±1.10a70.87±0.78a72.00±0.99a
2.5 质构分析
硬度是指在牙齿之间或舌与腭之间压缩样品所用的力[22]。表2显示了3种碱性凝固剂对魔芋凝胶硬度的影响,GCa的硬度最高,GAEW次之,GNa最低,三者之间有显著性差异(P<0.05)。对魔芋凝胶而言,硬度数值越大,魔芋凝胶形状越坚挺,外观品质越好[23]。弹性表示样品受挤压后的恢复能力[22]。如表3所示,3种碱性凝固剂制作的魔芋凝胶弹性的大小顺序为:GAEW>GCa>GNa。内聚性反映出样品内部紧密程度和抗外界破坏力。从表3可以看出,3种碱性凝固剂对魔芋凝胶内聚性的影响无显著差异,GNa的内聚性稍小于GCa和GAEW。咀嚼性反映了魔芋凝胶对咀嚼的持续抵抗性,咀嚼性越强,魔芋凝胶口感越好[24]。GCa和GAEW的咀嚼性无显著差异,且远大于GNa。回复性指样品受压后迅速恢复变形的能力,3种样品的回复性无显著差异,表明3种碱性凝固剂对魔芋凝胶回复性的影响无较大区别。综上,AEW相比碳酸钠制作的魔芋凝胶效果更好,与氢氧化钙制作的魔芋凝胶效果相似。
表2 三种魔芋凝胶的质构特性
Table 2 Texture characteristics of three konjac gels

样品指标硬度/g弹性内聚性咀嚼性回复性GCa2 657.85±169.11a0.96±0.01ab0.64±0.06a1 624.26±19.20a0.20±0.02aGNa1 903.18±41.49c0.95±0.01b0.69±0.06a1 239.62±100.31b0.20±0.02aGAEW2 244.42±100.96b0.97±0.00a0.74±0.05a1 561.75±140.03a0.18±0.01a
2.6 流变学特性
储能模量(G′)又称弹性模量,指物质受力产生弹性形变的程度,损耗模量(G″)又称黏性模量,表征物质在外力作用下阻碍物质流动的特性[25]。
图6-A表示在25 ℃条件下,不同凝固剂制作的魔芋凝胶G′和G″对角频率的依赖关系,在整个频率范围内,随着角频率的增加,3种样品都表现出G′>G″的特点,表明各样品网络结构足够紧密,均形成了较强的凝胶[13]。
图6-B显示了各样品在20~100 ℃测量温度时,G′和G″的变化,从而分析样品的热稳定性。温度低于40 ℃时,水分子吸收热量开始运动,带动KGM分子随之运动,但魔芋凝胶网络结构紧密,已有的热运动不足以解开其分子缠绕[26],因此在这一温度范围内G′保持稳定且高于G″。随温度升高,GCa的曲线较为平缓,受温度的影响较小,GNa和GAEW的空间网络结构开始受到破坏,其中GNa的曲线始终呈现缓慢下降的趋势。当温度大于70 ℃时,GAEW的G′不断降低,AEW制作的魔芋凝胶G′受高温影响较大。
随时间变化,魔芋凝胶的强度也会随之变化。因此,本研究在90 ℃条件下对3种样品进行时间扫描,如图6-C所示。可以看出,随着时间延长,3种样品的G′和G″变化趋势总体较缓慢,说明凝胶网络结构基本形成。其中,G′均表现出缓慢增长的趋势。GNa的G″曲线先降低再上升,最终趋于平缓。GCa和GAEW的G′曲线有相同的变化,最初阶段有一定程度下降,随时间延长进入平台期。总体上,3种凝胶样品G′和G″随时间无较大变化。从流变特性可以看出,3种样品均形成了较好的凝胶网络结构。

A-G′、G″随角频率的变化;B-G′、G″随温度的变化;C-G′、G″随时间的变化
图6 三种魔芋凝胶的流变特性
Fig.6 Rheological properties of three konjac gels
2.7 微观结构
从前面实验发现,3种凝固剂对魔芋凝胶的凝胶强度、持水特性有不同程度的影响。在一定程度上,魔芋凝胶的质构及持水性与其微观结构有一定的相关性[27]。因此,通过扫描电子显微镜对3种凝胶样品进行微观结构观察。由图7可以看出,不同凝固剂制作的魔芋凝胶体系结构有一定程度的变化,GCa形成的蜂窝网状结构较完整、封闭,网络壁层较厚,这可能是因为Ca2+与KGM分子产生架桥作用,有助于分子彼此扭结、缠绕,形成具有蜂窝网络结构的凝胶,该结构与前文GCa有良好的持水性和较强的凝胶强度有关[26]。GNa具有较多的连接区,但网状结构不紧密,且壁层较薄,壁上有少许微孔,细薄的网络结构和相对较多的孔洞解释了GNa析水率高、硬度较差的原因[28]。GAEW与GNa的微观结构类似,但网络结构增多,聚集程度稍微增强,空隙较小,且有序、平整,致密有序的网络结构有助于持水力的增强[29],与前文持水性测定所得结果保持一致。

A1-GCa放大500倍;A2-GCa放大800倍;B1-GNa放大500倍;B2-GNa放大800倍;C1-GAEW放大500倍;GAEW放大800倍
图7 三种碱性凝固剂对魔芋凝胶结构的影响
Fig.7 Effect of three alkaline coagulants on the structure of konjac gels
3 结论
本文以AEW代替传统碱性凝固剂,研究其对魔芋凝胶理化特性影响,并与氢氧化钙和碳酸钠制作的魔芋凝胶进行比较分析。研究表明,以AEW为凝固剂制作的魔芋凝胶,在色泽和凝胶强度方面有所改善,均优于氢氧化钙和碳酸钠制作的样品,有良好的商品性质。在持水性、冻融稳定性、质构分析和流变特性等方面表现出与氢氧化钙为凝固剂制作的魔芋凝胶相似的良好性能,这些优良性质与通过扫描电镜观察到的致密网络结果密切相关。综上所述,AEW具有制备魔芋凝胶的应用潜力。
[1] ZHANG Y Q, XIE B J, GAN X.Advance in the applications of konjac glucomannan and its derivatives[J].Carbohydrate Polymers, 2005, 60(1):27-31.
[2] DEVARAJ R D, REDDY C K, XU B J.Health-promoting effects of konjac glucomannan and its practical applications:A critical review[J].International Journal of Biological Macromolecules, 2019, 126:273-281.
[3] GAO S J, NISHINARI K.Effect of degree of acetylation on gelation of konjac glucomannan[J].Biomacromolecules, 2004, 5(1):175-185.
[4] WANG L X, JIANG Y P, LIN Y H, et al.Rheological properties and formation mechanism of DC electric fields induced konjac glucomannan-tungsten gels[J].Carbohydrate Polymers, 2016, 142:293-299.
[5] ZHOU Y, WU L L, TIAN Y, et al.A novel low-alkali konjac gel induced by ethanol to modulate sodium release[J].Food Hydrocolloids, 2020, 103:105653.
[6] KIM M J, HUNG Y C.Effect of alkaline electrolyzed water as an inhibitor of enzymatic browning in red delicious apples[J].Journal of Food Biochemistry, 2014, 38(6):542-550.
[7] LI Z H, ZHOU B, LI X T, et al.Effect of alkaline electrolyzed water on physicochemical and structural properties of apricot protein isolate[J].Food Science and Biotechnology, 2019, 28(1):15-23.
[8] 谭晓妍, 孙君社, 宁慧娟, 等.碱性电解水耦合酶提取茶渣蛋白工艺优化[J].食品工业科技, 2018, 39(15):213-218;227.
TAN X Y, SUN J S, NING H J, et al.Optimization of extraction process of protein from exhausted tea by alkaline electrolyzed-reducing water synergized with protease[J].Science and Technology of Food Industry, 2018, 39(15):213-218;227.
[9] 李晓飞, 李培源, 李安琪, 等.黄原胶添加对碱法诱导魔芋胶凝胶特性及凝胶机制的影响[J].中国农业科学, 2020, 53(14):2 941-2 955.
LI X F, LI P Y, LI A Q, et al.Effects of xanthan addition on the gel properties and gel mechanism of alkaline-induced konjac glucomannan gels[J].Scientia Agricultura Sinica, 2020, 53(14):2 941-2 955.
[10] ZHANG T, XUE Y, LI Z J, et al.Effects of deacetylation of konjac glucomannan on Alaska pollock surimi gels subjected to high-temperature (120 ℃) treatment[J].Food Hydrocolloids, 2015, 43:125-131.
[11] 王鑫, 吴瑀婕, 卢方云, 等.瓜尔豆魔芋胶的复配胶结合超声处理对鸡血豆腐凝胶特性及其作用力的影响[J].食品与发酵工业, 2021, 47(18):187-193.
WANG X, WU Y J, LU F Y, et al.Effects of gel properties and molecular interactions by guar gum and konjac gum combined with ultrasound on chicken blood tofu[J].Food and Fermentation Industries, 2021, 47(18):187-193.
[12] ZHAO H B, CHEN J, HEMAR Y, et al.Improvement of the rheological and textural properties of calcium sulfate-induced soy protein isolate gels by the incorporation of different polysaccharides[J].Food Chemistry, 2020, 310:125983.
[13] QIAO L K, LI Y P, CHI Y Z, et al.Rheological properties, gelling behavior and texture characteristics of polysaccharide from Enteromorpha prolifera[J].Carbohydrate Polymers, 2016, 136:1 307-1 314.
[14] DU X Z, LI J, CHEN J, et al.Effect of degree of deacetylation on physicochemical and gelation properties of konjac glucomannan[J].Food Research International, 2012, 46(1):270-278.
[15] GOLCHOOBI L, ALIMI M, SHOKOOHI S, et al.Interaction between nanofibrillated cellulose with guar gum and carboxy methyl cellulose in low-fat mayonnaise[J].Journal of Texture Studies, 2016, 47(5):403-412.
[16] XIN C, CHEN J, LIANG H S, et al.Confirmation and measurement of hydrophobic interaction in sol-gel system of konjac glucomannan with different degree of deacetylation[J].Carbohydrate Polymers, 2017, 174:337-342.
[17] 李俊宏. 魔芋胶复配体系及盐离子在水晶皮冻中的作用及应用研究[D].重庆:西南大学, 2020.
LI J H.Study on the function and application of konjac gum compounding system and salt ions in crystal jelly[D].Chongqing:Southwest University, 2020.
[18] 李培源, 李晓飞, 李安琪, 等.热碱致魔芋胶与黄原胶共混凝胶的显微结构与流变规律[J].中国农业科学, 2020, 53(18):3 792-3 804.
LI P Y, LI X F, LI A Q, et al.Microstructure and rheological behavior of mixed konjac glucomannan and xanthan induced by thermo-alkali treatment[J].Scientia Agricultura Sinica, 2020, 53(18):3 792-3 804.
[19] 原松梅. 影响魔芋葡甘聚糖凝胶强度及其吸附性的因素研究[D].长沙:湖南农业大学, 2013.
YUAN S M.Study of the influence factors of konjac glucomannan gel's strength and konjac glucomannan's adsorption[D].Changsha:Hunan Agricultural University, 2013.
[20] 徐东彦. 环糊精对卡拉胶/魔芋胶复配凝胶凝胶特性的影响及应用[D].济南:齐鲁工业大学, 2019.
XU D Y.Effect of cyclodextrins on the gelling properties of carrageenan/konjac glucommanan and its applications[D].Jinan:Qilu University of Technology, 2019.
[21] CHEN H M, FU X, LUO Z G.Effect of gum arabic on freeze-thaw stability, pasting and rheological properties of tapioca starch and its derivatives[J].Food Hydrocolloids, 2015, 51:355-360.
[22] YUAN C, DU L, ZHANG G J, et al.Influence of cyclodextrins on texture behavior and freeze-thaw stability of kappa-carrageenan gel[J].Food Chemistry, 2016, 210:600-605.
[23] HU Y, TIAN J, ZOU J, et al.Partial removal of acetyl groups in konjac glucomannan significantly improved the rheological properties and texture of konjac glucomannan and κ-carrageenan blends[J].International Journal of Biological Macromolecules, 2019, 123:1 165-1 171.
[24] 雷雯. 外源淀粉对魔芋豆腐品质和消化道代谢性能的影响[D].重庆:西南大学, 2020.
LEI W.Effects of exogenous starch on quality and digestive tract metabolic performance of konjac tofu[D].Chongqing:Southwest University, 2020.
[25] WU D, YU S M, LIANG H S, et al.The influence of deacetylation degree of konjac glucomannan on rheological and gel properties of konjac glucomannan/κ-carrageenan mixed system[J].Food Hydrocolloids, 2020, 101:105523.
[26] 傅玉颖, 沈亚丽, 陈国文, 等.Na+和Ca2+浓度对魔芋葡甘聚糖与黄原胶凝胶动态流变特性的影响[J].农业工程学报, 2018, 34(1):301-307.
FU Y Y, SHEN Y L, CHEN G W, et al.Effects of content of Na+ and Ca2+ on dynamic rheological properties of mixed gel system of konjac glucomannan and xanthan gum[J].Transactions of the Chinese Society of Agricultural Engineering, 2018, 34(1):301-307.
[27] NING Y J, CUI B, YUAN C, et al.Effects of konjac glucomannan on the rheological, microstructure and digestibility properties of debranched corn starch[J].Food Hydrocolloids, 2020, 100:105342.
[28] LIU X B, GAN J, NIRASAW S, et al.Effects of sodium carbonate and potassium carbonate on colloidal properties and molecular characteristics of konjac glucomannan hydrogels[J].International Journal of Biological Macromolecules, 2018, 117:863-869.
[29] JIANG Y Y, REDDY C K, HUANG K H, et al.Hydrocolloidal properties of flaxseed gum/konjac glucomannan compound gel[J].International Journal of Biological Macromolecules, 2019, 133:1 156-1 163.