果汁自然发酵成果酒的过程涉及多种微生物的参与,其中酿酒酵母起着核心作用[1]。使用酿酒酵母对果汁进行纯种发酵,可以更好地控制发酵过程,避免感官偏差、产品质量不均等问题[2-3]。目前,市售枸杞酒以浸泡型枸杞酒为主,即以白酒或黄酒为酒基,通过对枸杞等中药材浸泡、勾兑等调配而成。但此法得到的枸杞酒口感较差、品质不稳定、易沉淀,且枸杞中的生物活性成分提取不完全,保存率低[4]。发酵型枸杞酒相较于浸泡型枸杞酒能保留枸杞中原有的活性物质,且酒精度低,适应人群广。目前发酵枸杞酒所用酿酒酵母为葡萄酒、果酒通用酵母,因缺少专用的酿酒酵母导致发酵枸杞酒酒体单薄、风味不足、缺乏典型性等问题。因此,选育适合特定水果发酵的酿酒酵母是酿酒行业持续关注并亟需解决的问题[5]。
现代生物育种方法主要有诱变、基因工程及原生质体融合技术等[6]。张惠玲[7]通过原生质体融合方法打破分类界定,实现种间或更远缘的基因交流,筛选出适合枸杞酒酿造的新菌株,该菌株使枸杞酒中酯含量提高5%,酒精度提高2%vol~3%vol,发酵物质增加了5%~7%,但风味物质增加不明显,需要进一步改善酒体典型风味不突出的问题。田甜甜[6]通过常压室温等离子体诱变(atmospheric and room temperature plasma,ARTP)、高通量筛选(high-throughput screening,HTS)以及适应性实验室进化定向选育了1株耐酸性强、产香性能良好、用于青梅酒发酵的酿酒酵母ET008-c54。与其他育种方法相比,ARTP诱变技术进行微生物育种具有突变频率高、操作简单、成本低、安全、无污染等特点[8]。因此针对枸杞酒香气不足且典型性不突出等问题,选育适用于枸杞果汁发酵的酿酒酵母,是提高枸杞酒香气质量的根本所在。
本文从枸杞汁自然发酵液中分离筛选可以提高酒体醇厚性和风味物质含量的酿酒酵母。利用ARTP诱变和HTS方法进一步选育产香性能较好的突变株,并通过自酿枸杞酒与2种市售发酵枸杞酒的理化指标及风味物质的定量分析,解析了选育菌株在酿造枸杞酒产香方面的优势,并通过气味活性值(odor activity value,OAV)分析确定了影响枸杞酒风味的主要化合物,为枸杞酒工业化应用提供理论基础。
1 材料与方法
1.1 菌株和原料
果酒活性干酵母RW、SY和RV171,安琪酵母股份有限公司;活性干酵母DV10,法国莱蒙特葡萄酒酵母公司。
枸杞干果(宁杞5号)、市售发酵枸杞酒健康快车(酒精度约12%vol,糖度约30 g/L,配料表:枸杞、二氧化硫)和金色传杞(酒精度约12%vol,糖度约10 g/L,配料表:枸杞、二氧化硫),宁夏红枸杞产业集团。
1.2 试剂与培养基
1.2.1 试剂
酵母提取物、胰蛋白胨、葡萄糖和氯化三苯基四氮唑(triphenyltetrazolium chloride,TTC),中国国药集团化学试剂有限公司;氢氧化钠、氯化钠、浓盐酸、甲醇、无水乙醇等常规化学试剂均为分析纯,上海麦克林生化科技有限公司;果胶酶,白银赛诺生物科技有限公司;乙酸乙酯、乙酸异戊酯、丁酸乙酯、β-紫罗兰酮等标准品,阿拉丁(上海)生物科技有限公司。
1.2.2 培养基
YPD培养基(g/L):酵母粉1,葡萄糖2,胰蛋白胨2,115 ℃灭菌20 min;配制固体培养基时加入琼脂粉1.5~2.0。
TTC下层培养基(g/L):葡萄糖20,蛋白胨20,酵母浸膏10,琼脂粉20。
TTC上层培养基(g/L):TTC 0.05,葡萄糖0.5,琼脂粉20。
1.3 仪器与设备
ARTP-3常压室温等离子体诱变仪,思清源生物科技有限公司;GC-MS,赛默飞世尔科技有限公司;LS-B50L自动高压蒸汽灭菌器,致微(厦门)仪器有限公司;SHP-2500低温培养箱,上海精密实验设备有限公司。
1.4 实验方法
1.4.1 枸杞酒酿酒酵母的初步筛选
1.4.1.1 酿酒酵母的分离
取5 g宁杞5号枸杞干果于30 mL无菌水中,室温下静置培养12 h,将培养液摇匀后进行梯度稀释,并涂布于YPD固体培养基平板上,30 ℃培养48 h,待菌落长出后,挑取单菌落划线于YPD培养基平板中进行纯化,并保藏于4 ℃备用。
1.4.1.2 酿酒酵母的一级筛选
挑取YPD培养基上的单菌落于TTC下层培养基上培养48 h,倒入15 mL TTC上层培养基,并于30 ℃避光培养24 h。TTC显色原理是:活菌中所含脱氢酶可将TTC还原成红色,使平板上的菌落颜色呈现肉眼可见的红色菌落,且呈色的深浅可判断酵母产酒精能力的高低,产酒精能力强的酵母会显示深红色,次之显粉红色、微红色或不显色[9]。因此TTC可作为酿酒酵母利用葡萄糖产乙醇能力的显色剂。
1.4.1.3 酿酒酵母的二级筛选
取30 ℃,220 r/min培养48 h后的菌液50 μL接种于含有杜氏小管的YPD液体培养基中,30 ℃,静置培养,每2 h观察1次杜氏小管中气泡体积。杜氏管中产生气泡的时间和气泡的体积可直接反映菌株发酵的起酵速度和发酵能力。通过杜氏小管筛选试验,筛选出起酵速度快且发酵能力强的菌株。
1.4.1.4 酿酒酵母的三级筛选
不同的酿酒酵母分别进行枸杞酒发酵实验,发酵工艺如下:枸杞20 g,料液比为1∶10(质量比),白砂糖调节糖度为200 g/L,酵母接种密度为1×107 CFU/mL,添加偏重亚硫酸钾至SO2含量为100 mg/L,果胶酶为30 U/g,发酵温度20 ℃。每24 h测定重量损失以监测发酵,发酵液24 h内失重<0.2 g视为发酵结束,发酵结束后过滤并对发酵液进行理化指标和GC-MS分析。设置3个生物学平行。
1.4.2 常温室压等离子体诱变
ARTP诱变条件参考田甜甜[6]离子体诱变方法。
1.4.3 高通量筛选
(1)初筛:利用自动挑菌仪挑取平板上长出的单菌落,接入装有100 μL YPD培养基的96孔板中,220 r/min、30 ℃条件下培养2 d,用酶标仪测定OD600。将未接种的培养基用作对照,选取OD600较出发菌株明显提高的正向突变株,甘油管保藏,并进行复筛。
(2)复筛:为了验证突变菌株的发酵性能,将出发菌株和初筛的突变菌株进行发酵实验。将上述菌株分别接入含糖量200 g/L的枸杞汁中,20 ℃条件下发酵。发酵结束后,使用GC-MS测定挥发性成分,筛选出具有良好风味的突变菌株。
1.4.4 发酵实验
发酵条件同1.4.1.4。通过测定CO2失重来检测发酵过程,并对获得的枸杞酒进行理化指标测定和感官评价。
1.4.5 正向突变菌株遗传稳定性
将诱变后的菌株进行枸杞酒的发酵,发酵结束后,离心(10 000 r/min,3 min)收集酿酒酵母菌株于YPD中,220 r/min、30 ℃条件下培养2 d,进行下一次的枸杞酒发酵。连续传代培养7次,发酵结束后通过测定枸杞酒的主要风味化合物的含量来确定菌株是否具有遗传稳定性。
1.4.6 枸杞酒理化指标分析
pH、总糖、总酸、酒精度根据GB/T 15038—2006《葡萄酒、果酒通用分析方法》中描述的方法确定。
1.4.7 风味物质的分析
通过固相微萃取-气相色谱-质谱法(solid phase microextraction-GC-MS,SPME-GC-MS)测定枸杞酒中挥发性化合物,GC-MS条件参照李凯等[10]的方法。未知化合物的定性通过与NIST 05质谱库中标准谱图比对确定,化合物的定量通过在体积分数10%的乙醇溶液中配制待测化合物标准溶液并绘制标准曲线,依据标准曲线确定果酒中挥发性化合物的浓度[3]。OAV计算为在果酒中测得的某种物质浓度与其在葡萄酒中气味阈值之间的比率[11-12]。
1.4.8 感官评价
由10名经过专业培训的小组成员组成感官品评小组,对枸杞酒的色泽、香气、口感和状态4个方面进行打分,品评细则参考剧柠等[13]。
1.4.9 数据分析
每个独立实验重复3次,结果以平行实验后含量的均值±标准偏差表示。使用Origin 2020b和IBM SPSS Statistics 25.0软件进行绘图和显著性分析软件对数据进行方差分析。
2 结果与分析
2.1 枸杞酒酿酒酵母的初步筛选
2.1.1 酿酒酵母的分离及鉴定
从宁杞5号自然发酵液中分离出201株菌株,经过18S rDNA鉴定,其中酿酒酵母(Saccharomyces cerevisiae)115株。115株酿酒酵母编号为M-1~M-115,并进行下一步的筛选。
2.1.2 酿酒酵母的一级筛选
TTC显色剂能够被活细胞中的脱氢酶还原,形成从无色到红色的呈色反应,肉眼能直观地观察到细胞的呈色状态[14]。酿酒酵母发酵过程是将葡萄糖经过糖醇解途径生成丙酮酸,再经过丙酮酸脱羧酶、乙醇脱氢酶的作用生成乙醇。因此可利用TTC显色原理对酵母菌株的产酒精能力进行筛选[9]。菌落颜色越深,表明菌株产酒精能力越强;呈浅红色或无色,表明产酒精能力较弱或不产酒精[15]。其中20株颜色呈深红色,8株呈粉红色,对此28株菌株进行下一步的筛选。
2.1.3 酿酒酵母的二级筛选
酵母发酵过程中产生CO2气体,杜氏管中产生气泡的体积和时间可直接反映菌株发酵的起发酵能力和起酵速度。二级筛选结果显示:在12 h内气体充满杜氏小管的菌株有11株,在24 h内气体充满杜氏小管的菌株有7株,在36 h内气体充满杜氏小管的菌株有5株,在48 h内气体充满杜氏小管的菌株有3株,48 h后气体仍未充满杜氏小管的菌株视为无发酵能力。选择12 h内气体充满杜氏小管的11株菌株进行下一步的筛选实验。
2.1.4 酿酒酵母的三级筛选
将筛选的11株酿酒酵母和4株商业酿酒酵母分别进行枸杞酒发酵实验,根据理化指标及感官评价进行初步筛选,结果如表1所示。结果表明,15株酿酒酵母产酒精能力基本相同,但是对枸杞酒的品质影响显著,其中M-23发酵的枸杞酒酒体醇厚,酯香明显,酒体协调,且感官评价有最高得分。相较于其他14株菌株,M-23较适宜作为枸杞酒的酿造菌株,但菌株M-23发酵的枸杞酒香气物质提高较少,因此本文以该菌株作为出发菌株,对其进行进一步选育。
表1 不同菌株发酵枸杞酒的理化指标及感官评价
Table 1 Physical and chemical characteristics and sensory evaluation of wolfberry wines fermented by different strains

菌种名称酒精度/%vol总酸/(g·L-1)总糖/(g·L-1)感官得分感官评价M-38.70±0.023.16±0.245.08±0.3160.1酒体单薄、不醇厚M-48.92±0.013.24±0.014.08±0.1061.0寡淡、香味不突出M-78.78±0.013.16±0.024.64±0.2458.9酸涩味较重,酒体不协调M-118.91±0.032.71±0.314.04±0.4462.8酵母味较重,颜色不清亮M-88.75±0.013.24±0.164.68±0.6162.1酒体单薄,无明显酯香M-128.69±0.043.37±0.135.08±0.2054.6酒体浑浊,酵母味较重M-168.85±0.023.24±0.013.88±1.4162.5酸涩味较重M-228.91±0.013.46±0.115.28±0.8261.4寡淡,酒体不协调M-238.88±0.033.29±0.114.88±0.8176.2酒体醇厚,酯香明显M-268.64±0.113.41±0.175.48±0.2170.4酒体柔和,缺少枸杞香气M-308.59±0.013.54±0.045.28±0.8066.4酒体单薄,不醇厚RW8.70±0.034.10±0.105.80±0.6465.9寡淡、香味不突出SY8.80±0.024.31±0.054.61±0.6258.7酒体浑浊,酵母味较重RV1718.86±0.044.55±0.143.80±0.2065.2酒体单薄、不醇厚DV108.78±0.034.20±0.081.62±0.2467.3寡淡,酒体不协调
2.2 ARTP筛选具有良好产香性能的菌株
诱变时间是ARTP诱变的重要参数,对获得最佳突变菌株具有重要意义[16]。现代育种理论表明,诱变致死率≥95%时,正向突变率最高,可获得最佳突变体[17]。图1为不同诱变时间处理下酿酒酵母M-23的致死率,表明在诱变时间为35 s时,M-23的致死率达到99.02%;当诱变时间延长至40 s时,致死率几乎达到100%,因此确定35、40、45和50 s为ARTP诱变的最佳处理时间。然而,在诱变过程中,进行1次诱变处理获得的非致死突变菌株中所需表型的菌株的比例很小,所以需进行重复诱变直至获得目的菌株[6]。
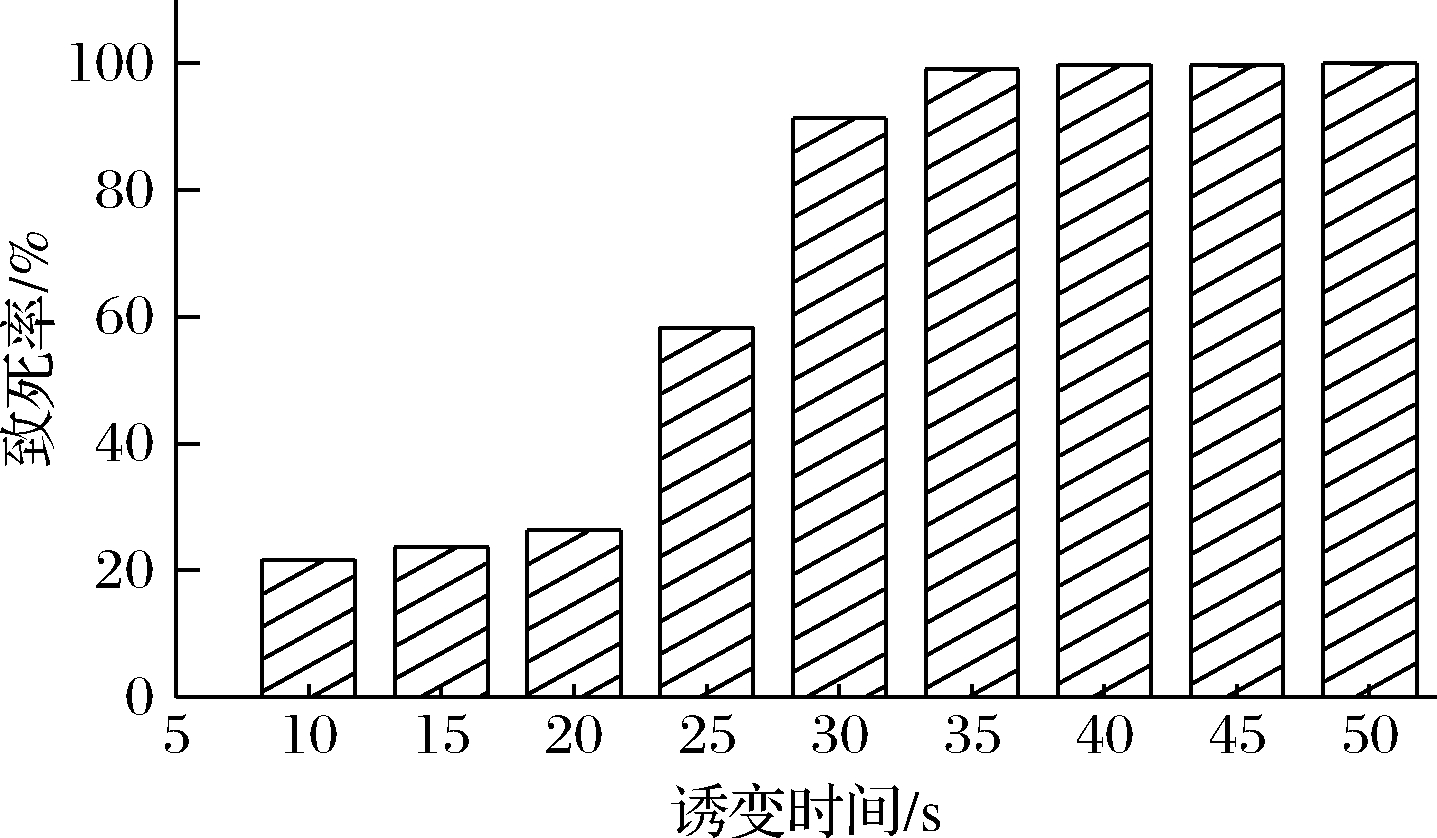
图1 不同处理时间下M-23致死率
Fig.1 Effect of treatment time on the lethality rate of M-23
将35、40、45、50 s处理时间下获得的852个菌株接入装有200 μL YPD液体培养基的96孔板中,30 ℃,220 r/min培养48 h后测定其OD600,M-23作为对照。挑选OD600明显高于M-23的菌株进行枸杞酒酿造,测定其发酵特性和风味物质的含量,筛选出与对照组在的风味物质含量上具有显著差异的菌株,并重复验证,部分结果如表2和表3所示。4株菌株发酵枸杞酒的理化指标无明显差异。在主要风味物质方面M-23-7-14的风味物质总含量明显高于其他菌株。例如,M-23-7-14枸杞酒中β-紫罗兰酮、苯乙醇、乙酸苯乙酯、辛酸和正己酸的含量分别是M-23的1.5、1.8、1.8、2.5和2.5倍。乙酸苯乙酯、苯乙醇和β-紫罗兰酮具有典型的花香味,辛酸和正己酸具有奶酪味,分别对枸杞的香气具有一定的贡献。总之,与M-23相比,诱变菌株M-23-7-14菌株酿造的枸杞酒中风味物质的含量提高了37.0%。因此,菌株M-23-7-14作为后续实验的目的菌株。
表2 ARTP诱变后枸杞酒的理化指标
Table 2 Physical and chemical characteristics of wolfberry wines fermented by different strains

菌株酒精度/%vol总糖/(g·L-1)总酸/(g·L-1)M-2310.51±0.344.31±0.054.40±0.11M-23-7-610.86±0.274.22±0.294.52±0.24M-23-7-1710.61±0.324.12±0.324.19±0.36M-23-7-1410.81±0.333.98±0.424.32±0.18
表3 ARTP诱变后枸杞酒主要风味物质的相对含量 单位:μg/L
Table 3 Main aroma compounds of wolfberry wines fermented by some strains

注:a~d代表方差分析和t检验的显著差异(P<0.05);nd代表未检测到
物质M-23M-23-7-6M-23-7-17M-23-7-14乙酸苯乙酯100.65±4.81a158.85±3.11b164.78±4.12c186.65±3.12d乙酸异戊脂202.91±8.21d191.06±2.42c153.87±3.51b118.31±7.45a己酸乙酯226.18±10.52c264.60±3.71d152.24±4.34b126.50±2.11a苯乙醇1 333.06±57.10a1 460.08±77.89b1 488.93±51.32b2 352.03±91.56c异戊醇3 036.32±64.90a3 354.14±87.56b3 442.05±40.56c4 812.58±68.98dβ-紫罗兰酮16.09±2.13a23.37±3.21c19.92±1.12b23.71±4.89d乙酸乙酯281.99±7.82a365.10±8.23b374.50±3.90c450.03±9.64d正壬醇14.12±2.92b15.69±1.81cndanda正丙醇9.83±1.25a11.89±0.51b13.22±1.21c18.34±1.62d辛酸713.31±45.61a1 354.15±54.24c1 296.51±50.90b1 765.07±38.65d正己酸64.60±7.15a99.95±5.11b99.67±5.45b161.01±4.86c丁酸乙酯15.42±0.99d14.66±1.10c11.77±2.11b9.59±1.34a肉桂酸乙酯9.49±2.31b14.23±3.21cnda19.01±2.56d辛酸乙酯1 535.3±35.34d1 466.26±28.01c1 154.90±31.21a1 232.54±38.98b癸酸乙酯1 778.15±42.15c1 329.03±45.45b1 247.96±45.32a1 473.06±24.45d棕榈酸乙酯86.83±13.56b63.96±12.31a93.52±8.9.4c142.20±5.66d丙酸乙酯7.15±1.21a9.95±1.41d8.52±0.45c7.81±0.61b肉豆蔻酸乙酯38.04±2.11b39.13±4.92c32.51±2.54a51.16±2.80d异丁醇120.23±4.80a141.72±10.11c134.59±7.61b191.14±6.91d总计9 589.6710 377.819 889.4613 140.75
2.3 酿酒酵母 M-23-7-14的遗传稳定性分析
由于酵母存在自我修复机制,只有具有稳定遗传特性的菌株才能用于工业生产[18],因此需要对菌株M-23-7-14进行遗传稳定性分析。对M-23-7-14进行传代培养,并对发酵枸杞酒的主要风味化合物进行测定,结果如图2所示。在7代传代培养中,菌株M-23-7-14发酵的枸杞酒的风味物质含量均保持相对稳定水平,说明菌株M-23-7-14具有较好的遗传稳定性,可用于枸杞酒的酿造。

图2 M-23-7-14遗传稳定性的验证
Fig.2 Genetic stability of M-23-7-14 for seven subcultures
2.4 枸杞酒挥发性化合物含量分析
2.4.1 挥发性化合物半定量分析
风味作为果酒的一个产品属性,是评价其品质的重要指标,而风味物质的种类、含量、感官阈值及其相互作用,是构成果酒香气的重要因素,决定了果酒的风味特征和典型特征[6]。目前,最普遍的分析方法是GC-MS和感官评价法[19]。主要的挥发性化合物对枸杞酒的品质发挥着重要作用,利用GC-MS对枸杞酒中的挥发性化合物进行检测(数据未显示)。在2种市售枸杞酒(健康快车、金色传杞)和2种自酿枸杞酒中共检测出84种挥发性化合物,其中醇类物质13种,酯类化合物38种,酸类化合物7种,醛/酮类化合物15种,芳香烃类化合物2种,其他类化合物6种。不同枸杞酒中挥发性化合物种类存在一定的差异,市售健康快车枸杞酒中检测出的挥发性化合物种类最少,有37种,M-23-7-14菌株发酵枸杞酒中检测出的化合物种类最多有53种,M-23菌株发酵枸杞酒和市售金色传杞枸杞酒分别检测出49和39种挥发性化合物。相较于菌株M-23,菌株M-23-7-14酿造的枸杞酒中癸酸和辛酸分别是M-23酿造枸杞酒的16.4和11.6倍,癸酸和辛酸具有黄油奶酪味,对枸杞酒的香气具有积极作用[20]。值得一提的是,β-紫罗兰酮是枸杞酒具有代表性的水果香气物质,该物质阈值极低,对果酒的香气品质影响极为明显[21]。在2种市售的枸杞酒中未检测到β-紫罗兰酮的存在,且菌株M-23-7-14酿造枸杞酒中该物质的含量是M-23的2倍。为了进一步探究枸杞酒中风味物质对枸杞酒香气的影响,选取4种枸杞酒中相对浓度较高及阈值较低的物质进行定量分析。
2.4.2 枸杞酒挥发性化合物的OAV分析
挥发性化合物的半定量分析可以测定枸杞酒中挥发性化合物的种类以及说明不同枸杞酒中挥发性化合物含量上的差异,但挥发性化合物在果酒中的实际含量和阈值对果酒的影响较大[3]。因此在挥发性化合物半定量的基础上进行定量分析,可以更好地反应枸杞中挥发性化合物的含量。选取半定量分析中相对浓度较高及阈值较低的21种挥发性化合物进行了定量测定,并对其进行OAV分析。结果如表4所示。
挥发性化合物对枸杞酒香气的贡献主要取决于该化合物在介质中的阈值,OAV>1的化合物说明其含量高于阈值,其于样品整体香气的呈现具有贡献作用,并且OAV值越大作用越显著[22]。由表4所示,在2种市售枸杞酒(健康快车和金色传杞)中OAV>1的特征香气成分均为7种,与2种市售枸杞酒相比,自酿枸杞酒增加了2种OAV>1的物质(肉桂酸乙酯和β-紫罗兰酮),对增加枸杞酒的花香具有一定的贡献。自酿枸杞酒中OAV最大的是乙酸异戊酯(10.5),其次是异戊醇(8.3)、丙醇(6.6)、β-紫罗兰酮(4.7)和肉桂酸乙酯(3.7),对枸杞酒的果香、花香及紫罗兰等香气轮廓的形成起决定性作用。健康快车枸杞酒中OAV最大的是丙醇(5.8),其次是乙酸乙酯(5.6)、乙酸异戊酯(4.4)、异戊醇(4.0)和丁酸乙酯(2.9)。对健康快车枸杞酒中清新口味、果香、花香以及威士忌等香气轮廓的形成起决定性作用。金色传杞枸杞酒中,OAV最大的是异戊醇(5.5)和丙醇(5.5),其次是己酸乙酯(4.8)、丁酸乙酯(3.6)和乙酸异戊酯(3.4),对金色传杞的清新醇味、威士忌香以及水果香轮廓的形成起着决定性作用。整体来说,自酿枸杞酒中主要风味化合物的种类和含量均高于2种市售枸杞酒。
表4 枸杞酒香气成分的OAV分析
Table 4 OAV analysis of aroma components in wolfberry wine
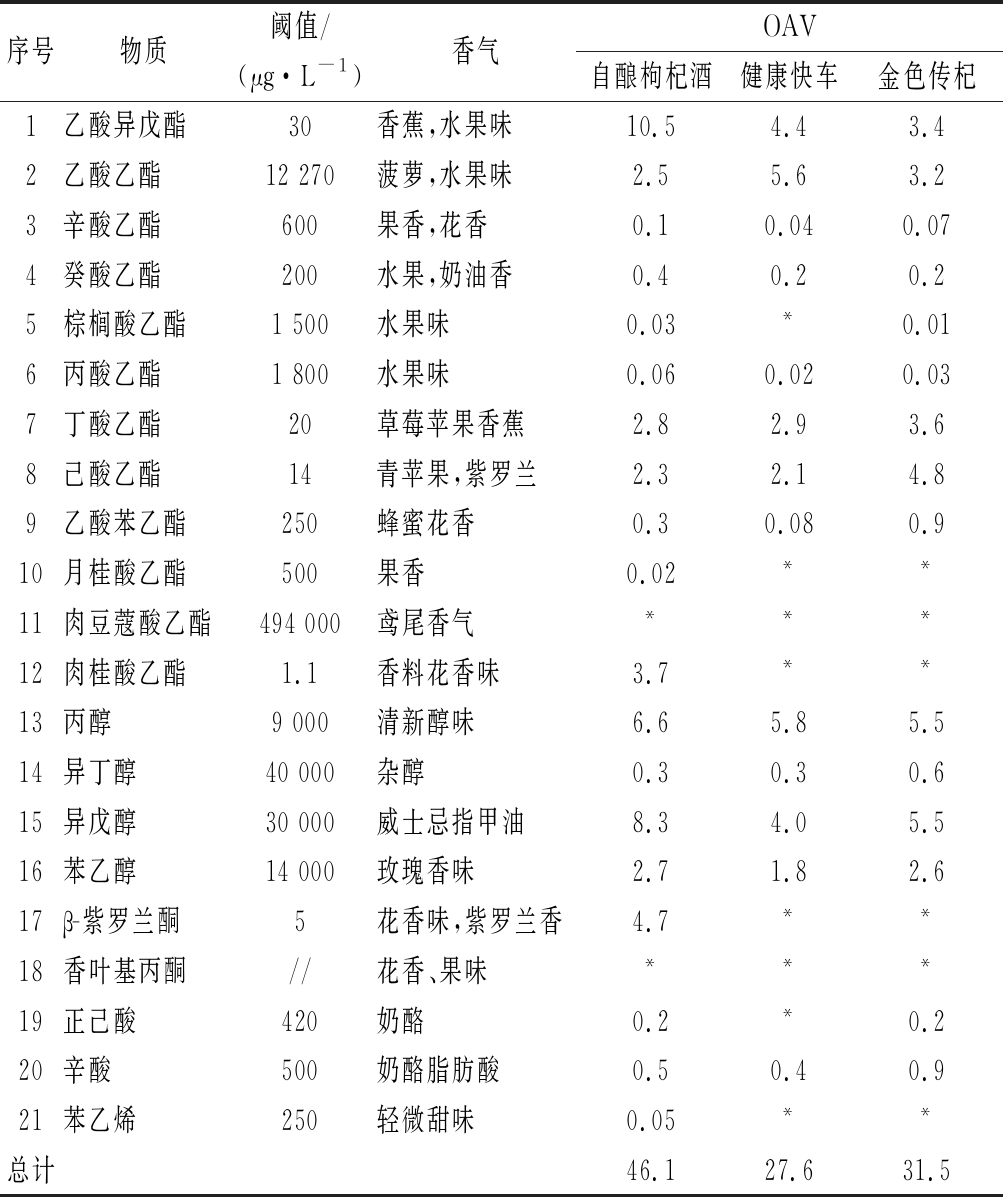
注://代表未查到数据;*代表数值太小,未显示
序号物质阈值/(μg·L-1)香气OAV自酿枸杞酒健康快车金色传杞1乙酸异戊酯30香蕉,水果味10.54.43.42乙酸乙酯12 270菠萝,水果味2.55.63.23辛酸乙酯600果香,花香0.10.040.074癸酸乙酯200水果,奶油香0.40.20.25棕榈酸乙酯1 500水果味0.03*0.016丙酸乙酯1 800水果味0.060.020.037丁酸乙酯20草莓苹果香蕉2.82.93.68己酸乙酯14青苹果,紫罗兰2.32.14.89乙酸苯乙酯250蜂蜜花香0.30.080.910月桂酸乙酯500果香0.02**11肉豆蔻酸乙酯494 000鸢尾香气***12肉桂酸乙酯1.1香料花香味3.7**13丙醇9 000清新醇味6.65.85.514异丁醇40 000杂醇0.30.30.615异戊醇30 000威士忌指甲油8.34.05.516苯乙醇14 000玫瑰香味2.71.82.617β-紫罗兰酮5花香味,紫罗兰香4.7**18香叶基丙酮//花香、果味***19正己酸420奶酪0.2*0.220辛酸500奶酪脂肪酸0.50.40.921苯乙烯250轻微甜味0.05**总计46.127.631.5
3 结论
本研究基于菌种发酵性能实验及感官品评分析,初步获得1株生长及发酵性能良好的菌株M-23,菌株M-23发酵的枸杞酒,酒体醇厚、酯香明显、酒体协调。以菌株M-23为出发菌株,通过ARTP和HTS进一步对枸杞酒优良酿酒酵母进行选育,得到1株优良菌株M-23-7-14。对不同菌株发酵的枸杞酒进行定性分析,结果表明M-23-7-14发酵枸杞酒的风味化合物的含量较出发菌株M-23提高了37.0%。本文首次对发酵枸杞酒中的风味物质进行定量研究,并结合OAV分析,明确了影响枸杞酒风味的9种挥发性化合物,分别是乙酸异戊酯、乙酸乙酯、丁酸乙酯、己酸乙酯、肉桂酸乙酯、丙醇、异戊醇、苯乙醇、β-紫罗兰酮。本研究提供了一种系统选育枸杞酒酿酒酵母的方法,基于该方法筛选得到的M-23-7-14菌株酿造的枸杞酒风味物质的种类和含量均高于2种市售枸杞酒,且较出发菌株M-23风味物质含量提高了37.0%,对提高枸杞酒的香气具有重要的参考价值。
[1] ![]() H, VR
H, VR NOV
NOV D, OMELKOV
D, OMELKOV J.Isolation, identification and characterization of regional indigenous Saccharomyces cerevisiae strains[J].Brazilian Journal of Microbiology, 2016, 47(1):181-190.
J.Isolation, identification and characterization of regional indigenous Saccharomyces cerevisiae strains[J].Brazilian Journal of Microbiology, 2016, 47(1):181-190.
[2] LORENZINI M, SIMONATO B, SLAGHENAUFI D, et al.Assessment of yeasts for apple juice fermentation and production of cider volatile compounds[J].LWT, 2019, 99:224-230.
[3] 李明瑕, 刘春凤, 王壬, 等.黄桃果酒酿酒酵母的筛选与发酵特性分析[J].食品与发酵工业, 2021, 47(14):113-122.
LI M X, LIU C F, WANG R, et al.Screening of Saccharomyces cerevisiae from yellow peach wine and their fermentation properties[J].Food and Fermentation Industries, 2021, 47(14):113-122.
[4] 王琦. 枸杞发酵酒类胡萝卜素降解对香气影响的研究[D].银川:宁夏大学, 2015.
WANG Q.The impact of carotenoids degradation in fermentation wolfberry wine on aroma compounds[D].Yinchuan:Ningxia University, 2015.
[5] TIAN T T, WU D H, NG C T, et al.A multiple-step strategy for screening Saccharomyces cerevisiae strains with improved acid tolerance and aroma profiles[J].Applied Microbiology and Biotechnology, 2020, 104(7):3 097-3 107.
[6] 田甜甜. 青梅酒酿酒酵母的选育及耐酸机制解析[D].无锡:江南大学, 2020.
TIAN T T.Screening of Saccharomyces cerevisiae for greengage wine and its mechanism of acid tolerance[D].Wuxi:Jiangnan University, 2020.
[7] 张惠玲. 细胞融合构建枸杞酒专用酵母的研究[J].中国酿造, 2010(11):141-144.
ZHANG H L.Construction of Chinese wolfberry yeast with cell fusion[J].China Brewing, 2010,29(11):141-144.
[8] JIANG G Z, YANG Z M, WANG Y, et al.Enhanced astaxanthin production in yeast via combined mutagenesis and evolution[J].Biochemical Engineering Journal, 2020, 156:107519.
[9] 董博宇, 陈叶福, 岳瑞雪, 等.TTC在发酵木糖高产乙醇的休哈塔假丝酵母选育中的应用[J].酿酒科技, 2008(10):40-43.
DONG B Y, CHEN Y F, YUE R X, et al.Application of TTC in breeding of Candida shehatae overproducing ethanol from xylose[J].Liquor-making Science & Technology, 2008(10):40-43.
[10] 李凯, 王金晶, 李永仙, 等.红心火龙果果酒特征香气分析[J].食品与发酵工业, 2019, 45(13):217-223.
LI K, WANG J J, LI Y X, et al.Characteristic aroma components of red pitaya wine[J].Food and Fermentation Industries, 2019, 45(13):217-223.
[11] 赵鹏涛. 西拉葡萄酒的香气活性物质以及影响瓶装葡萄酒香气因素的研究[D].杨凌:西北农林科技大学, 2017.
ZHAO P T.Characterization of Syrah wine aroma and study of the influence factors of the bottle wine flavor[D].Yangling:Northwest Agriculture and Forestry University, 2017.
[12] OUYANG X Y, YUAN G S, REN J, et al.Aromatic compounds and organoleptic features of fermented wolfberry wine:Effects of maceration time[J].International Journal of Food Properties, 2017, 20(10):2 234-2 248.
[13] 剧柠, 胡婕, 赵梅梅, 等.葡萄汁有孢汉逊酵母与酿酒酵母混种对发酵枸杞果酒的影响[J].食品工业科技, 2019, 40(6):106-113.
JU N, HU J, ZHAO M M, et al.Effects of mixed cultures with Hanseniaspora uvarum and Saccharomyces cerevisiae on fermented wolfberry wine[J].Science and Technology of Food Industry, 2019, 40(6):106-113.
[14] 李锐, 冯奎, 吴婧,等.不同来源酿酒酵母对柑橘果酒香气成分的影响[J].食品科学, 2010, 31(17):206-213.
LI R, FENG K, WU J, et al.Effects of Saccharomyces cerevisiae strains from different sources on the aromatic composition of orange wine[J].Food Science, 2010, 31(17):206-213.
[15] 徐俊, 雍晓雨, 费文斌, 等.基于TTC染色法的高活力酵母细胞定量筛选[J].食品与发酵工业, 2014, 40(7):1-5.
XU J, YONG X Y, FEI W B, et al.A rapid and dynamic quantitative screening method based on TTC staining of high activity yeast cells[J].Food and Fermentation Industries, 2014, 40(7):1-5.
[16] AN J, GAO F L, MA Q Y, et al.Screening for enhanced astaxanthin accumulation among Spirulina platensis mutants generated by atmospheric and room temperature plasmas[J].Algal Research, 2017, 25:464-472.
[17] CAO S, ZHOU X, JIN W B, et al.Improving of lipid productivity of the oleaginous microalgae Chlorella pyrenoidosa via atmospheric and room temperature plasma (ARTP)[J].Bioresource Technology, 2017, 244:1 400-1 406.
[18] LIU C F, LI Q, NIU C T, et al.The use of atmospheric and room temperature plasma mutagenesis to create a brewing yeast with reduced acetaldehyde production[J].Journal of the Institute of Brewing, 2018, 124(3):236-243.
[19] SIEBERT T E, BARTER S R, DE BARROS LOPES M A, et al.Investigation of ‘stone fruit’ aroma in Chardonnay, Viognier and Botrytis Semillon wines[J].Food Chemistry, 2018, 256:286-296.
[20] ENGLEZOS V, RANTSIOU K, CRAVERO F, et al.Volatile profile of white wines fermented with sequential inoculation of Starmerella bacillaris and Saccharomyces cerevisiae[J].Food Chemistry, 2018, 257:350-360.
[21] WACHÉ Y, BOSSER-DERATULD A, LHUGUENOT J C, et al.Effect of Cis/trans isomerism of β-carotene on the ratios of volatile compounds produced during oxidative degradation[J].Journal of Agricultural & Food Chemistry, 2003, 51(7):1 984-1 987.
[22] 周文杰, 张芳, 王鹏, 等.基于GC-MS/GC-O结合化学计量学方法研究库尔勒香梨酒的特征香气成分[J].食品科学, 2018, 39(10):222-227.
ZHOU W J, ZHANG F, WANG P, et al.GC-MS/GC-O combined with chemometrics for the screening and identification of aroma characteristics of Korla pear wine[J].Food Science, 2018, 39(10):222-227.