六妹羊肚菌(Morchella sextelata)[1]是一类重要的药食两用真菌,因其独特的外观、鲜美的口感和较高的经济价值引起了世界研究者的广泛关注。TIETEL等[2]报道羊肚菌中含有丰富的氨基酸、蛋白质、矿质元素和维生素等物质。羊肚菌还具有各种药用功效,如抗菌、抗氧化[3]、抗炎及提高免疫能力、抗过敏和降低血糖等。同时,研究者也一直对羊肚菌的人工栽培进行探索,目前羊肚菌的人工栽培技术已成功实现规模化生产。六妹羊肚菌是国内现主栽品种之一[4-5],前期研究中,本实验室发现六妹羊肚菌菌丝具有一定的耐盐性,所以本文对盐胁迫下羊肚菌菌丝体多糖及其抗氧化活性进行测定,探究多糖含量及体外抗氧化活性变化情况。
羊肚菌多糖是一类重要的真菌多糖,功效颇多,在抗肿瘤等方面具有天然的优势[6]。段巍鹤等[7]对小鼠进行实验,验证了菌丝胞内外多糖应急摄入后具有明显的抗疲劳的作用。姜浩等[8]总结了食用真菌多糖的研究进展。目前多糖的主要提取方法有酸碱提取法[9]、酶提法[10]、水提醇沉法[11]和超声波辅助提取法[12],每种方法各有优缺点。羊肚菌多糖又是一类天然抗氧化剂,有关其抗氧化活性测定的报道较多,主要包括羟自由基清除能力[13],DPPH自由基清除能力[14]以及还原力[15]等方面。但是很少有关于盐胁迫下羊肚菌理化性质的报道,盐胁迫下,羊肚菌体内的多糖结构及物质活性可能会发生变化,XIONG等[16]就利用γ射线辐照六妹羊肚菌子实体,研究了辐射后羊肚菌子实体多糖的结构和抗氧化活性,发现多糖表面出现断裂和孔隙,且辐射后抗氧化活性增加。因此本文对盐胁迫下六妹羊肚菌多糖及抗氧化活性的研究具有十分重要的现实意义。
1 材料与方法
1.1 菌株
六妹羊肚菌菌种为云南、四川等地主栽品种组织分离扩繁后所得,编号M3。
1.2 主要试剂
固体PDA培养基(g/L):土豆200、葡萄糖20、琼脂16。
液体发酵培养基(g/L):土豆200、葡萄糖20。
无水葡萄糖、氯化钠、95%乙醇、无水乙醇、氢氧化钾、苯酚、浓硫酸、硫酸铁、水杨酸、过氧化氢、磷酸氢二钠、磷酸二氢钠、铁氰化钾、三氯乙酸、氯化铁,国药集团化学试剂有限公司;维生素C,上海爱纯生物科技有限公司;香柏油,中国上海懿洋仪器有限公司;DPPH,上海麦克林生化科技有限公司。
1.3 仪器与设备
SQP型电子天平,赛多利斯科学仪器有限公司;OLYMPUS-BX61显微镜,日本奥林巴斯公司;KQ-500DE型超声提取仪,昆山市超声仪器有限公司;T6新悦可见分光光度计,北京普析通用仪器有限责任公司;Neo15R高速冷冻离心机,上海力申科学仪器有限公司;HHS-21-6型恒温水浴锅,上海博迅实业有限公司医疗设备厂;DGX-9243 B-1高温鼓风干燥箱,上海福玛实验设备有限公司。
1.4 实验方法
1.4.1 盐浓度的确定
将羊肚菌接种到添加NaCl的PDA培养基中,设定盐浓度为0、0.05、0.1、0.15、0.2、0.25、0.3、0.35、0.4 mol/L,共9个梯度。每隔12 h测量1次菌落直径,72 h后停止并拍照保存,选择合适的浓度。
1.4.2 菌种的培养与显微观察
将羊肚菌M3号接种到含玻璃纸的普通固体PDA培养基上,培养48 h后将玻璃纸转移到盐浓度0.3 mol/L的培养基胁迫处理,胁迫时间分别为0、3、6、12、24、48 h。培养完成后每个梯度挑取4~5处菌丝尖端,在显微镜下观察,每组梯度测量100根以上菌丝直径,观察直径变化。羊肚菌液体菌种设置对照组和实验组,在正常液体培养基中先培养72 h,然后对照组继续培养,实验组加盐进行盐胁迫处理,处理梯度为0、3、6、12、24、48 h。培养完成后发酵液4 ℃保存待测,菌丝球过滤并用蒸馏水冲洗2~3遍,烘箱50~60 ℃干燥,称量菌丝体干重后粉碎成粉末,密封备用。
1.4.3 羊肚菌多糖的提取与测定
提取对照组和实验组各时间梯度胞内外多糖。胞外多糖的提取采用水提醇沉法,5 mL发酵液与20 mL 95%乙醇混合后,4 ℃醇沉24 h,醇沉后4 000 r/min离心20 min,去上清液留沉淀,沉淀中加入30 mL蒸馏水后100 ℃溶解30 min,冷却后2 000 r/min离心20 min,上清液即为胞外多糖。胞内多糖参考黄玲玲[17]的提取方法,料水比为1∶40(g∶mL),超声波功率400 W,温度60 ℃浸提40 min,然后60 ℃热水浸提5 h,得到浸提液。浸提液按胞外多糖提取方法处理,最后得到胞内粗多糖溶液。取胞内外多糖溶液2 mL,加入1 mL 5%苯酚溶液和5 mL浓硫酸,摇匀冷却后在490 nm下测定吸光值,以蒸馏水作为对照,按标准曲线计算多糖含量,如公式(1)、公式(2)所示:
参考杨怀雷等[18]的方法绘制葡萄糖标准曲线,回归方程为y=11.218x-0.017 7,R2=0.999 3。
胞外多糖含量![]()
(1)
胞内多糖含量![]()
(2)
式中:c为多糖的质量浓度,mg/mL;V为提取液的体积,mL;n为稀释倍数;m为样品干重,g。
1.4.4 抗氧化性的测定
多糖溶液以1.4.3中3、6、12、24、48 h对照组和实验组中胞内外多糖提取液进行抗氧化实验。
DPPH自由基清除能力以维生素C为阳性对照,测定方法参照LEE等[19]的方法稍作调整。在试管中加入2 mL样品液和2 mL DPPH溶液,以无水乙醇为本底将体系补至6 mL,混匀后迅速遮光反应30 min,然后在517 nm下测定吸光值,以蒸馏水做对照溶液。
羟自由基清除能力测定方法参考LI等[20]的方法。在试管中加入1 mL FeSO4溶液,1 mL水杨酸-乙醇溶液和2 mL样品液,最后加入1 mL H2O2溶液,迅速混匀后静置30 min,然后在510 nm下测定吸光度值。本底为蒸馏水,以蒸馏水做对照溶液,维生素C为阳性对照,清除率计算如公式(3)所示:
清除率![]()
(3)
式中:A0为空白对照液的吸光值,Aa为样品液的吸光值,Ab为样品本底吸光值。
1.4.5 还原力的测定
采用铁氰化钾还原的方法[21]并简化。在试管中依次加入1 mL样品液,2 mL 0.2 mol/L的磷酸缓冲液和2 mL 1%的铁氰化钾溶液,混匀后50 ℃水浴30 min,冷却后加入2 mL 10%的三氯乙酸溶液。有沉淀产生需5 000 r/min离心10 min,取上清液,无沉淀则直接吸取2 mL反应液到试管中,加入2 mL蒸馏水和0.4 mL 0.1%的FeCl3溶液,混匀后遮光反应30 min,在700 nm下测定吸光值。吸光值越高,证明还原能力越强。以维生素C为阳性对照。
1.4.6 数据统计与分析
所有数据均以平均数±标准差(x±s)表示,重复3次,用WPS 2019软件统计分析,数据统计处理采用SPSS 19.0软件,利用字母标记法进行显著性分析。
2 结果与分析
2.1 不同盐浓度菌丝生长情况
从不同盐浓度梯度下羊肚菌菌丝生长状况看,随着盐浓度的增加,羊肚菌菌丝的生长速度被抑制,盐浓度越大菌丝生长越缓慢(图1,图2)。0.05 mol/L菌丝长速和长势与正常培养菌丝相比无明显变化,菌丝洁白浓密且粗壮。0.1~0.3 mol/L 5组浓度菌丝长势较强,但生长速度与浓度呈反比。0.35、0.4 mol/L浓度下菌丝稀疏,长势较弱。根据72 h时菌落直径绘制表1,据表1中差异显著性来看,除0.25 mol/L和0.3 mol/L两组梯度之间无显著差异,其他每组盐浓度梯度之间都呈极显著差异(P<0.01),且这两组盐浓度菌落直径约为正常生长的1/2。综合考虑,最终选择0.3 mol/L作为接下来的实验盐浓度。
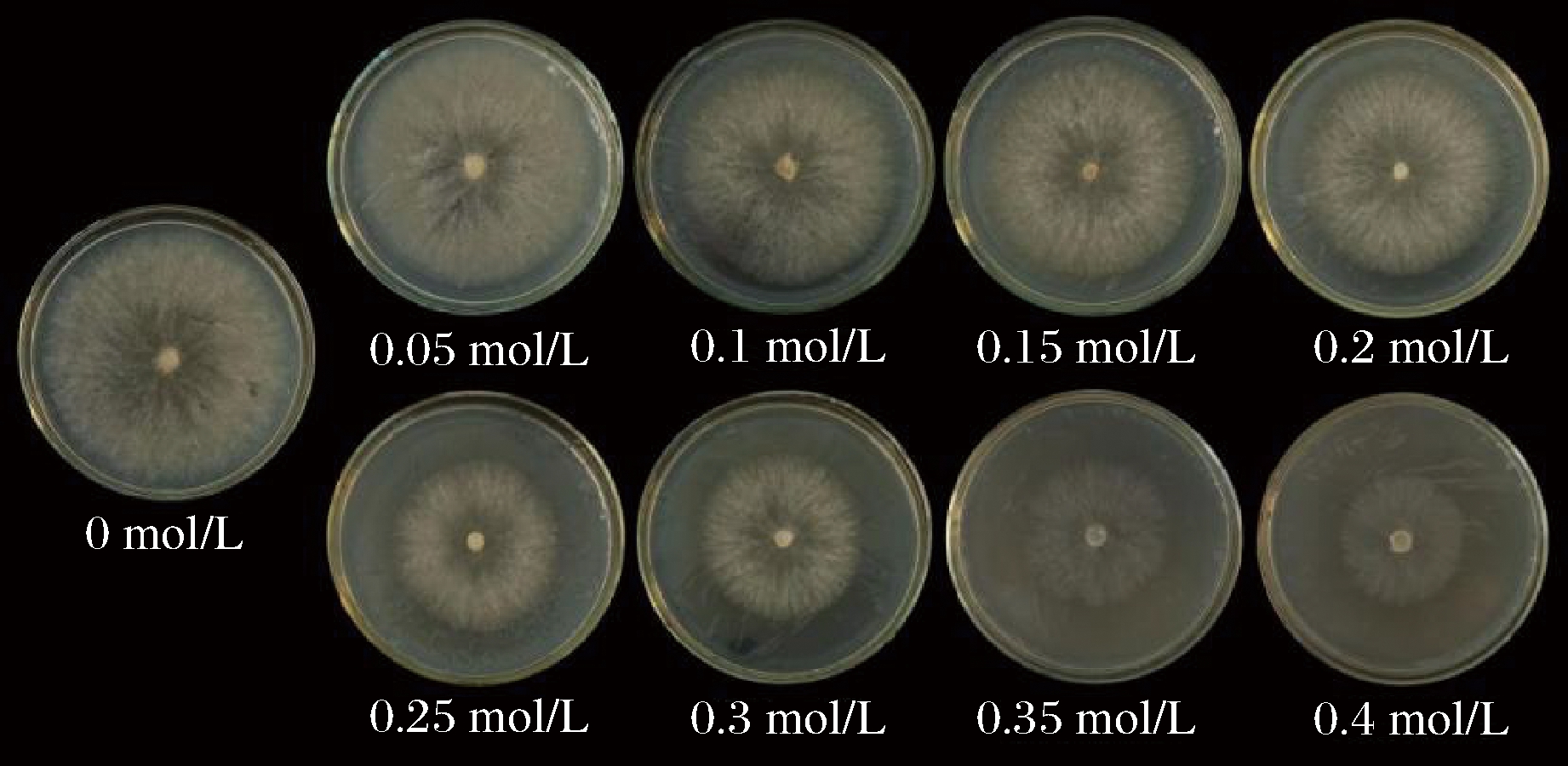
图1 不同盐浓度下的菌丝生长势
Fig.1 Mycelial growth potential under different salt concentrations
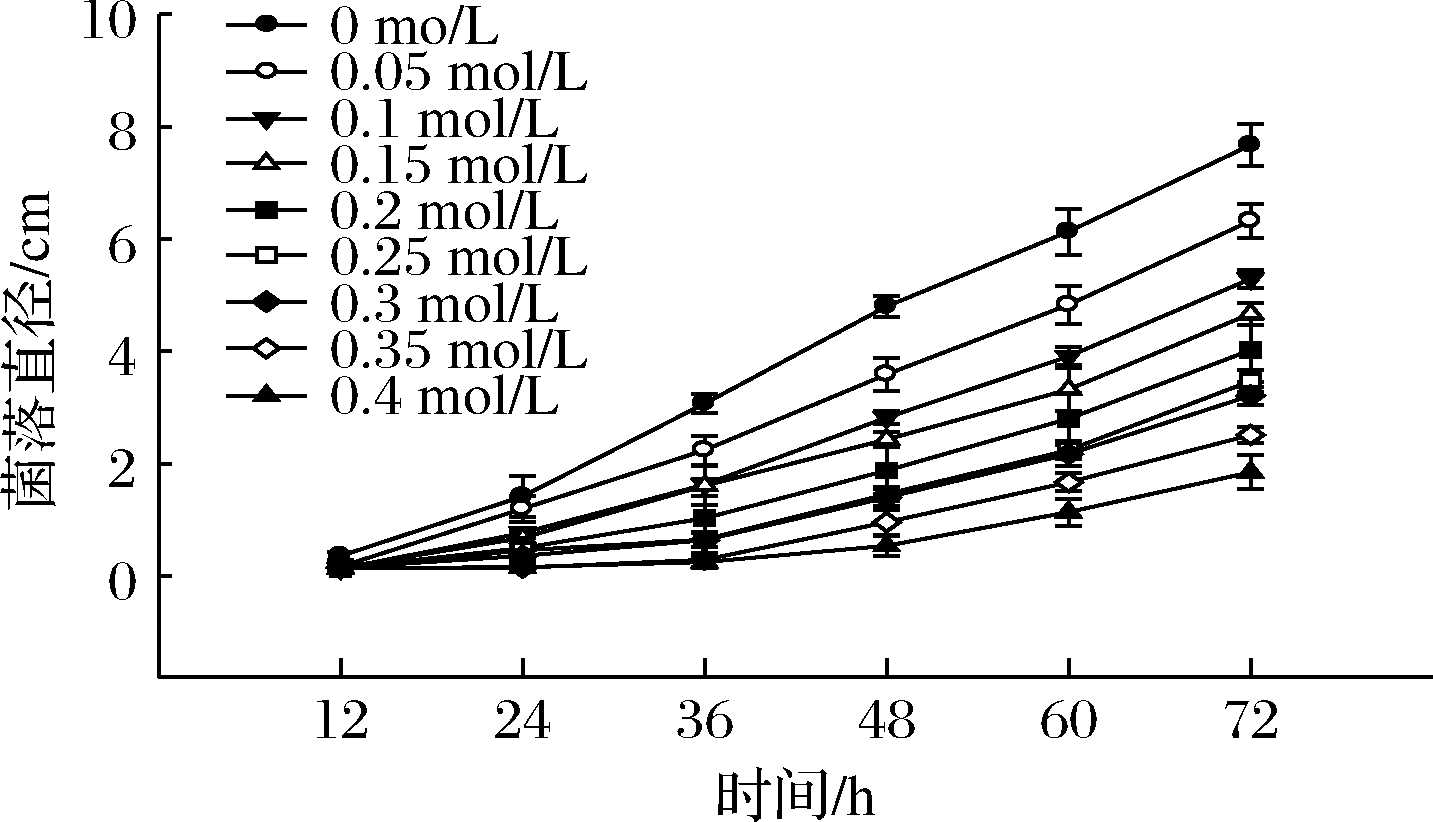
图2 不同盐浓度菌丝生长速度
Fig.2 Mycelial growth rate at different salt concentrations
表1 第72 h菌落直径差异显著性
Table 1 Colony diameter difference significance table at 72 h
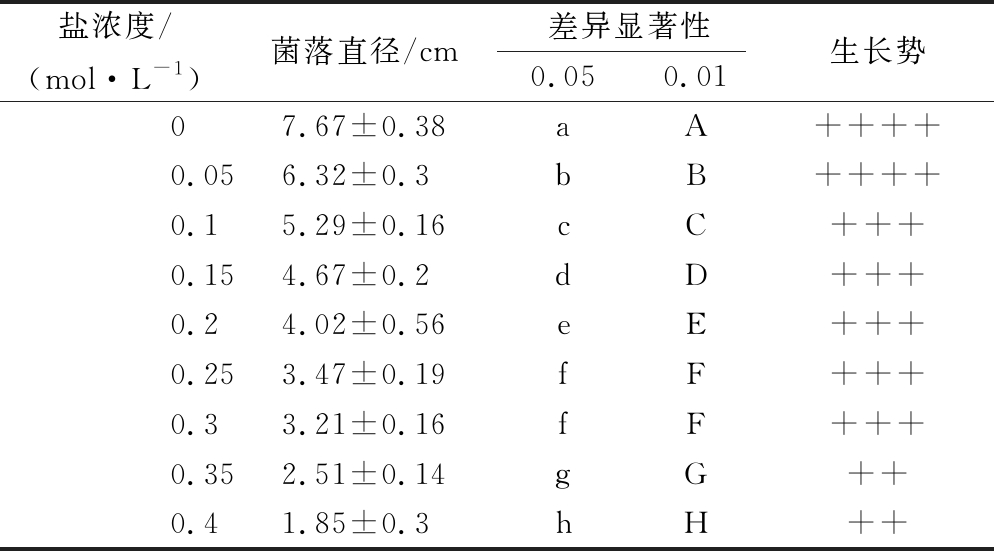
注:数据为5次重复平均值;“++++”表示菌丝生长势强,“+++”表示菌丝长势较强,“++”表示菌丝生长势一般。不同小写字母表示差异显著(P<0.05),不同大写字母表示极显著差异(P<0.01)
盐浓度/菌落直径/cm差异显著性生长势(mol·L-1)0.050.0107.67±0.38aA++++0.056.32±0.3bB++++0.15.29±0.16cC+++0.154.67±0.2dD+++0.24.02±0.56eE+++0.253.47±0.19fF+++0.33.21±0.16fF+++0.352.51±0.14gG++0.41.85±0.3hH++
2.2 不同培养时间菌丝显微形态
由图3可知,羊肚菌菌丝随盐胁迫时间的增加,菌丝形态无明显变化,排列疏松无规律,未产生菌丝扭结等现象,直径变化十分细微。根据菌丝直径数据可得出随着胁迫时间的增加,菌丝直径慢慢减小(图4),0 h和3 h菌丝变化无显著差异,到48 h菌丝直径与其他组别相比则呈显著差异性(P<0.05)。显然胁迫时间长短对菌丝直径具有一定影响,可能是菌丝外部为高渗环境,菌丝细胞失水缩小,所以胁迫时间越长,菌丝直径越小。

图3 0.3 mol/L盐浓度胁迫不同时间菌丝形态图(×1 000)
Fig.3 Morphology of mycelium under 0.3 mol/L salt stress at different time(×1 000)
注:0~48 h分别表示培养不同时间后菌丝形态
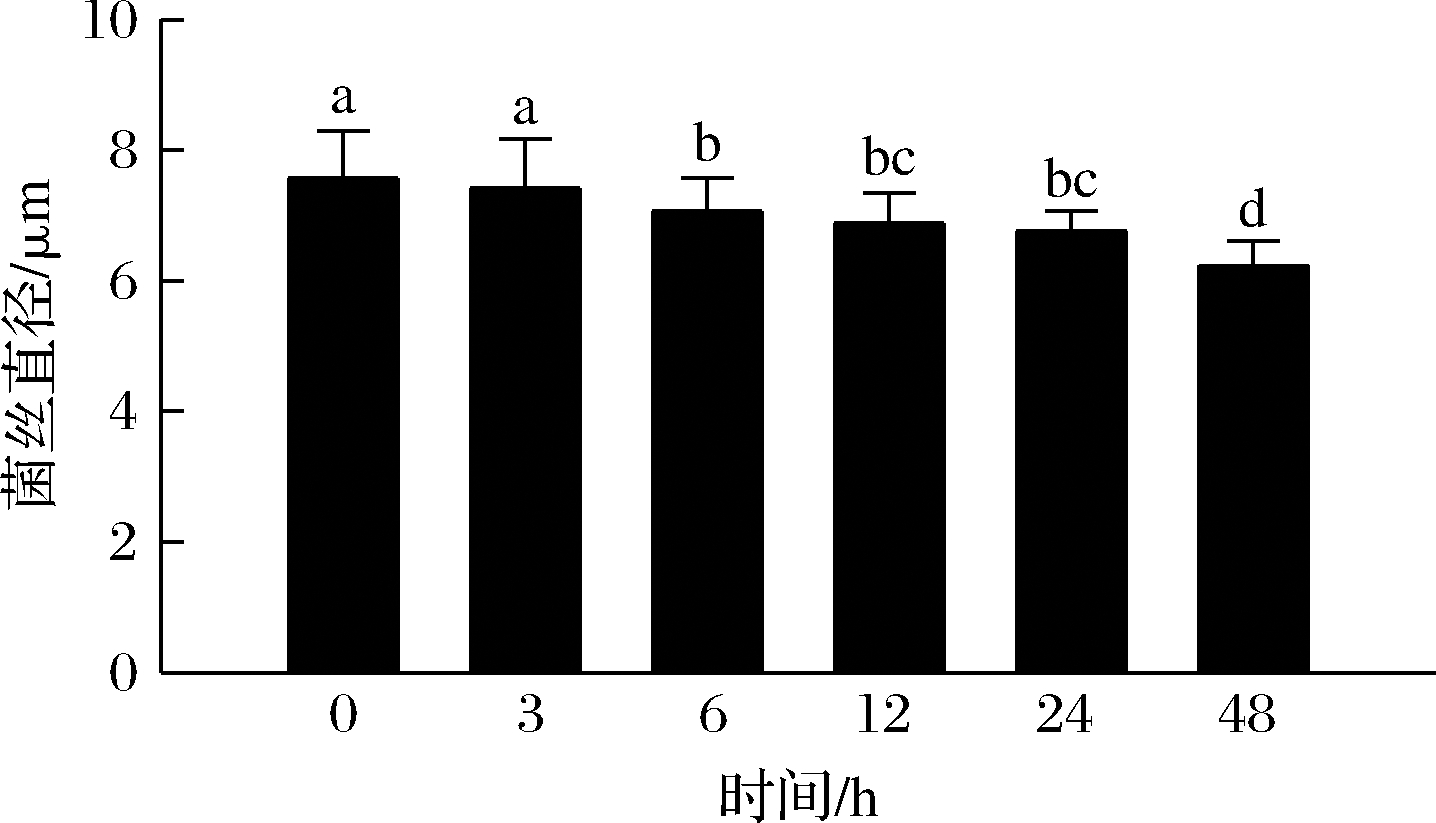
图4 0.3 mol/L盐浓度胁迫不同时间后放大1 000倍菌丝直径图
Fig.4 Magnification of 1 000-fold diameter of mycelium under 0.3 mol/L salt stress for different time
注:不同小写字母表示差异显著
2.3 胞内外多糖含量测定及菌丝体干重对比
由图5可知,盐胁迫后胞内多糖含量普遍低于正常环境中胞内多糖含量。对照组胞内多糖含量变化显著,可能是由于羊肚菌液体菌种生长周期为7 d左右,生长3 d后开始产生色素,对多糖的形成产生影响。到培养中后期培养基的营养成分减少,但菌丝质量一直增加,所以使菌丝胞内多糖减少。在3 h时,实验组胞内多糖含量高于对照组,为12.74 mg/g。由于羊肚菌菌丝刚处于逆境环境下,菌丝释放多糖等营养物质来抵御逆境,含量增加,随后一部分作为有机渗透调节物质降低渗透势而缓解盐胁迫,另一部分作为生长所需营养物质,所以多糖含量显著下降。对照组和实验组胞外多糖先增加后减少,12 h时含量最高,分别为0.29 mg/mL和0.14 mg/mL,实验组多糖总体含量远低于对照组多糖含量(图6)。
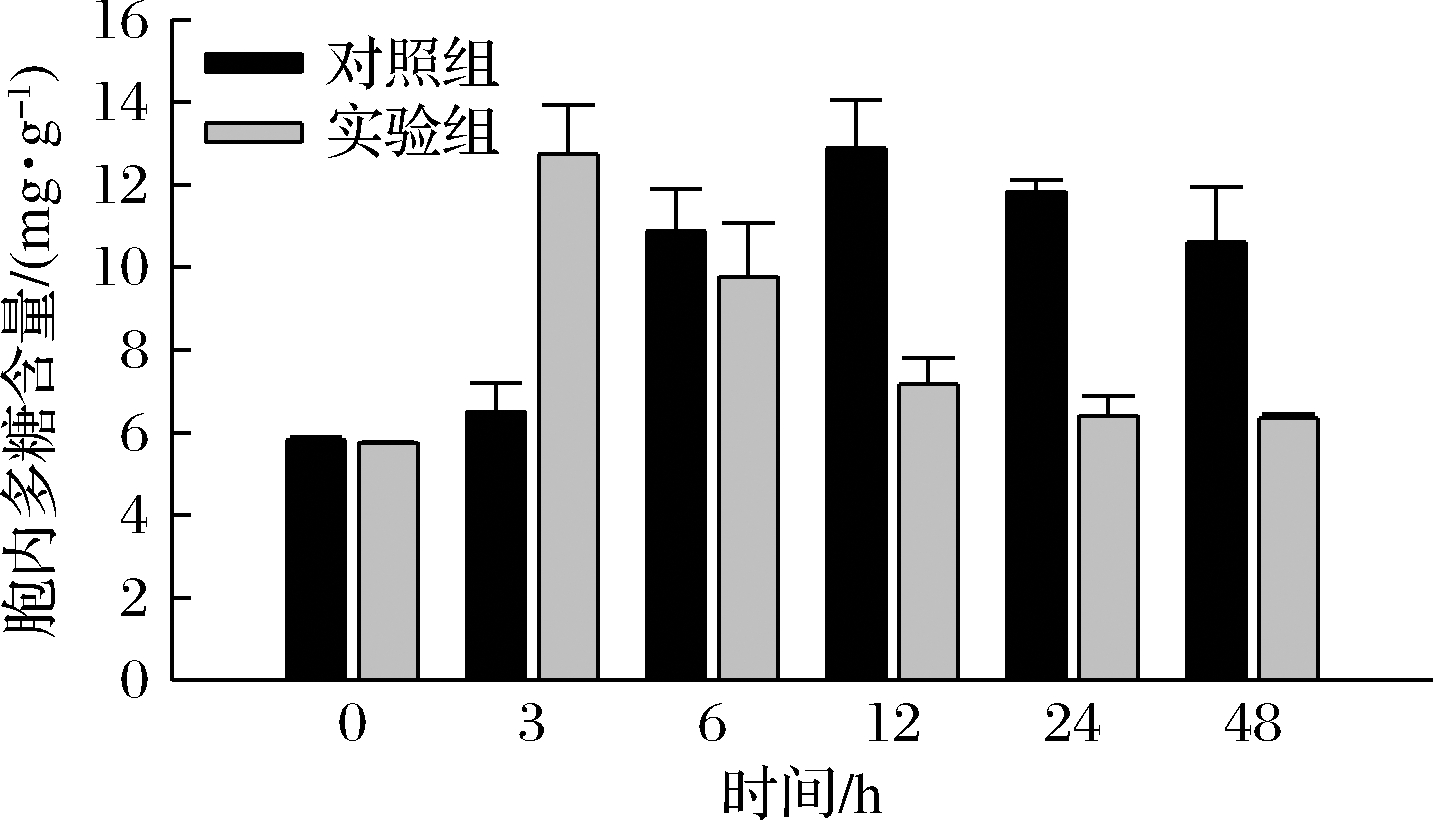
图5 胞内多糖含量
Fig.5 Intracellular polysaccharide content
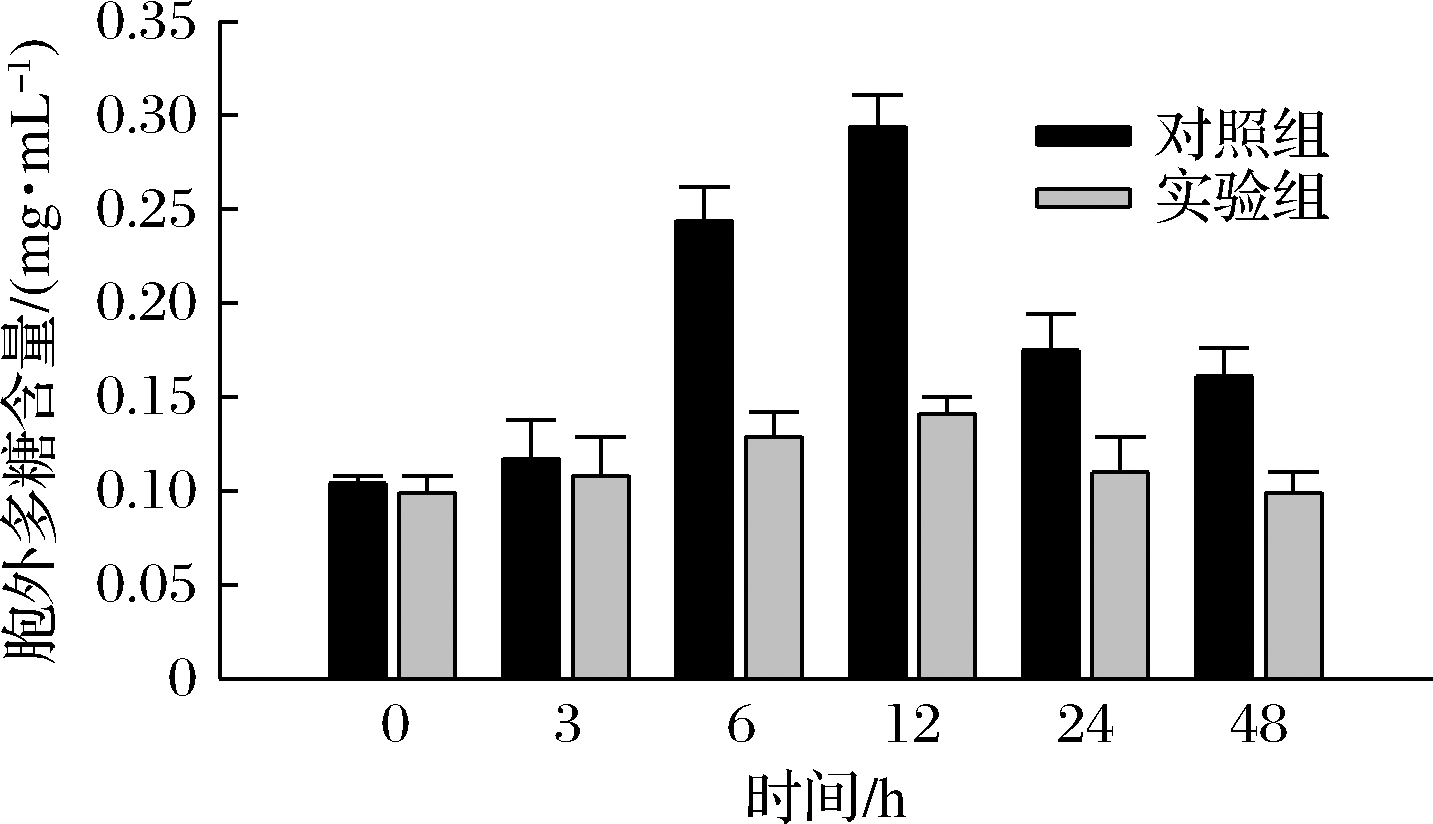
图6 胞外多糖含量
Fig.6 Extracellular polysaccharide content
由图7可知,随胁迫时间的增加,对照组和实验组菌丝干重都呈上升趋势。但在胁迫3 h和6 h时,羊肚菌菌丝刚受到胁迫,菌丝干重增加,略高于对照组菌丝干重,多糖含量增加可能也与此有关。12 h之后,对照组菌丝干重的增长趋势则高于实验组干重增长趋势,盐胁迫对菌丝开始出现抑制作用。
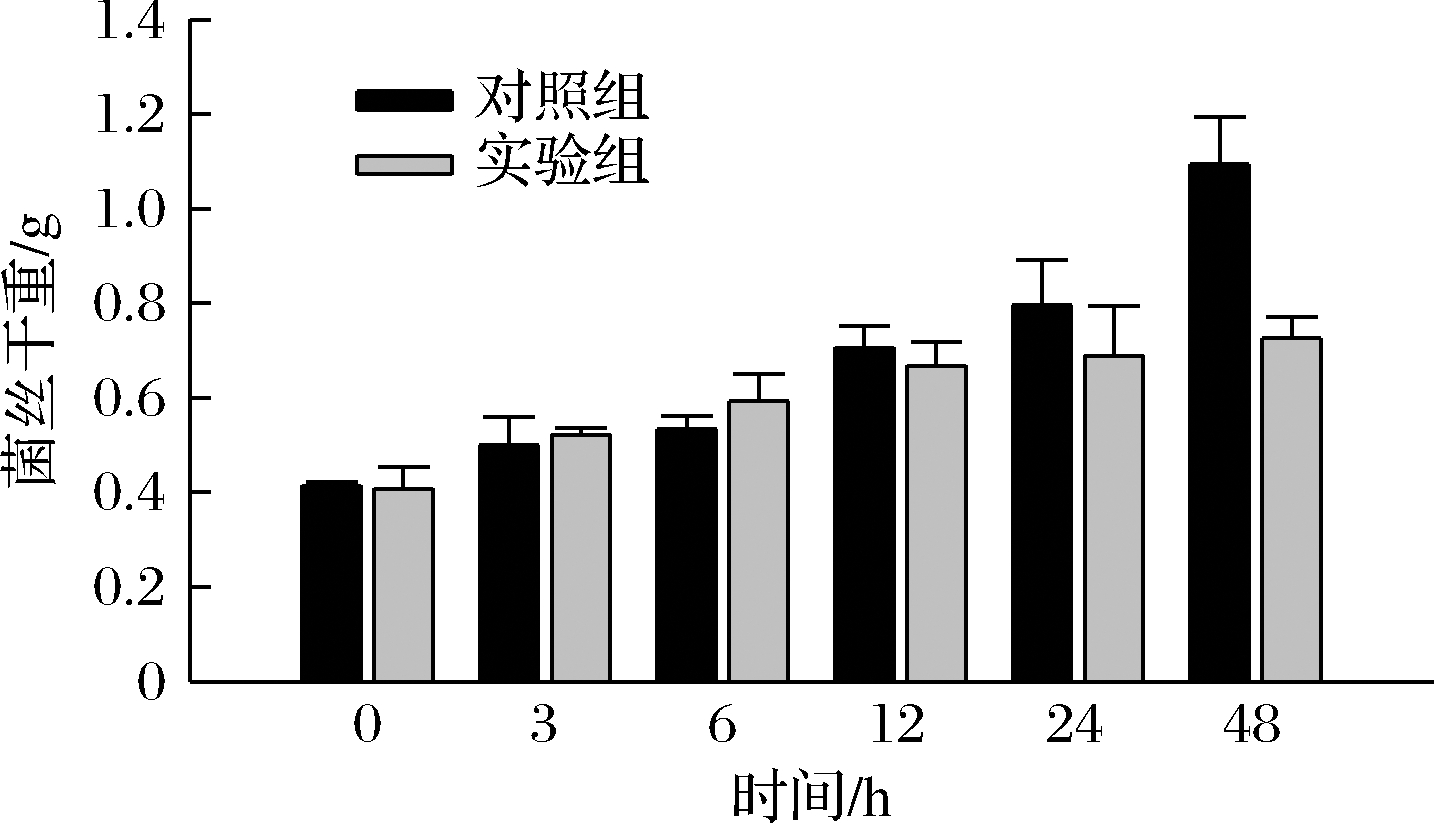
图7 菌丝干重
Fig.7 Dry weight of mycelium
2.4 抗氧化活性的研究
所有结果中维生素C质量浓度均为0.3 mg/mL,维生素C对照组和实验组为两次重复试验,主要作为对照进行参考。
2.4.1 胞内外多糖对DPPH自由基的清除率
由图8可知,维生素C具有很高的DPPH自由基清除效率,与之相比羊肚菌胞内多糖清除效率较低,但也具有一定的清除能力。随着培养时间的增加,对照组和实验组清除率变化趋势明显,对照组清除率分别为10.3%、15.6%、12%、11.5%和17.1%,实验组清除率分别为35.8%、34.3%、33.6%、31.2%和34.3%。图9为羊肚菌胞外多糖对DPPH自由基的清除率对比图,对照组清除率分别为5.8%、3.6%、7.1%、4.2%和9.2%,实验组为24.9%、24.2%、23.6%、23.5%和24.8%。结果显示,实验组胞内外多糖对DPPH自由基的清除率明显高于对照组,胞内多糖清除能力最高提升了3.47倍,胞外多糖清除能力最高提升了6.72倍。由此,可知盐胁迫增加了多糖对DPPH自由基的清除能力。而据2.3中胞内外多糖含量变化来看,多糖对于清除率总体趋势无明显影响。
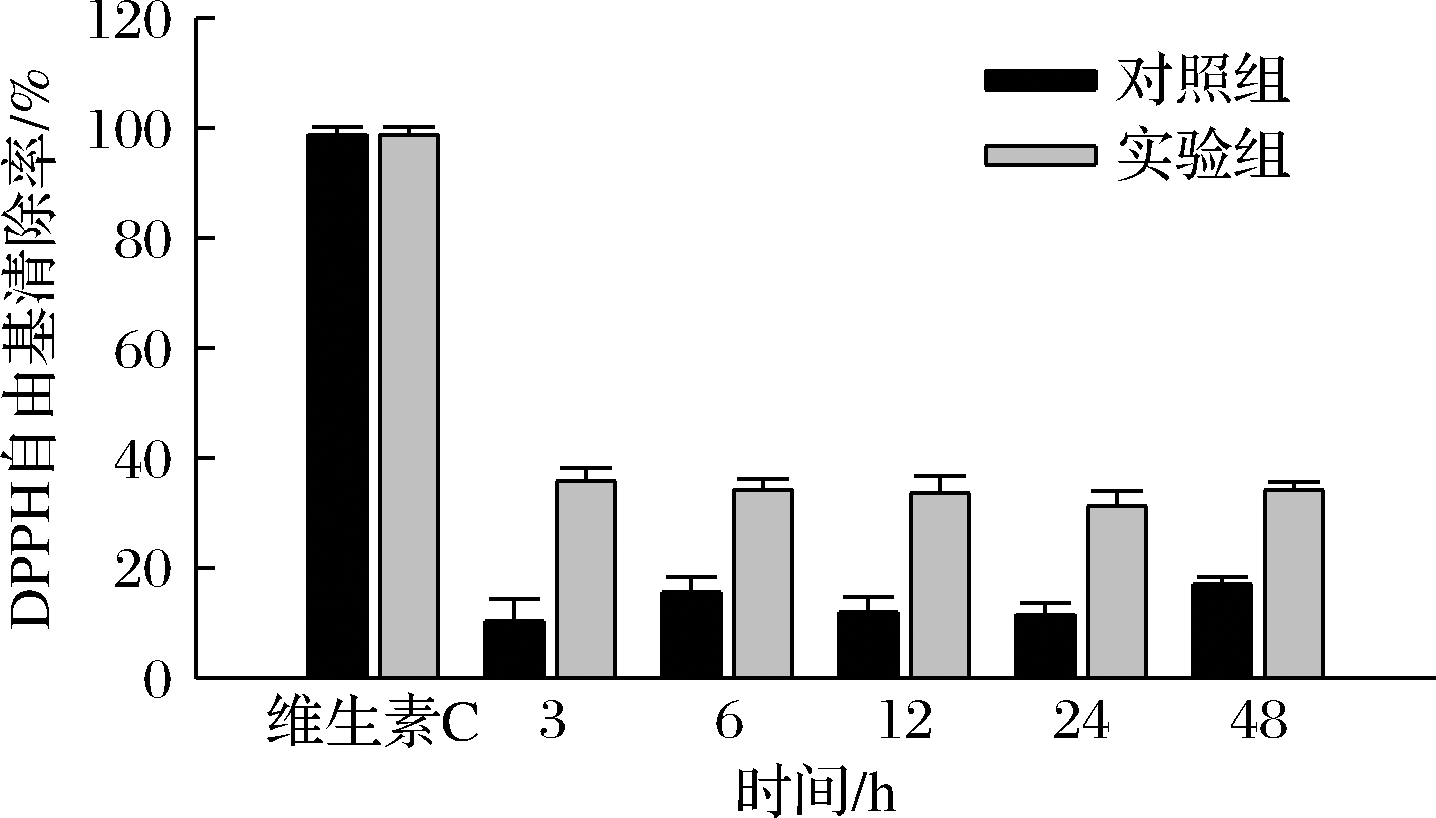
图8 胞内多糖的DPPH自由基清除率
Fig.8 DPPH free radical scavenging rate of intracellular polysaccharide
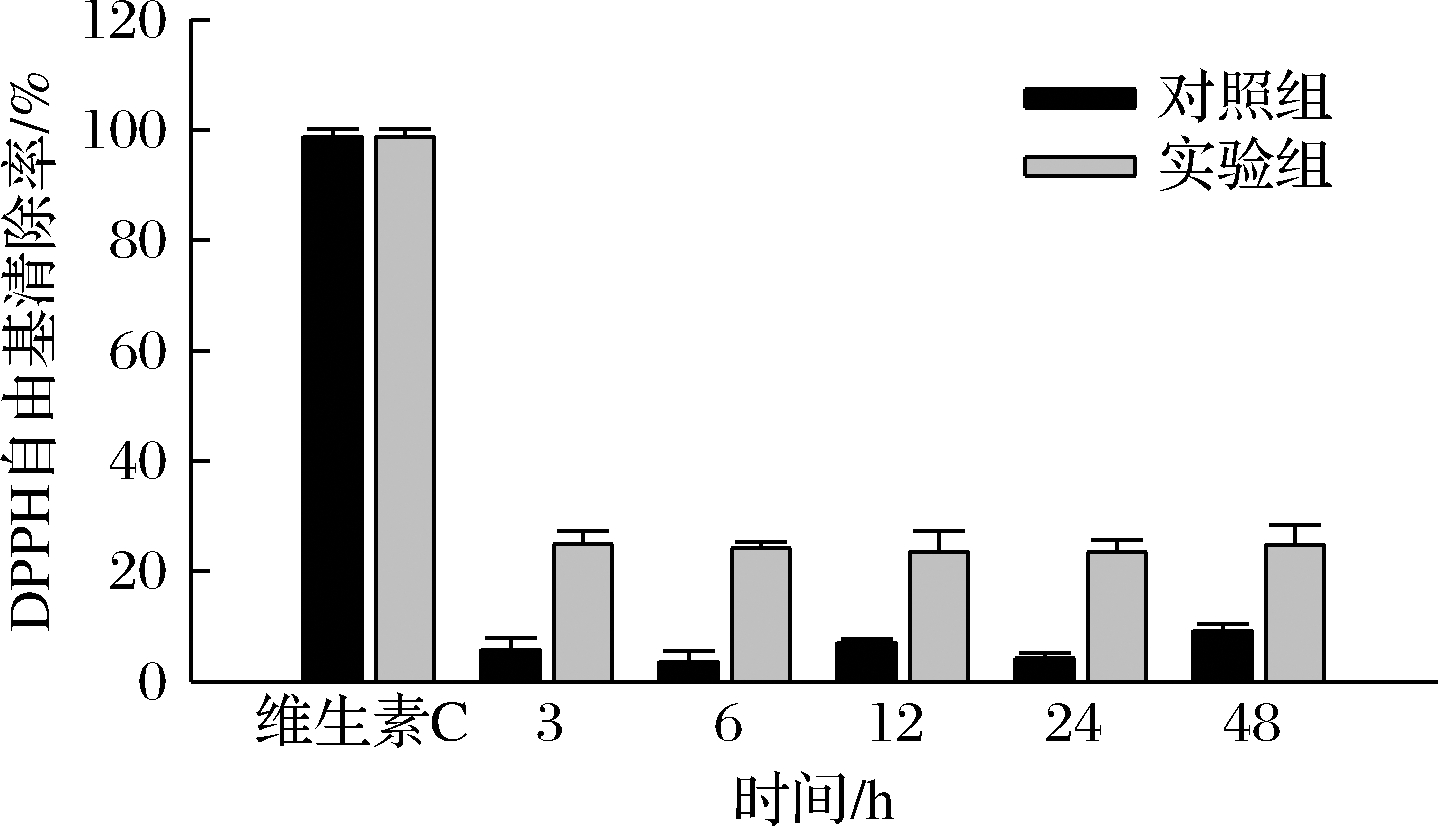
图9 胞外多糖的DPPH自由基清除率
Fig.9 DPPH free radical scavenging rate of extracellular polysaccharide
2.4.2 胞内外多糖对羟自由基的清除率
由图10可知,胞内多糖对羟自由基的清除率分别为,对照组3.6%、1.9%、3.1%、1%和0.4%,实验组16.9%、15.1%、27.5%、11.9%和11.1%。图11为胞外多糖羟自由基清除率对比图,对照组清除率分别为2.2%、2.8%、4.6%、3%和2.8%,实验组清除率分别为5.5%、7.7%、8.5%、7.9%和7.5%。结果显示,实验组胞内多糖清除羟自由基的能力远高于对照组,在12 h时清除率最高,为27.5%。胞外多糖中实验组清除羟自由基能力也高于对照组,清除率最高提升了2.75倍。说明盐胁迫也促进了多糖对羟自由基的清除能力。由2.3中胞内外多糖含量变化来看,胞内外多糖的清除率大致也呈先上升后下降的趋势,
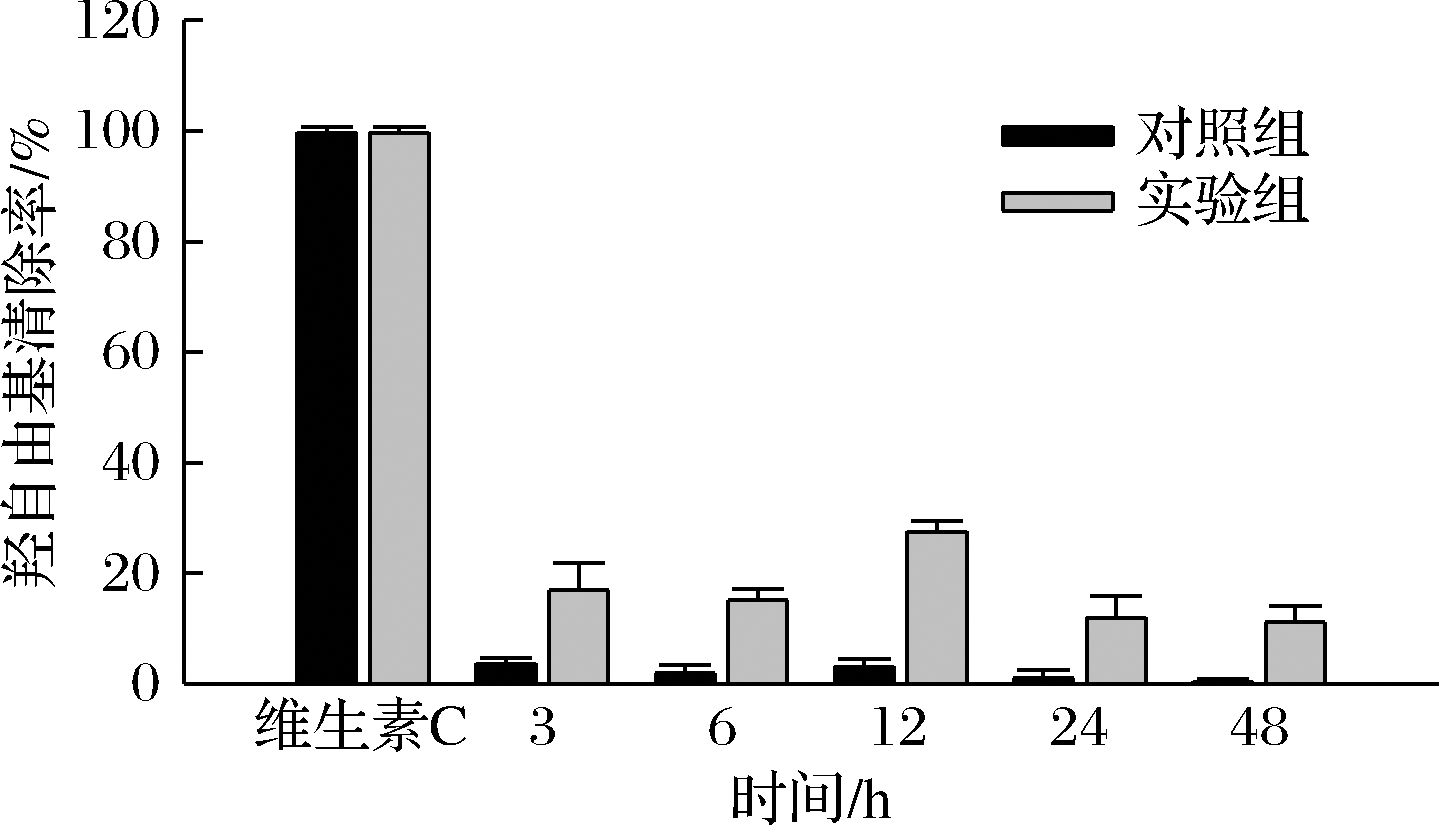
图10 胞内多糖的羟自由基清除率
Fig.10 Hydroxyl free radical scavenging rate of intracellular polysaccharides
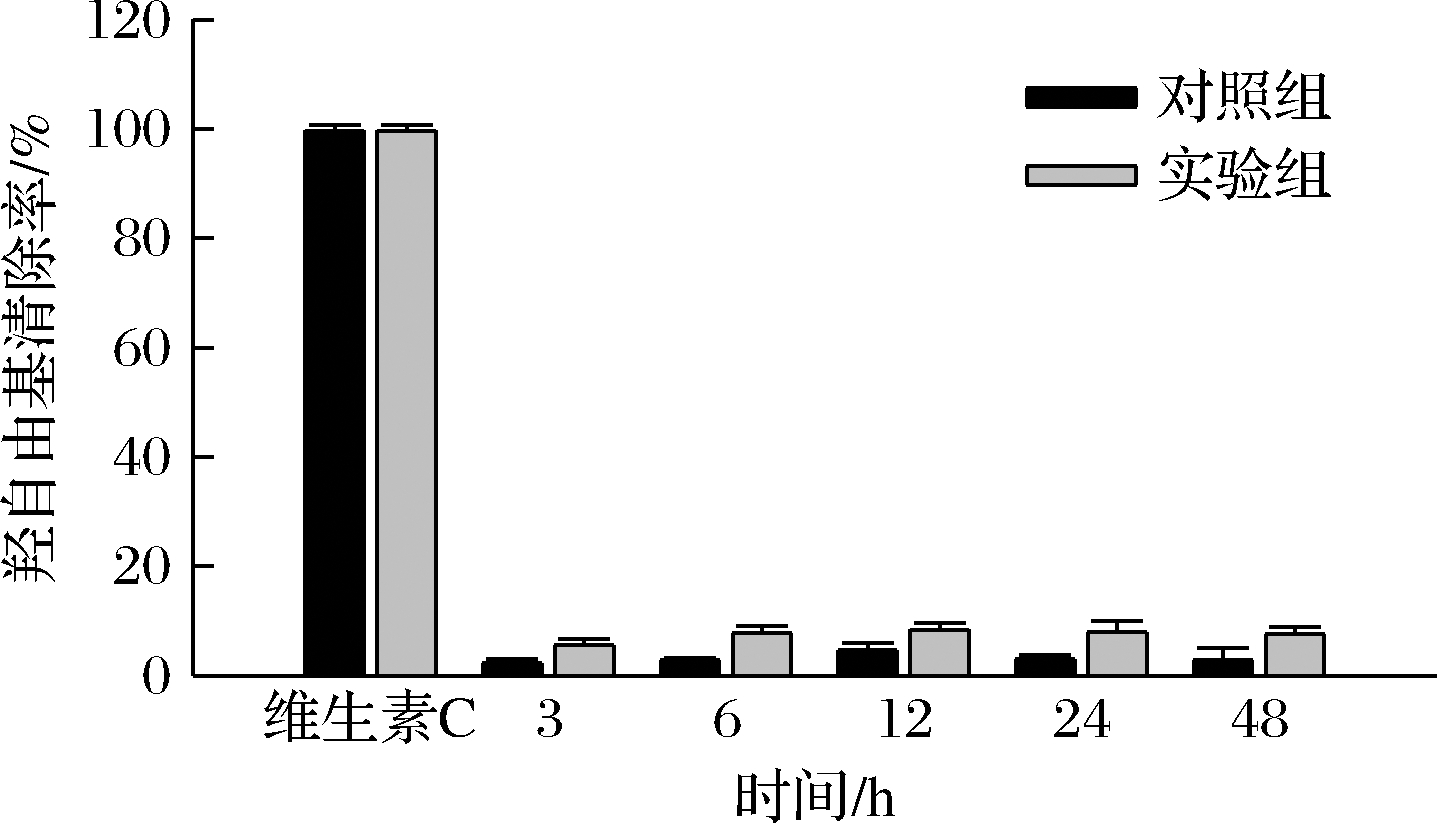
图11 胞外多糖的羟自由基清除率
Fig.11 Hydroxyl free radical scavenging rate of extracellular polysaccharide
2.5 还原力的测定
抗氧化剂能将铁氰化钾还原,利用亚铁离子生成普鲁士蓝,普鲁士蓝在700 nm处有最大吸收峰,所以吸光值越高,说明还原能力越强。由图12可知,盐胁迫下,胞内多糖的还原力明显降低。胞外多糖还原力先升后降再上升,6 h和48 h为上升时间点(图13)。结果显示,胁迫环境对羊肚菌胞内多糖还原能力的影响大于对胞外多糖还原能力的影响,而多糖含量的变化趋势对还原能力则无明显影响。
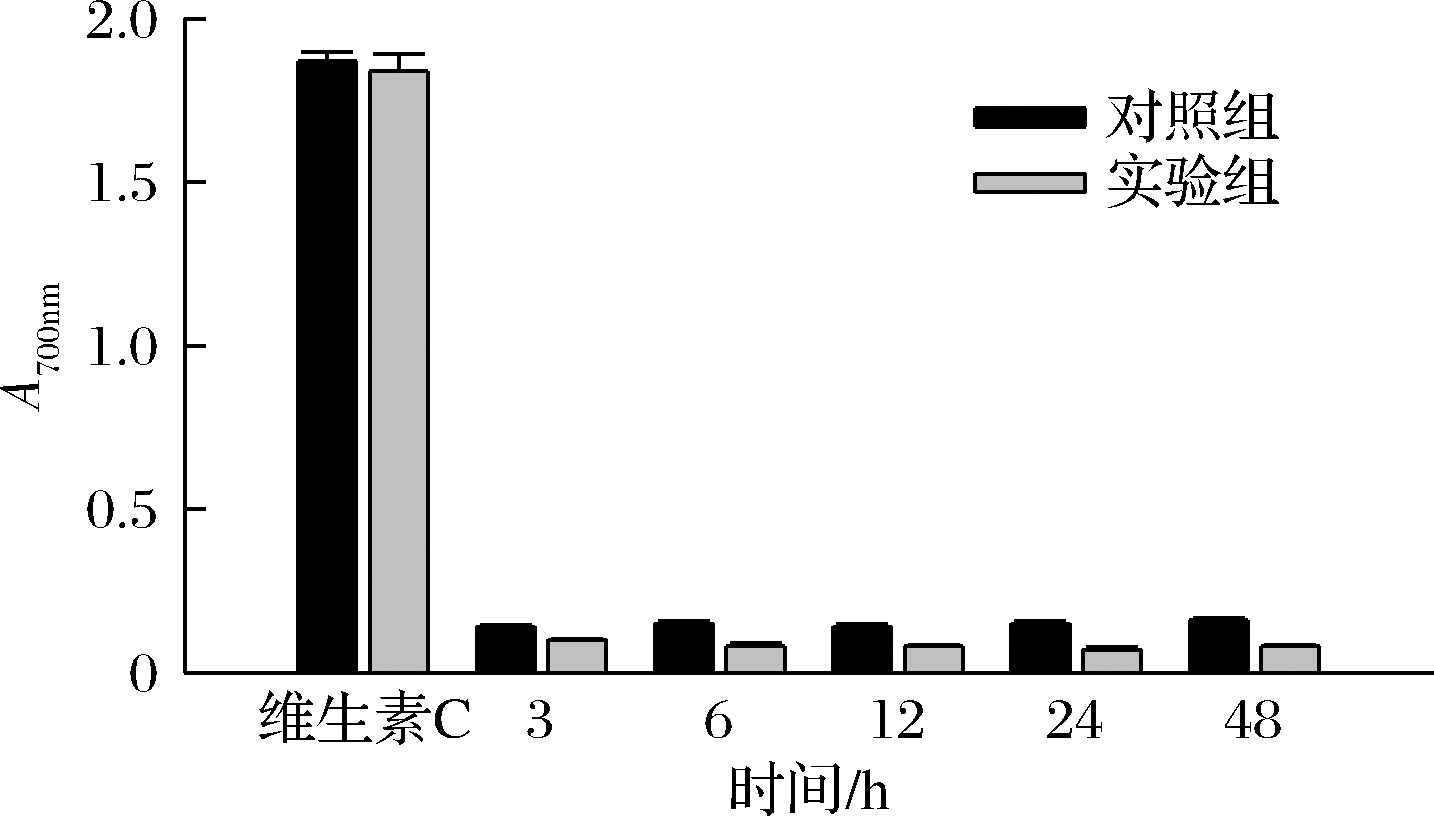
图12 胞内多糖还原能力
Fig.12 Reduction ability of intracellular polysaccharide
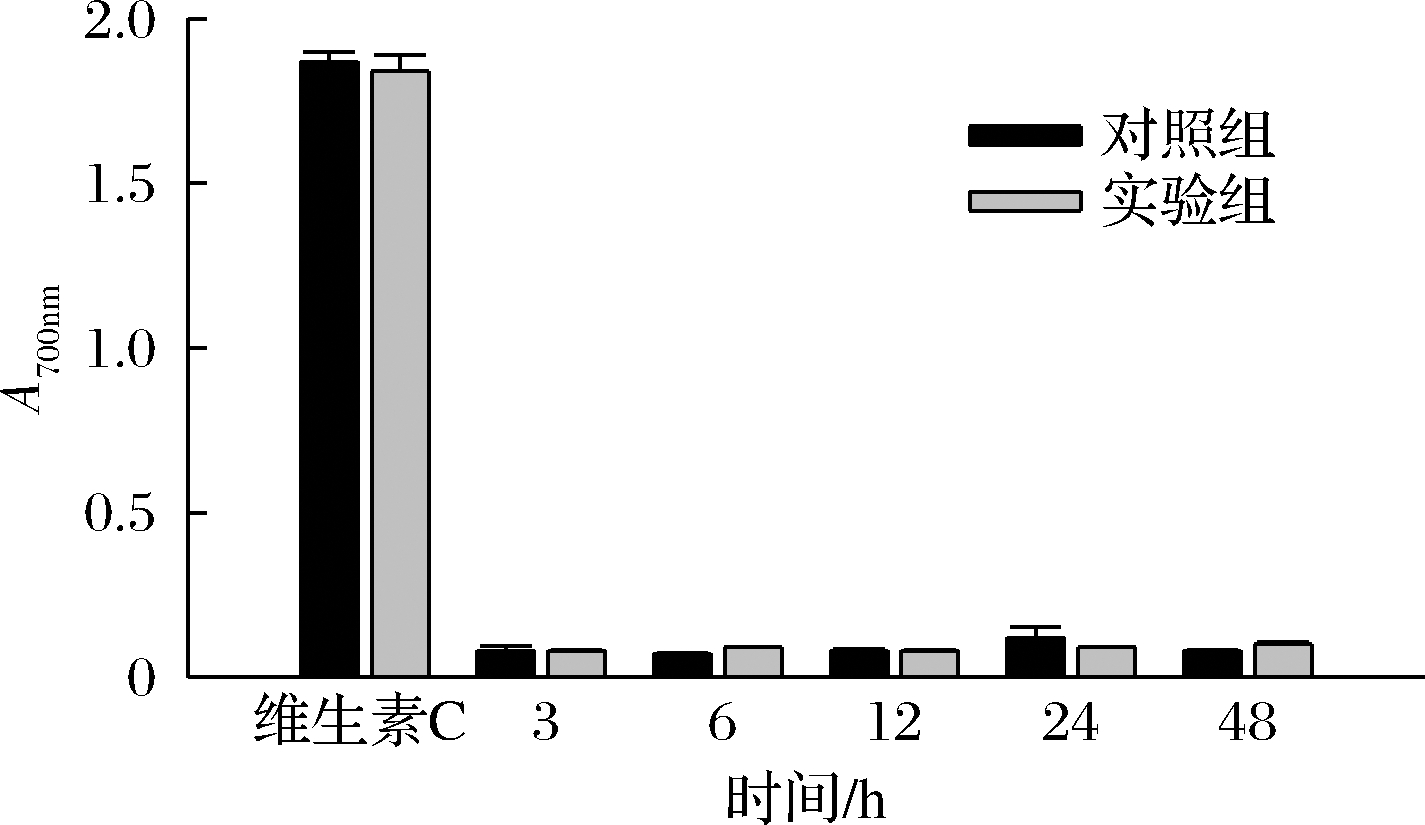
图13 胞外多糖还原能力
Fig.13 Reduction ability of extracellular polysaccharide
3 结论
盐胁迫下羊肚菌菌丝生长速度减慢,菌丝直径减小,胞内多糖和胞外多糖呈先升后降趋势,总体含量低于正常含量,但多糖对DPPH自由基和羟自由基的清除能力上升。对DPPH自由基的清除能力,胞内多糖最高提升了3.47倍,胞外多糖最高提升了6.72倍;对羟自由基的清除能力,胞内多糖清除率最高提升到27.5%,胞外多糖最高提升2.75倍。与冮洁等[22]测定的羊肚菌多糖不同的是,本文盐胁迫下羊肚菌菌丝体多糖含量下降,但抗氧化性增强,而富硒羊肚菌菌丝体多糖含量增加且抗氧化性增强。还原能力上,胞内多糖还原能力下降,胞外无明显升高或降低,总体来说DPPH自由基清除能力>羟自由基清除能力>还原能力。本研究所提取的多糖为粗多糖,提取未纯化,后期可以进一步对提取方案进行优化。
目前羊肚菌的栽培多在普通耕地上进行,盐碱地中栽培还未有人报道,而对于其可行性已有学者进行研究。如2020年李树文等[23]就对耐盐碱羊肚菌菌株进行了筛选。盐胁迫下羊肚菌生理活性和分子机制的研究还是一片空白,因此深度探究盐胁迫对羊肚菌理化性质的影响,可以对羊肚菌抗盐育种及栽培提供一定的前期基础和理论依据。
[1] 杜习慧, 赵琪, 杨祝良.羊肚菌的多样性、演化历史及栽培研究进展[J].菌物学报, 2014, 33(2):183-197.
DU X H, ZHAO Q, YANG Z L.Diversity, evolutionary history and cultivation of morels:A review[J].Mycosystema, 2014, 33(2):183-197.
[2] TIETEL Z, MASAPHY S.True morels (Morchella)-nutritional and phytochemical composition, health benefits and flavor:A review[J].Critical Reviews in Food Science and Nutrition, 2018, 58(11):1 888-1 901.
[3] 张建军, 贾乐, 李广贤, 等.羊肚菌生物学特性及生物活性研究进展[J].山东农业科学, 2021, 53(10):149-156.
ZHANG J J, JIA L, LI G X, et al.Research progress of bio-characteristics and bioactivities of Morchella spp[J].Shandong Agricultural Sciences, 2021, 53(10):149-156.
[4] 贺新生. 羊肚菌生物学基础、菌种分离制作与高产栽培技术[M].北京:科学出版社, 2017.
HE X S.Biological Basis, Isolation and Production of Morchella and High Yield Cultivation Techniques[M].Beijing:Science press, 2017.
[5] 龙正海, 许建安, 周惠燕, 等.浙江省羊肚菌属真菌资源调查初报[J].经济林研究, 2006, 24(4):55-60.
LONG Z H, XU J A, ZHOU H Y, et al.Resources investigation on Morchella fungi in Zhejiang Province[J].Nonwood Forest Research, 2006, 24(4):55-60.
[6] YAMADA H, KIYOHARA H. Complement-activating polysaccharides from medicinal herbs[J]. Immunomodulatory Agents from Plants, 1999. DOI:10.1007/978-3-0348-8763-2-7.
[7] 段巍鹤, 郭瑞, 张起莹, 等.羊肚菌活性成分应急性抗疲劳功能的研究[J].安徽农业科学, 2015, 43(8):1-3.
DUAN W H, GUO R, ZHANG Q Y, et al.Study on quick anti-fatigue function of Morchella active ingredients[J].Journal of Anhui Agricultural Sciences, 2015, 43(8):1-3.
[8] 姜浩, 孙涛, 姚皓昱, 等.食用真菌多糖的研究进展[J].食品工业科技, 2022,43(12):447-456.
JIANG H, SUN T, YAO H Y, et al.Research progress of edible fungal polysaccharides[J].Science and Technology of Food Industry, 2022,43(12):447-456.
[9] 陈文宁, 郑娟霞, 月金玲, 等.酸与碱处理对海带多糖提取及其抗氧化活性的影响[J].中国饲料, 2021(7):17-20.
CHEN W N, ZHENG J X, YUE J L, et al.Effects of acid and alkali treatment on extraction and antioxidant activity of Laminaria polysaccharides[J].China Feed, 2021(7):17-20.
[10] 孙玉军, 李正鹏, 马忠友, 等.中性蛋白酶法提取富硒羊肚菌菌丝体多糖的研究[J].中药材, 2012, 35(9):1 496-1 500.
SUN Y J, LI Z P, MA Z Y, et al.Study on the extraction of mycelium polysaccharides from selenium-rich Morchella esculenta with neutral proteinase method [J].Journal of Chinese Medicinal Materials, 2012, 35(9):1 496-1 500.
[11] MORALES D, SMIDERLE F R, VILLALVA M, et al.Testing the effect of combining innovative extraction technologies on the biological activities of obtained β-glucan-enriched fractions from Lentinula edodes[J].Journal of Functional Foods, 2019, 60:103446.
[12] ZHANG L J, WANG M S.Polyethylene glycol-based ultrasound-assisted extraction and ultrafiltration separation of polysaccharides from Tremella fuciformis (snow fungus)[J].Food and Bioproducts Processing, 2016, 100:464-468.
[13] 赵英, 刘晓慧, 刘小翠, 等.羊肚菌等9种食用菌抗氧化活性研究[J].山西大同大学学报(自然科学版), 2017, 33(2):28-32.
ZHAO Y, LIU X H, LIU X C, et al.Antioxidant activities of nine edible mushrooms extracts[J].Journal of Shanxi Datong University(Natural Science Edition), 2017, 33(2):28-32.
[14] 宋笛. 干燥真空储藏对羊肚菌营养成分和抗氧化性能的影响[J].粮食与油脂, 2020, 33(1):97-100.
SONG D.Effect of dry vacuum preservation on nutritional components and antioxidant properties of Morchella[J].Cereals & Oils, 2020, 33(1):97-100.
[15] 任嘉兴, 张锦华, 白宝清, 等.羊肚菌多糖提取工艺优化及抗氧化性研究[J].山西农业科学, 2018, 46(7):1 199-1 203.
REN J X, ZHANG J H, BAI B Q, et al.Study on optimization of extraction technology of polysaccharide and its antioxidant activity from Morchella esculentum[J].Journal of Shanxi Agricultural Sciences, 2018, 46(7):1 199-1 203.
[16] XIONG C, LI P, LUO Q, et al.Effect of γ-irradiation on the structure and antioxidant activity of polysaccharide isolated from the fruiting bodies of Morchella sextelata[J].Bioscience Reports, 2020, 40(9).DOI:10.1042/BSR20194522.
[17] 黄玲玲. 羊肚菌多糖的提取及体外抗氧化活性的研究[D].大连:大连工业大学, 2015.
HUANG L L.Study on extraction of polysaccharides in Morchella esculenta and its antioxidant activities in vitro[D].Dalian:Dalian Polytechnic University, 2015.
[18] 杨怀雷, 徐芳菲, 李蕾, 等.不同年生野山参中总皂苷和总多糖的含量测定[J].人参研究, 2019, 31(5):12-14.
YANG H L, XU F F, LI L, et al.Determination of total saponin and total polysaccharide in wild ginseng of different ages[J].Ginseng Research, 2019, 31(5):12-14.
[19] LEE Y L, YEN M T, MAU J L.Antioxidant properties of various extracts from Hypsizigus marmoreus[J].Food Chemistry, 2007, 104(1):1-9.
[20] LI S F, ZHANG L H, FU J N, et al.Antioxidant properties of polysaccharide extracts from fruitbodies of Hypsizigus marmoreus[J].Acta Agriculturae Boreali-Occidentalis Sinica, 2008, 17(4):302-305.
[21] TSAI S Y, TSAI H L, MAU J L.Antioxidant properties of Agaricus blazei, Agrocybe cylindracea, and Boletus edulis[J].LWT-Food Science and Technology, 2007, 40(8):1 392-1 402.
[22] 冮洁, 麦海美, 解彬, 等.羊肚菌菌丝体富硒条件优化及其硒多糖抗氧化活性研究[J].食品与发酵工业, 2016, 42(9):120-125.
GANG J, MAI H M, XIE B, et al.Optimization of Se-rich culture conditions and antioxidant activities of polysaccharides from Morchella esculenta mycelium[J].Food and Fermentation Industries, 2016, 42(9):120-125.
[23] 李树文, 徐丽丽, 于浩, 等.耐盐碱羊肚菌菌株筛选研究[J].中国食用菌, 2020, 39(12):23-27;32.
LI S W, XU L L, YU H, et al.Screening of saline-alkali tolerant Morchella spp[J].Edible Fungi of China, 2020, 39(12):23-27;32.