薄壳山核桃又名碧根果(Carya illinoinensis),19世纪初引进我国,在云南、浙江、江苏和安徽等地区均有广泛种植[1]。薄壳山核桃通常用在烘焙和糖果中,适量食用薄壳山核桃,可预防Ⅱ型糖尿病、高血压和肥胖症等疾病。薄壳山核桃中约含65%的油脂,以及蛋白质、维生素和矿物质等营养素[2],而油脂中有大量有益健康的化合物可用于制造黄油、乳液等可食用产品[3]。
薄壳山核桃油的提取方法有:机械压榨法(mechanical pressing,MP)、超临界流体萃取(supercritical fluid extraction,SFE)和水酶法。但MP提取的油脂的主要问题是提取率低[4],目前对SFE和水酶法已经有了不少研究,SFE利用流体高密度和低黏度的特点,能有选择性地提取出油脂[5],但设备昂贵,不适用于工业化生产。鉴于水酶法在生产成本、油得率和产物综合利用等方面的优势受到广泛关注,目前已有研究将水酶法应用于对山核桃、油茶籽、大豆等油料作物的提取[6]。水酶法选用特异性酶来降解细胞壁或脂蛋白、脂多糖,从而使油释放,并利用油与水密度差异及不相溶性将其分离,实现油脂的提取。尽管通过酶引起的细胞壁降解可改善油通过膜的渗透性,但通过水酶法提取油脂依然比传统方法提取效率低,如果在水酶法中运用超声波辅助处理,则可进一步提高渗透性[7]。超声处理提高油得率是利用超声波产生空化效应,空化气泡产生的剪切力会破坏细胞壁,进一步加快油脂扩散到溶剂中,与传统方法相比,超声-水酶法(ultrasonic-assisted enzymatic extraction,UAEE)提取条件温和,避免极端提取环境对油脂营养物质的破环,使获得高营养与感官质量的油脂[8]。
尽管超声处理不可避免的会产生乳状液,但提取效率仍显著增加,目前大多数研究只是确立了最佳提取工艺,却忽略了油脂释放机理以及油脂品质的探讨[6-7]。本试验中,在确定了超声辅助果胶酶法提取薄壳山核桃油脂的最佳工艺条件的基础上,着重探究了酶对薄壳山核桃油脂的释放机理;并将优化后的UAEE与MP、SFE提取薄壳山核桃油的理化性质、脂肪酸组成和总抗氧化活性等进行分析比较,确定了UAEE的优势所在和可完善的提取环节;旨在为薄壳山核桃油的精准提取、高效开发提供理论依据。
1 材料与方法
1.1 试剂与仪器
市售干燥的薄壳山核桃(波尼);果胶酶(500 U/mg),上海源叶生物科技有限公司;本试验中的甲酯化试剂均为色谱纯,安徽天地高纯溶剂有限公司;无水乙醚(30~60 ℃)、氢氧化钾、氯化钠等试剂均为分析纯,国药集团化学试剂有限公司。
FE28 pH计,梅特勒-托利多仪器(上海)有限公司;JY92-IIDN 超声波细胞粉碎机,宁波新芝生物科技股份有限公司;TGL-18MS 高速离心机,上海卢湘仪离心机仪器有限公司;JEM-1400 透射电镜,日本电子株式会社;Quanta 200 环境扫描电子显微镜,美国FEI公司;Agilent 7890A 气相色谱仪,美国安捷伦科技有限公司;SpectraMax i3x 酶标仪,上海美谷分子仪器有限公司。
1.2 试验方法
1.2.1 薄壳山核桃脂肪含量的测定
参照GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》,测定薄壳山核桃的脂肪含量。
1.2.2 UAEE提取薄壳山核桃油
首先称取(5.00±0.01) g粉碎后的薄壳山核桃粉放入100 mL的烧杯中,按1∶8(g∶mL)的料液比加入蒸馏水,在300 W的超声功率下进行超声预处理20 min,调节pH至3.5,加入一定量的果胶酶,其次,在55 ℃下恒温搅拌反应4 h后,置于80 ℃水浴10 min灭酶,再经8 000 r/min离心10 min,收集1次清油后,去除水解液,把剩余乳状液及残渣放入-40 ℃冰箱24 h后放置于25 ℃恒温箱内解冻至完全融化,重复上述离心操作,收集2次清油[9]。油得率计算如公式(1)所示,所有试验平行重复3次,结果取平均值。
油得率![]()
(1)
式中:M1为薄壳山核桃仁的质量,g;M2为总清油的质量,g;65.29为薄壳山核桃中的脂肪含量,%。
1.2.3 单因素实验
按照1.2.2 UAEE的步骤,单因素水平如下:加酶量为0%、0.2%、0.8%、1.0%、1.2%、2%(质量分数)(以薄壳山核桃仁计),酶解时间为2、3、4、5、6 h,料液比为1∶5、1∶6、1∶7、1∶8、1∶9(g∶mL),超声功率100、200、300、400、500 W,超声时间5、10、15、20、25 min,所有试验平行重复3次,结果取平均值。
1.3 薄壳山核桃油的性质测定
1.3.1 超声对薄壳山核桃微观结构的影响
薄壳山核桃透射电镜参照LIU等[10]的方法并稍作修改。取薄壳山核桃切片放入戊二醛和锇酸溶液里依次固定后,用一定浓度的丙酮逐级脱水,然后置于恒温箱中37~45~60 ℃温度段分别过夜,最后切片置于透射显微镜下观察。将超声前后的薄壳山核桃粉固定在金属载台,并将样品表面喷金,于环境扫描电子显微镜下观察。
1.3.2 油脂理化性质的测定
水分含量的测定参照GB 5009.236—2016《食品安全国家标准 动植物油脂水分及挥发物的测定》,酸价的测定参照GB 5009.229—2016《食品安全国家标准 食品中酸价的测定》,过氧化值的测定参照GB 5009.227—2016《食品安全国家标准 食品中过氧化值的测定》,共轭二烯(K232)与共轭三烯(K268)的测定参照GB/T 22500—2008《动植物油脂 紫外吸光度的测定》。
1.3.3 脂肪酸组成的测定
参照GB 5009.168—2016《食品安全国家标准 食品中脂肪酸的测定》的方法来进行脂肪酸的甲酯化与测定,采用峰面积归一化法定量测量脂肪酸含量。
1.3.4 角鲨烯的测定
参照LS/T 6120—2017《粮油检验 植物油中角鲨烯的测定 气相色谱法》中的方法测定角鲨烯的含量,采用内标法量测量角鲨烯含量。
1.3.5 酚类化合物的提取及总酚、总黄酮的测定
参照本课题组已有方法[11],采用福林酚法测定总酚含量,结果以每千克油中没食子酸的含量表示(mg GAE/kg)。亚硝酸钠-氯化铝法测定总黄酮含量,结果以每千克油中芦丁的含量表示(mg GAE/kg)。
1.3.6 总抗氧化活性的测定
参照本课题组已有方法[11],总抗氧化活性的测定分为:ABTS阳离子自由基清除活性、DPPH自由基清除活性和铁离子还原能力测定。结果都以含有Trolox物质的量表示(μmol TE/kg)。
1.3.7 不同提取方法的薄壳山核桃油的热重测定
称取(10.0±0.1) mg样品,放置于样品盘中,测试温度25~600 ℃[12]。扫描速率10 K/min,N2保护,记录温度变化与质量的关系曲线。
1.4 数据处理
试验均平行重复3次,结果表示为平均值±标准偏差,数据采用Origin 2018进行绘制。用SPSS 26进行单因素方差分析(analysis of variance,ANOVA),并检验数据的差异显著性,不同字母标注表示具有显著差异(P<0.05)。
2 结果与分析
2.1 UAEE提取薄壳山核桃油脂单因素试验分析
2.1.1 酶的种类、酶量、酶解时间和料液比对薄壳山核桃油得率的影响
酶的选择取决于油料的结构和细胞壁组成,果仁细胞壁一般由果胶、纤维素和半纤维素组成,不同的酶单一或混合使用都会产生不同的提取效果。如图1-a所示,混合使用果胶酶和碱性蛋白酶时,提取效率最高可达(75.2±1.4)%,可能是由于碱性蛋白酶能够使嵌在细胞壁网状结构中的蛋白体水解,增强细胞壁的膜渗透力,使油脂更容易被释放[13]。由各种酶的提取率可知,薄壳山核桃细胞壁的主要成分是果胶,从试验操作来考虑,接下来使用果胶酶进行试验。
除了酶种类,酶添加量和酶解时间也会影响油得率,如图1-b所示,酶添加量在0.0%~1.0%(质量分数)时,油得率呈显著增加趋势,这是因为提高酶添加量可以增加酶与底物分子之间的碰撞,提高反应速度,有利于油脂的释放[14]。在酶的添加量为1%时,油得率达到(73.9±0.78)%,当继续增加酶量时,油得率增加不显著(P<0.05),然而,酶量过大会导致酶解细胞壁速率变快以及产生苦味和异味[15],还会增加工艺成本。如图1-c所示,酶添加量为1%时,酶解时间从2 h增加到4 h,油得率呈快速上升趋势,当酶解时间继续延长,提取率反而有所下降。这主要是因为细胞壁降解出的水溶性的单糖、低聚糖,由于酶解时间过长又与释放出来的油滴和蛋白水解液在酸性环境不断搅拌的情况下,形成稳定的乳状液,使油滴难以从乳状液中分离出来[16]。过多延长酶解时间,会使薄壳山核桃油暴露在空气中的时间过长,接触氧气,造成油脂过氧化,因此确定4 h为最佳酶解时间。
合适的料液比有助于酶渗透到底物中,由图1-d可知,当料液比用量过低时,薄壳山核桃仁中大量油脂、蛋白质导致浆料黏度较大,导致果胶酶与底物接触不完全,不利于酶解的进行。当料液比过高时,酶和底物浓度则会变得相对较低,酶与底物发生碰撞的几率降低,影响果胶酶的反应速率[17]。考虑到副产物的浓缩与生产成本,因此,确定1∶8(g∶mL)为最佳的料液比。

a-酶的种类;b-酶添加量;c-酶解时间;d-料液比
图1 酶的种类、酶添加量、酶解时间和料液比对薄壳山核桃油得率的影响
Fig.1 Effect of enzyme type, enzyme contraction, enzymatic time and water-to-nuts ratio on extraction yield of pecan nuts oil
注:不同小写字母表示差异显著(P<0.05)
2.1.2 超声功率和时间对薄壳山核桃油得率的影响
超声功率和时间对油得率的影响如图2-a、图2-b所示,随着超声功率和时间的增加,薄壳山核桃油得率呈先增大后减小的趋势。由此可见,超声功率和时间对油得率的影响是双重的,提高超声功率和时间有利于增加热量和剪切力,使油脂体分解导致蛋白和油滴暴露于水相促进氢键结合,这种反应有助于蛋白质或碳水化合物聚集体的解体[18]、破坏细胞结构、增大酶与底物分子的接触面积、加速了油脂的释放,从而缩短提取时间、提高油得率。另一方面,高超声功率会导致油脂降解或异构化,导致油得率下降[19]。超声时间过长,会增加能耗,使油品质下降,因此,选择300 W和20 min为最佳条件。

a-超声功率;b-超声时间
图2 超声功率和时间对薄壳山核桃油得率的影响
Fig.2 Effect of ultrasonic power, and ultrasonic time on the extraction yield of pecan nuts oil
2.1.3 超声促进油脂释放情况
为了更好地了解UAEE提取油脂的机制,用透射显微镜来观察薄壳山核桃的优质体与蛋白体,如图3-a、图3-b所示,观察到薄壳山核桃中的油脂体与蛋白体多呈球形和椭圆形,很少有不规则形状。薄壳山核桃油脂体的平均直径为(4.18±1.39) μm,油脂体直径较大且数量多于蛋白体,这表明油体需要适量的酶来与细胞壁反应[20]。超声预处理可以产生空化作用导致细胞结构被破坏,使酶与油脂体的接触面积增大,从而彻底释放油脂。如图3-c、图3-d所示,样品在超声前,表面结构未见明显破坏,经过超声后,样品的结构呈现出明显的不规则孔洞,表明超声预处理有助于破坏样品的细胞结构,促进油的释放,这与KHADHRAOUI等[21]的研究结果相似。

OB-油体;PB-蛋白体
a-透射电镜图(5 μm);b-透射电镜图(10 μm);c-超声前扫描电镜图;d-超声后扫描电镜图
图3 薄壳山核桃透射电镜微观结构以及超声前后扫描电镜图
Fig.3 Transmission electron micrograph of pecan nuts, and scanning electron microscopy of pecan powder before and after ultrasonic treatment
2.1.4 不同提取方式的薄壳山核桃油脂品质
2.1.4.1 不同提取方式的薄壳山核桃油脂理化性质、脂肪酸组成及角鲨烯含量的对比
油脂的理化性质可以预判油脂的品质,薄壳山核桃油的理化性质包括:水分含量、过氧化值、酸价、K232、K268、脂肪酸组成、角鲨烯。如表1所示,3种提取方式的水分含量较低且无显著差异(P<0.05)。K232、K268反映油脂中的多不饱和脂肪酸的氢过氧化程度越高,油脂的氧化稳定性越弱。UAEE提取油脂的K268值最高,这与酶解时间有一定关系[22]。过氧化值和酸价是反映油脂品质的重要指标,UAEE提取的油脂的过氧化值为(0.032±0.003) mg/g,显著低于对照组(P<0.05),可能是因为果胶酶能使油脂的氧化程度降低[23]。3种提取方式的过氧化值和酸价均低于GB 2716—2018《食品安全国家标准 植物油》中0.25 g/100g和4 mg/g的上限。
薄壳山核桃油的脂肪酸主要是棕榈酸、硬脂酸、油酸、亚油酸,还含有其他少量的脂肪酸如:γ-亚油酸、二十烯酸等[2]。由表1可知,提取方式对脂肪酸的组成影响不大,但影响其脂肪酸含量,UAEE组油的总不饱和脂肪酸含量在90%以上,且油酸含量为68.62%显著高于MP组的66.61%和SFE组的65.19%(P<0.05),这可能是因为超声处理加速了细胞壁的降解,有利于油脂的溶出[24]。MP组油中角鲨烯含量最少为(98.11±5.36) mg/kg,是因为在压榨过程中,油料处理温度较高且榨油机也产生极大的剪切力与高温,导致角鲨烯的损失,然而UAEE反应条件比较温和,角鲨烯相对损失较小,但与SFE相比,还有一定的差距。根据理化性质结果表明,UAEE组油与MP和SFE组相比,具有一定优势。
表1 不同提取方式薄壳山核桃油的理化性质、脂肪酸组成及角鲨烯含量的对比
Table 1 Comparison of physicochemical properties, fatty acid composition and squalene content of pecan nuts oil extracted by different methods
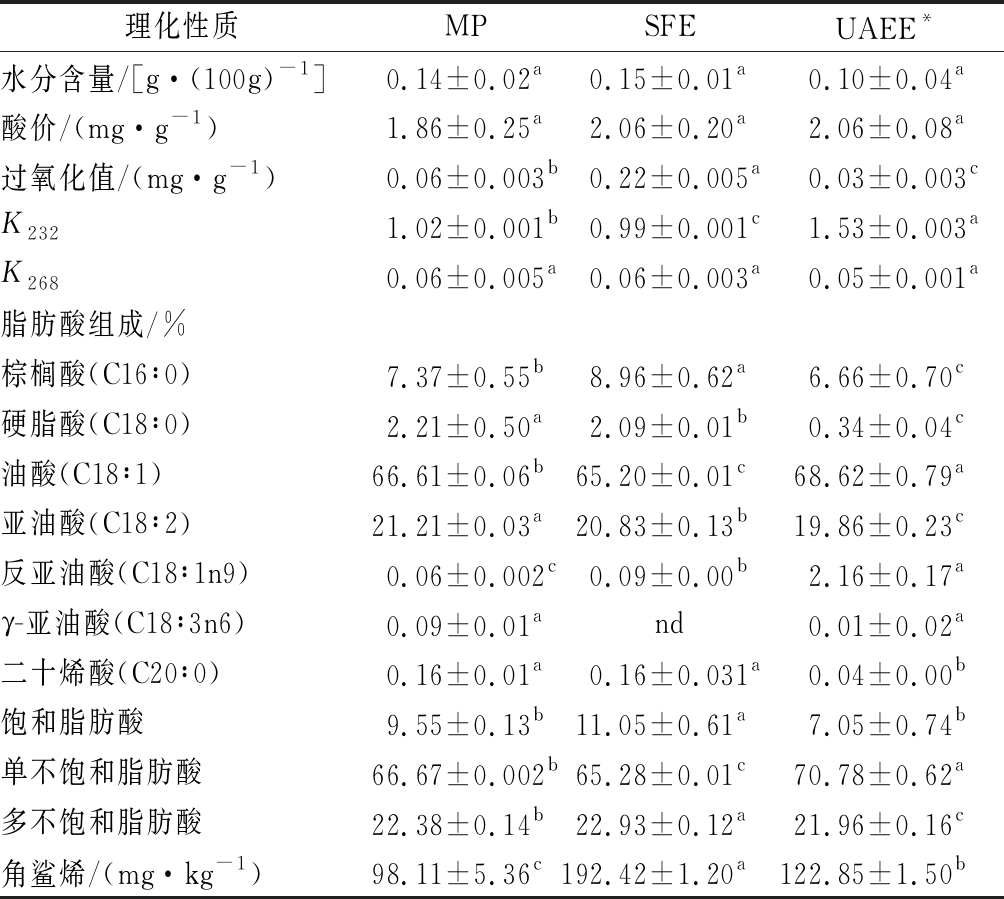
注:*表示UAEE最佳提取条件下提取的油脂;nd表示检测不出;肩标小写字母表示同一物质在不同提取方式中的差异(P<0.05)(下同)
理化性质MPSFEUAEE*水分含量/[g·(100g)-1]0.14±0.02a0.15±0.01a0.10±0.04a酸价/(mg·g-1)1.86±0.25a2.06±0.20a2.06±0.08a过氧化值/(mg·g-1)0.06±0.003b0.22±0.005a0.03±0.003cK2321.02±0.001b0.99±0.001c1.53±0.003aK2680.06±0.005a0.06±0.003a0.05±0.001a脂肪酸组成/%棕榈酸(C16∶0)7.37±0.55b8.96±0.62a6.66±0.70c硬脂酸(C18∶0)2.21±0.50a2.09±0.01b0.34±0.04c油酸(C18∶1)66.61±0.06b65.20±0.01c68.62±0.79a亚油酸(C18∶2)21.21±0.03a20.83±0.13b19.86±0.23c反亚油酸(C18∶1n9)0.06±0.002c0.09±0.00b2.16±0.17aγ-亚油酸(C18∶3n6)0.09±0.01and0.01±0.02a二十烯酸(C20∶0)0.16±0.01a0.16±0.031a0.04±0.00b饱和脂肪酸9.55±0.13b11.05±0.61a7.05±0.74b单不饱和脂肪酸66.67±0.002b65.28±0.01c70.78±0.62a多不饱和脂肪酸22.38±0.14b22.93±0.12a21.96±0.16c角鲨烯/(mg·kg-1)98.11±5.36c192.42±1.20a122.85±1.50b
2.1.4.2 不同提取方式的油的总酚、总黄酮及总抗氧化活性
多酚类物质是油脂的天然抗氧化剂,对油脂的加工、贮藏具有重要意义。由表2可知,MP、UAEE和SFE提取的酚类化合物含量分别为(199.9±9.26)、(129.0±2.26)和(111.6±7.79) mg GAE/kg,UAEE的多酚化合物含量显著低于MP(P<0.05),主要是因为水解液中多糖与酚类之间的相互作用,形成稳定的多酚-多糖复合物,这也被认为是提取过程中酚类物质损失的主要原因之一,但超声处理和添加果胶酶有利于细胞结构的破坏,使活性物质释放到油脂中[23]。DPPH、ABTS用于评估提取化合物的自由基清除活性,而铁离子还原/抗氧化能力法(ferric ion reducing antioxidant power,FRAP)来确定提取化合物的铁离子还原能力,由表2可知,3种方式提取油脂的DPPH抗氧化活性并无显著差异(P<0.05)。UAEE的ABTS抗氧化活性比SFE低,这可能是由于UAEE组中的酚类被果胶酶降解,大部分亲水性酚类溶于水解液而浪费[11]。FRAP的变化趋势与DPPH抗氧化活性相似,综上所述,超声处理和添加果胶酶在一定程度上能够提高油脂的抗氧化能力。
表2 不同提取方式的总酚、总黄酮及总抗氧化活性
Table 2 Contents of total phenols, total flavonoids and total antioxidant activity in different extraction
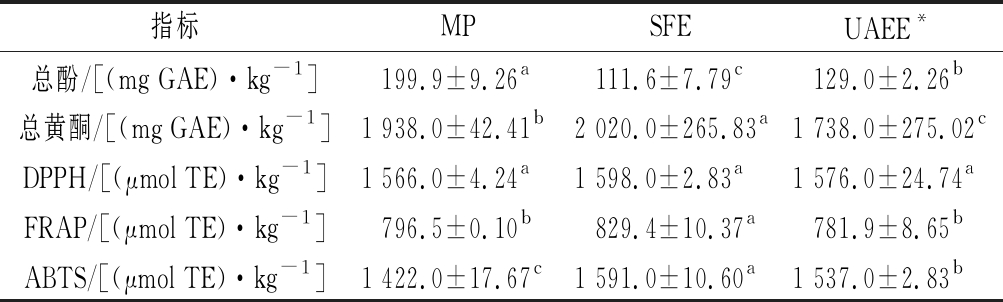
指标MPSFEUAEE*总酚/[(mg GAE)·kg-1]199.9±9.26a111.6±7.79c129.0±2.26b总黄酮/[(mg GAE)·kg-1]1 938.0±42.41b2 020.0±265.83a1 738.0±275.02cDPPH/[(μmol TE)·kg-1]1 566.0±4.24a1 598.0±2.83a1 576.0±24.74aFRAP/[(μmol TE)·kg-1]796.5±0.10b829.4±10.37a781.9±8.65bABTS/[(μmol TE)·kg-1]1 422.0±17.67c1 591.0±10.60a1 537.0±2.83b
2.1.4.3 不同提取方式的薄壳山核桃油脂的热重
油脂在加热过程中,热稳定性的改变常常表现为小分子物质的生成,导致油脂质量的变化。不同提取方式的薄壳山核桃油脂的失重率如图4所示,UAEE提取的油脂在25~397 ℃质量几乎不变化,主要是挥发性物质较少。MP、SFE提取的油脂明显比UAEE起始氧化温度要低,油脂在397~480 ℃失重速率较高,主要是甘油三酯及不饱和脂肪酸的降解,其余则为碳质残渣[25],在500 ℃附近油脂几乎全部失重[12]。不同提取方式的薄壳山核桃油脂氧化进程相似,起始失重温度接近,但UAEE组油的失重幅度比MP和SFE组的油要小,可能是因为MP和SFE提取油脂的饱和脂肪酸比UAEE含量高,说明UAEE提取的油脂有良好的热氧化稳定性。
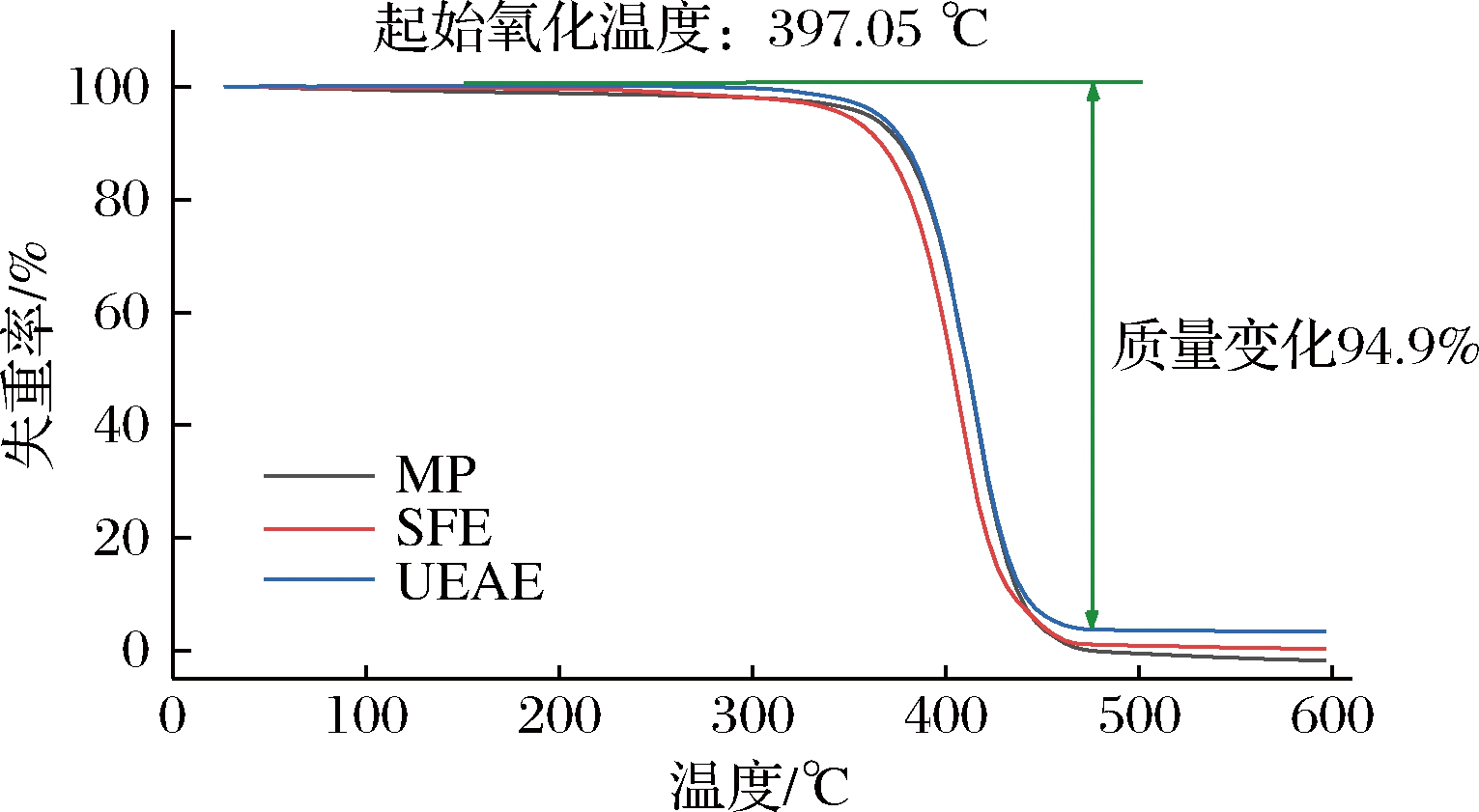
图4 不同提取方式的薄壳山核桃油热重曲线
Fig.4 Thermogravimetry curves of pecan nuts oil with different extraction methods
3 结论与讨论
UAEE以MP、SFE提取的薄壳山核桃油脂为对照,UAEE比MP和SFE提取的油酸分别约高2%和3.4%,UAEE组油的总不饱和脂肪酸含量在90%以上,表明UAEE有助于油酸的提取和保留,油脂的过氧化值低于对照组,这说明在提取过程中超声处理和添加果胶酶能使油脂的氧化程度降低,UAEE组脂的热裂解温度较高且失重幅度低,说明油脂中含有较多的抗氧化物质和较少的饱和脂肪酸,防止油脂氧化裂解,超声处理和果胶酶能有效降解薄壳山核桃细胞壁,有助于果仁中游离酚的释放,从而提高薄壳山核桃油中总酚含量及抗氧化活性。这些结果都表明适当超声预处理和添加果胶酶有助于薄壳山核桃油脂品质的提高,同时降低提取时间,节约成本。UAEE提取的薄壳山核桃油脂具有良好的营养保健功能,可作为功能性油脂来开发利用。
[1] 罗会婷, 贾晓东, 翟敏, 等.薄壳山核桃营养成分的研究进展[J].中国农学通报, 2017, 33(8):39-46.
LUO H T, JIA X D, ZHAI M, et al.A review of nutritional components in Carya illinoinensis[J].Chinese Agricultural Science Bulletin, 2017, 33(8):39-46.
[2] ATANASOV A G, SABHARANJAK S M, ZENGIN G, et al.Pecan nuts:A review of reported bioactivities and health effects[J].Trends in Food Science & Technology, 2018, 71:246-257.
[3] MWAURAH P W, KUMAR S, KUMAR N, et al.Novel oil extraction technologies:Process conditions, quality parameters, and optimization[J].Comprehensive Reviews in Food Science and Food Safety, 2020, 19(1):3-20.
[4] 吴非, 李钊, 周琪, 等.超声波辅助水酶法提取米胚油及其成分分析[J].食品科学, 2020, 41(24):233-241.
WU F, LI Z, ZHOU Q, et al.Ultrasonic-assisted aqueous enzymatic extraction and chemical composition of rice germ oil[J].Food Science, 2020, 41(24):233-241.
[5] 黄沅玮. 超临界流体萃取技术及其在植物油脂提取中的应用[J].食品工程, 2020(3):12-15;61.
HUANG Y W.Supercritical fluid extraction technology and its application in the extraction of vegetable oil[J].Food Engineering, 2020(3):12-15;61.
[6] 李丹丹, 杨宏志, 梁英, 等.水酶法提取葡萄籽油和蛋白质的研究[J].中国油脂, 2017, 42(9):28-33.
LI D D, YANG H Z, LIANG Y, et al.Aqueous enzymatic extraction process of oil and protein from grape seeds[J].China Oils and Fats, 2017, 42(9):28-33.
[7] 李良, 田甜, 吴长玲, 等.水酶法制取大豆油乳状液射流空化破乳工艺优化[J].农业机械学报, 2019, 50(9):357-363.
LI L, TIAN T, WU C L, et al.Optimization of emulsion demulsification technique with jet cavitation for water-enzymatic soybean oil[J].Transactions of the Chinese Society for Agricultural Machinery, 2019, 50(9):357-363.
[8] 杨建远, 邓泽元.水酶法提取植物油脂技术研究进展[J].食品安全质量检测学报, 2016, 7(1):225-230.
YANG J Y, DENG Z Y.Research progress on aqueous enzymatic extraction for the production of plant oil[J].Journal of Food Safety and Quality, 2016, 7(1):225-230.
[9] 季泽峰. 山核桃油水酶法制取工艺及其对油脂品质影响研究[D].杭州:浙江农林大学, 2018.
JI Z F.Aqueous enzymatic extraction of Carya cathayensis oil and physicochemical properties of its oil[D].Hangzhou:Zhejiang Agricultural & Forestry University, 2018.
[10] LIU C, HAO L H, CHEN F S, et al.Study on extraction of peanut protein and oil bodies by aqueous enzymatic extraction and characterization of protein[J].Journal of Chemistry, 2020, 2020:5148967.
[11] 黄帅, 蒋瑞, 王强, 等.酶处理对初榨橄榄油品质及抗氧化活性的影响[J].中国粮油学报, 2020, 35(8):104-110.
HUANG S, JIANG R, WANG Q, et al.Effects of enzymes on quality and antioxidant activity of virgin olive oil[J].Journal of the Chinese Cereals and Oils Association, 2020, 35(8):104-110.
[12] 张巧智, 李杨, 齐宝坤, 等.基于热重法的植物油氧化动力学研究[J].食品工业科技, 2016, 37(2):103-107.
ZHANG Q Z, LI Y, QI B K, et al.Study on the oxidation kinetics of vegetable oils by thermogravimetry[J].Science and Technology of Food Industry, 2016, 37(2):103-107.
[13] 向娇. 水酶法提取油茶籽油酶解工艺参数优化研究[D].长沙:湖南农业大学, 2015.
XIANG J.Study on the optimization of enzymolysis parameters for extracting oil-tea camellia oil by aqueous enzymatic method[D].Changsha:Hunan Agricultural University, 2015.
[14] GHASEMI Y Z, TAGHIAN DINANI S.Optimization of ultrasound-assisted enzymatic extraction of walnut kernel oil using response surface methodology[J].Journal of Food Process Engineering, 2018, 41(5):e12696.
[15] LATIF S, ANWAR F.Aqueous enzymatic sesame oil and protein extraction[J].Food Chemistry, 2011, 125(2):679-684.
[16] ZHANG S B, LIU X J, LU Q Y, et al.Enzymatic demulsification of the oil-rich emulsion obtained by aqueous extraction of peanut seeds[J].Journal of the American Oil Chemists′ Society, 2013, 90(8):1 261-1 270.
[17] KUMAR S P J, PRASAD S R, BANERJEE R, et al.Green solvents and technologies for oil extraction from oilseeds[J].Chemistry Central Journal, 2017, 11(1):9-15.
[18] GOULA A M, PAPATHEODOROU A, KARASAVVA S, et al.Ultrasound-assisted aqueous enzymatic extraction of oil from pomegranate seeds[J].Waste and Biomass Valorization, 2018, 9(1):1-11.
[19] HOSSEINI S, GHARACHORLOO M, TARZI B G, et al.Effects of ultrasound amplitude on the physicochemical properties of some edible oils[J].Journal of the American Oil Chemists′ Society, 2015, 92(11-12):1 717-1 724.
[20] 官梦姝, 徐聪, 姜瑞, 等.油脂体稳定性影响因素及机理的研究进展[J].食品工业科技, 2021, 42(16):421-428.
GUAN M S, XU C, JIANG R, et al.Recent progress of influence factors and mechanism of oil body stability[J].Science and Technology of Food Industry, 2021, 42(16):421-428.
[21] KHADHRAOUI B, TURK M, FABIANO-TIXIER A S, et al.Histo-cytochemistry and scanning electron microscopy for studying spatial and temporal extraction of metabolites induced by ultrasound.Towards chain detexturation mechanism[J].Ultrasonics Sonochemistry, 2018, 42(1):482-492.
[22] 李鹏飞. 水酶法提取花生油及蛋白质[D].无锡:江南大学, 2017.
LI P F.Enzyme-assisted aqueous extraction of oil and protein from peanut[D].Wuxi:Jiangnan University, 2017.
[23] GAI Q Y, JIAO J, WEI F Y, et al.Enzyme-assisted aqueous extraction of oil from Forsythia suspense seed and its physicochemical property and antioxidant activity[J].Industrial Crops and Products, 2013, 51:274-278.
[24] SICAIRE A G, VIAN M A, FINE F, et al.Ultrasound induced green solvent extraction of oil from oleaginous seeds[J].Ultrasonics Sonochemistry, 2016, 31:319-329.
[25] 纪佳璐, 吴莹, 徐斐然, 等.马泡瓜籽油理化特性、组成分析及氧化稳定性[J].食品科学, 2020, 41(21):15-21.
JI J L, WU Y, XU F R, et al.Physicochemical characteristics, composition and oxidative stability of Cucumis bisexualis seed oil[J].Food Science, 2020, 41(21):15-21.