色素在食品、日用化工、化妆品和医药工业得到广泛的应用,而化学合成的色素具有一定的毒性、致癌、致畸性,因此以天然色素取代化学合成色素已成为食品工业的发展趋势[1-2]。天然色素主要来自动植物、微生物的组织或代谢产物,大多无副作用,安全性高,很多天然色素具有预防治疗疾病、抗菌消炎、抗肿瘤、抗氧化等功能,应用价值较高[3]。而微生物天然色素,具有来源广、价格低廉,成本较低、受环境因素影响小等诸多优点,且能够避免动植物天然色素的许多缺陷,具有较大的发展潜力[4]。大部分细菌、真菌、放线菌都能够产生天然色素,但很多菌株色素产量低,有的菌株同时也产生毒素,纯化色素比较困难,因此从环境中筛选出高效、安全的产色素菌株尤为重要[5]。研究发现,丝状真菌菌源容易获取,菌丝发达,繁殖迅速,在食品中应用较多,如红曲霉产生的红曲色素[6]、三孢布拉霉产生的番茄红素和β-胡萝卜素等[7]。丝状真菌色素具有化学结构多样、生物活性显著、生产方便、消炎抑菌并往往兼有营养保健功能等优点,因此,丝状真菌有望成为食品色素的可靠来源[8]。
本实验室从环境中分离出1株焦曲霉,能产生丰富的棕红色色素,目前对该色素的研究未见报道,因此,本课题对该色素的组成特性、化学结构以及产色素的条件进行深入研究,以期开发出一种新型的天然的可食用的微生物源色素。
1 材料与方法
1.1 材料
1.1.1 菌株来源
焦曲霉:由合肥师范学院微生物实验室分离纯化鉴定,上海生工有限公司分子测序。
1.1.2 培养基
马丁氏培养基(g/L):葡萄糖 12.0,蛋白胨4.5,KH2PO4 1.2,MgSO4·7H2O 0.6,琼脂18~25,pH自然,0.1 MPa,121 ℃灭菌30 min。
1.1.3 试剂药品
所用试剂药品均为分析纯,国药集团化学试剂上海有限公司;应用于GC-MS的溶剂为色谱级甲醇,美国TEDIA公司;HPD600大孔树脂、硅胶(200~300目)、中性氧化铝(100~200目),青岛海洋化工有限公司。
1.1.4 仪器与设备
BXM-50VE高压蒸汽灭菌器、BSD-YX-2000立式摇床,上海博迅医疗生物仪器股份有限公司;Allegra 64r高速冷冻离心机,美国贝克曼仪器设备有限公司;LGj-10真空冷冻干燥机,北京松源华兴科技有限公司;IKA RV10旋转蒸发仪,德国艾卡仪器设备有限公司;UV-2100紫外可见分光光度计,北京瑞利分析仪器有限公司;Nicolet 380红外光谱仪,美国Themo Fisher科技有限公司;7890B-5977A GC-MS,美国安捷伦科技有限公司。
1.2 实验方法
1.2.1 焦曲霉色素粗提物的制备
无菌水冲洗焦曲霉保藏斜面,制成×106个/mL孢子悬液,吸取1 mL孢子悬液加入到150 mL马丁氏培养基中,置28 ℃、150 r/min振荡培养箱中振荡培养96 h。对焦曲霉发酵液进行10 000 r/min离心10 min,提取色素上清液,置冷冻干燥机的金属圆盘,并用扎孔的透明薄膜封口,置于-20 ℃预冻12 h,继而在真空冷冻干燥机中干燥12 h,后加入体积分数60%乙醇浸泡24 h,10 000 r/min离心10 min,去除蛋白与多糖,60 ℃旋转蒸发干燥与真空冷冻干燥,获取色素的粗提物。
1.2.2 焦曲霉色素的分离纯化
称取0.1 g色素粗提物,溶解到10 mL蒸馏水中,作为色素点样样品。分别配制V(氯仿)∶V(甲醇)=50∶50、V(水)∶V(甲醇)∶V(乙醇)= 20∶30∶50、V(水)∶V(乙醇)=40∶60、V(石油醚)∶V(氯仿)=40∶60、V(水)∶V(醋酸)∶V(乙醇)=20∶30∶50作为展开剂系统,选取购置的硅胶板作为固相载体,进行薄层层析,对色素进行分离,判断色素的组成特性。利用毛细管在距离硅胶板底部1 cm进行5次平行点样,置于不同展开剂的层析缸中,展开剂不能没过硅胶点样线,当展开剂前沿移至距离薄层板上端处,停止展开,按照公式(1)计算比移系数(retardation factor,Rf)。根据薄层层析结果,选取合适的展开剂作为淋洗剂进行柱层析,色素水溶液为样品,以大孔树脂、中性氧化铝、硅胶作为吸附材料进行柱层析纯化色素,将分离纯化较好的层析液进行干燥,获取色素的精提物。称取一定量的色素精提物粉末溶解在色谱级甲醇中,并高速离心,获取色素滤液,进行后续实验。
(1)
1.2.3 色素的紫外可见与红外扫描
将色素滤液在200~800 nm进行紫外可见扫描,以甲醇作为空白对照,获取该色素的最大吸收峰;称取0.1 g色素精提物粉末,按质量比1∶100与KBr粉末混合均匀压片,红外光谱仪在400~4 000 cm-1范围内进行扫描分析,获取焦曲霉色素重要化学基团的信息。
1.2.4 色素GC-MS
将色素滤液,用于GC-MS分析。采用Trace GC Ultra和ISQ Ⅱ MS对色素进行分析,GC-MS柱为TG-35 ms 的石英毛细管柱,柱温设定从50 ℃程序升温至300 ℃(10 ℃/min),载气(氦气)流速为1 mL/min;注射器和检测器温度为280 ℃,质谱分析在EI模式、70 eV 条件下进行满扫。
1.2.5 碳氮源对焦曲霉色素产量的影响
以马丁氏培养基为基础,按表1选择同量的不同种类的碳氮源进行单因素试验,每种组合培养基均取150 mL,接种1 mL的×106个/mL浓度的焦曲霉孢子悬液,于28 ℃、150 r/min振荡培养96 h,10 000 r/min 离心10 min,取上清液在色素最大吸收峰下检测其OD值,以未接种的相应培养基作为对照,每种组合设置3个平行,以获取最适碳氮源。
表1 碳氮源试验
Table 1 Carbon and nitrogen source test

因素水平碳源葡萄糖、乳糖、蔗糖、淀粉、玉米粉、柠檬酸钠、麦麸、甘露醇、乙酸钠氮源蛋白胨、酵母膏、硫酸铵、大豆粉、柠檬酸铵、氯化铵、硝酸钾、尿素、甘氨酸
1.2.6 产色素条件的优化
结合1.2.5实验结果,以马丁氏培养基为基础,采用均匀设计法对最适碳氮源、pH、温度、摇床转速、孢子悬液接种量、发酵时间7个因素进行优化实验,以获取最适产色素条件,提高色素产量,每批次试验配制150 mL培养基,做3次平行实验。
2 结果与分析
2.1 焦曲霉色素粗提物
焦曲霉经过96 h发酵培养,产生了丰富的棕红色色素,色素经焦曲霉菌发酵产生并分泌到胞外,进入发酵液(图1-a),色素水溶性较高;发酵液经过离心,得到棕红色上清液(图1-b),经真空冷冻干燥处理获取了色素粗提粉末(图1-c),该色素粉末在空气中吸湿性较强,易潮解。

a-色素发酵液;b-色素水溶液;c-色素粗提物
图1 焦曲霉色素提取过程
Fig.1 Extraction process of Aspergillus ustus pigment
2.2 焦曲霉色素的薄层层析
在薄层层析实验中,不同的展开剂对焦曲霉色素的分离情况不同。
氯仿∶甲醇分离系统:色素向上轻微移动,Rf= 0.14±0.025,难以分离,有拖尾现象,分离效果不佳(图2-a);甲醇∶乙醇分离系统:色素向上移动较快,分离较好,Rf= 0.7±0.008(图2-b);水∶乙醇分离系统:色素向上快速移动,分离较好,Rf= 0.72±0.008(图2-c);石油醚∶氯仿分离系统:色素基本无移动,分离效果较差,Rf= 0(图2-d);水∶醋酸∶乙醇分离系统:色素向上快速移动,分离较好,Rf=0.71±0.004(图2-e)。
图2结果说明该色素在极性较强的展开剂中,移动速度较快,分离效果较好,能被甲醇、乙醇、醋酸、水等极性较强物质拖动,而极性较弱的如氯仿、石油醚不能将色素拖动,其中水∶乙醇分离系统对色素的分离效果最好,性价比较高,可选择该展开系统作为后续的柱层析淋洗剂。不同的展开剂系统对色素进行分离,发现只有一种色素斑点,且颜色单一,推测焦曲霉色素是一种单一色素。
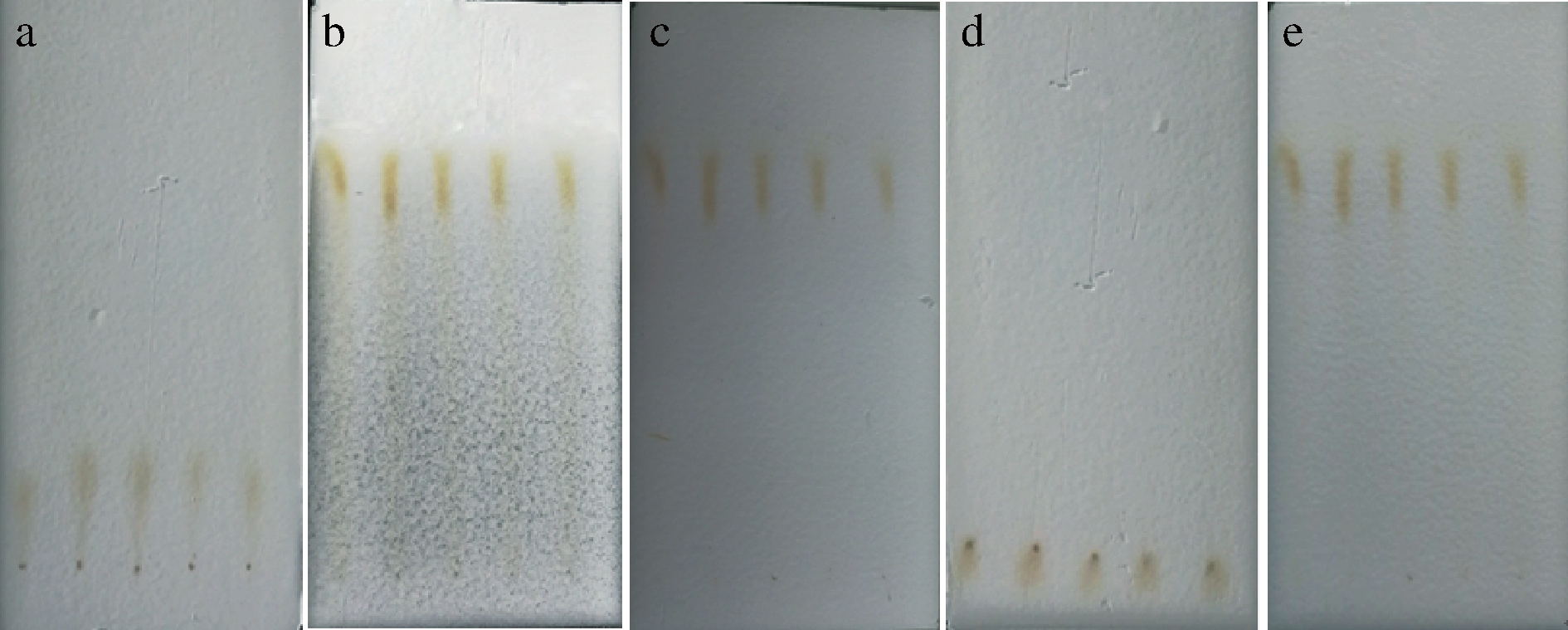
a-氯仿∶甲醇分离系统;b-水∶甲醇∶乙醇分离系统;c-水∶乙醇分离系统;d-石油醚∶氯仿分离系统;e-水∶醋酸∶乙醇分离系统
图2 焦曲霉色素薄层层析
Fig.2 Thin layer chromatography of Aspergillus ustus pigment
2.3 焦曲霉色素的柱层析
以色素粗提物的水溶液作为柱层析样品,分别选取大孔树脂、中性氧化铝、硅胶作为吸附材料,以薄层层析性价比最高的60%(体积分数)乙醇展开剂作为淋洗剂,采用干法装柱,进行柱层析,进一步对色素进行分离纯化,并收集层析液。由于大孔树脂的吸附力较强,和焦曲霉色素结合牢固,淋洗剂无法分离色素(图3-a);中性氧化铝与该色素的结合力较弱,轻易被水乙醇系统淋洗下来,但该色素整体溶解在淋洗系统中,达不到分离纯化的目的(图3-b);而该色素在硅胶结合适中,淋洗剂洗脱效果较好,能形成唯一单一的色素环,说明该色素为单色素,与色素薄层层析结果一致(图3-c)。收集硅胶柱层析的色素环流出液,对其进行旋转蒸发与真空冷冻干燥,并溶解于色谱级甲醇中,高速离心超滤获取色素滤液(图3-d),由于色素在甲醇中的溶解度较低,相比色素水溶液,色泽明显下降。

a-大孔树脂柱层析;b-硅胶柱层析;c-氧化铝柱层析;d-色素滤液
图3 焦曲霉色素柱层析
Fig.3 Column chromatographic of Aspergillus ustus pigment
2.4 色素紫外可见扫描
利用紫外-可见光在200~800 nm扫描色素滤液,以甲醇作为对照,发现焦曲霉色素在298 nm紫外区有1个明显的最大吸收峰,可作为色素产量的检测波长,在200~250 nm之间有锯齿状的精细结构,说明是一种含有苯环的有机物,由于在270~350 nm之间有1个最强吸收峰,可以判断有C![]() O键,而且含有多个C
O键,而且含有多个C![]() C双键,从而发生了红移现象(图4-a);将色素滤液进行旋转蒸发干燥,在400~4 000 cm-1进行红外扫描,光谱显示在1 638 cm-1 (1 657~1 227)是具有芳香骨架结构的C
C双键,从而发生了红移现象(图4-a);将色素滤液进行旋转蒸发干燥,在400~4 000 cm-1进行红外扫描,光谱显示在1 638 cm-1 (1 657~1 227)是具有芳香骨架结构的C![]() C双键的特征吸收峰,1 725 cm-1(1 760~1 690)有1个尖峰,显示有—C
C双键的特征吸收峰,1 725 cm-1(1 760~1 690)有1个尖峰,显示有—C![]() O双键的存在,说明该色素是一种芳香结构的酮类;在在1 180~1 360 cm-1区间有吸收峰,说明有C—O或者C—N键吸收,在675~870 cm-1有1个弱的吸收峰,说明有
O双键的存在,说明该色素是一种芳香结构的酮类;在在1 180~1 360 cm-1区间有吸收峰,说明有C—O或者C—N键吸收,在675~870 cm-1有1个弱的吸收峰,说明有![]() C—H存在,而在3 420 cm-1(3 300~3 500)有1个宽峰,显示有N—H键的存在[9](图4-b)。
C—H存在,而在3 420 cm-1(3 300~3 500)有1个宽峰,显示有N—H键的存在[9](图4-b)。

a-焦曲霉色素紫外可见扫描;b-焦曲霉色素红外扫描
图4 焦曲霉色素紫外可见与红外扫描
Fig.4 UV-vis and infrared scanning of Aspergillus ustus pigment
2.5 焦曲霉色素的GC-MS检测
对焦曲霉色素滤液进行GC-MS检测,从50~300 ℃ 连续性升温气相检测,重复3次样品,主要出现了2个主要的峰型且峰型一致,峰型较好,说明检测出2种主要物质,保留时间分别为18.549 min与21.565 min(图5)。
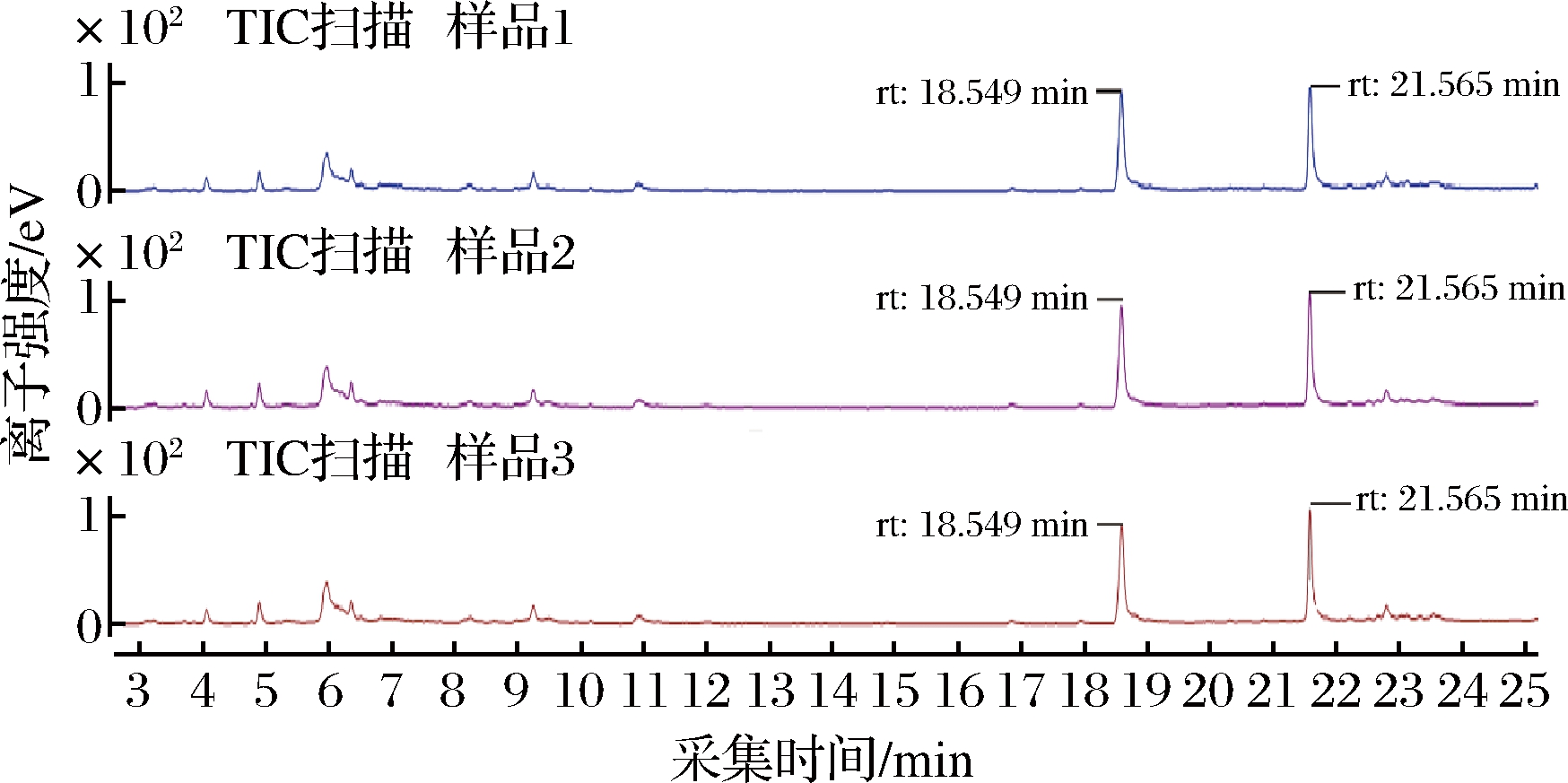
图5 焦曲霉色素气相色谱
Fig.5 Gas chromatogram of Aspergillus ustus pigment
通过质谱检测,保留时间18.549与21.565 min分子质量分别为154 Da与386 Da(图6-a),与NITS图库的比对,分子质量154 Da的化学结构推测为吡咯并[1,2-a]吡嗪-1,4-二酮六氢匹配度为50.2%,分子质量为386 Da的化学结构为二蒽酮类,匹配度达到98%(图6-b),图库给出的结构与红外检测的结果一致。
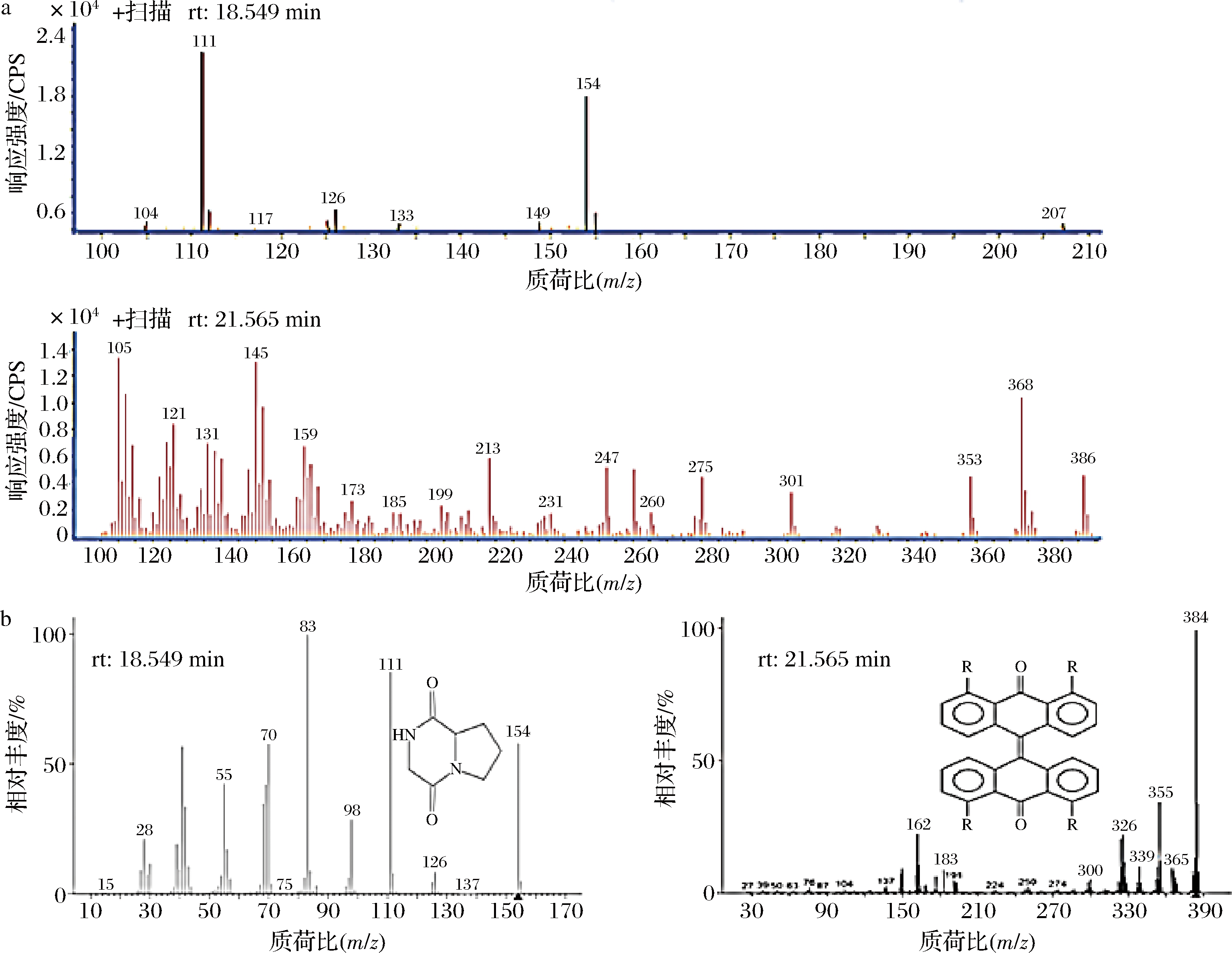
a-色素质谱;b-质谱解析
图6 焦曲霉色素质谱及解析
Fig.6 The MS of Aspergillus ustus pigment and analysis
2.6 不同碳氮源对焦曲霉产色素的影响
选择不同的碳氮源作基础培养基,培养96 h,在298 nm 处检测OD值,以判断色素合成的最适碳氮源。不同碳氮源对焦曲霉色素产量的影响差异较大,其中葡萄糖与蛋白胨的组合,色素产量最高(图7),因此选择葡萄糖与蛋白胨为最适碳氮源作进一步优化试验。
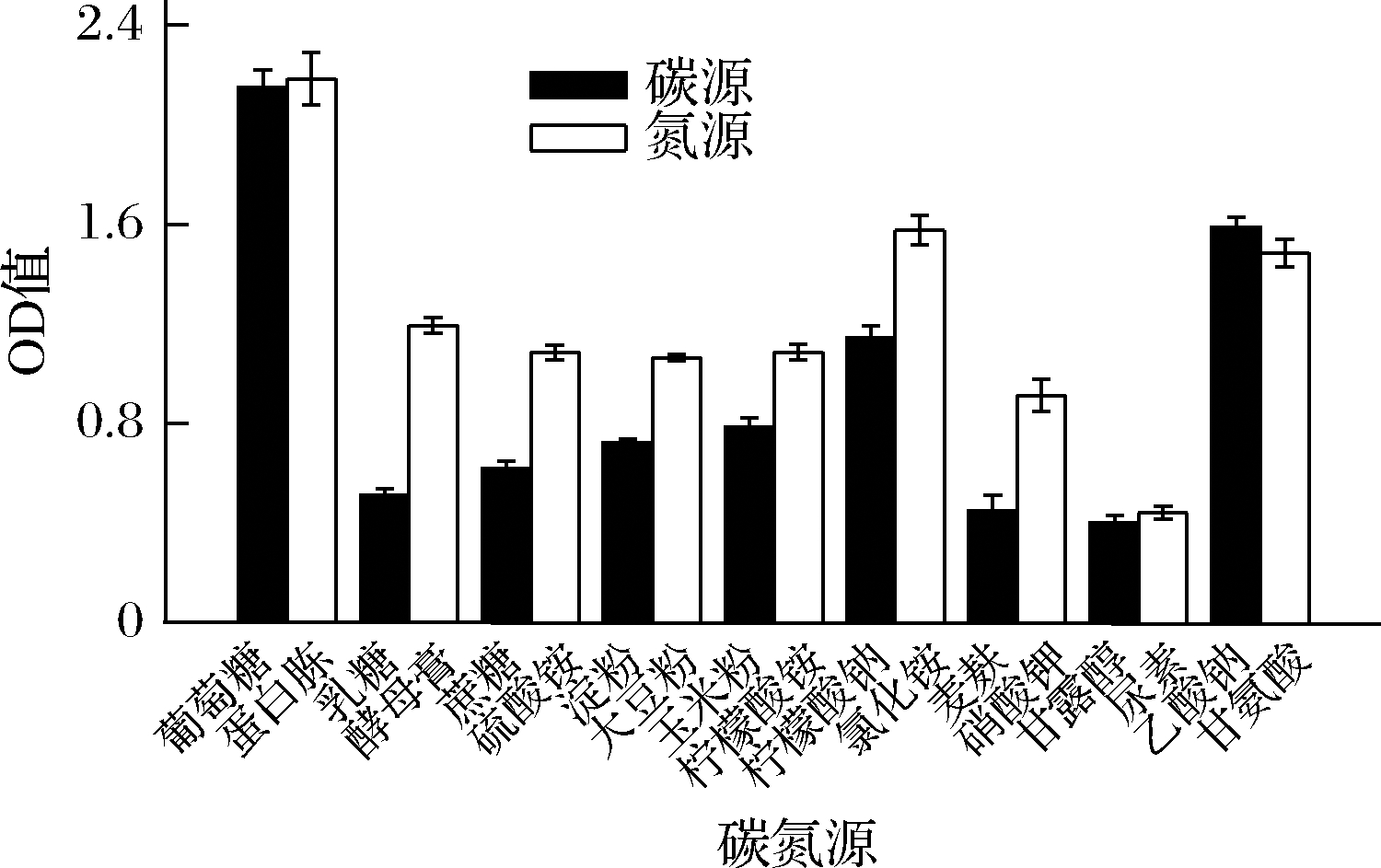
图7 碳氮源试验
Fig.7 Carbon and nitrogen source test
2.7 产色素条件的优化
利用均匀设计法(uniform design,UD)对焦曲霉曲霉产色素条件进行优化,试验采用7因素12水平,每批实验做3次平行,利用Minitab数理统计软件对均匀设计水平与响应值(表2)进行二元回归模型建立,得到方程1:Y=-13.7+1.35X1+0.551X2+0.007 55X3+0.036 8X4+0.458X5+0.024 8X6-![]()
表2 均匀设计与响应因子
Table 2 Uniform design and response factors
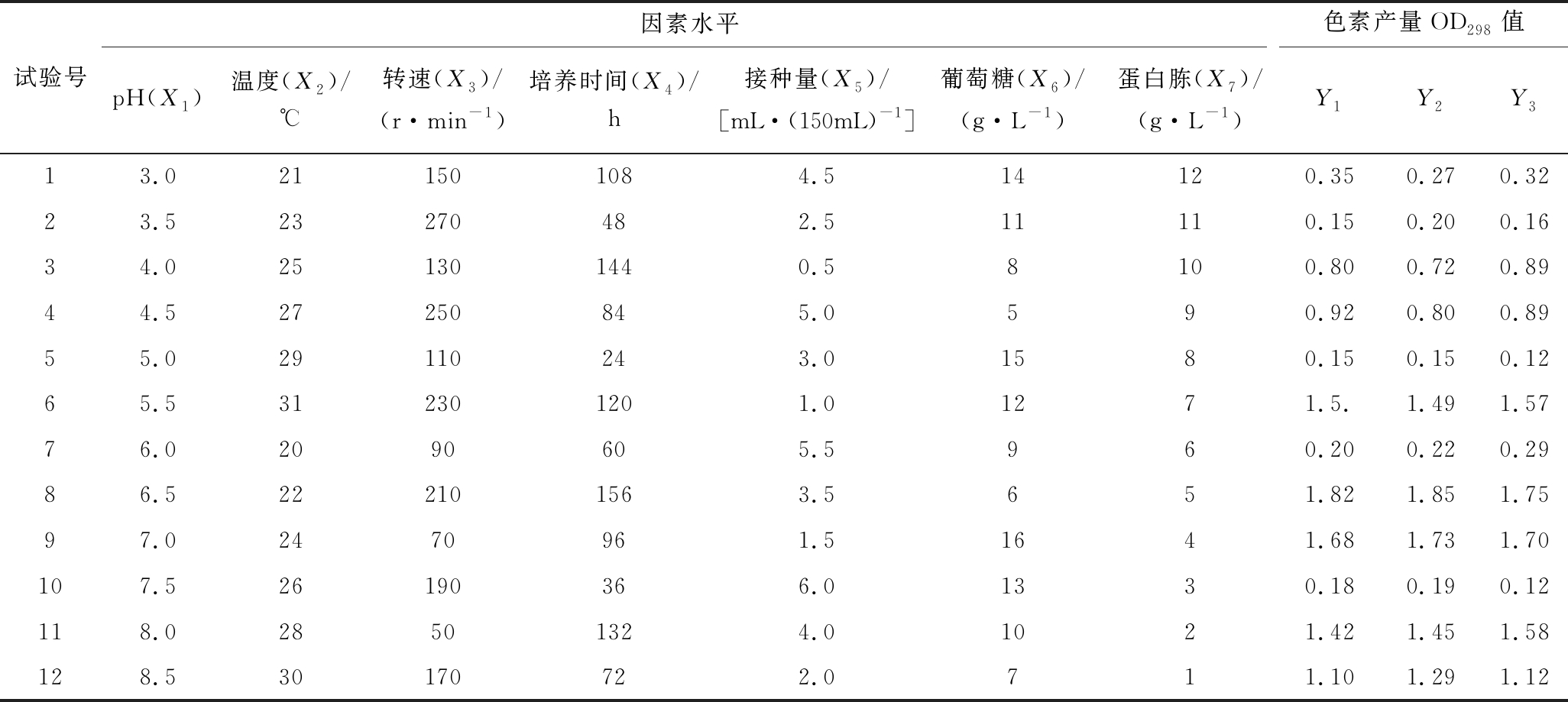
试验号因素水平色素产量OD298值pH(X1)温度(X2)/℃转速(X3)/(r·min-1)培养时间(X4)/h接种量(X5)/[mL·(150mL)-1]葡萄糖(X6)/(g·L-1)蛋白胨(X7)/(g·L-1)Y1Y2Y313.0211501084.514120.350.270.3223.523270482.511110.150.200.1634.0251301440.58100.800.720.8944.527250845.0590.920.800.8955.029110243.01580.150.150.1265.5312301201.01271.5.1.491.5776.02090605.5960.200.220.2986.5222101563.5651.821.851.7597.02470961.51641.681.731.70107.526190366.01330.180.190.12118.028501324.01021.421.451.58128.530170722.0711.101.291.12
并对试验结果的各个因素进行显著性检验与回归模型方差分析,7个因素中有pH、温度、摇床转速、孢子悬液接种量、发酵时间、葡萄糖6个因素显著(P<0.05)(表3),说明该6个因素对焦曲霉生产色素具有较大影响,而蛋白胨的量对色素的产生影响不显著。R2为99.2%,说明99.2%试验数据可以以此模型解释,达到试验要求,P值为0,该模型具有显著意义(表4)。应用MatlabR2012b软件解方程1获得焦曲霉产色素最优条件为:pH 7.1、温度 25.8 ℃、转速221.8 r/min、脱色时间128.7 h、接种量2.8 mL/150mL、葡萄糖16 g/L、蛋白胨12 g/L,色素理论产量OD值2.62,在最优脱色条件下作验证试验,色素OD值达到2.48,与预测值相仿。
表3 回归方程系数显著性检验
Table 3 Significant testing of regression equation coefficients
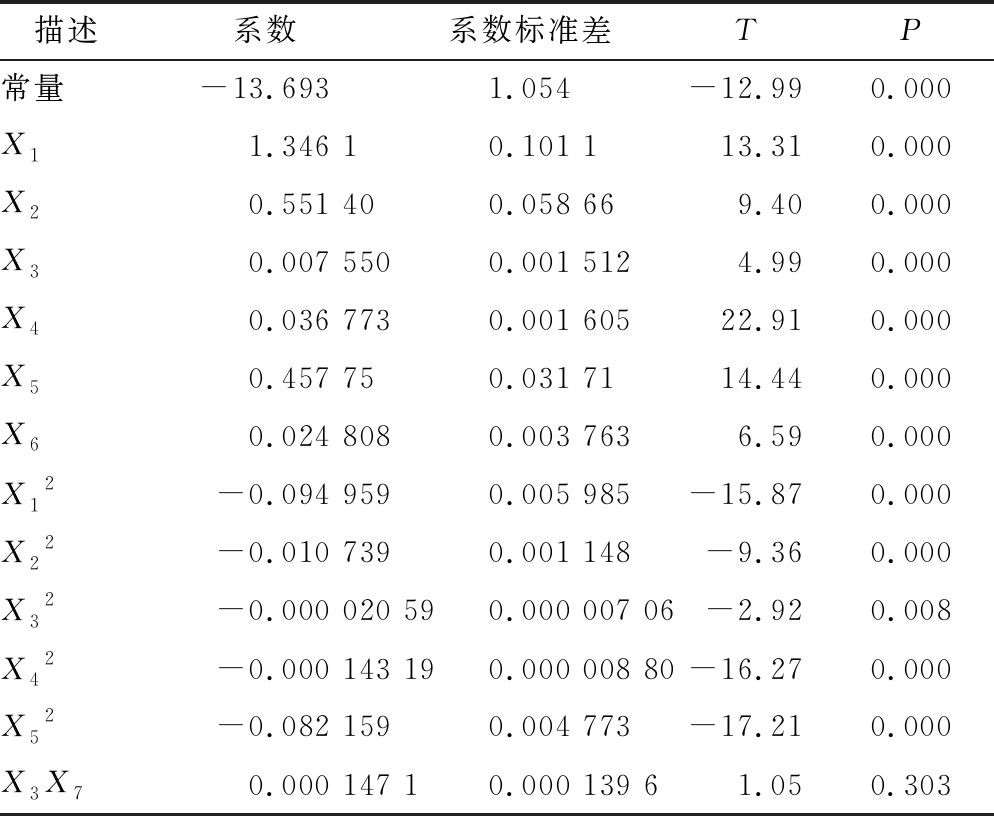
描述系数系数标准差TP常量-13.6931.054-12.990.000X11.346 10.101 113.310.000X20.551 400.058 669.400.000X30.007 5500.001 5124.990.000X40.036 7730.001 60522.910.000X50.457 750.031 7114.440.000X60.024 8080.003 7636.590.000X12-0.094 9590.005 985-15.870.000X22-0.010 7390.001 148-9.360.000X32-0.000 020 590.000 007 06-2.920.008X42-0.000 143 190.000 008 80-16.270.000X52-0.082 1590.004 773-17.210.000X3X70.000 147 10.000 139 61.050.303
表4 回归模型方差分析
Table 4 Variance analysis of regression model
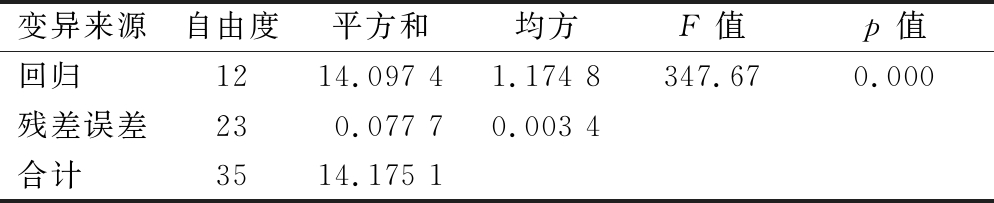
注:R2=99.2%
变异来源自由度平方和均方F 值p 值回归 1214.097 41.174 8347.670.000残差误差230.077 70.003 4合计 3514.175 1
3 讨论
研究发现大多数微生物均能产生色素,且很多色素具有生物学活性,如抗菌、抗癌、抗辐射和抗氧化等,但实际应用较少,目前唯一能够大规模实际应用的只有红曲色素,主要是由于微生物色素的稳定性易受到外界物化因素的影响,优良产色素菌株的缺乏、色素往往伴随着毒素的产生以及色素提纯较难等,限制了微生物色素的实际应用[10]。本研究分离的1株焦曲霉,产生的色素丰富,色泽鲜艳,且是胞外水溶性的色素,易于提取,为实际应用提供一定的基础。
色素的分离纯化及结构鉴定,有利于研究红色素的功能性及其稳定性,薄层层析法、柱层析法、HPLC、GC-MS等都是色素分离纯化的主要方法[11-12]。硅胶薄层层析以及柱层析分离纯化色素操作方便,分析速度快,分离效果好,不需要昂贵的仪器设备,只要通过使用不同的展开剂,就能够得到所需要的色素条带,并且结果直观、分离能力较好[13]。本研究得到的焦曲霉色素,利用不同的展开剂在硅胶板上进行薄层层析,能得到单一斑点的色素,分离效果较好,并通过柱层析得到色素精提物滤液,以便进行化学结构的鉴定。GC-MS色谱图显示,检测出色素主要有2种物质,气化温度分别在235 ℃与265 ℃左右,质谱检测并与NIST图库比对,得到了2种物质的结构,分别为吡咯吡嗪二酮与二蒽酮类,显示的结构与红外检测的基团吸收峰基本一致,吡咯吡嗪二酮类是一种拟肽化合物,具有保护神经、抗菌等多种生物活性[14],而且吡咯吡嗪二酮作为发色体应用于染料工业中,该发色体,色泽明亮,多为橙黄色[15];而作为母体结构的二蒽酮类是一般呈黄色,二蒽酮类衍生物主要存在豆科灌木植物狭叶或尖叶番茄中,是一种植物性聚酮类色素,具有泻下、止血、抗菌抗病毒的功能[16-17];蒽醌和萘醌等聚酮类化合物是真菌常见的色素类化合物,已发现了大约700种蒽醌类化合物,如常见且应用于食品工业的红曲霉素就是由红曲霉产生的聚酮类色素[18],但具有二蒽酮结构的聚酮类色素产生还未见报道,因此,焦曲霉色素可能同时含有吡咯吡嗪二酮与二蒽酮类化学结构的一种复合色素,是一种全新的微生物源类色素,且该两种物质结构具有较多的生物活性,后续需进一步对该色素的稳定性进行研究,包括高温、光照、重金属以及还原与氧化剂对色素稳定性的影响,为实际应用奠定基础。均匀设计法常应用于因素水平较多的实验设计,相比于正交设计、响应面设计,具有试验次数少、布点更均匀、更高效等特点,能够快速有效地实现条件优化[19-20]。
[1] MUMTAZ R, BASHIR S, NUMAN M, et al. Pigments from soil bacteria and their therapeutic properties: A mini review[J]. Current Microbiology, 2019, 76(6): 783-790.
[2] ADHIKARI P, PANDEY A. Antimicrobial compound production by pigment producing endophytic bacterium (Burkholderia sp. GBPI_TWL) isolated from Taxus wallichiana Zucc[J]. Biologia, 2021, 76(11): 3 567-3 578.
[3] VENIL C K, ZAKARIA Z A, AHMAD W A, et al.Bacterial pigments and their applications[J].Process Biochemistry, 2013,48(7):1 065-1 079.
[4] FARIQ A, YASMIN A, JAMIL M. Production, characterization and antimicrobial activities of bio-pigments by Aquisalibacillus elongatus MB592, Salinicoccus sesuvii MB597, and Halomonas aquamarina MB598 isolated from Khewra Salt Range, Pakistan[J]. Extremophiles, 2019, 23(4): 435-449.
[5] RAO M P N, XIAO M, LI W J.Fungal and bacterial pigments:Secondary metabolites with wide applications[J].Frontiers in Microbiology, 2017, 8:1113.
[6] DUFOSSÉ L, FOUILLAUD M, CARO Y, et al.Filamentous fungi are large-scale producers of pigments and colorants for the food industry[J].Current Opinion in Biotechnology, 2014, 26:56-61.
[7] 董雪田, 朱恺丽, 曲音波, 等.一种快速提取三孢布拉霉基因组的方法[J].食品与生物技术学报, 2021, 40(10):63-71.
DONG X T, ZHU K L, QU Y B, et al.Rapid method of genome extraction of Blakeslea trispora[J].Journal of Food Science and Biotechnology, 2021, 40(10):63-71.
[8] ASAI T, TSUKADA K, ISE S, et al.Use of a biosynthetic intermediate to explore the chemical diversity of pseudo-natural fungal polyketides[J].Nature Chemistry, 2015, 7(9):737-743.
[9] 傅建熙. 有机化学:结构和性质相关分析与功能[M].第四版, 北京:高等教育出版社, 2018:32-36.
FU J X.Organic Chemistry:Structure and Property Correlation Analysis and Function[M].4th ed, Beijing:Higher Education Press,2018:32-36.
[10] 范菲, 段雅丽, 刘亚鹏, 等.鉴定红曲菌中萘醌响应基因提高红曲色素产率[J].食品与发酵工业, 2022, 48(5):35-40;46.
FAN F, DUAN Y L, LIU Y P, et al.Identification of naphthoquinone-responsive gene in Monascus strain for improvement of Monascus pigments yield[J].Food and Fermentation Industries, 2022, 48(5):35-40;46.
[11] 钮怡清. 高效液相色谱法检测辣椒、花椒粉中五种合成色素[J].食品与发酵工业, 2021, 47(24):256-260.
NIU Y Q.Determination of five kinds of synthetic pigments in chili powder and paprika powder by HPLC[J].Food and Fermentation Industries, 2021,47(24):256-260.
[12] TSIAKA T, LANTZOURAKI D Z, SIAPI E, et al.Macular carotenoids in lipid food matrices:DOE-based high energy extraction of egg yolk xanthophylls and quantification through a validated APCI(+) LC-MS/MS method[J].Journal of Chromatography B, 2018, 1 096:160-171.
[13] YANG H H, LI J, WANG Y, et al.Identification of water-soluble, Monascus, yellow pigments using HPLC-PAD-ELSD, high-resolution ESI-MS, and MS-MS[J].Food Chemistry, 2018, 245:536-541.
[14] 张崇敬, 张志辉, 徐柏玲.微波辐射固相合成cis-和trans-3-(3,4-二羟基苄基)-六氢吡咯并[1,2-α]哌嗪-1,4-二酮[J].合成化学, 2008, 16(4):398-401;409.
ZHANG C J, ZHANG Z H, XU B L.Synthesis of cis-and trans-3-(3, 4-dihydroxybenzyl) -hexahydropyrrole[1,2-α] piperazine-1, 4-dione under microwave irradiation in solid phase[J].Synthetic Chemistry, 2008, 16(4):398-401;409
[15] 郭晓莎,陈亮亮,张关心.侧链含自由基单元的1,4-吡咯并吡咯二酮共轭聚合物的合成和半导体性质研究[J].化学通报, 2020, 83(8):711-717.
GUO X S, CHEN L L,ZHANG G X.Synthesis and semiconducting properties of 1,4-diketopyrrolopyrrole-based conjugated polymers with 2,2,6,6-tetramethyl-1-piperidinyloxyl units in the side chains[J].Chemistry, 2020, 83(8):711-717.
[16] 苏萍, 陈影, 张海静, 等.苏龙嘎-4颗粒抗番泻叶诱导腹泻的机理研究[J].中药药理与临床, 2020, 36(6):176-181.
SU P, CHEN Y, ZHANG H J, et al.Study on mechanism of Sulongga-4 granules against diarrhea induced by senna leaves[J].Pharmacology and Clinics of Chinese Materia Medica, 2020, 36(6):176-181.
[17] 张新娜, 潘赛超, 张旭冬, 等.高效液相色谱-串联质谱法同时测定番茄中的番茄苷与番茄碱[J].食品科学, 2019,40(22):236-242.
ZHANG X N, PAN S C, ZHANG X D,et al. Simultaneous determination of tomatine and tomatidine in tomatoes by high performance liquid chromatography-tandem mass spectrometry[J].Food Science, 2019, 40(22):236-242.
[18] 于雪, 张威, 吴玉洁, 等.微生物产色素机制及其生物活性[J].微生物学报, 2022, 62(4):1 231-1 246.
YU X, ZHANG W, WU Y J, et al.Production mechanism and biological activity of microbial pigments[J].Acta Microbiologica Sinica, 2022, 62(4):1 231-1 246.
[19] 唐启义, 冯明光.实用统计分析及其DPS数据处理系统[M].北京:科学出版社, 2002:267-295.
TANG Q Y, FENG M G.Practical Statistical Analysis and DPS Data Processing System[M].Beijing:Science Press, 2002:267-295.
[20] 方开泰, 马长兴.正交设计与均匀设计[M].北京:科学出版社, 2001:83-231.
FANG K T, MA C X.Orthogonal Design and Uniform Design[M].Beijing:Scie nce Press China, 2001:83-231.