乳液是一种具有三维网状结构的分散体系,因其具备保护芯材活性、控制芯材释放及对疏水或亲水芯材包埋的非限制性等优良特性,使其在医药、食品和化妆品等行业中被广泛应用。乳液制备过程中,乳化材料的选择尤为重要,常用的乳化剂大致可分为固体颗粒材料和表面活性剂两大类[1]。有研究表明,表面活性剂制备的乳液稳定性较差,且在食品中使用时易引起肠道炎症和其他有关肠道健康的不良病症[2],而部分固体颗粒稳定剂在食品应用中的安全性要远高于表面活性剂,这使其成为乳液制备中较好的选择。基于固体颗粒稳定的乳液又被称为Pickering乳液[3]。起初制备Pickering乳液的固体颗粒多为有机聚合物或无机颗粒,但这两类颗粒的安全性、生物可降解性和生物相容性较差[4],致使其在食品、医药行业中的应用受到了一定限制。进而人们逐渐将研究目标转向天然大分子颗粒,如:蛋白、多糖、几丁质等[5]。
淀粉作为天然的大分子多糖,因高产、价格便宜、颗粒小、无过敏性、生物可降解等特点,使其成为Pickering乳液生产中极具应用价值的稳定剂。但天然淀粉分子中多羟基(—OH)的亲水结构,降低了其在油水两相界面上的吸附能力,致使天然淀粉(native starch,NS)的乳化能力较弱。将疏水基团引入NS可增加其对油水两相的双重润湿性能,达到提升其乳化能力的目的,从而制备出更加优质的Pickering乳液。目前,淀粉疏水改性研究最多的基团为辛烯基琥珀酸酐(octenyl succinic anhydride,OSA),用其改性后NS颗粒的乳化性和乳化稳定性均得到了有效提高[6-7]。但食品级OSA改性淀粉的最大改性程度为3%,即取代度(degree of substitution,DS)最高为0.1[8],故在一定程度上限制了其乳化能力的提升。近年来,脂肪酸对淀粉的疏水改性也逐渐引起了学者们的广泛关注。GARC A-TEJEDA等[9]以合成的月桂酸改性苋菜淀粉为稳定剂制备Pickering乳液,发现月桂酸改性显著提高了天然苋菜淀粉的乳化性和乳化稳定性。LU等[10]通过使用月桂酸对高直链玉米淀粉疏水改性研究发现,月桂酸改性淀粉的乳化能力与取代度呈正相关,所得Pickering乳液在不同离子强度、pH和热处理条件下均表现出良好的稳定性。
A-TEJEDA等[9]以合成的月桂酸改性苋菜淀粉为稳定剂制备Pickering乳液,发现月桂酸改性显著提高了天然苋菜淀粉的乳化性和乳化稳定性。LU等[10]通过使用月桂酸对高直链玉米淀粉疏水改性研究发现,月桂酸改性淀粉的乳化能力与取代度呈正相关,所得Pickering乳液在不同离子强度、pH和热处理条件下均表现出良好的稳定性。
目前脂肪酸改性淀粉的相关研究主要集中在中长链脂肪酸,而短链脂肪酸对人体免疫调节和肠道菌群平衡具有重要作用,在食品和医药行业被广泛研究。丁酸是由结肠微生物群经发酵产生的短链脂肪酸,可通过减少胺类物质的产生、抑制肠黏膜细胞的增生,来降低人体结肠癌的患病率[11]。DAI等[12]通过研究丁酸酐改性玉米淀粉的结构特性和功能特性发现,其取代度和凝胶特性、热稳定性及抗消化性成正相关,且体外发酵试验中丁酸酐改性淀粉产生的丁酸浓度最高为NS的235倍,达到786.09 μmol/L。因此,丁酸酐改性淀粉作为功能性成分的颗粒在食品和医药等行业中具有很好的应用前景。
丁酸酐改性淀粉的功能特性已有相关研究,但基于丁酸的疏水结构特性,以其作为Pickering乳液稳定剂的相关研究鲜有报道。本研究以玉米淀粉为原料,且为进一步提高反应率、加深改性程度,选用酶法制备的多孔淀粉(porous starch,PS)为反应主体,丁酸酐为客体对PS进行结构改性,并以丁酸酐改性多孔淀粉(butyric anhydride porous starch ester,BA-PS)为稳定剂制备Pickering乳液,对其乳化性能进行研究。旨在为丁酸酐改性淀粉的选择与应用提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
玉米淀粉、α-淀粉酶(α-amylase,AM,10万 U/g)、淀粉葡糖苷酶(amyloglucosidase,AMG,10万U/mL)、正丁酸酐(分析纯),上海源叶生物科技有限公司;玉米油(试剂级),上海麦克林生化科技有限公司;DMSO-d6(纯度≥99.9%),剑桥同位素实验室;其他试剂均为分析纯。
1.2 仪器与设备
HWS-12电热恒温水浴锅,上海一恒科技有限公司;ASAP 2020全自动比表面积及孔隙度分析仪,美国麦克公司;JSM-6701F冷场发射型扫描电子显微镜,日本电子光学公司;NEXUS-670傅立叶红外光谱仪,美国Thermo公司;AVANCE III HD 400 MHz超导核磁共振波谱仪,瑞士Bruker公司;X′Pert-Pro MPD多晶粉末X射线衍射仪,荷兰PANalytical公司;FJ 200-SH高速均质机,上海韬越机械科技有限公司;Bettersize 2600激光粒度分布仪,丹东市皓宇科技;BX 53 MP奥林巴斯Olympus偏光显微镜,杭州物微仪器有限公司。
1.3 实验方法
1.3.1 PS的制备
参照DURA等[13]的方法稍做修改。将10.0 g玉米淀粉悬浮于pH为6.6的磷酸盐(60 mL)和pH为 4.5的醋酸盐(20 mL)混合缓冲液中,40 ℃水浴搅拌20 min。在分散后的淀粉悬浮液中加入淀粉质量4.5%的AM和AMG[m(AM)∶m(AMG)= 1∶2]的混合酶于55 ℃水浴搅拌24 h(100 r/min),得到的淀粉浆用1 mol/L的NaOH溶液调pH至10.0,使酶解反应终止。将悬浮液离心(4 ℃,7 000 r/min)处理10 min,沉淀用蒸馏水重复洗涤3次。收集的沉淀物冷冻干燥,研磨过筛(100目)后置于干燥器备用。
1.3.2 BA-PS的制备
参照ZHANG等[14]的方法并做适当修改。将3.0 g PS分散在水中(质量分数为30%),40 ℃水浴搅拌20 min使悬浮液充分分散。用30 g/L NaOH溶液调pH至8.5,按不同摩尔比,将一定量丁酸酐乙醇溶液缓慢滴加至淀粉浆中,并不断向其加NaOH溶液维持反应体系pH至8.5左右,滴加完成后经40 ℃反应2 h,反应结束后用3%(体积分数) HCl溶液调体系pH至6.5,混合物离心(6 000 r/min,10 min)并用蒸馏水洗涤2次,无水乙醇洗涤3次,收集沉淀,索式抽提36 h。最终得到的样品置于40 ℃烘箱干燥8 h,研磨过100目筛,并置于干燥器备用。将改性后的淀粉分别命名为BA-PS-1、BA-PS-2和BA-PS-3。
1.3.3 N2-吸附/脱附等温线测定
采用Micromeritics ASAP 2020系统,对NS与PS的N2-吸附/脱附等温线进行测量,结束后利用非定域密度泛函理论,从吸附数据中得到孔径的尺寸分布曲线。样品的比表面积依据BET(brunauer emmett teller)多层吸附理论计算。
1.3.4 扫描电子显微镜(scanning electron microscope,SEM)颗粒形态观察
取少量样品粉末于样品座上,之后将样品座置于离子溅射仪中镀金60 s。用SEM分别在2 000和5 000 倍下观察样品的表观形态。
1.3.5 丁酸酐改性淀粉取代度的计算
参照NAMAZI等[15]的方法,采用1H核磁共振谱图对BA-PS的取代度进行计算。
(1)核磁共振氢谱(1H nuclear magnetic resonance,1H NMR)检测
将一定量的样品装入核磁管并加入DMSO-d6使样品充分溶解。检测前进行30 s超声处理除去样品中溶解氧对试验结果的影响。
(2)取代度计算
取代度由氢谱图中0.86处脂肪酸末端链上3个质子峰面积与4.50~5.50淀粉葡萄糖单元中1号位氢和2、3、6号位羟基的质子峰面积和之比计算而来。计算如公式(1)所示:
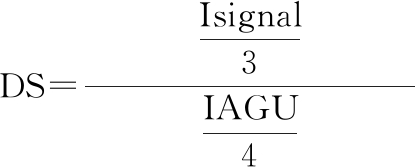
(1)
式中:Isignal,甲基的3个质子信号积分;IAGU,4.50~5.50的4个质子的积分。
1.3.6 傅里叶红外光谱(Fourier transform infrared spectroscopy,FT-IR)测定
称取2 mg完全干燥的样品粉末,并加入一定量的溴化钾混合碾磨,待其均匀无颗粒感后进行压片,制作好的溴化钾片在4 000~500 cm-1进行扫描测定。
1.3.7 X射线衍射(X-ray diffraction,XRD)测定
采用XRD对样品的结晶结构进行测定与分析。测试条件:扫描范围5°~35°;扫描速度2°/min;扫描步长0.06;方式:连续扫描。
1.3.8 乳化性能检测分析
1.3.8.1 淀粉Pickering乳液的制备
参照LEE等[16]的方法并做修改。称取一定量的淀粉样品(0.5 g淀粉/mL油),制备油体积分数为10%的O/W Pickering乳液。具体操作:将NS、PS、BA-PS-1、BA-PS-2和BA-PS-3分别分散在5 mmol/L,pH为7.0的磷酸盐缓冲溶液中,超声分散3 min后,向其中加入相应量的玉米油,匀浆机18 000 r/min均质120 s。所得乳液分别命名为NSE、PSE、BA-PS-1E、BA-PS-2E和BA-PS-3E。得到的新鲜乳液移取一部分于4 ℃静置20 d,对其乳化性和乳化稳定性进行观察和测定。
1.3.8.2 乳液粒度分布分析
采用Bettersize 2600激光粒度分布仪对制备的乳液进行粒径分布检测。以蒸馏水为分散介质,取少量乳液分散其中,达到适当遮光率,适度超声使乳液颗粒分散并保持相对稳定。粒度表示为平均体积径D[4,3],并对其进行分析。
1.3.8.3 乳液微观形态观察
采用Olympus BX 53光学显微镜观察乳液的形态。将乳液以1∶5的体积比用磷酸盐缓冲液稀释,并取1滴于载玻片后,显微镜放大20倍进行观察拍摄。
1.3.8.4 乳液表观稳定性分析
制备得到的乳液,装入玻璃血清瓶中密封,防止水分蒸发。4 ℃放置20 d后对乳液状态进行观察拍照。
1.4 统计分析
每组试验重复3次,采用Origin 8及SPSS 22等软件对数据进行统计分析。数据用平均值±标准差的形式表示。
2 结果与分析
2.1 多孔淀粉的孔结构表征
2.1.1 多孔淀粉SEM颗粒形态分析
不同放大倍数下的NS和PS的SEM结果显示如图1所示:NS的颗粒形态呈不规则的多边体或球形,颗粒表面较为平滑,且无肉眼可见的孔结构(图1-a、图1-b);PS颗粒呈现出较多孔径均匀且延伸到颗粒内部的孔洞(图1-c、图1-d),整个淀粉颗粒呈蜂窝状结构。这是由于在酶解过程中,外切型酶先作用于淀粉颗粒,对颗粒非还原性末端的α-1,4和α-1,6等糖苷键开始水解,使颗粒表面的无定形区被水解出细小的孔,然后内切型酶进入小孔内随机对淀粉的α-1,4糖苷键进行水解,为外切型酶提供更多新的水解位点,2种酶通过这种协同作用,使淀粉颗粒最终被水解成大量随机分布的孔洞结构[13,17]。这种孔结构可为客体分子暴露出更多的羟基位点来与其接触并反应。

a-NS×2 000;b-NS×5 000;c-PS×2 000;d-PS×5 000
图1 NS和PS的SEM图
Fig.1 SEM images of natural starch and porous starch
2.1.2 多孔淀粉N2-吸附/脱附分析
NS与PS的N2-吸脱附分析结果如图2所示,NS平均孔径为5.39 nm,利用BET模型计算出NS的比表面积为1.57 m2/g,这是由于在检测时淀粉颗粒间的堆积和天然玉米淀粉本身存在一些细小的肉眼不可见的孔结构所产生的;酶修饰后的PS平均孔径增大到11.13 nm,比表面积增大到3.914 4 m2/g。
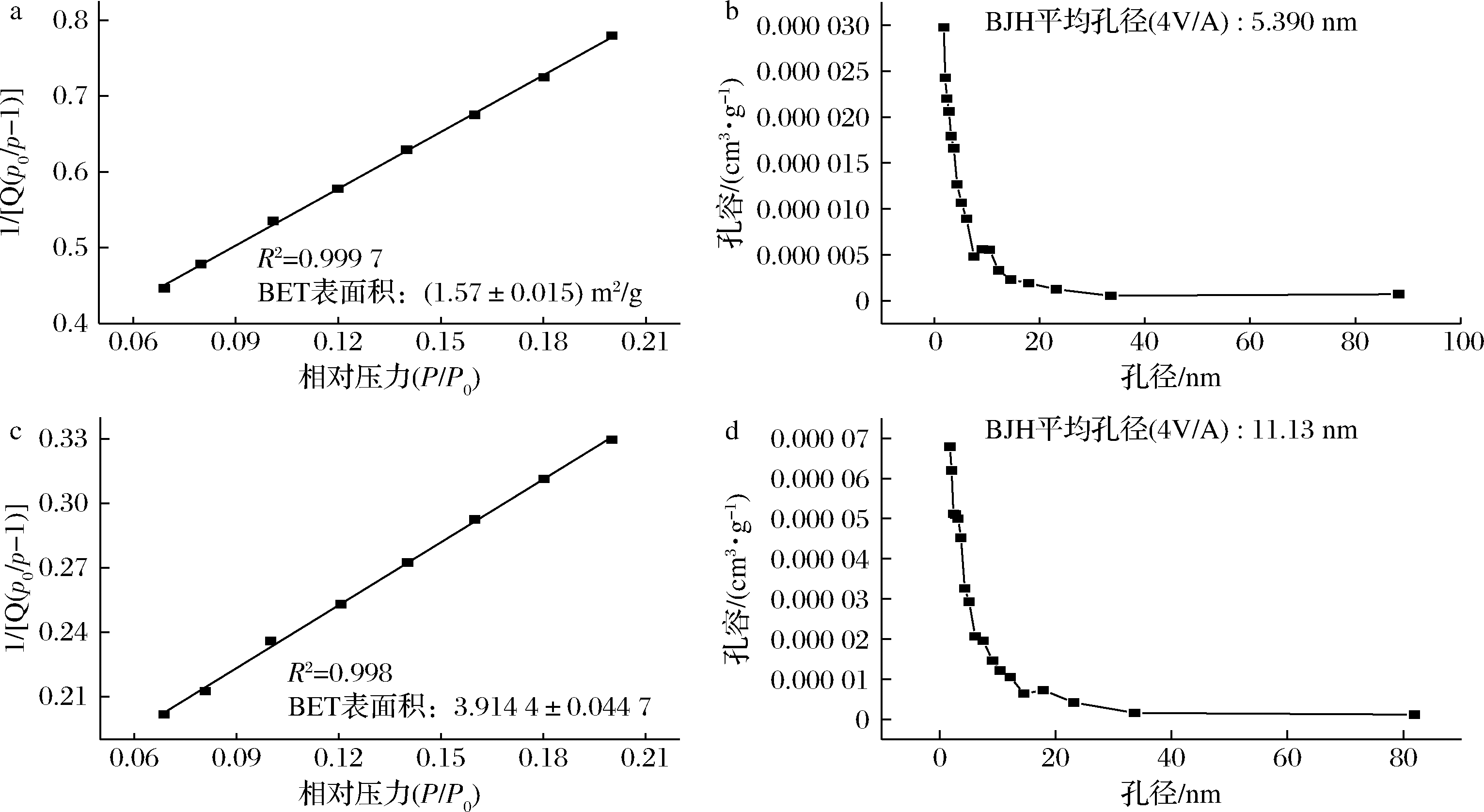
a-NS BET表面积图;b-NS孔径图;c-PS BET表面积图;d-PS孔径图
图2 天然淀粉和多孔淀粉的孔径分布及BET表面积图
Fig.2 Pore size distribution and BET surface area of natural starch and porous starch
2.2 丁酸酐改性多孔淀粉的结构表征
2.2.1 丁酸酐改性多孔淀粉的取代度
淀粉葡萄糖残基中2、3和6号位碳原子上的羟基最容易作为活性位点与客体分子发生反应[18],使淀粉改性。但天然玉米淀粉颗粒较为完整,暴露出能参与反应的羟基数量有限,而PS在酶改性过程中淀粉颗粒比表面积增大,颗粒内部被酶水解产生更多的羟基结构,这使得主体与客体分子的碰撞率增大、反应位点增多,提高了客体分子的利用度和整体的反应效率。LI等[19]发现,在相同条件下制备的OSA改性酶解PS的取代度高于OSA改性天然淀粉。BA-PS的取代度根据样品1H NMR谱图进行计算,结果如表1所示。随着反应体系中淀粉葡萄糖单元的羟基(—OH)与丁酸酐水解后游离羧基(—COOH)的摩尔比增大,BA与PS的分子碰撞率越高,丁酸酐改性淀粉的取代度逐渐增大。
表1 BA-PS的取代度
Table 1 DS of butyric anhydride modified porous starch
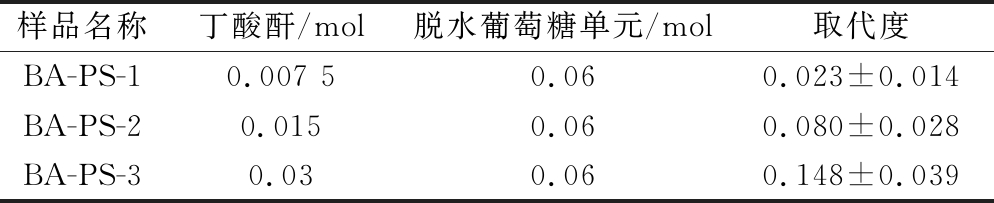
样品名称丁酸酐/mol脱水葡萄糖单元/mol取代度BA-PS-10.007 50.060.023±0.014BA-PS-20.0150.060.080±0.028BA-PS-30.030.060.148±0.039
2.2.2 1H NMR分析
不同样品的1H NMR谱图如图3所示。与NS、PS相比,酯化改性过程中丁酸酐的引入使得BA-PS的质子共振图谱中出现了BA的信号峰。酯化后BA-PS结构中脂肪酸酰基链末端甲基的3个质子(H-9)信号约为0.86处;羰基旁边的第2个亚甲基的2个质子(H-8)信号为1.48处;羰基旁边紧挨的第1个亚甲基的2个质子(H-7)信号为2.20处[15]。H-9、H-8和H-7处的信号强度随反应体系中—COOH与—OH摩尔比增加而增强,对应的取代度逐渐增大。随着酯化反应的发生,BA质子共振谱图(图3-a)中12.00处羧基(—COOH)上的质子信号消失,这是由于在酯化过程中丁酸酐羧基与淀粉中羟基反应形成—COOR[20],该处信号消失也表明在反应结束后残留的BA已完全除去。
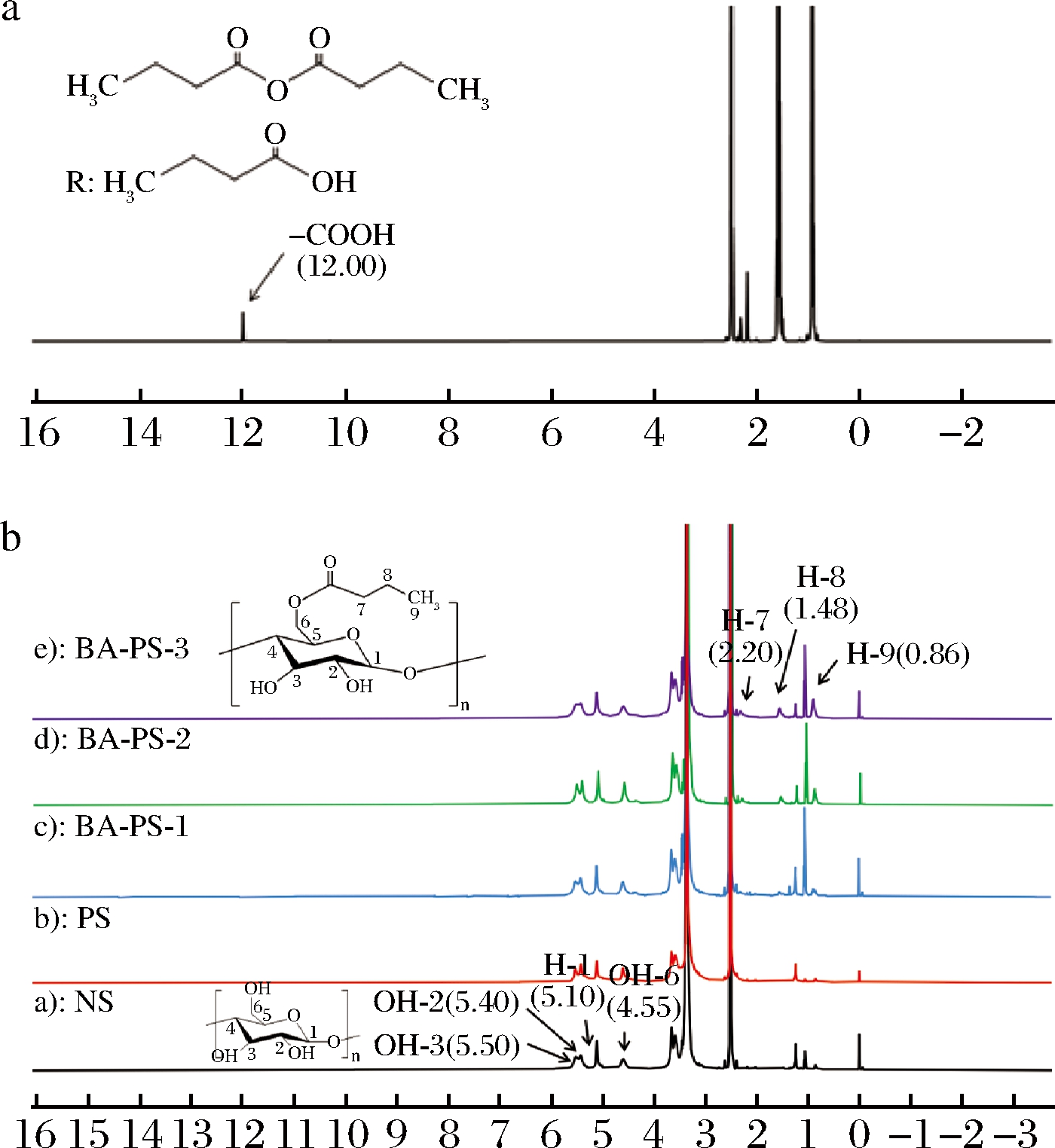
a-BA的1H NMR谱图;b-NS、PS和BA-PS的1H NMR谱图
图3 1H NMR波谱分析图
Fig.3 1H NMR spectrum analysis chart
2.2.3 SEM形态结构分析
不同改性程度的BA-PS的SEM如图4所示。淀粉颗粒酯化改性后保留了PS原有的颗粒形态,但随酯化反应的成功发生,会造成PS颗粒轻微的腐蚀现象,且随取代度的增加,BA-PS颗粒的腐蚀现象越严重。这与ZHANG等[21]用不同取代度OSA改性木薯淀粉研究中的观察结果一致。但由于本研究在酯化前对NS进行了多孔化处理,使本身只与淀粉表面接触的客体分子进入孔隙内部,增加了对淀粉颗粒的腐蚀程度。水相碱催化法制备的丁酸酐改性多孔淀粉保留了PS原有的多孔结构,在作为治疗结肠癌药物递送载体的应用中具有很好的潜力。

a-BA-PS-1;b-BA-PS-2;c-BA-PS-3
图4 丁酸酐改性PS的SEM图
Fig.4 SEM of butyric anhydride modified porous starch
2.2.4 FT-IR分析
酯化改性时淀粉葡萄糖单元中引入丁酸的结构,造成了淀粉分子化学结构的改变,该现象可以通过FT-IR光谱图(图5)得到证实。谱图中1 640和2 930 cm-1处分别对应的是淀粉葡萄糖结构中—CH—伸缩振动和结合水的弯曲振动;3 400 cm-1处为淀粉葡萄糖单元中—OH的伸缩振动[22]。与NS谱图相比,PS没有新的特征峰出现,这是由于在酶水解过程中,淀粉分子中非还原性末端的糖苷键被酶水解产生了孔结构,该过程可能会影响氢键的数量,但并没有新的官能团被引入和产生[23]。而BA-PS除了具有淀粉分子自身的特征峰外,在1 726 cm-1处出现了新吸收峰,该信号为羟基与羧基反应时所形成的酯基吸收峰(C![]() O)的伸缩振动,且随着取代度增加,峰强度逐渐增加,证明了该酯化反应的成功,这与1H NMR谱图中12.00处信号消失的结果相互印证。
O)的伸缩振动,且随着取代度增加,峰强度逐渐增加,证明了该酯化反应的成功,这与1H NMR谱图中12.00处信号消失的结果相互印证。

图5 NS、PS及BA-PS的FT-IR图
Fig.5 FT-IR of natural starch, porous starch and butyric anhydride modified porous starch
2.2.5 XRD分析
酶改性和酯化改性对天然淀粉结晶结构的影响如图6所示。NS的X射线衍射图中15°、17°、18°和23°处存在较强的衍射峰,表明天然玉米淀粉属于A型结晶。PS、BA-PS的X射线衍射图谱与NS表现出相同的信号衍射,表明酶改性和酯化改性都不会改变和破坏NS原有的结晶形态。这是由于这2种反应只发生在淀粉葡萄糖结构的非还原性末端,所以会使淀粉颗粒原有的结晶度有所降低,但晶型不被破坏。

图6 NS、PS和BA-PS的XRD图
Fig.6 XRD of natural starch, porous starch and butyric anhydride modified porous starch
2.2.6 乳液粒度分布
粒径分布分析是检测乳液稳定性的重要工具,从动力学的角度分析,在聚集速度相同的情况下,液滴尺寸越小,乳液分层所需要的时间越长[24]。图7为不同乳剂制备的Pickering乳液静置20 d后的粒径分布结果。PS颗粒的平均粒径主要分布在(13.47±0.01) μm(图7),NS乳化性差,制备的乳液均匀效果不好,乳液粒径检测呈三峰分布,第二峰与PS颗粒的峰重合,为游离的淀粉颗粒所分布的峰,第三峰为未被乳化的油滴的粒径分布。PSE的粒径分布为单峰分布,D[4,3]为(29.69±0.12) μm,且液滴尺寸较为均匀。3种不同改性程度的BA-PS制备的乳液平均体积径D[4,3]分别为(24.18±0.17)、(16.58±0.04)和(12.42±0.01) μm。与PS和NS相比,丁酸的引入可使淀粉颗粒制备出液滴尺寸较小的乳液,且随取代度的增加液滴尺寸逐渐减小。这是由于丁酸酐的疏水结构赋予淀粉颗粒一定的疏水性,使其在制备乳液时对油水界面的作用力增强,乳化性能增强。
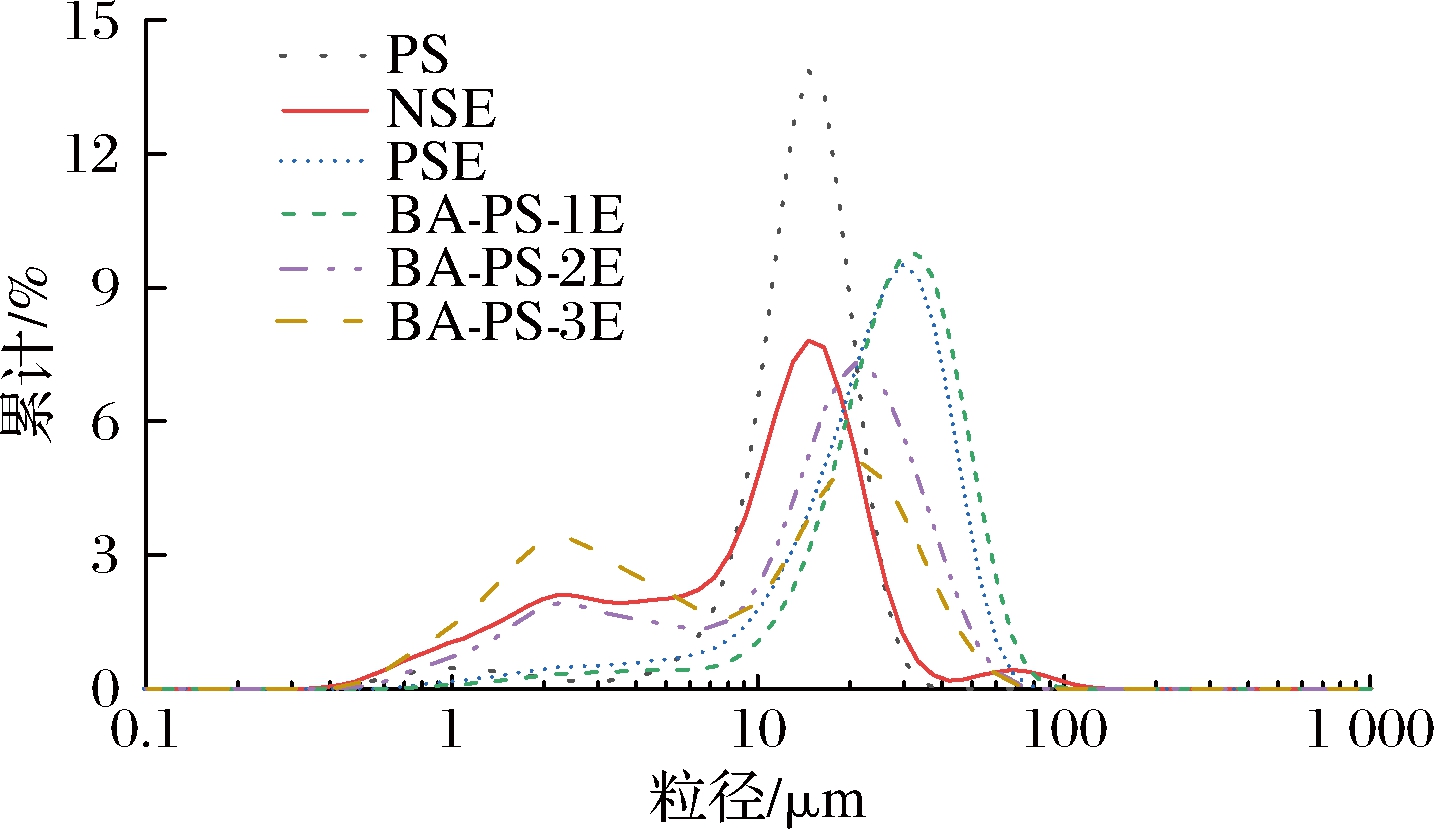
图7 不同乳剂制备的乳液粒径图
Fig.7 Particle size distribution drawing prepared by porous starch and different emulsions
2.2.7 乳液显微镜观察
不同乳剂制备的乳液静置20 d后的微观形态如图8所示。玉米原淀粉制备的乳液NSE(图8-a)在观察过程中,由于未盖盖玻片,且NS的乳化能力差,液滴伴随着分子运动,油相与水相分层,较大颗粒的油滴通过分子间作用力在液滴上层聚集,液滴边缘也可观察到少量聚集的油滴,这也是粒径检测中NSE出现三峰的原因。多孔淀粉制备的乳液PSE如图8-b所示,在观察过程中会出现和NS相同的油滴聚集现象,但与NS不同的是,PSE中存在少部分被乳化后分布在淀粉颗粒间的油滴,这是由于在酶改性过程中,NS颗粒中一部分无定型区的葡萄糖单元被水解,淀粉分子质量降低,乳化性能提升。LIU等[25]曾使用α-淀粉酶对OSA改性蜡质玉米淀粉进行水解来探究淀粉颗粒分子质量对其乳化性能的影响,发现摩尔质量降低后乳液的乳化性和乳化稳定性均有所提高。不同丁酸酐改性多孔淀粉制备的乳液如图8-c、图8-d、图8-e所示,BA-PS的乳化能力要明显优于PS和NS,油滴颗粒均匀分散,观察过程中液滴无分层和油滴聚集现象,且随取代度的增加,液滴尺寸逐渐减小,乳化效果越好。这是由于丁酸的引入使BA-PS在油水界面的双重润湿性增强,随改性程度增大,BA-PS在油水界面的可作用位点增加,且作用力增强,乳液高速剪切过程中淀粉充分填充于两相之间,使其形成颗粒小且稳定的乳液体系[26]。
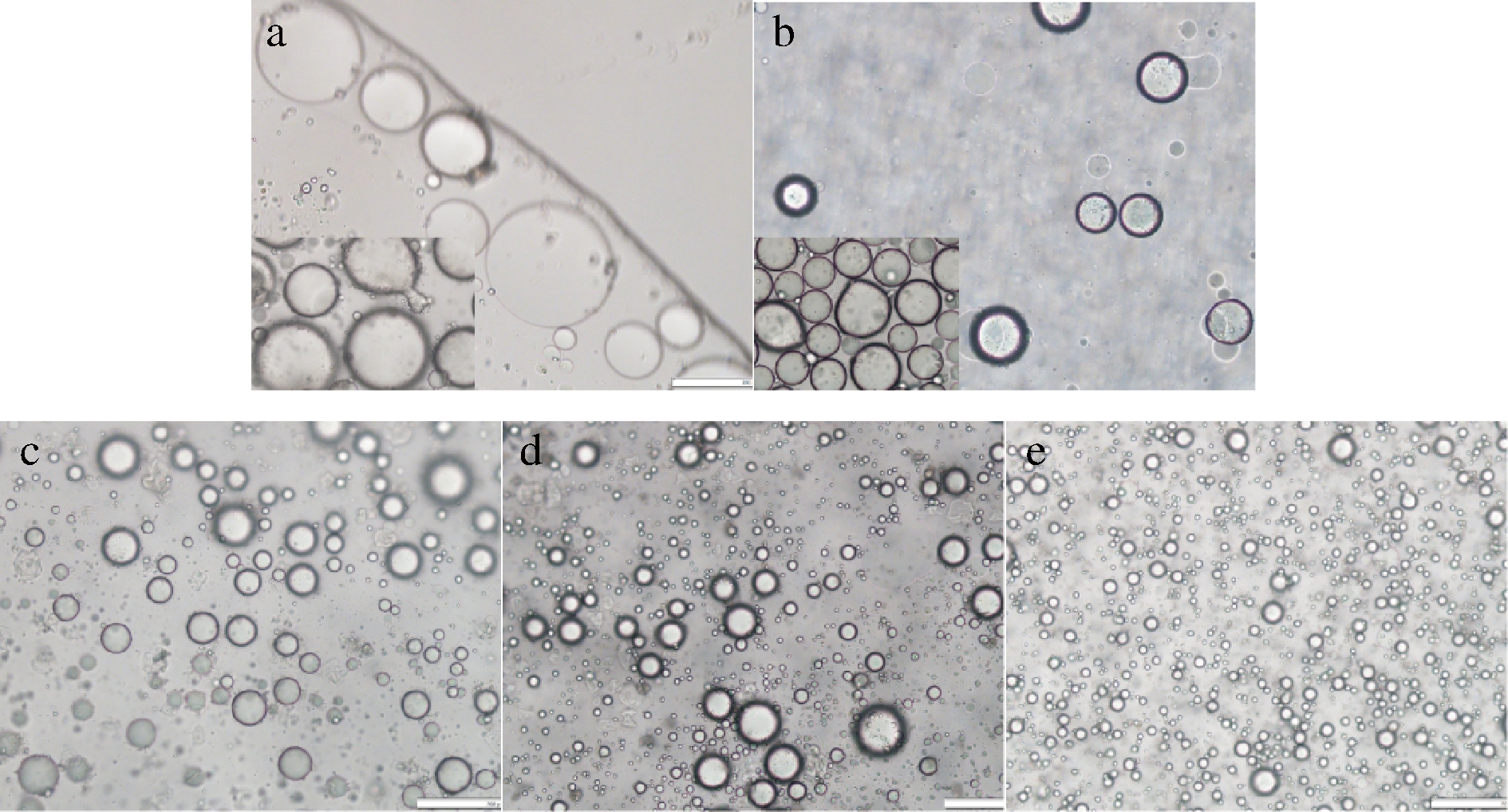
a-NSE;b-PSE;c-BA-PS-1E;d-BA-PS-2E;e-BA-PS-3E
图8 不同乳剂稳定的乳液贮存20 d显微镜图
Fig.8 Different emulsion stable emulsion microscope
2.2.8 乳液表观稳定性分析
不同乳剂制备的乳液表观稳定性分析如图9所示。不同乳剂制备的乳液静置20 d后,均出现了不同程度的分层现象,图中NSE结果表明,NS基本无乳化能力,静置后油相与水相完全分离。PS表现出一定的乳化能力,但其对油水两相的作用力较弱,使部分油滴裸露在淀粉颗粒外,造成最上层油滴的聚集。相比之下,BA-PS制备的乳液均表现出了较好的乳化性和乳化稳定性,且随取代度的增大,乳化层高度逐渐增大,乳化能力增强,BA-PS-3E静置后乳化层底部有清水析出,并且可推测出随着静置时间的延长,下层析出的水相体积逐渐增大直至不变,这是由于在乳液制备过程中BA-PS-3的疏水改性程度足以使其充分填充于油滴分子之间,之后在静电相互作用力下,使淀粉颗粒和液滴之间形成紧密的凝胶网络结构,将多余的水相挤出,该过程可以更好地形成液滴聚合网络,增强乳液的稳定性[27]。

图9 乳液贮存贮存20 d乳化稳定性分析表观图
Fig.9 The apparent diagram of emulsion stability analysis after 20 days of emulsion storage
3 结论
双酶法制备的PS颗粒在不破坏NS结构的基础上,赋予颗粒贯穿内部的孔洞结构,为酯化改性暴露出更多的接触位点,提高了反应率,且在一定程度上提升了酯化反应的取代度。酯化改性得到的BA-PS在保留PS多孔形态的基础上,颗粒发生一定程度的腐蚀,且随取代度增加而加深。乳化性能检测结果中,NS不具有乳化能力,酶改性使PS可对极少部分油滴颗粒发生乳化,NSE、PSE静置20 d后上层均有大量油滴析出,乳化效果差;而丁酸酐的疏水改性使PS的乳化性能显著提升,随取代度的增大,BA-PS的乳化能力逐渐增强,制备的Pickering乳液液滴尺寸逐渐减小,且不同改性程度的BA-PS稳定的乳液在20 d内均表现出较好的贮存稳定性。本研究制备的BA-PS保留了PS的多孔结构,可进一步作为载体进行活性物质吸附递送的相关研究;且以BA-PS为稳定剂制备的Pickering乳液表现出较好的乳化性和乳化稳定性,该乳液可进一步在药物包埋和靶向释放等方面进行深入研究,在食品和医药等行业中均有很好的应用前景。
[1] 吴昱春, 陈小草, 张琦, 等.Pickering乳液稳定机理及其在食品中的应用研究进展[J].食品科学, 2021, 42(7):275-282.
WU Y C, CHEN X C, ZHANG Q, et al.Stability mechanism of Pickering emulsion and its application in food industry[J].Food Science, 2021, 42(7):275-282.
[2] HALMOS E P, MACK A, GIBSON P R.Review article:Emulsifiers in the food supply and implications for gastrointestinal disease[J].Alimentary Pharmacology & Therapeutics, 2019, 49(1):41-50.
[3] 曹雁平, 许朵霞, 侯占群.食品乳状液及乳化新技术[M].北京:化学工业出版社, 2014.
CAO Y P, XU D X, HOU Z Q.Food Emulsion and New Emulsification Technology[M].Beijing:Chemical Industry Press, 2014.
[4] RAYNER M, MARKU D, ERIKSSON M, et al.Biomass-based particles for the formulation of Pickering type emulsions in food and topical applications[J].Colloids & Surfaces A:Physicochemical & Engineering Aspects, 2014, 458(1):48-62.
[5] 汤洋, 高成成, 张岩, 等.多糖基颗粒稳定的Pickering乳液凝胶研究进展[J].食品科学, 2022,43(3):341-351.
TANG Y, GAO C C, ZHANG Y, et al.Pickering emulsion gel stabilized by polysaccharide-based particles[J].Food Science, 2022,43(3):341-351.
[6] RUAN H, CHEN Q H, FU M L, et al.Preparation and properties of octenyl succinic anhydride modified potato starch[J].Food Chemistry, 2009, 114(1):81-86.
[7] 王秋丽. 辛烯基琥珀酸淀粉酯构建乳化微胶囊体系及其包埋应用的研究[D].广州:华南理工大学, 2018.
WANG Q L.Study on the emulsified microcapsule system made by octenyl succinic anhydride modified starch and its embedded application[D].Guangzhou:South China University of Technology, 2018.
[8] SIMSEK S, OVANDO-MARTINEZ M, MAREFATI A, et al.Chemical composition, digestibility and emulsification properties of octenyl succinic esters of various starches[J].Food Research International, 2015, 75:41-49.
[9] GARC A-TEJEDA Y V, LEAL-CASTA
A-TEJEDA Y V, LEAL-CASTA EDA E J, ESPINOSA-SOLIS V, et al.Synthesis and characterization of rice starch laurate as food-grade emulsifier for canola oil-in-water emulsions[J].Carbohydrate Polymers, 2018, 194:177-183.
EDA E J, ESPINOSA-SOLIS V, et al.Synthesis and characterization of rice starch laurate as food-grade emulsifier for canola oil-in-water emulsions[J].Carbohydrate Polymers, 2018, 194:177-183.
[10] LU X X, LIU H S, HUANG Q R.Fabrication and characterization of resistant starch stabilized Pickering emulsions[J].Food Hydrocolloids, 2020, 103:105703.
[11] RUSSO R, SANTARCANGELO C, BADOLATI N, et al.In vivo bioavailability and in vitro toxicological evaluation of the new butyric acid releaser N-(1-carbamoyl-2-phenyl-ethyl) butyramide[J].Biomedicine & Pharmacotherapy, 2021, 137:111385.
[12] DAI D D, SUN S L, HONG Y, et al.Structural and functional characteristics of butyrylated maize starch[J].LWT-Food Science and Technology, 2019, 112:108254.
[13] DURA A, BLASZCZAK W, ROSELL C M.Functionality of porous starch obtained by amylase or amyloglucosidase treatments[J].Carbohydrate Polymers, 2014, 101:837-845.
[14] ZHANG K R, CHENG F, ZHANG K, et al.Synthesis of long-chain fatty acid starch esters in aqueous medium and its characterization[J].European Polymer Journal, 2019, 119:136-147.
[15] NAMAZI H, FATHI F, DADKHAH A.Hydrophobically modified starch using long-chain fatty acids for preparation of nanosized starch particles[J].Scientia Iranica, 2011, 18(3):439-445.
[16] LEE Y K, CHANG Y H.Structural and in vitro digestibility properties of esterified maca starch with citric acid and its application as an oil-in-water (O/W) Pickering emulsion stabilizer[J].International Journal of Biological Macromolecules, 2019, 134:798-806.
[17] 张盼盼, 夏文, 王飞, 等.多孔淀粉制备方法及其应用的研究进展[J].广东化工, 2015, 42(17):102-105.
ZHANG P P, XIA W, WANG F, et al.Development of porous starch preparation and application[J].Guangdong Chemical Industry, 2015, 42(17):102-105.
[18] GARCIA M A V T, GARCIA C F, FARACO A A G.Pharmaceutical and biomedical applications of native and modified starch:A review[J].Starch-Starke, 2020, 72(7-8):1900270.
[19] LI H Y, MA Y X,YU L Y.Construction of octenyl succinic anhydride modified porous starch for improving bioaccessibility of β-carotene in emulsions[J].RSC Advances, 2020, 10(14):8 480-8 489.
[20] WEN Y, YE F Y, ZHU J F, et al.Corn starch ferulates with antioxidant properties prepared by N, N′-carbonyldiimidazole-mediated grafting procedure[J].Food Chemistry, 2016, 208:1-9.
[21] ZHANG B, MEI J Q, CHEN B, et al.Digestibility, physicochemical and structural properties of octenyl succinic anhydride-modified cassava starches with different degree of substitution[J].Food Chemistry, 2017, 229:136-141.
[22] LI J L, ZHOU M, CHENG F, et al.Characterization and properties of long-chain fatty acid starch esters prepared with regenerated starch by dry method[J].Starch-Starke, 2019, 71(11-12):1900143.
[23] 苟丽娜, 马云翔, 王宇霞, 等.高比表面积阿魏酸多孔淀粉酯结构表征及体外消化特性[J].食品与发酵工业, 2021,47(22):76-83.
GOU L N, MA Y X, WANG Y X, et al.Structural characterization and in vitro digestibility of ferulic acid porous starch ester with high specific surface area[J].Food and Fermentation Industries, 2021,47(22):76-83.
[24] 冯鑫, 马良, 戴宏杰, 等.食品级Pickering乳液的稳定性及β-胡萝卜素的装载研究[J].食品与发酵工业, 2021, 47(6):18-25.
FENG X, MA L, DAI H J, et al.The study on stability of food-grade Pickering emulsion and the loading of β-carotene[J].Food and Fermentation Industries, 2021, 47(6):18-25.
[25] LIU Z Q, LI Y, CUI F J, et al.Production of octenyl succinic anhydride-modified waxy corn starch and its characterization[J].Journal of Agricultural & Food Chemistry, 2008, 56(23):11 499-11 506.
[26] LI S N, ZHANG B, TAN C P, et al.Octenylsuccinate quinoa starch granule-stabilized Pickering emulsion gels:Preparation, microstructure and gelling mechanism[J].Food Hydrocolloids, 2019, 91:40-47.
[27] 罗文波, 魏宇清, 邵苗, 等.淀粉脂质复合物纳米粒子的制备、结构表征及其在Pickering乳液中的应用[J].粮油食品科技, 2021, 29(4):122-129.
LUO W B, WEI Y Q, SHAO M, et al.Preparation, characterization and application in Pickering emulsion of starch-lipid composite nanoparticles[J].Science and Technology of Cereals, Oils and Foods, 2021, 29(4):122-129.