亚麻籽,又称胡麻籽,是一年生或多年生草本植物,属亚麻科、亚麻属[1],在我国甘肃、内蒙、山西和宁夏的种植面积较大。目前,亚麻籽多被用来榨取油脂,榨油后的残渣亚麻籽饼粕富含亚麻籽胶(flaxseed gum,FSG)、亚麻籽蛋白、木酚素等多种功能性物质[2],但一般用作动物饲料或作为废物处理,FSG等物质未得到充分利用,造成很大资源浪费的同时也给环境增加了一定的负担[3],因此对亚麻籽饼粕中的有效物质进行提取是很有必要的。
FSG是一种阴离子杂多糖,主要由中性多糖(75%)和酸性多糖(25%)构成,中性多糖主要由木糖、L-阿拉伯糖和半乳糖(6.2∶3.5∶1,摩尔比)组成,分子质量为1 200 kDa;而酸性多糖主要由650 kDa(3.8%)和17 kDa(21.3%)2个亚组分构成,单糖单元主要为L-鼠李糖、D-半乳糖醛酸、L-半乳糖、L-岩藻糖(2.6∶1.7∶1.4∶1,摩尔比)[1]。FSG具有良好的乳化性、凝胶性和抗氧化性等功能特性,还具有降血糖、降胆固醇和调节肠道菌群等生理功能,常作为食品配料添加到乳制品、肉制品和果冻制品等食品中,来改善食品品质[4-5]。亚麻全籽、亚麻籽饼粕及亚麻籽壳[6-8]等均可作为提取FSG的原料,但不同的原料因传质阻力不同,其FSG的提取率也会有所不同。目前FSG的提取方法可分为干法和湿法,干法是指通过打磨制得FSG的技术,其制备工艺简单,但生产的FSG产品黏度低、质量较差;湿法是指以水为主要浸提溶剂提取FSG的方法,其得到的FSG质量好,黏度也较高[6]。超声提取法提取FSG属于湿法,其具有提取时间短、有效成分利于分离等优点[9]。不同提取方法也可能会得到产率、性质、功能不同的FSG样品。
本研究分别采用传统热水浸提法与超声提取法从亚麻籽饼粕中提取FSG,优化2种方法的工艺并对所得FSG的理化特性、结构及抗氧化活性进行比较研究,为进一步开发和利用FSG提供研究基础。
1 材料与方法
1.1 材料与试剂
亚麻籽饼粕(冷榨),内蒙古益善园生物科技有限责任公司。
抗坏血酸,深圳乐芙生物科技有限公司;DPPH,上海源叶生物科技有限公司;ABTS,上海翌圣生物科技有限公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、溴化钾(光谱纯)等其他所用试剂均为国产分析纯。
1.2 仪器与设备
Scientz-IID触摸式超声波细胞粉碎机、XHF-DY均质机,宁波新芝生物科技股份有限公司;T6-新悦可见分光光度计,北京普析通用仪器有限责任公司;K9860全自动凯氏定氮仪,海能未来技术集团股份有限公司;TM4000扫描电镜,日本株式会社日立高新技术那珂事业所;IRAffinity-1傅里叶变换红外光谱仪,日本岛津公司;Haake RS6000流变仪,美国Thermo Fisher公司。
1.3 实验方法
1.3.1 FSG提取工艺
1.3.1.1 原料预处理
原料预处理工艺:
将亚麻籽饼粕粉碎后过20目筛→于少量水中浸润5 min→加入2倍体积的无水乙醇,用玻璃棒搅拌混匀→超声200 W处理30 min→4 ℃下4 000 r/min离心10 min后弃去上清液→加入80%乙醇冲洗2次→置于4 ℃冰箱保存待用。
1.3.1.2 FSG热水浸提法提取工艺
单因素试验:向预处理好的原料中以料液比分别为1∶100、1∶125、1∶175、1∶225、1∶275、1∶300(g∶mL)加入蒸馏水,在提取温度分别为40、50、60、70、80 ℃和提取时间分别为0.5、1.0、1.5、2.0、2.5、3 h的条件下进行提取。
正交试验:在单因素试验的基础上,以提取率为指标,料液比、提取温度和提取时间为3个因素进行L9(33)正交试验。
浸提液过300目滤布取上清液→旋转蒸发进行浓缩→加入4倍体积乙醇醇沉12 h→6 000 r/min离心10 min取沉淀→沉淀复溶于5倍体积蒸馏水中→透析12 h→旋蒸除有机溶剂→冷冻干燥
1.3.1.3 FSG超声法提取工艺
单因素试验:向预处理好的原料中以料液比分别为1∶100、1∶125、1∶175、1∶225、1∶275、1∶300(g∶mL)加入蒸馏水,在超声功率分别为100、150、200、250、300、350、400 W和提取时间分别为10、20、30、40、50、60 min的条件下进行超声提取。
正交试验:在单因素试验的基础上,以提取率为指标,料液比、超声功率和超声时间为3个因素进行L9(33)正交试验。
提取液过300目滤布取上清液→旋转蒸发进行浓缩→加入4倍体积乙醇醇沉12 h→6 000 r/min离心10 min取沉淀→沉淀复溶于5倍体积蒸馏水中→透析12 h→旋蒸除有机溶剂→冷冻干燥
1.3.1.4 FSG提取率计算
以FSG多糖的质量为基础,FSG提取率计算如公式(1)所示:
(1)
式中:Y,FSG提取率,%;x,从标准曲线中计算出提取液中多糖的量,μg/mL;m,亚麻籽饼粕粉取样量,g;V1,FSG提取液总体积,mL;V2,FSG提取液测定用体积,mL;V3,FSG提取液测定液稀释总体积,mL。
1.3.2 理化指标的测定
水分含量测定参考GB 5009.3—2016,灰分含量测定参考GB 5009.4—2016,蛋白质含量测定参考GB 5009.5—2016,多糖含量测定参考SN/T 4260—2015,脂肪含量测定参考GB 5009.6—2016。
1.3.3 FSG的结构测定
1.3.3.1 微观结构测定
样品用导电双面胶带固定在样品台上,吹掉多余的粉末,扫描电镜观察其表面微观结构,扫描功率为10 kV。
1.3.3.2 红外光谱测定
参照DONG等[10]的方法并略有修改。称取1 mg样品与100 mg溴化钾混合,研磨使其充分混合呈均匀的粉末并进行压片,于4 000~400 cm-1下扫描,扫描64次,分辨率为4 cm-1。
1.3.4 FSG理化性质测定
1.3.4.1 pH值测定
参照HU等[11]的方法,分别对贮存第0、1、2、4、8天时FSG溶液的pH值进行测定。
1.3.4.2 初始黏度测定
使用流变仪测定2种提取方法得到的FSG的初始黏度。
1.3.4.3 起泡性测定
准确量取5 mg/mL的FSG溶液20 mL于具塞量筒中,记录初始体积为V1,手动鼓泡1 min后立即记录泡沫体积为V2,静置30 min后再次记录泡沫体积为V3,起泡性计算如公式(2)和公式(3)所示:
起泡性![]()
(2)
起泡稳定性![]()
(3)
1.3.4.4 乳化性测定
参考PEARCE等[12]的方法并略有改动。将FSG溶液与大豆油以体积比3∶1混合,使用高速均质机在10 000 r/min下乳化1 min后置于50 ℃水浴30 min。吸取下层液体100 μL,用1 g/L 的SDS溶液稀释150倍,于500 nm处测定吸光值。乳化活性与乳化稳定性计算如公式(4)和公式(5)所示:
乳化活性![]()
(4)
乳化稳定性![]()
(5)
式中:N为稀释倍数;c为样品质量浓度,g/m3;Ф为乳液中油相体积分数;L为光程;A0为在0 min时的吸光度;At为30 min时的吸光值;t为水浴时间,30 min。
1.3.5 FSG抗氧化特性测定
1.3.5.1 清除羟自由基(·OH)能力的测定
参照王德才等[13]的测定方法进行FSG样品清除·OH能力的测定。
1.3.5.2 清除DPPH自由基能力的测定
参照VON等[14]的测定方法进行FSG样品DPPH自由基清除能力的测定。
1.3.5.3 总还原力的测定
参照HAFSA等[15]的方法进行FSG样品总还原力的测定。
1.3.5.4 清除ABTS阳离子自由基能力的测定
参照THAIPONG等[16]的方法进行FSG样品清除ABTS阳离子自由基能力的测定。
1.4 数据处理及分析
用Excel 2010、Origin 2019b和SPSS 26进行作图与数据分析。实验结果均以平均值±标准差表示,采用单因素方差分析法进行显著性差异分析,当P<0.05时,表示差异显著。
2 结果与分析
2.1 亚麻籽饼粕的基本成分
通过测定得到原料亚麻籽饼粕的基本成分含量。水分含量为(0.93±0.01)%、灰分含量为(5.14±0.15)%、蛋白质含量为(33.96±0.48)%、脂肪含量为(0.63±0.04)%、膳食纤维含量为(59.15±0.68)%。
2.2 葡萄糖标准曲线
葡萄糖标准曲线绘制结果如图1所示,得到线性方程为y=10.271x+0.005 6,R2=0.998 6。

图1 葡萄糖标准曲线
Fig.1 Glucose standard curve
2.3 热水浸提法工艺的优化结果
2.3.1 单因素试验
由图2可知,料液比、提取时间、提取温度3个因素对FSG的提取率均有显著影响(P<0.05)。
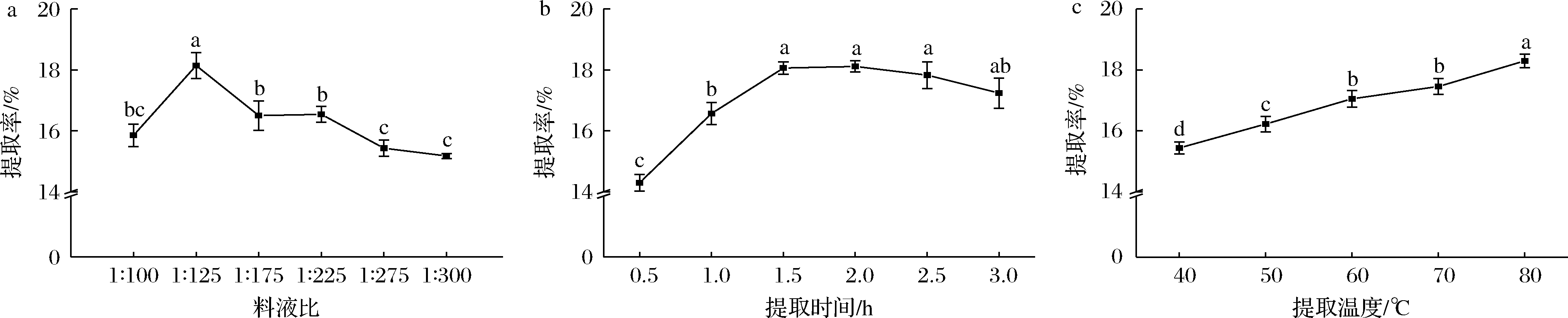
a-料液比;b-提取时间;c-提取温度
图2 料液比、提取时间、提取温度对FSG提取率的影响
Fig.2 Effects of solid-liquid radio, extraction time and extraction temperature on the extraction yield of FSG
注:小写字母表示不同组间同一样品间的显著性差异(P<0.05)(下同)
在料液比为1∶100~1∶300时,随着料液比的增加,整体呈现先升高后降低的趋势(P<0.05),在料液比为1∶125时提取率达到最大值,因此选取料液比为1∶125为宜。
在提取时间为0.5~3 h下,FSG提取率随时间延长呈现先升高后降低的趋势,在2 h时达到最高值。其可能原因是FSG溶出需要一定的时间,时间过短,FSG溶出不完全,在2 h时大部分FSG已溶出。提取时间为1.5与2 h无显著差异(P>0.05),考虑到浸提效率及过长的提取时间会滋生微生物以致对FSG质量造成影响,选择提取时间为1.5 h为宜。
在提取温度为40~80 ℃,FSG提取率随温度的升高而升高(P<0.05),在80 ℃时达到最大值。可能原因是低提取温度下传质阻力较大,导致FSG溶出速率较低,而温度升高致使分子间热运动加快,传质阻力降低,故提取率升高。考虑到浸提温度高于80 ℃后会对FSG结构破坏较大,故选择提取温度为80 ℃为宜。
2.3.2 正交试验
由表1和表2可知,3个因素对FSG提取率的影响主次排序为C(提取温度)>B(提取时间)>A(料液比),从9组处理中可以直观找出最优水平组合为第5组,即A2B2C3,此时提取率达到18.96%,正交优化结果同样为A2B2C3,故可得到热水浸提法提取FSG的最佳工艺条件为:料液比1∶125、提取时间120 min、提取温度80 ℃。SAFDAR等[17]采用热水浸提法从亚麻籽中提取FSG,在提取温度为100 ℃时达到最大提取率为8.92%,李小凤等[18]同样采用热水浸提法从亚麻籽中提取FSG,得到的提取率为7.28%,这可能是由于提取所用原料来源、原料产地、提取工艺等的不同导致的。
表1 L9(33)正交设计因素水平表
Table 1 Factors and levels table of orthogonal test

水平因素A(料液比)(g∶mL)B(提取时间)/minC(提取温度)/℃11∶100906021∶1251207031∶17515080
表2 正交试验结果
Table 2 Results of orthogonal experiment
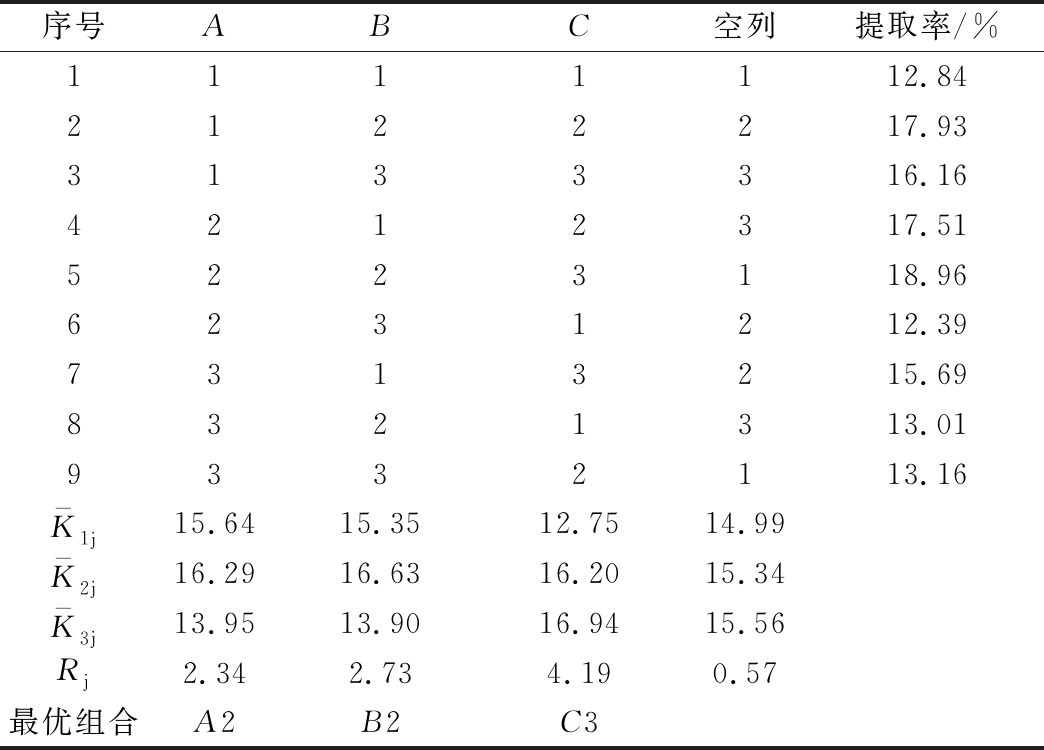
序号ABC空列提取率/%1111112.842122217.933133316.164212317.515223118.966231212.397313215.698321313.019332113.16K-1j15.6415.3512.7514.99K-2j16.2916.6316.2015.34K-3j13.9513.9016.9415.56Rj2.342.734.190.57最优组合A2B2C3
2.4 超声提取法工艺的优化结果
2.4.1 单因素试验
由图3可以看到,料液比、超声时间和超声功率3个因素均对FSG的提取效果影响显著(P<0.05)。

a-料液比;b-超声时间;c-超声功率
图3 料液比、超声时间、超声功率对FSG提取率的影响
Fig.3 Effects of solid-liquid radio, ultrasonic time and ultrasonic power on the extraction yield of FSG
当料液比为1∶100~1∶300时,随着料液比的增加,FSG提取率先升高后降低,当料液比为1∶175时提取率达到最大,故选择料液比1∶175为宜。
在超声处理时间为10~60 min时,FSG提取率随时间的延长而不断升高,在超声处理60 min时提取率达到最大,其中超声时间50与60 min下的差异不显著(P>0.05),考虑到提取时间过长,生产周期增长的同时导致生产成本增大,故最佳提取时间为50 min。
在100~400 W的超声功率下,FSG提取率随着功率的升高呈现先升高后降低的趋势,当超声功率为200 W时提取率达到最大值,故选取超声功率200 W为宜。
2.4.2 正交试验
由表3和表4可知,3个因素的主次关系为A(料液比)>B(超声时间)>C(超声功率)。从9个处理组中可以直观找出最优组合为第3组,即A1B3C3,提取率为23.82%,而正交优化最佳水平组合为A2B3C3,此时提取率达到23.83%。经过验证,正交优化水平组合的FSG提取率优于第3组处理,故得到超声法提取FSG的最佳工艺条件为料液比1∶175、超声时间50 min、超声功率250 W。
表3 L9(33)正交设计因素水平表
Table 3 Factors and levels table of orthogonal test

水平因素A(料液比)(g∶mL)B(超声时间)/minC(超声功率)/W11∶1253015021∶1754020031∶25050250
表4 正交试验结果
Table 4 Results of orthogonal experiment
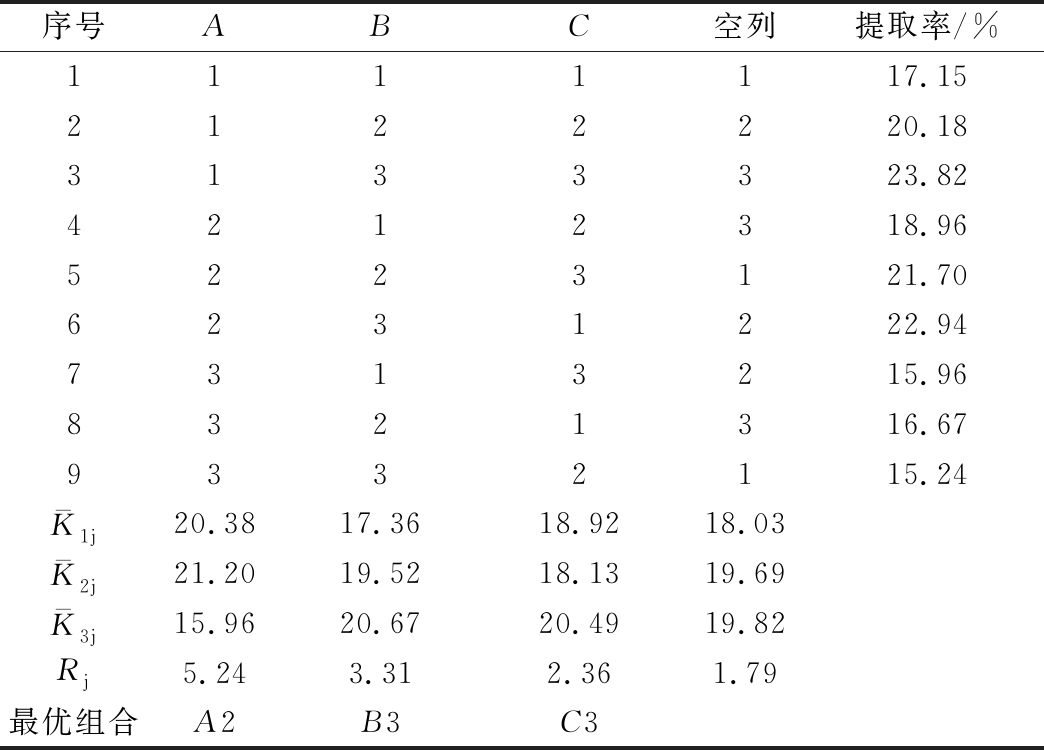
序号ABC空列提取率/%1111117.152122220.183133323.824212318.965223121.706231222.947313215.968321316.679332115.24K-1j20.3817.3618.9218.03K-2j21.2019.5218.1319.69K-3j15.9620.6720.4919.82Rj5.243.312.361.79最优组合A2B3C3
2.5 扫描电镜图
由图4可以看到,2种方法提取的FSG均呈立体且规则的片状结构,表面结构均较疏松,不同之处是热水提FSG的结构更加厚实致密,片状结构较完整,超声法提FSG的表面存在较多孔洞,其片状结构单薄且呈碎片化。2种方法提取的FSG表面结构的差异可能与提取方法的作用强度有关,热水浸提法作用条件较温和,对所提FSG结构破坏相对较小,而超声法提取强度较大,可能是由于超声产生的空化气泡爆开时形成了小的高压集中区域,导致其形成多孔洞的结构。

a-热水浸提FSG;b-超声法提FSG
图4 热水浸提法和超声法提取FSG的微观结构
Fig.4 The microstructure of FSG by hot water extraction and ultrasonic extraction
2.6 傅里叶红外光谱图
红外光谱是根据分子内部不同的官能团、化学键振动或转动等信息,以此来衡量物质分子中官能团或化学键的存在或变化的分析方法。由图5可以看出,提取方法对FSG的结构有一定影响。2 981~2 850 cm-1处为C—H键的伸缩振动[19](热水提FSG:2 945.24 cm-1);1 291~1 460 cm-1附近的吸收峰(热水提FSG:1 483.07 cm-1,超声提FSG:1 284.11、1 482.34 cm-1)为C—H的变角振动吸收峰[20];1 426~1 409 cm-1附近的吸收峰(热水提FSG:1 426.01 cm-1)为C—H弯曲弱振动[21];1 060~985 cm-1附近的吸收峰(热水提FSG:1 060.81 cm-1,超声提FSG:1 063.54 cm-1)代表C—O键的伸缩振动;917 cm-1附近的吸收峰(热水提FSG:914.73 cm-1,超声提FSG:909.61 cm-1)代表β-糖苷键的存在[19];875~560 cm-1处的吸收峰(热水提FSG:871.57 cm-1,超声提FSG:864.99 cm-1)表明有糖结构的存在[22]。2种提取方法得到FSG的二级结构差异可能是超声处理后由于机械作用的剪切力,破坏了多糖分子之间的相互作用,从而对其分子结构产生了一定影响[23]。

a-热水浸提FSG;b-超声法提FSG
图5 热水浸提法和超声法提取的FSG红外光谱图
Fig.5 Infrared spectra of FSG by hot water extraction and ultrasonic extraction
2.7 理化性质分析
2.7.1 pH稳定性
FSG溶液的pH值对其流动行为和黏度等理化性质有很大的影响,故分析贮存期间FSG的pH值变化是很有必要的。FSG溶液的最佳pH值为6.0~8.0。如图6所示,在贮存过程中,热水提FSG的pH值在6.38~6.61,超声FSG在6.27~6.46时,热水提FSG的pH值略高于超声提FSG,这可能是由于高温提取致使蛋白质和多糖的变性导致的[11]。2种FSG溶液的pH值总体变化不大,可以看出2种方法提取的FSG均具有良好的pH稳定性,这与HU等[11]的研究结果是相似的。

图6 提取方法对FSG的pH稳定性的影响
Fig.6 Effects of extraction methods on pH stability of FSG
2.7.2 黏度测定结果
由图7可知,在相同的质量浓度下,热水提FSG的表观黏度显著高于超声提FSG(P<0.05)。这可能是因为微观结构对黏度有一定的影响,超声提取作用强度较大,相比于热水提FSG,其片状结构单薄且呈碎片化,且超声处理可能会破坏糖苷键,从而破坏大分子的聚集,此外,减少的分子间相互作用可能导致FSG溶液的表观黏度显著降低。

图7 提取方法对FSG黏度的影响
Fig.7 Effects of extraction methods on the viscosity of FSG
2.7.3 起泡性测定结果
起泡性是一种衡量聚合物稳定泡沫、限制漏气及防止泡沫坍塌能力的指标[11]。通过观察泡沫体积及其随时间的变化来确定FSG的起泡性和稳定性。如图8所示,可以看到超声提FSG的起泡性和泡沫稳定性显著高于热水提FSG(P<0.05),可能的原因一方面是热水提FSG具有较高的初始黏度,使其稳定泡沫界面和抗坍塌的能力较低[11];另一方面可能是由于超声处理降低了FSG颗粒的粒度,同时降低了水的界面张力,有利于分子的快速扩散[24]。
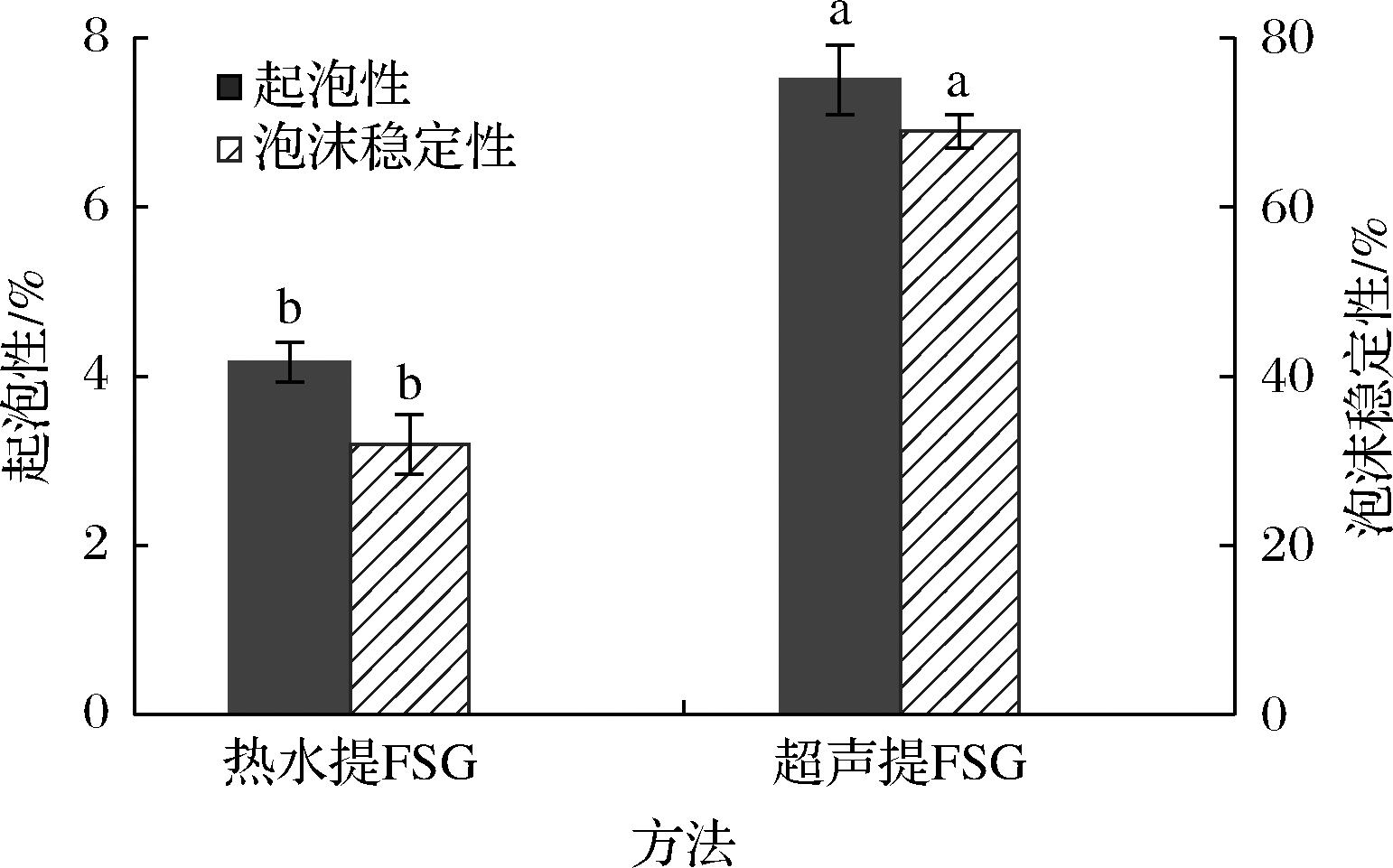
图8 提取方法对FSG起泡性和泡沫稳定性的影响
Fig.8 Effects of extraction methods on the foaming capacity and foam stability of FSG
2.7.4 乳化性测定结果
乳化性是食品应用中重要的功能性质之一,乳化能力取决于亲水胶体或乳化剂降低油水界面张力的能力。由图9可以看出,超声提FSG较热水提FSG相比具有更好的乳化性和乳化稳定性(P<0.05),可能原因是高强度的超声处理抑制了颗粒聚集,提高乳液界面吸附分子的能力。

图9 提取方法对FSG乳化性和乳化稳定性的影响
Fig.9 Effects of extraction methods on the emulsifying capacity and emulsion stability of FSG
2.8 抗氧化性测定结果
由图10可知,不同提取方法对得到的FSG的抗氧化能力均有影响,且热水提FSG与超声提FSG的4种抗氧化能力均随FSG质量浓度的增加而增加。
在FSG质量浓度为2~10 mg/mL时,超声提FSG的·OH清除能力高于热水提FSG,但均低于抗坏血酸。FSG多糖中的羧基能够络合金属离子如Fe2+等,抑制其与H2O2进行反应生成·OH,另一方面多糖中的羟基和羧基可作为氢供体,提供氢原子与·OH反应从而清除·OH,因此,多糖含量较高的超声提FSG的·OH清除效果更好。
超声提FSG的清除DPPH自由基能力高于热水提FSG,但均低于抗坏血酸。这可能是因为多糖的清除自由基能力与其供氢能力呈正相关[25],多糖的羟基和羧基均可作为氢的供体,其中羧基更容易解离氢原子,使DPPH还原成DPPH-H,因此多糖含量相对高的超声提FSG清除DPPH自由基能力更高。
总还原力是评价样品抗氧化活性的重要指标,还原能力测定通过铁氰化钾还原方法测量抗氧化剂的给电子能力,样品的还原能力可以作为评估其潜在抗氧化性能的指标[26]。如图10-c所示,在质量浓度为2~10 mg/mL时,超声提FSG的总还原力高于热水提FSG,均低于抗坏血酸的总还原力。

a-·OH清除活性;b-DPPH自由基清除活性;c-总还原力;d-ABTS阳离子自由基清除活性
图10 提取方法对FSG ·OH清除活性、DPPH自由基清除活性、总还原力、ABTS阳离子自由基清除活性的影响
Fig.10 Effects of extraction methods on the DPPH radical scavenging activity, hydroxyl radical scavenging activity, reducing power, ABTS radical scavenging activity of FSG
ABTS阳离子自由基是带正电荷的自由基,其清除过程的主要原理是电子的转移[27]。如图10-d所示,当FSG的质量浓度为0.4~2.0 mg/mL时,热水提FSG的ABTS阳离子自由基清除率高于超声提FSG,均低于抗坏血酸。
ABTS阳离子自由基是带正电荷的自由基,其清除过程的主要原理是电子的转移[27]。如图10-d所示,当FSG的质量浓度为0.4~2.0 mg/mL时,热水提FSG的ABTS阳离子自由基清除率高于超声提FSG,均低于抗坏血酸。
3 结论
本研究对比了热水浸提法和超声法所得到的FSG在结构、理化特性及抗氧化活性上的差异。在FSG的结构与理化性质方面,两者有着密切的关联性,热水提FSG表面结构相对完整致密,致使其相对于超声提FSG而言具有较高的初始黏度,可用作食品增稠剂等,但同时其较高的初始黏度也是导致其起泡性及起泡稳定性低于超声提FSG的原因之一;超声提FSG表面结构疏松多孔,这是相对高强度的超声处理引起的,这种处理也是其乳化性及乳化稳定性高于热水提FSG的一个原因,相比较下可见超声提FSG较为适用于烘焙食品以及蛋黄酱和沙拉酱等。抗氧化性方面,2种方法提取的FSG均具有良好的抗氧化活性。本研究考察了提取方法对FSG的影响,为提高亚麻籽饼粕的利用率、扩大FSG在食品中的应用及功能性产品的开发提供了理论基础及参考。
[1] 禹晓, 黄沙沙, 聂成镇, 等.亚麻籽胶结构及功能应用研究进展[J].食品研究与开发, 2020, 41(1):212-217.
YU X, HUANG S S, NIE C Z, et al.Research progress of the structure and functional application of flaxseed gum[J].Food Research and Development, 2020, 41(1):212-217.
[2] 王维义, 许帅强, 何宏燕, 等.亚麻籽的营养成分及功能研究进展[J].中国油脂, 2020, 45(4):83-85.
WANG W Y, XU S Q, HE H Y, et al.Progress in nutrients and function of flaxseed[J].China Oils and Fats, 2020, 45(4):83-85.
[3] 周彩莹, 零春甜, 李欣忆, 等.菌酶协同处理优化亚麻籽粕风味的工艺研究[J].食品研究与开发, 2021, 42(3):31-36;46.
ZHOU C Y, LING C T, LI X Y, et al.Optimization of preparation technology of flavor of flaxseed meal produced by fermentation with enzyme addition[J].Food Research and Development, 2021, 42(3):31-36;46.
[4] LIU J, SHIM Y Y, TSE T J, et al.Flaxseed gum a versatile natural hydrocolloid for food and non-food applications[J].Trends in Food Science & Technology, 2018, 75:146-157.
[5] MOCZKOWSKA M, KARP S, NIU Y G, et al.Enzymatic, enzymatic-ultrasonic and alkaline extraction of soluble dietary fibre from flaxseed-A physicochemical approach[J].Food Hydrocolloids, 2019, 90:105-112.
[6] RASHID F, AHMED Z, HUSSAIN S, et al.Linum usitatissimum L.seeds:Flax gum extraction, physicochemical and functional characterization[J].Carbohydrate Polymers, 2019, 215:29-38.
[7] MANINDER K, RAJWINDER K, SNEH P.Characterization of mucilages extracted from different flaxseed (Linum usitatissiumum L.) cultivars:A heteropolysaccharide with desirable functional and rheological properties[J].International Journal of Biological Macromolecules, 2018, 117:919-927.
[8] 杨续金, 候吉瑞, 吴婷媛, 等.亚麻籽壳中提胶的工艺研究[J].农产品加工, 2020(8):20-23.
YANG X J, HOU J R, WU T Y, et al.Study on the technology of extracting gum from flaxseed hull[J].Farm Products Processing, 2020(8):20-23.
[9] 邓祥元, 刘约翰, 高坤, 等.超声波辅助提取辣椒红色素的工艺研究[J].食品研究与开发, 2013(6):25-29.
DENG X Y, LIU Y H, GAO K, et al.Study on ultrasonic-assisted organic solvent extraction process of paprika red pigments[J].Food Research and Development, 2013(6):25-29.
[10] DONG X Y, DU S S, DENG Q C, et al.Study on the antioxidant activity and emulsifying properties of flaxseed gum-whey protein isolate conjugates prepared by Maillard reaction[J].International Journal of Biological Macromolecules, 2020, 153:1 157-1 164.
[11] HU Y X, SHIM Y Y, REANEY M J T.Flaxseed gum solution functional properties[J].Foods, 2020, 9(5):E681.
[12] PEARCE K N, KINSELLA J E.Emulsifying properties of proteins:Evaluation of a turbidimetric technique[J].Journal of Agricultural and Food Chemistry, 1978, 26(3):716-723.
[13] 王德才, 高丽君, 高艳霞.杭白芷多糖体外抗氧化活性的研究[J].时珍国医国药, 2009, 20(1):173-174.
WANG D C, GAO L J, GAO Y X.Antioxidative effects of polysaccharide from radix Angelicae dahurica in vitro[J].Lishizhen Medicine and Materia Medica Research, 2009, 20(1):173-174.
[14] VON STASIEWSKI M, et al.Antioxidant and antimicrobial performance of different Argentinean green tea varieties as affected by whey proteins[J].Food Chemistry, 2011, 125(1):186-192.
[15] HAFSA J, SMACH M A, SOBEH M, et al.Antioxidant activity improvement of apples juice supplemented with chitosan-galactose Maillard reaction products[J].Molecules, 2019, 24(24):4 557.
[16] THAIPONG K, BOONPRAKOB U, CROSBY K, et al.Comparison of ABTS, DPPH, FRAP, and ORAC assays for estimating antioxidant activity from guava fruit extracts[J].Journal of Food Composition and Analysis, 2006, 19(6-7):669-675.
[17] SAFDAR B, PANG Z H, LIU X Q, et al.Influence of different extraction techniques on recovery, purity, antioxidant activities, and microstructure of flaxseed gum[J].Journal of Food Science, 2020, 85(10):3 168-3 182.
[18] 李小凤, 赵倩竹, 滕英来, 等.亚麻籽胶微波辅助提取与热水浸提方法比较研究[J].中国粮油学报, 2016, 31(8):55-61.
LI X F, ZHAO Q Z, TENG Y L, et al.Comparison of microwave assisted extraction methods and hot water extraction on flaxseed gum extraction[J].Journal of the Chinese Cereals and Oils Association, 2016, 31(8):55-61.
[19] 侯成敏, 陈文宁, 陈玉放, 等.糖类结构的光谱分析的特点[J].天然产物研究与开发, 2012, 24(4):556-561.
HOU C M, CHEN W N, CHEN Y F, et al.Characteristics of spectral analysis for carbohydrates structures[J].Natural Product Research and Development, 2012, 24(4):556-561.
[20] 张丽美, 杨婷婷, 胡蒋宁, 等.超声波辅助提取茶粕多糖及其抗氧化活性[J].食品科学, 2013, 34(18):36-40.
ZHANG L M, YANG T T, HU J N, et al.Ultrasonic-assisted extraction and antioxidant activity of polysaccharides from seed cake of Camellia oleifera Abel[J].Food Science, 2013, 34(18):36-40.
[21] SANANDIYA N D, SIDDHANTA A K.Chemical studies on the polysaccharides of Salicornia brachiata[J].Carbohydrate Polymers, 2014, 112:300-307.
[22] 杨月娇, 马智玲, 白英.提取方法对马铃薯渣果胶结构特征及特性的影响[J].食品与发酵工业, 2021, 47(7):146-152.
YANG Y J, MA Z L, BAI Y.Extraction methods on structure and properties of pectin from potato residue[J].Food and Fermentation Industries, 2021, 47(7):146-152.
[23] VELA A J, VILLANUEVA M, SOLAESA  G, et al.Impact of high-intensity ultrasound waves on structural, functional, thermal and rheological properties of rice flour and its biopolymers structural features[J].Food Hydrocolloids, 2021, 113:106480.
G, et al.Impact of high-intensity ultrasound waves on structural, functional, thermal and rheological properties of rice flour and its biopolymers structural features[J].Food Hydrocolloids, 2021, 113:106480.
[24] YIN J Y, MA L Y, SIU K C, et al.Effects of ultrasonication on the conformational, microstructural, and antioxidant properties of konjac glucomannan[J].Applied Sciences, 2019, 9(3):461.
[25] XIAO H, CHEN C, LI C, et al.Physicochemical characterization, antioxidant and hypoglycemic activities of selenized polysaccharides from Sargassum pallidum[J].International Journal of Biological Macromolecules, 2019, 132:308-315.
[26] LI C, CHEN S L, SHA J, et al.Extraction and purification of total flavonoids from Eupatorium lindleyanum DC.and evaluation of their antioxidant and enzyme inhibitory activities[J].Food Science & Nutrition, 2021, 9(5):2 349-2 363.
[27] CAO M, WANG S L, GAO Y M, et al.Study on physicochemical properties and antioxidant activity of polysaccharides from Desmodesmus armatus[J].Journal of Food Biochemistry, 2020, 44(7):e13243.