甘草(Glycyrrhiza)属豆科,多年生草本植物,是一种传统的补益中草药,应用较广泛,具有补脾益气、清热解毒、祛痰止咳、缓急止痛及调和诸药等多种功效[1]。乌拉尔甘草、胀果甘草和光果甘草作为药用甘草植物收载于《中国药典》。现代医学研究表明甘草提取物的抗菌、抗病毒及免疫调节等药理活性对传染病防治方面具有较好的效果[2]。
2019年12月以来,开始滋蔓各地的新型冠状病毒肺炎(corona virus disease 2019,COVID-19)因其导致的严重疾病和死亡引起了全人类的恐慌。通过我国研究发现中药中针对治疗COVID-19的9种中药组方中均含有甘草成分[3]。研究表明,甘草所含的甘草酸二胺能够较好地抑制机体的炎性反应,提高免疫功能,对轻度患者具有显著疗效,安全性高,并且能对抗抗病毒西药导致的肝损伤的不良反应[4]。甘草对艾滋病(acquired immunodeficiency syndrome,AIDS)和重症急性呼吸综合征(severe acute respiratory syndrome,SARS)等传染性重大疾病也有较好的治疗效果[5-6];通过大量的临床试验对防治艾滋病的27种单味中药进行研究,结果显示,甘草是使用频率最高的抗病毒中药制剂,并且具有很强的抑制HIV活性的作用[5]。蒲洁莹等[6]报道甘草酸能防止SARS冠状病毒的繁殖,也能阻止其对细胞的侵入。综上所述,甘草具有多种药效,并且不断在被挖掘,因此,以研究尚未深入的甘草种子为对象,展开一系列探究可为明确其功能成分活性并开发相关抗氧化功能性食品提供参考。
甘草的前期研究大多以根及根茎部位中的甘草酸、黄酮及多糖等成分及其生物活性为主[7],但有关甘草种子化学成分的研究尚未深入开展,这不仅导致了甘草资源的浪费,而且使有关甘草不同部位活性成分的研究未能更全面。甘草种子含有蛋白、多糖、油脂及其他重要的化学成分,蛋白作为种子类植物富含的成分之一,具有较高的研究价值。目前关于种子蛋白类化合物的提取方法包含了水、乙醇、缓冲液、碱、盐、酸、酶法提取和碱溶酸沉及超声波辅助提取等方法[8],由于不同的提取方法对于不同的样品发挥的作用并不一致,而选择最佳提取方法对实验结果至关重要,因此,需要进行对比筛选。吕凯波等[9]通过超声波辅助碱溶酸沉法得到的红花籽粕蛋白提取率和含量最高,分别为26.53% 和51.49 mg/mL,蛋白质中多肽含量也最高,达到6.56 mg/mL,而碱法中得到的游离氨基酸含量较多,为2.14 mg/mL;说明不同的提取方法不仅会影响蛋白提取率及含量,还可能会对蛋白质分子内在结构、分子片段大小及组成造成一定影响。因此,筛选甘草种子蛋白的最佳提取方法,对其拥有更高的开发价值和应用前景有着十分重要的意义。
植物蛋白是一种天然的抗氧化物质,具有抗氧化,抗过敏、抗糖尿病、抗癌症等多种生理功能[10]。目前,有关甘草种子蛋白的研究鲜有报道。从甘草种子中提取蛋白,不仅能提高甘草的附加值,而且可以解决甘草资源浪费的问题,对甘草种子的开发和利用意义重大。本文以3种药用甘草种子为原料,通过研究水、乙醇、醋酸提取法和碱溶酸沉法及磷酸盐缓冲液(phosphate buffered solution, PBS)提取法等5种方法,以甘草种子蛋白提取率与含量为指标选出最佳提取方法,通过傅里叶红外光谱(Fourier transform infrared spectroscopy, FT-IR)和扫描电镜图像(scanning electron microscopy, SEM)分析甘草种子蛋白的结构特征,并通过研究对不同自由基的清除率测定其抗氧化活性,以期望能够为甘草种子蛋白的深入研究和开发提供理论依据。
1 材料与方法
1.1 材料与试剂
试验用的3种甘草种子均购于新疆库尔勒。石油醚、醋酸、氢氧化钠、铁氰化钾,天津市鑫铂特化工有限公司;无水乙醇、浓硫酸、磷酸二氢钠、磷酸氢二钠,天津市致远化学制剂有限公司;考马斯亮蓝G-250,上海蓝季生物有限公司;磷酸、三氯乙酸、硫酸亚铁,天津永晟精细化工有限公司;97%牛血清白蛋白(bovine albumin,BSA),北京索莱宝科技有限公司;DPPH试剂,上海麦克林生物公司;三氯化铁,天津市盛奥化学试剂有限公司;水杨酸,天津市北联精细化学品开发有限公司;过氧化氢,成都市科隆化学品有限公司;溴化钾,北京化工厂。以上试剂均为分析纯。
1.2 仪器与设备
FA2004 N电子天平,上海箐海仪器有限公司;FW-135高速万能粉碎机,北京市永光明医疗仪器有限公司;DF-101S恒温加热磁力搅拌器,上海兴创科学仪器设备有限公司;SF-TDL-40D离心机,上海菲恰尔分析仪器有限公司;RE-52AA旋转蒸发仪,上海亚荣生化仪器厂;LGJ-12真空冷冻干燥机,上海腾方仪器设备有限公司;T6紫外分光光度计,北京普析通用仪器有限责任公司。
1.3 实验方法
1.3.1 甘草种子蛋白的提取
分别称取适量3种甘草种子,进行粉碎。将甘草种子粉末与石油醚按1∶10(g∶mL)的比例置摇床中振摇3 h后,重复3次、进行抽滤;将脱脂后的粉末置于通风处室温下干燥12 h后,再次过筛,随后置于4 ℃保存备用。具体见图1。

图1 甘草种子水提蛋白
Fig.1 Water-extracted protein from Glycyrrhiza seed
1.3.1.1 水提法
分别称取3种脱脂粉末各5 g,放入圆底烧瓶内,加入蒸馏水100 mL[料液比为1∶20 (g∶mL)],40 ℃下磁力搅拌提取2 h、过滤、离心,旋蒸浓缩、冻干,得到甘草种子蛋白。
1.3.1.2 乙醇提取法
分别称取3种脱脂粉末各3 g,放入圆底烧瓶内,加入95%(体积分数)乙醇60 mL[料液比为1∶20(g∶mL)],40 ℃下磁力搅拌提取2 h、过滤、离心,旋蒸浓缩、冻干,得到甘草种子蛋白。
1.3.1.3 醋酸提取法
分别称取3种脱脂粉末各3 g,置圆底烧瓶中,加入20%(体积分数)醋酸60 mL(1∶20,g∶mL),40 ℃下磁力搅拌提取2 h、过滤、离心,旋蒸浓缩、冻干,得到甘草种子蛋白。
1.3.1.4 碱溶酸沉法
分别称取3种脱脂粉末各2 g,放入锥形瓶内,加入40 mL氢氧化钠溶液(pH 10),室温静置2 h、浓缩,将浓缩液置于锥形瓶中加入40 mL硫酸溶液(pH 4)室温静置1 h、离心、旋蒸、冻干,得到甘草种子蛋白。
1.3.1.5 磷酸盐缓冲液
分别称取3种脱脂粉末各2 g,置锥形瓶中,加入40 mL PBS溶液(0.2 mol/L,pH 8),室温静置2 h、离心、浓缩、冻干,得到甘草种子蛋白。
采用上述的不同方法提取3种甘草种子蛋白,并按照公式(1)计算蛋白提取率:
蛋白提取率![]()
(1)
1.3.2 甘草种子蛋白含量的测定
1.3.2.1 标准蛋白溶液配制
称取10 mg BSA标准品,定容至10 mL,配制1.0 mg/mL标准蛋白溶液,置4 ℃冰箱存放。
1.3.2.2 考马斯亮蓝的配制
精确称取100 mg考马斯亮蓝,加入50 mL 95%(体积分数)的乙醇进行溶解,再倒入100 mL 85%(体积分数)的磷酸,并加入蒸馏水至1 000 mL定容,备用。
1.3.2.3 绘制标准曲线
将配制好的标准蛋白溶液稀释成0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、1.0 mg/mL等不同质量浓度,每管加1 mL蛋白溶液和3.0 mL考马斯亮蓝溶液后立即摇匀,避光放置5 min后在595 nm处测定其吸光值。以质量浓度作为横坐标,以质量吸光值作为纵坐标绘制标准曲线。
1.3.3 样品中蛋白含量的测定
取10 mg甘草种子蛋白,加10 mL蒸馏水溶解,配制质量浓度为1 mg/mL的母液,离心、上清液加蒸馏水稀释成不同倍数的待测液、按照上述的方法分别测定其吸光值。
1.3.4 傅里叶红外光谱扫描
将水提法所得蛋白样品采用溴化钾压片法制样,用红外光谱仪检测其在4 000~400 cm-1的红外吸收光谱。
1.3.5 扫描电镜分析
取适量3种甘草种子蛋白粉末于样品台上,使用离子溅射仪在其表面镀一层导电膜,在5.0 kV电压下分别放大500和1 000倍观察其表面形态,利用X-射线能谱仪测定蛋白样品表面元素含量。
1.3.6 抗氧化活性测定[11]
1.3.6.1 DPPH自由基清除能力
分别准确取2 mL质量浓度为0.1、0.2、0.4、0.6、0.8、1.0 mg/mL的样品溶液,再加入2 mL 0.2 mmol/L的DPPH溶液于试管中,室温避光反应30 min,在517 nm处测吸光值,平行测定3次。清除率计算如公式(2)所示:
DPPH自由基清除率![]()
(2)
式中:A0、A1、A2分别代表空白组、样品组、对照组的吸光度。
1.3.6.2 羟自由基清除能力
分别准确取1.0 mL质量浓度为0.1、0.2、0.4、0.6、0.8、1.0 mg/mL的样品溶液,依次均加入1.0 mL 6 mmol/L 的硫酸亚铁、水杨酸-乙醇溶液和双氧水。在37 ℃条件下反应30 min后,510 nm处测吸光值,平行测定3次。清除率计算如公式(3)所示:
羟自由基清除率![]()
(3)
式中:A0、A1、A2分别代表空白组、样品组、对照组的吸光度。
1.3.6.3 总还原能力的测定
分别准确取0.8 mL质量浓度为0.1、0.2、0.4、0.6、0.8、1.0 mg/mL的样品溶液,再加入0.4 mL PBS 和10 g/L的铁氰化钾水溶液,于50 ℃条件下放置20 min,降至室温,再加入0.4 mL 10 g/L的三氯乙酸水溶液、1.6 mL蒸馏水和0.4 mL 0.1 g/L的三氯化铁水溶液,室温静止10 min后在700 nm处测吸光值。
1.4 统计学研究
通过Origin 2019和SPSS 26对数据进行绘图和处理。每次试验设置3个平行实验,数据以平均值±标准偏差表示。
2 结果与分析
2.1 甘草种子蛋白提取率
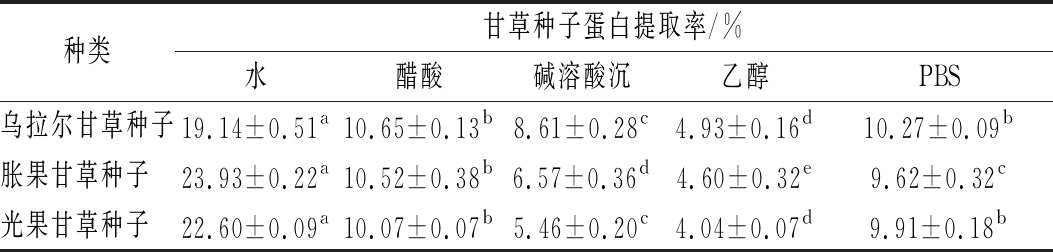
由表1可知,提取方法对蛋白提取率及含量影响较大,且不同提取方法得到的3种甘草种子蛋白提取率均存在显著差异,水提法所得的3种蛋白的提取率显著高于其他方法(P<0.01),分别为19.14%、23.93%、22.60%,说明水溶液可充分溶出样品中的蛋白成分;醋酸和PBS提取的蛋白提取率次之,为10.65%~9.62%,对蛋白质的溶解度也较高;而剩余两种方法的提取率较低,为8.61%~4.04%,其中乙醇溶液的提取效果最不理想,可能是因为本实验使用了95%乙醇,高浓度有机溶剂使蛋白失活,导致此次实验结果并不理想。
表1 甘草种子蛋白提取率![]()
Table 1 Results of protein extraction ![]() n=3)
n=3)
注:数据右上角的字母表示同一行数值的差异显著性,字母相同表示差异不显著(P>0.05),字母不同表示差异显著(P<0.05)(下同)
种类甘草种子蛋白提取率/%水醋酸碱溶酸沉乙醇PBS乌拉尔甘草种子19.14±0.51a10.65±0.13b8.61±0.28c4.93±0.16d10.27±0.09b胀果甘草种子 23.93±0.22a10.52±0.38b6.57±0.36d4.60±0.32e9.62±0.32c光果甘草种子 22.60±0.09a10.07±0.07b5.46±0.20c4.04±0.07d9.91±0.18b
2.2 甘草种子蛋白含量
由表2可知,5种提取方法提取的3种甘草种子蛋白含量也存在一定的差异,其中水提取的各样品蛋白含量均为最高,分别为36.54、30.80、30.12 mg/mL,显著高于其他方法所得蛋白(P<0.01);乙醇和PBS提取的蛋白含量次之,为30.04~25.57 mg/mL;而碱溶酸沉和醋酸溶液提取的蛋白含量相对较低,为25.90~20.01 mg/mL。
表2 甘草种子蛋白含量![]()
Table 2 Results of protein ![]() n=3)
n=3)
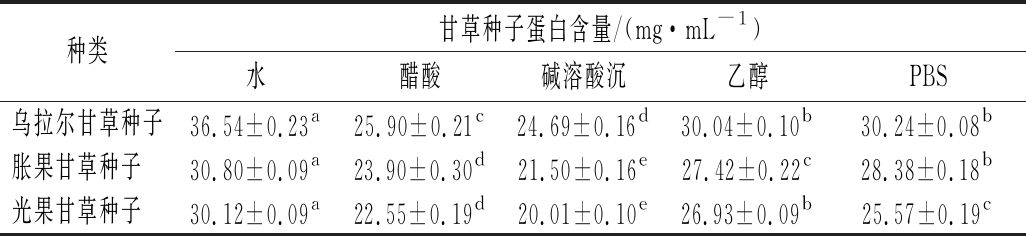
种类甘草种子蛋白含量/(mg·mL-1)水醋酸碱溶酸沉乙醇PBS乌拉尔甘草种子36.54±0.23a 25.90±0.21c 24.69±0.16d 30.04±0.10b 30.24±0.08b 胀果甘草种子 30.80±0.09a 23.90±0.30d21.50±0.16e27.42±0.22c28.38±0.18b光果甘草种子 30.12±0.09a 22.55±0.19d 20.01±0.10e26.93±0.09b 25.57±0.19c
通过比较不同提取方法可知,就蛋白提取率和含量而言,水提法提取率及含量均较高,说明水溶液能够使甘草种子蛋白充分溶出。因此,最终选择水提法作为甘草种子蛋白提取工艺,并后期将对它进行进一步优化。
2.3 红外光谱分析
FT-IR是用来鉴定生物大分子结构的常用手段。通过红外光的穿透,待测样品中分子的各化学键或官能团会对应的形成不同的吸收和振动频率,因此,可根据所形成的吸收峰,判断分子中的化学键或官能团[12]。由图2可看出,3种甘草种子蛋白在4 000~400 cm-1呈现出蛋白类化合物的特征吸收,3种样品在3 420~3 440 cm-1附近均出现强吸收峰,是典型的因N—H伸缩振动形成的酰胺A带的特征峰;出现在2 923 cm-1处的吸收峰是因C—N伸缩振动产生的酰胺B带的特征峰。氨基酸之间有着大量肽键,C![]() O的伸缩振动将导致酰胺Ⅰ在1 700~1 600 cm-1处出现特征吸收峰,3种样品均在1 640~1 660 cm-1处有吸收峰,其中乌拉尔甘草种子蛋白的吸收峰在1 637 cm-1处,归属于β-折叠,而胀果甘草和光果甘草种子蛋白的吸收峰分别在1 654和1 664 cm-1处,说明均具有α-螺旋结构[12]。1 450 cm-1处出现的吸收峰是由C—N伸缩振动引起的酰胺Ⅱ带的特征峰,酰胺Ⅱ带也同酰胺Ⅰ带一样,是由α-螺旋、β-折叠、β-转角和无规卷曲叠加共同作用产生的吸收带(表3)。酰胺Ⅰ和酰胺Ⅱ的存在由多肽中羰基的伸缩振动引起的,与肽链之间的交联程度有关,振动频率越高,肽链结合得越紧密。乌拉尔甘草和胀果甘草种子蛋白在1 384和1 383 cm-1处的吸收峰是因C—N伸缩振动引起的酰胺Ⅲ带,酰胺Ⅲ的存在证实了甘草种子蛋白三螺旋结构的完整[13]。此外,3种甘草种子蛋白的红外光谱峰位并无显著差异,但均显出了蛋白特征吸收峰。
O的伸缩振动将导致酰胺Ⅰ在1 700~1 600 cm-1处出现特征吸收峰,3种样品均在1 640~1 660 cm-1处有吸收峰,其中乌拉尔甘草种子蛋白的吸收峰在1 637 cm-1处,归属于β-折叠,而胀果甘草和光果甘草种子蛋白的吸收峰分别在1 654和1 664 cm-1处,说明均具有α-螺旋结构[12]。1 450 cm-1处出现的吸收峰是由C—N伸缩振动引起的酰胺Ⅱ带的特征峰,酰胺Ⅱ带也同酰胺Ⅰ带一样,是由α-螺旋、β-折叠、β-转角和无规卷曲叠加共同作用产生的吸收带(表3)。酰胺Ⅰ和酰胺Ⅱ的存在由多肽中羰基的伸缩振动引起的,与肽链之间的交联程度有关,振动频率越高,肽链结合得越紧密。乌拉尔甘草和胀果甘草种子蛋白在1 384和1 383 cm-1处的吸收峰是因C—N伸缩振动引起的酰胺Ⅲ带,酰胺Ⅲ的存在证实了甘草种子蛋白三螺旋结构的完整[13]。此外,3种甘草种子蛋白的红外光谱峰位并无显著差异,但均显出了蛋白特征吸收峰。
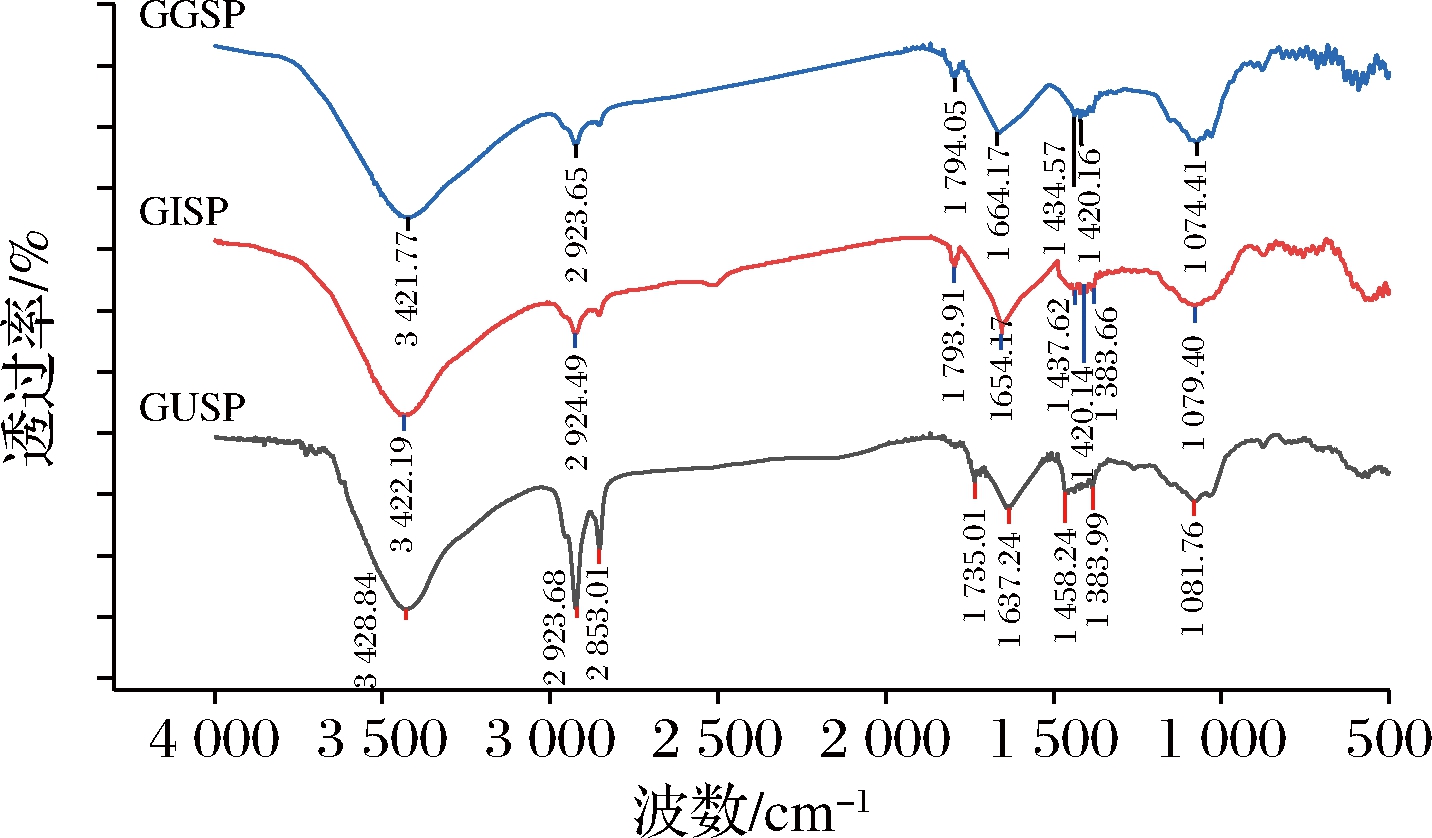
GUSP-乌拉尔甘草种子蛋白;GISP-胀果甘草种子蛋白;GGSP-光果甘草种子蛋白
图2 甘草种子蛋白红外光谱图
Fig.2 FT-IR of Glycyrrhiza seed proteins
表3 甘草种子蛋白红外光谱峰位及解析
Table 3 Peak position and analysis of Glycyrrhiza seed proteins

注:√表示存在此结构;-表示不存在此结构
结构波数/cm-1乌拉尔甘草种子蛋白胀果甘草种子蛋白光果甘草种子蛋白解析酰胺A带3 428.843 422.193 421.77N—H伸缩振动酰胺B带2 923.682 924.492 923.65C—N伸缩振动酰胺Ⅰ带1 637.241 654.171 664.17C O伸缩振动酰胺Ⅱ带1 458.241 437.621 437.57N—H面内弯曲振动-1 420.141 420.16C—N伸缩振动酰胺Ⅲ带1 383.991 383.66-C—N伸缩振动α-螺旋-√√1 646~1 664 cm-1β-折叠√--1 616~1 637 cm-11 681~1 700 cm-1β-转角---1 665~1 681 cm-1无规则卷曲---1 638~1 645 cm-1
3.4 扫描电镜图像分析
可通过SEM对蛋白样品进行清晰地定位分析,从而可观察其微观形貌结构特征,蛋白质的微观结构反映了其分子的聚集情况,能够影响甚至决定蛋白质的功能性质。由图3-A可知,乌拉尔甘草种子蛋白主要呈现出不规则的片状和纤维状聚集碎裂和疏松的结构状态,说明蛋白质原有的纤维结构基本没有遭到损坏。图3-B显示胀果甘草种子蛋白呈现出表面光滑的片状和棒状结构状态,且其厚薄较均匀,明显保持了较完整的结构。如图3-C所示,光果甘草种子蛋白呈现出不规则的棒状和片状及球状结构状态,且存在少量大小不一的微孔,说明蛋白质结构有部分被改变,但蛋白质整体结构仍较为完整。综上所述,水提法提取的甘草种子蛋白保留了较完整的结构,拥有较广泛的应用领域。

A-乌拉尔甘草种子蛋白;B-胀果甘草种子蛋白;C-光果甘草种子蛋白
图3 甘草种子蛋白扫描电镜图
Fig.3 SEM image of Glycyrrhiza seed proteins
表面元素组成的结果如表4所示,3种甘草种子蛋白均含有一定含量的氮和磷元素,此外,胀果甘草种子蛋白还含有少量硅元素;其中,磷是参与骨代谢和组成骨骼中无机盐成分的主要元素,能够维持骨骼和牙齿的健康[14]。
表4 甘草种子蛋白元素分析表
Table 4 SEM-EDX images of Glycyrrhiza seed proteins
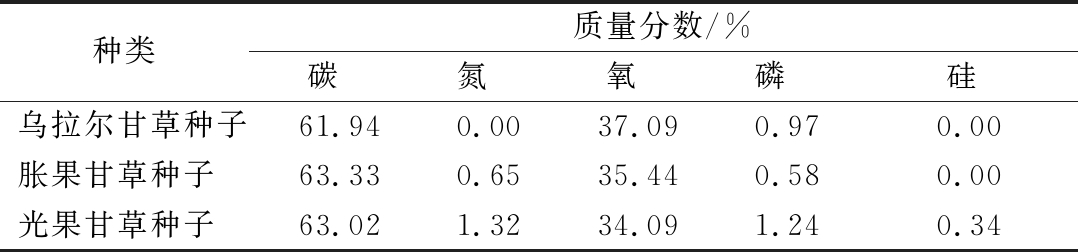
种类质量分数/%碳氮氧磷硅乌拉尔甘草种子61.940.0037.090.970.00胀果甘草种子 63.330.6535.440.580.00光果甘草种子 63.021.3234.091.240.34
2.5 甘草种子抗氧化活性
2.6.1 DPPH自由基清除能力
DPPH是一种具有很强稳定性的自由基,其存在孤对电子,一旦遇到抗氧化剂,因孤对电子与抗氧化剂进行配对,会使其颜色变浅,光谱吸收减少,因此,根据DPPH自由基的含量变化可以判断物质的抗氧化能力。
由图4可知,3种甘草种子蛋白质量浓度与其清除率呈明显的正相关关系。其中,乌拉尔甘草种子蛋白的清除作用稍强于其余2个品种(P<0.01),在质量浓度为1.0 mg/mL时,对DPPH自由基的清除率可达到92.37%;胀果甘草次之,而光果甘草为最低,在相同质量浓度下,两者对DPPH自由基的清除率分别为82.78%和72.91%。通过计算得出3种样品的IC50分别为0.37、0.47、0.61 mg/mL,这说明3种样品均有较强的清除DPPH自由基能力。
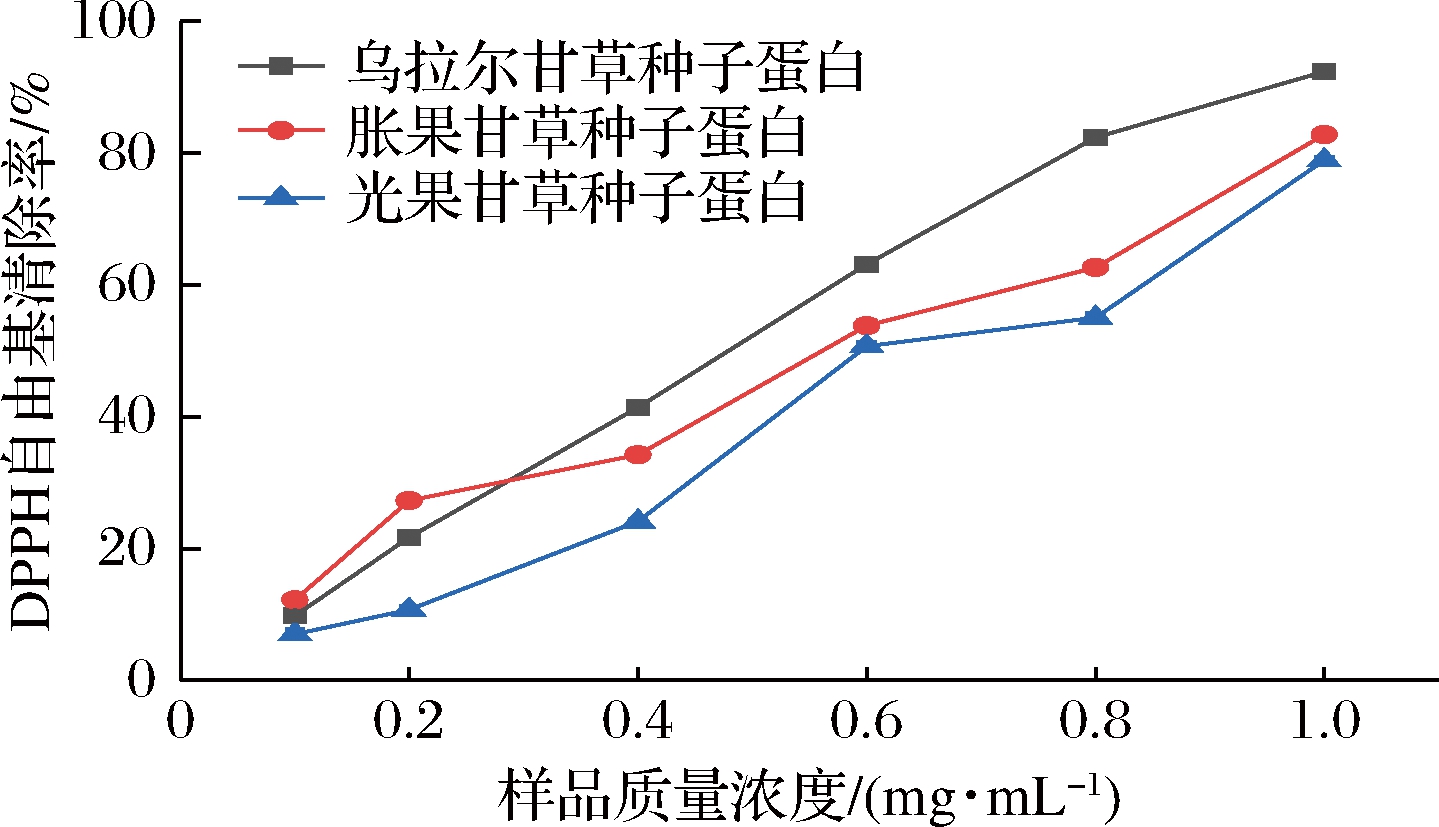
图4 DPPH自由基清除率
Fig.4 DPPH free radical scavenging activity of Glycyrrhiza seed proteins
2.6.2 羟自由基清除能力
羟自由基清除能力,是指具有提供氢质子能力的抗氧化剂能够还原高度氧化的羟自由基,从而阻止自由基的连锁反应的能力。由图5可知,3种甘草种子蛋白对羟自由基的清除能力随着样品质量浓度的增加而显著提高(P<0.01)。在质量浓度为1.0 mg/mL时,3种样品对羟自由基的清除率从高到低的排序为:乌拉尔甘草种子、胀果甘草种子、光果甘草种子;其清除率分别为77.30%、70.01%、65.81%。通过计算得出3种样品的IC50依次为0.51、0.92、0.77 mg/mL,由此推测,3种甘草种子蛋白均具有较强的供氢能力。
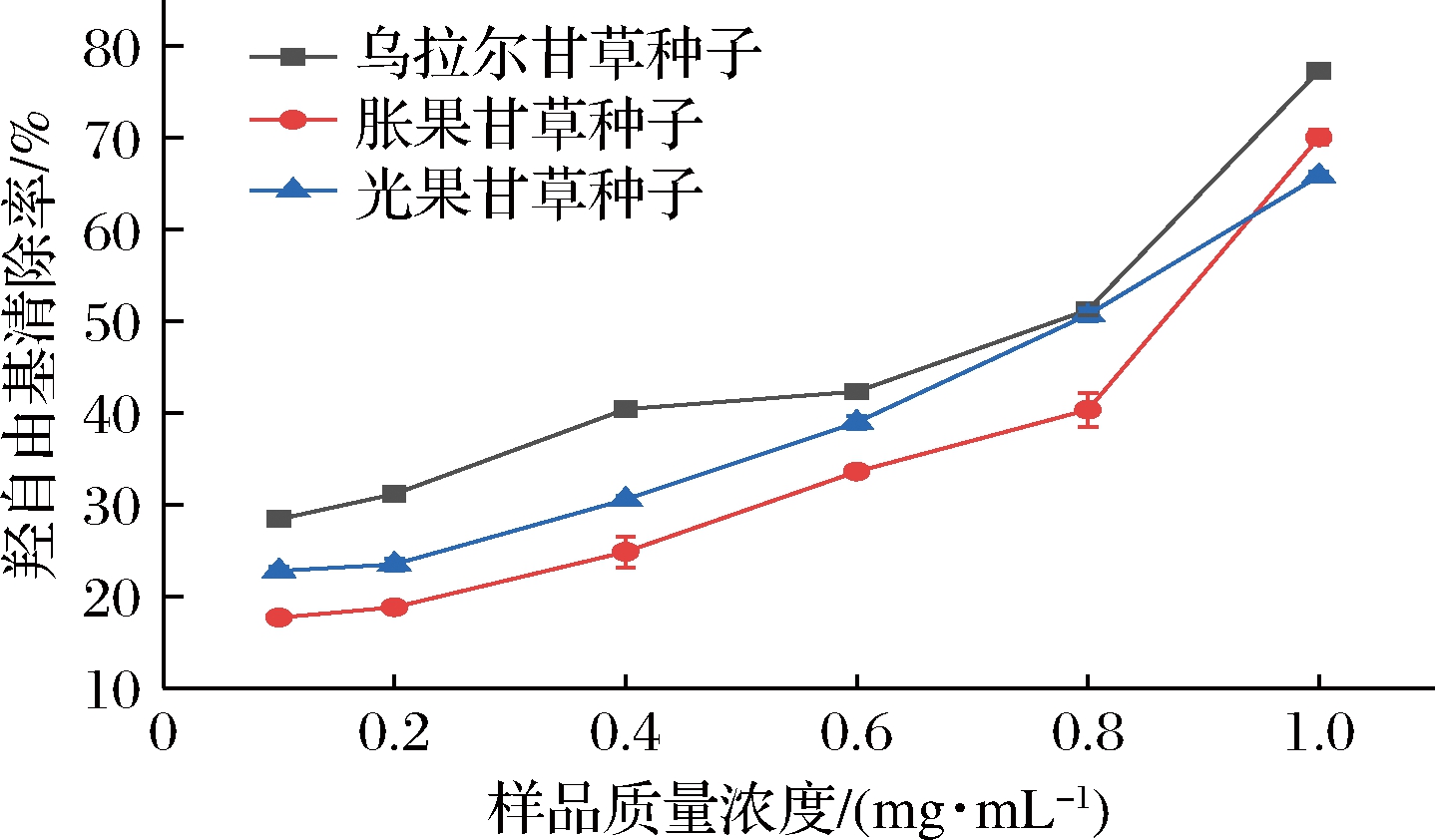
图5 羟自由基清除率
Fig.5 Hydroxyl free radical scavenging activity of Glycyrrhiza seed proteins
2.6.3 总还原能力
3种甘草种子蛋白均有一定的还原能力(图6)。其中,当样品质量浓度达到1.0 mg/mL时,乌拉尔甘草种子蛋白的还原能力稍强于其余2个品种,可达到2.344,而胀果甘草和光果甘草间差异并不显著,在相同质量浓度下两者总还原能力分别为2.012和1.998。说明3种甘草种子都拥有良好的还原能力。通过抗氧化测定结果得知,3种甘草种子蛋白均具备了较好的清除自由基的能力和总还原能力,是一种潜在的抗氧化剂,可在医药、食品和化妆品等领域中发挥作用。

图6 总还原能力
Fig.6 Total reduction capacity of Glycyrrhiza seed proteins
3 讨论与结论
3.1 讨论
3.1.1 提取率及含量
豆科植物作为一种理想的优质植物蛋白质来源,已普遍被大众食用,其中被誉为“黄金豆”的鹰嘴豆更是具有低过敏性、高生物效价等优点,并且其蛋白质提取率高达82.33%[15]。陈晓萌等[16]对2种红芸豆的蛋白含量进行了测定,发现其可溶性蛋白提取率与含量均为最高,分别为57.65%、66.81%和74.08%、66.50%。而芸豆籽的蛋白含量为20%~30%[17],较接近于甘草种子蛋白。以往的研究表明,甘草的根、茎和叶子部位均含有丰富的蛋白质。丁原全等[18]测得甘草根茎中氨基酸种类多达18种,其中人体必需氨基酸含量达到62.87 mg/mL,证明甘草是一种优质蛋白资源。本实验通过水提法提取的3种甘草种子蛋白提取率最高可达19.14%、23.93%、22.60%,相对应的蛋白含量为36.54、30.80、30.12 mg/mL,虽然其蛋白提取率与含量均没有大部分豆科植物高,但其营养价值绝对不容小觑。由此推断,甘草种子有望作为一种优质蛋白质来源,代替甘草根入药,来实现充分利用甘草各个部位,节省甘草资源,进而实现变废为宝。
3.1.2 结构
蛋白质是由氨基酸经肽键连接而成的生物大分子,其结构能够反映其分子的聚集情况,能够影响甚至决定蛋白质的功能性质。黑芸豆蛋白在红外光谱扫描下表现出几个特征峰,包括3 278.63 cm-1处的酰胺 A 带、1 634.31 cm-1处的酰胺Ⅰ带和1 519.76 cm-1处的酰胺 Ⅱ 带[19]。李婷等[20]通过扫描电镜观察花生粕4种蛋白发现,在2 000 倍下4种蛋白结构具有显著差异;清蛋白表面存在棱状突起和孔隙;球蛋白表面不平整,无多孔结构;醇溶蛋白表面高度不均匀,呈球状,连接紧密。本实验根据分析3种甘草种子蛋白的红外光谱扫描图得知,3种样品均在1 640~1 660 cm-1处有吸收峰,其中乌拉尔甘草种子蛋白的吸收峰在1 637 cm-1处,归属于β-折叠,而胀果甘草和光果甘草种子蛋白的吸收峰分别在1 654 和1 664 cm-1处,说明均具有α-螺旋结构。通过观察3种甘草种子蛋白在500和1 000倍放大的扫描电镜图得知,乌拉尔甘草种子蛋白主要呈现出不规则的片状和纤维状聚集碎裂和疏松的结构状态;胀果甘草种子蛋白呈现出表面光滑的片状和棒状结构状态,且其厚薄较均匀;光果甘草种子蛋白呈现出不规则的棒状和片状及球状结构状态,且存在少量大小不一的微孔。综上所述,水提法提取的甘草种子蛋白与一些豆科植物有着相似的结构,因此也可能拥有一致的生物活性。
3.1.3 抗氧化
豆类因含有丰富的蛋白质成分被认为是天然抗氧化剂的来源,豆类蛋白质构成了世界上大多数地区人们饮食中不可或缺的部分,为促进机体健康付出的贡献不容忽视。曲柳青等[21]对英国红芸豆蛋白进行水解,得到的抗氧化肽对DPPH自由基和羟自由基均有较高的抑制效果,分别为215.31和181.59 U/mg。以往的研究结果证明,甘草多糖也拥有较高的抗氧化能力。柴美灵等[22]通过利用超声辅助水提法从乌拉尔甘草根中提取多糖,发现其对DPPH自由基有一定的清除作用,其IC50为2.80 mg/mL。MUTAILLIFU等[23]以光果甘草根为研究对象,发现其多糖对DPPH自由基有较强的清除效果,样品质量浓度为1.0 mg/mL时,其清除活性为约83%,并且在多糖质量浓度为2 mg/mL时,对羟自由基的清除率为24.1%。此外,最新研究发现3种甘草籽多糖的体外抗氧化活性均高于其根部多糖,并且与蛋白质结合的多糖可以增强分子的负电荷,能够更好地稳定自由基,抑制氧化反应[24]。本实验研究的甘草种子蛋白体外抗氧化活性结果显示,3种蛋白样品均有较好的自由基清除能力与还原能力,当样品质量浓度为1.0 mg/mL时,乌拉尔甘草种子蛋白对DPPH自由基、羟自由基的清除能力与总还原能力均为最高,分别为92.37%、77.30%和2.344;IC50分别为0.37和0.51 mg/mL。根据上述数据推断,甘草种子蛋白对自由基可能有更强的清除效果,对此还需进行更深入的研究比较来验证。此外,紫花芸豆蛋白的羟自由基清除率和总还原能力分别为23.96%和0.280 5[25]。因此,可以判断甘草种子具有较强的的体外抗氧化活性,并且甘草种子蛋白的体外抗氧化活性可能比部分豆科植物蛋白更高。
3.2 结论
本研究对3种甘草种子蛋白的最佳提取方法、结构和抗氧化能力进行了研究和比较。结果表明,水提法得到的蛋白提取率与含量均为最高,提取率分别为19.14%、23.93%、22.60%,含量分别为36.54、30.80、30.12 mg/mL;3种蛋白的红外光谱都较为相似,均显出了典型的蛋白吸收峰,其中乌拉尔甘草种子蛋白具有β-折叠结构,而胀果甘草和光果甘草种子蛋白具有α-螺旋结构。扫描电镜图像结果显示,3种蛋白呈现出不同的结构状态,但均保留了较完整的结构。此外,所有蛋白均对DPPH自由基和羟自由基有较强的清除能力以及总还原能力。由此可见,甘草种子蛋白具有较好的抗氧化能力,研究结果可为甘草种子蛋白的进一步探究和利用及甘草新型蛋白资源的开发提供参考依据。
[1] 王琼, 李捷, 司马依·合斯莱提.新疆甘草资源开发利用现状与保护措施[J].草食家畜, 2018(2):52-56.
WANG Q, LI J, SIMAYI H.Utilization status and protection measures for licorice resources in Xinjiang[J].Grass-Feeding Livestock, 2018(2):52-56.
[2] 包芳, 李羽涵, 杨志刚.甘草代谢组学的研究进展[J].中草药, 2018, 49(19):4 662-4 669.
BAO F, LI Y H, YANG Z G.Advances in metabolomics research of Glycyrrhizae Radix et Rhizoma[J].Chinese Traditional and Herbal Drugs, 2018, 49(19):4 662-4 669.
[3] 张明发, 沈雅琴.甘草及甘草酸类成分抗病毒性肺炎的药理作用研究进展[J].药物评价研究, 2020, 43(7):1 452-1 468.
ZHANG M F, SHEN Y Q.Research progress on pharmacologic effects of licorice and glycyrrhizic acids against virus pneumonia[J].Drug Evaluation Research, 2020, 43(7):1 452-1 468.
[4] 周外民, 赵富明, 李榜龙, 等.甘草酸二胺在普通型新型冠状病毒肺炎患者治疗中的临床价值[J].病毒学报, 2020, 36(2):160-164.
ZHOU W M, ZHAO F M, LI B L, et al.Clinical value of diammonium glycyrrhizinate in treatment of COVID-19[J].Chinese Journal of Virology, 2020, 36(2):160-164.
[5] 郭娅娅, 徐立然, 吴少天, 等.中医药辨治艾滋病的临床研究概况[J].广州中医药大学学报, 2020, 37(1):190-194.
GUO Y Y, XU L R, WU S T, et al.Overview of clinical trials of acquired immune deficiency syndrome treated by Chinese medicine[J].Journal of Guangzhou University of Traditional Chinese Medicine, 2020, 37(1):190-194.
[6] 蒲洁莹, 何莉, 吴思宇, 等.甘草属植物中三萜类化合物的抗病毒作用研究进展[J].病毒学报, 2013, 29(6):673-679.
PU J Y, HE L, WU S Y, et al.Anti-virus research of triterpenoids in licorice[J].Chinese Journal of Virology, 2013, 29(6):673-679.
[7] 徐谓, 李洪军, 贺稚非.甘草提取物在食品中的应用研究进展[J].食品与发酵工业, 2016, 42(10):274-281.
XU W, LI H J, HE Z F.Research advances in application of licorice extracts as food additives[J].Food and Fermentation Industries, 2016, 42(10):274-281.
[8] 高蕾蕾, 李迎秋.植物蛋白的研究进展[J].江苏调味副食品, 2018, 35(4):6-10;16.
GAO L L, LI Y Q.Research progress of plant protein[J].Jiangsu Condiment Subsidiary Food, 2018, 35(4):6-10;16.
[9] 吕凯波, 吕述权, 朱家乐.不同提取方式对红花籽粕蛋白提取率及其功能特性的影响[J].食品科技, 2020, 45(7):249-254.
LYU K B, LYU S Q, ZHU J L.Effects of different extraction methods on extraction yield and functional properties of protein from safflower seed meal[J].Food Science and Technology, 2020, 45(7):249-254.
[10] 乔杨波, 庄蕾, 黄伟华, 等.植物蛋白多肽的研究进展[J].中国调味品, 2021, 46(5):175-178;197.
QIAO Y B, ZHUANG L, HUANG W H, et al.Research progress of plant protein polypeptides[J].China Condiment, 2021, 46(5):175-178;197.
[11] 高琦, 刘梓蘅, 耿艺, 等.响应面优化花生叶可溶性蛋白提取工艺及抗氧化活性分析[J].核农学报, 2020, 34(4):796-804.
GAO Q, LIU Z H, GENG Y, et al.Optimization of the extraction process of soluble protein from peanut leaf by response surface methodology and its antioxidant activity[J].Journal of Nuclear Agricultural Sciences, 2020, 34(4):796-804.
[12] 龙国徽. 大豆蛋白的结构特征与营养价值的关系[D].长春:吉林农业大学, 2015.
LONG G H.Structural properties of soy protein and its relationship to the nutritional value[D].Changchun:Jilin Agricultural University, 2015.
[13] 李梁, 李慧萍, 邵颖, 等.不同提取方法对东北林蛙皮胶原蛋白理化特性的影响[J].食品工业科技, 2016, 37(14):142-147.
LI L, LI H P, SHAO Y, et al.Effects of different methods on physico-chemical properties of collagen deprived from Rana chensinensis (Rana dybowskii) skins[J].Science and Technology of Food Industry, 2016, 37(14):142-147.
[14] ORCHARD T S, LARSON J C, ALGHOTHANI N, et al.Magnesium intake, bone mineral density, and fractures:Results from the Women′s Health Initiative Observational Study[J].The American Journal of Clinical Nutrition, 2014, 99(4):926-933.
[15] 周丽卿, 杜双奎, 赵佳, 等.响应面法优化鹰嘴豆蛋白提取工艺[J].食品科学, 2012, 33(8):66-70.
ZHOU L Q, DU S K, ZHAO J, et al.Optimization of chickpea protein extraction using response surface methodology[J].Food Science, 2012, 33(8):66-70.
[16] 陈晓萌, 王常青, 訾艳, 等.2种红芸豆蛋白的提取及组分分析[J].食品科学, 2015, 36(2):149-154.
CHEN X M, WANG C Q, ZI Y, et al.Extraction and analysis of proteins from red kidney beans from different growing regions[J].Food Science, 2015, 36(2):149-154.
[17] 冯玉超, 王长远, 李玉琼, 等.芸豆蛋白与糖基化芸豆蛋白结构与功能特性研究[J].中国食品学报, 2019, 19(7):99-107.
FENG Y C, WANG C Y, LI Y Q, et al.Studies on the structure and functional characteristics of the kidney bean protein and the modified kidney bean protein[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(7):99-107.
[18] 丁原全, 李瑞海.甘草、生姜和大枣配伍前后18种氨基酸含量变化及其机制初探[J].中国药师, 2020, 23(2):370-372.
DING Y Q, LI R H.Study on the content changes of 18 amino acids before and after the compatibility of licorice, ginger and jujube and the underlying mechanisms[J].China Pharmacist, 2020, 23(2):370-372.
[19] 李杨, 闫世长, 齐宝坤, 等.绿原酸改性黑芸豆蛋白抗氧化活性与乳化性能研究[J].农业机械学报, 2020, 51(5):356-362.
LI Y, YAN S Z, QI B K, et al.Emulsifying properties and antioxidant activities of black kidney bean protein modified by chlorogenic acid[J].Transactions of the Chinese Society for Agricultural Machinery, 2020, 51(5):356-362.
[20] 李婷, 任虹, 王丹丹, 等.4种花生粕蛋白的理化性质及功能特性研究[J].中国粮油学报, 2016, 31(11):37-42.
LI T, REN H, WANG D D, et al.Physicochemical and functional properties of 4 peanut meal protein[J].Journal of the Chinese Cereals and Oils Association, 2016, 31(11):37-42.
[21] 曲柳青, 崔素萍, 韩晶, 等.英国红芸豆蛋白抗氧化肽的分离纯化及体外活性研究[J].中国食品学报, 2018, 18(12):164-169.
QU L Q, CUI S P, HAN J, et al.Research on purification and antioxidative activity in vitro of peptides prepared from the British red kidney bean[J].Journal of Chinese Institute of Food Science and Technology, 2018, 18(12):164-169.
[22] 柴美灵, 李娜, 乔宏萍, 等.Box-Behnken法优化甘草多糖提取工艺及其体外抗氧化活性分析[J].食品工业科技, 2021,42(23):192-200.
CHAI M L, LI N, QIAO H P, et al.Application of Box-Behnken design for ultrasonic-assisted extraction of Glycyrrhiza polysaccharide and its antioxidant activity analysis in vitro[J].Science and Technology of Food Industry, 2021,42(23):192-200.
[23] MUTAILLIFU P, BOBAKULOV K, ABUDUWAILI A, et al.Structural characterization and antioxidant activities of a water soluble polysaccharide isolated from Glycyrrhiza glabra[J].International Journal of Biological Macromolecules, 2020, 144:751-759.
[24] ROZI P, ABUDUWAILI A, MA S J, et al.Isolations, characterizations and bioactivities of polysaccharides from the seeds of three species Glycyrrhiza[J].International Journal of Biological Macromolecules, 2020, 145:364-371.
[25] 毛小雨, 许馨予, 杨鹄隽, 等.紫花芸豆蛋白体外消化产物的抗氧化活性及结构特征分析[J].食品科学, 2021, 42(3):56-62.
MAO X Y, XU X Y, YANG H J, et al.Antioxidant activity and structural characteristics of in vitro digestion products of purple speckled kidney bean (Phaseolus vulgaris L.) protein[J].Food Science, 2021, 42(3):56-62.