蜂蜜是蜜蜂采集植物的花蜜、分泌物或蜜露,与自身分泌物结合后,在巢脾内转化、脱水、贮存至成熟的天然甜物质[1]。枇杷蜂蜜是蜜蜂采集枇杷花蜜酿造而成的。枇杷蜜粉充足且花期长,是重要的冬季蜜源。枇杷果实味甜、营养丰富,枇杷蜂蜜中营养成分和独特风味来源于枇杷蜜源。枇杷蜂蜜色白浓稠,具有独特的杏仁香味,有润肺止咳、调节胃肠道功能和增强免疫力等功效,是蜜中佳品[2]。
蜂蜜中主要成分是糖类物质,低聚糖是蜂蜜中重要的营养功效成分,其中低聚异麦芽糖(异麦芽糖、黑曲霉二糖等)、低聚果糖(蔗果三糖等)、大豆低聚糖(蜜三糖等)以及龙胆低聚糖(龙胆二糖等)[3],功能性低聚糖能促进肠道中双歧杆菌、乳酸杆菌的生长[4],具有增强机体免疫力[5],促进营养物质吸收、降低胆固醇和调节肠道渗透压等功效[3]。蜂蜜的酿造过程是复杂的生物转化过程,目前已有对蜂蜜成熟过程中水分、单糖、蔗糖及酶值等物质变化规律的研究[6-7],但尚未见对成熟过程中低聚糖变化的相关研究,因此开展枇杷蜂蜜成熟过程中低聚糖变化规律研究,可为枇杷蜂蜜成熟过程中成分和生物活性变化研究提供依据。
目前对糖类物质的检测方法主要包括GC[8]、GC-MS[9]、HPLC[10]、超高效液相色谱-串联质谱技术(ultra-performance liquid chromatography tandem mass spectrometry,UPLC-MS/MS)[11]、高效阴离子交换色谱法(high performance anion exchange chromatography,HPAEC)[12],其中GC-MS因其灵敏度高、分离能力强,能准确定性识别等优势,已被广泛用于蜂产品中糖类物质分析[9,13]。本研究建立了枇杷蜂蜜中低聚糖GC-MS检测方法,分析枇杷蜂蜜成熟过程中低聚糖变化规律,为枇杷蜂蜜品质评价提供数据参考。
1 材料与方法
1.1 材料与试剂
枇杷蜂蜜样品:采集于江苏省苏州市吴中区东山镇,采集蜂种为中华蜜蜂(华中型)。在枇杷盛花期随机选择枇杷园内的蜂场作为采样点,样品采集前清空巢脾,每日清晨进行样品采集,每日采集3个蜂箱的蜂蜜作为平行样品,共计45个枇杷蜂蜜样品。
枇杷花蜜样品:直接吸取于处于盛花期的枇杷花上。枇杷蜂蜜和花蜜样品于-20 ℃贮存直至分析。
依据SN/T 0852—2012《进出口蜂蜜检验规程》中规定的水分测定方法测定枇杷花蜜和蜂蜜中的水分含量(质量分数),每个样品平行测定3次。样品采集信息及水分含量(质量分数)见表1。
表1 枇杷花蜜和成熟过程中蜂蜜样品信息表
Table 1 Information on loquat honey sample collection during maturation

注:水分含量以“平均值±标准偏差”表示;水分含量中同列不同字母表示差异显著(P<0.05)
采集日期酿造天数天气环境温度/℃相对环境湿度/%水分含量/%2020.12.07花蜜阴7.0~13.278~9653.66±2.91a2020.12.08花蜜阴5.0~9.776~8548.20±0.13b2020.12.031阴转多云3.0~12.063~8025.34±0.14c2020.12.042阴转晴3.0~14.045~6523.78±0.13c2020.12.053阴5.0~11.567~7122.31±0.57cd2020.12.064晴9.1~15.045~8822.85±0.71cd2020.12.075阴7.0~13.278~9622.93±1.59cd2020.12.086阴5.0~9.776~8523.13±3.17cd2020.12.097晴8.2~14.073~8120.91±0.96de2020.12.108晴9.1~11.373~7821.76±2.20d2020.12.119小雨转阴5.0~10.480~9220.13±0.23e2020.12.1210多云转晴4.0~10.081~9219.77±0.80e2020.12.1311多云转晴3.0~12.053~9119.42±0.81e2020.12.1412阴-1.0~7.045~7220.52±0.38de2020.12.1513晴-2.0~9.045~6818.89±0.47e2020.12.1614晴0.0~12.029~6818.89±0.88e2020.12.1715晴3.0~16.045~6819.19±0.26e
试剂:吡啶、六甲基二硅胺烷、三氟乙酸酐(均为分析纯)、松二糖(CAS:547-25-1,纯度为98%),上海阿拉丁试剂有限公司;盐酸羟胺(分析纯),北京酷来搏科技有限公司;无水乙醇(分析纯),天津市大茂化学试剂厂;苯基-β-D-葡萄糖苷(CAS:1464-44-4,纯度为98%)、黑曲霉二糖(CAS:497-48-3,纯度为93%)北京百灵威科技有限公司;蔗糖(CAS:57-50-1,纯度≥98%)、棉子糖(CAS:512-66-3,纯度≥98%)、α,α-海藻糖(CAS:99-20-7,纯度≥98%)、α,β-海藻糖(CAS:585-91-1,纯度为98%)、β,β-海藻糖(CAS:499-23-0,纯度为98%)、昆布二糖(CAS:34980-39-7,纯度≥95%)、麦芽糖(CAS:69-79-4,纯度≥98%)、异麦芽酮糖(CAS:13718-94-0,纯度≥98%)、龙胆二糖(CAS:554-91-6,纯度≥98%)、蜜二糖(CAS:585-99-9,纯度为98%)、异麦芽糖(CAS:499-40-1,纯度≥97%)、蜜三糖(CAS:512-69-6,纯度≥98%)、蔗果三糖(CAS:470-69-9,纯度≥98%)、吡喃葡糖基蔗糖(CAS:13101-54-7,纯度≥97%)、松三糖(CAS:597-12-6,纯度≥98%),上海源叶生物科技有限公司。
1.2 仪器与设备
QP 2010气相色谱-质谱联用仪,日本岛津公司;QL-866旋涡混匀器,海门市其林贝尔仪器制造有限公司;1-15PK离心机,Sigma有限公司;TUS-200P振荡型恒温金属浴,上海一恒科技有限公司;Auto Vap S60样品全自动氮吹仪,美国ATR公司;BSA124S分析天平(感量0.000 1 g),赛多利斯科学仪器(北京)有限公司。
1.3 溶液配制
准确称取适量苯基-β-D-葡萄糖苷,用体积分数80%乙醇水配制成0.025 mg/mL的内标工作溶液。准确称取棉子糖、α,α-海藻糖、α,β-海藻糖、β,β-海藻糖、蔗糖、昆布二糖、黑曲霉二糖、松二糖、麦芽糖、异麦芽酮糖、龙胆二糖、蜜二糖、异麦芽糖、蜜三糖、蔗果三糖、吡喃葡糖基蔗糖和松三糖标准品适量,用超纯水配制成5~200 mg/mL的储备液,于4 ℃下避光储存备用。
1.4 样品提取与衍生化处理
称取0.25 g蜂蜜样品溶解于25 mL 80%(体积分数)乙醇溶液中,涡旋混匀,于8 000 r/min,4 ℃离心10 min,吸取上清液1 mL,用80%(体积分数)乙醇水稀释10倍(测定蔗糖含量时需稀释50倍),吸取稀释液100 μL于1.5 mL离心管,于40 ℃氮吹至干,待衍生。参照RUIZ-MATUTE等[9]的方法,上述1.5 mL离心管中加入20 μL苯基-β-D-葡萄糖苷溶液(0.025 mg/mL),涡旋混匀,加入350 μL盐酸羟胺吡啶溶液(25 mg/mL),涡旋混匀,75 ℃反应30 min,随后加入350 μL六甲基二硅胺烷和35 μL三氟乙酸酐,涡旋混匀,45 ℃反应30 min,12 000 r/min,4 ℃离心10 min,取上清液至进样瓶内,用于GC-MS分析。
1.5 分析条件
1.5.1 色谱条件
色谱柱:DB-5(30 m×0.25 mm,0.25 μm);载气为氦气,流量0.99 mL/min;进样口温度300 ℃,不分流进样;升温程序:初始温度180 ℃,保持5 min,以10 ℃/min升温至255 ℃,保持1 min,然后以15 ℃/min 升温至265 ℃,保持1 min,然后以1 ℃/min升温至270 ℃,然后以10 ℃/min升温至300 ℃,然后以20 ℃/min升温至320 ℃,保持10 min,进样量1 μL。
1.5.2 质谱条件
电子电离源;离子源温度230 ℃;电离能量70 eV;溶剂延迟10 min;扫描类型:选择离子监测模式(selected ion monitoring,SIM)。低聚糖衍生物对应的保留时间、监测特征离子参数见表2。
表2 低聚糖的保留时间、监测离子
Table 2 Retention time and selected ions of oligosaccharide derivatives

注:*为定量离子
化合物保留时间/min监测离子(m/z)化合物 保留时间/min监测离子(m/z)苯基-β-D-葡萄糖苷12.623361*,217,204,319棉子糖14.613217*,361,319,204蔗糖16.120361*,217,204,319α,α-海藻糖17.580217*,361,204,319α,β-海藻糖17.990217*,361,204,319β,β-海藻糖18.403217*,361,204,319昆布二糖18.753204*,361,217,319黑曲霉二糖19.08719.703204*,361,217,319204*,361,217,319松二糖19.14319.293217*,204,361,319217*,204,361,319麦芽糖19.21719.527204*,361,217,319204*,361,217,319异麦芽酮糖20.26720.580204*,217,361,319204*,217,361,319龙胆二糖20.38720.933204*,361,217,319204*,361,217,319蜜二糖21.02321.687204*,361,217,319204*,361,217,319异麦芽糖21.23321.817204*,361,217,319204*,361,217,319蜜三糖25.760361*,217,204,319蔗果三糖25.827217*,361,204,319吡喃葡糖基蔗糖26.127361*,204,217,319松三糖26.517361*,217,204,319
1.6 数据处理
枇杷蜂蜜和花蜜样品中低聚糖含量均平行测定3次,数据结果均以“平均含量±标准偏差”表示。采用IBM SPSS Statistics 23数据分析软件进行方差分析。
2 结果与分析
2.1 GC-MS仪器条件优化
优化升温程序可实现多种低聚糖的色谱分离,17种低聚糖的衍生物总离子流色谱图见图1-a。但由于糖类物质结构类似,仅依靠色谱分离难以实现完全区分,因此需对质谱参数进行优化,以实现同时对蜂蜜中多种低聚糖的准确定性、定量分析。SIM模式下所获目标物色谱峰噪声干扰小,响应值高,目标物检测灵敏度高,因此采用SIM模式进行数据采集。糖类物质经质谱分析后获得的离子碎片相近,选择单一离子难以对低聚糖进行有效区分,因此选择响应值高且可以与其他物质有效区分的离子作为特征定量离子,另选择响应值较高的其他碎片离子作为特征定性离子,3种特征定量离子提取色谱图见图1-b~图1-d。

1-苯基-β-D-葡萄糖苷;2-棉子糖;3-蔗糖;4-α,α-海藻糖;5- α,β-海藻糖;6-β,β-海藻糖;7-昆布二糖;8- 黑曲霉二糖(特征色谱峰1);9- 松二糖(特征色谱峰1);10- 麦芽糖(特征色谱峰1);11- 松二糖(特征色谱峰2);12- 麦芽糖(特征色谱峰2);13- 黑曲霉二糖(特征色谱峰2);14- 异麦芽酮糖(特征色谱峰1);15- 龙胆二糖(特征色谱峰1);16- 异麦芽酮糖(特征色谱峰2);17- 龙胆二糖(特征色谱峰2);18- 蜜二糖(特征色谱峰1);19- 异麦芽糖(特征色谱峰1);20- 蜜二糖(特征色谱峰2);21- 异麦芽糖(特征色谱峰2);22-蜜三糖;23-蔗果三糖;24-吡喃葡糖基蔗糖;25-松三糖
a-总离子流色谱图(total ion chromatograms,TIC);b-m/z=204提取离子色谱图;c-m/z=217提取离子色谱图;d-m/z=361提取离子色谱图
图1 低聚糖标准品衍生物色谱图
Fig.1 Chromatograms of the oligosaccharide standard substance derivatives
2.2 衍生化方法选择
低聚糖不易挥发,通常先将其转化为易挥发的低聚糖衍生物后,再进行GC-MS分析。常见的衍生化方法主要为硅烷化、酰基化和烷基化衍生,其中硅烷化衍生适用于含活性氢官能团物质的衍生化反应,其衍生产物易挥发,结构稳定不易降解,可直接进行色谱分析,因此在本研究中被应用于蜂蜜中低聚糖的衍生化处理。但还原性低聚糖由于存在环化和开环转化等反应,直接进行硅烷化衍生时会产生多种异构体,难以准确定量。在硅烷化衍生前对低聚糖进行肟化反应,可使其环化反应受限,有效减少还原性低聚糖多种衍生产物的形成[14]。最终,经肟化-硅烷化衍生后,还原性低聚糖(黑曲霉二糖、麦芽糖、松二糖、异麦芽酮糖、龙胆二糖、蜜二糖和异麦芽糖)仅形成顺式和反式2种衍生产物;非还原性低聚糖(蔗糖、海藻糖,昆布二糖、棉子糖、松三糖、蜜三糖、蔗果三糖和吡喃葡糖基蔗糖)形成单一衍生产物[15],利于准确定量分析。
2.3 方法学评价
建立食品中内源性物质检测分析方法,需对其进行方法学评价,以确保检测方法的可靠性和有效性。目前,针对内源性物质的方法学评价主要有标准加入法、替代基质法和替代分析物法3种方式[16],由于枇杷蜂蜜样品中低聚糖响应较高,采用标准加入法添加同浓度目标分析物后,会出现峰值过饱和的现象,损伤仪器,同时不能实现对目标物的准确定量。此外,难以获得不含目标分析物的替代基质,使得替代基质法同样不适用于枇杷蜂蜜中低聚糖分析的方法学评价。最终采用替代分析物法进行方法学评价,选用与待测低聚糖结构类似且枇杷蜂蜜和花蜜中均不含有的苯基-β-D-葡萄糖苷作为替代物。为进一步验证其作为替代物的可行性,采用体积分数80%乙醇水配制17种低聚糖与苯基-β-D-葡萄糖苷的混合标准溶液经1.4节所述方法提取、衍生并上机测定。结果显示待测低聚糖回收率为81.72%~118.99%,苯基-β-D-葡萄糖苷回收率为118.83%,说明苯基-β-D-葡萄糖苷与待测低聚糖在提取以及衍生化过程中化学行为相近,同时,经色谱分离可实现良好区分,因此苯基-β-D-葡萄糖苷可作为待测低聚糖的替代物用于方法学评价。
2.3.1 基质效应评价
采用替代物评估枇杷蜂蜜中低聚糖含量分析方法的基质效应。枇杷蜂蜜样品经上述1.4节制备苯基-β-D-葡萄糖苷空白基质液。分别配制质量浓度为0.13~13.24 μg/mL的苯基-β-D-葡萄糖苷系列基质匹配标准工作溶液和溶剂标准工作溶液并进行测定。基质效应通过替代物的基质匹配标准曲线和溶剂标准曲线的斜率比进行评估,结果表明,替代物在枇杷蜂蜜中的基质效应为103.25%,符合欧盟对方法学评价中基质效应的相关要求[17],因此可采用溶剂标准曲线进行枇杷蜂蜜和花蜜中低聚糖的定量分析。
2.3.2 线性范围、检出限及定量限
内标法定量可减少前处理及仪器测定过程中的误差,降低基质干扰,实现对待测物的准确定量。因此本研究中选择苯基-β-D-葡萄糖苷为内标物,采用内标法对待测低聚糖进行定量分析。
吸取适量各低聚糖标准储备液,配制不同浓度低聚糖系列混合标准工作液(表3),按1.4节方法在衍生化前加入20 μL内标物苯基-β-D-葡萄糖标准溶液(0.025 mg/mL),经衍生化处理后上机测定。以低聚糖与内标物的峰面积比为纵坐标,以低聚糖浓度为横坐标绘制标准曲线,计算回归方程和相关系数。17种低聚糖标准曲线方程、回归系数及线性范围见表3。17种低聚糖在其相应的浓度范围内线性良好,相关系数均大于0.99。
表3 十七种低聚糖的溶剂标准曲线方程、相关系数和线性范围
Table 3 Regression equations,correlation coefficients,linear ranges of 17 kinds of oligosaccharides
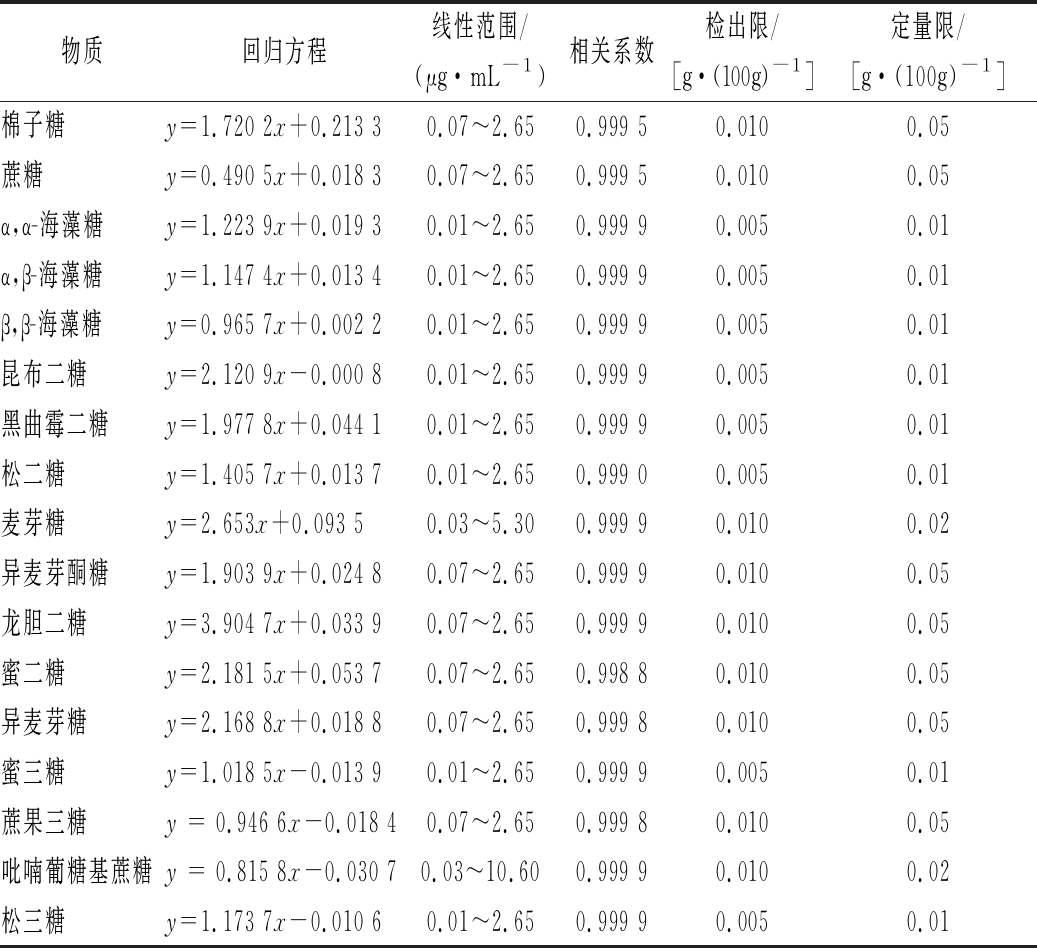
物质回归方程线性范围/(μg·mL-1)相关系数检出限/[g·(100g)-1]定量限/[g·(100g)-1]棉子糖y=1.720 2x+0.213 30.07~2.650.999 50.0100.05蔗糖y=0.490 5x+0.018 30.07~2.650.999 50.0100.05α,α-海藻糖y=1.223 9x+0.019 30.01~2.650.999 90.0050.01α,β-海藻糖y=1.147 4x+0.013 40.01~2.650.999 90.0050.01β,β-海藻糖y=0.965 7x+0.002 20.01~2.650.999 90.0050.01昆布二糖y=2.120 9x-0.000 80.01~2.650.999 90.0050.01黑曲霉二糖y=1.977 8x+0.044 10.01~2.650.999 90.0050.01松二糖y=1.405 7x+0.013 70.01~2.650.999 00.0050.01麦芽糖y=2.653x+0.093 50.03~5.300.999 90.0100.02异麦芽酮糖y=1.903 9x+0.024 80.07~2.650.999 90.0100.05龙胆二糖y=3.904 7x+0.033 90.07~2.650.999 90.0100.05蜜二糖y=2.181 5x+0.053 70.07~2.650.998 80.0100.05异麦芽糖y=2.168 8x+0.018 80.07~2.650.999 80.0100.05蜜三糖y=1.018 5x-0.013 90.01~2.650.999 90.0050.01蔗果三糖y = 0.946 6x-0.018 40.07~2.650.999 80.0100.05吡喃葡糖基蔗糖y = 0.815 8x-0.030 70.03~10.600.999 90.0100.02松三糖y=1.173 7x-0.010 60.01~2.650.999 90.0050.01
2.3.3 回收率和精密度
通过添加替代分析物开展方法的回收率和精密度评价[18],选择与目标物线性浓度范围内响应相近的替代物添加浓度进行添加回收实验。本方法中枇杷蜂蜜样品中分别按照0.01、0.10、1.00 g/100g添加苯基-β-D-葡萄糖苷,按照1.4节进行样品提取与衍生化处理,GC-MS测定,计算方法回收率和相对标准偏差。结果表明,蜂蜜样品中苯基-β-D-葡萄糖苷在3个添加浓度的回收率在87.43%~117.17%。日内相对标准偏差在2.97%~11.94%;日间相对标准偏差在5.25%~14.13%,说明方法准确性、稳定性良好,可满足检测的要求,因此本方法适用于枇杷蜂蜜和花蜜中低聚糖的定量分析。
2.4 枇杷蜂蜜和枇杷花蜜中低聚糖组成差异
枇杷蜂蜜和花蜜样品按1.4节方法进行提取和衍生化处理,采用1.5节GC-MS方法进行测定,结果表明,枇杷蜂蜜中共有效检出11种低聚糖,分别为蔗糖、α,β-海藻糖、黑曲霉二糖、松二糖、麦芽糖、异麦芽酮糖、异麦芽糖、蜜三糖、蔗果三糖、吡喃葡糖基蔗糖和松三糖。枇杷花蜜中共检出6种低聚糖,分别为蔗糖、β,β-海藻糖、昆布二糖、黑曲霉二糖、蔗果三糖和吡喃葡糖基蔗糖。枇杷蜂蜜低聚糖组成较花蜜更为丰富,枇杷花蜜和蜂蜜中低聚糖种类组成差异如图2所示,枇杷蜂蜜和花蜜中均含有蔗糖、黑曲霉二糖、蔗果三糖和吡喃葡糖基蔗糖。β,β-海藻糖、昆布二糖仅存在于花蜜中,并未在蜂蜜中发现,其原因是经蜂蜜酿造后,花蜜中昆布二糖和β,β-海藻糖可被β-葡萄糖苷酶和海藻糖酶分解为葡萄糖[19-20]。α,β-海藻糖、松二糖、麦芽糖、异麦芽酮糖、异麦芽糖、蜜三糖和松三糖7种低聚糖仅存在于枇杷蜂蜜中,其原因是在蜂蜜酿造过程中,在蜜蜂的分泌物和花蜜中酸类物质等作用下解离出花蜜中键合的低聚糖[6],同时存在酶解[7]和转糖基化[21]等作用使蜂蜜中的糖类物质发生转化,进而产生了更多种类的低聚糖。
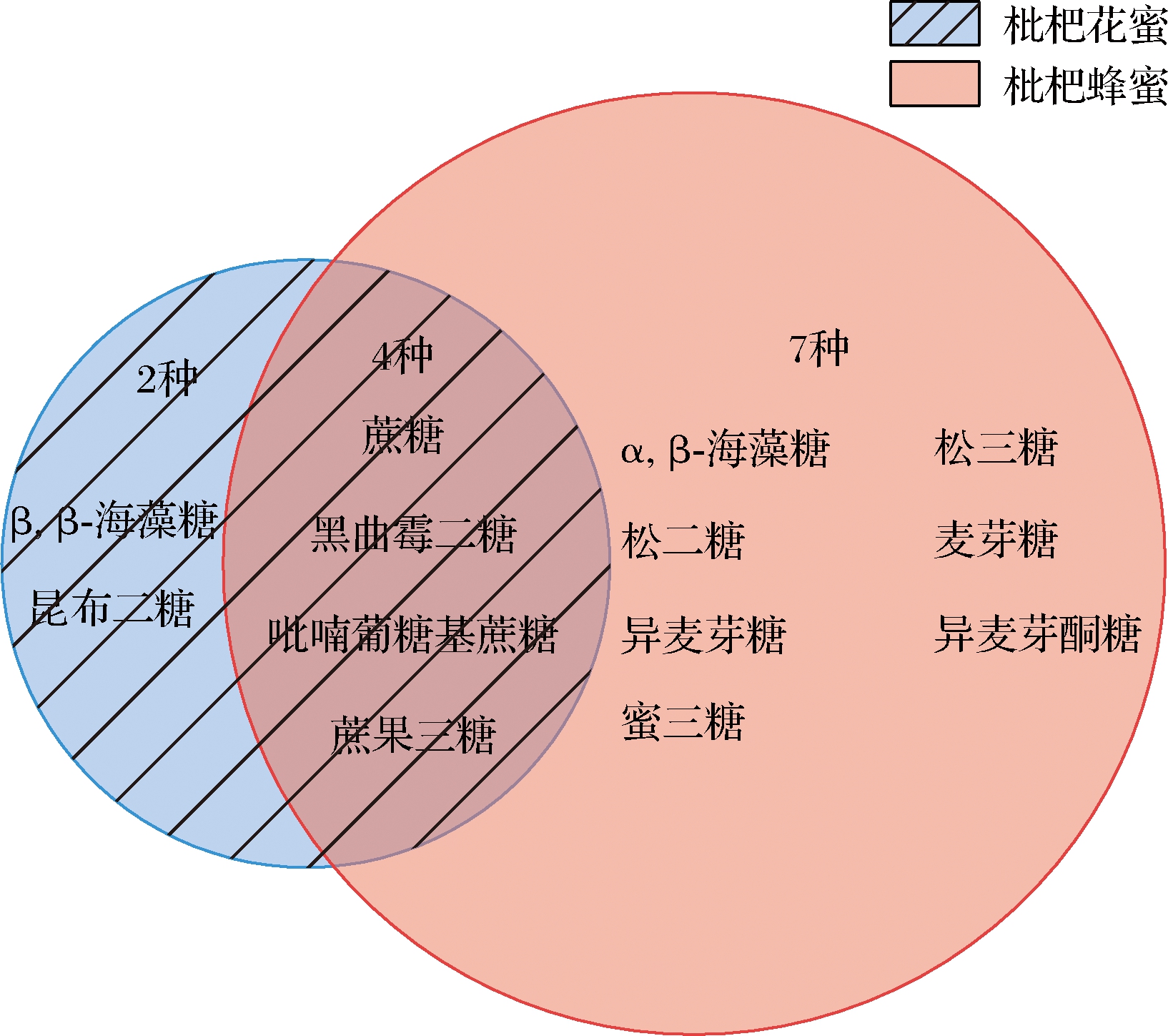
图2 枇杷花蜜和枇杷蜂蜜中低聚糖比较的韦恩图
Fig.2 Venn diagram for comparison of oligosaccharides in loquat nectar and loquat honey
2.5 枇杷蜂蜜中低聚糖含量特征分析
我国枇杷蜂蜜中低聚糖种类丰富,枇杷蜂蜜中各低聚糖的占比不同。酿造15 d的蜂蜜中,蔗糖含量占检出低聚糖总含量的52.10%;吡喃葡糖基蔗糖占30.10%;麦芽糖占10.96%;松二糖占1.51%;黑曲霉二糖占1.08%;异麦芽糖占0.95%;蔗果三糖占0.64%;异麦芽酮糖占0.55%;蜜三糖、α,β-海藻糖和松三糖含量偏低,占比均<0.50%。我国枇杷蜂蜜中低聚糖总含量丰富,11种低聚糖的总含量为15.77~20.97 g/100g,高于西班牙北部伊比利亚高原的薰衣草蜜、百花蜜、甘露蜜等蜂蜜(5.63~8.52 g/100g)[22]。
三糖中吡喃葡糖基蔗糖含量最高,含量范围为2.91~5.51 g/100g,高于西班牙枇杷蜂蜜、牛油果蜂蜜、树莓蜂蜜以及加拿大苜蓿蜂蜜、油菜蜜、三叶草蜜(0.07~3.43 g/100g)等蜂蜜[10,23]。蔗果三糖含量(0.07~0.12 g/100g)相对高于西班牙枇杷蜂蜜(0~0.09 g/100g)[23]。蜜三糖含量(0.05~0.14 g/100g)相对高于西班牙牛油果蜜、树莓蜜以及冬香薄荷蜜(0.00~0.05 g/100g)[23]。松三糖含量范围为0.03~0.05 g/100g,与报道的西班牙枇杷蜂蜜中松三糖含量范围(0.00~0.09 g/100g)接近[23]。本研究中枇杷蜂蜜中三糖含量(除松三糖外)较上述已报道的西班牙和加拿大蜂蜜高,其中吡喃葡糖基蔗糖含量最高,是我国枇杷蜂蜜中特征性三糖。
本研究中江苏东山白玉枇杷花蜜中蔗糖含量高达21.70 g/100g,高于报道的福建莆田枇杷花蜜中蔗糖含量(3.35 g/100g)[24]。不同品种枇杷中的糖类组差异[25]可能是不同品种枇杷花蜜中蔗糖含量差异的原因之一。由于枇杷蜜源中的蔗糖含量较高,导致枇杷蜂蜜中含有较高含量的蔗糖。经蜜蜂长时间酿造转化后,蔗糖含量在酿造15 d的蜂蜜中可降至9.24 g/100g,但高于GH/T 18796—2012《蜂蜜》所规定蜂蜜中蔗糖含量(≤5 g/100g)以及西班牙枇杷蜂蜜中蔗糖含量(0~0.1 g/100g)[23]。枇杷蜂蜜中,除蔗糖外,麦芽糖含量最高,含量为0.92~2.08 g/100g,高于西班牙枇杷蜂蜜(0.97~1.49 g/100g)[23]以及加拿大油菜蜜(0.76 g/100g)[10],但低于西班牙龙舌兰蜂蜜(2.71 g/100g)[23]。黑曲霉二糖在枇杷蜂蜜中含量为0.09~0.20 g/100g,与报道的加拿大油菜蜜中黑曲霉二糖含量(0.23 g/100g)接近[10],但低于西班牙枇杷蜂蜜(1.08~1.63 g/100g)[23]。松二糖在枇杷蜂蜜中含量为0.17~0.32 g/100g,低于西班牙枇杷蜂蜜(1.64~2.71 g/100g)[23]及西班牙其他10种蜂蜜(0.72~2.87 g/100g)[13];枇杷蜂蜜中海藻糖和异麦芽酮糖含量偏低,其中α,β-海藻糖含量(0.04~0.07 g/100g)低于西班牙牛油果蜜、百花蜜、枇杷蜜等蜂蜜(0.35~0.76 g/100g)[23];异麦芽酮糖含量(0.06~0.11 g/100g)接近报道的加拿大苜蓿蜂蜜中异麦芽酮糖含量(0.067 g/100g)[10],但低于西班牙枇杷蜂蜜(0.28~0.56 g/100g)[23]。本研究中枇杷蜂蜜中蔗糖、麦芽糖含量相对高于西班牙枇杷蜂蜜,其他二糖含量相对低于西班牙枇杷蜂蜜。
2.6 蜂蜜干重中低聚糖含量随酿造天数变化分析
蜂蜜酿造过程是脱除水分、富集与转化营养物质的复杂生物过程。随酿造时间延长,蜂蜜水分含量逐渐降低,如表1水分含量测定结果所示,花蜜中水分含量受环境影响较大,环境湿度高时采集的花蜜中水分含量高,可达53.66%质量分数。花蜜经蜜蜂采集酿造后,酿造1 d蜂蜜中水分含量降至25.34%,在酿造1~8 d的枇杷蜂蜜中水分含量在21.76%~25.34%波动变化,酿造9 d时水分含量下降,在酿造9~15 d枇杷蜂蜜中水分含量在18.89%~20.52%且含量无显著性差异。由水分变化规律可知,在酿造2 d后枇杷蜂蜜中水分含量低于24%,符合行业标准GH/T 18796—2012《蜂蜜》所规定的二等品水分含量要求;酿造13 d后枇杷蜂蜜水分含量低于20%,符合GH/T 18796—2012《蜂蜜》所规定的一等品水分含量要求。水分含量的减少对蜂蜜中物质具有一定的浓缩效应。本研究通过对样品干重中低聚糖含量[样品干重中低聚糖含量=样品湿重中低聚糖含量测定值/(100%-样品水分含量)]变化进行分析,以排除因浓缩效应造成的低聚糖含量上升。各低聚糖在枇杷花蜜和蜂蜜样品干重中的含量及单因素方差分析结果如表4所示。
表4 枇杷花蜜和蜂蜜中低聚糖含量(均值±标准差,n=3) 单位:g/100g干重
Table 4 Content of oligosaccharides in loquat nectar and loquat honey(mean±SD, n=3)
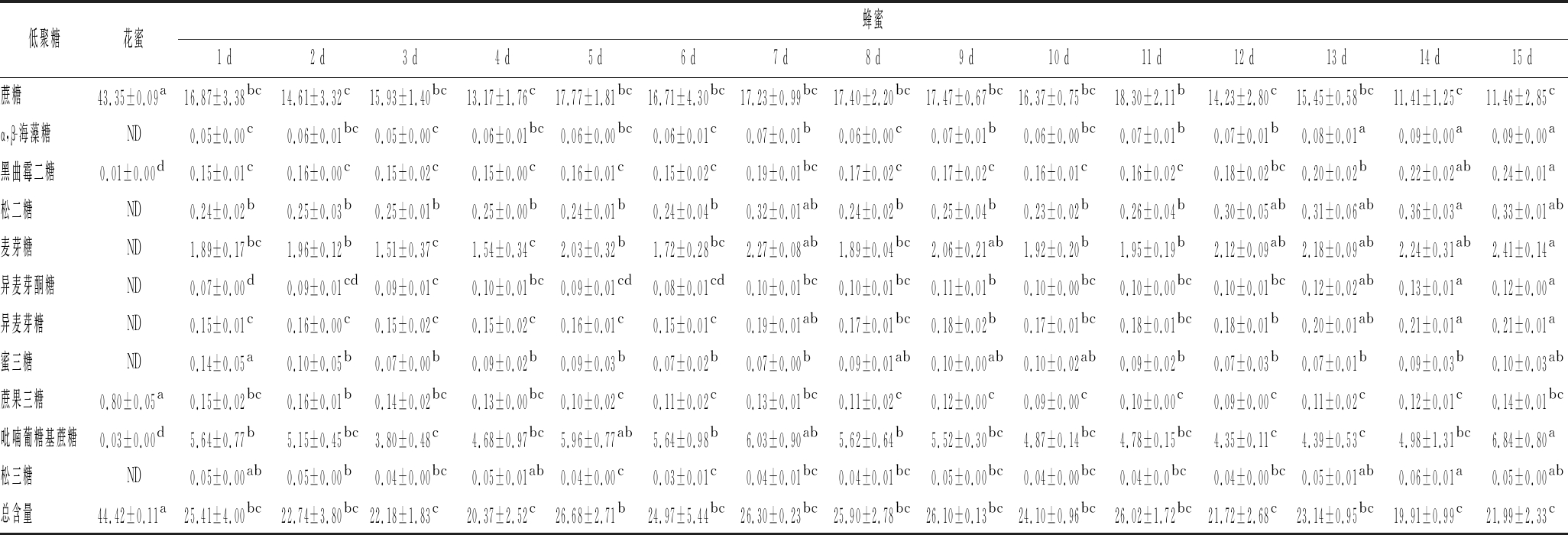
注:同行不同字母表示差异显著(P<0.05);ND表示未检出
低聚糖花蜜蜂蜜1 d2 d3 d4 d5 d6 d7 d8 d9 d10 d11 d12 d13 d14 d15 d蔗糖43.35±0.09a16.87±3.38bc14.61±3.32c15.93±1.40bc13.17±1.76c17.77±1.81bc16.71±4.30bc17.23±0.99bc17.40±2.20bc17.47±0.67bc16.37±0.75bc18.30±2.11b14.23±2.80c15.45±0.58bc11.41±1.25c11.46±2.85cα,β-海藻糖ND0.05±0.00c0.06±0.01bc0.05±0.00c0.06±0.01bc0.06±0.00bc0.06±0.01c0.07±0.01b0.06±0.00c0.07±0.01b0.06±0.00bc0.07±0.01b0.07±0.01b0.08±0.01a0.09±0.00a0.09±0.00a黑曲霉二糖0.01±0.00d0.15±0.01c0.16±0.00c0.15±0.02c0.15±0.00c0.16±0.01c0.15±0.02c0.19±0.01bc0.17±0.02c0.17±0.02c0.16±0.01c0.16±0.02c0.18±0.02bc0.20±0.02b0.22±0.02ab0.24±0.01a松二糖ND0.24±0.02b0.25±0.03b0.25±0.01b0.25±0.00b0.24±0.01b0.24±0.04b0.32±0.01ab0.24±0.02b0.25±0.04b0.23±0.02b0.26±0.04b0.30±0.05ab0.31±0.06ab0.36±0.03a0.33±0.01ab麦芽糖ND1.89±0.17bc1.96±0.12b1.51±0.37c1.54±0.34c2.03±0.32b1.72±0.28bc2.27±0.08ab1.89±0.04bc2.06±0.21ab1.92±0.20b1.95±0.19b2.12±0.09ab2.18±0.09ab2.24±0.31ab2.41±0.14a异麦芽酮糖ND0.07±0.00d0.09±0.01cd0.09±0.01c0.10±0.01bc0.09±0.01cd0.08±0.01cd0.10±0.01bc0.10±0.01bc0.11±0.01b0.10±0.00bc0.10±0.00bc0.10±0.01bc0.12±0.02ab0.13±0.01a0.12±0.00a异麦芽糖ND0.15±0.01c0.16±0.00c0.15±0.02c0.15±0.02c0.16±0.01c0.15±0.01c0.19±0.01ab0.17±0.01bc0.18±0.02b0.17±0.01bc0.18±0.01bc0.18±0.01b0.20±0.01ab0.21±0.01a0.21±0.01a蜜三糖ND0.14±0.05a0.10±0.05b0.07±0.00b0.09±0.02b0.09±0.03b0.07±0.02b0.07±0.00b0.09±0.01ab0.10±0.00ab0.10±0.02ab0.09±0.02b0.07±0.03b0.07±0.01b0.09±0.03b0.10±0.03ab蔗果三糖0.80±0.05a0.15±0.02bc0.16±0.01b0.14±0.02bc0.13±0.00bc0.10±0.02c0.11±0.02c0.13±0.01bc0.11±0.02c0.12±0.00c0.09±0.00c0.10±0.00c0.09±0.00c0.11±0.02c0.12±0.01c0.14±0.01bc吡喃葡糖基蔗糖0.03±0.00d5.64±0.77b5.15±0.45bc3.80±0.48c4.68±0.97bc5.96±0.77ab5.64±0.98b6.03±0.90ab5.62±0.64b5.52±0.30bc4.87±0.14bc4.78±0.15bc4.35±0.11c4.39±0.53c4.98±1.31bc6.84±0.80a松三糖ND0.05±0.00ab0.05±0.00b0.04±0.00bc0.05±0.01ab0.04±0.00c0.03±0.01c0.04±0.01bc0.04±0.01bc0.05±0.00bc0.04±0.00bc0.04±0.0bc0.04±0.00bc0.05±0.01ab0.06±0.01a0.05±0.00ab总含量44.42±0.11a25.41±4.00bc22.74±3.80bc22.18±1.83c20.37±2.52c26.68±2.71b24.97±5.44bc26.30±0.23bc25.90±2.78bc26.10±0.13bc24.10±0.96bc26.02±1.72bc21.72±2.68c23.14±0.95bc19.91±0.99c21.99±2.33c
2.6.1 枇杷蜂蜜酿造过程中二糖变化规律
在蜂蜜酿造过程中,蔗糖可被酶解为单糖[7],同时也可在酶的转化作用下转化为其他糖类物质[26],因此蔗糖含量随酿造时间延长呈下降趋势。蔗糖在花蜜干重中含量为43.35 g/100g,经蜂蜜酿造后,蔗糖含量下降,在酿造1~11 d蜂蜜干重中含量在13.17~18.30 g/100g范围内波动,酿造12 d后蔗糖含量显著降低并在14 d时降至最低含量(11.41 g/100g),之后含量无显著性差异。
除蔗糖外,枇杷蜂蜜中其他二糖在酿造过程中含量均呈上升趋势。麦芽糖是枇杷蜂蜜中含量较高的二糖,但未在枇杷花蜜中检出。已有报道显示,枇杷花蜜中存在麦芽四糖和麦芽五糖[22],枇杷蜂蜜的麦芽糖可来源于花蜜中麦芽多糖的分解[27]。麦芽糖在蜂蜜干重的含量在1~6 d内含量无显著性差异,含量为1.54~1.72 g/100g;7 d时含量上升至2.27 g/100g;在8~11 d内含量无显著性差异,含量为1.89~2.06 g/100g;12 d时含量开始持续上升并在15 d时达到最高含量(2.41 g/100g)。
松二糖、黑曲霉二糖、异麦芽糖、异麦芽酮糖和α,β-海藻糖在蜂蜜酿造过程中含量表现出相似的上升规律。松二糖、异麦芽糖、异麦芽酮糖和α,β-海藻糖均未在花蜜中检出,其在蜂蜜酿造过程中含量的增加可能源于糖类物质的转化作用。由于糖苷酶在分解糖类物质的同时伴随着转糖基化作用而产生新的低聚糖,如麦芽糖经转糖基化生成异麦芽糖[28]。黑曲霉二糖在花蜜干重中含量为0.01 g/100g,经蜜蜂酿造后,黑曲霉含量增加,除花蜜中黑曲霉二糖的富集外,也可能存在糖类物质的转化生成黑曲霉二糖。枇杷蜂蜜中松二糖、黑曲霉二糖、异麦芽糖、异麦芽酮糖和α,β-海藻糖在1~13 d内含量保持波动上升,在松二糖、黑异麦芽糖、异麦芽酮糖和α,β-海藻糖第14天含量达到最高水平,分别为0.36、0.21、0.13、0.09 g/100g,之后含量均无显著性差异;黑曲霉二糖在15 d时含量达最高(0.24 g/100g)。
由以上分析结果可知,枇杷蜂蜜中除蔗糖外,其他二糖含量均随酿造时间延长呈增加趋势,在酿造前期含量波动上升,其中麦芽糖和黑曲霉二糖在15 d时含量达最高;松二糖、异麦芽糖、异麦芽酮糖和α,β-海藻糖含量在14 d时达到最高,之后含量无显著性差异。
2.6.2 枇杷蜂蜜酿造过程中三糖变化规律
本研究中三糖在枇杷蜂蜜酿造过程中呈无规律波动性变化。枇杷蜂蜜中,除吡喃葡糖基蔗糖外,其他三糖经蜂蜜酿造后含量未表现出明显增加。吡喃葡糖基蔗糖在枇杷蜂蜜干重中含量显著高于花蜜,在酿造1~15 d中吡喃葡糖基蔗糖含量呈波动性变化,含量为3.80~6.84 g/100g,其在酿造15 d时含量上升至最高水平(6.84 g/100g)。酿造过程中蔗糖可经转糖基化作用生成吡喃葡糖基蔗糖[26],同时吡喃葡糖基蔗糖也可被酶解[29],在这两种转化作用的共同作用下可造成吡喃葡糖基蔗糖含量的波动性变化。
随酿造时间延长,蔗果三糖、蜜三糖和松三糖含量分别为0.09~0.16、0.07~0.14、0.03~0.06 g/100g。同时,蔗果三糖、蜜三糖和松三糖含量分别在酿造1 d与酿造15 d的枇杷蜂蜜干重中无显著性差异。值得注意的是,蔗果三糖在枇杷花蜜中干重含量达0.80 g/100g,显著高于枇杷蜂蜜干重中蔗果三糖含量。经蜜蜂酿造,花蜜中蔗果三糖被转化酶分解[30],可造成枇杷蜂蜜中蔗果三糖含量低于枇杷花蜜。蜂蜜酿造过程中物质分解和转化作用是导致三糖含量呈波动性变化的原因之一。
2.6.3 枇杷蜂蜜酿造过程中检出低聚糖总含量变化规律
随酿造时间的延长,蜜蜂将采集的花蜜不断添加到巢脾中,巢脾内蜜量增多,同时经蜜蜂振翅扇风和吞吐酿造,蜂蜜中水分被脱除,巢脾逐渐封盖。在酿造过程中营养物质被富集,同时也发生着物质转化。随酿造时间延长,枇杷蜂蜜中糖类物质经过蜜蜂充分酿造转化,在酿造后期各物质含量趋于稳定。蔗糖在枇杷蜂蜜11种低聚糖总含量中占比最高,随酿造时间延长蔗糖含量降低,也导致低聚糖总含量在蜂蜜干重中随酿造时间延长而降低,酿造14 d时低聚糖总含量达到最低(19.91 g/100g),之后含量无显著性差异。
3 结果与讨论
本研究建立了基于两步法衍生化的GC-MS法测定枇杷花蜜和不同酿造天数枇杷蜂蜜中低聚糖含量,该技术准确度高、精密度好,可为枇杷蜂蜜品质评价提供技术支持。通过测定枇杷花蜜和蜂蜜中低聚糖含量,发现花蜜经蜜蜂的酿造转化后,在蜂蜜中产生了种类更为丰富的低聚糖,且以吡喃葡糖基蔗糖为枇杷蜂蜜中特征性三糖。通过分析不同酿造天数枇杷蜂蜜中低聚糖含量变化规律,发现在蜂蜜酿造过程中,低聚糖含量处于动态变化中,随酿造天数延长低聚糖含量变化规律不同。二糖中,蔗糖含量下降,在酿造14 d时蔗糖含量降低至最低含量水平之后含量无显著性差异;其他二糖含量均呈上升趋势,松二糖等4种二糖含量在酿造14 d时达到最高,之后无显著性差异;麦芽糖和黑曲霉二糖含量在酿造15 d时达到最高。三糖含量在酿造过程中呈无规律波动变化,其中吡喃葡糖基蔗糖含量在蜂蜜酿造15 d时达到最高。本研究为制定枇杷蜂蜜的合理采收时间和鉴别其是否酿制完全提供数据支撑。
[1] 章彬佳, 程春生, 胡福良.蜂蜜中几种常见酶的研究进展[J].蜜蜂杂志, 2007, 27(6):11-13.
ZHANG B J, CHENG C S, HU F L.Research progress of several common enzymes in honey[J].Journal of Bee, 2007, 27(6):11-13.
[2] 龚蜜.枇杷蜜[J].蜜蜂杂志, 1993, 13(3):6-7.
GONG M.Loquat honey[J].Journal of Bee, 1993, 13(3):6-7.
[3] 邹月, 黄金凤, 魏琴.功能性低聚糖的研究进展及应用现状[J].中国调味品, 2021, 46(2):180-185;195.
ZOU Y, HUANG J F, WEI Q.Research progress and application status of functional oligosaccharides[J].China Condiment, 2021, 46(2):180-185;195.
[4] MAO B Y, LI D Y, ZHAO J X, et al.Metagenomic insights into the effects of fructo-oligosaccharides (FOS) on the composition of fecal microbiota in mice[J].Journal of Agricultural and Food Chemistry, 2015, 63(3):856-863.
[5] ZHAO S, PENG X, ZHOU Q Y, et al.Bacillus coagulans 13002 and fructo-oligosaccharides improve the immunity of mice with immunosuppression induced by cyclophosphamide through modulating intestinal-derived and fecal microbiota[J].Food Research International(Otuuawa,Ont.), 2021, 140:109793.
[6] 迟韵阳. 蜂蜜成熟过程中糖的变化及油菜蜜腺分泌蔗糖的分子机制[D].南昌:南昌大学, 2020.
CHI Y Y.Changes of carbohydrates during the ripening of honey and molecular mechanism of sucrose secretion in Brassica napus nectary[D].Nanchang:Nanchang University, 2020.
[7] 于泽浩. 蜂蜜成熟过程中成分变化的研究[D].福州:福建农林大学, 2017.
YU Z H.Research on the changes of components in honey during ripening[D].Fuzhou:Fujian Agriculture and Forestry University, 2017.
[8] LI B W, SCHUHMANN P J.Gas chromatographic analysis of sugars in granola cereals[J].Journal of Food Science, 1981, 46(2):425-427.
[9] RUIZ-MATUTE A I, BROKL M, SORIA A C, et al.Gas chromatographic-mass spectrometric characterisation of tri- and tetrasaccharides in honey[J].Food Chemistry, 2010, 120(2):637-642.
[10] SWALLOW K W, LOW N H.Analysis and quantitation of the carbohydrates in honey using high-performance liquid chromatography[J].Journal of Agricultural & Food Chemistry, 1990, 38(9):1 828-1 832.
[11] 魏京华, 陈历俊, 赵军英, 等.液相色谱-质谱法快速检测4种乳源低聚糖[J].食品科学, 2016, 37(14):86-91.
WEI J H, CHEN L J, ZHAO J Y, et al.Rapid and simultaneous detection of 4 milk oligosaccharides using LC-MS[J].Food Science, 2016, 37(14):86-91.
[12] GENG L J, HUANG J R, FENG F, et al.Determination of fructooligosaccharides in milk powder using high performance anion-exchange chromatography coupled with pulsed amperometric detection[J].Chinese Journal of Chromatography, 2014, 32(12):1 380-1 384.
[13] SANZ M L, SANZ J, MARTíNEZ-CASTRO I.Gas chromatographic-mass spectrometric method for the qualitative and quantitative determination of disaccharides and trisaccharides in honey[J].Journal of Chromatography A, 2004, 1 059(1-2):143-148.
[14] 熊喜悦, 盛小奇, 王华, 等.代谢组学气相色谱-质谱分析方法中样品衍生化技术的新进展[J].化学通报, 2015, 78(7):602-607.
XIONG X Y, SHENG X Q, WANG H, et al.Development of chemical derivatization in metabolites analysis by GC-MS[J].Chemistry, 2015, 78(7):602-607.
[15] 陶乐平, 丁在富, 张部昌.气相色谱在多糖结构测定中的应用[J].色谱, 1994, 12(5):351-354.
TAO L P, DING Z F, ZHANG B C.Application of gas chromatography in the determination of polysaccharide structure[J].Chinese Journal of Chromatography, 1994, 12(5):351-354.
[16] VAN DE MERBEL N C.Quantitative determination of endogenous compounds in biological samples using chromatographic techniques[J].Trends in Analytical Chemistry, 2008, 27(10):924-933.
[17] European Commission. SANTE/11945—2011 method validation and quality control procedures for pesticide residues analysis in food and feed[S]. European Commission. 2011.
[18] THOMPSON M, ELLISON S L R, FAJGELJ A, et al.Harmonized guidelines for the use of recovery information in analytical measurement [J].Pure and Applied Chemistry, 1999, 71(2):337-348.
[19] OPASSIRI R, KETUDAT CAIRNS J R, AKIYAMA T, et al.Characterization of a rice β-glucosidase highly expressed in flower and germinating shoot[J].Plant Science, 2003, 165(3):627-638.
[20] BECKER A, SCHLÖDER P, STEELE J E, et al.The regulation of trehalose metabolism in insects[J].Experientia, 1996, 52(5):433-439.
[21] SILVA S P, MOREIRA A S P, DOMINGUES M D R M, et al.Contribution of non-enzymatic transglycosylation reactions to the honey oligosaccharides origin and diversity[J].Pure and Applied Chemistry, 2019, 91(7):1 231-1 242.
[22] PASCUAL-MATÉ A, OSÉS S M, MARCAZZAN G L, et al.Sugar composition and sugar-related parameters of honeys from the northern Iberian Plateau[J].Journal of Food Composition and Analysis, 2018, 74:34-43.
[23] DE LA FUENTE E, SANZ M L, MART NEZ-CASTRO I, et al.Volatile and carbohydrate composition of rare unifloral honeys from Spain[J].Food Chemistry, 2007, 105(1):84-93.
NEZ-CASTRO I, et al.Volatile and carbohydrate composition of rare unifloral honeys from Spain[J].Food Chemistry, 2007, 105(1):84-93.
[24] 雷琼. 福建省两种蜜源植物花蜜中矿质元素和糖类物质的研究[D].福州:福建农林大学, 2012.
LEI Q.Study on the mineral elements and carbohydrate in two kind of plant necter in Fujian[D].Fuzhou:Fujian Agriculture and Forestry University, 2012.
[25] 陈秋燕, 周京一, 张波, 等.白肉枇杷与红肉枇杷成熟果实可溶性糖组成差异及其与蔗糖代谢相关酶活性的关系[J].果树学报, 2010, 27(4):616-621.
CHEN Q Y, ZHOU J Y, ZHANG B, et al.Sugar composition difference between white- and red-fleshed loquat fruits and its relation with activities of sucrose-metabolizing enzymes[J].Journal of Fruit Science, 2010, 27(4):616-621.
[26] ![]() L.Physicochemical parameters as a tool for the assessment of origin of honey[J].Journal of AOAC International, 2017, 100(4):840-851.
L.Physicochemical parameters as a tool for the assessment of origin of honey[J].Journal of AOAC International, 2017, 100(4):840-851.
[27] COLLINS B S, KELLY C T, FOGARTY W M, et al.The high maltose-producing α-amylase of the thermophilic actinomycete, Thermomonospora curvata[J].Applied Microbiology & Biotechnology, 1993, 39(1):31-35.
[28] PAYNE D W, EVANS W A L.Transglycosylation in the desert locust, Schistocerca gregaria Forsk[J].Journal of Insect Physiology, 1964,10(5):675-688.
[29] TAKEUCHI K, SAKAI S, MIYAKE T. Crystalline erlose: United States, US19850786823[P]. 1988-07-19.
[30] MANOOCHEHRI H, HOSSEINI N F, SAIDIJAM M, et al.A review on invertase:Its potentials and applications[J].Biocatalysis and Agricultural Biotechnology, 2020, 25:101599.