赤霉素(gibberellin,GAs)作为植物中一类重要的生长调节剂,在自然界广泛分布。赤霉素在植物生长过程中主要参与种子萌发,幼苗生长发育、果实成熟发育等重要的生理过程,其中以GA3最为活跃[1-2]。赤霉素通过促进细胞分裂伸长来调控植物株高、器官大小、叶面积以及根系发育;也有报道发现赤霉素对株高、单颗植株叶片数、新生枝鲜重等都有重要的影响[3-9]。近年来通过田间调研发现,为追求产量的增加,苋菜、菠菜等叶类蔬菜在种植过程中会外源施用赤霉素。因此,外源赤霉素的使用是否会有残留;以及外源赤霉素的施用是否会对人体健康产生危害也越来越多地引起关注。目前GB 2763—2019《食品中农药最大残留限量》标准中尚未制定赤霉素在蔬菜中的最大残留限量。日本肯定列表中对赤霉素在蔬菜中残留限量定为0.2 mg/kg[10]。据文献报道,赤霉素主要采用液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)法[11-17],高效液相色谱法[18-20]等方法检测。这些分析方法的应用范围包括茄果类蔬菜、葡萄等水果以及豆芽样品。采用的样品处理方法常为有机溶剂提取结合固相萃取净化等方法,存在操作繁琐、消耗时间长等不足。苋菜、菠菜等叶类蔬菜的基质成分复杂,基质干扰较大,增加了分析的难度。本文通过优化提取溶剂、提取时间、吸附剂、盐的种类和稀释倍数等实验条件,建立了基于QuEChERS与LC-MS/MS相结合的苋菜、菠菜中赤霉素的残留分析方法。并将此方法应用于市场上流通的苋菜、菠菜样品的分析检测。该方法具有快速、简便、准确等特点,满足苋菜、菠菜中农药残留分析的要求。
1 材料与方法
1.1 仪器与试剂
8050型液相色谱-串联质谱仪,日本岛津公司;HeidolphMul tiReax涡旋仪,德国Heidolph公司;高速离心机,德国Eppendorf公司;Milli Q超纯水系统,美国Millipore公司。
乙腈和甲醇(色谱纯),德国Merck公司;甲酸(纯度99%),美国Sigma公司;C18、石墨化碳黑(GCB)、Florisil净化剂,天津博纳艾杰尔公司;PSA净化剂,美国Agilent公司;乙酸、无水硫酸镁、无水醋酸钠(分析纯),广州化学试剂厂;0.22 μm尼龙66微孔过滤膜,天津津腾实验设备有限公司;赤霉素1 000 mg/L标准溶液(纯度≥99.0%),农业农村部环境质量监督检验测试中心(天津);苋菜、菠菜,样品购自本地市场。
1.2 样品前处理
称取5.00 g样品于50 mL离心管中,加入20.00 mL含1%(体积分数)乙酸的甲醇溶液,加入1.00 g无水硫酸镁和0.20 g无水醋酸钠,涡旋振荡2 min;后以4 500 r/min 离心5 min;取上清液用0.22 μm尼龙66滤膜过滤,待测定。
1.3 超高效液相色谱-串联质谱条件
色谱柱:岛津Shim-pack XR-ODSIII柱(2.0 mm×75 mm, 1.6 μm)。流动相A:0.1%甲酸水(体积分数);流动相B:乙腈;梯度洗脱程序:0~2 min, 10%B;2~5 min, 10%B~95%B;5~7 min, 95%B;7.1 min, 10%B。流速:0.3 mL/min;柱温:40 ℃;进样量:1 μL。雾化气:3 L/min;加热气:10 L/min;干燥气:10 L/min;离子源接口温度:300 ℃;脱溶剂温度:250 ℃;加热块:400 ℃。采用ESI离子源,负离子多反应监测模式(multi-reaction monitoring,MRM)检测。赤霉素的质谱检测参数见表1。
表1 赤霉素质谱检测参数
Table 1 Parameters of MS for the detection of GA3

注:*定量离子
分析物母离子(m/z)产物离子(m/z)驻留时间/msQ1/V碰撞能量/eVQ3/VGA3345.2143.0*100172814239.3100241615
1.4 标准溶液的配制
取1 000 mg/L赤霉素标准溶液,用甲醇配制成100 mg/L的储备液,-20 ℃保存。使用不含待测化合物的苋菜、菠菜空白基质将赤霉素分别配制成0.001、0.005、0.010、0.050、0.10、0.50、1.00 mg/L系列基质标准溶液。
1.5 正确度和精密度
称取经测定不含赤霉素的空白苋菜、菠菜样品5.00 g,分别对应添加0.010、0.10、0.50 mg/kg 3个浓度的标准溶液。涡旋混匀后放置过夜(约12 h),按照1.2节进行前处理。每个添加浓度重复5次,考察方法回收率和相对标准偏差(relative standard deviation,RSD),用以评价方法的正确度和精密度。
2 结果与分析
2.1 提取溶剂的选择
根据赤霉素的性质,以不含待测化合物的苋菜为基质,对比乙腈、含1%(体积分数)乙酸的乙腈、含2%(体积分数)乙酸的乙腈、甲醇、含1%(体积分数)乙酸的甲醇和含2%(体积分数)乙酸的甲醇溶液的提取效果。结果如图1所示,采用乙腈、含1%(体积分数)乙酸的乙腈、含2%(体积分数)乙酸的乙腈为提取溶剂的回收率为2%~65%;使用甲醇、含1%(体积分数)乙酸的甲醇和含2%(体积分数)乙酸的甲醇溶液为提取溶剂的回收率为70%~72%;甲醇及酸化甲醇的提取效果整体效果优于乙腈及酸化乙腈溶剂的提取效果,且含1%(体积分数)乙酸的甲醇为提取溶剂时赤霉素的回收率最好达72%,满足NY/T 788—2018《农作物中农药残留试验准则》中农药定量分析要求。本试验最终采用含1%(体积分数)乙酸的甲醇溶液为提取溶剂。

图1 提取溶剂对赤霉素回收率的影响
Fig.1 Effect of extraction solvent on recoveries of GA3
2.2 吸附剂的优化
试验对比了PSA、C18、GCB、Florisil、GCB+PSA、MgSO4+PSA+C18的净化效果,以及未使用吸附剂提取液直接检测的结果。结果如图2所示,单一使用PSA、C18、GCB或Florisil吸附剂时,赤霉素的回收率为68%~74%;使用GCB+PSA、MgSO4+PSA+C18时赤霉素的回收率为52%~60%;而未使用吸附剂的提取液直接进行检测时赤霉素的回收率最高,为79%,满足NY/T 788—2018《农作物中农药残留试验准则》中农药定量分析要求。本试验最终采用提取液过0.22 μm尼龙66有机滤膜后直接检测的条件。

图2 吸附剂对赤霉素回收率的影响
Fig.2 Effect of adsorbents on recoveries of GA3
2.3 提取时间的优化
试验考察了提取时间分别为1、2、3、4、5 min对方法回收率的影响。结果如图3所示,前1、2 min随着提取时间的延长,回收率也增加,分别为83%和86%;随着提取时间继续增加为3、4、5 min,回收率分别为79%、78%以及83%,其并未随提取时间的增而继续增加,反而呈现先降低再升高的趋势。因此提取2 min时,赤霉素的回收率最高,达85%以上且满足NY/T 788—2018《农作物中农药残留试验准则》中农药定量分析要求。综上所述,本研究最终采用2 min作为提取时间。

图3 提取时间对赤霉素回收率的影响
Fig.3 Effect of extraction time on recoveries of GA3
试验优化过程中发现,提取溶剂中加入盐后,会放出大量的热,且前2 min热量相对较高,而随着提取时间的增加释放的热量逐渐趋于减少,且在5 min时提取液的温度明显比提取1~2 min时低。因此结合提取时间与回收率的变化情况,分析原因是否是提取液温度的变化影响了赤霉素的提取效果,有待于后续研究进一步考证。
2.4 稀释倍数和盐的优化
在提取溶剂优化试验中发现,甲醇和乙腈在溶解盐的能力上存在明显的差别。在盐的种类、质量等均相同的条件下,甲醇对盐的溶解能力相对较差,更容易析出。试验中采用稀释2、3、4倍提取溶剂和4 g MgSO4+1 g NaAC、2 g MgSO4+1 g NaCl、1 g MgSO4+0.5 g NaAC和1 g MgSO4+0.2 g NaAC的组合来优化提取溶剂以及盐的种类、用量。结果如图4所示,当使用4倍提取液进行提取时,4种盐的组合对赤霉素的提取效率最好,都可达到76%以上。但是在多批次进样后发现,4 g MgSO4+1 g NaAC、2 g MgSO4+1 g NaCl 和1 g MgSO4+0.5 g NaAC的组合条件下离子源会析出大量的盐,严重影响了仪器的正常运行,同时色谱进样瓶中的分析样品随时间延长也会有部分盐析出,增加了损坏仪器的风险。而1 g MgSO4+0.2 g NaAC经过多次验证,重复进样离子源并没有盐析出,同时色谱进样瓶中的分析样品随时间的变化未见盐析出。综合上述试验结果,本试验最终采用4倍提取液和1 g MgSO4+0.2 g NaAC盐进行后续样品的分析。

图4 盐对赤霉素回收率的影响
Fig.4 Effect of salt on recoveries of GA3
2.5 线性方程、检出限(limit of detection, LOD)和定量限(limit of quantity, LOQ)
用1.2节的方法对空白苋菜、菠菜进行前处理,得到的2种空白基质用以配制标准溶液。以待测化合物浓度为横坐标(x),定量离子对的色谱峰面积为纵坐标(y)获得赤霉素的工作曲线。赤霉素在2种基质中的线性方程、LOD(信噪比S/N=3)和LOQ见表2,赤霉素的LOQ为添加的最低浓度0.010 mg/kg,满足NY/T 788—2018《农作物中农药残留试验准则》中关于苋菜和菠菜中赤霉素残留分析的要求。
2.6 方法回收率和精密度
按照1.5节所述进行添加回收试验。不同基质中赤霉素的回收率见表2。结果表明,赤霉素在苋菜、菠菜中的回收率为82%~91%,RSD为2%~6%,方法准确度和精密度均符合NY/T 788—2018《农作物中农药残留试验准则》中关于残留分析的要求。赤霉素在苋菜、菠菜空白样品中加标(0.05 mg/kg)的色谱图见图5。

a-苋菜;b-菠菜
图5 赤霉素在苋菜、菠菜空白样品中加标(0.05 mg/kg)的色谱图
Fig.5 MRM chromatograms of GA3 in edible amaranth and spinach spiked at 0.05 mg/kg level
2.7 样品基质效应的考察
农药残留检测过程中基质效应现象是影响定量准确度的关键因素之一,会对某些待测物的准确定量与定性造成影响,因此建立分析方法之时,必须要对待测物的基质效应进行评估。本研究以公式(1)对基质效应(matrix effects,ME)进行了评价[21]:
(1)
当ME>1时,则为基质增强效应;ME<1时,则为基质减弱效应;ME越接近1,表明基质效应越小。苋菜和菠菜作为植物源类食品中常见的叶类蔬菜,基质效应更是不可避免。采用上述基质效应评价方法对苋菜和菠菜中赤霉素的基质效应进行评价,结果显示(表2),赤霉素在苋菜中的基质效应为1.59;在菠菜中的基质效应为1.69,二者相近且均为较强的基质增强效应(ME≥1.59)。因此,为保证定量结果的准确性,本试验选择基质匹配外标法定量,用于对试验中所有检测结果的定量。
表2 赤霉素在苋菜和菠菜中的线性方程、添加回收率、RSD、基质效应、LOD和LOQ(n=5)
Table 2 Linear equations, recoveries, RSDs, matrix effects, LODs and LOQs of GA3 in edible amaranth and spinach
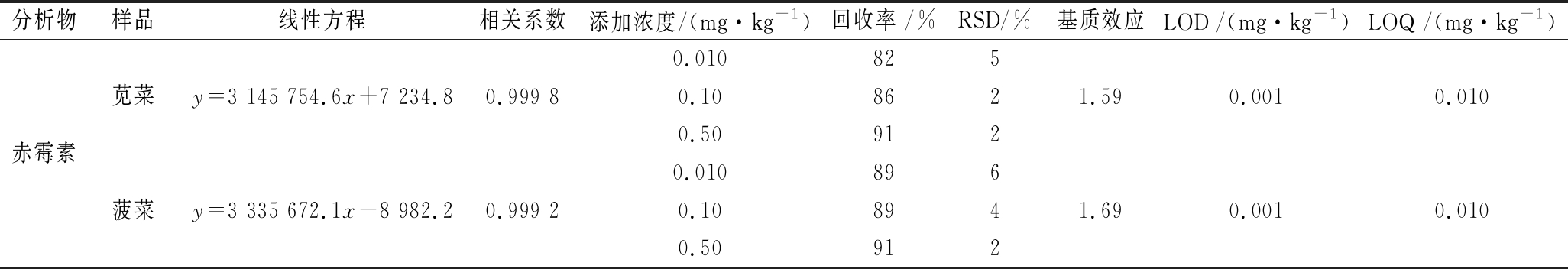
分析物样品线性方程相关系数添加浓度/(mg·kg-1)回收率 /%RSD/%基质效应LOD /(mg·kg-1)LOQ /(mg·kg-1)0.010825苋菜y=3 145 754.6x+7 234.80.999 80.108621.590.0010.010赤霉素0.509120.010896菠菜y=3 335 672.1x-8 982.20.999 20.108941.690.0010.0100.50912
2.8 实际样品分析
分析来自本地市场的苋菜131个样品,其中32个苋菜样品中检出赤霉素,最大值0.006 mg/kg,均低于LOQ。分析来自本地市场的菠菜331个样品,其中21个菠菜样品中检出赤霉素(≥LOQ),检出最大值0.16 mg/kg。详见表3。
表3 市场苋菜、菠菜样品中赤霉素的残留情况
Table 3 The residues of GA3 in market edible amaranth and spinach samples

样品类型样品数量/个检出最大值/(mg·kg-1)赤霉素检出率/%(≥0.001 mg/kg)超标率[11]/%(≥0.2 mg/kg)苋菜1310.00624.40菠菜3310.1618.70
3 结论
本文通过优化提取溶剂、提取时间、吸附剂类型、盐的种类和稀释倍数,建立了QuEChERS-LC-MS/MS快速测定苋菜和菠菜中赤霉素的分析方法。QuEChERS法易于操作、时间成本短;LC-MS/MS法除选择性、灵敏度等优势外,同时兼具高通量的特点。本文结合了2种技术的优点,能有效降低蔬菜基质干扰,同时使该方法在实际应用中更具有可操作性。试验分析结果表明,方法的灵敏度、准确度和精密度等满足农药残留检测的要求,适用于苋菜、菠菜等叶菜中赤霉素残留的快速分析。同时对市场131个苋菜样品、331个样品菠菜进行分析检测,赤霉素检出最大值为0.16 mg/kg,以日本肯定列表中对赤霉素在蔬菜中残留限量判定,无超标样品[11]。
[1] OGAWA M, HANADA A, YAMAUCHI Y, et al.Gibberellin biosynthesis and response during Arabidopsis seed germination[J]. The Plant Cell, 2003, 15(7):1 591-1 604.
[2] CHENG H, QIN L J, LEE S, et al.Gibberellin regulates Arabidopsis floral development via suppression of DELLA protein function[J].Development(Cambridge,England), 2004, 131(5):1 055-1 064.
[3] 江雪. 外源赤霉素对毛竹实生苗生长的影响[D].南京:南京林业大学, 2015.
JIANG X.The effects of exogenous gibberellin on growth of moso bamboo seedling[D].Nanjing:Nanjing Forestry University, 2015.
[4] 李品荣, 陈强, 常恩福, 等.李子丰产栽培技术研究[J].中国生态农业学报, 2003,11(1):124-126.
LI P R, CHEN Q, CHANG E F, et al.The study on high-yield cultivation techniques of plums[J].Chinese Journal of Eco-Agriculture, 2003, 11(1):124-126.
[5] KUCHLAN P, KUCHLAN M K, HUSAIN S M.Effect of foliar application of growth activator, promoter and antioxidant on seed quality of soybean[J].Legume Research, 2017, 40(2):313-318.
[6] DILIP W S, SINGH D, MOHARANA D, et al. Influence of gibberellic acid(GA3)on seed germination and seedling growth of Kagzi Lime[J]. Journal of Scientific Agriculture, 2017, 1:62-69.
[7] 徐小玉, 张凤银, 曹阳.赤霉素和乙烯利对美女樱种子萌发及幼苗生长的影响[J].种子, 2014, 33(6):72-74.
XU X Y, ZHANG F Y, CAO Y.Effects of gibberellin and ethephon on seed germination and seedling growth of Verbena hybrida[J].Seed, 2014, 33(6):72-74.
[8] RAHEMI M, BANINASAB A.Effect of gibberellic acid on seedling growth in two wild species of pistachio[J].The Journal of Horticultural Science and Biotechnology, 2000,75(3):336-339.
[9] 叶倩, 朱富伟, 陈汉才, 等.赤霉素对苋菜产量和营养品质的影响及其残留研究[J].中国农学通报, 2018, 34(18):65-70.
YE Q, ZHU F W, CHEN H C, et al.Amaranthus tricolor:Effect of GA3 on yield and nutritional quality and its residue dynamic[J].Chinese Agricultural Science Bulletin, 2018, 34(18):65-70.
[10] 中华人民国和国农业部农药检定所.中国农药信息网农药最大残留限量数据库[EB/OL]. http://www.icama.org.cn/fwb/index.jhtml.
Institute for the Control of Agrochemicals the people′s Republic of China. Pesticide maximum residue limit database of China Pesticide Information Network[EB/OL].http://www.icama.org.cn/fwb/index.jhtml.
[11] 周杨, 刘丽丽, 刘谦, 等.高效液相色谱-串联质谱法测定豆芽中赤霉素残留[J].农药科学与管理, 2015, 36(6):41-43.
ZHOU Y, LIU L L, LIU Q, et al.Determination of gibberellin residue in bean sprouts by HPLC-MS/MS[J].Pesticide Science and Administration, 2015, 36(6):41-43.
[12] 牟艳莉, 郭德华, 丁卓平, 等.高效液相色谱-串联质谱法测定瓜果中11种植物生长调节剂的残留量[J].分析化学, 2013, 41(11):1 640-1 646.
MOU Y L, GUO D H, DING Z P, et al.Determination of 11 kinds of plant growth regulator residues in fruits and melons by high performance liquid chromatography tandem mass spectrometry[J].Chinese Journal of Analytical Chemistry, 2013, 41(11):1 640-1 646.
[13] 张军, 杜平.高效液相色谱-串联质谱法测定葡萄中的吡效隆和赤霉素[J].色谱, 2011, 29(11):1 133-1 136.
ZHANG J, DU P.Determination of forchlorfenuron and gibberellin acid in the grapes using high performance liquid chromatography tandem mass spectrometry[J].Chinese Journal of Chromatography, 2011, 29(11):1 133-1 136.
[14] 陆益民, 易国斌, 陈创彬, 等.西瓜中 4种植物生长调节剂残留的分析方法研究[J].分析测试学报, 2011, 30(2):186-189.
LU Y M, YI G B, CHEN C B, et al.Study on method of determination of four plant growth regulater residues in watermelons[J].Journal of Instrumental Analysis, 2011, 30(2):186-189.
[15] 赵瑛博, 周艳明, 忻雪, 等.高效液相色谱-串联质谱法测定水果、蔬菜中赤霉素残留[J].食品科学, 2011, 32, (6):209-212.
ZHAO Y B, ZHOU Y M, XIN X, et al.Determination of gibberellin residue in vegetables and fruits by HPLC-MS/MS[J].Food Science, 2011, 32(6):209-212.
[16] 张婧雯,郭春海,葛世辉, 等.固相萃取-超高效液相色谱串联质谱法同时测定豆芽中6-苄基腺嘌呤、赤霉素和4-氯苯氧乙酸的残留量[J].中国食品卫生杂志, 2014, 26 (5):441-445.
ZHANG J W, GUO C H, GE S H, et al.Simultaneous determination of 6-benzylaminopurine,gibberellin and 4-chlorophenoxyacetic acid in bean sprouts by solid phase extractionultra high performance liquid chromatography tandem mass spectrometry[J].Chinese Journal of Food Hygiene, 2014, 26(5):441-445.
[17] 虞淼, 吴淑春.高效液相色谱-串联质谱同时测定草莓、杨梅中20种植物生长调节剂残留[J].食品科学, 2015, 36(24):246-252.
YU M, WU S C.Simultaneous determination of 20 plant growth regulator residues in strawberry and Chinese bayberry (Myrica rubra) by high performance liquid chromatography-tandem mass spectrometry[J].Food Science, 2015, 36(24):246-252.
[18] 黄红林, 刘实, 张桃芝.固相萃取-高效液相色谱测定番茄中的赤霉素 GA3残留[J].分析科学学报, 2005, 21(1):75-77.
HUANG H L, LIU S, ZHANG T Z.Determination of gibberellin residue in tomato by solid phase extraction-high performance liquid chromatography[J].Journal of Analytical Science, 2005, 21(1):75-77.
[19] 李海飞, 聂继云, 李静, 等.基质固相分散萃取-高效液相色谱法测定葡萄中赤霉素GA3残留量[J].中国果树, 2013(4):57-58;65.
LI H F, NIE J Y, LI J, et al.Determination of gibberellin residue in grapes by solid phase extraction-high performance liquid chromatography[J].China Fruits, 2013(4):57-58;65.
[20] 张敏, 闫超杰, 付海滨, 等.固相萃取净化-高效液相色谱测定水果中赤霉素、多效唑、烯效唑残留量[J].食品与发酵工业, 2014, 40 (2):192-195.
ZHANG M, YAN C J, FU H B, et al.Determination of gibberellin, paclobutrazol and uniconazole residues in fruits by SPE-HPLC[J].Food and Fermentation Industries, 2014, 40(2):192-195.
[21] HE Z Y, WANG L, PENG Y, et al. Multiresidue analysis of over 200 pesticides in cereals using a QuEChERS and gas chromatographytandem mass spectrometry-based method[J]. Food Chemistry, 2015, 169:372-380.