近年来,羊奶及其产品的生产和消费迅速增加,众多品牌纷纷进入市场,使市场呈现大规模增长。2017年世界羊奶年产量超过1 800万t,10年内(2007~2017年)累计增长约20%,市场趋势表明2030年羊奶产量将再增加53%[1-2]。由于羊奶脂肪分子小、易消化、低过敏性以及一些功能特性吸引了更多消费者,羊奶及其产品的需求量明显增加[3-4]。奶粉由于含水量低且无需冷藏,具有较长保存期、易于贮存和运输等优点,在国际乳品贸易中占比份额较大[5]。羊奶是一种季节性强且产量低的产品,而牛奶的价格低廉,促使国内外羊奶粉真实性或牛乳成分污染检测成为羊奶产品质量检测中的重点检测项目之一。GOLINELLI等[3]聚合酶链式反应(polymerase chain reaction,PCR)检测报告显示巴西4个品牌的20批山羊奶酪中都存在掺假牛奶的现象。有报道,采用双重PCR方法对巴西160份羊奶样品检测,发现市场上41.2%的羊奶中掺入了牛奶[6]。因此,羊奶及其产品价值提高和市场扩大趋势促使羊奶产品中牛奶成分的检测已成为必然。
目前,基于DNA的检测方法已逐渐取代基于蛋白质的检测方法。因为DNA与蛋白质相比,其耐热性更强,在大多数生物体细胞中均存在且不受物质形态的影响[7]。在DNA的分析方法中,PCR由于特异性好、灵敏度高已经被广泛应用[8]。MAFRA等[9]将PCR技术应用于含一定量牛奶的山羊奶酪和17份商业奶酪检测。DENG等[10]通过PCR法对原料奶和加工乳制品(冷冻干燥、巴氏杀菌、超高温灭菌)的二元混合物进行了检测。SOVOV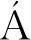 等[11]利用开发的基于PCR的高分辨率熔解曲线法对人工制备的乳制品和豆制品混合样品以及市售的真实产品进行了验证。目前采用PCR技术检测奶类掺假的研究较多,然而对于市售羊奶粉的掺假应用研究报道较少。
等[11]利用开发的基于PCR的高分辨率熔解曲线法对人工制备的乳制品和豆制品混合样品以及市售的真实产品进行了验证。目前采用PCR技术检测奶类掺假的研究较多,然而对于市售羊奶粉的掺假应用研究报道较少。
综上,本研究采集了38种国内外市售羊奶粉产品,其中包括纯羊奶粉和配方羊奶粉,提取其中DNA,通过普通PCR与实时荧光定量PCR对羊奶粉中的牛源性成分进行定性定量检测,为消费者提供目前市售羊奶粉的整体安全信息和质量参考,同时为食品安全监督管理部门提供理论依据。
1 材料与方法
1.1 材料
38种市售国内外品牌的羊奶粉产品线上、线下购于国内,包括33个纯羊奶粉(其中6个国外品牌)、5个配方羊奶粉(均为国内品牌)。对采集的样品进行编号和记录,国内羊奶粉品牌共32个,编号为1~31和38,国外羊奶粉品牌共6个,编号为32~37,所有羊奶粉在常温条件下保存,在较短时间内完成检测。纯羊奶粉和纯牛奶粉样品均为实验室前期对生鲜羊奶、牛奶喷雾干燥获得。
1.2 试剂与仪器
试剂:十二烷基磺酸钠(sodium dodecyl sulfate,SDS),Sigma公司;Tris平衡酚、氯仿、异戊醇、无水乙醇,西安晶博生物技术有限公司;6×DNA loading buffer、琼脂糖、2×Es Taq MasterMix、UltraSYBR Mixture、Bio DL 2 000、蛋白酶K、Dured 核酸染料,康为世纪生物科技有限公司;引物(ATP-6和12SBT-REV),生工生物工程股份有限公司。
仪器:ND-1000超微核酸分析仪,美国热电公司;T100 Thermal Cycler梯度PCR仪、CFX Connect Optics Module实时荧光定量PCR仪,BIO-RAD;UVCI-1100凝胶呈像仪,Major Science;TGL-16aR高速冷冻离心机,上海安亭科学仪器厂;1-14K台式小型离心机,美国Sigma公司;HH4数显恒温水浴锅,江苏金坛友谊仪器研究所;DYY-4C水平电泳仪,北京六安仪器厂。
1.3 羊奶粉中DNA的提取
称取1 g羊奶粉样品加入9 mL蒸馏水溶解均匀,5 000 r/min离心10 min,弃去上层清液,加入600 μL磷酸盐缓冲溶液(phosphate buffer saline,PBS)充分混合,12 000 r/min离心10 min,弃去上层清液,保留底部沉淀。向上述沉淀物中加入350 μL DNA提取缓冲液,50 μL SDS和20 μL蛋白酶K,混合均匀后置于56 ℃恒温条件下水浴4 h。加入500 μL DNA提取酚试剂充分混匀,12 000 r/min离心10 min;取上清液加入等体积V(DNA提取酚)∶V(氯仿)∶V(异戊醇)=25∶24∶1的混合液萃取1次,12 000 r/min离心10 min;再取上清液加入等体积V(氯仿)∶V(异戊醇)=24∶1的混合液萃取2次,12 000 r/min离心10 min;再取上清液加入2倍体积无水乙醇,12 000 r/min离心10 min,弃去上清液,加入体积分数75%的乙醇沉淀DNA,离心5 min后弃去乙醇溶液,将液体晾干,最后加入30 μL TE溶液溶解DNA沉淀。
1.4 DNA含量、纯度以及PCR扩增效果检测
采用超微量核酸分析仪测定总DNA浓度和纯度。吸取1 μL TE缓冲溶液作为空白对照,同样吸取1 μL DNA样品测定读取浓度和纯度。将提取的羊奶粉DNA用1%(质量分数)的琼脂糖凝胶在110 V下电泳40 min,在凝胶成像仪下观察DNA的完整性。利用线粒体引物ATP-6进行普通PCR扩增,以检验提取出的可扩增DNA的质量。
PCR反应体系:3.4 μL 2×Es Taq MasterMix,引物各0.3 μL,DNA模板1 μL,加入ddH2O补齐至10 μL。PCR扩增条件:在95 ℃预变性5 min;94 ℃变性30 s,60 ℃(12SBT-REV)/58 ℃(ATP-6)退火30 s,72 ℃延伸30 s,重复30个循环;最后在72 ℃总延伸10 min。PCR反应产物使用1%的琼脂糖凝胶在110 V下电泳40 min后,在凝胶成像仪紫外光下观察并拍照。具体引物序列见表1。
表1 引物序列及扩增片段长度
Table 1 Primer sequence and amplified fragment length

引物名称引物序列(5'—3')片段大小/bp参考文献ATP-6F:TATTAGGCCTCCCCCTTGTT294[12]R:CCCTGCTCATAAGGGAATAGCCC12SBT-REVF:CTAGAGGAGCCTGTTCTATAATCGATAA346[13]R:AAATAGGGTTAGATGCACTGAATCCAT
1.5 普通PCR检测羊奶粉掺假牛乳成分
1.5.1 普通PCR检测羊奶粉中牛奶粉DNA的检测限
为了确定本试验中普通PCR对牛奶粉中DNA的检测能力,将纯牛奶粉以0.01%、0.1%、0.5%、1%、5%、10%、30%和50%(质量分数)的比例与纯羊奶粉混合均匀,并从中提取DNA。以牛特异性基因12SBT-REV为目的基因,使用上述PCR反应体系及条件,经过琼脂糖凝胶电泳后,在凝胶成像仪下拍照。
1.5.2 普通PCR定性检测羊奶粉产品中的牛乳成分
按照上述DNA的提取方法从羊奶粉中提取DNA,采用牛特异性目的基因12SBT-REV进行普通PCR扩增,以检测38种羊奶粉产品中的牛乳成分。
1.6 实时荧光定量PCR检测羊奶粉掺假牛乳成分
1.6.1 实时荧光定量PCR检测牛奶粉DNA的灵敏度
将纯牛奶粉中提取的DNA以10倍梯度进行连续稀释,即DNA质量浓度分别稀释成100、10、1和0.1 ng/μL,再结合SYBR Green I染料进行实时荧光定量PCR,以测定12SBT-REV的扩增效率和灵敏度。每个稀释度进行3次重复,以DNA浓度的对数值与获得的Ct值建立标准曲线。实时荧光定量PCR的扩增效率根据标准曲线的斜率按照公式(1)进行计算:
扩增效率/%=[10(-1/斜率)-1]×100
(1)
实时荧光定量PCR反应体系:5 μL 2×Ultal SYBR Mixture,上下游引物各0.3 μL,1 μL的DNA模板,用ddH2O将反应体系补齐至10 μL。反应条件为95 ℃预变性10 min;95 ℃变性30 s,60 ℃退火1 min,72 ℃延伸1 min,40个循环。在每个循环结束处采集1次荧光信号,熔解曲线温度为65 ℃升高至94 ℃。
1.6.2 实时荧光定量PCR定量检测羊奶粉产品中的牛乳成分
将纯牛奶粉分别按照比例0.1%、0.5%、1%、5%、10%、30%和50%(质量分数)与纯羊奶粉混合均匀以制备掺假模型标准曲线。从制得的二元混合物中提取DNA,并使用牛的引物对12SBT-REV,在上述实时荧光定量PCR反应条件下进行定量检测。再将经过普通PCR定性检测出的掺假羊奶粉以同样的实时荧光定量PCR条件进行定量检测。
1.7 统计分析
每个样品均进行3次平行测定,结果取平均值。实验数据采用SPSS 22.0 统计分析软件进行T检验和显著性分析。
2 结果与分析
2.1 羊奶粉DNA含量、纯度、完整性的检测结果
2.1.1 DNA纯度与含量的检测
从38种羊奶粉中提取的DNA利用超微量分光光度计测定,不同种类羊奶粉的DNA纯度和含量的测定结果如图1所示。DNA的OD260/280值为1.3~1.5,其中从纯羊奶粉中提取DNA的OD260/280值约为1.4,显著高于配方羊奶粉中DNA的OD260/280值约1.25(P<0.05),而最佳的DNA的OD260/280值通常为1.8。DNA质量浓度为200~500 ng/μL,其中从纯羊奶粉中提取的DNA含量显著高于配方羊奶粉(P<0.05)。该结果表明,纯羊奶粉中提取DNA的纯度和含量均较高于配方羊奶粉。

a-DNA纯度;b-DNA含量
图1 不同种类羊奶粉中DNA的纯度和含量
Fig.1 Purity and content of DNA in different types of goat milk powder
注:*表示纯羊奶粉和配方羊奶粉之间有显著性差异(P<0.05)
2.1.2 DNA琼脂糖凝胶电泳检测
为了检测DNA的降解程度,对38种羊奶粉中提取的总DNA进行琼脂糖凝胶电泳检测,结果如图2所示。从羊奶粉产品中得到的总基因组DNA均呈现出不同程度的弥散和拖尾,部分加样孔较亮,表明样品中提取的DNA有较明显的降解,可能含有蛋白质、酚等杂质污染。

1~38-38种羊奶粉样品;M-DL 2000 Marker
图2 38种市售羊奶粉中DNA琼脂糖凝胶电泳图
Fig.2 Agarose gel electrophoresis of DNA in 38 commercially available goat milk powders
2.1.3 PCR检测的结果
PCR成功扩增是判定DNA质量的一个重要依据,通常需要较高质量的DNA模板。如图3所示,采用羊特异性引物ATP-6对所提取的DNA样品进行普通PCR扩增,本研究中38个样品中所提取的总基因组DNA均可扩增出294 bp的目的基因片段,条带清晰且明亮,空白对照无条带。因此,羊奶粉样品中所提取的DNA虽然有不同程度降解,但均具有满足PCR扩增的模板数量和质量,可用于后续掺假检测分析。

1~38-38种羊奶粉样品;M-DL 2000 Marker;NTC-无模板对照
图3 38种市售羊奶粉中DNA的羊线粒体基因ATP-6的PCR电泳图
Fig.3 PCR electrophoresis of ATP-6 of the goat mitochondrial gene from DNA in 38 commercially available goat milk powders
2.2 牛乳中DNA的普通PCR检测限
以12SBT-REV为特异性引物对不同掺假比例牛乳提取的DNA进行普通PCR扩增,电泳结果如图4所示。泳道1~8依次表示牛乳掺假比例为0.01%、0.1%、0.5%、1%、5%、10%、30%、50%(质量分数),NTC表示无模板对照,明显观察到0.01%比例的泳道没有出现目标条带,从0.1%到50%比例的泳道随着牛乳成分掺假比例的增加,得到目的条带的亮度依次增加。因此,普通PCR可以实现羊奶粉中牛源性成分的定性检测,并且最低可以检测到0.1%的牛源性成分。
泳道1~8-羊奶粉中含有0.01%、0.1%、0.5%、1%、5%、10%、30%、50%(质量分数)的牛奶粉;NTC-无模板对照;M:DL2000 Marker
图4 牛乳中DNA的普通PCR掺假检测限
Fig.4 Detection limit of DNA adulteration in cow′s milk by ordinary PCR
2.3 牛乳中DNA的实时荧光定量PCR灵敏度检测
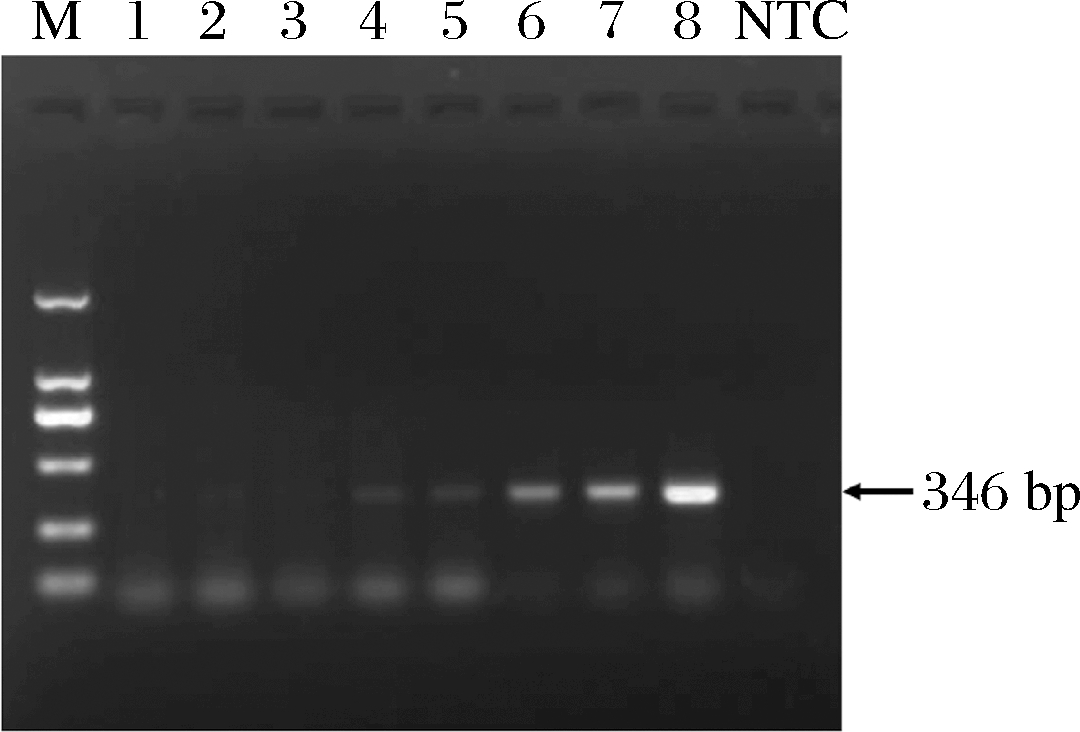
为了测定牛特异性引物12SBT-REV在实时荧光定量中的扩增效率和灵敏度,对牛奶粉中提取的DNA进行10倍梯度稀释,得到100~0.1 ng的灵敏度(图5)。所得标准曲线的斜率为-3.141,表明扩增效率为108.1%。因此,特异性引物12SBT-REV在实时荧光定量中灵敏度较好,可以用于下一步的试验。
图5 牛奶粉中DNA检测灵敏度
Fig.5 Sensitivity of DNA detection in milk powder
2.4 普通PCR定性检测羊奶粉中掺假牛源性成分的结果
对38种市售羊奶粉进行掺假检测试验,使用纯羊奶粉和纯牛奶粉分别作为阴性和阳性对照,同时设置空白对照。检测结果如图6所示,在38种羊奶粉产品中,共检测出8种产品含有牛源性成分,样品序号分别是2、3、7、8、12、17、18和30号。根据羊奶粉产品配料表(表2)得知,样品7、12、17和30号样品中分别添加有乳清蛋白粉或者脱盐牛乳清粉,与检测结果相一致。而国产羊奶粉样品2、3、8和18号样品的配料表中均显示为生羊乳,未标明添加有牛乳成分。故该4种羊奶粉中存在牛源性成分污染或掺假情况。15号样品虽然为配方羊奶粉,但在其配料表中未标示含有牛乳成分,并且也未检测到含有牛乳成分,说明产品中不含牛乳成分,与检测结果相一致。综上所述,在38种羊奶粉产品中共检测到4种国产羊奶粉产品(2、3、8和18号样品)与配料表不相符,具有牛源性成分污染或掺假的情况。

1~38-38种羊奶粉样品;M-DL 2000 Marker;NTC-无模板对照;牛-纯牛奶粉;羊-纯羊奶粉
图6 38种市售羊奶粉中牛源性成分定性检测结果
Fig.6 Qualitative test results of bovine-derived components in 38 commercial goat milk powder
2.5 实时荧光定量PCR检测羊奶粉中牛源性成分的结果
为了量化羊奶粉中的牛源性成分,通过ΔCt值与牛源性成分百分比的对数建立的定量标准曲线如图7。该图显示羊奶粉中含有0.1%~50%(质量分数)的牛源性成分时,所建立的标准曲线线性良好(R2=0.986 9),表明羊奶粉中牛源性成分含量为0.1%~50%时可以用此标准曲线进行定量检测。
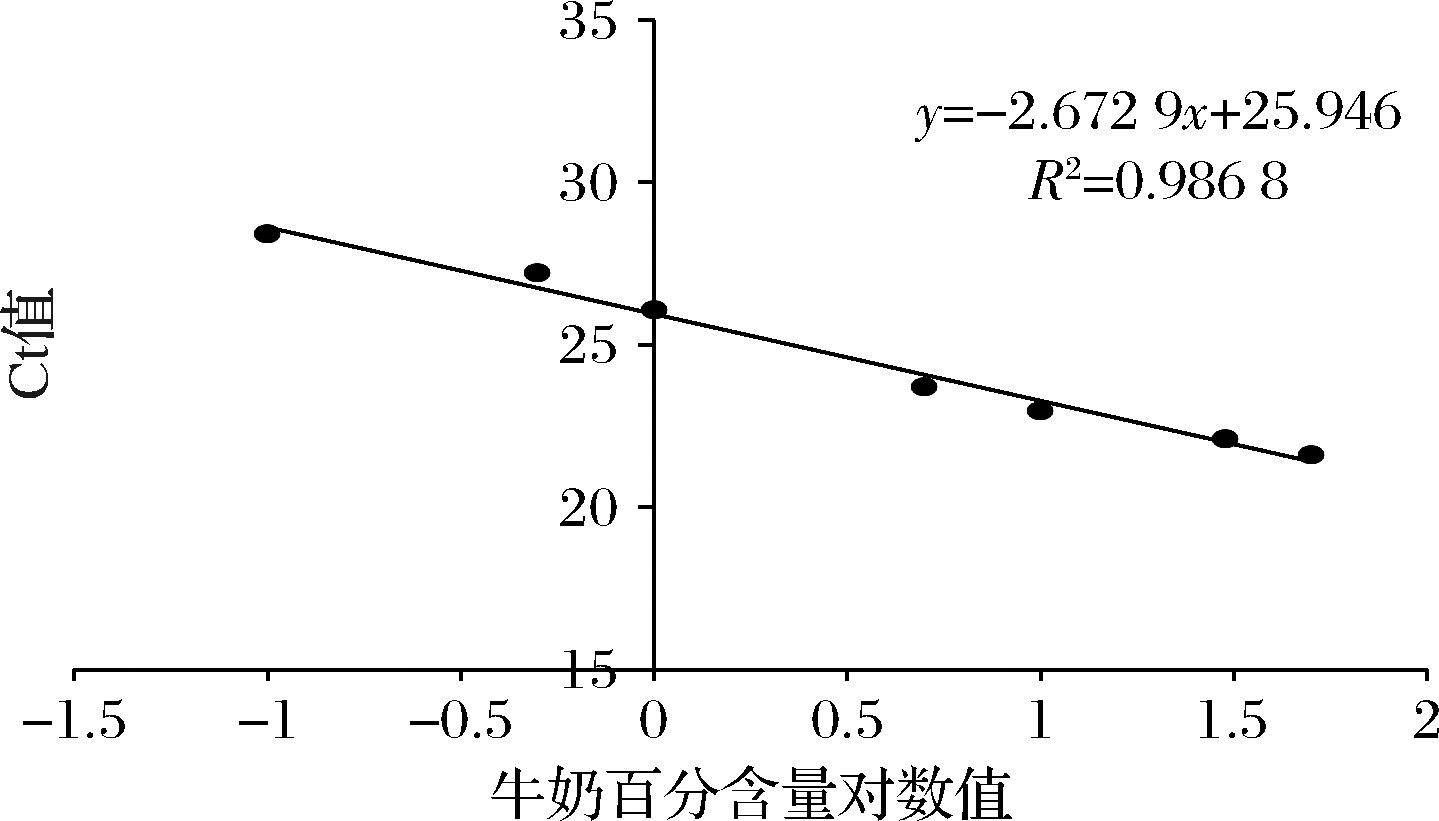
图7 实时荧光定量PCR检测掺假牛源性成分标准曲线
Fig.7 Standard curve of quantitative real-time PCR for detection of adulterated bovine-derived components
对上述定性检测结果得到的4种与配料表不相符的羊奶粉产品进一步进行牛源性成分的定量检测,得到定量检测结果如表2所示。2、3、8和18号羊奶粉样品通过实时荧光定量检测得到Ct值分别为25.33、28.64、26.42以及19.45(图8),扩增曲线为S型,熔解曲线具有单一的熔解峰。根据定量标准曲线,对应得到的牛源性成分分别为1.70%、0.1%、0.66%和高于50%(质量分数)。该结果表明,2、3、8号羊奶粉中牛源性成分极低,可能是由于生产加工中污染造成的,而18号羊奶粉样品中牛源性成分较高,存在牛乳掺假情况。
表2 38种市售羊奶粉中牛源性成分掺假检测
Table 2 Detection of adulteration of bovine-derived components in 38 commercially available goat milk powders

注:“+”表示样品中检测出牛源性成分;“-”表示样品中未检测出牛源性成分;“——”表示未对样品进行测定
样品类型样品序号标识主成分牛引物Ct值牛DNA判定结果掺假比例纯牛奶粉阳性对照生牛乳18.24+——————纯羊奶粉阴性对照生羊乳31.32-——————纯羊奶粉1生羊乳———-相符———纯羊奶粉2生羊乳25.33+不符1.70%纯羊奶粉3生羊乳28.64+不符0.10%纯羊奶粉4生羊乳———-相符———纯羊奶粉5生羊乳———-相符———纯羊奶粉6生羊乳———-相符———配方羊奶粉7生羊乳乳清蛋白粉———+相符———全脂羊奶粉8生羊乳26.42+不符0.66%纯羊奶粉9生羊乳———-相符———纯羊奶粉10生羊乳———-相符———全脂羊奶粉11生羊乳———-相符———配方羊奶粉12生羊乳脱盐乳清粉———+相符———纯羊奶粉13生羊乳———-相符———纯羊奶粉14生羊乳———-相符———配方羊奶粉15生羊乳添加剂———-相符———全脂羊奶粉16生羊乳———-相符———配方羊奶粉17生羊乳脱盐乳清粉———+相符———全脂羊奶粉18生羊乳19.45+不符>50%全脂羊奶粉19生羊乳———-相符———全脂羊奶粉20生羊乳———-相符———全脂羊奶粉21生羊乳———-相符———纯羊奶粉22生羊乳———-相符———纯羊奶粉23生羊乳———-相符———纯羊奶粉24生羊乳———-相符———纯羊奶粉25生羊乳———-相符———纯羊奶粉26生羊乳———-相符———纯羊奶粉27生羊乳———-相符———纯羊奶粉28生羊乳———-相符———纯羊奶粉29生羊乳———-相符———配方羊奶粉30生羊乳脱盐乳清粉———+相符———纯羊奶粉31生羊乳———-相符———纯羊奶粉32生羊乳———-相符———纯羊奶粉33生羊乳———-相符———配方羊奶粉34生羊乳———-相符———纯羊奶粉35生羊乳———-相符———全脂羊奶粉36生羊乳———-相符———纯羊奶粉37生羊乳———-相符———全脂羊奶粉38生羊乳———-相符———

NTC-无模板对照
a-扩增曲线;b-溶解曲线
图8 羊奶粉2、3、8和18号样品的实时荧光定量PCR扩增曲线和熔解曲线
Fig.8 Amplification cure and melting curve analysis of real-time PCR products of goat milk powder 2, 3, 8 and 18 samples
3 讨论
羊奶粉在生产加工中经过高温高压等多道加工程序,会导致奶中的DNA发生一定程度的断裂或者降解,同时DNA的质量还会受到蛋白质、残留酚类物质的影响,因此奶粉中DNA提取具有一定的难度。本研究从羊奶粉中提取DNA的OD值为1.3~1.5,低于最佳值1.8[14],该结果与LIAO等[12]所得DNA纯度相近。DNA质量浓度范围为200~500 ng/μL,与LIAO等研究从奶粉中提取DNA的浓度值相接近,该值均高于LIU等[15]和刘永峰等[16]对牛奶提取DNA的浓度值。DNA浓度的提高可能受高温条件下细胞膜通透性增加的影响,朱扬等[17]研究中也表明肉制品经过高温加工处理后,DNA含量相比较于生肉试验组显著升高。另外,纯羊奶粉中提取的DNA纯度和含量均显著高于配方羊奶粉,这可能是由于配方羊奶粉中添加有较多种类的营养物质,对DNA提取造成更多的干扰和影响。其次,配方羊奶粉与纯羊奶粉生产加工工艺有所不同,也会影响配方羊奶粉DNA的提取质量。运用本实验中DNA提取方法得到的羊奶粉DNA,能够较好地满足于后续的掺假检测试验。
本研究羊奶粉中牛源性成分的检出限为0.1%(质量分数),该结果低于RODRIGUES等[6]研究中通过PCR检测方法得到山羊乳样品中0.5%(质量分数)牛乳的检出限,并且验证了市场上有41.2%的羊奶中掺有牛奶。LIAO等[12]研究结果得到的牛奶成分的检出限同本研究一致,然而其提出0.1%牛源性成分含量的定量结果可能并不可靠,这是由于在0.1%掺假检测水平下的目标分析物浓度低造成的。虽然0.1%的定量结果存在不可靠的可能性,但是在实际判断产品掺假时,考虑到0.1%的掺假量不具有获取经济利益的动机,因此该水平下的牛源性成分的定性检测比定量检测更具有意义。
在38种国内外市售羊奶粉样品中检测出有4款国内羊奶粉中含有牛源性成分,且在营养成分表中未进行标明。其中3款羊奶粉中的牛源性成分远低于10%,然而故意掺假含量通超过10%才具有经济利润[18],因此该3款羊奶粉中的牛源性成分可能为生产加工中污染导致的。本研究仅在国内羊奶粉品牌产品中检测出不应出现的牛源性成分,而在国外品牌羊奶粉产品中未见不符合规定的牛源性成分。
4 结论
本研究分别通过普通PCR和实时荧光定量PCR对羊奶粉中的牛源性成分进行定性和定量检测。羊奶粉中提取DNA的OD值为1.3~1.5,质量浓度为200~500 ng/μL,纯羊奶粉DNA的纯度和浓度显著高于配方羊奶粉(P<0.05),DNA部分降解,PCR扩增效果较好,DNA质量满足后续掺假检测要求。普通PCR以及实时荧光定量PCR均最低能够检测到质量分数0.1%的牛源性成分,实时荧光定量PCR可实现对0.1%~50%(质量分数)的牛源性成分进行定量。对38种市售品牌的羊奶粉进行掺假检测,有4种标签为纯羊奶粉的国产羊奶粉产品中检测出牛源性成分,其中3种羊奶粉中牛源性成分约为1%,另一种羊奶粉中牛源性成分含量高于50%。本研究有助于消费者了解国内外羊奶粉品质安全情况,为商业羊奶粉掺假检验提供可靠依据。
[1] PULINA G, MIL N M J, LAV
N M J, LAV N M P, et al.Invited review:Current production trends, farm structures, and economics of the dairy sheep and goat sectors[J].Journal of Dairy Science, 2018, 101(8):6 715-6 729.
N M P, et al.Invited review:Current production trends, farm structures, and economics of the dairy sheep and goat sectors[J].Journal of Dairy Science, 2018, 101(8):6 715-6 729.
[2] PEREIRA E V D S, DE SOUSA FERNANDES D D, DE ![]() M C U, et al.Simultaneous determination of goat milk adulteration with cow milk and their fat and protein contents using NIR spectroscopy and PLS algorithms[J].LWT-Food Science and Technology, 2020, 127:109427.
M C U, et al.Simultaneous determination of goat milk adulteration with cow milk and their fat and protein contents using NIR spectroscopy and PLS algorithms[J].LWT-Food Science and Technology, 2020, 127:109427.
[3] GOLINELLI L P, CARVALHO A C, CASAES R S, et al.Sensory analysis and species-specific PCR detect bovine milk adulteration of frescal (fresh) goat cheese[J].Journal of Dairy Science, 2014, 97(11):6 693-6 699.
[4] VERRUCK S, DANTAS A, PRUDENCIO E S.Functionality of the components from goat′s milk, recent advances for functional dairy products development and its implications on human health[J].Journal of Functional Foods, 2019, 52:243-257.
[5] BRANDAO M P, NETO M G, DE CARVALHO DOS ANJOS V, et al.Detection of adulteration of goat milk powder with bovine milk powder by front-face and time resolved fluorescence[J].Food Control, 2017, 81(1):168-172.
[6] RODRIGUES N P A, GIVISIEZ P E N, QUEIROGA R C R E, et al.Milk adulteration:Detection of bovine milk in bulk goat milk produced by smallholders in northeastern Brazil by a duplex PCR assay[J].Journal of Dairy Science, 2012, 95(5):2 749-2 752.
[7] KUMAR A, KUMAR R R, SHARMA B D, et al.Identification of species origin of meat and meat products on the DNA basis:A review[J].Critical Reviews in Food Science and Nutrition, 2015, 55(10):1 340-1 351.
[8] LO Y T, SHAW P C.DNA-based techniques for authentication of processed food and food supplements[J].Food Chemistry, 2018, 240:767-774.
[9] MAFRA I, ROXO  , FERREIRA I M P L V O, et al.A duplex polymerase chain reaction for the quantitative detection of cows′ milk in goats′ milk cheese[J].International Dairy Journal, 2007, 17(9):1 132-1 138.
, FERREIRA I M P L V O, et al.A duplex polymerase chain reaction for the quantitative detection of cows′ milk in goats′ milk cheese[J].International Dairy Journal, 2007, 17(9):1 132-1 138.
[10] DENG L, LI A L, GAO Y, et al.Detection of the bovine milk adulterated in camel, horse, and goat milk using duplex PCR[J].Food Analytical Methods, 2020, 13(4):560-567.
[11] SOVOV T,
T, ![]() L, et al.Detecting soybean and milk in dairy and soy products with post-PCR high resolution melting assays[J].Czech Journal of Food Sciences, 2020, 38(4):209-214.
L, et al.Detecting soybean and milk in dairy and soy products with post-PCR high resolution melting assays[J].Czech Journal of Food Sciences, 2020, 38(4):209-214.
[12] LIAO J, LIU Y F, KU T, et al.Qualitative and quantitative identification of adulteration of milk powder using DNA extracted with a novel method[J].Journal of Dairy Science, 2017, 100(3):1 657-1 663.
[13] L PEZ-CALLEJA I M, GONZ
PEZ-CALLEJA I M, GONZ LEZ I, FAJARDO V, et al.Application of an indirect ELISA and a PCR technique for detection of cows′ milk in sheep′s and goats′ milk cheeses[J].International Dairy Journal, 2007, 17(1):87-93.
LEZ I, FAJARDO V, et al.Application of an indirect ELISA and a PCR technique for detection of cows′ milk in sheep′s and goats′ milk cheeses[J].International Dairy Journal, 2007, 17(1):87-93.
[14] XIONG X, HUANG M H, YUAN F Y, et al.Development and validation of a fast DNA extraction protocol for fish products[J].Food Analytical Methods, 2019, 12(9):1 998-2 008.
[15] LIU Y F, GAO J L, YANG Y F, et al.Novel extraction method of genomic DNA suitable for long-fragment amplification from small amounts of milk[J].Journal of Dairy Science, 2014, 97(11):6 804-6 809.
[16] 刘永峰, 库婷, 高俊岭, 等.超低温冻藏牛奶中牛基因组DNA的提取方法[J].陕西师范大学学报(自然科学版), 2015,43(6):94-99.
LIU Y F, KU T, GAO J L, et al.Study on cattle genomic DNA extraction from milk preserved at ultra-low temperature[J].Journal of Shaanxi Normal University (Natural Science Edition), 2015(6):94-99.
[17] 朱扬, 刘永峰, 魏燕超, 等.牛肉及其中式加工品中猪肉成分的定性、定量检测方法研究[J].中国农业科学, 2018, 51(22):4 352-4 363.
ZHU Y, LIU Y F, WEI Y C, et al.Qualitative and quantitative detection methods of pork in beef and its Chinese processing products[J].Scientia Agricultura Sinica, 2018, 51(22):4 352-4 363.
[18] LI T T, JALBANI Y M, ZHANG G L, et al.Detection of goat meat adulteration by real-time PCR based on a reference primer[J].Food Chemistry, 2019, 277:554-557.