圆苞车前(Plantago ovata),英文名Psyllium,又称欧车前或洋车前,为车前属,在世界上大多数地区都有种植,特别是印度[1-2]。车前草在传统医学中用作药用植物,具有数百年历史[3]。2014年,圆苞车前子壳(psyllium husk, PH)被我国列为新资源食品。PH含有丰富的膳食纤维、胶质及生物活性物质,有控制血糖、胆固醇水平,维护胃肠道及心脑血管功能,还可用于吸附除污、增稠、胶凝等[4-5]。GUO等[6]对PH的成分进行分析发现其碳水化合物含量约占85%。FISCHER等[7]报道了PH中最丰富的多糖是高分支的阿拉伯糖木聚糖,还包含15%的酸性糖,且凝胶成分占PH质量的55%~60%。因此,PH可制备具有良好膳食纤维比例的圆苞车前子壳胶(psyllium husk gum, PHG)。
长期以来,人们一直在研究不同来源的天然多糖,对其分离、表征、生物活性和结构特征等方面进行研究,并将其广泛用于食品、医药、环境等领域。由于多糖具有保留水并形成水凝胶的能力,其在食品工业中被广泛用作增稠剂和胶凝剂[8]。多糖是黏弹性材料,其流变特性是食品工业中的应用基础,流变学参数是食品胶体开发应用、质量评估及加工工程设计所必需的。近几年来,众多学者报告了从不同植物中提取的多糖的流变特性,如茶籽[9]、秋葵[10]、皂荚[11]等。虽然GUO等[4]对PH中的可溶性凝胶成分进行了研究,但不溶性膳食纤维对胶体的结构及性能产生的影响也不容忽视。目前已有PH应用于酸奶[12]、面团[13]等的研究,却没有对PH流变特性的报道。因此,本文旨在探究圆苞车前子壳这一新型食品原料的流变及结构特性,为其在食品工业中的应用提供参考。
1 材料与方法
1.1 材料与试剂
圆苞车前子壳粉(纯度99%,总糖含量为87.36 g/100g,蛋白质含量为0.40 g/100g,总膳食纤维含量为76.41 g/100g),上海味庆生物科技有限公司;荧光增白剂M2R,上海阿拉丁试剂公司;NaCl、CaCl2、NaOH、HCl、二甲基硅油、戊二醛,成都市科龙化工试剂厂;实验试剂均为分析纯。
1.2 仪器与设备
JA3003B型电子天平,上海精天电子仪器有限公司;HH-4型数显恒温搅拌水浴锅,上海新诺仪器设备有限公司;CJ-78-1型磁力搅拌器,上海将任实验设备有限公司;FD-1A-50型真空冷冻干燥仪,北京博伊康实验仪器有限公司;MCR302型流变仪,奥地利安东帕公司;LSM800型激光共聚焦显微镜,德国卡尔蔡司公司;Phenom ProX型扫描电子显微镜,荷兰 Phenom-World公司。
1.3 实验方法
1.3.1 微观结构观察
扫描电镜:将充分干燥的凝胶样品(30 g/L PHG),用离子溅射镀膜仪喷金镀膜后,在10kV(高倍镜下15kV)的加速电压下,1 000~15 000倍观察。
激光共聚焦显微镜:将凝胶样品(30 g/L PHG)用荧光增白剂(Calcofluor White M2R,M2R)(水溶,0.1 g/L)染色至少1 h。将染色的样品放在载玻片上,盖上盖玻片后在显微镜下观察。处理过程应避光,防止光漂白。
1.3.2 样品制备
用蒸馏水配制不同质量浓度(5、10、20、30 g/L)的圆苞车前子壳悬浮液,搅拌均匀使其水合充分,并用NaCl或CaCl2调整溶液中的离子强度(0、0.01、0.02、0.05、0.1 mol/L)。将上述溶液置于85 ℃水浴锅中加热搅拌5 min,冷却后置于4 ℃冰箱中放置过夜,得到PHG。
1.3.3 流变测试
将制备好的样品放置在流变仪测试平台上,除平板边缘多余的样品,用硅油覆盖样品,防止测试时溶剂蒸发。采用平板PP25系统(间距1 mm)进行动态和稳态剪切测量,测试前,平衡3 min。采用流变模型对测试数据点进行回归拟合,拟合系数r2表示拟合度。随质量浓度的增加,样品呈现从稀溶液到浓溶液到凝胶的状态。10 g/L的PHG呈现流体状态,更适合用于研究其流动与变形过程。因此,在研究其他加工因素对样品流变特性的影响时,测试皆在该浓度下进行。
1.3.3.1 质量浓度对PHG流变特性的影响
不同质量浓度的PHG(5、10、20、30 g/100mL)在施加恒定应变0.5%(线性黏弹性区域内)下,进行动态频率扫描(0.1~10 Hz),记录储能模量和损耗模量随频率的变化。采用Power-law模型即公式(1)对数据点进行拟合,来表征储能模量对频率的依赖性:
G′=kwn
(1)
式中:G′表示储能模量,Pa;ω为振荡频率,rad/s;k表示稠度系数,Pa·sn;n为流体行为指数。
1.3.3.2 剪切力对PHG流变特性的影响
对10 g/L PHG进行稳态剪切测试。在25 ℃温度下,剪切速率从5~130 s-1递增,130 s-1保持一段时间后从130~5 s-1递减,记录测试过程中剪切应力及黏度随剪切速率变化的关系。应力与剪切速率的关系曲线中得到的滞后环面积可体现样品的触变性[14]。用黏度曲线及Herschel-Bulkley模型即公式(2)拟合数据点以判断PHG假塑性:
τ=τ0+kγ
(2)
式中:τ表示剪切应力,Pa;k为稠度系数,Pa·sn;γ表示剪切速率,s-1;n为流体行为指数;τ0是屈服应力,Pa。
1.3.3.3 pH对PHG流变特性的影响
用0.1 mol/L的NaOH或HCl调整溶液的pH值(pH 4.0、7.0、10.0)。在25 ℃温度下,对不同pH条件下的PHG 10 g/L进行稳态剪切扫描,即测定剪切速率在0.1~100 s-1范围内样品的表观黏度的变化。用Power-law模型即公式(3)拟合数据点,以研究pH对PHG流变特性的影响:
ηa=kγn-1
(3)
式中:ηa为表观黏度,Pa·s;γ表示剪切速率,s-1;k表示稠度系数,Pa·sn;n为流体行为指数。
1.3.3.4 温度对PHG流变特性的影响
经过85 ℃热处理的PHG(10 g/L),在0.5%应变下,以2 ℃/min的速率在5~85 ℃范围内进行温度扫描。对质量浓度10 g/L的,经过热处理获得的PHG样品与未经热处理的PH溶胶进行稳态剪切扫描(如1.3.3.3操作步骤),并用公式(3)进行数据拟合,以研究热处理对PHG流变特性的影响。
1.3.3.5 盐离子对PHG流变特性的影响
将含有不同盐(NaCl或CaCl2)浓度的PHG 10 g/L,在施加恒定应变0.5%下,进行动态频率扫描(0.1~100 rad/s)。研究盐离子的种类及浓度对PHG流变特性的影响。
1.4 数据处理与分析
采用SPSS 19.0及RheoCompass 1.12进行数据分析,Origin 8.0作图,每次试验重复3次。
2 结果与分析
2.1 PHG的微观表征
由图1可知,PHG的微观结构呈带褶皱(图1-a中箭头所示)的不规则片状。但GUO等[4]报道PH中碱提取凝胶的微观结构呈现丝状网络结构。推测不溶性膳食纤维的存在改变了多糖凝胶的网络结构,使其表面变粗糙,出现一些不规则形状[15]。此外,不溶性膳食纤维含有大量的极性基团,具有吸水性和空间稳定性,可与其他成分通过非共价作用,形成新的网络[16]。用荧光增白剂对PHG中的β型糖苷键染色,在共聚焦显微镜下(如图1-c所示)能更清晰地观察到凝胶结构。PHG的网络结构连续性差,凝胶抵抗机械作用力的能力差[3]。片状结构的堆叠导致了较多的不规则孔洞或腔室,这有利于持水和吸附[16]。

a-PHG电镜图(1 000×,20 μm);b-PHG电镜图(15 000×,1 μm);c-PHG激光共聚焦显微镜图(50 μm)
图1 PHG(30 g/L)的微观结构图
Fig.1 The microstructure of PHG (30 g/L)
2.2 PHG的流变表征
在许多食品加工过程中流变特性易受浓度、温度、盐、pH、加热或机械前处理等因素影响[17],因此研究加工条件对PHG流变特性的影响,对其在食品领域的应用具有重要意义。
2.2.1 质量浓度对PHG流变特性的影响
对PHG进行频率扫描可获得储能模量和损耗模量信息,两者分别代表材料的弹性和黏性特征[18]。如图2所示,在振荡频率范围内G′超过G″,且在低频率区模量几乎平行。说明PHG以弹性特征为主,可判断为具有网状结构的弱凝胶[19]。PHG流变行为更接近固体,一定程度的形变可恢复[20]。这与FARAHNAKY等[21]对PH中凝胶成分流变特性的观察一致,说明PH中其他成分的存在不会改变其流体特征。随质量浓度增加,模量对剪切频率的依赖性降低,说明结构的增强。低质量浓度(5~10 g/L)下,不同浓度质量PHG的G′和G″之间是相近的,说明其凝胶结构相近。用Power-law模型拟合G′对振荡频率ω的依赖性,拟合结果见表1。流体行为指数n> 0, 说明PHG是物理凝胶,而非共价凝胶,可判断为弱凝胶;n值远离1,说明PHG表现出弹性凝胶的特征,与牛顿流体差异大[22]。且质量浓度越高,拟合度越好。
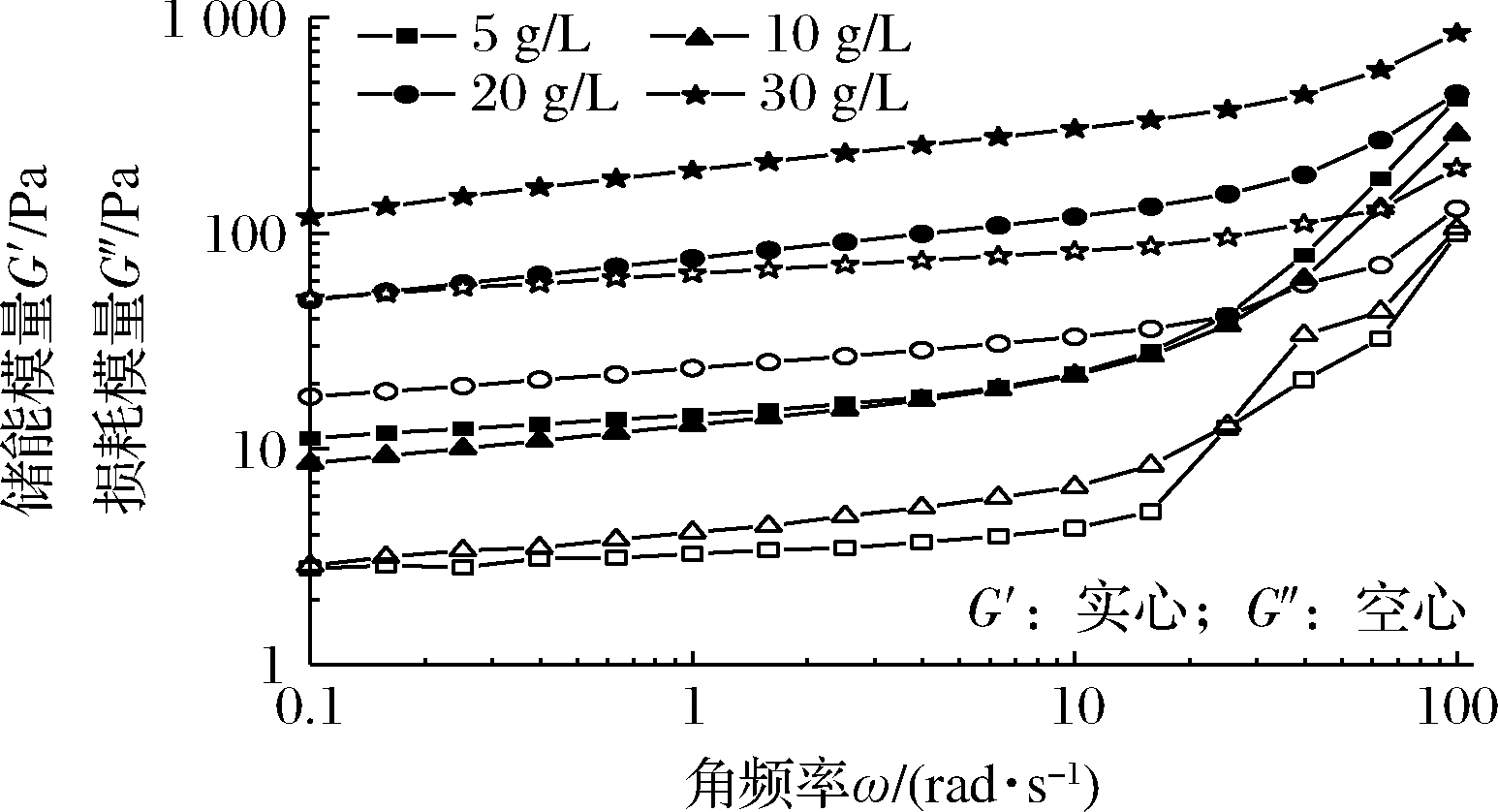
图2 不同浓度PHG的模量随频率变化的曲线
Fig.2 The curves of PHG modulus versus frequency with different PH concentrations
表1 不同因素下PHG的Power-law模型参数
Table 1 Power-law parameters of PHG under different factors
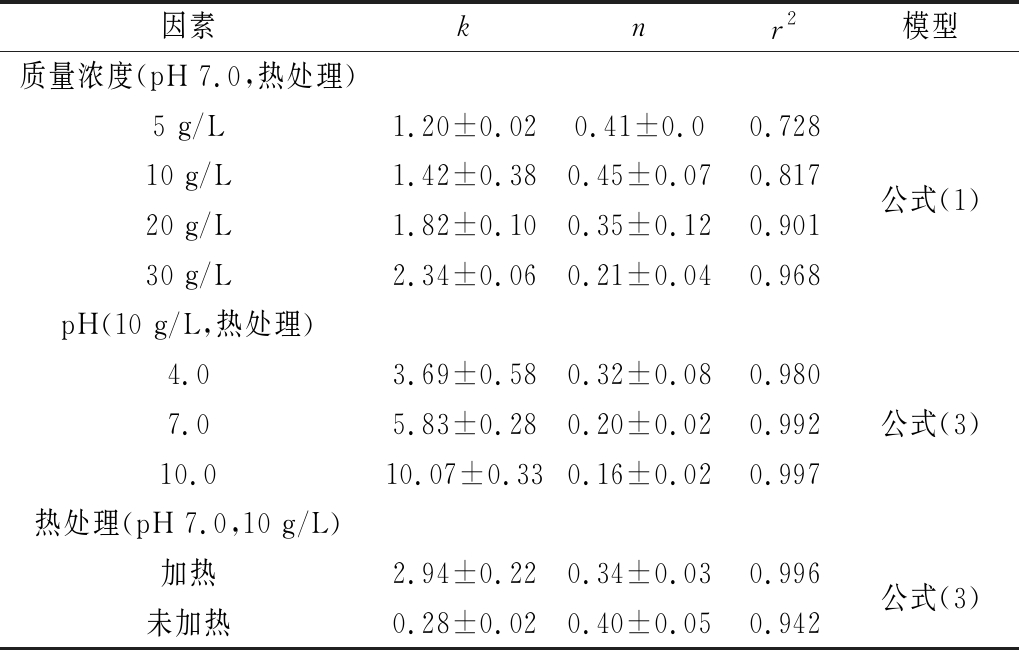
因素knr2模型质量浓度(pH 7.0,热处理)5 g/L1.20±0.020.41±0.00.72810 g/L1.42±0.380.45±0.070.817公式(1)20 g/L1.82±0.100.35±0.120.90130 g/L2.34±0.060.21±0.040.968pH(10 g/L,热处理)4.03.69±0.580.32±0.080.9807.05.83±0.280.20±0.020.992公式(3)10.010.07±0.330.16±0.020.997热处理(pH 7.0,10 g/L)加热2.94±0.220.34±0.030.996公式(3)未加热0.28±0.020.40±0.050.942
2.2.2 剪切力对PHG流变特性的影响
具有触变性的流体,在加工、包装及运输过程中受到剪切变形时,经过一段时间可以恢复其流变性质,这是流体的触变性[21]。触变性对食品或医药制品来说是理想特性。通过滞后实验(剪切速率先增加后降低)可获得流动曲线(应力τ-剪切速率γ)和黏度曲线(表观黏度ηa -剪切速率γ),具体见图3。剪切应力随剪切速率的变化总体先增加后降低的趋势,且呈现出小的滞后环,表明PHG具有一定的触变性。由图3可知,10 g/L PHG滞后面积小,呈现出低触变性特征。剪切应力随剪切速率的增加而变化的曲线符合Herschel-Bulkley模型,拟合曲线为τ=1.44+0.14γ0.87(r2=0.997),流体行为指数0.87< 1,屈服应力1.44> 0,PHG可判断为假塑性流体[16]。黏度曲线显示PHG具有黏度随剪切速率增加而下降的剪切变稀行为。PHG的黏度较PH中的凝胶成分略高[21],较其他植物多糖(如黄果斛,苦丁茶[23],皂荚等提取多糖[24])高10~100倍,可用作增稠剂。因此,PHG可判断为具有低触变性的假塑性流体(剪切稀化型流体)。这样的特性可使液体食品易于泵送,并在吞咽时具有较低的稠度。

图3 PHG(10 g/L)的流动曲线和黏度曲线
Fig.3 Flow curve and viscosity curve of PHG (10 g/L)
2.2.3 pH对PHG流变特性的影响
pH的变化会导致大分子材料的构象和溶液的表观黏度发生变化[23]。图4显示了PHG在不同pH范围内通过稳态剪切和动态频率扫描获得的表观黏度ηa和复数黏度η*。不同pH条件下,PHG的ηa随剪切速率增加而下降。将ηa随剪切频率的变化用幂律模型拟合[其中k是稠度指数(Pa·sn),n为流体行为指数],拟合结果见表1。由k值可知,不同pH范围内ηa具有以下趋势:pH 10.0>pH 7.0>pH 4.0。酸性条件可以破坏氢键,使多糖链断裂,降低分子质量,导致多糖的ηa降低。碱性条件下导致ηa增加,这与其他研究者报告的碱性条件使植物多糖螺旋链解聚形成柔性链而导致黏度降低的现象不同[20,25],推测可能是由于PH中不溶性膳食纤维的存在影响了多糖的分子构象[16]。n值随pH的增加而降低,说明碱性条件下PHG的剪切稀化现象更明显[21]。由此可知,将PHG用作食品增稠剂时,适当提高pH可以改善口感。
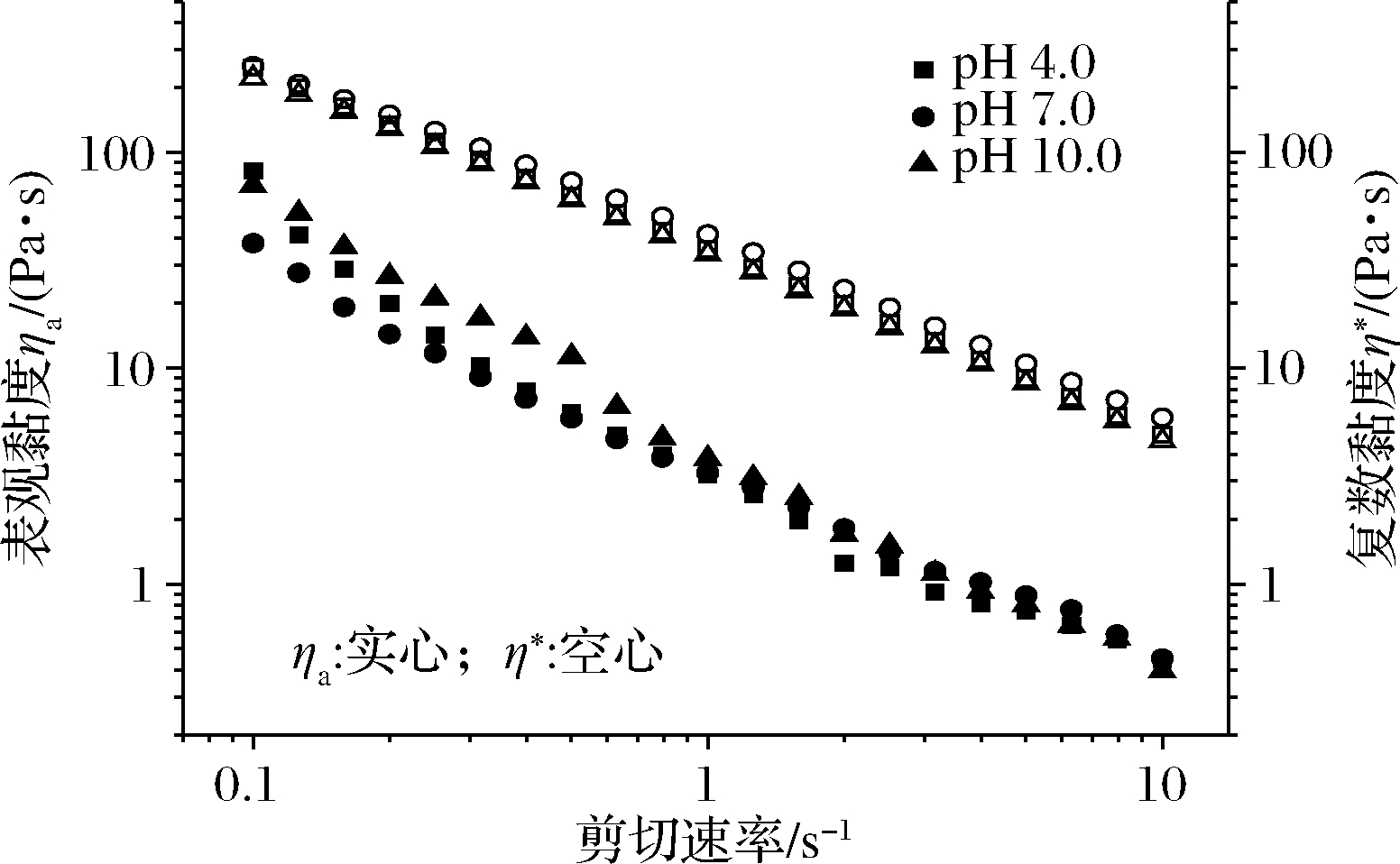
图4 不同pH下,PHG(10 g/L)的表观黏度ηa和复数黏度η*随剪切速率的变化曲线
Fig.4 Apparent (ηa) and complex (η*) viscosities as function of shear rate of PHG (10 g/L) at different pH
Cox-Merz定律(η*=k·ηα|ω=γ)即剪切速率ω与振荡频率γ相等时流体的表观黏度与复数黏度值相等,该定律的应用可在稳态剪切和动态振荡实验之间建立相关性。Cox-Merz定律在PHG的应用存在偏差(η*>ηa)这与PHG为弱凝胶,其分子间的相互作用易被破坏有关[25]。此外,还能说明PHG中高密度聚集体及纤维网络的存在[19]。
2.2.4 温度对PHG流变特性的影响
动态温度扫描用于评估温度变化对PHG黏弹性的影响。如图5-a所示,在升温和降温过程中,PHG(10 g/L)的G′均大于G″,但都随温度升高而降低。温度升高可导致分子热运动加剧,大分子间的缠结减弱以及氢键的断裂,从而导致PHG黏弹性的降低[17]。评估黏弹性行为的另一个参数是损耗因子(tanδ),它是G″与G′之比。tanδ<1表示流体主要是弹性行为,表现出固体特征,反之是黏性行为表现出液体特征[18]。如图5-a所示,在实验范围内,PHG表现为固体特征,且G″与G′无交点,说明其热稳定性好,在5~85 ℃范围内没有出现固态到液态的转变。这与GUO等[4]对PH中凝胶成分的熔点研究结果一致。升温曲线和降温曲线之间存在滞后环,说明PHG凝胶中有氢键作用,在升温过程中伴随着分子内或分子间氢键的断裂[20]。但PH中凝胶成分的温度扫描过程中无滞后环[4],说明PH中不溶性膳食纤维等成分的存在降低了凝胶的热稳定性。
将PH溶胶经热处理(85 ℃)形成PHG凝胶,研究热处理对PHG表观黏度的影响,如图5-b所示。用Power-law模型拟合数据点,以研究热处理对流变特性的影响。拟合结果(表1)说明热处理可以提高PHG的黏度及假塑性。加热后PHG的增稠作用导致流动性降低。因此在进行生产加工时,可以根据需要使用PH溶胶或者黏度较高的凝胶。

a-G′与G″随温度变化曲线;b-(未)经热处理PHG的黏度曲线
图5 温度对PHG 10 g/L流变特性的影响
Fig.5 Effect of temperature on rheological properties of PHG 10 g/L
2.2.5 盐离子对PHG流变特性的影响
低浓度盐添加可以促进多糖凝胶化[18],图6显示了低离子浓度下(0.01~0.1 mol/L)PHG的G′随频率的变化。与未引入盐离子的PHG相比,盐的加入能降低G′对频率的依赖性,增加结构稳定性。推测可能是适量的Ca2+在PHG中发生桥联作用增加了网络结构的稳定性[10],但浓度较低时该作用较弱,会在高频区被打断。此外,一价阳离子可能与PHG中的羟基、羧基生成盐而影响体系的酸碱度,干扰氢键及静电作用[4, 11]。

图6 离子种类及浓度对PHG(10 g/L)储能模量G′的影响
Fig.6 The effect of ion species and concentration on the G′ of PHG (10 g/L)
3 结论与讨论
PHG在微观表征下,其结构呈带褶皱的不规则片状,间隙和孔洞多。流变测试结果表明,PHG为弱凝胶且具有低触变性、假塑性和较高的黏度。改变加工条件可改变PHG的流变性质:(1)随着质量浓度的增加,PHG结构增强,稠度指数增加,流体行为指数降低;(2)PHG受到剪切作用而产生的变形在一定时间内可恢复,且黏度随剪切速率增加而下降;(3)提高pH(4.0~10.0),PHG的非牛顿性更强。碱性条件下,黏度略微提高,而酸性条件下,黏度降低;(4)热处理可以提高PHG的黏度及假塑性,在5~85 ℃,PHG具有较好的热稳定性。升温和降温曲线之间存在滞后环,说明PHG中存在氢键;(5)Na+或者Ca2+的引入可以增加PHG的结构稳定性。上述结果表明,强吸水性及高膳食纤维含量的PHG,具有低触变性、高黏性和可调控的流变性质,可以用作功能性可食原料(如增稠剂、黏合剂及膳食补充剂等)。本研究为PHG在食品领域的研发提供了理论基础,有利于拓宽其实际应用范围。在未来的研究中,我们会进一步探究PHG流变特性与实际工厂加工的关系,构建流变与生产之间的桥梁,以期为PHG相关产品的开发提供更全面的参考。
[1] THAKUR V K, THAKUR M K.Recent trends in hydrogels based on Psyllium polysaccharide:A review[J].Journal of Cleaner Production, 2014,82:1-15.
[2] YIN J Y, NIE S P, GUO Q B, et al.Effect of calcium on solution and conformational characteristics of polysaccharide from seeds of Plantago asiatica L.[J].Carbohydrate Polymers, 2015,124:331-336.
[3] GONÇALVES S, ROMANO A.The medicinal potential of plants from the genus Plantago (Plantaginaceae)[J].Industrial Crops and Products, 2016,83:213-226.
[4] GUO Q, CUI S W, WANG Q, et al.Microstructure and rheological properties of Psyllium polysaccharide gel[J].Food Hydrocolloids, 2009,23(6):1 542-1 547.
[5] CHONG R W W, BALL M, MCRAE C, et al.Comparing the chemical composition of dietary fibres prepared from sugarcane, Psyllium husk and wheat dextrin[J].Food Chemistry, 2019,298:125032.
[6] GUO Q, CUI S W, WANG Q, et al.Microstructure and rheological properties of Psyllium polysaccharide gel[J].Food Hydrocolloids, 2009,23(6):1 542-1 547.
[7] FISCHER M H, YU N X, GRAY G R, et al.The gel-forming polysaccharide of Psyllium husk (Plantago ovata forsk)[J].Carbohydrate Research, 2004,339(11):2 009-2 017.
[8] TIMILSENA Y P, ADHIKARI R, KASAPIS S, et al.Rheological and microstructural properties of the chia seed polysaccharide[J].International Journal of Biological Macromolecules, 2015,81:991-999.
[9] 焦宇知, 汪艳芝, 朱云, 等.茶籽粕多糖流变学性质分析[J].食品工业科技, 2016,37(17):134-137;141.
JIAO Y Z, WANG Y Z, ZHU Y, et al.Analysis of rheological properties of polysaccharides from oil-tea-cake[J].Science and Technology of Food Industry, 2016, 37(17):134-137;141.
[10] 张苒, 杨洪武, 刘咏.黄秋葵秸秆多糖的流变学性质研究[J].合肥工业大学学报(自然科学版), 2019,42(2):261-266.
ZHANG R, YANG H W, LIU Y.Rheological properties of okra straw polysaccharide [J].Journal of Hefei University of Technology (Natural Science Edition), 2019,42 (2):261-266.
[11] 菅红磊, 朱莉伟, 张卫明, 等.两种皂荚多糖胶流变性质的表征[J].食品科学, 2010,31(17):68-72.
JIAN H L, ZHU L W, ZHANG W M, et al.Rheological characteristics of gums from Gleditsia sinensis Lam.Seeds with different shapes[J].Food Science, 2010, 31(17):68-72.
[12] LADJEVARDI Z S, GHARIBZAHEDI S M T, MOUSAVI M.Development of a stable low-fat yogurt gel using functionality of Psyllium (Plantago ovata Forsk) husk gum[J].Carbohydrate Polymers, 2015,125:272-280.
[13] PEJCZ E, SPYCHAJ R, WOJCIECHOWICZ-BUDZISZ A, et al.The effect of Plantago seeds and husk on wheat dough and bread functional properties[J].LWT, 2018,96:371-377.
[14] RAO M R P, WARRIER D U, GAIKWAD S R, et al.Phosphorylation of Psyllium seed polysaccharide and its characterization[J].International Journal of Biological Macromolecules, 2016,85:317-326.
[15] 周玉瑾, 李梦琴, 李超然, 等.麦麸水溶性膳食纤维和水不溶性膳食纤维对面条性状指标的影响及其扫描电镜的观察[J].食品与发酵工业, 2015,41(6):128-133.
ZHOU Y J, LI M Q, LI C R, et al.Effects on noodle quality by the SDF or IDF of wheat bran and SEM graphs[J].Food and Fermentation Industries, 2015, 41(6):128-133.
[16] 代曜伊, 刘敏, 郑炯.竹笋不溶性膳食纤维对草莓果酱流变及质构特性的影响[J].食品与发酵工业,2017,43(3):83-88.
DAI Y Y, LIU M, ZHENG J.Effect of the bamboo shoots insoluble dietary fiber on physical properties of strawberry jam[J].Food and Fermentation Industries, 2017,43(3):83-88.
[17] HESARINEJAD M A, SAMI JOKANDAN M, MOHAMMADIFAR M A, et al.The effects of concentration and heating-cooling rate on rheological properties of Plantago lanceolata seed mucilage[J].International Journal of Biological Macromolecules, 2018,115:1 260-1 266.
[18] 任剑豪, 甘增鹏, 詹浩通, 等.荸荠淀粉糊流变性质的研究[J].中国粮油学报, 2019,34(11):29-37.
REN J H, GAN Z P, ZHAN H T, et al.Rheological properties of chufa starch paste[J].Journal of the Chinese Cereals and Oils Association, 2019,34(11):29-37.
[19] AUGUSTO P E D, FALGUERA V, CRISTIANINI M, et al.Viscoelastic properties of tomato juice:Applicability of the cox-merz rule[J].Food and Bioprocess Technology, 2013,6(3):839-843.
[20] AUGUSTO P E D, FALGUERA V, CRISTIANINI M, et al.Influence of fibre addition on the rheological properties of peach juice[J].International Journal of Food Science & Technology, 2011,46(5):1 086-1 092.
[21] FARAHNAKY A, ASKARI H, MAJZOOBI M, et al.The impact of concentration, temperature and pH on dynamic rheology of Psyllium gels[J].Journal of Food Engineering, 2010,100(2):294-301.
[22] 易兵, 丁长银.高粘度羧甲基纤维素钠水凝胶的触变性[J].纤维素醚工业,2002(2):32-39.
YI B, DING C Y.Thixotropy of high viscosity sodium carboxymethyl cellulose hydrogel [J].Cellulose Ether Industry, 2002(2):32-39.
[23] 朱科学, 赵书凡, 朱红英, 等.苦丁茶冬青多糖流变学特性研究[J].食品工业科技,2017,38(22):61-65;70.
ZHU K X, ZHAO S F, ZHU H Y, et al.Rheological properties of polysaccharide isolated from Ilex Kudingcha C.J.Tseng[J].Science and Technology of Food Industry, 2017, 38(22):61-65;70.
[24] 蒋建新, 朱莉伟, 安鑫南, 等.植物多糖胶流变性质的研究[J].中国野生植物资源, 2003, 22(5):29-33.
JIANG J X, ZHU L W, AN X N, et al.Studies on rheologies of plant polysaccharide gum[J].Chinese Wild Plant Resources, 2003, 22(5):29-33.
[25] SHI J J, ZHANG J G, SUN Y H, et al.The rheological properties of polysaccharides sequentially extracted from peony seed dreg[J].International Journal of Biological Macromolecules, 2016,91:760-767.