花生是重要的经济作物,约含有50%的脂肪,25%~30%的蛋白质,10%~13%的碳水化合物,以及微量的维生素B1、维生素B6等天然营养物质,被认为是烟酸、维生素E的良好来源,有着“长生果”的美誉。研究表明,摄入这些营养物质对健康有广泛的益处,如降低患癌症的风险、促进心脏健康、保持认知和思维能力等[1-2]。对于大多数人来说,花生摄入量的增加可以被认为是一种营养优势。然而,对于花生过敏患者来说,食用含有未标识花生成分的食品会造成严重的过敏反应。根据联合国粮农组织(Food and Agriculture Organization, FAO)的最新统计,花生被认定为最严重的食物致敏物之一[3],其引起的过敏占食品过敏总量的7%~20%[4]。与其他食物过敏对比,花生导致的过敏症状极其严重,极低的摄入量就能引发过敏反应,可导致消化系统、呼吸系统、皮肤等损伤,甚至引起过敏性休克危及生命[5]。而且花生过敏人群大多数是终身的,只有10%的过敏人群可能会随年龄的增长产生耐受,花生过敏不仅造成过敏患者健康损害,还严重影响个人及其家庭的生活质量。
目前,针对花生过敏尚缺乏准确的治疗方案[6],对致敏成分进行准确标识、避免食用致敏食品仍是保障过敏患者食品安全的主要途径。美国、欧盟发达国家和地区制定了相关法律法规,严格规定预包装食品和配料标签必须标示致敏成分。2018年我国对《食品安全国家标准预包装食品标签通则》(GB 7718)修订草案进行征求意见,该草案中将致敏物质标示由推荐性条款变为强制性条款。因此,为更好地保障广大消费者的身体健康,减少花生过敏可能造成的危害,本文分别从蛋白质和DNA水平对花生致敏蛋白检测方法进行归纳分析,对深入研究花生致敏蛋白的检测方法和预防花生过敏具有重要参考价值。
1 花生致敏蛋白
根据国际免疫学联合会过敏原命名委员会(International Union of Immunological Societies, IUIS)公布的最新数据,共有18种花生致敏蛋白(Ara h l~Ara h 18)已被认可[7]。其中大多是种子贮藏蛋白,糖基化程度非常高,分子质量为0.7~100 kDa(表1)[8]。Ara h l是分子质量为64 kDa的糖蛋白,占花生总蛋白量的12%~16%,通过分析发现此类蛋白为花生中含量最高的致敏蛋白,且多数过敏患者的血清能成功识别[9]。相关学者通过实验表明,在天然状态下Ara h l主要以水溶性蛋白的形式存在,具有高度稳定的三聚体结构(图1)[10]。Ara h 2占花生总蛋白量的5.9%~9.3%,含有8个半胱氨酸残基,可以形成较多的二硫键,使其在100 ℃的高温下仍能保持结构稳定且抗酶解[11]。通过与大豆进行高度对比发现,Ara h 3的序列与大豆球蛋白具有一定的相似性,分子结构都具有较强的的稳定性[12]。90%以上过敏患者的血清能识别Ara h l和Ara h 2,而Ara h 3在亚洲、欧洲及美洲只有50%过敏患者的血清能准确识别。此外,只有极少数过敏患者的血清能识别Ara h 4~Ara h 17致敏蛋白,由于目前与之相关的研究相对较少,因此并没有对其做进一步的了解。需要强调的是,Ara h 4的特殊性已经不像过去那么凸显,其实质上为Ara h 3.02[13]。Ara h 5蛋白广泛存在于各类真核细胞内,但研究表明这种蛋白在花生中的含量极低,难以大量获得其纯品[14];Ara h 6和Ara h 7在花生中含量都相对较低,其中Ara h 6约占花生总蛋白的4.5%;分别将Ara h 6、Ara h 7与Ara h 2的氨基酸序列进行分析,发现二者序列的同源性高达59%和35%,还具备较强的热稳定性[15-16];Ara h 8在烘烤和胃消化等条件下很不稳定,由此分析可知其热稳定性较差[17];Ara h 9是一类具有较强热稳定性的非特异性脂转运蛋白[18];Ara h 10、Ara h 11主要存在于花生的油脂中,因此被称为油脂蛋白。Ara h 12的分子质量有8、12、5.184 kDa 3种,同样Ara h 13的分子质量也有8、11、5.472 kDa 3种,均属于防御素[19]。

图1 花生主要致敏蛋白的空间结构[20-22]
Fig.1 Space structure of major peanut allergenic protein[20-22]
注:该空间结构来源于Protein Data Bank数据库
表1 花生致敏蛋白
Table 1 Peanut allergenic protein
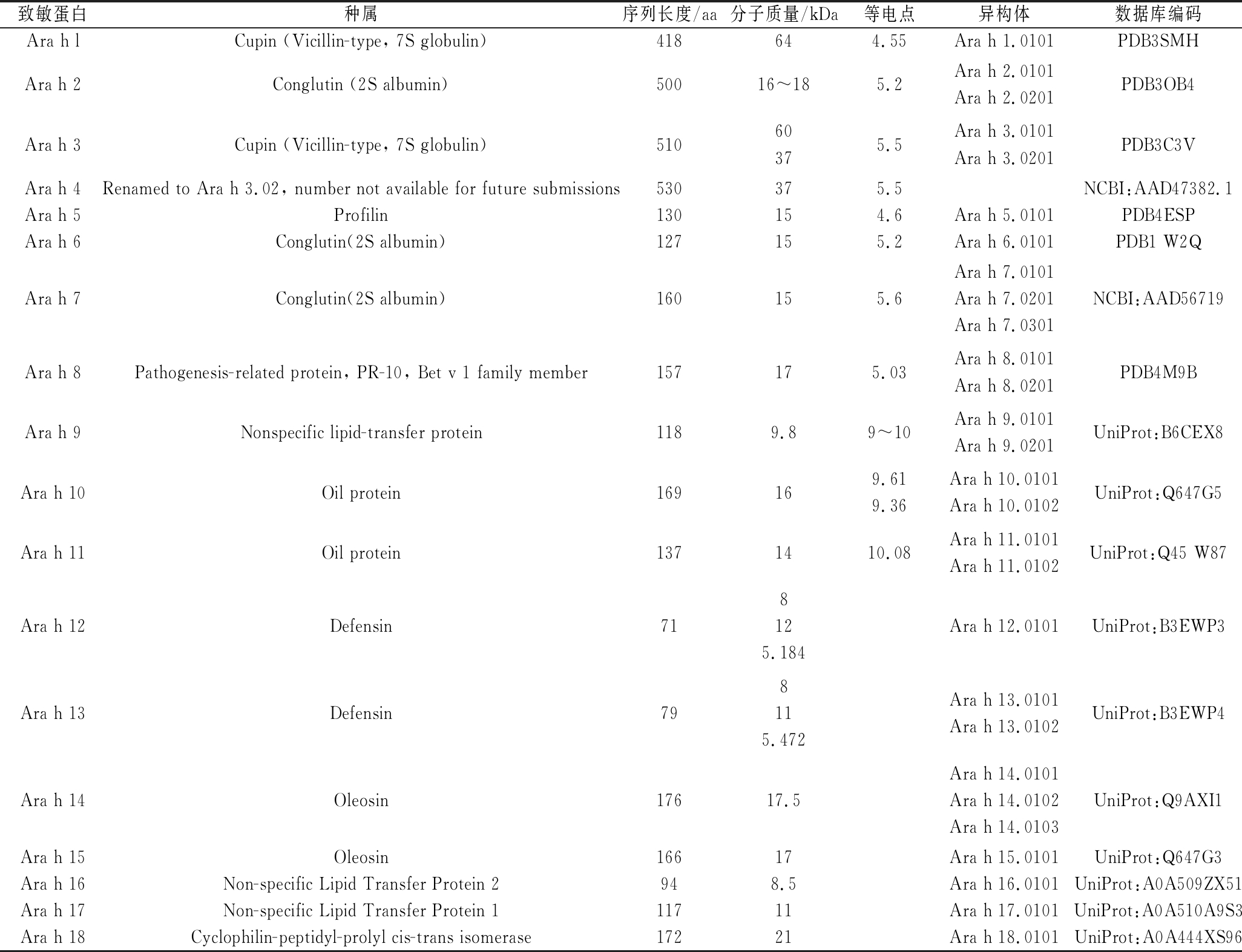
注:数据库编码来源于Protein Data Bank、Universal Protein和National Center for Biotechnology Information数据库
致敏蛋白种属序列长度/aa分子质量/kDa等电点异构体数据库编码Ara h lCupin (Vicillin-type, 7S globulin)418644.55Ara h 1.0101PDB3SMHAra h 2Conglutin (2S albumin)50016~185.2Ara h 2.0101Ara h 2.0201PDB3OB4Ara h 3Cupin (Vicillin-type, 7S globulin)51060375.5Ara h 3.0101Ara h 3.0201PDB3C3VAra h 4Renamed to Ara h 3.02, number not available for future submissions530375.5NCBI:AAD47382.1Ara h 5Profilin130154.6Ara h 5.0101PDB4ESPAra h 6Conglutin(2S albumin)127155.2Ara h 6.0101PDB1 W2QAra h 7Conglutin(2S albumin)160155.6Ara h 7.0101Ara h 7.0201Ara h 7.0301NCBI:AAD56719Ara h 8Pathogenesis-related protein, PR-10, Bet v 1 family member157175.03Ara h 8.0101Ara h 8.0201PDB4M9BAra h 9Nonspecific lipid-transfer protein1189.89~10Ara h 9.0101Ara h 9.0201UniProt:B6CEX8Ara h 10Oil protein169169.619.36Ara h 10.0101Ara h 10.0102UniProt:Q647G5Ara h 11Oil protein1371410.08Ara h 11.0101Ara h 11.0102UniProt:Q45 W87Ara h 12Defensin718125.184Ara h 12.0101UniProt:B3EWP3Ara h 13Defensin798115.472Ara h 13.0101Ara h 13.0102UniProt:B3EWP4Ara h 14Oleosin17617.5Ara h 14.0101Ara h 14.0102Ara h 14.0103UniProt:Q9AXI1Ara h 15Oleosin16617Ara h 15.0101UniProt:Q647G3Ara h 16Non-specific Lipid Transfer Protein 2948.5Ara h 16.0101UniProt:A0A509ZX51Ara h 17Non-specific Lipid Transfer Protein 111711Ara h 17.0101UniProt:A0A510A9S3Ara h 18Cyclophilin-peptidyl-prolyl cis-trans isomerase17221Ara h 18.0101UniProt:A0A444XS96
2 致敏机制
食物过敏是特殊人群对某些食物或成分产生的不良免疫反应,包括免疫球蛋白E(immunoglobulin E,IgE)介导、非IgE介导或两者的结合。然而花生过敏本身是IgE介导产生的超敏反应,主要是I型超敏反应机制。对于过敏个体而言,致敏原通过树突状细胞呈现给T细胞,异常激活Th2型效应T细胞进行转化产生IgE,与组织中的肥大细胞和嗜碱性粒细胞膜表面上的FcεRI受体结合[23-24]。当再次接触这种致敏原时发生脱颗粒反应,激活肥大细胞和嗜碱粒细胞并释放组织胺、白三烯、血小板活化因子等生物活性介质,对效应组织和器官造成影响,引起各种临床过敏的症状,如节律紊乱,急性荨麻疹,过敏性休克、死亡等[25-26],IgE介异的过敏机制如图2所示[27]。
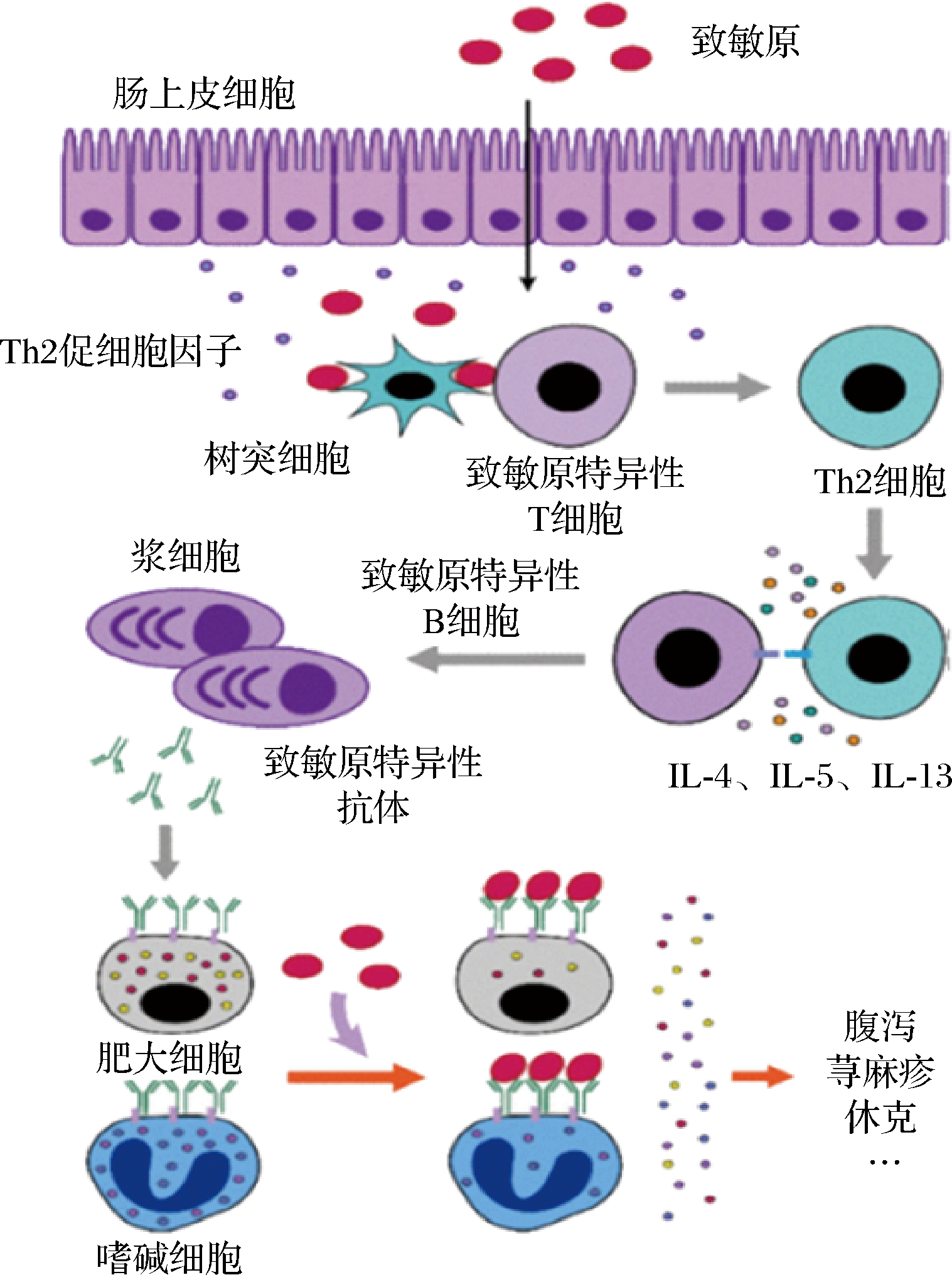
图2 IgE介导的过敏机制[27]
Fig.2 IgE mediated allergic mechanism[27]
3 致敏蛋白的检测方法
目前,主要从两个层面进行检测:一是基于蛋白质水平的检测方法,如放射性免疫分析法(radio immuno assay,RIA)、免疫印迹(immunoblotting,IB)[28]、酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)[29]、高效液相色谱分析法(HPLC)[30]以及质谱分析法(MS)[31]。RIA和IB只能得到定性或半定量结果,而ELISA是定量方法,虽然ELISA精密度高、操作简单,但目前仅用于常规食品分析。二是基于DNA水平的检测方法,其中聚合酶链式反应(PCR)[32]可用于特定DNA片段的扩增,实时荧光定量(real-time polymerase chain reaction,RT PCR)[33]对待测样品的特定DNA序列进行分析即可获得准确的定量结果,环介导等温扩增反应(loop-mediated isothermal amplification,LAMP)[34]即可通过肉眼观察白色沉淀或绿色荧光就能判断结果,不需要繁琐的电泳和紫外鉴定。
由于食品中花生致敏蛋白种类及含量较多,复杂的加工过程可能会不同程度地影响DNA和蛋白质[35]。因此,在实际应用中,方法的选择主要取决于所涉及的食品(特定抗体、DNA引物的可用性和可达到的检测限)以及加工历史。
3.1 基于蛋白质水平的检测方法
3.1.1 RIA
RIA用放射性同位素标记花生致敏蛋白,同时与未标记的花生致敏蛋白竞争结合一定量的特异性抗体,通过测量放射性同位素的含量间接计算花生致敏蛋白的量[36]。
DAVOUDZADEH等[37]通过Turbo-MPTM类型的免疫分析设备对包含花生致敏蛋白的十三类食源性致敏蛋白IgE进行定量检测,证明了Turbo-MPTM类型的免疫分析设备进行定量检测的可重复性,所产生的数据可通过Pharmacia Uni CAP系统进行读取,克服了传统放射性免疫分析设备数据交互性能低的缺点。尽管放射性免疫分析法具备灵敏度高和特异性强等优点,但也存在放射性污染的可能。因此在具体应用中必须具有官方允许以及有效预防措施,以确保实验的安全性和准确性。
3.1.2 IB
IB是一种常用的蛋白质免疫分析方法,先根据分子质量分离相关蛋白质,通过具体方式把分离的蛋白质固定到相关的固相载体上,随后将抗体当作“探针”对相关蛋白质进行检测,最终用标记的二抗进行“显色”处理。
YAPO-CREZOIT等[38]采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳和蛋白质印迹法,分析两份花生种子的蛋白质图谱。在花生种子的浸提物中,检测出致敏蛋白Ara h 1(63.5 kDa)、Ara h 2(17、20 kDa)和Ara h 3(25、36、40、44 kDa)的可见指纹,以及约36 kDa的Ara h 3致敏带,有效证明花生致敏蛋白的存在。詹少德[39]以分离得到的高纯度Ara h 2和溴化氢活化的Sepharose-4B柱材作为亲和介质材料,制备了从兔抗Ara h 2血清中分离纯化抗Ara h 2多克隆抗体的亲和层析柱,并采用免疫印迹技术进行鉴定。结果显示,纯化后得到的天然Ara h 2纯度高达90%,其多克隆抗体效价高,特异性强。虽然免疫印迹法具备分辨率高、特异性强、灵敏度高等特点,但在实验中易出现杂带或凝胶染色不匀的现象,影响实验精准度。因此,免疫印迹手段被广泛运用于相关致敏蛋白的定性分析。
3.1.3 ELISA
ELISA将酶促反应的敏感性和抗原-抗体反应的高特异性进行结合,是一种常见的定量免疫学检测手段[40],可以分为夹心法、间接法和竞争法,常采用双抗夹心法和竞争法对花生致敏蛋白进行检测。
PENG等[41]采用单抗为捕获抗体和检测抗体,并对检测抗体进行HRP标记,建立了Ara h 2夹心ELISA检测方法,测得检测限为0.02 ng/mL。MONTSERRAT等[42]创建了不同的ELISA方法对花生致敏蛋白展开检测,实验表明竞争ELISA敏感性优于夹心ELISA。JANSSENDUIJGHUIJSEN等[43]采用双单抗夹心ELISA法研究食用花生对受试者血清致敏蛋白的影响,在受试者的血清和体外检测均检测到Ara h 6,这为双单抗夹心ELISA法检测食品中的花生致敏蛋白提供了一定的参考方向。陈献雄等[44]利用双单克隆夹心法对Ara h l进行检测,测得检测限为5 ng/mL,线性范围为5~80 ng/mL,并同时能对10种含有花生成分的食品进行检测,得出的结果与其包装上标注的基本一致,因此可用于定性检测食品中花生致敏蛋白。从免疫学检测的方面来看,ELISA是一项最为重要且应用广泛的技术。由于利用较高活性的酶反应以及抗原-抗体的结构互补,在某种程度上来说能够使反应结果更为清晰,从而有效优化灵敏度和针对性。然而,ELISA方法的不足在于其特异性取决于抗原的制备,这限制了其应用范围,有待改进。
3.1.4 LC-MS/MS
LC-MS/MS将定性和分离两类功能进行了实际结合,能良好地进行定量及定性分析;同时对样品前处理进行了具体简化,能对相关样品进行迅速检测且实际操作也比较简易,在蛋白质鉴定方面有着宽泛的使用前景。
PILOLLI等[45]开发了一种基于超声波辅助溶剂萃取的尺寸排阻色谱柱的样品处理程序,整合多维色谱分析系统,建立了一种简单有效的分析方法,最后通过选择反应检测扫描分析法从复杂底物中识别出花生致敏蛋白。此外,在线固相萃取的使用可以在传统的反相分离之前,对部分目标肽段进行富集与纯化,这为最终的选择反应检测建立了一定的优势,在获得较高灵敏度的同时仍能保持合理的运行时间。DALY等[46]采用质谱法对花生和杏仁ELISA试剂盒的检测结果进行验证,发现交叉反应是杏仁ELISA检测结果呈现阳性的主要原因。此方法成功弥补ELISA假阳性问题且更为可靠,具有实际应用价值。洪宇伟等[47]采用LC-MS/MS对花生蛋白中的Ara h 2类致敏蛋白进行检测,测得检测限为6.23 μg/g,回收率数值处于1.07~1.132。然而该方法对样品、实际操作要求较高且仪器较为昂贵,所以在实际运用一般都会受到限制。
3.2 基于DNA水平的检测方法
3.2.1 PCR
PCR是DNA检测中最常用的技术,其原理是在引物和Taq DNA聚合酶的作用下延伸DNA子链,使DNA模板实现指数级扩增,再通过琼脂凝胶电泳和荧光检测技术对扩增目标片段进行分析。
JAMES等[48]针对花生叶绿体tRNA基因中tml区域,通过PCR技术完成引物的设计,获得642 bp的片段,由此将原料所含的花生致敏成分准确检出,并进一步探究多重PCR对谷物致敏蛋白进行检测的应用前景。HOUHOULA等[49]利用PCR技术检测152份食品样品,共检出125份阳性花生样品,占样品总数的83%。虽然PCR也是对花生致敏蛋白进行定量分析的检测技术,能够在食品致敏蛋白的相关检验中得到广泛应用,但是引物设计所受干扰因素较多,例如引物长度不够会产生假阳性结果;而一旦DNA出现降解,检测环节会存在较高的污染风险,出现假阴性的现象。因此,PCR在花生致敏蛋白的检测与应用中存在一定的局限性。
3.2.2 RT-PCR
RT-PCR是在定性PCR技术的基础上发展起来的DNA定量技术,将具有相应荧光作用的基团添加到PCR反应体系中,利用荧光信号的累积实时监测整个PCR过程,最后通过标准曲线对检测物质进行定量分析。常用的荧光标记法主要有SYBR Green I类荧光染料以及TaqMan类探针。
陈家杰等[50]针对花生致敏蛋白Ara h 1基因的DNA序列,分别设计两对特异性引物,建立SYBR Green I荧光实时定量PCR方法,对8种食品样品进行检测,检测结果均与标注的食物致敏蛋白内容一致。兰海鸥[51]建立了花生致敏蛋白基因(Ara h 1)的TaqMan探针快速检测方法,主要针对特异性片段(Ara h 1自身DNA序列)进行引物的实际设计,八类花生产品实际检测结论和包装标注的实际成分完全一样,表明其可以运用到花生产品致敏蛋白Ara h 1的实际检测环节。近年来,实时荧光聚合酶链反应的特异、快速、高效等优点被科研工作者所熟知。但花生产品的部分致敏蛋白在加工环节有效去除后,基因检测结果依旧呈现阳性,如何避免检测结果的假阳性将成为该方法进一步研究的方向[52]。
3.2.3 LAMP
PCR需要热循环过程,通常整个扩增过程需要1~2 h。近年来,为克服PCR方法在检测时间上的局限性,人们开发了几种等温扩增方法,其中LAMP最为常见。为实现高特异性,该法采用识别保守序列DNA的6个特异性片段的4条引物和1种链置换DNA聚合酶,在65 ℃左右使链置换DNA的合成不停地自我循环[53]。
SHEU等[54]利用两组特异性LAMP引物分别针对花生核糖体DNA序列区的Ara h 1基因序列和内部转录序列1(ITS1),60~65 ℃条件下进行60 min的扩增反应,用于检测加工食品或膳食中的花生成分。结果表明,LAMP对花生的检测灵敏度高于传统PCR,靶向ITS1的敏感性优于靶向Ara h 1基因。YUAN等[55]将LAMP与微流控芯片集成,利用NeuRed染料建立了一种检测花生致敏蛋白基因的比色方法。在LAMP反应过程中,产生大量的氢离子,溶液逐渐变酸,使得颜色发生变化,反之则保持原来的颜色。但由于反应体系中含有缓冲液,pH的变化不够明显。这也许可以解释为什么建立的LAMP体系的灵敏度没有PCR体系高。尽管如此,这种方法还是很方便的,可以用肉眼来区分结果。
4 总结与展望
由于食物过敏反应在人群中的发生率呈现出逐年上升的态势,食物过敏已成为全球颇受关注的食品安全问题。目前,预防食物过敏最有效的应对方法是避免食用含致敏蛋白的食物,然而花生已经被广泛应用到各类食品当中,而我国强制要求食物标签标注致敏成分的制度还不完善,因此这种方式难以实现。针对这种情况,加强对食物中致敏蛋白的检测,对减少食物过敏事件的发生显得至关重要。本文分别从蛋白质和DNA水平对花生致敏蛋白的多种检测方法进行了综述,并分析比较这些方法在花生致敏蛋白检测中的优缺点(图3)。

图3 花生致敏蛋白检测技术基本原理及优缺点
Fig.3 Basic principles as well as advantages and disadvantages of peanut allergenic protein detection technologies
近年来,基于蛋白质的检测方法在花生致敏蛋白检测中发挥了特别重要的作用,并展现出较高的灵敏度和较强的特异性。随着科学技术的进步,新材料、新技术的不断涌现,食品致敏蛋白检测方法越来越丰富。从传统经验判断到仪器检测,从生化分析到分子鉴定,方法的准确性、灵敏度和稳定性也越来越高,蛋白质组、代谢组、基因组等基于组学的检测方法将成为检测致敏蛋白的新一代技术手段。针对标签符合真伪鉴定、掺兑物检测等核心问题,应构建从定性判别到精准定量分析、从单物种单目标识别到多物种多目标多元高通量识别、从多组分到全组分分析的致敏蛋白检测体系,深入对致敏蛋白检测方法的研究。
[1] MUMTAZ S, ALI S, KHAN R, et al.Therapeutic role of garlic and vitamins C and E against toxicity induced by lead on various organs[J].Environmental Science and Pollution Research International, 2020, 27(9):8 953-8 964.
[2] AHMED M, ALZOUBI K H, KHABOUR O F.Vitamin E prevents the cognitive impairments in post-traumatic stress disorder rat model:Behavioral and molecular study[J].Psychopharmacology, 2020, 237(2):599-607.
[3] CHIZOBA EKEZIE F G, CHENG J H, SUN D W.Effects of nonthermal food processing technologies on food allergens:A review of recent research advances[J].Trends in Food Science & Technology, 2018, 74:12-25.
[4] LIEBERMAN J A, GUPTA R S, KNIBB R C, et al.The global burden of illness of peanut allergy:A comprehensive literature review[J].Allergy, 2021, 76(5):1 367-1 384.
[5] HOURIHANE J O, KILBURN S A, DEAN P, et al.Clinical characteristics of peanut allergy[J].Clinical and Experimental Allergy, 1997, 27(6):634-639.
[6] 黄玉霞, 梁金玲, WANG L, 等.食品中花生过敏原及其检测方法的研究进展[J].食品工业科技, 2018, 39(22):314-318;327.
HUANG Y X, LIANG J L, WANG L, et al.Research progress of peanut allergen and its detection methods[J].Science and Technology of Food Industry, 2018, 39(22):314-318;327.
[7] 赵兴华. 栽培种花生过敏原蛋白的鉴定与分子进化研究[D].福州:福建农林大学, 2020.
ZHAO X H.Identification and molecular evolution of allergen protein in cultivated peanut (Arachis hypogaea)[D].Fuzhou:Fujian Agriculture and Forestry University, 2020.
[8] IQBAL A, SHAH F, HAMAYUN M, et al.Allergens of Arachis hypogaea and the effect of processing on their detection by ELISA[J].Food & Nutrition Research, 2016, 60:28945.
[9] FILEP S, BLOCK D S, SMITH B R E, et al.Specific allergen profiles of peanut foods and diagnostic or therapeutic allergenic products[J].Journal of Allergy and Clinical Immunology, 2018, 141(2):626-631.e7.
[10] 王俊娟, 李欣芮, 陈成, 等.花生主要过敏原Ara h 1线性B细胞表位的预测及鉴定[J].食品科学, 2021, 42(17):106-112.
WANG J J, LI X R, CHEN C, et al.Prediction and identification of linear B cell epitope on the major peanut allergen Ara h 1[J].Food Science, 2021, 42(17):106-112.
[11] 田阳, 饶欢, 陶莎, 等.花生致敏蛋白Ara h 2提取纯化及免疫分析[J].粮食与油脂, 2016, 29(12):29-32.
TIAN Y, RAO H, TAO S, et al.Purification and immune identification of peanut allergen Ara h 2[J].Cereals & Oils, 2016, 29(12):29-32.
[12] WALCZYK N E, SMITH P M C, TOVEY E R, et al.Peanut protein extraction conditions strongly influence yield of allergens Ara h 1 and 2 and sensitivity of immunoassays[J].Food Chemistry, 2017, 221:335-344.
[13] POMÉS A, DAVIES J M, GADERMAIER G, et al.WHO/IUIS Allergen Nomenclature:Providing a common language[J].Molecular Immunology, 2018, 100:3-13.
[14] WANG Y, FU T J, HOWARD A, et al.Crystal structure of peanut (Arachis hypogaea) allergen Ara h 5[J].Journal of Agricultural and Food Chemistry, 2013, 61(7):1 573-1 578.
[15] 詹少德, 邱昌将, 朱盼, 等.花生过敏原蛋白Ara h 6基因克隆和原核表达[J].食品科学, 2016, 37(3):125-130.
ZHAN S D, QIU C J, ZHU P, et al.Gene cloning and prokaryotic expression of peanut allergen Ara h 6[J].Food Science, 2016, 37(3):125-130.
[16] APOSTOLOVIC D, MARSH J T, BAUMERT J, et al.Purification and initial characterization of Ara h 7, a peanut allergen from the 2S albumin protein family[J].Journal of Agricultural and Food Chemistry, 2021, 69(22):6 318-6 329.
[17] PANDEY A K, VARSHNEY R K, SUDINI H K, et al.An improved enzyme-linked immunosorbent assay (ELISA) based protocol using seeds for detection of five major peanut allergens Ara h 1, Ara h 2, Ara h 3, Ara h 6, and Ara h 8[J].Frontiers in Nutrition, 2019, 6:68.
[18] KRAUSE S, REESE G, RANDOW S, et al.Lipid transfer protein (Ara h 9) as a new peanut allergen relevant for a Mediterranean allergic population[J].Journal of Allergy and Clinical Immunology, 2009, 124(4):771-778.e5.
[19] PALLADINO C, BREITENEDER H.Peanut allergens[J].Molecular Immunology, 2018, 100:58-70.
[20] CABANOS C, URABE H, TANDANG-SILVAS M R, et al.Crystal structure of the major peanut allergen Ara h 1[J].Molecular Immunology, 2011, 49(1-2):115-123.
[21] MUELLER G A, GOSAVI R A, POMÉS A, et al.Ara h 2:Crystal structure and IgE binding distinguish two subpopulations of peanut allergic patients by epitope diversity[J].Allergy, 2011, 66(7):878-885.
[22] JIN T C, GUO F, CHEN Y W, et al.Crystal structure of Ara h 3, a major allergen in peanut[J].Molecular Immunology, 2009, 46(8-9):1 796-1 804.
[23] JOERIS T, MÜLLER-LUDA K, AGACE W W, et al.Diversity and functions of intestinal mononuclear phagocytes[J].Mucosal Immunology, 2017, 10(4):845-864.
[24] WAMBRE E, BAJZIK V, DELONG J H, et al.A phenotypically and functionally distinct human T H2 cell subpopulation is associated with allergic disorders[J].Science Translational Medicine, 2017, 9(401):eaam9171.
[25] KANAGARATHAM C, EL ANSARI Y S, LEWIS O L, et al.IgE and IgG antibodies as regulators of mast cell and basophil functions in food allergy[J].Frontiers in Immunology, 2020, 11:603050.
[26] 傅玲琳, 王彦波.食物过敏:从致敏机理到控制策略[J].食品科学, 2021, 42(19):1-19.
FU L L, WANG Y B.Food allergy:From sensitization mechanism to control strategy[J].Food Science, 2021, 42(19):1-19.
[27] XU J Y, YE Y L, JI J, et al.Advances on the rapid and multiplex detection methods of food allergens[J].Critical Reviews in Food Science and Nutrition, 2021:1-21.
[28] WU Z H, ZHANG Y, ZHAN S D, et al.Development of immunoaffinity chromatographic method for Ara h 2 isolation[J].Protein Expression and Purification, 2017, 131:85-90.
[29] 王耀, 刘胜男, 邢荣花, 等.双抗体夹心ELISA检测花生致敏蛋白Ara h 2的方法建立[J].食品工业, 2021, 42(3):290-293.
WANG Y, LIU S N, XING R H, et al.Establishment of double antibody sandwich ELISA for peanut allergenic protein Ara h 2[J].The Food Industry, 2021, 42(3):290-293.
[30] SAYERS R L, JOHNSON P E, MARSH, J T, et al.The effect of thermal processing on the behaviour of peanut allergen peptide targets used in multiple reaction monitoring mass spectrometry experiments[J].The Analyst, 2016, 141(13):4 130-4 141.
[31] 周红菲, 吴志华, 张英, 等.质谱法分析烘焙对花生过敏原Ara h 1潜在致敏性的影响[J].食品科学, 2021, 42(3):1-6.
ZHOU H F, WU Z H, ZHANG Y, et al.Effect of roasting on the potential allergenicity of peanut allergen Ara h 1 evaluated by mass spectrometry[J].Food Science, 2021, 42(3):1-6.
[32] 左树娜. 可视化SRCA检测食品中花生过敏原Ara h 1基因的研究[D].保定:河北农业大学, 2020.
ZUO S N.Study on the detection of peanut allergen protein Ara h 1 gene in food by visual saltatory rolling circle amplification[D].Baoding:Hebei Agricultural University, 2020.
[33] SANCHIZ A, S NCHEZ-ENCISO P, CUADRADO C, et al.Detection of peanut allergen by real-time PCR:Looking for a suitable detection marker as affected by processing[J].Foods (Basel, Switzerland), 2021, 10(6):1 421.
NCHEZ-ENCISO P, CUADRADO C, et al.Detection of peanut allergen by real-time PCR:Looking for a suitable detection marker as affected by processing[J].Foods (Basel, Switzerland), 2021, 10(6):1 421.
[34] QIAN C, WANG R, WU H, et al.Recent advances in emerging DNA-based methods for genetically modified organisms (GMOs) rapid detection[J].TrAC Trends in Analytical Chemistry, 2018, 109:19-31.
[35] 王烁, 孙晓东, 钮冰, 等.不同加工方式对花生致敏性的影响[J].食品科技, 2020, 45(4):49-55.
WANG S, SUN X D, NIU B, et al.Effect of different processing methods on the allergenicity of peanut[J].Food Science and Technology, 2020, 45(4):49-55.
[36] SHINMOTO H, MATSUO Y, NAGANAWA Y, et al.Epitope analysis of peanut allergen Ara h 1 with human monoclonal IgM antibody 92-2[J].Cytotechnology, 2010, 62(4):307-311.
[37] DAVOUDZADEH D, CHEN A, VALCOUR A, et al.Inter-laboratory reproducibility and inter-assay correlation of the Turbo-MPTM radioimmunoassay for quantitative measurement of allergen-specific immunoglobulin E[J].Journal of Allergy and Clinical Immunology, 2004, 113(2):S290.
[38] YAPO-CREZOIT C C A, ANANGA A, YAPO F, et al.Comparison of major peanut allergens Ara h 1, Ara h 2 and Ara h 3 between peanut cultivars from C te d’Ivoire and the USA using SDS PAGE and Western Blots[J].IOSR Journal of Pharmacy and Biological Sciences, 2017, 12(1):31-36.
te d’Ivoire and the USA using SDS PAGE and Western Blots[J].IOSR Journal of Pharmacy and Biological Sciences, 2017, 12(1):31-36.
[39] 詹少德. 花生过敏原Ara h 2免疫亲和层析分离方法的建立[D].南昌:南昌大学, 2016.
ZHAN S D.Development of immunoaffinity chromatographic method for peanut allergen Ara h 2 isolation[D].Nanchang:Nanchang University, 2016.
[40] XI J, SHI Q Q.Development of an indirect competitive ELISA kit for the detection of soybean allergenic protein gly m bd 28K[J].Food Analytical Methods, 2016, 9(11):2 998-3 005.
[41] PENG J, SONG S S, LIU L Q, et al.Development of sandwich ELISA and immunochromatographic strip for the detection of peanut allergen Ara h 2[J].Food Analytical Methods, 2015, 8(10):2 605-2 611.
[42] MONTSERRAT M, SANZ D, JUAN T, et al.Detection of peanut (Arachis hypogaea) allergens in processed foods by immunoassay:Influence of selected target protein and ELISA format applied[J].Food Control, 2015, 54:300-307.
[43] JANSSENDUIJGHUIJSEN L M, WICHERS H J, VAN NORREN K, et al.Detection of peanut allergen in human blood after consumption of peanuts is skewed by endogenous immunoglobulins[J].Journal of Immunological Methods, 2017, 440:52-57.
[44] 陈献雄, 邬玉兰, 吉琼梅, 等.花生主要过敏原Ara h 1单克隆抗体的制备与应用[J].免疫学杂志, 2017, 33(1):68-72.
CHEN X X, WU Y L, JI Q M, et al.Preparation and application of monoclonal antibodies against allergen Ara h 1 from peanut[J].Immunological Journal, 2017, 33(1):68-72.
[45] PILOLLI R, DE ANGELIS E, MONACI L.Streamlining the analytical workflow for multiplex MS/MS allergen detection in processed foods[J].Food Chemistry, 2017, 221:1 747-1 753.
[46] DALY M, ANSARI P, H UBL G, et al.Assessing almond and peanut allergens using commercially available immunoanalytical kits and LC-MS/MS:A case study[J].Journal of AOAC INTERNATIONAL, 2019, 101(1):96-101.
UBL G, et al.Assessing almond and peanut allergens using commercially available immunoanalytical kits and LC-MS/MS:A case study[J].Journal of AOAC INTERNATIONAL, 2019, 101(1):96-101.
[47] 洪宇伟, 陈启, 张京顺, 等.超高效液相色谱-电喷雾质谱法检测花生过敏原Ara h 2[J].食品安全质量检测学报, 2015,6(5):1 895-1 902.
HONG Y W, CHEN Q, ZHANG J S, et al.Identification and quantification of peanut allergen Ara h 2 using ultra-performance liquid chromatography-tandem mass spectrometry[J].Journal of Food Safety & Quality, 2015, 6(5):1 895-1 902.
[48] JAMES D, SCHMIDT A M.Use of an intron region of a chloroplast tRNA gene (trnL) as a target for PCR identification of specific food crops including sources of potential allergens[J].Food Research International, 2004, 37(4):395-402.
[49] HOUHOULA D, KOUSSISSIS S, LOUGOVOIS V, et al.Detection of peanut allergen traces with a real time PCR assay - the challenge to protect food-allergic consumers[J].Journal of Food Research, 2017, 7(1):32.
[50] 陈家杰, 王海燕, 梁秋妮, 等.两种PCR方法检测食品中花生过敏原Ara h 1成分[J].食品研究与开发, 2011, 32(9):69-74.
CHEN J J, WANG H Y, LIANG Q N, et al.Development of two PCR assays to detect peanut allergen Ara h 1 DNA residue in food products[J].Food Research and Development, 2011, 32(9):69-74.
[51] 兰海鸥. 大豆、核桃、花生过敏原基因三重实时荧光检测方法的建立及应用[D].兰州:西北民族大学, 2020.
LAN H O.Establishment and application of triplex real-time fluorescence detection method for TaqMan probe of allergen gene in soybean, walnut and peanut[D].Lanzhou:Northwest University for Nationalities, 2020.
[52] 李颖超. 加工处理对花生致敏原的影响及其机理[D].无锡:江南大学, 2016.
LI Y C.Effect of processing on peanut allergens and its mechanisms[D].Wuxi:Jiangnan University, 2016.
[53] NOTOMI T, OKAYAMA H, MASUBUCHI H, et al.Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Research, 2000, 28(12):e63.
[54] SHEU S C, TSOU P C, LIEN Y Y, et al.Development of loop-mediated isothermal amplification (LAMP) assays for the rapid detection of allergic peanut in processed food[J].Food Chemistry, 2018, 257:67-74.
[55] YUAN D, KONG J L, LI X X, et al.Colorimetric LAMP microfluidic chip for detecting three allergens:Peanut, sesame and soybean[J].Scientific Reports, 2018, 8:8 682.