蛋白质和肽是人体重要的营养成分,它们能够改变食品的外观、风味和质构,并且具有多样的生物学活性,常被添加到加工食品当中或作为功能性成分使用。然而,食品加工过程中的一些操作(如加热、剪切、高压等),会导致蛋白质和肽的稳定性降低,并对其功能特性和生物活性造成不同程度的影响,这在一定程度上限制了其在食品工业中的应用[1]。因此,利用改性技术改变蛋白质和肽的结构及理化性质,进而改善其功能特性和生物活性,对于拓宽蛋白质和肽在食品工业中的应用具有重要意义[2]。化学法、物理法以及酶法是经常使用的蛋白质与肽的改性方法。化学法改性由于通常会使用对人体有害的试剂,因此在食品行业的应用受到限制;物理法改性主要借助机械力,改性效果一般都不理想;而酶法改性成本相对较高,且酶解过程可能会产生苦味和涩味[3-4]。因此,开发一种简单、高效、绿色、安全的蛋白质和肽的改性方法一直是食品科学领域研究的热点。
美拉德反应(Maillard reaction,MR)也称糖基化反应,指的是含氨基的化合物(如蛋白质、肽或氨基酸等)与含羰基的化合物(主要是各种还原糖)间发生的复杂化学反应,是食品加工过程中一类常见的非酶褐变反应[2]。MR过程中,蛋白质分子中氨基酸(主要是赖氨酸和精氨酸)残基上的游离氨基与糖的还原性羰基共价交联(图1),生成具有良好功能性质的美拉德反应产物(Maillard reaction products,MRPs),进而对食品的色泽、风味和功能活性等方面产生重要影响[5]。MR是在没有任何化学试剂参与下自发进行的化学反应,而且在操作性和安全性方面具有一定的优势,属“绿色”加工工艺,是一种非常理想的改性氨基化合物的方法,符合现代社会人们对天然食品与日俱增的需求,因此,通过MR改善蛋白质和肽类物质功能特性与生物活性的研究越来越受到人们的关注[6]。在Web of Science数据库中以“Maillard reaction”进行主题检索,结果显示,截至2021年10月,国内外学者累计发表了16 000多篇(其中蛋白质/肽改性约3 000篇)MR相关的文章,且文献数量总体上呈逐年增加的趋势,表明基于MR的蛋白质或肽的改性是一个非常重要的科学研究领域。
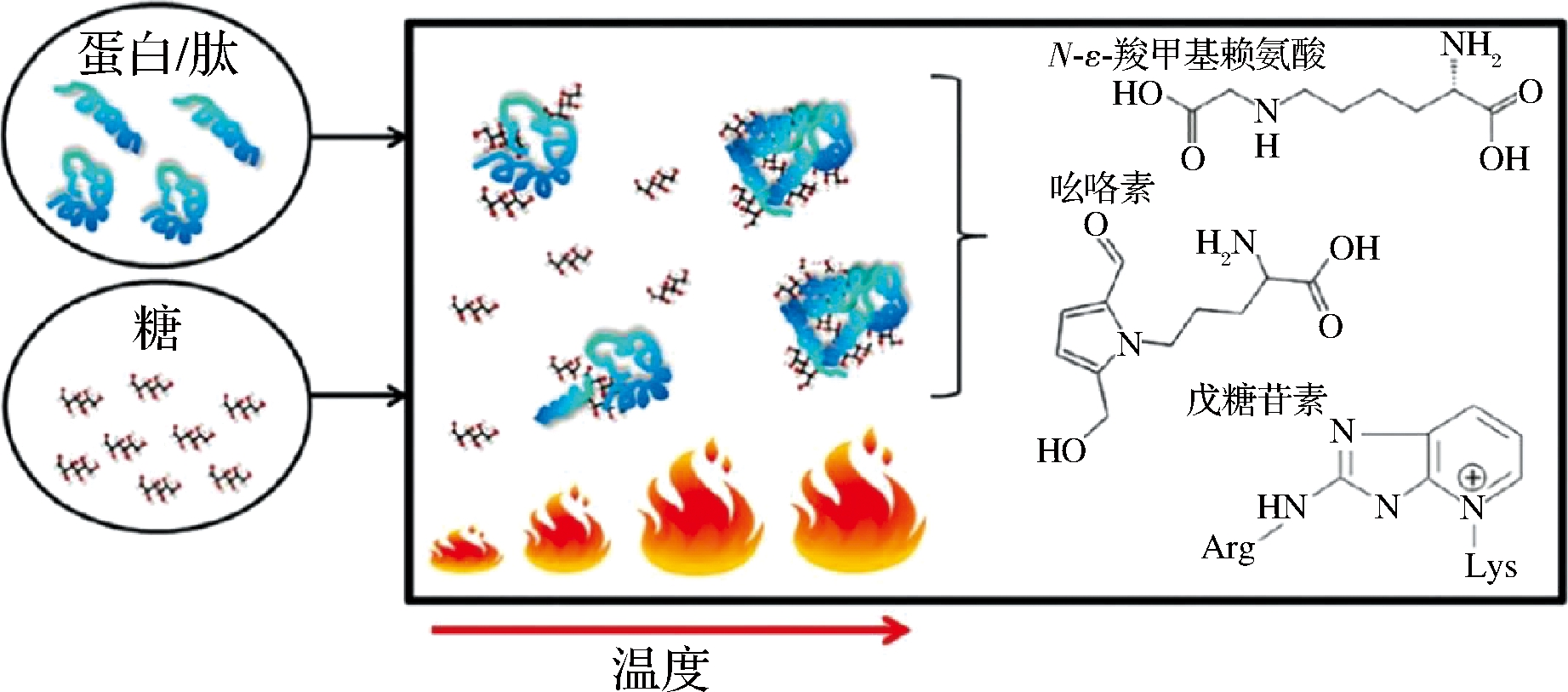
图1 食品加工过程中美拉德反应产物形成示意图
Fig.1 Simplified scheme of Maillard reaction product formation during food processing
本文概述了MR的反应过程与反应方法,总结了有关MR对食品蛋白或肽的功能特性和生物活性影响的最新研究进展。另外,进一步分析和讨论了当前利用MR改性蛋白质和肽所面临的挑战,指出了未来采用MR改性蛋白质或肽的研究方向,旨在为MR在食品、保健品乃至医药领域的深度应用提供参考。
1 MR概述
1.1 MR过程
MR最早由法国化学家L.C.MAILLARD于1912年提出,1953年HODGE等正式将其命名为Maillard反应。MR是一个极其复杂的化学过程,至今MR的反应途径和反应产物尚未完全明确,根据已有文献报道,MR大致可分为3个阶段,各阶段及其对应的主要产物如图2所示[1,7]:
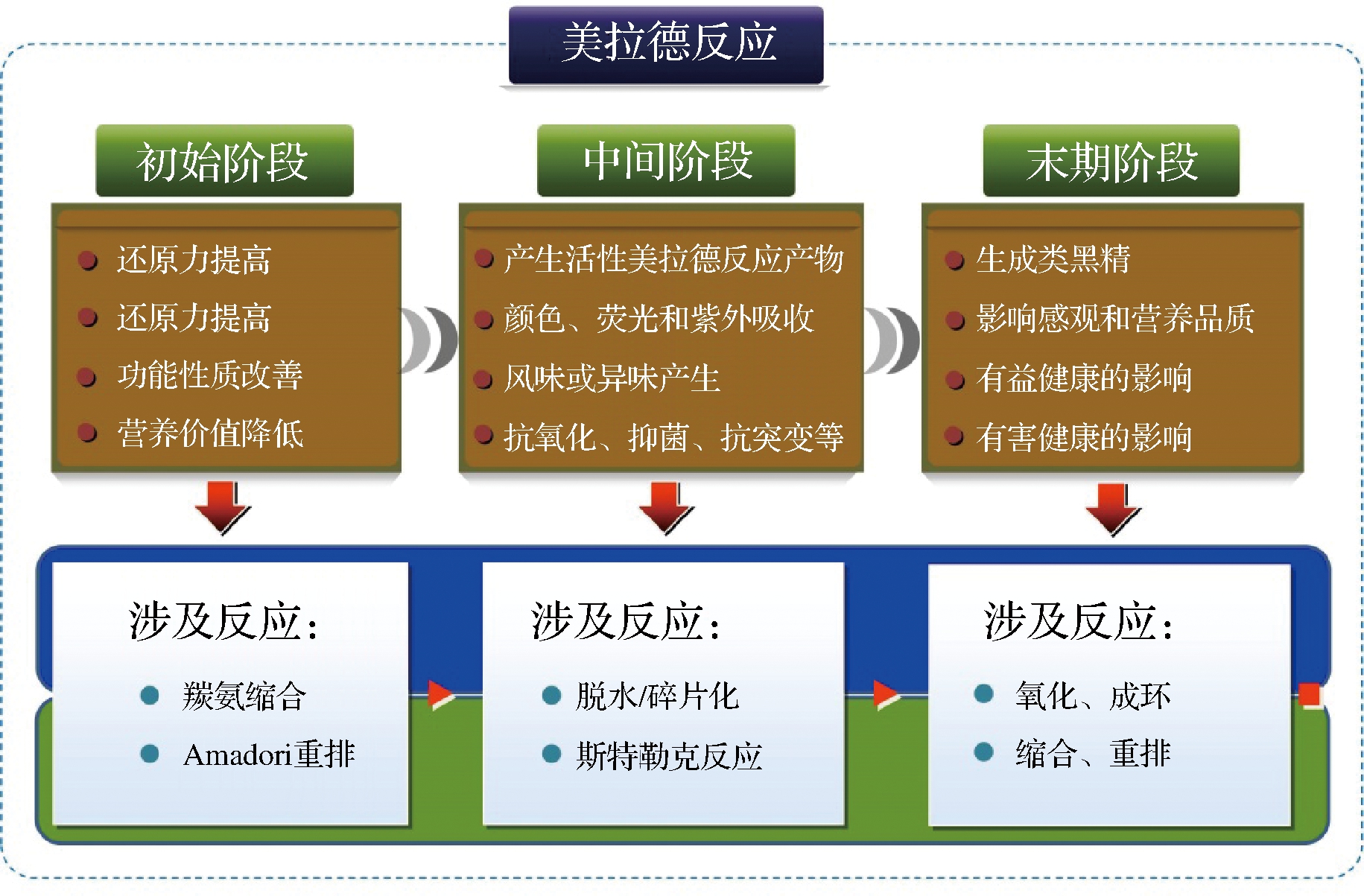
图2 美拉德反应的3个阶段及各阶段的主要产物
Fig.2 The three stages of Maillard reaction and the main products of each stage
(1)初始阶段
还原糖羰基与蛋白质或肽分子中的ε-氨基发生脱水缩合反应生成席夫碱,后经环化转变为N-取代糖基胺,N-取代糖基胺进行分子重排生成Amadori产物。初始阶段反应体系的还原力显著提高,体系中蛋白质/肽的乳化、起泡和凝胶特性以及溶解性等功能性质得到明显改善,蛋白质营养价值降低(必需氨基酸的损耗),但产物的颜色、风味或异味、荧光等方面不会发生变化。
(2)中间阶段
MR变得更为复杂,Amadori产物在不同pH条件下均可发生降解,可历经还原酮、还原型葡糖醛酮和糠醛或斯特勒克降解(Strecker)3条不同的反应路线,生成具有抗氧化、抑菌、抗突变以及抗癌等不同活性的MRPs。淡黄色出现,荧光、风味或异味产生以及还原能力的进一步提高是MR中间阶段的主要特征,此外,中间阶段的MRPs会在近紫外区产生强烈的光吸收,因此,294 nm处的紫外吸收值常用于评估中间阶段MRPs的生成量[8]。
(3)末期阶段
中间阶段形成的众多MRPs继续与氨基酸发生氧化、成环、缩合和重排等一系列反应,最终生成褐色的含氮聚合物和共聚物,统称为类黑精。类黑精能对食品的色泽、风味和质地产生直接影响,并且具有较强的抗氧化、抗微生物、益生元和抗高血压等生物学活性,每天我们食用的熟食,油炸食品和焙烤食品中都含有大量的类黑精[8]。也有报道显示,末期阶段会产生一些抗营养物质以及有毒物质,并可能造成一些有害影响,包括诱变、致癌和细胞毒性作用等[9]。
1.2 MR方法
促MR发生的方法主要有2种,即干热法和湿热法。近年来还出现了借助超声波、微波、辐照、脉冲电场和超高压等外场辅助的方法来促进MR的发生。不管采用哪种方法,蛋白质/肽本身的特性、糖的种类、反应温度和pH、反应物浓度和比例、水分活度(aw)、盐离子种类/浓度以及反应时间等都可能对MR产生影响(图3)[4,10]。上述众多因素中,反应物类型对MR速率的影响占主导作用。一般认为,MR的速率与还原糖分子的大小成反比,富含赖氨酸的反应物更易于发生反应。此外,反应物的类型也会影响MRPs的风味,而其余因素决定着MR的动力学。
图3 不同因素对美拉德反应速率影响示意图[4]
Fig.3 Schematic overview of the effect of different factors on Maillard reaction rate
注:↑表示上升;↓表示下降;S表示糖
1.2.1 干热法
首先是将蛋白质或肽与糖按一定比例混合于溶液中,然后将混合物冻干。将冻干粉置于密闭容器中,于特定温度和湿度条件下反应数小时乃至数周即得MRPs。常用的反应条件是温度40~80 ℃,相对湿度60%~85%[11]。干热法MR易受反应物间不均匀接触的限制,且长时间的反应可能导致体系产生不良颜色和风味,并生成溶解性差的大分子物质,而且干热法大多采用冷冻干燥,所需周期长,效率低,因而在实际应用中具有一定的局限性[4]。
1.2.2 湿热法
湿热法工艺相对简单。一般是将蛋白质或肽与还原糖按一定的比例混合在特定pH值的溶液中,然后将溶液转入密闭容器中,于特定温度下进行加热,最后通过冰浴冷却,降低反应温度,从而终止反应。与干热法相比,湿热法具有反应时间短、反应易于控制和产物性能较稳定等优点,越来越受到人们的重视,但是,湿热法反应物浓度低,回收产品时需要将缓冲溶液或者水分去除,产物的回收率较低。同时,湿热法反应过程中,蛋白质易于在高温溶液中变性并随后发生聚合。为了克服这些不良影响,可以利用大分子拥挤效应,在相对较高的浓度下进行反应,通过限制可用的排除体积来防止蛋白质的展开和随后的变性[12]。
2 MR改进蛋白质/肽的功能性质
MRPs的功能性质主要指复合物中蛋白质或小肽的功能性质,包括乳化性、起泡性、凝胶性、溶解性以及成膜性等,这些性质直接决定着产品的质量。MR一般以蛋白质或肽的自身特性为基础,通过引入多羟基的糖进行改性,以实现对蛋白质或肽功能性质的强化与改善。到目前为止,已采用MR成功实现了对多种蛋白质或肽的改性(表1)。
表1 美拉德反应对蛋白/肽功能特性的影响
Table 1 The influence of Maillard reaction on the functional properties of protein/peptide

反应体系反应方法反应条件功能特性参考文献大豆分离蛋白+麦芽糖干热法蛋白与麦芽糖质量比1∶2,60 ℃,60 h溶解度↑,乳化性↑[13]乳清蛋白/乳清蛋白肽+乳糖微波辅助湿热法蛋白/肽与乳糖质量比1∶1,pH 6.0,60 s溶解度↑,乳化性↑,起泡性↑[14]牛血清白蛋白+葡聚糖干热法蛋白与葡聚糖质量比1∶1,60 ℃,相对湿度79%,24 h乳化性↑,起泡性↑[15]大豆分离蛋白+香菇多糖超声辅助湿热法蛋白与香菇多糖质量比4∶1~1∶4,pH 7~12,50~90 ℃,100~300 w,20~60 min乳化性↑,溶解性↑,热稳定性↑,起泡性↑,黏度↑[16]β-乳球蛋白+半乳糖干热法蛋白与半乳糖质量比1∶1,pH 7.0,40~50 ℃,24~48 h,水分活度0.44起泡性↑[17]英国红芸豆抗氧化肽+木糖湿热法肽与木糖质量比1∶1,pH 7.0,4 h起泡性↑,乳化性↑,吸油性↑[18]胶原蛋白肽+木糖湿热法肽与木糖质量10∶3,pH 7.4,80~120 ℃,150 min乳化性↑,起泡性↑[11]乳清蛋白+葡聚糖干热法蛋白质量分数12%、葡聚糖质量分数3.6%~10.8%,60 ℃,相对湿度63%,2~9 d凝胶性↑[12]乳清蛋白+乳糖干热法蛋白与乳糖质量比1∶1,60 ℃,相对湿度79%,6~72 h凝胶性↑[19]蛋清蛋白+瓜尔豆胶酶解物干热法蛋白与瓜尔豆胶酶解物质量比200∶1,pH 9.0,相对湿度79%,4 d,凝胶性↑[20]豌豆蛋白+阿拉伯树胶干热法蛋白与阿拉伯树胶质量比1∶4,pH 7.0,相对湿度79%,1~5 d溶解性↑,乳化性↑,pH稳定性↑,热稳定性↑,豆腥味↓[21]大米蛋白+葡聚糖微波辅助湿热法蛋白与葡聚糖质量比1∶3,pH 11.0,1~8 min溶解性↑,乳化性↑,起泡性↑[22]大豆分离蛋白+葡萄糖干热法蛋白与葡萄糖质量比1∶1,55 ℃,相对湿度79%,6 h溶解性↑,乳化性↑[23]花生分离蛋白+木糖湿热法蛋白与木糖质量比5∶1~1∶100,pH 9.0, 90 ℃,90 min成膜性↑[24]玉米醇溶蛋白+葡萄糖超声辅助湿热法蛋白与葡萄糖质量比10∶1,450 W超声5 min,70 ℃,30 min 成膜性↑[25]乳清蛋白+木糖湿热法蛋白与木糖质量比2∶1,80 ℃,45 min或90 ℃加热30 min成膜性↑[26]
2.1 乳化性
乳化对食品的质构和感官特性有重要影响,在食品体系中起着非常重要的作用。MRPs能够对乳状液的稳定性起到关键作用。在乳化期间,一些蛋白质或小肽在乳化过程中能够吸附在水-油界面形成一层黏弹性的膜,而糖分子可以通过在水相的增稠和胶凝行为赋予体系稳定性。影响MRPs乳化性的因素包括糖的含量、糖的分子质量、糖的结构、赖氨酸的含量以及反应时间等[9]。BU等[13]研究发现,通过干法MR制备的大豆分离蛋白与麦芽糖共价复合物的乳化性较原大豆蛋白显著提高;NOOSHKAM等[14]将乳清蛋白/乳清蛋白肽与乳糖在微波辅助下进行湿法MR,得到了具有比原乳清蛋白/乳清蛋白肽更好乳化特性的MRPs;张晓燕等[15]用干热法对牛血清白蛋白进行糖基化改性,所得MRPs的乳化性较改性前显著提高;WEN等[16]研究证实,利用超声辅助的湿法MR对大豆分离蛋白进行糖化修饰,不仅能显著改善大豆分离蛋白的乳化能力,还能提高其溶解性、发泡性和热稳定性。
2.2 起泡性
泡沫特性是决定牛奶、冰淇淋、冷冻甜点以及蛋黄酱等许多食品质量的重要因素。泡沫的形成和稳定性直接影响这些食品的质构进而决定产品的感官品质[9]。高水溶性是蛋白质/肽作为良好泡沫稳定剂的先决条件,另外,蛋白质/肽的分子结构和柔韧性也是影响其起泡特性的重要因素。CORZO-MART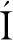 NEZ等[17]研究证实,半乳糖修饰的β-乳球蛋白在pH 5.0的条件下具有比原蛋白更好的发泡特性,适合作果汁和运动饮料等酸性食品的发泡剂;赵玉滨[18]研究发现,通过温热法使用木糖对英国红芸豆抗氧化肽进行糖基化改性能使其起泡性提高51.7%,起泡稳定性提高25.4%;CHEN等[11]的研究表明,基于MR的胶原蛋白肽的糖化改性不仅增强了胶原蛋白肽的乳化特性,还改善了其发泡性能。
NEZ等[17]研究证实,半乳糖修饰的β-乳球蛋白在pH 5.0的条件下具有比原蛋白更好的发泡特性,适合作果汁和运动饮料等酸性食品的发泡剂;赵玉滨[18]研究发现,通过温热法使用木糖对英国红芸豆抗氧化肽进行糖基化改性能使其起泡性提高51.7%,起泡稳定性提高25.4%;CHEN等[11]的研究表明,基于MR的胶原蛋白肽的糖化改性不仅增强了胶原蛋白肽的乳化特性,还改善了其发泡性能。
2.3 凝胶性
凝胶具有三维网状结构,可以捕获水和其他小分子,并保留液体连续相,对食品的质地起着十分重要的作用。SPOTTI等[12]研究发现,通过干法MR制备乳清分离蛋白-葡聚糖共聚物,能显著改善乳清分离蛋白的凝胶特性;WU等[19]研究证实,乳糖糖化的乳清蛋白比原乳清蛋白具有更好的相对黏弹性和更高的机械强度,即乳糖对乳清蛋白的糖化作用提高了乳清蛋白的凝胶性质;段汝清等[20]在干热条件下用瓜尔豆胶酶解物对蛋清蛋白进行糖基化改性,发现糖基化改性后的蛋白凝胶结构更加致密,凝胶性能得到有效改善。
2.4 溶解性
溶解性直接影响发泡、乳化、胶凝以及黏度等其他食品功能性质,因此,溶解性是新型食品及其配方开发的关键功能特性。ZHA等[21]采用干法MR制备豌豆蛋白与阿拉伯树胶的共聚物,发现加热3 d所得MRPs的溶解性比原豌豆蛋白显著改善,同时乳化性和稳定性也显著提高,豆腥味明显下降;CHENG等[22]在微波辅助下利用湿法MR对大米蛋白进行葡聚糖共聚修饰,发现所得MRPs的溶解性显著提高;左颖昕等[23]研究发现,干热条件下用葡萄糖对大豆分离蛋白进行糖基化改性能使其溶解性提高56.18%。
2.5 成膜性
近年来,人们对可生物降解包装的兴趣日益浓厚。蛋白质作为天然生物聚合物,可开发成可生物降解的薄膜。但是,与合成膜相比,基于蛋白质的薄膜的拉伸强度、伸长率和耐水性一般都比较差。MR是一种改善蛋白膜性能的安全有效的方法。LIU等[24]利用木糖对花生蛋白膜进行MR修饰,使膜的抗张强度提高了77%,伸长率提高了67%,溶解度从96.6%降至43.4%,膜的机械性能和耐水性明显提高;李萍等[25]的研究表明,葡萄糖改性的玉米醇溶蛋白膜的抗拉强度、吸水性、抗氧化性以及阻油性等膜特性均得到显著改善;张曦等[26]研究发现,木糖修饰的乳清蛋白膜与修饰之前相比,刺穿强度提高了1倍,水蒸气透过率降低24%,抗拉强度提高1.5倍,且显著延缓了核桃仁酸价的上升。
MR对蛋白质/肽乳化性、起泡性、凝胶性、溶解性及成膜性等功能性质有显著影响,这可归因于蛋白质/肽空间结构稳定性的提高以及结构变化引起的糖和蛋白质分子灵活性的增加。此外,改进的电荷效应和/或空间位阻效应也可能对蛋白质/肽功能性质的改善发挥着至关重要的作用[7]。
3 MR提高蛋白质/肽的生理活性
MRPs不但拥有许多优良的功能特性,能够在食品的颜色、质构和风味等方面发挥重要作用,同时也具有抑菌、抗氧化和抗过等敏多种多样的生理活性,在保健食品和功能性食品领域展现出很大的开发潜力(图4)。

图4 美拉德反应产物的潜在应用
Fig.4 Potential applications of the Maillard reaction products(MRPs)
3.1 抑菌作用
近年来,抑菌剂在食品和日用品行业得到了广泛应用。关于MRPs抑菌作用的报道有很多。SHENG等[27]研究发现,溶菌酶-支链淀粉的MRPs具有比天然溶菌酶更宽范围的抑菌活性;杨珮瑜等[28]研究证实,葡萄糖改性的黄鲫蛋白水解物对虾、蟹的腐败菌有很强抑制作用,且作用效果显著高于改性前的黄鲫蛋白水解物;EINARSSON[29]研究表明,MRPs的抑菌活性取决于MRPs的类型和浓度,也与MRPs的分子质量有关,通常分子质量高于1 000 Da的产品比低分子质量的产品具有更好的抑菌效果;JI等[30]研究表明,鱿鱼皮酶解物与葡萄糖、果糖或乳糖反应生成的MRPs对大肠杆菌、耐甲氧西林金黄色葡萄球菌和哈维弧菌均具有较强抑制作用,其中对大肠杆菌的抑菌效果最佳。RUFI N-HENARES等推测[31],MR最后阶段形成的黑色素通过螯合细胞膜中金属离子和引起不可逆细胞膜损伤而发挥抑菌作用;HAUSER等[32]认为,MR过程中会产生过氧化氢,它是MRPs中的一种重要抗菌成分,能够破坏细菌的细胞壁,并对菌体中的蛋白质、脂类和核酸等大分子物质造成损伤;WÜHR等[33]证实,MRPs中的烯二醇、氨基还原酮和二羰基化合物可通过产生活性氧而发挥抑菌作用。尽管MRPs的抑菌效果及机理已有很多报道,但其确切作用机制仍有待深入研究。
N-HENARES等推测[31],MR最后阶段形成的黑色素通过螯合细胞膜中金属离子和引起不可逆细胞膜损伤而发挥抑菌作用;HAUSER等[32]认为,MR过程中会产生过氧化氢,它是MRPs中的一种重要抗菌成分,能够破坏细菌的细胞壁,并对菌体中的蛋白质、脂类和核酸等大分子物质造成损伤;WÜHR等[33]证实,MRPs中的烯二醇、氨基还原酮和二羰基化合物可通过产生活性氧而发挥抑菌作用。尽管MRPs的抑菌效果及机理已有很多报道,但其确切作用机制仍有待深入研究。
3.2 抗氧化作用
抗氧化剂是一种重要的功能性成分,可以清除活性氧,进而避免自由基链式反应的发生。许多研究表明,与单独的蛋白质或肽相比,MRPs具有显著改善的抗氧化活性。KCHAOU等[34]通过测定总抗氧化能力、DPPH自由基清除活性和还原力研究了MR修饰的鱼明胶膜的体外抗氧化活性,发现修饰后的鱼明胶薄膜具有更强的抗氧化作用,有望用作可食用包装材料;JIANG等[35]研究发现,蟹壳肽-果糖的MRPs具有比原蟹壳肽更强的总抗氧化活性和还原力,同时也具有比原蟹壳肽更强的清除羟自由基和DPPH自由基的活性;杜玲玲等[36]研究表明,乳清分离蛋白及其水解物与半乳糖反应生成的MRPs的抗氧化活性(还原力、对DPPH自由基和ABTS阳离子自由基的清除活性)较原乳清分离蛋白及其水解物显著提高;YANG等[37]研究证实,鱼蛋白水解物-核糖的MRPs显示出比原水解物更强的抗氧化活性,可通过增强谷胱甘肽合成来保护HepG2细胞免受叔丁基过氧化氢(t-BHP)诱导的氧化应激,也能通过促进Nrf2核转位和ERK的磷酸化来诱导HO-1和γ-GCL等抗氧化相关酶的表达。MRPs优良的抗氧化活性已得到广泛认可,但是,由于MR体系复杂,涉及到的反应种类繁多,迄今MRPs的抗氧化机理尚未完全明了。现有的研究结果表明,还原酮、类黑精和挥发性杂环化合物是MRPs主要的抗氧化活性成分,它们主要通过消除活性氧、螯合金属离子、还原能力和作为供氢体终止自由基链式反应的能力来发挥抗氧化作用[38]。
3.3 抗过敏作用
MRPs的抗过敏作用在一些强致敏食品的加工中显示出潜在的应用前景。MR可以对食物中引起过敏反应的组分上的关键位点进行修饰,并能调节食物过敏原与IgG和/或IgE的亲和力和可及性,减少食品的抗原性,从而发挥抗过敏作用[5]。ZHANG等[39]研究发现,基于MR的糖基化修饰能有效降低α-乳白蛋白的抗原性;BLANC等[40]研究表明,MR修饰的花生过敏原Ara h 1在IgE结合试验中的变应原性降低;ZHAO等[41]用葡萄糖对鱼类主要过敏原(小白蛋白)进行MR修饰,发现修饰后的过敏原IgG/IgE结合特性明显减弱。毛积华等[42]研究证实,通过MR以半乳糖和葡萄糖修饰的卵清蛋白构象发生了明显变化,致使其对IgG/IgE结合力显著下降,致敏性降低;MRPs也能够直接发挥抗过敏作用。例如,YANG等[43]研究证实,比目鱼蛋白水解物-核糖的MRPs能够通过减少CO的合成以及抑制β-己糖胺酶和组胺的释放来发挥抗过敏作用。MR对食品蛋白过敏原潜在致敏性的影响与过敏原的热稳定性、过敏原中赖氨酸/精氨酸残基的数量、还原糖的类型和浓度、食物基质的组成以及作用条件(如温度、pH、持续时间和湿度等)等密切相关[5]。
3.4 抗炎作用用
对于哺乳动物而言,氧化应激是引起机体炎症的重要原因。氧化应激会导致机体产生过量的自由基(如活性氧和活性氮),进而促进炎症性疾病的发展。MRPs具有抗氧化作用,可以清除活性氧和活性氮,因此,具有潜在的间接抗炎活性。NISHIZWA等[44]利用MR通过藻酸盐低聚糖对鲑鱼肌原纤维蛋白进行糖基化修饰,显著提高了其抗炎活性,反应生成的MRPs不仅能抑制脂多糖(lipopolysaccharide,LPS)诱导的RAW264.7细胞一氧化氮合酶、肿瘤坏死因子-α、白介素-6和环氧合酶2的基因表达,还能抑制角叉菜胶诱发的小鼠炎症性足水肿;CHOE等[45]报道,比目鱼蛋白水解物-核糖MRPs能显著抑制白介素-6、白介素-1β、肿瘤坏死因子-α以及单核细胞趋化因子蛋白等促炎细胞因子的生成,其抗炎机制可能与其对NF-κB和MAPKs信号通路的抑制作用有关;CHEN等[46]报道,源自乳清蛋白分离物-葡萄糖的MRPs可通过增加抗炎免疫反应和减少对自身抗原的免疫反应性来保护非肥胖型糖尿病小鼠免受Ⅰ型糖尿病的侵害。
3.5 其他生理活性
SUMMA等[47]研究发现MRPs具有抗突变的作用。HONG等[48]研究揭示,酪蛋白水解物-木糖的MRPs具有比原酪蛋白水解物更强的血管紧张素I转换酶抑制活性。BORRELLI等[49]证实,MR的终产物蛋白黑素能够选择性地促进双歧杆菌的生长,有成为益生元成分的潜力。LIU等[50]报道,金枪鱼蛋白水解物及其MRPs对黄嘌呤氧化酶具有良好抑制作用,并能有效降低奥曲西林钾诱导的高尿酸血症大鼠血清中的尿酸水平,表明MRPs具有抗高尿酸血症活性。TRAN等[51]研究发现,壳聚糖-葡萄糖的MRPs对α-淀粉酶和α-葡萄糖苷酶均具有一定抑制作用,提示MRPs具有降血糖活性。CHEN等[52]研究证实,鱼鳞肽-木糖的MRPs能够降低肝损伤小鼠血清中的谷草转氨酶和谷丙转氨酶的活性,抑制各种抗氧化酶(如超氧化物歧化酶、过氧化氢酶和谷胱甘肽过氧化物酶)活性的下降,具有良好的保肝作用。
4 MR改性蛋白质/肽面临的挑战
MRPs不仅能对食品质构和风味产生积极影响,而且具有多种优良的功能特性和丰富的生物学活性,越来越受到人们关注。但MR在食品和医疗保健领域大范围推广应用之前仍面临一系列的挑战。第一,MR引起的褐变通常是不可避免的,但并非总是需要的。非酶褐变不仅影响食品的感官质量和消费者的可接受性,也是缩短食品货架期的一个限制性因素[53]。第二,MR会导致食品的营养价值降低。首先,MR会造成甲硫氨酸、赖氨酸和色氨酸等一些必需氨基酸的消耗;其次由于结构发生了改变,MRPs对胃肠道消化酶表现出很高的抵抗力,蛋白质效率会明显降低;再者,MRPs的存在也会影响微量元素(例如铁、镁等)的生物利用度[54-55];最后,MRP可以破坏某些维生素(例如维生素B1和B6),并会对磷吸收产生负面影响[56]。第三,MR过程中可能会产生一些有毒性和致癌性的MRPs(例如5-羟甲基糠醛、杂环胺、丙烯酰胺和高级糖化终产物)[57],这些物质与糖尿病、衰老、心血管疾病、动脉粥样硬化和阿尔茨海默氏病等几种疾病的患病率增加有关[8,56]。此外,高级糖化终产物可能会引发过敏反应,其高摄入量也可能导致组织和细胞发生异常乃至功能障碍(如蛋白质结构修饰、干扰脂类代谢以及血管发炎和血栓形成)[58]。第四,MRPs组成复杂,对MRPs的检测和准确定量仍是一个较大难题。第五,MR反应机理尚未完全明了,反应条件与特定产物生成之间关系尚不明确,MRPs的具体组成、确切结构、构效关系、代谢过程与途径以及与肠道微生物菌群的相互作用等也尚未完全清楚,这些都在一定程度上限制了它的实际应用。
5 展望
MR已被证实是一种非常有前途的蛋白肽和肽的改性方法,鉴于当前MR面临的一系列挑战,未来研究应从以下几方面考虑:(1)强化微波、超声波、超高压、脉冲电场、离子液体等技术手段在MR中的应用,提高反应效率,降低反应成本,减少不期望的副反应的发生,使MR向利大于弊方向转变。(2)深化MR反应动力学研究,协调好各方面因素对MR的影响,通过添加天然抗氧化剂类功能性成分或使用酶干预的方法来控制和调整MR进程,实现MRPs的定向可控制备,最大限度减轻MR带来的负面效应。(3)加快化学法、光谱法、色谱法以及质谱法等现代高新分析、检测与鉴定技术的研发,以便实时监测MR的进展,并实现目标MRPs的快速分离、分析和表征。(4)深入探索MR的反应机制以及MRPs的构效关系,为目标MRPs生产技术方案的“量身定制”提供参考。(5)将MRPs功能特性和生物活性的研究由简单模型系统向复杂食品基质系统转变,由体外实验向体内实验转变,以充分认识MRPs全部潜力以及局限性,为拓展其在医学、材料等领域的应用奠定基础。(6)加强MRPs的代谢以及生理学和毒理学作用方面的研究,解析MRPs在体内的代谢过程与具体的代谢途径,明确MRPs与肠道微生物菌群的相互作用,探究MRPs发挥各种生理作用的机制,揭示MRPs中有毒组分的致病和致癌机制,以获取其在体内发挥实际作用的更多信息。未来,随着科学技术的不断发展以及相关理论研究的进一步深入,MR必将在食品和医疗保健领域得到更加广泛的应用。
[1] DE OLIVEIRA F C, COIMBRA J S D R, DE OLIVEIRA E B, et al.Food protein-polysaccharide conjugates obtained via the Maillard reaction:A review[J].Critical Reviews in Food Science and Nutrition, 2016, 56(7):1 108-1 125.
[2] LIU J H, RU Q M, DING Y T.Glycation a promising method for food protein modification:Physicochemical properties and structure, a review[J].Food Research International, 2012, 49(1):170-183.
[3] 冯燕英, 牟代臣, 祁文磊, 等.蛋白质糖基化接枝改性研究进展[J].食品与机械, 2019, 35(2):190-195.
FENG Y Y, MU D C, QI W L, et al.Research progress on grafting modification of protein glycosylation[J].Food & Machinery, 2019, 35(2):190-195.
[4] KUTZLI I, WEISS J, GIBIS M.Glycation of plant proteins via Maillard reaction:Reaction chemistry, technofunctional properties, and potential food application[J].Foods (Basel, Switzerland), 2021,10(2):376.
[5] TEODOROWICZ M, VAN NEERVEN J, SAVELKOUL H.Food processing:The influence of the Maillard reaction on immunogenicity and allergenicity of food proteins[J].Nutrients, 2017, 9(8):835.
[6] 张蓓. 燕麦蛋白质糖基化改性及乳化性研究[D].无锡:江南大学, 2015.
ZHANG B.Study on modification of oat protein isolate by glycation reaction and emulsifying properties[D].Wuxi:Jiangnan University, 2015.
[7] NAIK R R, WANG Y, SELOMULYA C.Improvements of plant protein functionalities by Maillard conjugation and Maillard reaction products[J].Critical Reviews in Food Science and Nutrition, 2021:1-26.DOI:10.1080/10408398.2021.1910139.
[8] NOOSHKAM M, VARIDI M, BASHASH M.The Maillard reaction products as food-born antioxidant and antibrowning agents in model and real food systems[J].Food Chemistry, 2019, 275:644-660.
[9] DE OLIVEIRA F C D, COIMBRA J S D, DE OLIVEIRA E B, et al.Food protein-polysaccharide conjugates obtained via the Maillard reaction:A review[J].Critical Reviews in Food Science and Nutrition, 2016, 56(7):1 108-1 125.
[10] ECHAVARR A A P, PAG
A A P, PAG N J, IBARZ A.Melanoidins formed by Maillard reaction in food and their biological activity[J].Food Engineering Reviews, 2012, 4(4):203-223.
N J, IBARZ A.Melanoidins formed by Maillard reaction in food and their biological activity[J].Food Engineering Reviews, 2012, 4(4):203-223.
[11] CHEN K N, YANG Q F, HONG H, et al.Physicochemical and functional properties of Maillard reaction products derived from cod (Gadus morhua L.) skin collagen peptides and xylose[J].Food Chemistry, 2020, 333:127489.
[12] SPOTTI M J, PERDUCA M J, PIAGENTINI A, et al.Gel mechanical properties of milk whey protein-dextran conjugates obtained by Maillard reaction[J].Food Hydrocolloids, 2013, 31(1):26-32.
[13] BU G H, REN M K, ZUO Y X, et al.Functional characteristics and structural properties of soybean protein isolate-maltose conjugates[J].Cereal Chemistry, 2022, 99(1):100-110.
[14] NOOSHKAM M, MADADLOU A.Microwave-assisted isomerisation of lactose to lactulose and Maillard conjugation of lactulose and lactose with whey proteins and peptides[J].Food Chemistry, 2016, 200:1-9.
[15] 张晓燕, 孟令莉, 吴子健, 等.葡聚糖分子质量对其与牛血清白蛋白共聚物性质的影响[J].食品与发酵工业, 2021, 47(15):104-110.
ZHANG X Y, MENG L L, WU Z J, et al.Effects of dextran molecular weight on characteristics of BSA-dextran conjugates.[J].Food and Fermentation Industries, 2021, 47(15):104-110.
[16] WEN C T, ZHANG J X, QIN W, et al.Structure and functional properties of soy protein isolate-lentinan conjugates obtained in Maillard reaction by slit divergent ultrasonic assisted wet heating and the stability of oil-in-water emulsions[J].Food Chemistry, 2020, 331:127374.
[17] CORZO-MART NEZ M, CARRERA S
NEZ M, CARRERA S NCHEZ C, MORENO F J, et al.Interfacial and foaming properties of bovine β-lactoglobulin:Galactose Maillard conjugates[J].Food Hydrocolloids, 2012, 27(2):438-447.
NCHEZ C, MORENO F J, et al.Interfacial and foaming properties of bovine β-lactoglobulin:Galactose Maillard conjugates[J].Food Hydrocolloids, 2012, 27(2):438-447.
[18] 赵玉滨. 英国红芸豆蛋白抗氧化肽糖基化改性及产物功能性质研究[D].大庆:黑龙江八一农垦大学, 2021.
ZHAO Y B.Study on the glycosylation modification of British red kidney bean protein antioxidant peptide and the functional properties of the product[D].Daqing:Heilongjiang Bayi Agricultural University, 2021.
[19] WU J J, CHEN H, ZHOU L, et al.An insight into heat-induced gelation of whey protein isolate-lactose mixed and conjugate solutions:Rheological behavior, microstructure, and molecular forces[J].European Food Research and Technology, 2021, 247(7):1 711-1 724.
[20] 段汝清, 苏宇杰, 王俊伟, 等.瓜尔豆胶酶解液改性蛋清蛋白凝胶性质的研究[J].食品与生物技术学报, 2018, 37(7):714-721.
DUAN R Q, SU Y J, WANG J W, et al.Effect of guar gum hydrolysate on gel properties of egg white protein[J].Journal of Food Science and Biotechnology, 2018, 37(7):714-721.
[21] ZHA F C, DONG S Y, RAO J J, et al.The structural modification of pea protein concentrate with gum Arabic by controlled Maillard reaction enhances its functional properties and flavor attributes[J].Food Hydrocolloids, 2019, 92:30-40.
[22] CHENG Y H, MU D C, JIAO Y, et al.Microwave-assisted Maillard reaction between rice protein and dextran induces structural changes and functional improvements[J].Journal of Cereal Science, 2021, 97:103134.
[23] 左颖昕, 布冠好.葡萄糖接枝对大豆分离蛋白功能特性和结构的影响[J].河南工业大学学报(自然科学版), 2018, 39(2):58-64.
ZUO Y X,BU G H.Functional and structural properties of soybean protein isolate-glucose conjugates.[J].Journal of Henan University of Technology(Natural Science Edition), 2018, 39(2):58-64;71.
[24] LIU L, LIN W J, LIU H Z, et al.Effect of xylose on the structural and physicochemical properties of peanut isolated protein based films[J].RSC Advances, 2017, 7(83):52 357-52 365.
[25] 李萍, 张慧君, 郭浩, 等.糖基化改性玉米醇溶蛋白膜的性能及硬胶囊体外释放分析[J].农业工程学报, 2021, 37(14):302-309.
LI P, ZHANG H J, GUO H, et al.Performance of zein film modified by glycosylation and in vitro release analysis of hard capsule[J].Transactions of the Chinese Society of Agricultural Engineering, 2021, 37(14):302-309.
[26] 张曦, 李琦, 景浩.乳清蛋白-木糖美拉德反应产物的成膜性及其膜包裹对核桃仁脂质过氧化的抑制作用[J].食品科学, 2011, 32(5):58-64.
ZHANG X, LI Q, JING H.Film-forming properties of Maillard reaction products formed from whey protein and xylose and their inhibitory effect on lipid oxidation in walnut kernel[J].Food Science, 2011, 32(5):58-64.
[27] SHENG L, SU P, HAN K, et al.Synthesis and structural characterization of lysozyme-pullulan conjugates obtained by the Maillard reaction[J].Food Hydrocolloids, 2017, 71:1-7.
[28] 杨珮瑜, 刘冬梅, 阮关强,等.黄鲫蛋白水解液美拉德反应物的抑菌性及抗氧化性研究[J].中国食品学报, 2016, 16(4):51-57.
YANG P Y, LIU D M, RUAN G Q, et al.Studies on antibacterial and antioxidant activities of the Maillard reaction products of half-fin anchovy hydrolysates[J].Journal of Chinese Institute of Food Science and Technology, 2016, 16(4):51-57.
[29] EINARSSON H.The effect of time, temperature, pH and reactants on the formation of antibacterial compounds in the Maillard reaction[J].LebensmittelWissenschaft Und Technologie, 1987, 20(2):51-55.
[30] JI L L, ZHANG Y, SONG W D, et al.Analysis on antibacterial activities and volatile compounds of Maillard reaction products derived from squid skin[C].E3S Web of Conferences, 2020, 145:01028.
[31] RUFI N-HENARES J A, DE LA CUEVA S P.Antimicrobial activity of coffee melanoidins—A study of their metal-chelating properties[J].Journal of Agricultural and Food Chemistry, 2009, 57(2):432-438.
N-HENARES J A, DE LA CUEVA S P.Antimicrobial activity of coffee melanoidins—A study of their metal-chelating properties[J].Journal of Agricultural and Food Chemistry, 2009, 57(2):432-438.
[32] HAUSER C, MÜLLER U, SAUER T, et al.Maillard reaction products as antimicrobial components for packaging films[J].Food Chemistry, 2014, 145:608-613.
[33] WÜHR A, DECKERT M, PISCHETSRIEDER M.Identification of aminoreductones as active components in Maillard reaction mixtures inducing nuclear NF-κB translocation in macrophages[J].Molecular Nutrition & Food Research, 2010, 54(7):1 021-1 030.
[34] KCHAOU H, BENBETTAÏEB N, JRIDI M, et al.Enhancement of structural, functional and antioxidant properties of fish gelatin films using Maillard reactions[J].Food Hydrocolloids, 2018, 83:326-339.
[35] JIANG W, LIU Y, YANG X Q, et al.Antioxidant and antibacterial activities of modified crab shell bioactive peptides by Maillard reaction[J].International Journal of Food Properties, 2018, 21(1):2 730-2 743.
[36] 杜玲玲, 刘璐, 李晓东,等.美拉德反应对乳清分离蛋白及其水解物抗氧化性的影响[J].食品科学, 2017, 38(1):171-176.
DU L L, LIU L, LI X D, et al.Effect of Maillard reaction on antioxidant activity of whey protein isolate and its hydrolysate[J].Food Science, 2017, 38(1):171-176.
[37] YANG S Y, LEE S, PYO M C, et al.Improved physicochemical properties and hepatic protection of Maillard reaction products derived from fish protein hydrolysates and ribose[J].Food Chemistry, 2017, 221:1 979-1 988.
[38] GU F L, KIM J M, HAYAT K, et al.Characteristics and antioxidant activity of ultrafiltrated Maillard reaction products from a casein-glucose model system[J].Food Chemistry, 2009, 117(1):48-54.
[39] ZHANG M, ZHENG J Y, GE K S, et al.Glycation of α-lactalbumin with different size saccharides:Effect on protein structure and antigenicity[J].International Dairy Journal, 2014, 34(2):220-228.
[40] BLANC F, VISSERS Y M, ADEL-PATIENT K, et al.Boiling peanut Ara h 1 results in the formation of aggregates with reduced allergenicity[J].Molecular Nutrition & Food Research, 2011, 55(12):1 887-1 894.
[41] ZHAO Y J, CAI Q F, JIN T C, et al.Effect of Maillard reaction on the structural and immunological properties of recombinant silver carp parvalbumin[J].LWT - Food Science and Technology, 2017, 75:25-33.
[42] 毛积华, 王辉, 涂宗财,等.己糖修饰的糖基化卵清蛋白产物及其致敏性分析[J].食品与机械, 2020, 36(6):11-15;98.
MAO J H, WANG H, TU Z C, et al.Analysis of glycation products and sensitization of ovalbumin modified by different hexoses[J].Food & Machinery, 2020, 36(6):11-15;98.
[43] YANG S Y, KIM S W, KIM Y, et al.Optimization of Maillard reaction with ribose for enhancing anti-allergy effect of fish protein hydrolysates using response surface methodology[J].Food Chemistry, 2015, 176:420-425.
[44] NISHIZAWA M, SAIGUSA M, SAEKI H.Conjugation with alginate oligosaccharide via the controlled Maillard reaction in a dry state is an effective method for the preparation of salmon myofibrillar protein with excellent anti-inflammatory activity[J].Fisheries Science, 2016, 82(2):357-367.
[45] CHOE I H, JEON H J, EOM S H, et al.The anti-inflammatory effect of a glycosylation product derived from the high hydrostatic pressure enzymatic hydrolysate of a flatfish byproduct[J].Food & Function, 2016, 7(6):2 557-2 565.
[46] CHEN Y J, NAGY T, GUO T L.Glycated whey proteins protect NOD mice against type 1 diabetes by increasing anti-inflammatory responses and decreasing autoreactivity to self-antigens[J].Journal of Functional Foods, 2019, 56:171-181.
[47] SUMMA C, MCCOURT J, C MMERER B, et al.Radical scavenging activity, anti-bacterial and mutagenic effects of Cocoa bean Maillard Reaction products with degree of roasting[J].Molecular Nutrition & Food Research, 2008, 52(3):342-351.
MMERER B, et al.Radical scavenging activity, anti-bacterial and mutagenic effects of Cocoa bean Maillard Reaction products with degree of roasting[J].Molecular Nutrition & Food Research, 2008, 52(3):342-351.
[48] HONG X, MENG J, LU R R.Improvement of ACE inhibitory activity of casein hydrolysate by Maillard reaction with xylose[J].Journal of the Science of Food and Agriculture, 2015, 95(1):66-71.
[49] BORRELLI R C, FOGLIANO V.Bread crust melanoidins as potential prebiotic ingredients[J].Molecular Nutrition & Food Research, 2005, 49(7):673-678.
[50] LIU Y, ZOU J, ZHAO Y Q, et al.Antihyperuricemic effect of tuna protein hydrolysate and derived products after in vitro digestion or Maillard reaction on oteracil potassium-induced hyperuricemia rats[J].International Journal of Food Science & Technology, 2019, 54(1):263-270.
[51] TRAN T N, DOAN C T, NGUYEN V B, et al.Anti-oxidant and anti-diabetes potential of water-soluble chitosan-glucose derivatives produced by Maillard reaction[J].Polymers, 2019, 11(10):1 714.
[52] CHEN X, FANG F, WANG S Y.Physicochemical properties and hepatoprotective effects of glycated Snapper fish scale peptides conjugated with xylose via Maillard reaction[J].Food and Chemical Toxicology, 2020, 137:111115.
[53] GUERRA-HERNANDEZ E, LEON GOMEZ C, GARCIA-VILLANOVA B, et al.Effect of storage on non-enzymatic browning of liquid infant milk formulae[J].Journal of the Science of Food and Agriculture, 2002, 82(5):587-592.
[54] GARC A M M, SEIQUER I, DELGADO-ANDRADE C, et al.Intake of Maillard reaction products reduces iron bioavailability in male adolescents[J].Molecular Nutrition & Food Research, 2009, 53(12):1 551-1 560.
A M M, SEIQUER I, DELGADO-ANDRADE C, et al.Intake of Maillard reaction products reduces iron bioavailability in male adolescents[J].Molecular Nutrition & Food Research, 2009, 53(12):1 551-1 560.
[55] DELGADO-ANDRADE C, SEIQUER I, NAVARRO M P.Effects of consumption of Maillard reaction products on magnesium digestibility and tissue distribution in rats[J].Food Science and Technology International, 2007, 13(2):109-115.
[56] FU Y, ZHANG Y H, SOLADOYE O P, et al.Maillard reaction products derived from food protein-derived peptides:Insights into flavor and bioactivity[J].Critical Reviews in Food Science and Nutrition, 2020, 60(20):3 429-3 442.
[57] ALJAHDALI N, CARBONERO F.Impact of Maillard reaction products on nutrition and health:Current knowledge and need to understand their fate in the human digestive system[J].Critical Reviews in Food Science and Nutrition, 2019, 59(3):474-487.
[58] GUPTA R K, GUPTA K, SHARMA A, et al.Maillard reaction in food allergy:Pros and cons[J].Critical Reviews in Food Science and Nutrition, 2018, 58(2):208-226.