嘌呤(purine)是生物体内重要的含氮碱基,是存在于人体细胞和大多数食品的一类天然生物碱[1],主要包括腺嘌呤(adenine)、鸟嘌呤(guanine)、黄嘌呤(xanthine)、次黄嘌呤(hypoxanthine)及其衍生物。嘌呤以碱基的形式参与合成核苷酸进而构成核酸等人体重要的遗传物质。此外,嘌呤还能以ATP、组成辅酶调节代谢等形式参与机体的各项生命活动[2]。研究表明,当人体摄入过多嘌呤或者嘌呤代谢紊乱,造成体内尿酸滞留过多或排出减少,容易导致高尿酸血症,进而诱发痛风[3]。肉类食品因其高营养价值及其诱人的风味深受广大消费者的喜爱,在人们的日常饮食中占有很大的比例。但同时肉类也是一类高嘌呤食品(76~398 mg/100g)[4],过多的摄入肉类可显著影响血尿酸水平,增加痛风发病率[5]。《高尿酸血症与痛风患者膳食指导》[4]建议,高尿酸群体应减少外源性嘌呤摄入,减轻血尿酸负担,降低痛风风险或减少痛风发作次数。
目前国内外对于肉类嘌呤含量研究较多,但尚未有研究者对其进行归纳。本文介绍了嘌呤与痛风病的关系,将肉类样品前处理及嘌呤检测方法进行了对比,对已测得肉类嘌呤含量的结果进行分类整理,并针对肉类产品降嘌呤方法进行了总结,以期为肉类嘌呤后续的相关研究提供参考,为消费者提供肉类产品选择的依据。
1 嘌呤与痛风
1.1 嘌呤简介
嘌呤是一种带有4个氮原子的杂环芳香有机物,是核酸的重要组成部分,嘌呤的结构[6]与基本性质[7]见图1和表1。嘌呤在人体代谢的终产物是尿酸,嘌呤分子通过代谢过程被小肠吸收,最终形成尿液被降解和排泄[8]。人体内尿酸约有1/5由每日摄入的食物嘌呤转化而来;另约有4/5的尿酸由人体内氨基酸、核苷酸等小分子化合物合成和核酸分解生成[9],研究发现,嘌呤广泛存在于各类食物中,常见的干菌菇类、动物内脏类、海鲜类、大豆类等食品有较高的嘌呤含量,摄入食品的种类及含量与痛风的发生密切相关[10]。
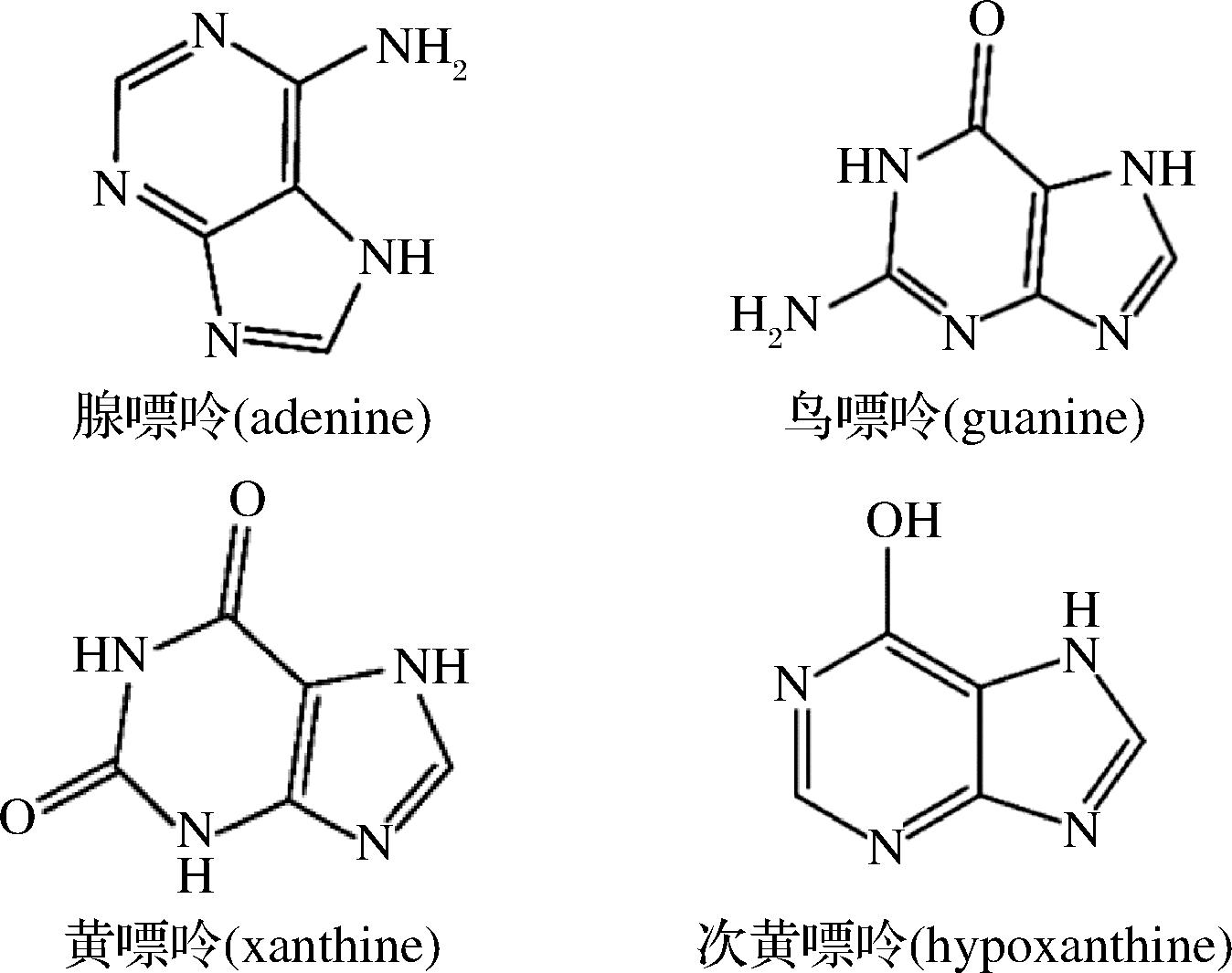
图1 4种嘌呤的结构式
Fig.1 Structural formula of four purines
表1 四种嘌呤的基本性质
Table 1 Basic properties of four purines
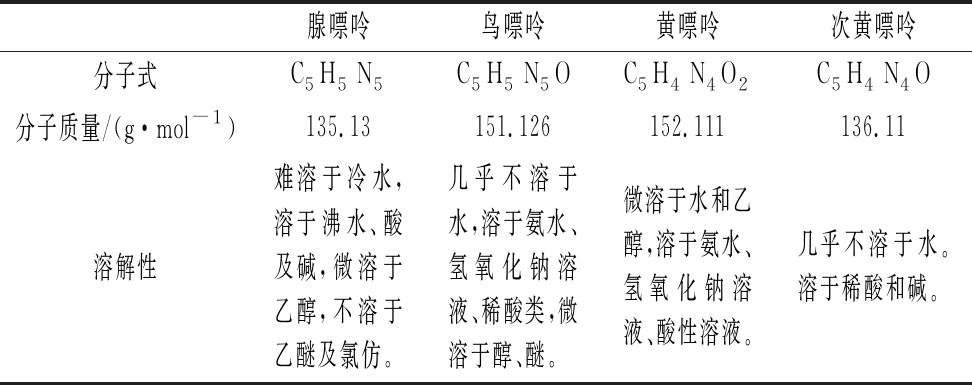
腺嘌呤鸟嘌呤黄嘌呤次黄嘌呤分子式C5H5 N5C5H5 N5OC5H4 N4O2C5H4 N4O分子质量/(g·mol-1)135.13151.126152.111136.11溶解性难溶于冷水,溶于沸水、酸及碱,微溶于乙醇,不溶于乙醚及氯仿。几乎不溶于水,溶于氨水、氢氧化钠溶液、稀酸类,微溶于醇、醚。微溶于水和乙醇,溶于氨水、氢氧化钠溶液、酸性溶液。几乎不溶于水。溶于稀酸和碱。
1.2 嘌呤与痛风病
痛风是一种由单钠尿酸盐沉积所致的晶体相关性关节病,与嘌呤代谢紊乱或尿酸排出减少所致的高尿酸血症直接相关,是常见的代谢性疾病,常表现为急性关节炎、痛风石形成、痛风石性慢性关节炎、尿酸盐肾病和尿酸性尿路结石等[4]。当人体内嘌呤摄入增多或代谢紊乱产生较多的尿酸,而肾脏不能及时将尿酸排出体外,可引起高尿酸血症。当血中尿酸浓度持续增加达到过饱和状态时,尿酸析出,形成结晶沉积在关节、软骨及肾脏组织中,引起组织的异物炎症反应,造成疼痛和功能障碍,进而导致痛风发作[11]。
2 肉类中嘌呤含量的测定方法
嘌呤检测目前没有规范、统一的标准,因此,检测嘌呤的方法有很多。不同文献报道同一种食品嘌呤含量也存在差异,王新宴等[12]测得猪肉的总嘌呤含量为98.5 mg/100g,而骆捷怡等[13]测得猪肉总嘌呤含量为121.5 mg/100g,明显高于王新宴等的研究结果。嘌呤目前最常见的检测方法是高效液相色谱法,其检测过程主要是肉类食品中嘌呤类物质通过一定的方式转化为4种游离嘌呤,然后选择合适的液相色谱条件进行测定[14]。
2.1 肉类样品前处理方法
食品样品前处理的方法有酸解提取法、有机溶剂提取法、柱萃取、膜萃取和离子交换柱纯化法等[15]。酸解提取法使用较为广泛,该方法可从核酸、核苷酸和核苷中释放嘌呤碱基,所获得的嘌呤碱基代表食品中总嘌呤含量[16]。酸解提取法中酸的种类、浓度、比例,水解时间及温度等条件均会影响最终实验结果[17]。
表2是最近几年文献报道使用的水解液及加标回收率,根据GB/T 27404—2008《实验室质量控制范围 食品理化检测》,嘌呤属于未制定最高残留限量(maximum residue limit,MRL)的物质,含量通常在10 mg/100g以上,加标回收率应在95%~105%较为合适。就肉类嘌呤前处理而言,通常选择高氯酸或者三氟乙酸与甲酸组成的混合酸进行酸解,但已有较多研究表明使用高氯酸进行水解会使嘌呤遭到破坏,从而降低回收率。张静[18]使用高氯酸水解猪肉样品中的嘌呤,测得加标回收率在79.85%~102.60%。除此之外,使用高氯酸水解通常需要在沸水浴条件下水解60 min,冰水浴后加入NaOH或KOH进行中和调整pH,整个过程程序繁琐,耗时较长,并且高氯酸作为管制类化学品价格较为昂贵且不易购买,这些都提高了检测成本。三氟乙酸与甲酸1∶1等体积混合,可以提高嘌呤提取效率,减少损失;任丽琨[19]和张滋慧[20]研究时采用V(甲酸)∶V(三氟乙酸)∶V(水) =5∶5∶1的混合溶液提取水产品中的嘌呤,得到的检测结果显示水解效果较好,损失较少,4种嘌呤加标回收率均高于95%。
表2 嘌呤水解液选择及其加标回收率
Table 2 Selection of purine hydrolysate and its recovery rate
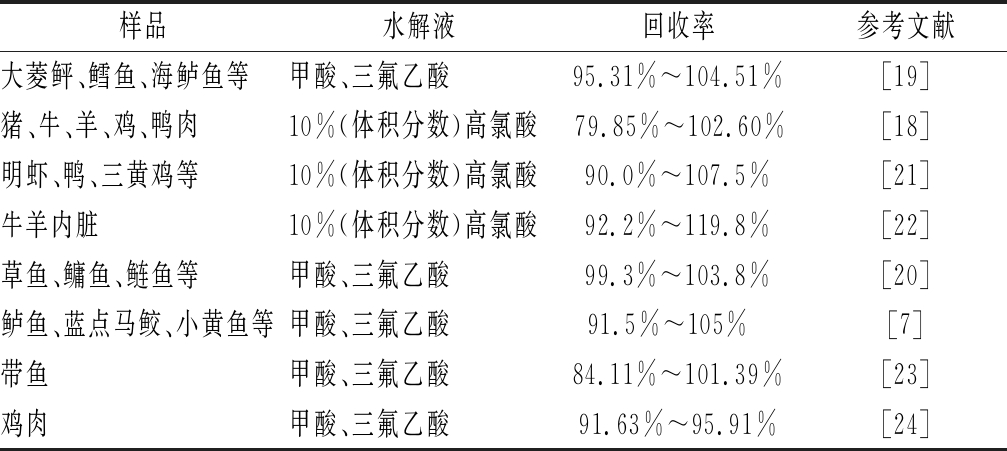
样品水解液回收率参考文献大菱鲆、鳕鱼、海鲈鱼等甲酸、三氟乙酸95.31%~104.51%[19]猪、牛、羊、鸡、鸭肉10%(体积分数)高氯酸 79.85%~102.60%[18]明虾、鸭、三黄鸡等10%(体积分数)高氯酸90.0%~107.5%[21]牛羊内脏10%(体积分数)高氯酸92.2%~119.8%[22]草鱼、鳙鱼、鲢鱼等甲酸、三氟乙酸99.3%~103.8%[20]鲈鱼、蓝点马鲛、小黄鱼等甲酸、三氟乙酸91.5%~105% [7]带鱼甲酸、三氟乙酸84.11%~101.39%[23]鸡肉甲酸、三氟乙酸91.63%~95.91%[24]
2.2 嘌呤的检测方法
目前最常用的嘌呤检测方法是高效液相色谱法,但由于不同种类样品性质差异较大,没有较为统一的液相检测条件。表3是部分文献检测肉类嘌呤含量所使用的液相条件。
表3 肉类嘌呤检测液相条件
Table 3 Liquid phase conditions for purine detection in meat

样品色谱柱流动相及其pH文献大菱鲆、鳕鱼、海鲈鱼等Agilent Eclipse XDB-C18V(水)∶V(甲醇)∶V(冰乙酸)∶V(20%四丁基氢氧化铵)=879∶100∶15∶6[19]猪、牛、羊、鸡、鸭肉Agilent Eclipse XDB-C180.02 mol/L KH2PO4-H3PO4(pH=3.8)[18]牛羊内脏CAPCELL PAK-C180.007 mol/L KH2PO4-H3PO4(pH=3.83)[22]鲈鱼、蓝点马鲛、小黄鱼等Waters Atlantis dC180.02 mol/L KH2PO4-H3PO4(pH=3.6)[7]明虾、鸭、三黄鸡等Agilent Eclipse XDB-C180.007nol/L KH2PO4-H3PO4(pH=4.0)[21]草鱼、鳙鱼、鲢鱼等Waters Atlantis T30.02 mol/L KH2PO4-H3PO4 (pH=3.6)[20]海鲈鱼Agilent Eclipse XDB-C18V(水)∶V(甲醇)∶V(冰乙酸)∶V(20%四丁基氢氧化铵)=879∶100∶15∶6[25]凤尾鱼YMC-TriartC1870% 0.08 mol/L磷酸铵缓冲液-30%甲醇[26]大菱鲆Agilent Eclipse XDB-C18V(水)∶V(甲醇)∶V(冰乙酸)∶V(20%四丁基氢氧化铵)=879∶100∶15∶6[27]猪、牛肉Waters Atlantis T399% 10 mmol/L甲酸铵溶液-1%甲醇[28]鹅肝酱、鳗鱼、凤尾鱼等Shodex AsahiPak 320-HQ0.15 mol/L KH2PO4-H3PO4 (pH=2.5~2.8)[29]猪、鸡、牛、兔、鸭肉Waters Atlantis dC180.02 mo1/L KH2PO4(pH=3.8)[12]蟋蟀、蚂蚱等可食用昆虫Luna C180.05 mol/L KH2PO4(pH=3.6)-乙腈[30]
嘌呤检测通常使用 C18色谱柱作为固定相,不同型号的C18色谱柱其相适应的色谱条件不同。张静[18]、杨海斌等[31]用Agilent Eclipse XDB-C18柱测定了水产品、畜禽肉、调味品等中4种嘌呤的含量。张滋慧[20]、RONG等[28]用 Waters Atlantis T3柱测定了水产品、猪牛肉等中4种嘌呤的含量。其他学者还有使用 Waters Atlantis dC18、CAPCELL PAK-C18柱等其他各类C18柱去检测嘌呤含量[22, 32]。
流动相种类和浓度均会对高效液相色谱分离结果产生一定影响。目前所选择的流动相是以不同浓度、pH的KH2PO4-H3PO4和V(水)∶V(甲醇)∶V(冰醋酸)∶V(20%四丁基氢氧化铵)=879∶100∶15∶6为主,凌云等[33]利用Waters Atlantis dC18对比了pH为3.2、3.6、3.8、4.0、4.6的0.02 mol/L KH2PO4-H3PO4对4种嘌呤分离效果的影响,发现pH为3.6或3.8时,4种嘌呤达到基线分离,但出峰顺序有所不同。
另外,柱温、检测波长也会对最终分离检测结果产生影响。程庆红[34]研究结果显示在26~34 ℃范围内,柱温的上升使腺嘌呤和黄嘌呤的保留时间逐渐减小,对次黄嘌呤的保留时间无影响。大多数研究者柱温选择25~35 ℃,采用254 nm作为检测波长。
由于HPLC方法样品前处理程序相对繁琐,检测时间与成本较高等原因[35],有研究者开始尝试其他方法检测嘌呤含量。GUO等[36]通过重氮化反应将腺嘌呤和鸟嘌呤转化为次黄嘌呤和黄嘌呤,然后通过黄嘌呤氧化酶转化为尿酸。用表面增强拉曼光谱(surface-enhanced Raman spectroscopy,SERS)测量尿酸的含量,计算总嘌呤含量。结果显示,当鱼肉样品中的尿酸浓度在0.005~0.6 mmol/L时,在631 cm-1的特征拉曼峰值处建立的标准曲线具有良好的线性关系(R2=0.986 4)。回收率为101.7%~105.0%,具有较好的重现性(relative standard deviation,RSD<10%)。此方法较目前常用的HPLC方法测定总嘌呤含量更简单、快速,但是缺少样品中4种嘌呤相对含量的数据。
3 肉类的嘌呤含量
肉类是人们日常生活主要消费食品之一,但消费者长期食用大量肉类及制品会提高痛风发病率[37],因此,对肉类中嘌呤含量的检测一直是食品嘌呤检测的热点。已知常见肉类中嘌呤的含量见表4。
表4 常见肉类的嘌呤含量 单位:mg/100g
Table 4 purine content of common meat

注:—表示未检出该物质
样品鸟嘌呤腺嘌呤次黄嘌呤黄嘌呤总嘌呤参考文献猪肉 14.6±2.216.9±3.981.4±14.00.3±0.1113.2±19.8[21]猪肝 134±7.289.8±4.018.7±1.432.7±1.9275.2±14.6[38]牛肝 129.8±6.876.3±2.423.7±1.220.8±0.8250.6±13.7[38]牛肉 11.6±0.717.7±0.867.9±2.47.4±0.5104.7±3.4[38]羊肝 105.8±3.082.2±3.520.7±0.819.15±0.9227.8±6.6[38]畜肉羊肉 22.9±1.624.2±1.553.9±2.98.1±0.4109.1±6.3[38]猪臀肉 21.0±5.020.6±1.1105.6±8.53.6±0.7150.7±9.0[28]猪里脊 16.0±2.418.4±1.2107.1±4.03.3±1.4144.8±5.3[28]猪前腿肉15.4±0.618.7±1.292.3±5.63.0±0.3129.4±14.4[28]牛里脊 13.3±1.017.6±0.986.6±8.15.8±0.7122.3±11.2[28]兔肉 15.3±1.319.3±1.7108.8±6.50.9±0.3144.3±8.8[21]鸭肉 14.4±0.532.9±3.7121.5±1.52.3±1.2178.7±3.5[21]三黄鸡肝107.2±9.4102.3±3.14.6±1.620.9±2.9295.9±6.0[31]三黄鸡肉21.7±0.524.9±0.6128.7±6.80.6±0.1175.9±6.5[31]禽肉三黄鸡心43.1±0.638.0±5.658.2±2.44.5±3.4143.8±4.0[31]土鸡肝 5.1±3.3125.9±7.13.5±0.35.1±3.3216.9±14.0[31]土鸡肉 0.7±0.118.1±0.5111.8±4.60.7±0.1149.0±4.5[31]土鸡心 5.8±0.332.8±1.173.4±1.85.8±0.3140.0±3.2[31]草鱼 18.3±1.321.9±5.462.7±7.52.7±0.6105.5±6.2[20]鲢鱼 20.0±9.216.8±1.560.5±2.23.1±1.0100.4±9.5[20]鲤鱼 13.4±4.017.6±1.068.1±2.31.6±0.4100.6±11.2[20]沙丁鱼 98.46±9.439.1±7.1102.6±7.2—240.3±15.0[20]水产带鱼 42.9±6.514.4±1.264.4±10.35.6±0.2127.3±13.4[20]鱿鱼 16.1±2.115.3±1.1117.3±4.12.2±0.2150.9±6.2[20]小黄鱼 66.7±3.712.8±2.615.1±2.3—94.6±5.0[20]牡蛎 22.5±2.327.3±3.19.2±5.3581.6±4.9140.5±7.1[20]扇贝 17.8±5.162.2±3.619.5±2.22.4±0.8101.9±3.0[20]
3.1 畜肉嘌呤含量
潘洪志等[38]研究结果表明,畜肉产品中,肝脏中嘌呤含量显著高于肌肉组织,其中猪肝最高,牛肝次之,羊肝最少,肝脏中鸟嘌呤含量最高,腺嘌呤次之。肌肉组织中,猪肉最高,羊肉和牛肉没有明显差异,肌肉中次黄嘌呤含量最高,腺嘌呤次之。RONG等[28]研究表明不同部位的猪肉、牛肉嘌呤含量有所差别,发现4个部位猪肉中猪臀肉嘌呤最高、猪里脊肉次之,然后是猪前腿肉,猪排肉中嘌呤含量最少;4个部位牛肉中牛里脊肉最高,牛肋条肉次之,然后是牛肩胛肉,牛肋眼肉嘌呤含量最低。总的来说,猪肉嘌呤含量高于牛肉。ZHENG等[39]对比了杜洛克猪(Duroc)、杜洛克猪×长白猪×大白猪杂交品种(DLY)、二花脸猪(EHL)、巴马香猪(BMX)、山东莱芜猪(LW)、4个中国猪种×4个国外猪种杂交品种(HS)6个品种猪肉嘌呤含量,发现LW品种的总嘌呤含量显著低于除Duroc外的其他4个品种,BMX总嘌呤含量最高;对比了12个猪组织、器官嘌呤含量发现猪肺、肝、肾嘌呤含量均大于200 mg/100g,4个不同部位的肌肉(半膜肌、腰最长肌、咬肌和心肌)和2个消化器官(猪大肠和猪胃)嘌呤含量在100~150 mg/100g,而在猪蹄、猪皮和猪背膘等组织中嘌呤含量均小于50 mg/100g;嘌呤含量与其他品质指标的相关性分析结果表明,嘌呤含量与最终pH (pHu)、水分含量、肌内脂肪含量(intramuscular fat,IMF)、L*、a*、b* 3个颜色参数以及颜色和大理石花纹主观评分等8个猪肉品质显著相关。这表明pHu高、IMF和大理石纹丰富、色泽鲜艳的猪肉嘌呤含量相对较低。消费者可以通过观察肉类的肉色和大理石花纹,选择到较低嘌呤含量的猪肉产品。
3.2 禽肉嘌呤含量
杨海斌等[31]研究结果表明,肝、肾等组织中嘌呤以鸟嘌呤、腺嘌呤为主,肉、心、胗等组织中嘌呤含量以次黄嘌呤最高,肉中次黄嘌呤含量约占总嘌呤含量的70%。潘洪志等[38]对比了鸡鸭鹅不同部位的嘌呤含量,研究显示禽肉中鸡肉有最高嘌呤含量;肝脏中,鸭肝嘌呤含量最高,其次是鹅肝,鸡肝嘌呤含量最低。胗脏中,鸭胗嘌呤含量最高。然而,KANEKO等[29]研究发现鸡肝的嘌呤为312 mg/100g,而鹅肝嘌呤含量仅为81.9 mg/100g。其原因可能是鹅肝的脂肪含量很高,大约是鸡肝的4倍,嘌呤一般以核酸的形式存在于细胞核或细胞质中,核酸的数量与细胞的数量成正比。脂肪细胞很大,因此相同重量鹅肝中的细胞数量比正常鸡肝要少。
3.3 水产品嘌呤含量
QU等[32]发现不同种类海鲜及其部位嘌呤含量有所差异,结果显示虾和香螺、红螺的嘌呤含量高于鱼类和贝类;鱼皮和肝脏中嘌呤含量高于肌肉组织,研究者发现海参的嘌呤含量仅有约8 mg/100g,可为消费者提供低嘌呤膳食提供参考。KANEKO等[40]测定了36种生鲜鱼嘌呤含量,结果显示近90%的生鲜鱼嘌呤含量高于100 mg/100g。其中鲣鱼和沙丁鱼的嘌呤含量甚至高于200 mg/100g。许多贝类、软体动物和鱼干中的嘌呤含量也超过150 mg/100g;然而几种鱼卵和加工过的鱼丸等鱼制品只含有少量的嘌呤,前者可能是由于鱼卵为单一细胞组成,因此有较低嘌呤含量,后者在斩拌、漂洗过程脱除部分嘌呤;在嘌呤组成方面,几乎所有的鱼卵,超过一半的贝类、软体动物和加工鱼制品腺嘌呤和鸟嘌呤含量约占总嘌呤含量的60%。
3.4 火锅及肉汤中的嘌呤含量
火锅和肉汤是深受人们喜爱的大众饮食,吃火锅时会大量进食嘌呤含量高的肉类,煲制肉汤长时间的炖煮,会让嘌呤更多的嘌呤溶于汤中,增加痛风风险。左俊英[41]以松茸、茶树菇、香菇、金针菇、母鸡、冷鲜筒子骨为主料熬制火锅底汤,发现底汤在8 h熬制过程中,嘌呤含量逐渐增加。1 h内总嘌呤含量增幅较小,可能是因为原料组织结构致密,不利于嘌呤溶出。在2~4 h增速和增量较大,可能是原料组织结构在熬制过程中逐渐变得疏松而溶出大量的嘌呤物质。5~8 h增速和增量减小,可能与溶出速度降低有关;在涮煮过程中,涮煮原料嘌呤会不断溶出,增大汤底的嘌呤含量。荣胜忠等[42]模拟涮火锅过程,探究羊肉、牛肉、青虾和汤中嘌呤含量的变化规律,研究发现3种汤里总嘌呤含量随加肉量增加、时间延长以及水分的不断减少而逐渐增大,所以建议不喝或少喝火锅汤,对想喝火锅汤的消费者可在喝汤前加一定量的水以稀释嘌呤浓度或者在涮肉之前提前盛汤。
煲汤是常见的饮食方式,骆婕怡等[13]通过研究冷水下锅不补水、冷水下锅补水、焯水下锅不补水、焯水下锅补水等4种煲制方式下猪肉汤中嘌呤含量的变化趋势,研究发现随着煲制时间的延长,猪肉汤中各嘌呤含量呈现上升趋势,在煲制前30 min猪肉汤的嘌呤溶出较快。在不补水的情况下,焯水会显著降低猪肉汤中的嘌呤含量;在补水的情况下,焯水的影响不显著。因此,习惯清汤的消费者,可采用补水的方式进行煲汤;喜欢浓汤的消费者,可在煲制前对原料肉焯水以降低汤中的嘌呤含量。
4 降低肉类中嘌呤物质的方法
既然不少肉类中高含量的嘌呤可能会影响消费者的健康,故消费者希望能通过一定的处理来降低嘌呤的含量。嘌呤类物质具有很高的化学稳定性,在通常的食品加工处理条件下很难发生化学变化。有研究表明,嘌呤经过100 ℃水浴加热5 h、2 450 MHz微波加热20 min、40 kHz超声波处理30 min等3种方式处理后,4种嘌呤标准品溶液含量没有明显变化[7],以上结果说明常用加工方式都不能使嘌呤结构分解。因此,在食品中嘌呤的脱除只能从一个介质转移到另一个介质,但其总体嘌呤含量基本保持不变。
4.1 加工工艺的处理
LOU等[16]将罗非鱼通过切块、清洗、研磨成糜、烹饪等方式探究鱼糜制作过程中嘌呤含量的变化,发现清洗过程总嘌呤含量下降速度快于研磨和烹饪过程;清洗过程总嘌呤含量下降了约60%,清洗10 min时,总嘌呤下降明显,在测定的3种嘌呤中,次黄嘌呤明显下降,腺嘌呤略微下降,鸟嘌呤未见明显变化,随着清洗次数的增加,次黄嘌呤含量显著降低,总嘌呤含量也相应降低。清洗过程引起的鱼肉总嘌呤含量下降主要是由于鱼肉次黄嘌呤含量的下降。
刘建林等[43]对比了乳清和复合发酵剂(木糖葡萄球菌、肉葡萄球菌、戊糖片球菌和植物乳杆菌比为1∶1∶2∶1)对发酵羊肉干中嘌呤形成的影响,结果发现发酵羊肉干在制作过程中各嘌呤的含量呈逐渐升高趋势,复合发酵剂可以抑制产品嘌呤含量升高,其主要抑制的是腺嘌呤、鸟嘌呤和次黄嘌呤含量的升高。
TAKAYANAGI等[26]采用高效液相色谱法测定了凤尾鱼发酵前后的总嘌呤和游离嘌呤含量。研究发现,凤尾鱼在发酵后腺嘌呤、次黄嘌呤和总嘌呤含量显著下降。在次黄嘌呤相关的嘌呤中,游离嘌呤含量结果显示凤尾鱼发酵前含有大量的肌苷酸(inosinemonphosphate,IMP),而发酵后含有较多的肌苷。在鸟嘌呤和腺嘌呤相关的嘌呤中,这些核苷酸随着发酵而减少,而核苷和碱基增加。对游离嘌呤的测定表明发酵后嘌呤的减少是由于核苷酸含量的降低。这些结果表明微生物种类和发酵时间对嘌呤含量有显著影响。TAKAYANAGI等[44]还研究了用日本传统的清酒糟浸泡方法制备的剑鱼中嘌呤组成的变化。结果表明,清酒浸泡后剑鱼的总嘌呤含量、次黄嘌呤和鸟嘌呤含量降低,在研究剑鱼游离嘌呤组成时,发现浸泡过程使剑鱼中IMP的比例降低,而使清酒糟中肌苷的比例升高。
张滋慧[20]研究了40 kHz超声波处理30 min对带鱼和沙丁鱼嘌呤的影响,研究发现随着处理时间的延长,腺嘌呤和次黄嘌呤含量逐渐降低,鸟嘌呤含量变化不显著。30 min内总嘌呤含量降低了约30%。其机理可能是由于超声波的空化作用、机械作用一定程度上破坏了组织细胞结构,从而使嘌呤能更多地向水中转移,不过作者未设置清水浸泡作为对组照,不能说明超声波对嘌呤具体的脱除效果。
ZHANG等[45]研究了0.1(对照)、200、400、600 MPa压力处理10 min后,在4 ℃贮藏10 d对鱿鱼肌肉嘌呤的影响,结果显示与对照组相比,高压处理第0天对鸟嘌呤和次黄嘌呤含量没有显著影响,而腺嘌呤含量在不同压力处理后下降了15.6%~17.7%;第10天,鸟嘌呤随着压力水平的增加而增加,而腺嘌呤和次黄嘌呤则随着压力的增加而减少;腺嘌呤与次黄嘌呤含量降低的原因可能是腺苷酸在腺苷酸脱氨酶或腺苷脱氨酶的作用下生成次黄嘌呤核苷酸或次黄嘌呤核苷,进而生成次黄嘌呤,而次黄嘌呤有一定溶解度,能在加工过程中快速释放。结果表明,适当的高压处理可以降低鱿鱼在贮藏过程中的嘌呤含量。
4.2 使用外源添加物
任丽琨[19]以清水浸泡为对照,研究了大蒜粉、生姜粉、花椒粉、桂皮、八角等香辛料对大菱鲆嘌呤含量的影响并探究了作用机理,发现100 g/L香辛料水溶液浸泡15 min后,除桂皮外,其余4种香辛料水溶液均具有良好的嘌呤脱除效果,其中大蒜粉嘌呤脱除效果最佳,但以30 g/L大蒜粉水溶液浸泡大菱鲆背部鱼肉15 min后,其总嘌呤脱除率仅为18.96%,说明仅凭浸泡处理不能使大菱鲆嘌呤含量明显降低;而用30 g/L大蒜粉浸泡15 min,水煮15 min后,大菱鲆背部鱼肉嘌呤含量下降了72.79%,高于清水处理的59.86%嘌呤脱除率,通过分子对接技术发现大蒜素在浸泡过程中通过氢键与疏水作用提高了黄嘌呤氧化酶活性,使部分次黄嘌呤转化为黄嘌呤,转化而来的黄嘌呤热稳定性降低,进而易被脱除。孙宏等[46]对比了花椒粉水溶液与清水经过浸泡-水煮等方式对大菱鲆鱼片嘌呤含量及品质的影响,研究发现以2%花椒粉水溶液浸泡鱼片15 min,总嘌呤含量降低了50.94 mg/100g,将鱼片浸泡45 min时,总嘌呤含量降至最低;相较于新鲜大菱鲆鱼片,清水对大菱鲆鱼片进行浸泡45 min-水煮8 min处理之后,总嘌呤含量减少58.07%;而2%花椒粉水溶液对大菱鲆鱼片进行相同处理后能够使总嘌呤含量减少79.50%。
4.3 采用适当的烹饪方式
吕兵兵[23]研究了水煮、清蒸、油炸等3种烹饪方式对带鱼嘌呤含量的影响,结果显示其总嘌呤含量较新鲜带鱼嘌呤含量显著降低。4种嘌呤中,鸟嘌呤和次黄嘌呤经不同的热处理后,显著降低。水煮前20 min,带鱼肉中嘌呤含量快速降低,水煮20 min到60 min之间缓慢减少,而鱼汤中嘌呤变化趋势正好相反,这可能是由于热萃取作用使鱼肉中嘌呤物质溶于鱼汤中。带鱼总嘌呤含量和4种嘌呤含量随着清蒸和油炸时间的增加,总体呈现先下降后趋于平衡的趋势。3种烹饪方式中,水煮对嘌呤的脱除作用强于清蒸和油炸。杨海斌[21]发现草鱼肉与鸭肉在水煮过程中,会使肉中次黄嘌呤逐渐向汤中转移,使得肉中嘌呤逐渐减少,汤中嘌呤含量逐渐上升,在水煮过程中,肉中约60%~70%的嘌呤会转移到汤中,但肉和汤中总嘌呤含量基本保持不变。LI等[47]在研究水煮过程中海水鱼的嘌呤含量的变化也发现通过水煮能将嘌呤从鱼肉转移到鱼汤中,降低了鱼肉的嘌呤含量。综上,肉经过水煮后弃掉汤汁可以减少嘌呤的摄入。
除了高嘌呤食物会给消费者带来健康危害外,食物中的尿酸也会影响人体的血尿酸水平,故研究人员除了想法设法脱除肉类中嘌呤物质外,还开展了脱除食物中尿酸的研究。ZHANG等[48]报道了一种新型的高活性碱性尿酸氧化酶(uricase,UOX),并对其在碱性条件下降低食物中尿酸含量的应用进行了论证。从腺虫中克隆了UOX基因,并在大肠杆菌中进行了表达(rUOX)。rUOX在40 ℃和pH为10时活性最强,在pH为9~11的碱性条件下,rUOX的初始活性保持在90%以上;在55 ℃以下,rUOX的初始活性保持在80%以上。0.045 U/mL rUOX在30 ℃,pH为10的条件下与啤酒、牛肉和酵母提取物反应5 h后,与不加rUOX的对照组相比,啤酒和牛肉尿酸浓度分别从15.49 μmol/L、8.53 μmol/L下降至0 μmol/L,酵母提取物尿酸浓度从75.07 μmol/L下降至11.73 μmol/L,除此之外,实验组啤酒、牛肉和酵母提取物总嘌呤含量分别下降了62%、47%、26%。
4.4 降嘌呤处理对产品品质的影响
肉类嘌呤的降低主要通过嘌呤的转移来实现[18]。通过切块、清洗、搅打成糜、超声波辅助等非热加工方式一定程度破坏组织结构,使更多嘌呤溶解在溶剂中,从而降低嘌呤含量。通过水煮、清蒸、油炸等热加工处理通过热萃取作用加快嘌呤转移至溶剂的速度。以上处理均会影响产品质地、色泽,造成营养成分、鲜味物质的损失。其中典型的具有嘌呤杂环芳烃结构呈鲜味核苷酸有5′-肌苷酸(5′-inosine monophosphate,IMP)和5′-鸟苷酸(5′-guanosine monophosphate,GMP),通常肉类中主要呈味物质是IMP[49]。杜超[50]发现随着炖煮次数的增加,鸡汤核苷酸及其降解产物先逐渐升高,炖煮15次后趋于稳定;随着炖煮次数增加,鸡肉核苷酸及其降解产物的含量总体呈现逐渐降低室温趋势,炖煮10次后趋于稳定。结果表明,嘌呤类物质逐渐由肉转移至肉汤中,与此同时肉中的鲜味物质也会转移至汤汁中,从而降低肉本身所具有的鲜味物质。
5 展望
肉类食品是一类营养丰富、深受消费者喜爱的食品,其较高嘌呤的含量,使很多痛风病人望而却步。目前肉类嘌呤研究有以下几个问题:(1)缺乏稳定、规范嘌呤的检测方法;(2)肉类嘌呤含量受到生长环境、年龄、性别等因素影响,使得出的数据不够全面和准确;(3)目前对嘌呤研究主要集中在不同种类肉品嘌呤含量的检测,对不同方法对嘌呤脱除效果的相关研究较少,且目前肉类嘌呤脱除效果研究还停留在实验室等小范围内﹐市场上缺乏低嘌呤肉类产品,不能满足广大痛风病人的需求;(4)对于低嘌呤肉类食品,如何在降低嘌呤含量的同时,兼顾产品口味、色泽、质地、营养价值以及保质期,需要进一步研究。
未来对低嘌呤产品的开发﹐可以将多种嘌呤去除方法联合起来,亦可将植物类嘌呤脱除方法借鉴到肉类嘌呤脱除中,探究其对肉类嘌呤含量脱除效果的影响,也可以利用基因工程定向表达可以降低嘌呤含量的酶或从自然界筛选能够降低嘌呤微生物,谨慎评估其安全性。相信随着新的技术、方法在肉类嘌呤研究的不断推进,越来越多的低嘌呤肉类产品将会被开发出来,满足受痛风困扰消费者的营养需求。
[1] 林洪, 曲欣.食品中嘌呤含量分布的研究进展[J].食品安全质量检测学报, 2012, 3(5):373-378.
LIN H, QU X.The research progress of purine distribution in food[J].Journal of Food Safety and Quality, 2012, 3(5):373-378.
[2] DÖLLE C, RACK J G M, ZIEGLER M.NAD and ADP-ribose metabolism in mitochondria[J].The FEBS Journal, 2013, 280(15):3 530-3 541.
[3] MAIUOLO J, OPPEDISANO F, GRATTERI S, et al.Regulation of uric acid metabolism and excretion[J].International Journal of Cardiology, 2016, 213:8-14.
[4] 于康, 李融融, 李春微, 等.WS/T 560—2017,高尿酸血症与痛风患者膳食指导 [M].北京:国家标准出版社, 2017.
YU K, LI R R, LI C W, et al.WS/T 560—2017,Dietary Guide for Hyperuricemia and Gout Patients[M].Beijing:National Standards Publishing House, 2017.
[5] AIHEMAITIJIANG S, ZHANG Y Q, ZHANG L, et al.The association between purine-rich food intake and hyperuricemia:A cross-sectional study in Chinese adult residents[J].Nutrients, 2020, 12(12):3 835.
[6] 宋洁, 刘晓飞, 王薇, 等.大豆嘌呤的研究进展[J].食品工业, 2019, 40(1):295-298.
SONG J, LIU X F, WANG W, et al.Research progress of soybean purine[J].The Food Industry, 2019, 40(1):295-298.
[7] 曲欣. 水产品中嘌呤含量分布及其在贮藏加工中变化规律的研究[D].青岛:中国海洋大学, 2013.
QU X.Study on the contents and change rules during storage and processing of purines in aquatic foods[D].Qingdao:Ocean University of China, 2013.
[8] 蔡路昀, 张滋慧, 曹爱玲, 等.食品中的嘌呤含量分布及在贮藏加工中变化研究进展[J].食品科学, 2018, 39(19):260-265.
CAI L Y, ZHANG Z H, CAO A L, et al.Advances in research on purine distribution in foods and its changes during storage and processing[J].Food Science, 2018, 39(19):260-265.
[9] 荣胜忠, 邹立娜, 崔新宇, 等.中国居民膳食嘌呤摄入量评估[J].营养学报, 2015, 37(3):226-228;234.
RONG S Z, ZOU L N, CUI X Y, et al.Assessment of dietary purine intake in Chinese residents[J].Acta Nutrimenta Sinica, 2015, 37(3):226-228;234.
[10] MAJOR T J, TOPLESS R K, DALBETH N, et al.Evaluation of the diet wide contribution to serum urate levels:Meta-analysis of population based cohorts[J].BMJ (Clinical Research Ed.), 2018, 363:k3951.
[11] 徐李华. 食品中嘌呤含量与高尿酸血症关系的研究进展[J].中国城乡企业卫生, 2020, 35(1):26-28.
XU L H.Research progress on the association between purine content in food and hyperuricemia[J].Chinese Journal of Urban and Rural Enterprise Hygiene, 2020, 35(1):26-28.
[12] 王新宴, 凌云, 储晓刚, 等.肉制品中四种嘌呤含量在水煮过程中的变化[J].食品科学, 2008, 29(7):67-69.
WANG X Y, LING Y, CHU X G,et al.Effects of boil processing on content of four kinds of purines in meat products [J].Food Science, 2008, 29(7):67-69.
[13] 骆婕怡, 汪薇, 自卫东, 等.猪肉汤中嘌呤含量的研究[C].广东省食品学会年会论文集.广州:广东省食品学会,2013:82-85.
LUO J Y, WANG W, ZI W D,et.al.Change of purines content in pork broth[C].Proceedings of the annual meeting of Guangdong food society.Guangzhou:Guangdong food society,2013:82-85
[14] 冯晓晶. 嘌呤及其代谢产物尿酸检测方法研究和应用[D].太原:山西医科大学, 2011.
FENG X J.Methods study for determination and application of purine and uric acid part Ⅰ methods study for determination of total amount of purine in food by diazotization-xanthine oxidase-HPLC[D].Taiyuan:Shanxi Medical University, 2011.
[15] 李婷婷, 任丽琨, 王当丰, 等.食品中嘌呤含量分布及其高效液相色谱检测研究进展[J].现代食品科技, 2018, 34(5):257-266.
LI T T, REN L K, WANG D F, et al.Purine content distribution in foods and purine determination by HPLC:A review[J].Modern Food Science and Technology, 2018, 34(5):257-266.
[16] LOU S N, CHEN H H, HSU P Y, et al.Changes in purine content of tilapia surimi products during processing[J].Fisheries Science, 2005, 71(4):889-895.
[17] FAN H, YANG F Q, LI S P.Determination of purine and pyrimidine bases in natural and cultured Cordyceps using optimum acid hydrolysis followed by high performance liquid chromatography[J].Journal of Pharmaceutical and Biomedical Analysis, 2007, 45(1):141-144.
[18] 张静. 常见食品中嘌呤类组分及其在加工贮藏中的变化规律研究[D].杭州:浙江工业大学, 2020.
ZHANG J.Study on purine components in common foods and the change rule during storage and processing[D].Hangzhou:Zhejiang University of Technology, 2020.
[19] 任丽琨. 基于HPLC的嘌呤碱基检测方法的建立及海水鱼嘌呤脱除探究[D].锦州:渤海大学, 2019.
REN L K.Study on the detection and removal of purine bases in marine fishes based on HPLC [D].Jinzhou:Bohai University, 2019.
[20] 张滋慧. 水产品中嘌呤含量的测定及脱嘌呤方法研究[D].锦州:渤海大学, 2019.
ZHANG Z H.Study on the purine content of aquatic products and purine removing method [D].Jinzhou:Bohai University, 2019.
[21] 杨海斌. 各种肉类食物中嘌呤类物质的检测[D].太原:山西医科大学, 2012.
YANG H B.Detection of purine substances in various meat foods[D].Taiyuan:Shanxi Medical University, 2012.
[22] 王静莹. 青海特色肉类中尿酸和嘌呤快速检测技术研究[D].西宁:青海师范大学, 2018.
WANG J Y.Study on rapid detection technology of uric acid and purine in meat of Qinghai [D].Xining:Qinghai Normal University, 2018.
[23] 吕兵兵. 不同储藏条件及烹制方法对带鱼嘌呤含量的影响研究[D].杭州:浙江大学, 2013.
LYU B B.Effctes of preserving and cooking on the content of purine in Trichiurus haumela[D].Hangzhou:Zhejiang University, 2013.
[24] 方妍, 谢定源, 丁璐, 等.优化高效液相色谱法测定鸡肉及鸡汤中嘌呤含量[J].中国调味品, 2020, 45(12):115-123.
FANG Y, XIE D Y, DING L,et al.Optimization of high performance liquid chromatography for detecting purine content in chicken and chicken soup [J].China Condiment, 2020, 45(12):115-123.
[25] 李婷婷, 任丽琨, 王当丰, 等.大蒜粉处理对海鲈鱼嘌呤含量的影响[J].中国食品学报, 2020, 20(11):107-114.
LI T T, REN L K, WANG D F, et al.Effect of garlic powder on purine content in Perca fluviatilis[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(11):107-114.
[26] TAKAYANAGI F, FUKUUCHI T, YAMAOKA N, et al.Measurement of the total purine contents and free nucleosides, nucleotides, and purine bases composition in Japanese anchovies (Engraulis japonicus) using high-performance liquid chromatography with UV detection[J].Nucleosides, Nucleotides & Nucleic Acids, 2020, 39(10-12):1 458-1 464.
[27] LI T T, REN L K, WANG D F, et al.Effect of allicin and its mechanism of action in purine removal in turbot[J].Journal of Food Science, 2020, 85(10):3 562-3 569.
[28] RONG S Z, ZOU L N, ZHANG Y N, et al.Determination of purine contents in different parts of pork and beef by high performance liquid chromatography[J].Food Chemistry, 2015, 170:303-307.
[29] KANEKO K, TAKAYANAGI F, FUKUUCHI T, et al.Determination of total purine and purine base content of 80 food products to aid nutritional therapy for gout and hyperuricemia[J].Nucleosides, Nucleotides & Nucleic Acids, 2020, 39(10-12):1 449-1 457.
[30] SABOLOV M, KULMA M,
M, KULMA M, ![]() L.Sex-dependent differences in purine and uric acid contents of selected edible insects[J].Journal of Food Composition and Analysis, 2021, 96:103746.
L.Sex-dependent differences in purine and uric acid contents of selected edible insects[J].Journal of Food Composition and Analysis, 2021, 96:103746.
[31] 杨海斌, 张加玲, 刘桂英, 等.鸡鸭不同组织脏器中嘌呤和尿酸的含量及其分布研究[J].营养学报, 2013, 35(5):505-507.
YANG H B, ZHANG J L, LIU G Y, et al.Study on the contents and distribution of purines and uric acid in different tissues of chickens and ducks[J].Acta Nutrimenta Sinica, 2013, 35(5):505-507.
[32] QU X, SUI J X, MI N S, et al.Determination of four different purines and their content change in seafood by high-performance liquid chromatography[J].Journal of the Science of Food and Agriculture, 2017, 97(2):520-525.
[33] 凌云, 王新宴, 雍炜, 等.高效液相色谱法检测肉类食品中4种嘌呤碱[J].分析化学, 2008, 36(6):724-728.
LING Y, WANG X Y YONG W, et al.Deteminaton of four purines in meat by high performance liquid chromatography[J].Chinese Journal of Analytical Chemistry, 2008, 36(6):724-728.
[34] 程庆红. 海鲜食品中嘌呤类物质的提取与测定[D].长春:吉林大学, 2008.
CHENG Q H.Extraction and determination of purines in seafood [D].Changchun:Jilin University, 2008.
[35] MARKELJ J, ![]() T, PIHLAR B.Optimization of high performance liquid chromatography method for simultaneous determination of some purine and pyrimidine bases[J].Acta Chimica Slovenica, 2016, 63(1):8-17.
T, PIHLAR B.Optimization of high performance liquid chromatography method for simultaneous determination of some purine and pyrimidine bases[J].Acta Chimica Slovenica, 2016, 63(1):8-17.
[36] GUO X Y, WANG X Y, HUANG D W, et al.Method study on determination of total purine content in fish meat by diazotization reaction combined with SERS[J].LWT 2020, 123:109027.
[37] ZHANG Y Q, CHEN C, CHOI H, et al.Purine-rich foods intake and recurrent gout attacks[J].Annals of the Rheumatic Diseases, 2012, 71(9):1 448-1 453.
[38] 潘洪志, 荣胜忠, 邹立娜, 等.中国常见动物性食品中嘌呤的含量[J].营养学报, 2012, 34(1):74-78.
PAN H Z, RONG S Z, ZOU L N, et al.The contents of purine in common animal foods in China [J].Acta Nutrimenta Sinica, 2012, 34(1):74-78.
[39] ZHENG M, HUANG Y Z, JI J X, et al.Effects of breeds, tissues and genders on purine contents in pork and the relationships between purine content and other meat quality traits[J].Meat Science, 2018, 143:81-86.
[40] KANEKO K, AOYAGI Y, FUKUUCHI T, et al.Total purine and purine base content of common foodstuffs for facilitating nutritional therapy for gout and hyperuricemia[J].Biological & Pharmaceutical Bulletin, 2014, 37(5):709-721.
[41] 左俊英. 菌菇火锅底汤熬煮过程营养及安全性研究[D].扬州:扬州大学, 2013.
ZUO J Y.Study on nutrition and safety of mushroom hot pot soup during boiling[D].Yangzhou:Yangzhou University, 2013.
[42] 荣胜忠, 邹立娜, 王国栋, 等.涮火锅过程中肉、虾和汤中嘌呤含量变化研究[J].卫生研究, 2012, 41(6):1 014- 1016.
RONG S Z, ZOU L N, WANG G D, et al.Changes of purine content in meat, shrimp and soup during hot pot rinsing[J].Journal of Hygiene Research, 2012, 41(6):1 014-1 016.
[43] 刘建林, 孙学颖, 李敬超, 等.不同发酵剂对发酵羊肉干中嘌呤形成的影响[J].食品科技, 2020, 45(6):116-121.
LIU J L, SUN X Y, LI J C, et al.Inhibition of starter cultures on purine formation in mutton jerky[J].Food Science and Technology, 2020, 45(6):116-121.
[44] TAKAYANAGI F, FUKUUCHI T, YAMAOKA N, et al.The observed variation in the purine composition of food after soaking in sake lees[J].Nucleosides, Nucleotides & Nucleic Acids, 2018, 37(6):348-352.
[45] ZHANG Y F, WANG G, JIN Y F, et al.Effects of high hydrostatic pressure processing on purine, taurine, cholesterol, antioxidant micronutrients and antioxidant activity of squid (Todarodes pacificus) muscles[J].Food Control, 2016, 60:189-195.
[46] 孙宏, 李婷婷, 宋敏杰, 等.预制调理低嘌呤大菱鲆鱼片的制备及品质研究[J].食品工业科技, 2021, 42(2):58-62;69.
SUN H, LI T T,SONG M J, et al.Preparation and quality of pre-conditioned low purine turbot fillet[J].Science and Technology of Food Industry, 2021, 42(2):58-62;69.
[47] LI T T, REN L K, WANG D F, et al.Optimization of extraction conditions and determination of purine content in marine fish during boiling[J].PeerJ, 2019, 7:e6690.
[48] ZHANG R, GAO S J, ZHU C Y, et al.Characterization of a novel alkaline Arxula adeninivorans urate oxidase expressed in Escherichia coli and its application in reducing uric acid content of food[J].Food Chemistry, 2019, 293:254-262.
[49] 李学鹏, 谢晓霞, 朱文慧, 等.食品中鲜味物质及鲜味肽的研究进展[J].食品工业科技, 2018, 39(22):319-327.
LI X P, XIE X X, ZHU W H, et al.Research progress of umami substances and umami peptides in food[J].Science and Technology of Food Industry, 2018, 39(22):319-327.
[50] 杜超. 反复炖煮对鸡肉和鸡汤风味品质的影响[D].锦州:渤海大学, 2020.
DU C.Effect of repeated stewing on the flavor formation of chicken and chicken broth[D].Jinzhou:Bohai University, 2020.