全球社会风险之一便是由粮食危机引起的大面积饥饿致死问题和营养不良现象,食品工业在提供食品和食物营养方面起着至关重要的作用[1]。因此,食品工业需要开发更高效、可持续的食品生产流程,减少对原料的浪费,同时还需要保证更高质量的食品质量。目前食品工业包括发酵、生物转化和下游加工等多种加工技术[2-3],这些过程通常自动化程度高,可通过实时监测生化反应产物来保证食品质量。通过气相色谱法、液相色谱串联质谱法及近红外光谱分析技术等可对食品生产加工过程进行监测,但这些分析方法设备昂贵,检测步骤繁琐,操作要求较高,无法在工业中大规模使用。此外,复杂化合物质的检测需要更具选择性和特异性的分析方法[3]。在此基础下,生物传感器脱颖而出。生物传感器具有器型小巧、灵敏高效、操作简单以及特异性强等特点,是进行食品生产加工过程的监控和产品质量检测以及成分鉴定的一种既高效又经济实惠的方式。
此外,食品加工过程中不可避免的会伴有食品污染,根据食品中有害物质的特性进行检测,是保证食品安全的有效方法。食品检验检疫方法一般分为物理学检测技术和生物学检测技术,前者通常采用仪器进行检验,设备造价一般比较昂贵。生物传感器虽然被分类为生物学检测技术,但生物传感器涉及生物工程和其他技术,其中电化学生物传感器更是直接将物理技术与生物技术相结合,具有物理学的高灵敏性、高准确率和生物学的特异选择性。鉴于电化学生物传感器在食品生产过程中的实用性,本文讨论基于酶的电化学生物传感器的基本原理及其在食品行业中的应用,并介绍相关最新研究进展,为电化学生物传感器在食品中的进一步应用提供参考。
1 电化学生物传感器
根据国际理论与应用化学联合会对生物传感器的定义,即利用目标分析物质与酶、免疫制剂、组织、细胞器或全细胞等生物识别元件的特异性生化反应,借助传感器将生化反应转换为电、热、光等各种信号对目标分析物质进行检测的一类装置[4],是一种“自给自足”的集成设备,根据生物传感器的作用机理,将其分为三类:生物催化基团(酶)、生物亲和性基团(抗体、核酸)和微生物基团(微生物)。酶生物传感器是基于酶的固定化技术发展而来,酶的固定方法主要包括物理吸附、共价结合、包埋和交联。酶生物传感器是间接性传感器,由固定化酶和信号转换器组成,通过测量在底物消耗或酶反应产物形成过程中发生的质子浓度(H+)、气体(如CO2、NH3、O2等)的释放或吸收、光吸收或反射、热辐射等变化来检测特定分析物的存在,然后传感器将这些变化转换成可测量的信号(电、光或热信号)[5-6],通过这些信号间接地测量待测分析物,其中葡萄糖传感器就是典型的酶生物传感器(图1)[7]。
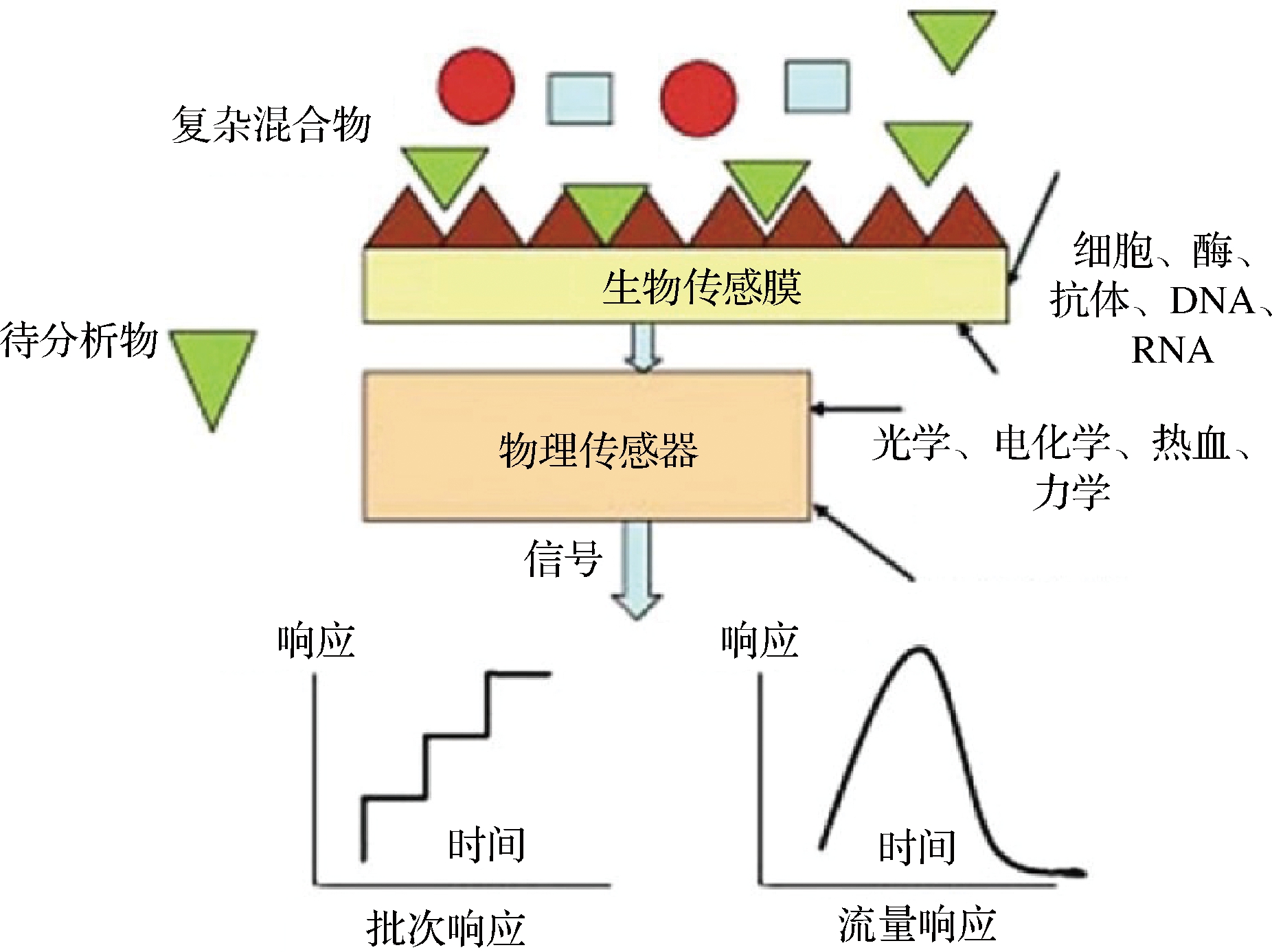
图1 一种典型生物传感器的示意图[7]
Fig.1 Schematic diagram of a typical biosensor[7]
电化学生物传感器具有灵敏度高、结构简单、易于操作和成本低廉等特点,即使是小型仪器也可以提供非常稳定的电压/电流源和检测信号[8]。在电化学生物传感器中因分析物存在于电极表面、由分析物直接形成电活性物质以及通过将生物识别反应与氧化还原探针或介导酶电极耦合而间接产生的电流、电压、电阻或表面电荷[5, 9],都是电化学信号,最常见的传感器类型有电流法、电导法、电位法和阻抗法。其中电化学阻抗谱(electrochemical impedance spectroscopy,EIS)是一种在特定系统参数下检测电极表面分析物相互作用的方法[10],基于EIS生物传感器的研究集中在设计适体传感器和免疫传感器中[11],因此在此文中不做讨论。通过酶催化底物发生氧化还原反应产生的电子传递可以增强电化学信号,并显著提高电化学生物传感器的灵敏度。
2 电流生物传感器在食品检测中的应用
在电流生物传感器中,被测信号是由工作电极上的电活性物质(如金、碳、铂等)通过氧化还原反应产生的电流信号[9],工作电极表面产生的电流大小与待测分析物浓度呈正比,通过连续监测电流大小对待测物进行定量分析,电流生物传感器多以酶为识别元件。通常,恒定电位下测量电流称为安培法;电位在受控变化期间测量电流则称为伏安法,安培法较伏安法灵敏度更高。根据用于测量生化反应的电子转移方法,基于酶的电流生物传感器现已开发三代[12-13],如图2所示[14]。第一代酶电极依赖于O2和H2O2的反应变化来转移电子。第一代酶电极对O2呈现极高的依赖性,为消除这种对氧的依赖产生的消极影响,第二代酶电极将人造电子介体(小分子氧化还原活性分子)引入酶电极中作为酶的活性中心与电极表面间的桥梁。目前,二代酶生物传感器研究发展较为成熟,是常采用的酶生物传感器。第三代酶电极基于酶活性中心到电极的直接电子转移,这种生物传感器的稳定性和电子转移速率显著提高。
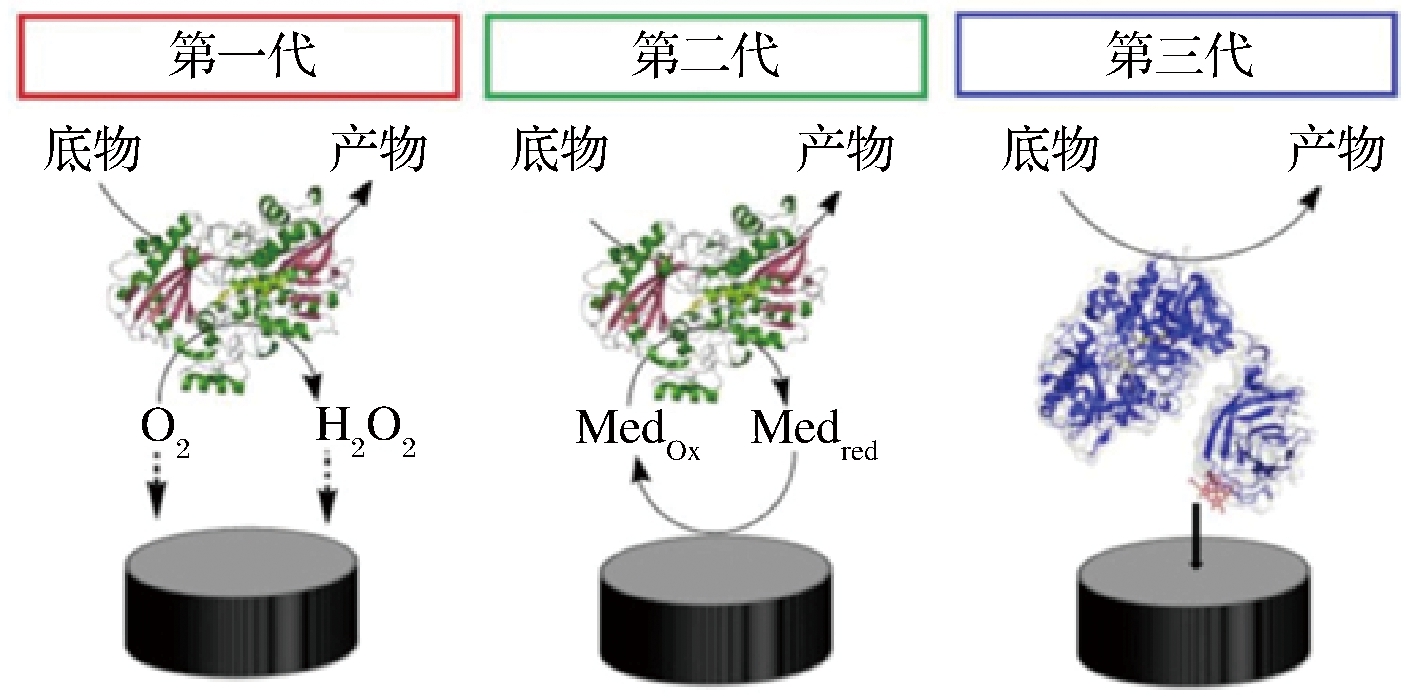
图2 第一代、第二代和第三代电流型酶生物传感器示意图[14]
Fig.2 Schematic illustration of first-, second-, and third-generation amperometric enzymatic biosensors[14]
注:Medox为氧化态人造电子介质;Medred为还原态人造电子介质
2.1 在葡萄糖检测中的应用
葡萄糖氧化酶(glucose oxidase,GOx)是一种广为人知的酶,食品工业中常将GOx固定在传感器上设计成生物传感器用于测定果汁或白酒发酵中的葡萄糖[12, 15]。在葡萄糖生物传感器中,固定GOx的材料及其在电极表面的组装机制对酶电极的性能有很大的影响。GONG等[16]采用亲和吸附法将GOx固定在纤维素修饰电极上,此方法可以最大限度地保持GOx活性。该葡萄糖生物传感器具有电流变化快(t<5 s)、重现性好(相对标准偏差<5%)、底物选择性好、稳定性好等特点,该生物传感器在1.25~40 mmol/L对葡萄糖的电流信号响应呈线性关系,且2个月后仍能保持约80%的电流响应。另有研究以阿魏酸为单体,直接掺入GOx为生物识别元件,用牛血清白蛋白作为酶稳定剂,利用电聚合法合成新型阿魏酸膜,设计一种新型电流型葡萄糖生物传感器,该葡萄糖生物传感器表现出更广泛(0.082~34 mmol/L)的葡萄糖浓度线性响应[17]。该传感器的灵敏度为1.1 μA mmol/(L·cm2),检测下限为0.025 mmol/L,葡萄糖浓度定量下限为0.082 mmol/L。J![]() DRZAK等[18]利用无创背散射技术成功将二氧化硅/木质素(SiO2/Lig)杂化材料与其他材料连接起来作为固定GOx的载体,通过表面吸附将GOx-SiO2/Lig体系与单笔碳纳米管/铂纳米颗粒载体结合,制备出第一代葡萄糖生物传感器。该团队还对以二茂铁为介体的GOx-SiO2/Lig基碳糊电极为第二代葡萄糖生物传感器的活性物质的效果作出评价。结果显示使用该载体的生物传感器的葡萄糖传感灵敏度为0.78 μA mmol/L,线性响应范围为0.5~9 mmol/L,检测下限为145 μmol/L,为葡萄糖的测定提供了良好的电化学参数。
DRZAK等[18]利用无创背散射技术成功将二氧化硅/木质素(SiO2/Lig)杂化材料与其他材料连接起来作为固定GOx的载体,通过表面吸附将GOx-SiO2/Lig体系与单笔碳纳米管/铂纳米颗粒载体结合,制备出第一代葡萄糖生物传感器。该团队还对以二茂铁为介体的GOx-SiO2/Lig基碳糊电极为第二代葡萄糖生物传感器的活性物质的效果作出评价。结果显示使用该载体的生物传感器的葡萄糖传感灵敏度为0.78 μA mmol/L,线性响应范围为0.5~9 mmol/L,检测下限为145 μmol/L,为葡萄糖的测定提供了良好的电化学参数。
2.2 在维生素检测中的应用
维生素是人体维持正常生理功能所必需的微量元素,且只能从食物中获取,因此维生素含量是某些食品的营养指标之一。目前,利用电流传感器定量检测维生素的方法有限,仅有以酿酒酵母为载体的全细胞生物传感器、利用含硫化合物的电催化丝网印刷电流传感器和以秋葵为原料质保的纳米碳为识别元件的生物传感器3种[19-21],都为非酶电化学生物传感器。KAÇAR等[22]结合磁性纳米材料和聚合物的优点,将抗坏血酸氧化酶(ascorbate oxidase,AOx)固定在聚L-天冬氨酸[poly-L-aspartic acid,P(L-Asp)]膜上,并用碳纳米纤维(carbon nanofiber,CNF)和纳米金刚石颗粒(nanodiamond,ND)修饰玻碳电极(glassy carbon electrode,GCE),设计出电流型L-抗坏血酸生物传感器,优化L-Asp在CNF-ND/GCE表面的电聚合步骤(图3),使该生物传感器对L-抗坏血酸的定量测定更加准确可靠。在优化条件下,AOx/P(L-Asp)/ND-CNF/GCE生物传感器对L-抗坏血酸的检测线性范围为2.0×10-7~1.8×10-3 mol/L,检测下限为1.0×10-7 mol/L,灵敏度为105 μA mmol/(L·cm2),该生物传感器已应用于维生素C泡腾片和含抗坏血酸药粉中L-抗坏血酸的测定,并获得较好的检测结果。

图3 AOx/P(L-Asp)/Nd-CNF/GCE的制备工艺[22]
Fig.3 The fabrication process of AOx/P(L-Asp)/ND-CNF/GCE[22]
2.3 在酪胺检测中的应用
研究表明适量的酪胺可促进新陈代谢,但过量的酪胺可引起心力衰竭、哮喘和荨麻疹等健康问题,因此监控食品加工过程中酪胺的含量非常重要。采用酪氨酸酶(tyrosinase,Ty)电流型生物传感器检测乳制品和发酵饮料中的酪胺含量是一种高效、简便的分析方法。研究人员以柑橘提取物为还原剂和稳定剂合成纳米金颗粒(gold nanoparticles,AuNP),以AuNP作为介体与聚8-苯胺基-1-萘磺酸一起修饰玻碳电极,将Ty固定在玻碳电极上[23]。在优化后的条件下,该生物传感器在10~120 μmol/L与酪胺含量呈线性关系,检测下限为0.71 μmol/L,具有良好的选择性、长期稳定性和重现性,已成功应用于乳制品和发酵饮料中酪氨酸的测定。对于干酪样品中酪胺含量的测定,S NCHEZ-PANIAGUA等[24]将Ty固定在磷酸钙材料上,然后与戊二醛交联,制备一种酪胺检测的电化学生物传感器,并检测在整个贮藏期内干酪中酪胺含量的变化,其中高达干酪和布里干酪的平均分析回收率分别为(95.5±5.8)%和(96.9±7.5)%,响应时间为6 s。酱油发酵过程中也易产生酪胺,有研究阐述一种新型电流型酪胺生物传感器用于酱油样品中酪胺含量的检测[25]。该生物传感器将Ty固定在CNFs、壳聚糖(chitosan,CH)、离子液体1-丁基-3-甲基咪唑四氟硼酸盐(1-butyl-3-methylimidazolium tetrafluoroborate,IL)和AuNP复合膜修饰的玻碳电极上,由于CNFs、AuNP和离子液体的协同作用,Ty/AuNP/CNFS-IL-CH/GCE生物传感器为酪胺检测提供了一种准确、高灵敏度和选择性的酪胺分析方法。该方法的线性工作范围为2.0×10-7~4.8×10-5 mol/L,灵敏度为176.6 μA mmol/L,检出下限为9.3×10-8 mol/L。
NCHEZ-PANIAGUA等[24]将Ty固定在磷酸钙材料上,然后与戊二醛交联,制备一种酪胺检测的电化学生物传感器,并检测在整个贮藏期内干酪中酪胺含量的变化,其中高达干酪和布里干酪的平均分析回收率分别为(95.5±5.8)%和(96.9±7.5)%,响应时间为6 s。酱油发酵过程中也易产生酪胺,有研究阐述一种新型电流型酪胺生物传感器用于酱油样品中酪胺含量的检测[25]。该生物传感器将Ty固定在CNFs、壳聚糖(chitosan,CH)、离子液体1-丁基-3-甲基咪唑四氟硼酸盐(1-butyl-3-methylimidazolium tetrafluoroborate,IL)和AuNP复合膜修饰的玻碳电极上,由于CNFs、AuNP和离子液体的协同作用,Ty/AuNP/CNFS-IL-CH/GCE生物传感器为酪胺检测提供了一种准确、高灵敏度和选择性的酪胺分析方法。该方法的线性工作范围为2.0×10-7~4.8×10-5 mol/L,灵敏度为176.6 μA mmol/L,检出下限为9.3×10-8 mol/L。
2.4 在双酚A检测中的应用
双酚A(bisphenol A,BPA)是一种内分泌干扰物质,常被用作食品和饮料罐内侧涂层,还具有致癌的危害。对BPA的快速检测,WU等[26]将可聚合的丙烯酰化基团附着在Ty的表面(图4,I),而Ty分子通过原位聚合(即aTyr)生成聚合物外壳,首次成功制备了具有单一酶分子核和薄聚合物网壳的酪氨酸酶纳米胶囊(即nTyr),并用制备的nTyr代替传统的天然酪氨酸酶为生物识别元件,构建一种新型电化学纳米生物传感器(图4,Ⅲ),该电化学生物传感器可保持天然Ty原有活性,检测下限为12 nmol/L,线性范围为5×10-8~2×10-6 mol/L。作用于酚类物质,漆酶的氧化还原酶结构较Ty更稳定,FERNANDES等[27]选择将还原的石墨烯氧化物/氧化亚铁纳米颗粒(rGO-Fe3O4 NPs)的杂化偶合物与CH和漆酶组装成多层超结构制成电化学生物传感器。其中CH良好的生物相容性有望提高漆酶的稳定性,而rGO-Fe3O4 NPs的协同效应将改善漆酶的电子转移过程,该生物传感器在广泛的BPA浓度范围内(6×10-1~228×10-1 mol/L)提供线性响应,具有高灵敏度[2 080 μA μmol/(L·cm2)]、高检出限(18 nmol/L),用于瓶装水的实际样品结果证明该法可行,回收率为107%~124%。
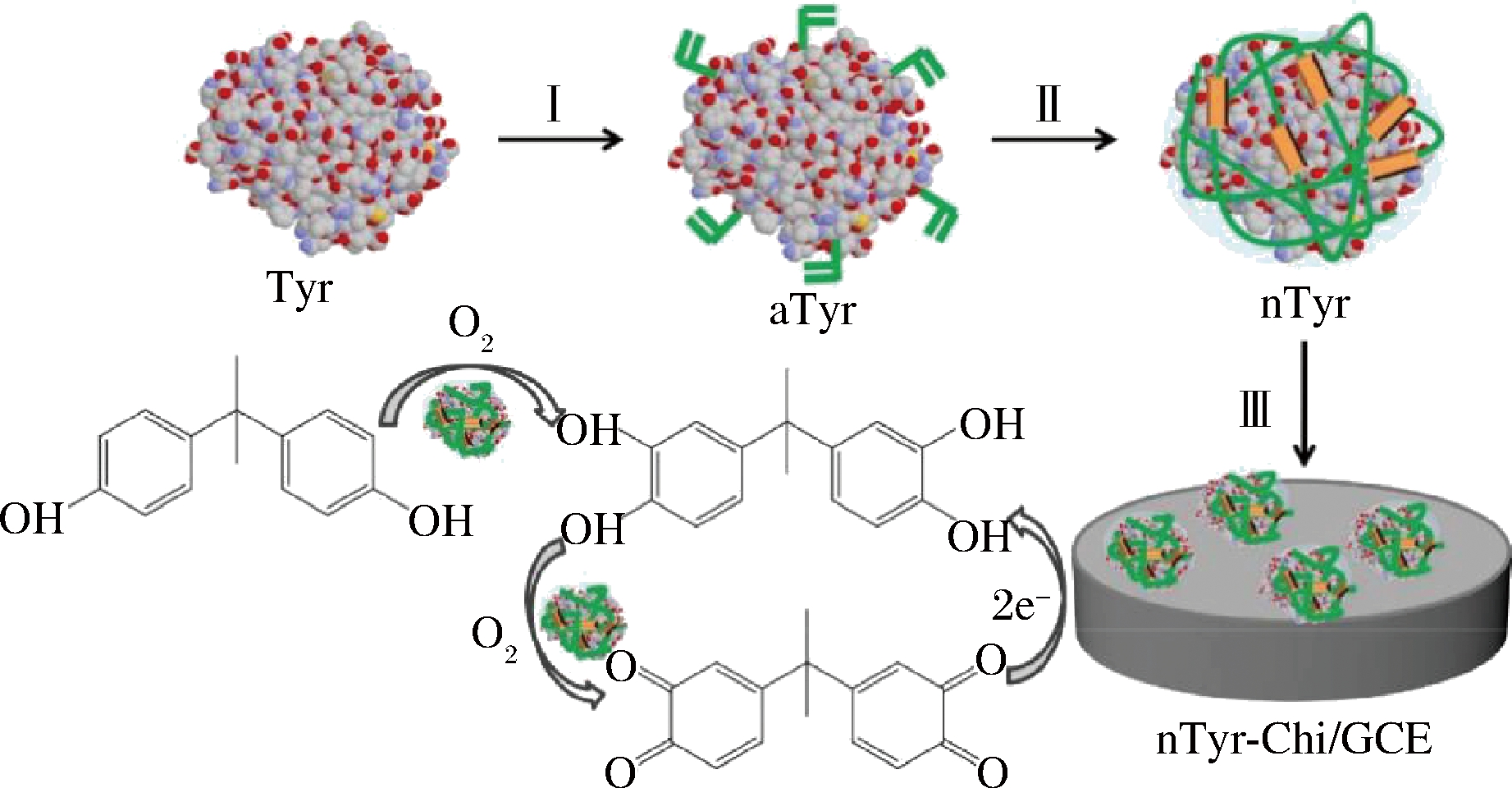
图4 用于双酚A检测的nTyr和基于nTyr的生物传感器的构造图解[26]
Fig.4 Illustration for the construction of nTyr and nTyr-based biosensor for BPA detection[26]
2.5 在L-谷氨酸检测中的应用
L-谷氨酸(L-glutamic acid,L-Glu)常作为风味增强剂用于食品中,但其安全性仍存在争议,因此对L-Glu快速且准确的监测是一个重要问题。MENTANA等[28]在低成本的商用一次性丝网印刷铂电极上研制一种高精度的第一代L-Glu生物传感器,用于监测食品中L-Glu的含量,保证食品安全。他们通过牛血清白蛋白与戊二醛交联,将谷氨酸氧化酶固定在丝网印刷的一次性铂电极上,并用过氧化聚吡咯膜进行修饰,制备出谷氨酸氧化酶(L-glutamate oxidase,GLOD)生物传感器,通过测量O2消耗介导的GLOD催化反应生成H2O2检测L-Glu的浓度。该生物传感器的灵敏度为18.3 mA mmol/(L·cm2),检测线性范围为0.005~1.8 mmol/L,检测下限为5.4 mmol/L,能稳定维持使用50 h,50 h后的信号强度为初始强度的25%。
2.6 在真菌毒素检测中的应用
食品从生产、运输、贮藏到食用一系列过程中都要严格防止微生物的污染,因此对致病菌以及某些真菌毒素的检测尤为重要。有研究提出了一种基于黄曲霉毒素B1(aflatoxin B1,AFB1)抑制乙酰胆碱酯酶(acetylcholinesterase,AChE)的生物传感器检测黄曲霉毒素的新方法,并以实收橄榄油样品为例对该方法的适用性进行评价[29]。D AZ NIETO等[30]采用类似方法研发了一种用依靠酶修饰电极的第三代生物传感器技术定量检测杂色曲霉毒素(sterigmatocystin,STEH),该传感器在6.9×10-9~5.0×10-7 mol/L内呈现良好线性关系,检出限为2.3×10-9 mol/L。该法利用具有宽pH范围热稳定性的大豆过氧化物酶(soybean peroxidase,SPE)和化学还原的氧化石墨烯的复合物修饰的玻碳电极。由于STEH是AFB1生物转化的前体,与AFB1的产生有关,因此可以用该生物传感器用于谷物及其衍生产品、花生、玉米等易受AFB1污染食品的检测。对添加STEH的玉米样品进行分析,平均回收率为96.5%,实验表明使用该法测定的STEH浓度与HPLC法吻合。
AZ NIETO等[30]采用类似方法研发了一种用依靠酶修饰电极的第三代生物传感器技术定量检测杂色曲霉毒素(sterigmatocystin,STEH),该传感器在6.9×10-9~5.0×10-7 mol/L内呈现良好线性关系,检出限为2.3×10-9 mol/L。该法利用具有宽pH范围热稳定性的大豆过氧化物酶(soybean peroxidase,SPE)和化学还原的氧化石墨烯的复合物修饰的玻碳电极。由于STEH是AFB1生物转化的前体,与AFB1的产生有关,因此可以用该生物传感器用于谷物及其衍生产品、花生、玉米等易受AFB1污染食品的检测。对添加STEH的玉米样品进行分析,平均回收率为96.5%,实验表明使用该法测定的STEH浓度与HPLC法吻合。
3 电导生物传感器在真菌毒素检测中的应用
酶与底物反应时的离子浓度变化会改变电解质溶液的电导率,电导型生物传感器通过在两个平行电极之间施加电位差,测量溶液的电导率[31]。将胆碱酯酶、脲酶、葡萄糖氧化酶等的抑制分析用于生物传感器中检测有毒物质是目前的常用方法。
3.1 在黄曲霉毒素检测中的应用
在所有毒性真菌毒素中,黄曲霉毒素被认为是毒性最大且对农业造成经济负担最大的一种毒素。在饱和戊二醇(glutaraldehyde,GA)蒸汽中固定AChE的电导型生物传感器,测试其对不同种类毒性物质的灵敏度,发现该生物传感器可用于识别不同种类的毒素,最适合检测黄曲AFB1(线性范围为0.02~170 μmol/L,检出限0.016 μmol/L)或待测样品中的总毒性[32]。
3.2 在棒曲霉素检测中的应用
棒曲霉毒素常存在于腐烂的蔬菜瓜果和谷物中,特别是苹果及其加工制品,高浓度的棒曲霉素具有致突变、致癌和致畸性,因此需要严控食品中棒曲霉素含量。SOLDATKIN等[33]则利用脲酶,根据棒曲霉素可以使某些酶的巯基失活从而抑制酶活性的原理,设计了一种检测棒曲霉素的脲酶电化学传感器(图5)。该电导传感器在1~50 μmol/L线性范围内获得的剩余酶活性与样品中棒曲霉素的浓度呈反比。

A-脲酶生物传感器方案;B-导电装置
图5 脲酶生物传感器方案和导电装置[33]
Fig.5 Scheme of biosensor and conductometric set-up[33]
3.3 在赭曲霉毒素A检测中的应用
赭曲霉毒素A(ochratoxin,OTA)是一种神经毒素,防止OTA污染食品是非常必要的。目前,用于OTA检测的酶电化学生物传感器基本都以辣根过氧化物酶为催化剂的H2O2氧化真菌毒素[34-35]。DRIDI等[36]开发了一款直接检测橄榄油中OTA的灵敏电导生物传感器,该生物传感器将嗜热菌蛋白酶(thermolysin,TLN)包埋在含有金纳米颗粒的聚乙烯醇/聚乙烯亚胺的基质中,并使用GA蒸气进行交联。传感器在最佳条件下(交联时间35 min、pH 7、25 ℃)对OTA的线性响应高达60 nmol/L,灵敏度为597 μS μmol/L,检测下限为1 nmol/L,此法操作简单,在分析前不需任何样品前处理,可对橄榄油样品进行快速检测。
4 电位生物传感器在食品检测中的应用
酶与底物反应时基本都涉及H+的释放或吸收,从而导致离子浓度变化,电位法便是测量平衡状态(无电流或无显著电流流动时)下工作电极和参比电极间的电位差,测量信号以对数方式反应目标分析物浓度(图6),该法可用于目标分析物的定量检测[9, 31]。电位生物传感器分为离子选择电极(ion selective electrodes,ISE)、酶场效应晶体管(enzyme field-effect transistors,EnFET)和光寻址电位传感器(light-addressable potentiometric sensors,LAPS)[5]。

图6 电位测量的工作原理[37]
Fig.6 Working schematics of the potentiometric measurement
4.1 在葡萄糖检测中的应用
许多参与酶反应的小分子都可利用酶电极进行电位传感,因此开发各种固定化酶的基质和方案的研究在不断发展。CHOU等[37]以ZnO和掺铝氧化锌(aluminum-doped zinc oxide,AZO)为敏感膜,采用丝网印刷技术和溅射系统制备了一种电位型阵列式新型葡萄糖生物传感器。在此传感器中酶反应可以导致ZnO纳米结构周围离子分布的变化,从而引起电极的电位响应。Nafion-GOx/GO/AZO/Ag传感器的线性范围为2~10 mmol/L,灵敏度为15.44 mV mmol/L,检测下限为1.89 mmol/L,响应时间为26 s,与传统葡萄糖生物传感器相比,此传感器不仅分析性能好,还具有良好的抗干扰能力和重复性。把经典金属氧化物半导体场效应晶体管的金属栅单独分离出来,再将栅极重构为插入到水溶液中的参比电极,即为离子敏感场效应晶体管(ion-sensitive field-effect transistor,ISFET),当ISFET与栅极表面的薄酶膜一起固定时,它们就组成了EnFET[5]。葡萄糖ENFET基于葡萄糖形成过程中生物膜局部pH的变化,LUO等[38]将GOx和纳米MnO2固定在ISFET栅极上制备葡萄糖ENFET。该葡萄糖生物传感器表明,敏感膜的局部pH随着葡萄糖浓度增加而显著升高。在最佳条件下,该器件在0.025~1.90 mmol/L与葡萄糖呈线性关系,扩展的动态上限为3.5 mmol/L,具有较好的重现性和稳定性。
4.2 在重金属检测中的应用
基于酶抑制原理,可以利用此类传感器间接检测重金属离子[39]。工业中大量的磷酸盐被用于洗涤剂和锅炉水的处理,因此需对食品用水磷酸盐含量进行测定。ISE通常由离子专用膜和单独或集成的参比电极组成,在电位传感器中使用ISE可将待测样品中特定离子的活度转化成可用pH/mV计测量的电位(电压)[9, 31]。基于各种金属和相关络合物,ISE可以用于磷酸盐的测定,有研究采用恒电流聚合法制备了嘌呤核苷磷酸化酶(purine nucleoside phosphorylase,PNP)和黄嘌呤氧化酶(xanthine oxidase,XOD)固定于聚吡咯薄膜,比较两种电化学(电位法和电流法)磷酸盐生物传感器的制备方法,发现尿酸和抗坏血酸的干扰不会影响两种传感器的性能[40]。电位型生物传感器可以检测到最小为20 mmol/L的磷酸盐离子,线性范围为20~200 μmol/L;电流型生物传感器检测下限为0.1 mmol/L,线性范围为0.1~1 mmol/L。
5 三种电化学生物传感器在食品检测中的应用总结
应用于食品检测中的电化学生物传感器有快速灵敏、结果准确、抗干扰能力好、稳定性好及成本低等特点,以酶为识别元件更提高了传感器的检测特异性。3种电化学生物传感器中电流型在食品中应用最广泛、发展最成熟,用于定量监测食品加工过程中风味物质含量或有害物质产生,如葡萄糖、维生素或酪胺、双酚A等,保证食品质量。也有研究以乙酰胆碱酶为识别元件设计出第三代酶电极电流传感器检测AFB1,结果与HPLC法吻合,为酶基电流传感器在食品检测中的应用提供新方向。电导型传感器利用酶抑制原理,常应用于定量检测样品中的真菌毒素,但由于复杂溶液中电导率检测难度大,该传感器适用性不强。电位法相比于电流法,电位法在选择性和稳定性方面更具优势,它不需要额外的电位,因此更适合于长期监测。电位法发展潜力巨大,但目前实际应用较少,多数用于医疗护理领域(表1)。
表1 电化学生物传感器类型比较及传感器的分析特性
Table 1 Comparison of electrochemical biosensor types and analytical characteristics of electrochemical biosensor

注:“——”表示文献中未提及
传感器类型优势劣势检测样品线性范围灵敏度检测限参考文献葡萄糖1.25~40 mmol/L466.7 μA mol/(L·cm2)0.475 mmol/L[16]葡萄糖0.082~34 mmol/L1.1 μA mol/(L·cm2)0.025 mmol/L[17]电子传递介体容易流失,葡萄糖0.5~9 mmol/L0.78 μA mmol/L145 μmol/L[18]生物传感器对底物响应迅速,电子传递介体容易流失,维生素C泡腾片2.0×10-7~1.8×10-3 mol/L105 μA mol/(L·cm2)1.0×10-7 mol/L[22]检测灵敏度高,分析更准确。影响传感器效率。乳制品、发酵饮料10~120 μmol/L———0.71 μmol/L[23]电流型干酪5.8×10-7~1.6×10-5 mol/L150 mA mol/(L·cm2)4.85×10-8 mol/L[24]酱油2.0×10-7 ~4.8×10-5 mol/L176.6 μA mol/(L·cm2)9.3×10-8 mol/L[25]食品塑料罐5×10-8~2×10-6 mol/L———12 nmol/L[26]瓶装水6×10-9~228×10-9 mol/L2 080 μA μmol/(L·cm2) 18 nmol/L[27]番茄酱、干酪0.005~1.8 mmol/L18.3 mA mmol/(L·cm2)5.4 mmol/L[28]玉米6.9×10-9~5.0×10-7 mol/L———2.3×10-9 mol/L[29]电导测量装置可用于研究在溶液在高离子浓度介质中测量微小电导率AFB10.02~170 μmol/L———0.016 μmol/L[32]电导型中造成带电物质浓度变化的酶反应。变化难度大,限制生物传感器的适用性。棒曲霉素1~50 μmol/L——————[33]橄榄油1~60 nmol/L597 μS μmol/L1 nmol/L[36]选择性和稳定性更强,且不需要额外作为一种新兴方法,在食品中葡萄糖2~10 mmol/L15.44 mV mmol/L1.89 mmol/L[37]电位型的电位,更适合于长期监测。的实际应用较少。葡萄糖0.025~1.90 mmol/L———3.5 mmol/L[38]碳酸盐溶液20~200 μmol/L———20 mmol/L[40]
6 展望
基于酶的电化学生物传感器已成熟地运用于食品加工过程监测和质量控制中对各种分析物进行定性或定量分析。与传统方法相比,该类生物传感器器型小巧、操作简单、经济实惠,还具有实时监测能力、高灵敏度和强特异性等优点。然而,基于酶的生物传感器更多应用于食品物质分析,对食源致病菌的检测常使用生物亲和性基团(适配体、抗体)作为识别元件。但仍有研究利用酶电极检测真菌毒素,为此类传感器控制食品质量安全提供新思路。目前,将电流生物传感器应用于食品行业的研究较为成熟,已经形成围绕固定化酶的载体和固定方法进行改进的系统性体系;而电导生物传感器的研究基本停留在5年前,究其原因可能是在高离子浓度介质中测量微小电导率变化难度大,限制电导测量设备用于生物传感器的适用性;电位生物传感器作为一种新兴技术,目前研究大多在理论范围内,实际应用常在医疗护理领域,对食品的应用还有待开发。虽然目前已经有大量的相关传感器的设计研究,但要将这项技术引入工业水平,还需要更为全面的研究,食品加工业环境需要更好的重现性和稳定性,所以此类传感器未来的发展需要对这些方向进行深入研究。
[1] DUONG L N K, AL-FADHLI M, JAGTAP S, et al.A review of robotics and autonomous systems in the food industry:From the supply chains perspective[J].Trends in Food Science & Technology, 2020, 106:355-364.
[2] 肖叶, 叶精勤, 阎俊, 等.生物加工技术对水产品主要过敏原的致敏性消减作用研究进展[J].食品与发酵工业, 2021, 47(6):274-279.
XIAO Y, YE J Q, YAN J,et al.The allergenicity reduction effect of bioprocessing technology on main allergens in aquatic products[J].Food and Fermentation Industries, 2021, 47(6):274-279.
[3] VILLALONGA A, S NCHEZ A, MAYOL B, et al.Electrochemical biosensors for food bioprocess monitoring [J].Current Opinion in Food Science, 2022,43:18-26.
NCHEZ A, MAYOL B, et al.Electrochemical biosensors for food bioprocess monitoring [J].Current Opinion in Food Science, 2022,43:18-26.
[4] 蒋雪松, 许林云, 卢利群, 等.生物传感器在食品污染物检测中的应用研究进展[J].食品科学, 2013,34(23):357-362.
JIANG X S, XU L Y, LU L Q, et al.Development of biosensors for the detection of containments in foodstuffs[J].Food Science, 2013, 34(23):357-362.
[5] NGUYEN H H, LEE S H, LEE U J, et al.Immobilized enzymes in biosensor applications[J].Materials (Basel, Switzerland), 2019, 12(1):121.
[6] 曹强, 肖雨诗, 孟庆一, 等.酶基生物传感器在快速检测中的研究进展[J].食品安全质量检测学报, 2019,10(20):6 902-6 908.
CAO Q, XIAO Y S, MENG Q Y, et al.Research progress of enzyme-based biosensors in rapid detection[J].Journal of Food Safety & Quality, 2019, 10(20):6 902-6 908.
[7] JUSTINO C I L, DUARTE A C, ROCHA-SANTOS T A P.Recent progress in biosensors for environmental monitoring:A review[J].Sensors (Basel, Switzerland), 2017,17(12):2 918.
[8] YANG H.Enzyme-based ultrasensitive electrochemical biosensors[J].Current Opinion in Chemical Biology, 2012,16(3-4):422-428.
[9] VIZZINI P, BRAIDOT M, VIDIC J, et al.Electrochemical and optical biosensors for the detection of Campylobacter and Listeria:An update look[J].Micromachines, 2019,10(8):500.
[10] MAGAR H S, HASSAN R Y A, MULCHANDANI A.Electrochemical impedance spectroscopy (EIS):Principles, construction, and biosensing applications[J].Sensors (Basel, Switzerland), 2021,21(19):6 578.
[11] LEVA-BUENO J, PEYMAN S A, MILLNER P A.A review on impedimetric immunosensors for pathogen and biomarker detection[J].Medical Microbiology and Immunology, 2020,209(3):343-362.
[12] KURBANOGLU S, ERKMEN C, USLU B.Frontiers in electrochemical enzyme-based biosensors for food and drug analysis[J].TrAC Trends in Analytical Chemistry, 2020,124:115809.
[13] XIE Y, LIU T, CHU Z Y, et al.Recent advances in electrochemical enzymatic biosensors based on regular nanostructured materials[J].Journal of Electroanalytical Chemistry, 2021, 893:115328.
[14] FERN NDEZ H, ARÉVALO F J, GRANERO A M, et al.Electrochemical biosensors for the determination of toxic substances related to food safety developed in south America:Mycotoxins and herbicides[J].Chemosensors, 2017,5(3):23.
NDEZ H, ARÉVALO F J, GRANERO A M, et al.Electrochemical biosensors for the determination of toxic substances related to food safety developed in south America:Mycotoxins and herbicides[J].Chemosensors, 2017,5(3):23.
[15] 廖兆民, 蔡俊, 林建国.微生物葡萄糖氧化酶的研究进展[J].食品与发酵工业, 2018,44(7):308-315.
LIAO Z M, CAI J, LIN J G.Research progress of microbial glucose oxidase[J].Food and Fermentation Industries, 2018, 44(7):308-315.
[16] GONG W L, HAN Q Y, CHEN Y R, et al.A glucose biosensor based on glucose oxidase fused to a carbohydrate binding module family 2 tag that specifically binds to the cellulose-modified electrode[J].Enzyme and Microbial Technology, 2021,150:109869.
[17] VALDÉS-RAM REZ G, GALICIA L.Biosensing membrane base on ferulic acid and glucose oxidase for an amperometric glucose biosensor[J].Molecules (Basel, Switzerland), 2021,26(12):3 757.
REZ G, GALICIA L.Biosensing membrane base on ferulic acid and glucose oxidase for an amperometric glucose biosensor[J].Molecules (Basel, Switzerland), 2021,26(12):3 757.
[18] J![]() DRZAK A,
DRZAK A, ![]() T, KLAPISZEWSKI
T, KLAPISZEWSKI  , et al.Carbon paste electrode based on functional GOx/silica-lignin system to prepare an amperometric glucose biosensor[J].Sensors and Actuators B:Chemical, 2018,256:176-185.
, et al.Carbon paste electrode based on functional GOx/silica-lignin system to prepare an amperometric glucose biosensor[J].Sensors and Actuators B:Chemical, 2018,256:176-185.
[19] AKYILMAZ E, YA A
A ![]() DINÇKAYA E.Whole cell immobilized amperometric biosensor based on Saccharomyces cerevisiae for selective determination of vitamin B1 (thiamine)[J].Analytical Biochemistry, 2006,354(1):78-84.
DINÇKAYA E.Whole cell immobilized amperometric biosensor based on Saccharomyces cerevisiae for selective determination of vitamin B1 (thiamine)[J].Analytical Biochemistry, 2006,354(1):78-84.
[20] SMART A, WESTMACOTT K L, CREW A, et al.An electrocatalytic screen-printed amperometric sensor for the selective measurement of thiamine (vitamin B1) in food supplements[J].Biosensors, 2019,9(3):98.
[21] SHA T Z, LIU J J, SUN M M, et al.Green and low-cost synthesis of nitrogen-doped graphene-like mesoporous nanosheets from the biomass waste of okara for the amperometric detection of vitamin C in real samples[J].Talanta, 2019,200:300-306.
[22] KAÇAR C, ERDEN P E.An amperometric biosensor based on poly(L-aspartic acid), nanodiamond particles, carbon nanofiber, and ascorbate oxidase-modified glassy carbon electrode for the determination of L-ascorbic acid[J].Analytical and Bioanalytical Chemistry, 2020,412(22):5 315-5 327.
[23] DA SILVA W, GHICA M E, AJAYI R F, et al.Tyrosinase based amperometric biosensor for determination of tyramine in fermented food and beverages with gold nanoparticle doped poly(8-anilino-1-naphthalene sulphonic acid) modified electrode[J].Food Chemistry, 2019,282:18-26.
[24] S NCHEZ-PANIAGUA L
NCHEZ-PANIAGUA L PEZ M, REDONDO-G
PEZ M, REDONDO-G MEZ E, L
MEZ E, L PEZ-RUIZ B.Electrochemical enzyme biosensors based on calcium phosphate materials for tyramine detection in food samples[J].Talanta, 2017,175:209-216.
PEZ-RUIZ B.Electrochemical enzyme biosensors based on calcium phosphate materials for tyramine detection in food samples[J].Talanta, 2017,175:209-216.
[25] ERDEN P E, KAÇAR SELVI C, K L
L Ç E.A novel tyramine biosensor based on carbon nanofibers, 1-butyl-3-methylimidazolium tetrafluoroborate and gold nanoparticles[J].Microchemical Journal, 2021,170:106729.
Ç E.A novel tyramine biosensor based on carbon nanofibers, 1-butyl-3-methylimidazolium tetrafluoroborate and gold nanoparticles[J].Microchemical Journal, 2021,170:106729.
[26] WU L X, LU X B, NIU K, et al.Tyrosinase nanocapsule based nano-biosensor for ultrasensitive and rapid detection of bisphenol A with excellent stability in different application scenarios[J].Biosensors and Bioelectronics, 2020,165:112407.
[27] FERNANDES P M V, CAMPI A J M, SILVA A F.A layered nanocomposite of laccase, chitosan, and Fe3O4 nanoparticles-reduced graphene oxide for the nanomolar electrochemical detection of bisphenol A[J].Mikrochimica Acta, 2020, 187(5):262.
A J M, SILVA A F.A layered nanocomposite of laccase, chitosan, and Fe3O4 nanoparticles-reduced graphene oxide for the nanomolar electrochemical detection of bisphenol A[J].Mikrochimica Acta, 2020, 187(5):262.
[28] MENTANA A, NARDIELLO D, PALERMO C, et al.Accurate glutamate monitoring in foodstuffs by a sensitive and interference-free glutamate oxidase based disposable amperometric biosensor[J].Analytica Chimica Acta, 2020,1 115:16-22.
[29] BEN REJEB I, ARDUINI F, ARVINTE A, et al.Development of a bio-electrochemical assay for AFB1 detection in olive oil[J].Biosensors and Bioelectronics, 2009,24(7):1 962-1 968.
[30] D AZ NIETO C H, GRANERO A M, GARCIA D, et al.Development of a third-generation biosensor to determine sterigmatocystin mycotoxin:An early warning system to detect aflatoxin B1[J].Talanta, 2019,194:253-258.
AZ NIETO C H, GRANERO A M, GARCIA D, et al.Development of a third-generation biosensor to determine sterigmatocystin mycotoxin:An early warning system to detect aflatoxin B1[J].Talanta, 2019,194:253-258.
[31] GRIESHABER D, MACKENZIE R, VÖRÖS J, et al.Electrochemical biosensors-sensor principles and architectures[J].Sensors (Basel, Switzerland), 2008, 8(3):1 400-1 458.
[32] STEPURSKA K V, SOLDATKIN O O, KUCHERENKO I S, et al.Feasibility of application of conductometric biosensor based on acetylcholinesterase for the inhibitory analysis of toxic compounds of different nature[J].Analytica Chimica Acta, 2015,854:161-168.
[33] SOLDATKIN O O, STEPURSKA K V, ARKHYPOVA V M, et al.Conductometric enzyme biosensor for patulin determination[J].Sensors and Actuators B:Chemical, 2017,239:1 010-1 015.
[34] ALONSO-LOMILLO M A, DOM NGUEZ-RENEDO O, FERREIRA-GONÇALVES L, et al.Sensitive enzyme-biosensor based on screen-printed electrodes for Ochratoxin A[J].Biosensors and Bioelectronics, 2010, 25(6):1 333-1 337.
NGUEZ-RENEDO O, FERREIRA-GONÇALVES L, et al.Sensitive enzyme-biosensor based on screen-printed electrodes for Ochratoxin A[J].Biosensors and Bioelectronics, 2010, 25(6):1 333-1 337.
[35] ALONSO-LOMILLO M A, DOM NGUEZ-RENEDO O, ROM
NGUEZ-RENEDO O, ROM N L, et al.Horseradish peroxidase-screen printed biosensors for determination of Ochratoxin A[J].Analytica Chimica Acta, 2011, 688(1):49-53.
N L, et al.Horseradish peroxidase-screen printed biosensors for determination of Ochratoxin A[J].Analytica Chimica Acta, 2011, 688(1):49-53.
[36] DRIDI F, MARRAKCHI M, GARGOURI M, et al.Thermolysin entrapped in a gold nanoparticles/polymer composite for direct and sensitive conductometric biosensing of ochratoxin A in olive oil[J].Sensors and Actuators B:Chemical, 2015,221:480-490.
[37] CHOU J C, LIN S H, LAI T Y, et al. A facile fabrication of a potentiometric arrayed glucose biosensor based on nafion-GOx/GO/AZO[J].Sensors (Basel, Switzerland), 2020, 20(4):964.
[38] LUO X L, XU J J, ZHAO W, et al.A novel glucose ENFET based on the special reactivity of MnO2 nanoparticles[J].Biosensors and Bioelectronics, 2004, 19(10):1 295-1 300.
[39] CHEY C O, IBUPOTO Z H, KHUN K, et al.Indirect determination of mercury ion by inhibition of a glucose biosensor based on ZnO nanorods[J].Sensors (Basel, Switzerland), 2012, 12(11):15 063-15 077.
[40] LAWAL A T, ADELOJU S B.Polypyrrole based amperometric and potentiometric phosphate biosensors:A comparative study B[J].Biosensors and Bioelectronics, 2013,40(1):377-384.