黄酒具有口感醇厚、香气馥郁等特色,深受我国消费者的青睐。多样的酿造原料、复杂的酿造工艺及多菌种共酵体系赋予了黄酒丰富的功能性成分,主要包括多糖、低聚糖、蛋白质、多肽、游离氨基酸、有机酸和风味物质[1],其中糖类物质占比最高。黄酒中糖类物质主要包括葡萄糖、麦芽糖、海藻糖、黄酒低聚糖与黄酒多糖等[2]。低聚糖已被报道可有效促进肠道益生菌的增殖[3],但黄酒低聚糖能否发挥此种功效尚未可知。黄酒低聚糖是由2~10个单糖通过糖苷键连接而成的低聚合度糖,主要来源于原料稻米与小麦中淀粉的酶解、小麦麸皮酶解、微生物自身代谢等[4]。黄酒中低聚糖含量丰富,低聚异麦芽糖是黄酒低聚糖的主要成分[4]。BAI等[5]利用高效液相色谱法对黄酒中低聚异麦芽糖进行定量检测,测得黄酒中低聚异麦芽糖含量多集中于7~8 g/L。然而,尚未有人对黄酒中低聚糖进行分离纯化及功能研究。
研究发现膳食低聚糖具有增强胃肠动力、上调机体有益代谢产物含量及增加肠内有益菌群丰度等功能[6]。黄酒低聚糖难以被胃和小肠酶解,大多数可到达结肠内被结肠微生物发酵利用[4]。短链脂肪酸(short chain fatty acids,SCFAs)为结肠微生物酵解难消化碳水化合物的代谢产物,具有促进肠道蠕动、调节pH促进有益菌增殖、调节脂质代谢等功效[7]。黄酒低聚糖是否可通过对肠道菌群的有益调节发挥益生功效仍有待探讨。
本研究选取市场主流的半干型黄酒为原料,通过黄酒原液浓缩、乙醇醇沉、旋蒸除乙醇、Sevage法除蛋白、旋蒸除Sevage试剂、3 000 Da与300 Da膜分离、冷冻干燥技术等步骤对黄酒低聚糖进行分离,同时通过DEAE Sepharose Fast Flow与Sephadex G15对黄酒低聚糖进行纯化。低聚果糖是广泛应用于食品工业中的功能性低聚糖[3],而葡萄糖可作为菌群发酵的共同碳源被肠道菌群利用[8]。因此本研究通过小鼠肠道菌群体外发酵研究比较了葡萄糖(阴性对照组)、低聚果糖(阳性对照组)与黄酒低聚糖的体外益生效果,为黄酒低聚糖后续功能验证提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 实验样品
本研究所用半干型黄酒样品,中国绍兴某公司。
1.1.2 实验试剂
DEAE Sepharose Fast Flow、Sephadex G15,北京索莱宝科技有限公司;低聚果糖,上海麦克林生化科技有限公司;BBL、LBS、BDS、EMB培养基,青岛高科园海博生物技术有限公司;乙酸、丙酸、丁酸、异丁酸,上海阿拉丁有限公司;系列葡聚糖标准品,美国聚合物标准品公司;半乳糖、甘露糖、木糖、阿拉伯糖、核糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸,美国Sigma-Aldrich公司;其余试剂,国药集团化学试剂有限公司。
1.2 仪器与设备
R-1020旋转蒸发器、SHB-B95型循环水式多用真空泵,杭州庚雨仪器有限公司;卷式膜纳滤设备,绍兴海纳膜技术有限公司;ME204号立式大容量多管离心机、Trace 1300 ISQ气相色谱-质谱联用仪,赛默飞世尔科技有限公司;752N紫外可见光分光光度计,杭州汇尔仪器设备有限公司;Beta 1-8实验室型冻干机,北京博劢行仪器有限公司;HYG-B全温摇瓶柜,苏州培英实验设备有限公司;SKD-1800全自动凯氏定氮仪,上海沛欧分析仪器有限公司;DHL-A电脑恒流泵、DBS-100电脑全自动部分收集器,上海青浦沪西仪器厂;AW 200 SG厌氧工作站,瑞士康科技有限公司;pH计,梅特勒-托利多仪器有限公司;Waters 1525 EF高效液相色谱仪,美国沃特世公司;ICS 5000离子色谱仪,美国戴安公司。
1.3 实验方法
1.3.1 实验样品
1.3.1.1 黄酒原液浓缩与分级醇沉
黄酒低聚糖的分离纯化步骤如图1所示。首先利用旋转蒸发器于55 ℃将黄酒原液以9∶1的体积比减压浓缩。向浓缩物中添加无水乙醇至体系内乙醇体积分数达75%,充分搅拌后于4 ℃冰箱静置过夜,24 h后离心收集合并沉淀,并于-20 ℃冰箱保存。

图1 黄酒低聚糖分离纯化流程图
Fig.1 Flow chart of separation and purification of Huangjiu oligosaccharides
1.3.1.2 Sevage法除黄酒蛋白
将所得沉淀以去离子水溶解后,置于旋转蒸发器中旋蒸除去体系内残留乙醇。将溶液与Sevage试剂[V(三氯甲烷)∶V(正丁醇)=4∶1]在摇瓶中以5∶1体积比混合,置于全温摇瓶柜内充分混匀。2 h后将混合液于立式大容量多管离心机中离心(4 000 r/min,8 min),此时变性蛋白聚集于有机试剂与水层分界处。收集上层糖液重复上述操作,直至分层处基本无蛋白沉淀。收集合并上层糖液,置于旋转蒸发器中旋蒸除去体系内有机试剂,上清液保存于-20 ℃。
1.3.1.3 膜分离收集黄酒低聚糖
参考CAI等[9]的研究方式对黄酒低聚糖进行截留,并进行适量修改。将除蛋白后的黄酒糖液置于卷式膜纳滤设备中,以3 000 Da聚醚砜超滤膜进行截留。随后向膜过滤机中添加足量去离子水,直至体系内低聚糖充分过滤。收集滤出液,保存于-20 ℃冰箱。随后以300 Da聚酰胺纳滤膜对上述滤出液进行截留,向膜过滤机中添加足量去离子水,收集截留液保存于-20 ℃冰箱。将糖液置于-80 ℃冰箱中过夜冷冻后,于冷冻干燥机进行冻干,得到淡黄色粗黄酒低聚糖粉。
1.3.1.4 黄酒低聚糖提取率与回收率的测定
按1.3.1.3将黄酒原液分别以3 000 Da超滤膜与300 Da纳滤膜过滤后,测定300~3 000 Da截留范围内黄酒液中总糖含量与还原糖含量。测得各步骤所得糖液中总糖(苯酚硫酸法[9])与还原糖(DNS法[9])含量,黄酒低聚糖提取率与回收率,如公式(1)~公式(3)所示:
m1=m2-m3
(1)
低聚糖提取率![]()
(2)
低聚糖回收率![]()
(3)
式中:m1为黄酒低聚糖总含量;m2为黄酒截留液总糖含量;m3为黄酒截留液还原糖含量;m4为各步骤糖液总糖含量;m5为各步骤糖液还原糖含量;m6为各步骤糖液低聚糖总量。
1.3.2 黄酒低聚糖的纯化
1.3.2.1 DEAE Sepharose Fast Flow离子交换柱层析纯化
参考沈赤[10]的研究方法,并进行适当修改。采用离子交换柱层析技术分离携带不同电荷的黄酒低聚糖。玻璃层析柱内径2 cm,柱高80 cm,上样体积5 mL,上样质量浓度10 mg/mL。将DEAE Sepharose Fast Flow填料缓慢倾倒入层析柱内,冲洗平衡后分别以去离子水、0.1、0.2、0.3 mol/L NaCl溶液进行洗脱,各洗脱液均洗脱20管。调节恒流泵流速至2 mL/min,每5 min收集1管样品,以苯酚硫酸法逐管检测收集管内糖含量。
1.3.2.2 Sephadex G15葡聚糖凝胶柱纯化
参考易晓敏等[11]的研究方法,并进行适当修改。利用Sephadex G15对DEAE Sepharose Fast Flow离子交换柱分离后的低聚糖组分进行二次纯化。将该组分配制为10 mg/mL的溶液,上样体积5 mL,以去离子水为洗脱液进行洗脱,同时用自动部分收集器逐管进行收集。调节恒流泵流速至0.5 mL/min,每10 min 收集一管样品,以苯酚硫酸法逐管检测收集管内糖含量。
1.3.2.3 黄酒低聚糖分子质量分布
配制5 mg/mL的黄酒低聚糖溶液,糖液经0.22 μm水系滤膜过滤后注入液相小瓶中待测,以Waters 1525色谱仪进行分子质量测定。分别称取重均分子质量为180、342、505、1 200、3 650 Da的葡聚糖标准品并配制为5 mg/mL的标准溶液。以色谱峰的保留时间(Rt)为横坐标,分子质量的对数值(lgMw)为纵坐标进行回归得标准曲线方程,通过标准曲线计算得到黄酒低聚糖分子质量。洗脱程序参考了刘卫宝[12]的研究方法。
1.3.2.4 黄酒低聚糖的单糖组成
利用ICS 5000离子色谱仪对黄酒低聚糖的单糖组成进行分析,预处理与洗脱方法参考了刘卫宝[12]的研究,并进行适当修改。配制包括鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖、核糖、葡萄糖醛酸、半乳糖醛酸在内的5 mg/L的低质量浓度混合单糖标准溶液与200 mg/L的葡萄糖标准溶液。高浓度葡萄糖标准品用于测定黄酒低聚糖中葡萄糖的摩尔比,低浓度标准品用于测定黄酒低聚糖中其余单糖的含量。
1.3.3 黄酒低聚糖对肠道菌群体外增殖评价
1.3.3.1 小鼠粪便匀浆的配制
新鲜的小鼠粪便从江南大学动物实验中心获得,小鼠此前未进行过抗生素治疗。以无菌粪便收集盒收集小鼠粪便,立即用无菌磷酸盐缓冲液(PBS,0.1 mol/L)转移至厌氧操作箱内。小鼠粪便与PBS缓冲液以1∶10(g∶mL)比例配制。经涡旋振荡器充分混匀后,以3层无菌纱布混合过滤得到粪便匀浆用于接种[13]。
1.3.3.2 体外发酵方法
小鼠粪便菌群的发酵方式参考郑志昌等[8]的方法,并进行适当修改。粪便培养基的配制参考王如月[13]的研究方案。分别以葡萄糖、低聚果糖与黄酒低聚糖(纯化后)充当碳源物质,培养基在115 ℃下灭菌30 min。以葡萄糖组为阴性对照组,低聚果糖组为阳性对照组,黄酒低聚糖组为实验组进行厌氧培养。体外发酵在无菌三角瓶中进行,每瓶分装入30 mL培养基。粪便菌液以10%(体积分数)接入,并置于厌氧工作站37 ℃下恒温培养。在孵育前,以无菌注射器从管内吸取1.5 mL培养基进行指标测定,随后在发酵4、8、12、24、36、48 h时以相同的方式获得随后的等分试样,并保存在-80 ℃直至分析。各分组设置3个平行实验。
1.3.3.3 发酵液OD600值的测定
参考李娟[14]的方法对发酵液OD600值进行测定,并进行适当修改。1 mL发酵液于4 ℃下12 000 r/min离心5 min,分别收集上清液与菌体。向菌泥管中加入1 mL无菌水后涡旋混匀,随后置于酶标仪测定OD600值以表征菌体生长情况。
1.3.3.4 发酵液pH值的测定
收集各时间点发酵液后迅速浸入冰水以停止发酵。随后以精密pH计测定1.3.3.3所得上清液的pH值。
1.3.3.5 发酵液糖余量测定
各时间点发酵液的糖余量以苯酚硫酸法进行测定[9]。
1.3.3.6 发酵液SCFAs含量测定
取1 mL发酵上清液进行SCFAs的提取。以乙醚萃取发酵液中SCFAs,经无水Na2SO4除水后,过0.22 μm有机相滤膜后注入液相小瓶中待测。预处理与上机条件参考了WANG等[15]的研究方法。
1.3.3.7 黄酒低聚糖对小鼠肠道特定菌群生长情况的影响
按说明书要求对双歧杆菌、乳杆菌、拟杆菌与大肠杆菌检测培养基进行配制,随后于121 ℃下灭菌20 min备用。取不同时间点的发酵液并以生理盐水进行梯度稀释,取合适稀释度的100 μL稀释液均匀涂布于不同的选择培养基上[16]。将平板置于厌氧工作站37 ℃恒温培养48 h。培养结束后进行平板计数。
1.3.4 数据分析
本研究各实验设置3组平行,使用GraphPad Prism 8进行统计分析,所有数据均表示为平均值±标准差。多重比较之间的差异采用单因素方差分析和Fisher′s LSD检验进行分析,P<0.05被认为是显著的。
2 结果与分析
2.1 黄酒低聚糖提取率
通过苯酚硫酸法及DNS法测得黄酒原液中低聚糖含量为(13.88±0.02)g/L。各步骤黄酒低聚糖提取率及回收率如表1所示。经图1系列步骤操作后,黄酒低聚糖提取率达(31.80±0.89)%,黄酒低聚糖回收率为72.49%~86.44%。在醇沉阶段,部分低聚糖仍溶于上清液中,未能完全被乙醇沉淀;在Sevage试剂除蛋白阶段,有机相与水相分层处的糖液未能完全收集,存在一定损失;超滤与纳滤阶段的损失主要归因于卷式膜过滤机内部及滤膜内残存部分低聚糖;低聚糖冻干粉的质量略低于过膜后所测糖液质量,原因可能是部分糖粉残留于冻干盘难以彻底刮净。
表1 黄酒低聚糖的提取率及回收率
Table 1 Extraction rate and recovery rate of Huangjiu oligosaccharides

注:提取率中-代表此数据无测量意义(即提取步骤尚未进行)
步骤黄酒低聚糖含量/(g·L-1)提取率/%回收率/%过膜测定黄酒低聚糖含量13.88±0.02--醇沉后10.06±0.0372.49±1.7972.49±1.79除蛋白后8.03±0.0157.89±1.3679.86±1.073 000 Da过膜后6.19±0.0344.61±0.7177.05±0.17300 Da过膜后5.35±0.0138.56±0.8286.44±0.94冻干粉末4.41±0.0331.80±0.8982.45±0.76
2.2 黄酒低聚糖的纯化
2.2.1 DEAE Sepharose Fast Flow分离纯化黄酒低聚糖
采用DEAE Sepharose Fast Flow对黄酒低聚糖溶液进行分离纯化。如图2-a所示,粗黄酒低聚糖经DEAE Sepharose Fast Flow层析柱洗脱后可得4种不同低聚糖组分(Huangjiu oligosaccharides,HJO)HJO-1,HJO-2,HJO-3与HJO-4。其中HJO-1含量占比(76.19±0.90)%,HJO-2含量占比(7.63±0.58)%,HJO-3含量占比(5.85±0.37)%,HJO-4含量占比(10.33±0.68)%。考虑到收集时间成本与脱盐成本,本实验选用HJO-1进行后续分离纯化,测得HJO-1的提取率达(66.23±1.03)%。
2.2.2 Sephadex G15分离纯化黄酒低聚糖
利用Sephadex G15对HJO-1组分进行后续分离纯化。如图2-b所示,本次洗脱共洗脱出两种低聚糖HJO-a与HJO-b。其中HJO-a含量占比为(94.40±0.70)%,HJO-b含量占比为(5.60±0.16)%。考虑到收集时间成本,本研究多次收集HJO-a进行冷冻干燥,并测得HJO-a的提取率为(82.10±4.18)%。将提取到的HJO-a用于体外菌群增殖实验。

a-DEAE Sepharose Fast Flow;b-Sephadex G15
图2 粗黄酒低聚糖的梯度洗脱曲线
Fig.2 Stepwise elution curve of crude Huangjiu oligosaccharides
2.2.3 黄酒低聚糖的分子质量分布与单糖组成
由图3-a可知,经DEAE-Sepharose Fast Flow层析柱纯化出的HJO-a均一性良好,峰形单一且对称。标准曲线计算得到其重均分子质量为1 002 Da;由图3-b可知,黄酒低聚糖HJO-a主要由葡萄糖(81.74%)、阿拉伯糖(6.13%)、甘露糖(5.51%)、木糖(4.92%)与半乳糖(1.70%)等5种单糖组成,其百分摩尔比已在文中标出。

a-分子质量;b-单糖组成
图3 HJO-a的分子质量与单糖组成测定
Fig.3 Determination of molecular weight and monosaccharide composition of HJO-a
2.3 黄酒低聚糖对肠道菌群体外增殖评价
2.3.1 黄酒低聚糖的组成
测得黄酒低聚糖糖粉中低聚糖含量为(84.21±0.16)%,还原糖含量为(4.76±0.17)%,蛋白质(凯氏定氮法[9])含量为(6.51±0.14)%,水分(《食品安全国家标准 食品中水分的测定》GB 5009.3—2016)含量为(3.13±0.04)%。
2.3.2 发酵液pH值的变化
pH值是反映糖类物质在酵解过程中被人体肠道菌群利用程度的重要指标[13],益生元可通过降低肠道pH值来抑制病原菌的繁殖[17]。如图4-a所示,对照组、低聚果糖组与黄酒低聚糖组发酵液的pH值均随发酵时间的延长而降低。其中以低聚果糖为碳源的发酵液pH下降最快,黄酒低聚糖组次之,而对照组下降最慢。前12 h发酵液pH变化较大,这表明菌群生长较为旺盛。24~48 h发酵液pH幅度较小,这表明菌群代谢较慢或基本停滞。低聚糖已被报道可促进肠道内乳杆菌与双歧杆菌等益生菌的增殖[4]。添加低聚果糖与黄酒低聚糖的发酵液pH下降较快的原因可能是定向促进了肠内双歧杆菌等益生菌的增殖,进而增加乳酸与SCFAs的含量,最终实现pH的快速降低。与低聚果糖相比,黄酒低聚糖组发酵液pH下降较慢,这可能是由于黄酒低聚糖的平均聚合度比低聚果糖稍大。
2.3.3 发酵液菌群密度的变化
OD600值可反映菌体密度,表征小鼠肠道菌群在不同碳源培养基中的生长情况[8]。如图4-b所示,随发酵时间的增加,对照组、低聚果糖组与黄酒低聚糖组的菌体密度均随发酵时间的延长而逐渐增加。与低聚果糖和黄酒低聚糖组相比,前4 h对照组菌群增长速率较高,这可能是由于葡萄糖为单糖,易于被肠道菌群优先利用。与葡萄糖相比,低聚果糖与黄酒低聚糖聚合度相对较高,需被肠道菌群逐步酵解后再利用,因此在前4 h低聚果糖与黄酒低聚糖菌群密度较对照组低。在4~24 h内,黄酒低聚糖与低聚果糖的菌群密度高于对照组,这表明低聚糖逐步被肠道菌群降解,随后用于菌群生长繁殖。在24~48 h内,菌群代谢缓慢,这可能是由于营养物质基本耗尽,菌群生长进入稳定期。
2.3.4 发酵液糖余量的变化
肠道菌群对不同碳源的消耗速率存在差异[8]。如图4-c所示,随发酵时间增加,对照组、低聚果糖组与黄酒低聚糖组的总糖余量均随发酵时间的延长而逐渐降低。相比于低聚果糖组与黄酒低聚糖组,在前4 h肠道菌群对葡萄糖的消耗速率更快,这与图4-b菌群生长曲线一致。在4~24 h,各组总糖余量相差不大,这表明黄酒低聚糖与低聚果糖被肠道菌群酵解后利用。除聚合度的影响外,糖的组成种类、单糖组成、链连接方式等因素也对糖消耗速率存在影响,如荞麦蜂花粉多糖在酵解24 h后可基本被消耗[14],在相同时间下车前子多糖仅能酵解47.2%,豌豆纤维仅能酵解20%[14]。

a-pH;b-OD600值;c-总糖余量
图4 不同碳源对发酵液相关指标的影响
Fig.4 Effect of different carbon sources on related indicators in fermentation broth
2.3.5 发酵过程中不同时间点发酵液SCFAs的变化
较低的pH会影响肠道菌群的组成,进而影响SCFAs的产生。本研究利用气相色谱-质谱联用法对发酵液中SCFAs含量进行测定。如图5所示,随发酵时间的增加,发酵液中乙酸、丙酸、丁酸与异丁酸含量均表现为逐渐增加的趋势。在发酵过程,黄酒低聚糖组在不同发酵时间点乙酸与丁酸的含量均显著高于对照组(图5-a、图5-c,P<0.05);除4 h与8 h,黄酒低聚糖组在不同发酵时间点丙酸的含量均显著高于对照组(图5-b,P<0.05),这可能是由于部分丙酸被肠道菌群利用所致;此外,除4 h时间点,黄酒低聚糖组在不同发酵时间点异丁酸的含量均显著高于对照组(图5-d,P<0.05),这可能是由于黄酒低聚糖聚合度较高,发酵速率较慢所致。在发酵过程中,低聚果糖组发酵液中乙酸与丙酸含量略高于黄酒低聚糖组,而黄酒低聚糖组丁酸与异丁酸含量则稍高于低聚果糖组。
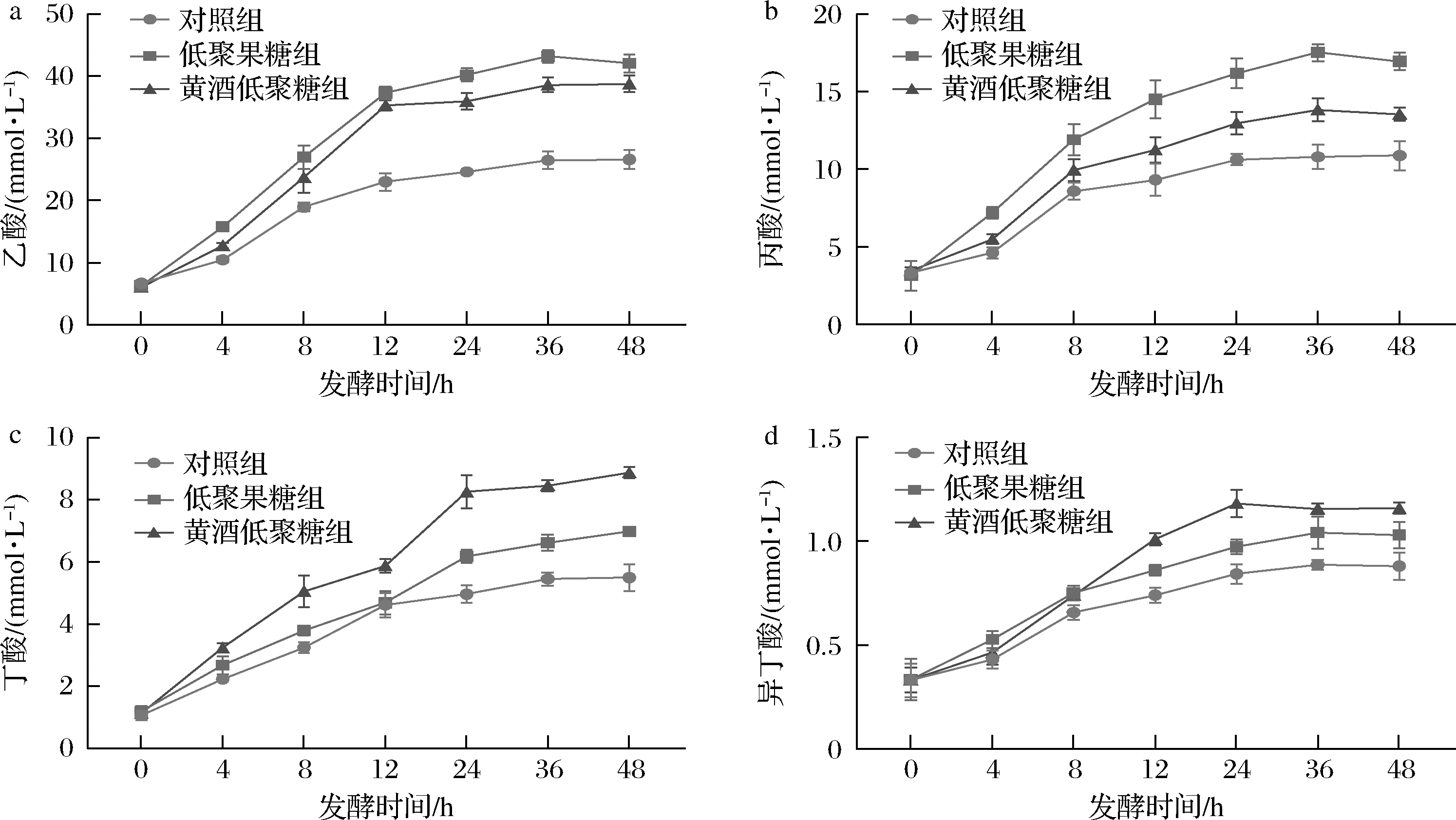
a-乙酸;b-丙酸;c-丁酸;d-异丁酸
图5 不同碳源对发酵液 SCFAs 含量的影响
Fig.5 Effect of different carbon sources on SCFAs contents in fermentation broth
SCFAs是肠道微生物酵解难消化的碳水化合物的主要产物[18],在降低肠道pH值、调节宿主代谢、细胞增殖和免疫调节方面发挥重要作用。此外,SCFAs 可被宿主吸收,被认为是宿主肠道的重要能量来源[14]。据报道,喂食含低聚半乳糖的猪饲料可显著提高猪回肠中SCFAs含量[19],并增加粪便中双歧杆菌与乳杆菌的含量;壳寡糖干预可增加便秘小鼠肠道SCFAs含量,并增加肠道乳杆菌与拟杆菌等菌属的丰度[20]。因此,可推测黄酒低聚糖对SCFAs的增加可能对机体表现出一定的益生作用。
2.3.6 发酵过程中不同时间点发酵液特定菌群数量的变化
为探究黄酒低聚糖的益生特性,本研究对不同时间点发酵液中双歧杆菌、乳杆菌、拟杆菌与大肠杆菌数量进行检测,如表2所示。
表2 不同碳源对发酵过程中不同时间点发酵液特定菌群数量的变化 单位:lgCFU/mL
Table 2 Effect of different carbon sources on the number of specific gut microbiota at different time points
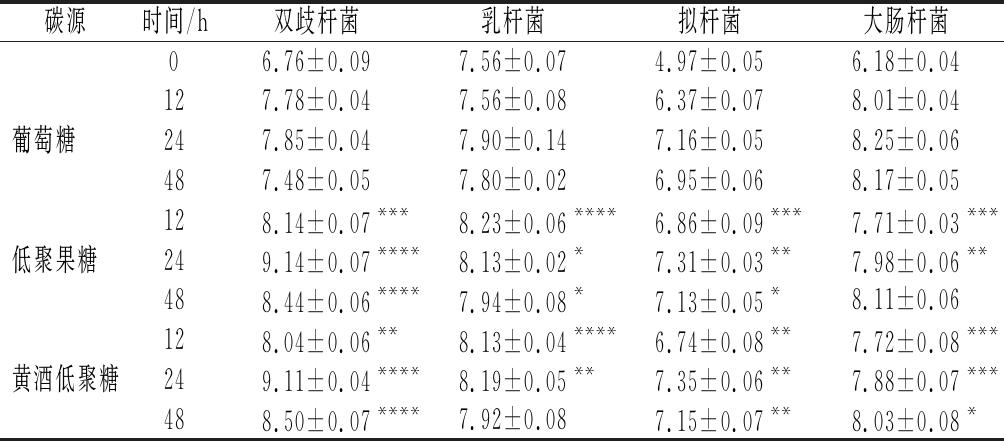
注:同列肩标*表示与对照组相比差异显著(P<0.05),**表示与对照组相比差异极显著(P<0.01),***表示与对照组相比差异极显著(P<0.001),****表示与对照组相比差异极显著(P<0.000 1)
碳源时间/h双歧杆菌乳杆菌拟杆菌大肠杆菌06.76±0.097.56±0.074.97±0.056.18±0.04127.78±0.047.56±0.086.37±0.078.01±0.04葡萄糖 247.85±0.047.90±0.147.16±0.058.25±0.06487.48±0.057.80±0.026.95±0.068.17±0.05128.14±0.07***8.23±0.06****6.86±0.09***7.71±0.03***低聚果糖 249.14±0.07****8.13±0.02*7.31±0.03**7.98±0.06**488.44±0.06****7.94±0.08*7.13±0.05*8.11±0.06128.04±0.06**8.13±0.04****6.74±0.08**7.72±0.08***黄酒低聚糖249.11±0.04****8.19±0.05**7.35±0.06**7.88±0.07***488.50±0.07****7.92±0.087.15±0.07**8.03±0.08*
与对照组相比,黄酒低聚糖与低聚果糖显著增加了不同时间点发酵液中双歧杆菌、乳杆菌与拟杆菌的数量(P<0.05),同时显著降低了大肠杆菌的数量(P<0.05)。在本实验中,黄酒低聚糖与低聚果糖效果相近,这表明黄酒低聚糖可发挥类似的益生作用。
在人体肠道菌群中,双歧杆菌、乳杆菌与拟杆菌为重要的肠道益生菌[8,10]。肠道双歧杆菌可参与机体多种消化酶、氨基酸、SCFAs与维生素的合成,进而发挥抗衰老、抗肿瘤、减轻肠道炎症等功效[21]。此外,双歧杆菌还可抑制致病菌的增殖及毒素的侵袭[16];乳杆菌可发挥代谢产SCFAs、降低胆固醇、促进机体对矿物质的吸收等功效,从而维持肠道微生态平衡[16,22];拟杆菌是对人体有益的共生菌,已被证明可产生SCFAs,促进机体吸收并增强机体免疫[16,23];大肠杆菌为条件致病菌,一定条件下可诱发机体疾病,降低机体免疫力[10]。由此可推测,黄酒低聚糖对肠道菌群存在积极的调节作用,有望提取黄酒低聚糖作为膳食干预剂对肠道疾病进行靶向治疗。
3 结论
本研究首次对黄酒中低聚糖进行分离纯化,并进行体外菌群增殖评价,主要结论如下:
(1)本研究通过75%乙醇醇沉、Sevage法除蛋白及膜分离法从黄酒中提取黄酒低聚糖。经琼脂糖凝胶柱DEAE Sepharose Fast Flow及Sephadex G15分离纯化后得到主要的黄酒低聚糖组分HJO-a,其纯度可达(84.21±0.16)%;(2)与葡萄糖相比,以黄酒低聚糖为碳源的培养液可显著增加发酵液中SCFAs的含量(P<0.05),并有效促进发酵液中肠道益生菌双歧杆菌、乳杆菌与拟杆菌的增殖(P<0.05),并显著降低了条件致病菌大肠杆菌的含量(P<0.05);(3)与低聚果糖相比,黄酒低聚糖对肠道菌群的增殖可发挥类似的调节作用,这揭示黄酒低聚糖可作为潜在的益生元被肠道菌群利用。
[1] 蔡际豪. 不同工艺绍兴黄酒风味比对及传统绍兴黄酒风味表征研究[D].杭州:浙江工业大学, 2020.
CAI J H.Flavor comparison of Shaoxing Huangjiu with different processes and flavor characterization of traditional Shaoxing Huangjiu[D].Hangzhou:Zhejiang University of Technology, 2020.
[2] 史瑛, 冯欣静, 周志磊, 等.黄酒多糖对炎症性肠病及便秘作用机制的研究进展[J].食品与发酵工业, 2021, 47(9):275-283.
SHI Y, FENG X J, ZHOU Z L, et al.Research progress on the mechanism of Huangjiu polysaccharides on inflammatory bowel disease and constipation[J].Food and Fermentation Industries, 2021, 47(9):275-283.
[3] 刘洋, 瞿恒贤, 张龙飞, 等.低聚糖对益生菌发酵乳功能特性的影响[J].食品与发酵工业, 2022,48(5):75-80.
LIU Y, QU H X, ZHANG L F, et al.Effects of oligosaccharides on the functional characteristics of probiotic fermented milk[J].Food and Fermentation Industries, 2022,48(5):75-80.
[4] 冯欣静, 史瑛, 周志磊, 等.黄酒低聚糖对便秘、肠道炎症与肥胖作用的研究进展[J].中国酿造, 2021, 40(8):1-7.
FENG X J, SHI Y, ZHOU Z L, et al.Research progress of effect of Huangjiu oligosaccharides on constipation, intestinal inflammation and obesity[J].China Brewing, 2021, 40(8):1-7.
[5] BAI W D, FANG X D, ZHAO W H, et al.Determination of oligosaccharides and monosaccharides in Hakka rice wine by precolumn derivation high-performance liquid chromatography[J].Journal of Food and Drug Analysis, 2015, 23(4):645-651.
[6] LIU X Y, CHEN S, YAN Q J, et al.Effect of Konjac mannan oligosaccharides on diphenoxylate-induced constipation in mice[J].Journal of Functional Foods, 2019, 57:399-407.
[7] BINDELS L B, DELZENNE N M, CANI P D, et al.Towards a more comprehensive concept for prebiotics[J].Nature Reviews Gastroenterology & Hepatology, 2015, 12(5):303-310.
[8] 郑志昌, 陈映彤, 郭娟娟, 等.莲子低聚糖各单体体外益生效果研究[J].中国食品学报, 2019, 19(7):56-63.
ZHENG Z C, CHEN Y T, GUO J J, et al. Studies on the probiotic effect of different monomers of oligosaccharides from Lotus(Nelumbo nucifera gaertn.) seeds in vitro[J]. Journal of Chinese Institute of Food Science and Technology, 2019, 19(7):56-63.
[9] CAI M, CHEN S, MA Q H, et al.Isolation of crude oligosaccharides from Hericium erinaceus by integrated membrane technology and its proliferative activity[J].Food Hydrocolloids, 2019, 95:426-431.
[10] 沈赤. 绍兴黄酒多糖的分离提取、生物活性及其对肠道微生物的影响[D].无锡:江南大学, 2014.
SHEN C.The separation and extraction, biological activities of polysaccharides from Shaoxing rice wine and their effects on intestinal microflora[D].Wuxi:Jiangnan University, 2014.
[11] 易晓敏, 唐雪娟, 王娟.香蕉低聚糖的微波、超高压法提取与柱层析分离纯化[J].中国食品学报, 2016, 16(9):107-112.
YI X M, TANG X J, WANG J.Extraction of banana oligosaccharides using microwave, ultrahigh pressure methods and purification by column chromatography[J].Journal of Chinese Institute of Food Science and Technology, 2016, 16(9):107-112.
[12] 刘卫宝. 黄芪多糖、寡糖的制备及其发酵益生作用的研究[D].无锡:江南大学, 2020.
LIU W B.Study on preparation of Astragalus polysaccharides and oligosaccharides and their probiotic effects[D].Wuxi:Jiangnan University, 2020.
[13] 王如月. 燕麦多糖及其寡糖的制备与对肠道微生物的影响研究[D].无锡:江南大学, 2020.
WANG R Y.Preparation of oat polysaccharides and its oligosaccharides and their effects on intestinal microorganisms[D].Wuxi:Jiangnan University, 2020.
[14] 李娟. 荞麦蜂花粉多糖对肠道菌群的影响[D].南昌:南昌大学, 2020.
LI J.Effects of polysaccharide from Fagopyrum esculentum moench bee pollen on instinal microflora[D].Nanchang:Nanchang University, 2020.
[15] WANG G, YANG S R, SUN S S, et al.Lactobacillus rhamnosus strains relieve loperamide-induced constipation via different pathways independent of short-chain fatty acids[J].Frontiers in Cellular and Infection Microbiology, 2020, 10:423.
[16] 邹妍, 胡家强, 王津, 等.茶叶粉的基本成分及益生特性研究[J].食品研究与开发, 2021, 42(15):20-26.
ZOU Y, HU J Q, WANG J, et al.Studies of the basic components and probiotic properties of tea powder[J].Food Research and Development, 2021, 42(15):20-26.
[17] CHEN C, HUANG Q, FU X, et al. In vitro fermentation of mulberry fruit polysaccharides by human fecal inocula and impact on microbiota[J].Food & Function, 2016, 7(11):4 637-4 643.
[18] MAKKI K, DEEHAN E C, WALTER J, et al.The impact of dietary fiber on gut microbiota in host health and disease[J].Cell Host Microbe, 2018, 23(6):705-715.
[19] DEN BESTEN G, VAN EUNEN K, GROEN A K, et al.The role of short chain fatty acids in the interplay between diet, gut microbiota, and host energy metabolism[J].Journal of Lipid Research, 2013, 54(9):2 325-2 340.
[20] ZHANG X Y, YANG H B, ZHENG J P, et al.Chitosan oligosaccharides attenuate loperamide-induced constipation through regulation of gut microbiota in mice[J].Carbohydrate Polymers, 2021, 253:117218.
[21] 柴茂. 双歧杆菌对便秘的缓解作用及其机制分析[D].无锡:江南大学, 2021.
CHAI M.Analysis of the alleviation effects on constipation by Bifidobacterium and its mechanisms[D].Wuxi:Jiangnan University, 2021.
[22] CHENG Y W, LIU J M, LING Z X.Short-chain fatty acids-producing probiotics:A novel source of psychobiotics[J].Critical Reviews in Food Science and Nutrition, 2021.DOI:10.1080/10408398.2021.1920884.
[23] 易建勇, 赵圆圆, 毕金峰, 等.果胶精细结构与其肠道微生物酵解特性的构效关系[J].中国食品学报, 2021, 21(11):337-348.
YI J Y, ZHAO Y Y, BI J F, et al.The structure-function relationship between pectin and intestinal microbial fermentation characteristics[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(11):337-348.