浓香型白酒是我国著名白酒,历史悠久,具有独特的风味和香气,年产量占中国白酒的70%以上[1-2]。浓香白酒的工艺特点是采用固态泥窖发酵法酿制,在发酵生产上依赖于高粱、大曲等原材料在窖池中的无氧发酵,其中霉菌、酵母和细菌在内的微生物群参与了风味物质的合成[3]。但由于窖内不同层糟醅所处空间位置不同,因而微生态环境不同,微生物的生长代谢状态存在差异,在酿造过程中产生微生物代谢物质差异[4],最终导致不同层糟醅所产酒的酒质不同。生产实践证明,窖池的上层糟醅所产酒酒质明显低于下层,如何提高上层糟醅原酒酒质,是酿酒行业亟待解决的问题,也是提高企业优质酒产量最为经济、高效的途径。
白酒中风味物质主要包括有机酸、酯类、醇类、醛类及其他芳香族化合物和杂环类化合物,根据风味化合物的种类和含量可以确定不同类型白酒的风味特征[5]。浓香型白酒的特征风味化合物包括己酸、丁酸、乙酸和乳酸及其相应的乙酯,其中己酸乙酯和己酸对其典型风味贡献最大[6-8]。有报道[9-11]称浓香型糟醅的主要香气成分酯类和酸类含量均呈现下层>中层≥上层的分布规律,且丁酸乙酯、己酸乙酯、乳酸乙酯、己酸、丁酸等典型风味物质在下层糟醅中的含量均明显高于上层;此外,段明松等[12]采用顶空-固相微萃取-气质联用法(headspace-solid-phase microextraction-GC/MS, HS-SPME-GC/MS)对不同空间位置的浓香原酒香气成分进行了分析,结果表明下层原酒中风味物质总量最高,其中酯类物质总量、正己醇、异戊醇、正丁醇和己酸等主要风味物质含量均高于中层和上层原酒;沈才萍等[4]和冯海燕等[13]研究表明,下层原酒风味成分含量较高,口感最为丰富,其中有机酸、丁酸乙酯、己酸乙酯含量明显高于上层原酒。综上,浓香型白酒生产中不同层原酒风味差异已明晰,然而对于造成这种风味差异的原因尚不明确,相关研究亟待分析。
本研究采用HS-SPME-GC/MS研究了上下层原酒风味特征,并利用正交偏最小二乘法判别分析(orthogonal partial least squares discrimination analysis, OPLS-DA)模型确定引起上下层原酒差异的主要风味物质,进而通过Spearman相关性分析,结合糟醅相关指标探究了引起原酒差异的主要因素,最后研究了氧气和黄水对原酒风味物质的影响。本研究以期为浓香型白酒生产工艺改进提供借鉴,为提升优质原酒产量提供一定的理论支撑。
1 材料与方法
1.1 实验材料
1.1.1 实验样品
糟醅、原酒和黄水由四川某白酒企业提供。随机选择三口正常发酵采用泥封封窖的窖池,在发酵结束后用取样器对上层和下层糟醅进行取样,并对对应糟醅样品蒸馏的原酒和发酵结束后的黄水进行取样。
1.1.2 培养基
EG培养基(用于绝对厌氧菌筛选)、LB培养基(用于细菌筛选培养)、PDA培养基(用于真菌筛选培养)、MRS培养基(用于乳酸菌的特性研究)、RCM培养基(用于厌氧菌特性研究)、YPD培养基(用于酵母特性研究)均购自青岛海博生物技术有限公司。
高粱培养液[9]:称取200 g高粱(粉碎)于烧杯中,用适量蒸馏水润湿后蒸熟,加入300 mL蒸馏水,加入0.2 mL α-淀粉酶和0.2 mL糖化酶,60 ℃液化糖化2 h,离心过滤取上清液,121 ℃灭菌20 min。用于研究黄水浓度对分离微生物的影响。
1.2 仪器与设备
DF-101 KS恒温加热磁力搅拌器,郑州恒岩仪器有限公司;固相萃取装置,上海安谱公司;Thermo Fisher TRACE 1300气相色谱-质谱联用仪,美国赛默飞世尔科技有限公司;FE 20 pH计,梅特勒-托利多仪器(上海)有限公司;CY-12 C便携式测氧仪,杭州艾普仪器设备有限公司;SW-CJ-1 CCV超净工作台,苏州安泰空气技术有限公司;AW 200 SG厌氧工作站,瑞士康科技有限公司;KC/HWS-250 PY恒温恒湿培养箱,上海凯测实验设备有限公司;GZX-9146 MBE电热鼓风干燥箱,上海博迅实业有限公司;HYL-C 3组合式摇床,苏州太仓市强乐实验设备有限公司;SynergyH 1全功能酶标仪,美国Bio-RAD公司。
1.3 实验方法
1.3.1 原酒风味物质测定
吸取5 mL稀释20倍的原酒至20 mL顶空固相微萃取瓶中,加1.5 g氯化钠和20 μL 2-辛醇内标,混匀,45 ℃萃取50 min[14]。气相进样口温度为250 ℃,载气为高纯氦气,流速为1.0 mL/min。升温程序:初始温度40 ℃,保持2 min,以4 ℃/min升至150 ℃,保持2 min;再以6 ℃/min升至230 ℃并保持5 min。质谱条件:电离模式为电子轰击离子源,70 eV;四极杆温度150 ℃;离子源温度230 ℃;传输线温度250 ℃;质量扫描范围35~350 aum。
1.3.2 糟醅相关指标测定
糟醅水分含量、酸度、pH、还原糖、淀粉含量[15]和氧气含量:水分测定采用烘干法;酸度采用酸碱滴定法;pH采用pH计直接测定;淀粉和还原糖含量采用斐林试剂法测定;发酵前期糟醅氧气含量利用便携式测氧仪测定。
糟醅有机酸测定:糟醅样本用无水乙醇浸泡离心,并经适当稀释后采用气相色谱分析糟醅中有机酸含量[16]。气相进样口温度为230 ℃,检测器温度为230 ℃,载气为高纯氦气,流速为1.0 mL/min,进样量为1 μL,分流比为30∶1。采用以下梯度条件:初始温度35 ℃,保持0 min,以4 ℃/min升至60 ℃,保持4 min,以6 ℃/min的速度升温至195 ℃,保持20 min[16]。
1.3.3 白酒酿造相关微生物的分离筛选与鉴定
取10 g糟醅于含90 mL无菌水的三角瓶中,150 r/min摇床培养30 min,取上清液100 μL稀释10-3、10-4、10-5 3个梯度涂布于EG固体培养基(厌氧工作站,37 ℃),LB固体培养基(恒温恒湿培养箱,37 ℃)和PDA固体培养基(恒温恒湿培养箱,28 ℃),培养2 d后挑取不同形态的单菌落于相应固体培养基上进行纯化,纯化2~3次后挑取单菌落进行甘油保藏。
取甘油保藏的菌株进行液体培养,培养2 d后吸取1 mL菌液,离心收集菌体沉淀,采用SDS-CTAB法提取菌体DNA,扩增后送至上海生工生物工程股份有限公司进行测序分析。菌株信息如表1所示。
表1 分离微生物种属信息
Table 1 Species information for isolated microorganisms

编号菌种名拉丁种名分离来源类型培养温度/℃LA嗜酸乳杆菌Lactobacillus acetotolerans糟醅兼性厌氧37SX木糖葡萄球菌Staphylococcus xylosus糟醅严格厌氧37BL地衣芽孢杆菌Bacillus licheniformis糟醅严格厌氧37BA解淀粉芽孢杆菌Bacillus amyloliquefaciens糟醅兼性厌氧37CT酪丁酸梭菌Clostridium tyrobutyricum糟醅兼性厌氧37CS煎盘梭菌Clostridium sartagoforme糟醅严格厌氧37CA己酸菌Caproicibacterium amylolyticum糟醅兼性厌氧37RU瘤胃球菌Ruminococcaceae bacterium BL-6糟醅严格厌氧37PS毕赤酵母Pichia sorbitophila糟醅兼性厌氧28
1.3.4 两种关键因子氧气和黄水对分离微生物的影响
氧气含量对分离微生物的影响:在装有150 mL培养基的250 mL锥形瓶中接种5%菌液,分别在厌氧条件和50、150 r/min转速下振荡培养,每种梯度设置3个重复,培养24 h后测定OD600值[17]。
黄水浓度对分离微生物的影响:添加25%的高粱培养液为基础培养基,设置黄水体积分数0%、25%、50%、75%共4个梯度,剩余部分用去离子水补全,每个梯度设置3个重复处理,121 ℃灭菌20 min。以5%的接种量将微生物接种至培养基,置于厌氧条件下培养,24 h后测定OD600值[18]。
2 结果与分析
2.1 上下层原酒风味成分分析
利用HS-SPME-GC/MS测定上下层原酒风味,并对白酒中常见的50种风味物质(图1)进行分析。基于风味物质含量对原酒进行层次聚类分析,结果显示上下层原酒各自聚成1簇,说明上下层原酒风味物质含量存在差异。对风味物质含量进行分析可以看出,上层原酒风味物质总量为(2 110.82±348.48)mg/L,下层原酒为(3 757.98±594.87)mg/L(P<0.05)。2种原酒中酯类、酸类、醇类三类化合物的含量之和均占风味物质总量的95%以上,但酯类物质在上层原酒中占比89.58%,在下层中占比94.74%(P<0.05),酸类和醇类在上层原酒中分别占比3.79%和2.27%,在下层中占比1.69%、1.11%(P<0.05),上层原酒的风味更为复杂,与沈才萍等[4]的报道一致。在酯类中,上层原酒的酯类含量显著低于下层原酒(P<0.05),且决定浓香酒特征风味的4大酯(己酸乙酯、丁酸乙酯、乙酸乙酯和乳酸乙酯)在上层原酒中含量显著低于下层(P<0.05),可能是由于下层糟醅与窖泥接触面积更大且厌氧程度更高,有利于己酸菌、梭菌等细菌代谢产生有机酸及进一步合成对应酯类物质。上层原酒的酸类和醛类含量显著低于下层原酒(P<0.05),醇类、酚类含量均显著高于下层原酒(P<0.05)。

图1 上下层原酒风味成分分析
Fig.1 Analysis of flavor components of original liquor in the upper and lower layers of the cellar
为了明确上下层原酒风味物质的差异,进行OPLS-DA模型分析,提取2个主成分,PC 1贡献率36.8%,PC 2贡献率18.4%,总贡献率55.2%,基本可以代表样品的整体信息。结果表明,上层原酒和下层原酒在PC 1上差异较大,在PC 2上差异不明显。通过化合物的变量投影重要性(variable importance in the projection, VIP)分析,选取VIP>1.2的15个化合物(图2-b)。由图2-a可知,己酸丙酯、己酸己酯、乳酸乙酯等10种酯和壬醛、癸醛聚集在下层原酒周围,表明这些风味物质含量与下层原酒正相关,说明下层原酒酯类物质含量高于上层原酒,浓香型白酒的特征风味物质己酸乙酯也高于上层原酒;1-丁醇、醋酸辛酯和庚酸聚集在下层原酒周围,与上层原酒正相关,具体原因有待研究。

a-上下层原酒风味OPLS-DA;b-主要差异风味物质
图2 上下层原酒差异风味物质分析
Fig.2 Analysis of different flavor components of original liquor in the upper and lower layers of the cellar
2.2 上下层糟醅相关指标分析
浓香白酒的窖内发酵是复杂的微生物体系与糟醅相互作用的过程,发酵结束后糟醅的各项指标是发酵过程的综合体现[19]。本研究对比了发酵7 d时上下层糟醅的氧气含量和发酵结束后上下层糟醅的理化指标及有机酸含量(表2)。
表2 上下层糟醅相关指标
Table 2 Indicators of the fermented grains in the upper and lower layers
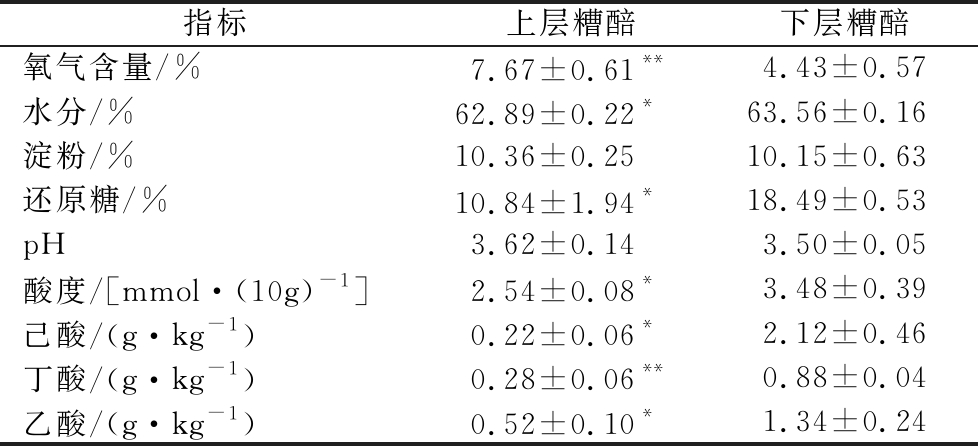
注:用t检验法进行显著性分析,同一行中上层糟醅与下层糟醅对比,**表示差异极显著(P<0.01),*表示差异显著(P<0.05),不标者表示差异不显著(P>0.05)
指标上层糟醅下层糟醅氧气含量/%7.67±0.61**4.43±0.57水分/%62.89±0.22*63.56±0.16淀粉/%10.36±0.2510.15±0.63还原糖/%10.84±1.94*18.49±0.53pH3.62±0.143.50±0.05酸度/[mmol·(10g)-1]2.54±0.08*3.48±0.39己酸/(g·kg-1)0.22±0.06*2.12±0.46丁酸/(g·kg-1)0.28±0.06**0.88±0.04乙酸/(g·kg-1)0.52±0.10*1.34±0.24
结果表明,发酵7 d时,上层糟醅的氧气含量显著高于下层(P<0.05),可能是由于重力作用,下层糟醅孔隙度较小,也可能是由于糟醅发酵过程中产生的黄水富集于窖池底部。上层糟醅的淀粉含量和pH与下层糟醅无明显差异,但水分含量、还原糖含量和酸度显著低于下层(P<0.05),这可能是由于发酵后期下层糟醅浸泡在黄水中,湿度和酸度较高,抑制了某些微生物的代谢活动,降低了还原糖的利用率。
酸类物质是白酒发酵过程中微生物共同作用的结果,是白酒中重要的呈香呈味物质,也是生成对应酯类物质的前体。上层糟醅中的己酸、丁酸、乙酸含量均显著低于下层(P<0.05),这是由于下层糟醅直接接触窖泥且溶氧系数低,有利于窖泥中的己酸菌、梭菌等厌氧菌代谢产生己酸、丁酸等有机酸,加上黄水受重力作用自然下渗等各种因素,导致下层糟醅中有机酸含量显著高于上层,最终会使下层原酒中对应酯类物质含量升高,与上文中下层原酒酯类和酸类物质含量明显高于上层的结论相一致。
2.3 糟醅相关指标与原酒风味相关性分析
从以上结果看,上下层糟醅的相关指标和原酒风味物质含量存在差异,但糟醅指标与原酒中风味物质含量的关系规律不明确,因此通过Spearman相关性分析进一步阐述了糟醅相关指标与原酒风味物质之间的关系,结果见图3。

图3 糟醅相关指标与原酒主要风味物质的相关性分析
Fig.3 Correlation between indicators of fermented grains and key flavor components of original liquor
注:红色代表正相关,蓝色代表负相关,**表示相关极显著(P<0.01),*表示相关显著(P<0.05),不标者表示相关不显著(P>0.05)
糟醅的水分含量与醋酸辛酯、正丁醇和正己醇呈显著负相关,与丁酸乙酯、乳酸乙酯和庚酸乙酯等7种酯以及异丁醇、壬醛等呈显著正相关;pH与异戊酸异戊酯呈显著负相关,与丁酸苯乙酯、己酸和2,4-二叔丁基苯酚呈显著正相关;酸度与正丁醇和正己醇呈显著负相关,与己酸乙酯和丁酸乙酯等5种酯以及癸醛、壬醛等呈显著正相关;还原糖含量与醋酸辛酯和2,4-二叔丁基苯酚呈显著负相关,与乳酸乙酯、乙酸乙酯等5种酯类物质呈显著正相关;氧气含量与己酸乙酯、乙酸乙酯和庚酸乙酯等9种酯以及癸醛、(2,2-二乙氧基乙基)-苯呈显著负相关,与2,4-二叔丁基苯酚呈显著正相关,其中与氧气含量呈负相关的4种己酸酯和庚酸乙酯、壬酸乙酯、癸酸乙酯、异戊酸异戊酯、癸醛5种物质为上层原酒和下层原酒的主要差异风味物质。综上可知,糟醅的水分含量和氧气含量与原酒风味最为相关。主要是由于黄水从上层向下层渗透,有机酸和还原糖等物质向下层迁移,使下层糟醅中香味成分进一步增加,同时由于发酵前期上下层糟醅中氧气含量不同,使得微生物的生长状况、代谢强度存在差异[4],最终导致原酒风味的差异。
2.4 氧气对分离微生物的影响
由上文可知发酵前期氧气含量的差异最终会导致原酒风味的差异,而酿造过程的实质是微生物利用原料中的淀粉、还原糖和蛋白质等营养成分产生有机酸和醇类等物质的过程[3],因此,为探究氧气影响原酒风味的机理,分析了氧气对常见白酒酿造微生物的影响。
由表3可以看出当厌氧培养和振荡培养时,菌株生长量不同,且不同菌株生长量变化趋势不一致。CT、CS、CA、RU等严格厌氧菌,在厌氧条件下生长量较高,而在振荡培养时生长被抑制。LA、SX、BL、BA、PS等兼性厌氧菌在振荡培养时随摇床转速增大生长量增加,但在厌氧培养时显示出不同的生长量变化趋势,其中LA、BL和BA在厌氧培养时生长量显著高于振荡培养(P<0.05),而SX和PS在厌氧培养时生长量显著低于振荡培养(P<0.05)。结果表明,不同微生物对氧气的敏感性有差异,因此发酵前期上下层糟醅氧气含量的差异会导致微生物群落结构的差异,进而造成发酵前期糟醅中代谢产物的差异[4, 20],最终造成原酒风味差异。
表3 氧气含量对分离微生物生长的影响
Table 3 Effects of oxygen content on the growth of isolated microorganisms
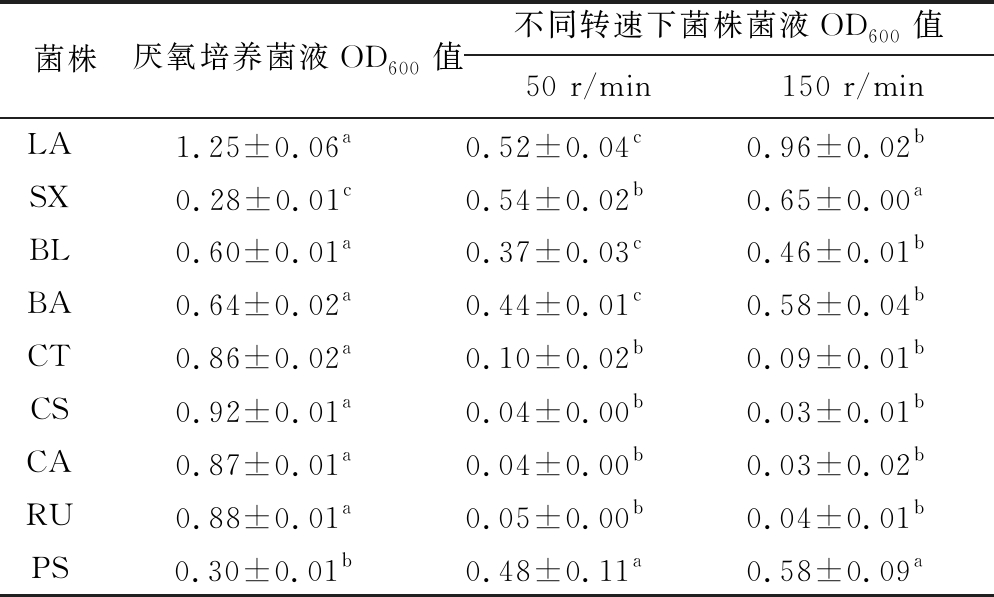
注:同行字母不同表示差异显著(P<0.05)(下同)
菌株厌氧培养菌液OD600值不同转速下菌株菌液OD600值50 r/min150 r/minLA1.25±0.06a0.52±0.04c0.96±0.02bSX0.28±0.01c0.54±0.02b0.65±0.00aBL0.60±0.01a0.37±0.03c0.46±0.01bBA0.64±0.02a0.44±0.01c0.58±0.04bCT0.86±0.02a0.10±0.02b0.09±0.01bCS0.92±0.01a0.04±0.00b0.03±0.01bCA0.87±0.01a0.04±0.00b0.03±0.02bRU0.88±0.01a0.05±0.00b0.04±0.01bPS0.30±0.01b0.48±0.11a0.58±0.09a
2.5 黄水对分离微生物的影响
随发酵的进行窖内氧气含量逐渐降低(一般在发酵14 d后完全耗尽)[11],黄水慢慢在窖池底部沉积,酯类物质开始产生并显著增长[21],为研究发酵后期黄水是否影响了风味物质的产生,探究了黄水对分离微生物的影响。
如表4所示,随培养液中黄水浓度升高菌株生长量下降。当黄水体积分数为0%时,菌株生长量较高;黄水体积分数升至20%时,所有菌株的生长量均显著下降(P<0.05),且除LA生长量降低17.07%外,其余菌株生长量均减少65%以上;当培养液中黄水体积分数升至50%或75%时,LA仍能生长,但生长量显著降低(P<0.05),其余菌株生长均被抑制。徐亚超等[22]研究了黄水的抑菌特性,表明黄水呈酸性时抑菌活性增强,呈碱性时抑菌活性稍有下降,但活性仍较高;盛杰[23]的研究表明黄水在外界条件下抑菌性能几乎没有改变,且随糖添加量和酸度的提升黄水抑菌性能明显提高;郭辉祥等[24]研究了发酵期间黄水成分变化趋势,黄水酸度随发酵时间延长先升高后趋于平缓,发酵35~45 d时,酸度最高。由此可见,黄水具有抑菌性能,且酸度越高抑菌活性越强,与本研究所得结论一致。
表4 黄水对分离微生物生长的影响
Table 4 Effects of yellow water on the growth of isolated microorganisms
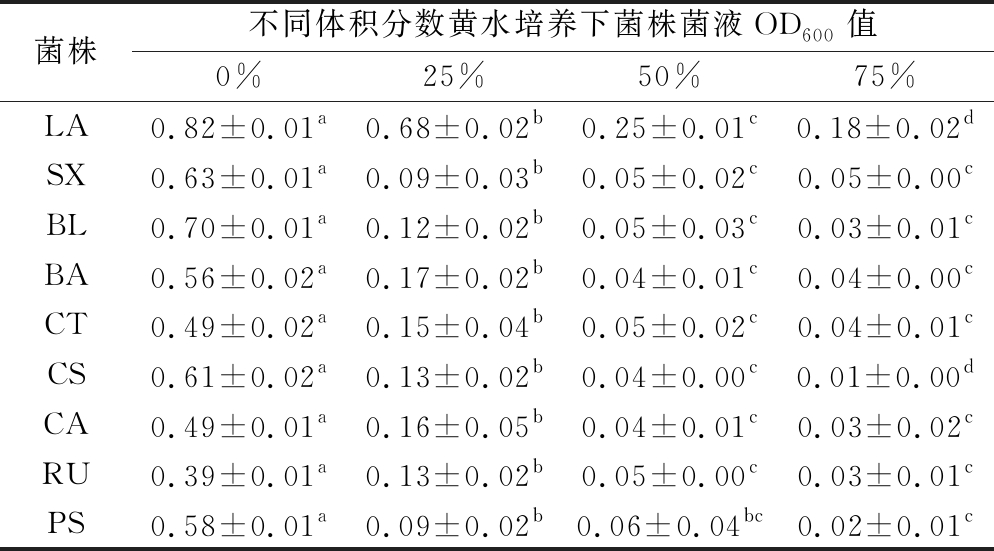
菌株不同体积分数黄水培养下菌株菌液OD600值0%25%50%75%LA0.82±0.01a0.68±0.02b0.25±0.01c0.18±0.02dSX0.63±0.01a0.09±0.03b0.05±0.02c0.05±0.00cBL0.70±0.01a0.12±0.02b0.05±0.03c0.03±0.01cBA0.56±0.02a0.17±0.02b0.04±0.01c0.04±0.00cCT0.49±0.02a0.15±0.04b0.05±0.02c0.04±0.01cCS0.61±0.02a0.13±0.02b0.04±0.00c0.01±0.00dCA0.49±0.01a0.16±0.05b0.04±0.01c0.03±0.02cRU0.39±0.01a0.13±0.02b0.05±0.00c0.03±0.01cPS0.58±0.01a0.09±0.02b0.06±0.04bc0.02±0.01c
综上,发酵后期黄水会对微生物的生长代谢产生影响。发酵20 d左右时,黄水酸度达到最高值的一半[24],下层糟醅中大部分微生物的生长代谢被黄水抑制,风味物质的生成主要与发酵前期微生物产生的酶、酸类、醇类等物质有关,同时黄水中含有大量的酸类和醇类等物质,也有利于下层糟醅中酯类物质的生成;另外,上层糟醅中微生物代谢产生的酸类、醇类和酯类等物质也会渗入到下层糟醅,进一步促进下层糟醅中风味物质的积累,增大了上下层糟醅风味物质含量的差异。
3 结论
本研究分析了浓香白酒生产中上下层原酒风味的特点,并探究了造成上下层原酒差异的主要因素。结果表明,上下层原酒风味存在一定差异,主要表现在上层原酒的酯类、酸类和醛类含量低于下层原酒,醇类和酚类含量高于下层原酒,己酸乙酯、乳酸乙酯和正丁醇等15种物质为引起上层和下层原酒差异的主要风味物质。通过相关性分析确定氧气为引起上下层原酒风味差异的关键因素,发酵前期由于不同微生物对氧气的敏感性不同,上下层氧气含量的差异会造成微生物代谢物差异,氧气含量与引起原酒差异的4种己酸酯和其他5种主要风味物质呈显著负相关。发酵后期,黄水在窖池底部沉积,当黄水浓度达到50%时会抑制大部分微生物的生长,风味物质的生成主要受发酵前期微生物产生的代谢物和黄水的影响。研究结果表明,上下层原酒风味的差异主要受发酵前期的氧气和发酵后期黄水的影响,因此可以通过对发酵前期窖内氧气含量和后期黄水的控制提升上层酒的品质,进而提高优质浓香型原酒的产量。
[1] TAO Y, LI J B, RUI J P, et al.Prokaryotic communities in pit mud from different-aged cellars used for the production of Chinese strong-flavored liquor[J].Applied and Environmental Microbiology, 2014, 80(7):2 254-2 260.
[2] LIU M K, TANG Y M, GUO X J, et al.Structural and functional changes in prokaryotic communities in artificial pit mud during Chinese Baijiu production[J].mSystems, 2020, 5(2):e00829-19.
[3] 王雪山. 不同环境清香类型白酒发酵微生物种群结构比较及溯源解析[D].无锡:江南大学, 2018.
WANG X S.Microbial community structure and microbial source tracking of Chinese light-flavor liquor fermentation in different environments[D].Wuxi:Jiangnan University, 2018.
[4] 沈才萍, 李喆, 敖宗华, 等.泸型酒生产中不同层糟醅微生物与白酒风味的关系[J].四川理工学院学报(自然科学版), 2013, 26(5):14-18.
SHEN C P, LI Z, AO Z H, et al.Relationship between liquor flavor and fermented grain microbes in different depths in the same pit in Luzhou Laojiao[J].Journal of Sichuan University of Science & Engineering(Natural Science Edition), 2013, 26(5):14-18.
[5] 张明珠, 吴学凤, 穆冬冬, 等.不同香型白酒的风味物质及抗氧化作用分析[J].食品工业科技, 2021, 42(11):218-225.
ZHANG M Z, WU X F, MU D D, et al.Analysis of flavoring substances and antioxidant characteristics of different flavor Baijiu[J].Science and Technology of Food Industry, 2021, 42(11):218-225.
[6] 周轩. 浓香型白酒基酒挥发性成分分析及等级识别研究[D].镇江:江苏大学, 2019.
ZHOU X.Analysis of volatile compounds of strong-flavor base liquor and study on grade recognition[D].Zhenjiang:Jiangsu University, 2019.
[7] 应静. 浓香型酒新发酵模式的糟醅微生物群落和代谢产物研究[D].贵阳:贵州大学, 2019.
YING J.Study on microbial communities and metabolites in fermented grains of Luzhou-flavor liquor[D].Guiyang:Guizhou University, 2019.
[8] QIAN W, LU Z M, CHAI L J, et al.Cooperation within the microbial consortia of fermented grains and pit mud drives organic acid synthesis in strong-flavor Baijiu production[J].Food Research International, 2021, 147:110449.
[9] 王晖, 蒲叶, 李霁阳, 等.白酒窖泥中乳酸菌分离鉴定及其发酵产挥发性风味物质比较[J].食品科学技术学报, 2020, 38(1):26-35.
WANG H, PU Y, LI J Y, et al.Isolation and identification of lactic acid bacteria from mud of Baijiu and comparison of fermented volatile flavor compounds[J].Journal of Food Science and Technology, 2020, 38(1):26-35.
[10] 徐勇, 郎召伟, 沈咪娜, 等.泸型酒酿造过程中上层和下层酒醅的有机酸变化分析[J].四川理工学院学报(自然科学版).2018, 31(5):9-13.
XU Y, LANG Z W, SHEN M N, et al.Organic acids dynamics in the upper and bottom layers during Luzhou-flavor Baijiu fermentation[J].Journal of Sichuan University of Science and Engineering (Natural Science Edition), 2018, 31(5):9-13.
[11] 高玲, 许冠生, 张磊, 等.浓香型白酒糟醅发酵过程中主要参数的跟踪研究[J].酿酒科技, 2018(1):47-53.
GAO L, XU G S, ZHANG L, et al.Tracing study of main parameters in the fermentation process of Nongxiang fermented grains[J].Liquor-Making Science & Technology, 2018(1):47-53.
[12] 段明松, 胡晓龙, 曾田, 等.不同空间位置的浓香型原酒中香气成分的差异性分析[J].酿酒科技, 2019(1):126-130;135.
DUAN M S, HU X L, ZENG T, et al.Difference in flavoring components in Nongxiang base liquor from different positions of fermented grains in pit[J].Liquor-Making Science & Technology, 2019(1):126-130;135.
[13] 冯海燕, 李喆, 宋宝, 等.芝麻香不同层酒醅酒风味成分及味感的差异性[J].酿酒科技, 2019(4):88-91;95.
FENG H Y, LI Z, SONG B, et al.Difference in the flavoring components and taste of Zhimaxiang Baijiu produced by fermented grains at different layer[J].Liquor-Making Science & Technology, 2019(4):88-91;95.
[14] 郎召伟. 泸型酒酿造过程中风味物质变化分析[D].无锡:江南大学, 2015.
LANG Z W.Analysis of flavor compounds in the production of Luzhou-flavor liquor[D].Wuxi:Jiangnan University, 2015.
[15] 赵扬扬. 不同窖帽高度和不同封窖方式对浓香型白酒品质的影响研究[D].重庆:重庆大学, 2015.
ZHAO Y Y.Study of pit cap with different heights and different sealing ways impacting on the quality of Luzhou-flavor liquor[D].Chongqing:Chongqing University, 2015.
[16] 高江婧, 任聪, 刘国英, 等.浓香型白酒酒醅风味物质和微生物菌群结构随发酵时间的变化规律[J].食品与发酵工业, 2019, 45(20):1-6.
GAO J J, REN C, LIU G Y, et al.Dynamic changes of flavor compounds and microbial community in fermented grains of Chinese Strong aroma-type Baijiu during fermentation[J].Food and Fermentation Industries, 2019, 45(20):1-6.
[17] 王晴, 朱成诚, 王欣悦, 等.具有生防潜力的枯草芽孢杆菌KC-1培养基及培养条件的优化[J].黑龙江八一农垦大学学报, 2021, 33(4):67-76.
WANG Q, ZHU C C, WANG X Y, et al.Optimization of culture medium and culture conditions of Bacillus subtilis KC-1 with biocontrol potential[J].Journal of Heilongjiang Bayi Agricultural University, 2021, 33(4):67-76.
[18] 王风青, 毕长富, 王川, 等.黄水基质微生物发酵合成γ-聚谷氨酸培养基及条件优化[J].食品工业科技, 2021, 42(11):106-115.
WANG F Q, BI C F, WANG C, et al.Culture medium and condition optimization of γ-polyglutamic acid synthesized by microbial fermentation using yellow water[J].Science and Technology of Food Industry, 2021, 42(11):106-115.
[19] YAN S B, WANG S C, WEI G G, et al.Investigation of the main parameters during the fermentation of Chinese Luzhou-flavour liquor[J].Journal of the Institute of Brewing, 2015, 121(1):145-154.
[20] XIANG W L, LI K, LIU S, et al.Microbial succession in the traditional Chinese Luzhou-flavor liquor fermentation process as evaluated by SSU rRNA profiles[J].World Journal of Microbiology and Biotechnology, 2013, 29(3):559-567.
[21] 张艳艳. 浓香型白酒发酵过程中微生物群落动态变化研究[D].北京:中国科学院大学, 2017.
ZHANG Y Y.Study on dynamic change of microbial community during Luzhou-flavor liquor fermentation[D].Beijing:University of Chinese Academy of Sciences, 2017.
[22] 徐亚超, 盛杰, 刘安军.白酒发酵副产物黄水抑菌特性及稳定性研究[J].食品科学, 2017, 38(15):122-126.
XU Y C, SHENG J, LIU A J.Antimicrobial properties and stability of yellow water, a byproduct of Chinese liquor fermentation[J].Food Science, 2017, 38(15):122-126.
[23] 盛杰. 酿酒黄水抑菌特性的研究[D].天津:天津科技大学, 2016.
SHENG J.Study on antibacterial activity of yellow water-wine fermentation[D].Tianjin:Tianjin University of Science and Technology, 2016.
[24] 郭辉祥, 余东, 龙远兵, 等.发酵期间多粮浓香型白酒窖内黄水成分的变化趋势[J].中国酿造, 2020, 39(1):82-87.
GUO H X, YU D, LONG Y B, et al.Change trend of Huangshui components in multiple-grains strong-flavor Baijiu fermentation pit during the fermentation period[J].China Brewing, 2020, 39(1):82-87.