黄原胶(xanthan gum,XG)又名汉生胶、黄胞胶,是由美国农业部北方研究所在20世纪50年代初,发现并分离得到的一种酸性多糖[1]。目前,它主要是通过野油菜黄单胞菌(Xanthomonas campestris),以玉米淀粉、蔗糖等碳水化合物为主要原料,经过好氧深层发酵得到[2]。1969年,美国食品和药品管理局(Food and Drug Administration,FDA)批准黄原胶可以作为食品添加剂使用[3];1980年,FDA将黄原胶列为安全产品。如今,中国是世界上最大的黄原胶生产国,高品质和多规格是其发展方向。
黄原胶的基本结构为3种单糖组成的重复单元,分别为葡萄糖、甘露糖和葡萄糖醛,其比例为2∶2∶1[4]。由于独特的结构,其具有良好的增稠性、悬浮性和乳化稳定性[5],成为一种具有巨大商业收益及潜在价值的多功能微生物多糖,被广泛应用于食品、工业和医药等行业[6]。所以提高黄原胶产量,如利用表面活性剂等方法以提高其质量一直是研究热点。表面活性剂是一种同时具有亲水性和亲油性的聚合物,能够降低表面和界面张力[7],独特结构使其溶于水后,极少的量就可以显著的改变界面性质,从而产生一系列的应用功能[8]。表面活性剂之所以能够提高多糖产量,主要是由于其能够通过提高细胞膜通透性,增加糖基转移酶活力、促进脂质代谢和溶解脂质分子,从而促进细胞分泌胞外多糖[9-11]。除此之外,表面活性剂还可以提高氧转移,从而改善黄原胶的生产和流变特性,如黏度。据报道,表面活性剂能够提高β-葡聚糖类型的胞外多糖产量,例如普鲁兰多糖[12]和结冷胶[13]等。目前关于表面活性剂对于影响多糖发酵的细胞膜通透性、代谢状态以及结构等方面的具体机制尚不明确。因此利用表面活性剂来提高细胞膜通透性、改善脂质代谢和提高酶的释放,从而达到提高黄原胶产量的目的是具有潜力的可行性方法[14]。
本研究以X.campestris TX53为出发菌株,使用甘油为唯一底物,在高浓度表面活性剂胁迫下进行耐受性驯化,得到具有高耐吐温-80和曲拉通X-100能力的突变株,并对其发酵生产的新型黄原胶的结构、及其所引起的流变特性的改变进行了研究。
1 材料与方法
1.1 实验材料
1.1.1 试验菌种
野油菜黄单胞菌X.campestris CCTCC M2015714、野油菜黄单胞菌X.campestris TX53(由表面活性剂胁迫下驯化筛选获得),均保藏于糖生物制造与生物反应器实验室。
1.1.2 培养基
固体培养基(g/L):甘油100.0,鱼粉蛋白胨5.0,牛肉浸膏3.0,酵母浸膏1.0,琼脂20.0,pH 7.0~7.2。
种子培养基(g/L):甘油100.0,鱼粉蛋白胨5.0,牛肉浸膏3.0,酵母浸膏1.0,pH 7.0~7.2。
摇瓶发酵培养基 (g/L):甘油 80.0,鱼粉蛋白胨 3.0,酵母浸膏 1.5,NaNO3 0.8,MgSO4·7H2O 2.5,FeSO4·7H2O 0.01,K2HPO4·3H2O 3.5,KH2PO4 2.0,pH 7.0~7.2。
基础驯化培养基为种子培养基。驯化过程中培养基中吐温-80的质量浓度以5 g/L为梯度依次增加至50 g/L, 曲拉通X-100质量浓度此基础上以5 g/L为梯度增加至30 g/L,其他成分不变。
1.2 实验试剂
甘油、鱼粉蛋白胨、牛肉浸膏、酵母浸膏、NaOH、HCl、NaNO3、MgSO4·7H2O、FeSO4·7H2O、KH2PO4、K2HPO4·3H2O、无水乙醇、C2HF3O2、CH4O、CHCl3、C4H10O、吐温-80、Triton X-100等试剂均购于国药集团化学试剂有限公司。
1.3 仪器与设备
Sigma 3K15离心机,德国Sigma公司;TU-1810 紫外可见分光光度计,北京普析通用仪器有限责任公司;Quanta200扫描电子显微镜(scanning electron microscopy,SEM),美国FEI公司;Brookfield DV-Ⅱ型旋转黏度计,美国 Brookfield 公司;Scientz-10 N冷冻干燥机,宁波新芝生物科技股份有限公司。
1.4 试验方法
1.4.1 表面活性剂胁迫下野油菜黄单胞菌适应性驯化选育过程
将X.campestris CCTCC M2015714种子培养至生长中期,取5 mL接入含有5 g/L吐温-80的50 mL种子培养液中,连续传代10次。取1 mL种子稀释液涂布至相同固体培养基上,30 ℃恒温培养。挑取大且饱满、色泽鲜亮的菌落。后续培养液中吐温-80以5 g/L 的增量直至50 g/L进行驯化筛选。将上述菌种按照相同方法进行曲拉通X-100胁迫下的耐受性驯化,质量浓度逐渐增加至30 g/L。
1.4.2 遗传稳定性实验
将获得的X.campestris TX53连续传代,于30 ℃、200 r/min下培养120 h,测量每一代新型黄原胶的产量、微生物数量,验证X.campestris TX53的遗传特性。
1.4.3 多糖样品与纯化
发酵结束后稀释发酵液,离心收集上清液,加入无水乙醇,4 ℃过夜。离心收集沉淀,氮吹去除有机试剂,纯水复溶得到粗寡糖。去除残存蛋白,重新醇沉析出多糖,氮吹复溶,冷冻干燥得到纯品[15]。
1.4.4 分析测定方法
1.4.4.1 多糖含量测定
总糖含量测定采用苯酚-硫酸法[16]。酸性多糖含量测定采用间苯二酚法。
1.4.4.2 蛋白含量测定
利用紫外光谱扫描法[17]。
1.4.4.3 产量的测定
发酵液稀释离心后得到上清液中加入无水乙醇析出黄原胶,于40 ℃、0.1 MPa真空干燥至恒重,测量并计算黄原胶产量。
1.4.5 单糖组成分析
准确称取5×10-3 g新型黄原胶样品、2 mg烘至恒重的单糖标准品(葡萄糖、岩藻糖、鼠李糖、阿拉伯糖、半乳糖、木糖、果糖、葡萄糖醛酸和半乳糖醛酸),按照王子朝等[18]的方法,进行单糖标曲的绘制和样品的处理。
1.4.6 红外光谱分析(Fourier-transform infrared spectroscopy,FT-IR)
取1 mg多糖样品粉末与KBr充分混合,采用压片法制样。Nexus 470红外光谱仪对多糖进行扫描[19]。
1.4.7 扫描电子显微镜观察
将冻干的样品固定于金属样品台上,镀膜后用Quanta 200扫描电子显微镜观察拍照,加速电压15 kV。
1.4.8 流变学性能的测定
配制质量浓度为 1、2.5、5、7.5、10 g/L的新型黄原胶和食品级黄原胶溶液,采用 Brookfield DV-Ⅱ 型旋转黏度计于 25 ℃、3号转子、6 r/min下分别测定不同胶浓度下黏度变化,以及测量不同剪切速率的新型黄原胶和食品级黄原胶溶液黏度变化;4、25、50、80、100 ℃下2种溶液黏度变化情况;溶液加热至100 ℃ 30、60、90、120、150、180 min并恢复至室温,测定其黏度变化;在pH分别为1.0、3.0、5.0、7.0、9.0、11.0、13.0时测定2种溶液的黏度变化;在2种溶液中,分别加入不同量的NaCl、MgSO4、KCl和CaCl2,保证4种盐的终质量浓度均为1、2.5、5、7.5、10 g/L,测定其黏度变化。
1.4.9 透明度
配制10 g/L黄原胶溶液,离心30 min去除搅拌溶解过程中裹入的气泡。于600 nm处测量各溶液吸光度,以纯水溶液做空白对照。
1.5 数据处理与分析
所有实验均具有3次平行,实验数据结果以平均值±标准偏差的形式体现。采用Origin 9.1软件绘图。
2 结果与分析
2.1 表面活性剂胁迫下野油菜黄单胞菌驯化筛选
通过多次不间断转接,最终耐受性达到了吐温-80 50 g/L、曲拉通X-100 30 g/L,后通过平板筛选,驯化得到1株可耐受吐温-80 50 g/L、曲拉通X-100 30 g/L-的野油菜黄单胞菌X.campestris TX53,并且活性较好、突变性能稳定。此后的驯化菌特性研究都是采用此突变株为研究对象。
从图1可以看出,驯化株X.campestris TX53生长在50 g/L吐温-80,30 g/L曲拉通X-100的培养基上时,其他条件相同,其形成的菌落明显小于原始菌,生长曲线基本一致,但是生长略滞后于原始菌。根据研究表明,这是由于不同表面活性剂对于菌体毒性不一,能够不同程度的抑制细菌的生长,与对照组相比,所有表面活性剂在添加后都会使得细菌细胞减小,其中曲拉通X-100影响最大,导致细菌的大小发生了明显变化,并且细胞形态由杆状向圆形转变[14]。

a-原始菌种X.campestris CCTCC M2015714未添加表面活性剂的培养基中的菌落形态;b-驯化菌种X.campestris TX53在添加表面活性剂的培养基中的菌落形态;c-原始菌种与驯化菌种的生长曲线
图1 原始菌种与驯化菌种的菌落形态以及生长曲线
Fig.1 The colony morphology and growth curv of original strain X.campestris CCTCC M2015714 and domesticated strain X.campestris TX53
2.2 产量的测定
如图2-a所示,X.campestris TX53在未添加和添加表面活性剂情况下的黄原胶产量均高于X.campestris CCTCC M2015714,产量最高为9.3 g/L,较之前提升了25%~30%。这与两者发酵120 h总糖含量变化的结果一致 (图2-b)。总糖的测定采用苯酚-硫酸法,而发酵液中成分极其复杂,无法精确测定其中某个特定多糖的含量,黄原胶是一种酸性多糖,采用间苯二酚法对其中酸性多糖进行测定,其结果更为精确,并消除了中性多糖的影响。
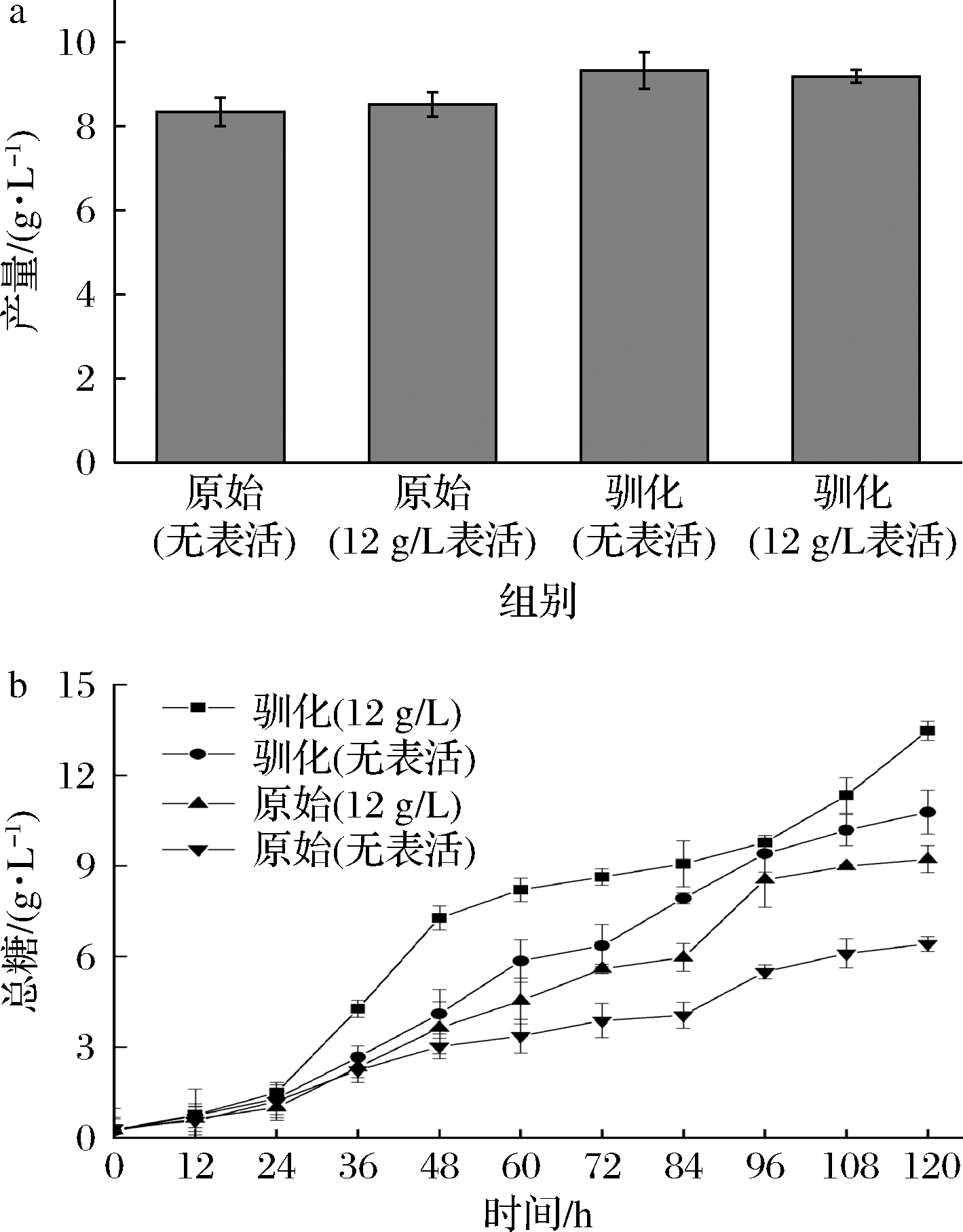
图2 原始菌与驯化菌未添加和添加表面活性剂发酵黄原胶产量
Fig.2 Growth curve of original strain and domesticated strain
2.3 产物组成及结构分析
2.3.1 紫外光谱分析
使用紫外光谱对2种黄原胶溶液在200~300 nm 进行扫描,结果如图3-a所示。结果显示,样品在200 nm处附近出现最大的紫外吸收峰,这也是碳水化合物对紫外可见光的吸收特性,进一步证明发酵产物是多糖。此外,在其他波长处无紫外吸收[20],说明纯化样品中几乎不含核酸和蛋白质,对后续实验不造成影响。
2.3.2 单糖组成分析
在黄原胶的合成过程中,特定的酶和前体物质的缺失可能会导致其有关性质的改变[21-22]。对比图3-b单糖标准品出峰结果,在表面活性剂胁迫下驯化菌种发酵得到新型多糖,只由葡萄糖、甘露糖和葡萄醛酸组成,其摩尔比为2.0∶1.71∶1,与普通食品级黄原胶单糖组成相同,摩尔比例为2.0∶1.84∶1。由此可见,新型多糖的单糖组成和摩尔比与食品级黄原胶基本一致。
2.3.3 红外光谱分析
红外光谱是分析多糖结构的一种重要手段。由图3-c可知,2种黄原胶具有相同的特征吸收峰。在800~1 500 cm-1具有相同的多吸收峰,这是证明黄原胶结构的有效依据;在1 600 cm-1是由于丙酮酸盐的C![]() O伸缩振动引起的;在1 700 cm-1处黄原胶羧基中的C
O伸缩振动引起的;在1 700 cm-1处黄原胶羧基中的C![]() O伸缩振动引起吸收峰;此外,2 900 cm-1和3 200~3 500 cm-1处都显示出特征吸收峰。这些数据与之前的报道一致。由此说明新型黄原胶的糖苷键类型和官能团信息没有改变。
O伸缩振动引起吸收峰;此外,2 900 cm-1和3 200~3 500 cm-1处都显示出特征吸收峰。这些数据与之前的报道一致。由此说明新型黄原胶的糖苷键类型和官能团信息没有改变。

1-阿拉伯糖;2-半乳糖;3-葡萄糖;4-木糖;5-甘露糖;6-半乳糖醛酸;7-葡萄糖醛酸
a-紫外扫描结果;b-单糖组成离子色谱图;c-红外扫描结果
图3 食品级黄原胶和新型黄原胶的紫外光谱、单糖组成以及红外扫描
Fig.3 The UV scanning curve, HPAEC profiles of monosaccharide standard and FT-IR spectra of commercial xanthan and novel xanthan
综合新型黄原胶的红外图谱和单糖组成,与普通食品级黄原胶一致,进一步表明该多糖是黄原胶。
2.3.4 分子质量的测定
由表1可知,原始菌在不添加表面活性剂时,发酵产黄原胶的分子质量为6.7×106 Da,添加适量表面活性剂后,原始菌种产黄原胶的分子质量为1.4×107 Da,而食品黄原胶的分子质量为2.0×107 Da。驯化菌种产黄原胶的分子质量为1.2×107 Da,略低于原始菌种。这与报道[14]一致,在所有情况下,从含有不同表面活性剂的发酵液中,提取纯化得到的黄原胶的分子质量都高于对照组。
表1 不同黄原胶分子质量
Table 1 The molecular weight of different xanthan

黄原胶种类Mw/DaMn/DaPDI原始(无添加表面活性剂)6 736 2961 089 4206.18原始(添加12 g/L表面活性剂)14 394 2714 969 1452.90驯化(添加12 g/L表面活性剂)12 081 8293 281 6383.69普通食品级20 031 8413 199 5086.26
聚合物分散性指数(polymer dispersity index,PDI),常用于描述聚合物分子质量分布。黄原胶作为一种大分子的微生物多糖,可通过PDI=Mw/Mn(Mw为重均分子质量,Mn为数均分子质量),计算其分散性指数。经过聚合物散性指数分析发现,表面活性剂的加入,有效降低了黄原胶分子质量的离散程度,使得到的黄原胶的质量得以提升。
2.3.5 扫描电子显微镜
在本研究中,利用扫描电镜对食品黄原胶与新型黄原胶的微观形态进行研究。图4-a中食品黄原胶的微观结构更致密,表面更光滑,没有孔洞的出现。而图4-b中新型黄原胶的微观表面结构更为粗糙,出现大量分布不均匀的多孔状结构,结构由原始的片状转变为丝状。这表明表面活性剂具有破坏黄原胶胶体结构的能力,可使其产生缺陷、链接键断裂,进而造成凝胶网络弱化、丝状结构产生的现象,达到了黏度降低的效果。这一结果与彭曼曼等[23]报道的,由于多糖表面结构的断裂,导致溶胶黏度降低的结果一致。
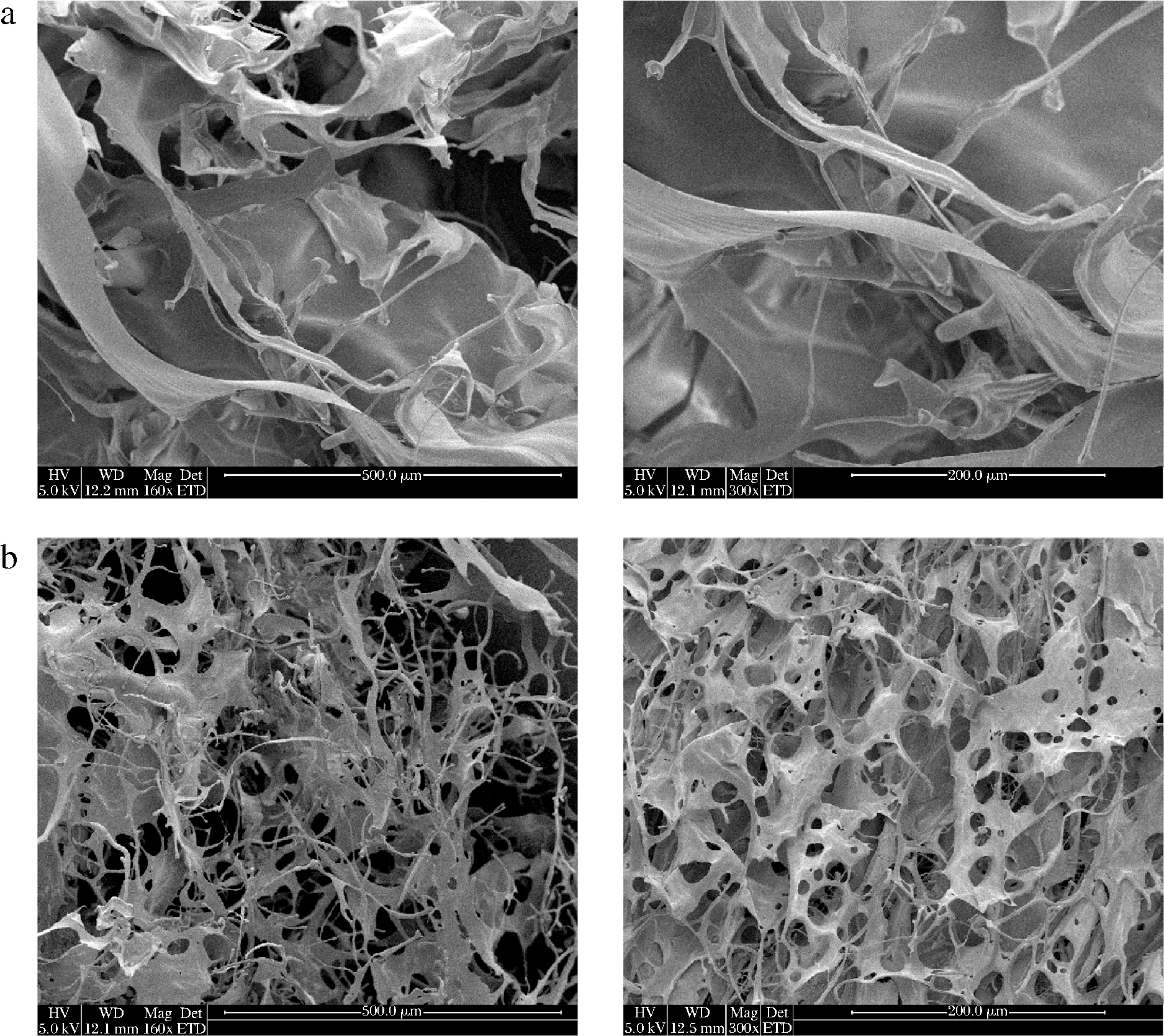
a-食品级黄原胶;b-新型黄原胶
图4 黄原胶SEM图像
Fig.4 SEM images of food grade xanthan and novel xanthan
2.4 流变性能分析
2.4.1 不同胶浓度对溶液黏度的影响
由图5-a可知2种黄原胶溶液的胶浓度与黏度呈正相关,即使新型黄原胶质量浓度达到10 g/L,其黏度才达到2 700 cp左右,远低于同等条件下的食品级黄原胶。
2.4.2 pH对溶液黏度的影响
在pH低于3.0或高于9.0时,黄原胶的侧链基团会发生降解,但是其黏度基本稳定不变。从图5-b可以看出,这种新型黄原胶与普通食品级黄原胶性质一样,在1~13的pH值范围内具有相当稳定的黏度,这说明其对酸碱具有非常良好的稳定性。本实验结果与其他学者的论述观点保持一致。
2.4.3 100 ℃加热不同时间对溶液黏度的影响
由图5-c和图5-d可知,加热不同时间及恢复室温后,2种黄原胶溶液的黏度无显著变化,表明了新型黄原胶与食品级黄原胶同样具有良好耐热性,且在温度冷却至室温后,黏度可快速恢复。这一结果也与文献报道黄原胶所具有的特性一致。

a-胶浓度对黄原胶溶液黏度的影响;b-pH对胶溶液黏度的影响;c-100 ℃加热不同时间对胶溶液黏度的影响;d-恢复至室温后对溶液胶浓度的影响
图5 不同因素对黄原胶溶液黏度的影响
Fig.5 Effect of different factors on the viscosity of food grade xanthan and novel xanthan
2.4.4 盐对溶液黏度的影响
从图6可以看出,食品级黄原胶溶液在加入不同种类的盐之后,表现出良好的盐耐受性,其溶液黏度几乎不受盐浓度影响。而新型黄原胶则表现出特殊的流变学特性,根据CLARKE-STURMAN等[24]的报道,当盐离子质量浓度在1~10 g/L时,溶液黏度呈现上升趋势,这是由于分子链间的非共价键导致的棒状排列的分子结构,促进了相互缠绕,这与食品级黄原胶的结果不一致。

图6 盐对胶溶液黏度的影响
Fig.6 Effect of salt on the viscosity of commercial xanthan and novel xanthan
2.4.5 剪切速率对溶液黏度的影响
由图7可知,2种黄原胶溶液黏度均与剪切速率呈负相关,说明在表面活性剂胁迫下发酵生产的新型黄原胶仍具有假塑性特性。
2.4.6 透明性
黄原胶溶液透明度是衡量其表观性能的重要指标之一,与外观和用途密切相关。多糖的结构、分子质量大小、溶解性和来源等多种因素都会影响其溶液透明度[25]。新型黄原胶透光率最高可达90%以上,远高于食品级黄原胶。图7-c中可以明显看到新型黄原胶溶液清澈透明透明性明显高于食品级黄原胶。新型黄原胶的高透明性可以在牙膏、饮料、酱油和化妆品等产品加工过程形成更好的色泽,提高产品接受度。
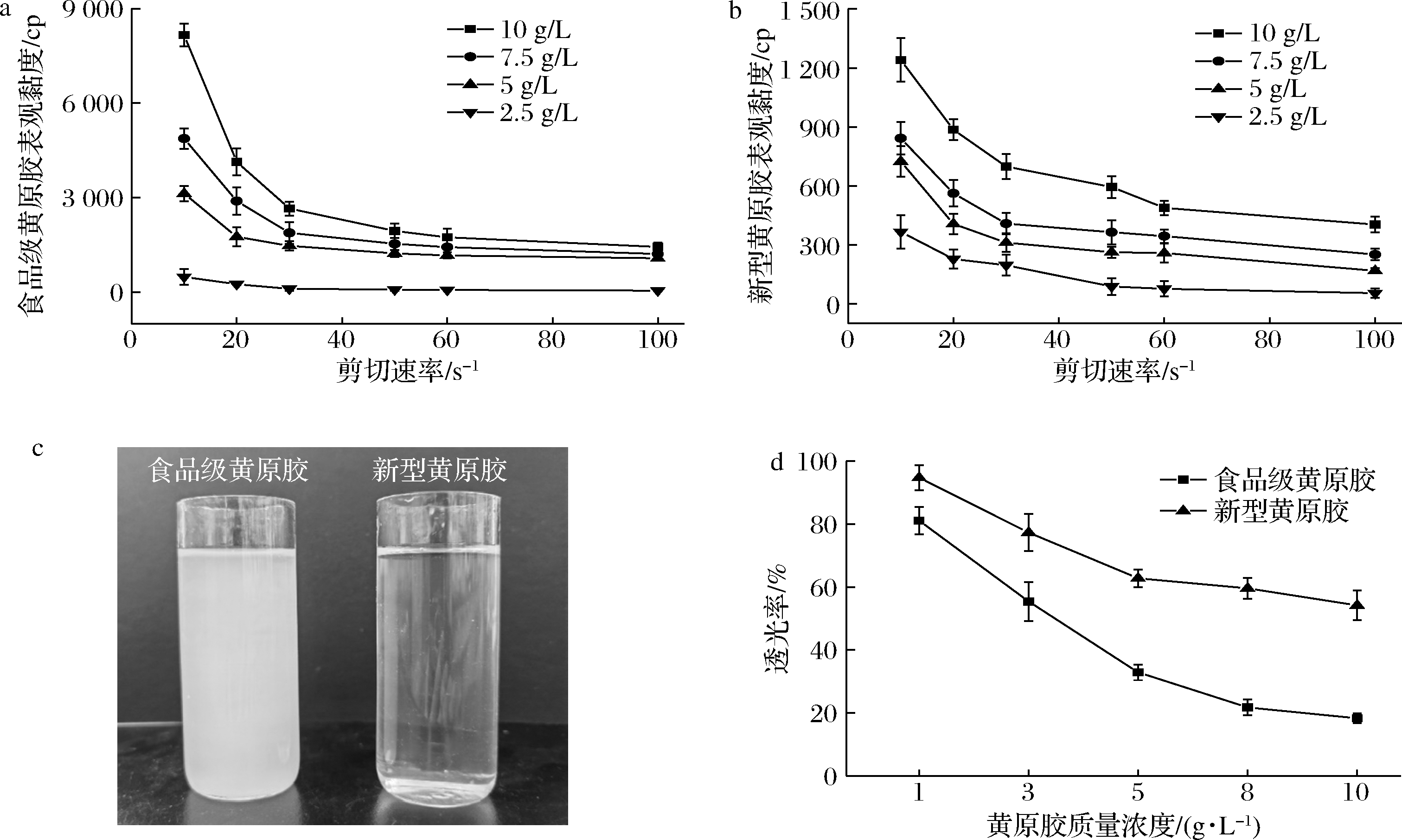
a-剪切速率对食品级黄原胶胶溶液黏度的影响;b-剪切速率对新型黄原胶胶溶液黏度的影响;c-食品级黄原胶和新型黄原胶透明性对比图;d-胶浓度对透明性的影响
图7 剪切速率对黄原胶胶溶液黏度的影响以及食品级黄原胶与新型黄原胶透明性
Fig.7 Influence of shear rate on the viscosity of commercial xanthan and novel xanthan and transparency of food grade xanthan and novel xanthan
3 结论
本研究在表面活性剂胁迫下,以甘油为唯一底物发酵生产黄原胶,采取梯形驯化的方法,结合摇瓶复筛,获得了1株能够耐受50 g/L吐温-80和30 g/L曲拉通X-100的野油菜黄单胞菌优良菌株X.campestris TX53,该菌株在12 g/L表面活性剂质量浓度下发酵120 h,可稳定生产分子质量在1.2×107~2.0×107 Da 的新型黄原胶。经过结构鉴定,新型黄原胶与原始黄原胶的结构一致,但两者的微观表面存在显著差异,食品级黄原胶空间排列整齐紧凑,新型黄原胶空间结构杂乱且疏松,呈现不连续、粗糙的多孔结构,导致了两者之间流变性能的差异。研究结果表明,新型黄原胶仍为剪切变稀流体,即假塑性流体,其溶液的黏度与剪切速率负相关,说明这种新型黄原胶在原料加工和泵送过程中可以通过增大流速而减小阻力。
研究结果显示,通过添加表面活性剂来获得新型多糖具有可行性。该新型黄原胶呈现出的高透明度与流变性能,体现出了其作为功能性多糖的多应用性。此外还需进一步优化培养基组成、探索代谢途径中相关基因的表达,以提高新型黄原胶的产量并探究新型黄原胶的潜在功能性。若作为食品添加剂,在同等条件下高透明低黏度的新型黄原胶可以提高在饮料、膳食纤维等产品中的添加量,进一步确定新型黄原胶作为新型膳食纤维、食品添加剂或抗氧化补充剂的适用性,真正推广到食品中还需进行更多探索与验证。
[1] ROSALAM S, ENGLAND R.Review of xanthan gum production from unmodified starches by Xanthomonas comprestris sp[J].Enzyme & Microbial Technology, 2006, 39(2):197-207.
[2] WANG Z C, WU J R, ZHU L, et al.Activation of glycerol metabolism in Xanthomonas campestris by adaptive evolution to produce a high-transparency and low-viscosity xanthan gum from glycerol[J].Bioresource Technology, 2016, 211:390-397.
[3] RIAZ T, IQBAL M W, JIANG B, et al.A review of the enzymatic, physical, and chemical modification techniques of xanthan gum[J].International Journal of Biological Macromolecules, 2021, 186:472-489.
[4] KUMAR A, RAO K M, HAN S S.Application of xanthan gum as polysaccharide in tissue engineering:A review[J].Carbohydrate Polymers, 2018, 180:128-144.
[5] ZHONG C H, WANG H H, ZHANG L Z, et al.Flotation separation of molybdenite and talc by xanthan gum[J].Powder Technology, 2021, 388:158-165.
[6] SU L, JI W K, LAN W Z, et al.Chemical modification of xanthan gum to increase dissolution rate[J].Carbohydrate Polymers, 2003, 53(4):497-499.
[7] SINGH A, VAN HAMME J D, WARD O P.Surfactants in microbiology and biotechnology:Part 2.application aspects[J].Biotechnology Advances, 2007, 25(1):99-121.
[8] 陈慧卿. 氧杂全氟烷基聚乙二醇系氟碳表面活性剂的合成及性能研究[D].上海:上海交通大学, 2009.
CHEN H Q.Study on synthesis and properties of oxa-perfluoroalkyl end-capped peg-based fluorocarbon surfactants[D].Shanghai Jiao Tong University, 2009.
[9] LI H, XU H, LI S, et al.Optimization of exopolysaccharide welan gum production by Alcaligenes sp.CGMCC2428 with Tween-40 using response surface methodology[J].Carbohydrate Polymers, 2012, 87(2):1 363-1 368.
[10] AROCKIASAMY S, BANIK R M.Optimization of gellan gum production by Sphingomonas paucimobilis ATCC 31461 with nonionic surfactants using central composite design[J].Journal of Bioscience and Bioengineering, 2008, 105(3):204-210.
[11] SILVA C C, DEKKER R F H, SILVA R S S F, et al.Effect of soybean oil and Tween 80 on the production of botryosphaeran by Botryosphaeria rhodina MAMB-05[J].Process Biochemistry, 2007, 42(8):1 254-1 258.
[12] SHENG L, TANG G Y, SU P, et al.Understanding the influence of Tween 80 on pullulan fermentation by Aureobasidium pullulans CGMCC1234[J].Carbohydrate Polymers, 2016, 136:1 332-1 337.
[13] AROCKIASAMY S, BANIK R M.Optimization of gellan gum production by Sphingomonas paucimobilis ATCC 31461 with nonionic surfactants using central composite design[J].Journal of Bioscience and Bioengineering, 2008, 105(3):204-210.
[14] GHASHGHAEI T, SOUDI M R, HOSEINKHANI S, et al.Effects of nonionic surfactants on xanthan gum production:A survey on cellular interactions[J].Iranian Journal of Biotechnology, 2018, 16(1):1 483.
[15] 王子朝, 朱莉, 吴剑荣, 等.以甘油为底物发酵生产新型黄原胶[J].食品与生物技术学报, 2018, 37(10):1 028-1 034.
WANG Z C, ZHU L, WU J R, et al.Production of a new xanthan gum with glycerol as substrate[J].Journal of Food Science and Biotechnology.2018, 37(10):1 028-1 034.
[16] 王如月, 余讯, 徐静静, 等.燕麦β-葡聚糖及其寡糖对肠道菌群结构和代谢的影响[J].食品与发酵工业, 2020, 46(11):85-91;97.
WANG R Y, YU X, XU J J, et al.Effects of oat β-glucan and its oligosaccharides on composition and metabolism of intestinal microorganisms[J].Food and Fermentation Industries, 2020, 46(11):85-91;97.
[17] KUAN Y H, NAFCHI A M, HUDA N, et al.Effects of sugars on the gelation kinetics and texture of duck feet gelatin[J].Food Hydrocolloids, 2016, 58(2):267-275.
[18] 王子朝, 吴剑荣, 朱莉, 等.Xanthomonas campestris CCTCC M2015714以甘油为底物发酵产黄原胶的性质分析[J].生物学杂志, 2017, 34(5):15-19.
WANG Z C, WU J R, ZHU L, et al.Characterization of xanthan gum produced from glycerol by Xanthomonas campestris CCTCC M2015714[J].Journal of Biology, 2017, 34(5):15-19.
[19] PORTERFIELD J Z, ZLOTNICK A.A simple and general method for determining the protein and nucleic acid content of viruses by UV absorbance[J].Virology, 2010, 407(2):281-288.
[20] ROSALAM S, ENGLAND R.Review of xanthan gum production from unmodified starches by Xanthomonas campestris sp.[J].Enzyme and Microbial Technology, 2006, 39(2):197-207.
[21] DONOT F, FONTANA A, BACCOU J C, et al.Microbial exopolysaccharides:Main examples of synthesis, excretion, genetics and extraction[J].Carbohydrate Polymers, 2012, 87(2):951-962.
[22] HAMCERENCU M, DESBRIERES J, POPA M, et al.New unsaturated derivatives of xanthan gum:Synthesis and characterization[J].Polymer, 2007, 48(7):1 921-1 929.
[23] 彭曼曼, 吴思凝, 迪珂君, 等.超声处理对魔芋葡甘聚糖流变与结构的影响[J].食品与发酵工业, 2020, 46(3):152-159.
PENG M M, WU S N, DI K J, et al.Effect of ultrasonic treatment on the rheology and structure of konjac glucomannan[J].Food and Fermentation Industries, 2020, 46(3):152-159.
[24] CLARKE-STURMAN A J, PEDLEY J B, STURLA P L.Influence of anions on the properties of microbial polysaccharides in solution[J].International Journal of Biological Macromolecules, 1986, 8(6):355-360.
[25] 吴琴, 陶瑞霄, 迟原龙, 等.银耳粗多糖的理化特性研究[J].食品科技, 2016, 41(12):149-153.
WU Q, TAO R X, CHI Y L, et al. Physicochemical properties of crude polysaccharides from Tremellafucitormis[J].Food Science and Technology, 2016, 41(12):149-153.