鱼肉经漂洗、斩拌等工艺制成鱼糜,鱼糜富含肌原纤维蛋白,可用于生产鱼丸、鱼糕和鱼酱等产品。鱼糜产品因其营养价值高、味美而备受消费者喜爱。为满足鱼糜产品感官和质构特性多样化,向鱼糜中添加多糖(淀粉、魔芋胶、卡拉胶等)、蛋白质(大豆蛋白、明胶)和酚类化合物(茶多酚)以改善鱼糜凝胶特性[1],利用多糖-蛋白质、蛋白质-蛋白质和多酚-蛋白质相互作用促进凝胶网络结构形成[1]。近年来,人们充分认识到膳食和健康的紧密关联性,在追求食品带来的感官享受同时,更加注重健康膳食和营养功能性。研究者向鱼糜中添加功能性物质(燕麦麸皮[2]、菊粉[3]、β-葡聚糖[4]等)以改善鱼糜凝胶特性,同时增加其营养功能性,以满足鱼糜凝胶产品营养多样化需求。此外,鱼糜产品加工常采用两段式加热法,热诱导蛋白质变性聚集增强表面疏水性,蛋白质结构发生变化,导致蛋白质消化率降低[5],因此蛋白质消化率对评价添加功能性物质的凝胶产品质量具有重要意义。
仙草胶(hsian-tsao gum,HG)主要成分是一种从药食两用草本植物(仙草,又称凉粉草)中提取的阴离子杂多糖,分子呈杆状构象和刚性结构[6],不同于其他商用胶(果胶、黄原胶等)。HG具有良好的生物活性(抗氧化性、降血脂、保肝等活性)[6]和促凝胶性[7],能够与淀粉产生协同增效作用[8],可用于制作的龟苓膏等凝胶产品,产生了巨大经济效益。然而HG在蛋白质凝胶产品中的应用研究较缺乏。近年来,HG与蛋白质相互作用研究引发关注。研究发现HG能够改善畜禽肉蛋白凝胶质构特性,例如增大凝胶弹性、咀嚼性和硬度等,提高持水性[7, 9]。淀粉是鱼糜制品常用的添加物,然而关于HG对淀粉-鱼糜凝胶特性和体外消化性的影响鲜有报道。因此,本实验以淀粉-鱼糜为研究对象,探讨添加HG对淀粉-鱼糜复合凝胶感官特性、凝胶特性(凝胶强度、质构特性、凝胶形成作用力、微观结构)和体外消化性的影响,为HG在淀粉-鱼糜凝胶产品的应用提供理论参考。
1 材料与方法
1.1 材料与试剂
新鲜罗非鱼(体重约1.5 kg),广西钦州市东风市场;仙草胶由实验室自制;小麦淀粉(食品级),上海源叶生物科技公司;牛血清蛋白(生化试剂),上海金穗生物科技有限公司;无水乙醇、氯化钠、尿素、β-巯基乙醇(分析纯),国药集团化学试剂有限公司。
1.2 仪器与设备
CT3质构仪,美国Brookfield公司;Evolution201紫外分光光度计,赛默飞世尔科技(中国)有限公司;BX53荧光显微镜,日本Olympus公司;KN580全自动凯氏定氮仪,济南阿尔瓦仪器有限公司;DS-1高速组织捣碎机,上海标本模型厂。
1.3 实验方法
1.3.1 样品制备
参考LIN等[10]报道方法制备仙草胶,并稍作修改。称取100 g粉碎仙草,加入1 L乙醇(体积分数80%)浸泡,分离沉淀后加入1 L 0.14 mol/L碳酸氢钠溶液,95 ℃浸提120 min,过滤收集上清液,加入无水乙醇至乙醇体积分数为80%、4 ℃过夜,离心(5 000×g,5 min)收集沉淀,复溶、醇沉、离心(重复1次),冻干制得凉粉草胶。仙草胶基本成分分析(干基):多糖(68.21±3.51) g/100g,蛋白质(6.94±0.35) g/100g,脂肪(1.52±0.08) g/100g,灰分(18.36±1.27) g/100g。
参考CHEN等[11]报道方法制备复合鱼糜凝胶,并稍作修改。新鲜罗非鱼去头、皮、内脏、骨刺,清洗(肉水质量比1∶5,搅动10 min)后离心脱水(2 500 r/min,15 min),搅碎(1 800 r/min,2 min),加盐(2.5%,质量分数)斩拌(1 800 r/min,3 min),分别加入仙草胶HG(0.5%、1.0%、2.0%,质量分数)和3.0%(质量分数)淀粉继续斩拌(2 500 r/min,4 min),调整水分含量至80%,灌入塑料肠衣(直径45 mm)、封口。采用二段加热法(40 ℃,30 min;90 ℃,20 min)制备鱼糜凝胶,冰浴、冷却后于4 ℃贮藏过夜,备用。斩拌操作过程采用冰浴控制样品温度不超过10 ℃。所有制备样品的pH为6.9~7.1。未添加仙草胶组设为对照组(HG-0),样品分别为HG-0.5、HG-1、HG-2。
1.3.2 凝胶强度测定
参考文献[3],并稍作修改。用不锈钢圆形刀片将样品切成圆柱体(直径为30 mm,高20 mm),采用质构仪测定。测定条件:压缩模式,TA18球形探头,底座TAPA,压缩距离16 mm,测试速度1.0 mm/s,触发值5.0 g。
1.3.3 质构特性(texture profile analysis,TPA)测定
参考文献[11],并稍作修改。用不锈钢圆形刀片将样品切成圆柱体(直径为30 mm,高20 mm),采用质构仪测定。测定条件:TPA模式,压缩距离10 mm,探头TA11/1000,底座TAPA,测试速度1.0 mm/s,触发值5.0 g。
1.3.4 凝胶形成作用力测定
参考ZHANG等[12]方法测定。
1.3.5 体外消化性测定
参考文献[5],并稍作修改。取1.0 g样品(干基)加入25 mL去离子水,10 000×g均质1 min,分别进行胃蛋白酶和胃蛋白酶+胰蛋白酶消化实验。对于胃蛋白酶消化实验,用1 mol/L HCl将样品调至pH 2.0(胃蛋白酶最适pH),根据样品质量,以1∶100的质量比加入胃蛋白酶(>400个单位/mg的蛋白质), 37 ℃ 振荡消化2 h,然后用1 mol/L NaOH将pH调至7.2灭酶(且为胰蛋白酶最适pH), 离心收集沉淀(10 000×g,20 min)。对于胃蛋白酶+胰蛋白酶消化实验,在完成胃蛋白酶消化实验的基础上,根据样品质量,以1∶50的质量比添加胰蛋白酶(1.645个单位/mg蛋白),37 ℃下振荡消化2 h,调pH>9灭酶,离心收集沉淀(10 000×g,20 min)。样品分解率和样品中蛋白质消化率计算如公式(1)、公式(2)所示(以干基计算):
样品分解率![]()
(1)
蛋白质消化率![]()
(2)
式中:Wi,消化后样品质量,g;Wt,消化前样品质量,g;W0,消化前样品中蛋白质的含量(g/g 样品);W1,消化后样品中蛋白质含量(g/g 样品)。
1.3.6 凝胶微观结构
参考文献[3],并稍作修改。样品切成5 mm×5 mm×5 mm薄片,置于-80 ℃冷冻30 min,然后用组织切片机将其切成10 μm厚,置于载玻片上,用1%溴酚蓝溶液(蛋白染料)染色3 min,用蒸馏水冲洗过量的染料,采用BX53显微镜观察鱼糜凝胶结构,图像采用高清数码相机(DP12)拍摄(10×目镜、10×物镜)。
1.3.7 感官评价
参考文献[4,13],并稍作修改。依据《GB/T 16291.1—2012感官分析 选拔、培训与管理评价员一般导则》,组建感官评价小组。评价小组成员是由年龄为20~35岁,食品专业的5名男性和3名女性组成。感官评价前,评价员熟悉样品特性,并经充分讨论后,确定主要评价指标(弹性、硬度、组织状态、风味、色泽),按表1进行感官评价。
表1 感官评价标准
Table 1 Sensory evaluation criteria

评定项目评定标准分值/分有弹性,稍用力按压表面不裂开,迅速恢复原状11~15弹性有弹性,稍用力按压表面不裂开,缓慢恢复原状6~10弹性尚可,稍用力按压表面裂开1~5第一口咬下去软硬适中11~15硬度第一口咬下去有稍许硬6~10第一口咬下去明显感觉硬,有结实感1~5咸淡适中,无明显的鱼腥味11~15风味咸淡适中,有稍许的鱼腥味6~10咸淡适中,有明显的鱼腥味1~5切面致密,无明显的气孔存在,分布均匀11~15组织状态切面有较小的气孔存在,分布均匀6~10切面有较大的气孔存在,分布不均匀1~5有光亮度,且呈白色,颜色均匀11~15色泽有光亮度,呈灰黑色,颜色均匀6~10呈黑色,颜色不均匀1~5
1.4 数据处理
采用SPSS 19.0软件对3次重复实验数据进行统计分析,显著性水平设为P<0.05,采用Origin 2021进行主成分分析和Pearson相关性分析,并作图。采用Image J软件处理微观结构图并计算孔隙率。
2 结果与分析
2.1 HG对淀粉-鱼糜凝胶感官特性的影响
添加HG对淀粉-鱼糜凝胶感官特性的影响如图1所示。与对照组(HG-0)相比,添加HG可增大淀粉-鱼糜的感官弹性和硬度,其中HG-0.5组鱼糜感官硬度增加12.91%,HG-2组鱼糜感官硬度增大42.12%,其与质构特性中的弹性和硬度变化一致(表2)。添加HG影响淀粉-鱼糜组织状态,与HG、淀粉和鱼糜蛋白质之间相互作用引起的凝胶微观结构变化有关。另外,添加HG减弱淀粉-鱼糜凝胶鱼腥味归因于多糖影响蛋白质与风味成分相互作用,进而影响风味物质的吸附和释放[14]。添加HG降低了鱼糜凝胶白度,但HG可改善鱼糜凝胶质地和风味,且HG具有良好的生物活性,例如抗氧化性、保肝和降血脂等活性[6],在改善鱼糜质地和功能性方面具有较好的应用前景。

图1 添加HG对淀粉-鱼糜凝胶感官特性的影响
Fig.1 Effects of adding HG on sensory properties of starch-added surimi gels
2.2 HG对淀粉-鱼糜凝胶强度的影响
凝胶强度定义为破断力与凹陷深度(形变)的乘积,可作为鱼糜产品质量分级依据。添加HG对鱼糜凝胶破断力、凹陷深度和凝胶强度的影响如图2所示。随着HG添加量增加,鱼糜凝胶强度、破断力和凹陷深度均呈现先增加后减小的趋势,且在HG添加量0.5%时均达最大值。破断力反映鱼糜凝胶强度和抵抗凝胶破裂的能力,形变与凝胶弹性呈现一定的正相关性[15],其形变值变化与表2凝胶弹性变化趋势一致。与对照组相比,添加HG可增强淀粉-鱼糜凝胶破断力、形变和凝胶强度,与HG的亲水性、溶胀性和分散性以及蛋白质-多糖互作有关。HG是一种含糖醛酸结构的阴离子多糖,富含亲水性基团,例如—OH、—COOH等,其与鱼糜蛋白质竞争性结合水分,有效提高鱼糜蛋白质浓度,进而增大凝胶强度,同时HG吸水溶胀对鱼糜基质产生局部压力,促使形成紧凑、稳固的凝胶网络结构[4];HG可作为一种有效填充物,均匀分散到鱼糜凝胶基质中,并与淀粉产生协同作用[8],有效增强凝胶网络结构;另外,HG可与鱼糜蛋白质发生相互作用,例如静电作用、疏水相互作用等,改变蛋白质结构,增强鱼糜凝胶强度[16]。然而,继续增加HG降低了鱼糜凝胶强度和破断力,表明过量HG阻碍鱼糜蛋白质交联,扰乱鱼糜凝胶网络结构形成[13]。研究发现添加酵母β-葡聚糖[4]、可德胶和明胶[11]对鱼糜凝胶破断力和形变值的影响均呈现先增加后减小的趋势,支持本研究结果。结果表明HG在改善淀粉-鱼糜凝胶强度方面具有较好效果。
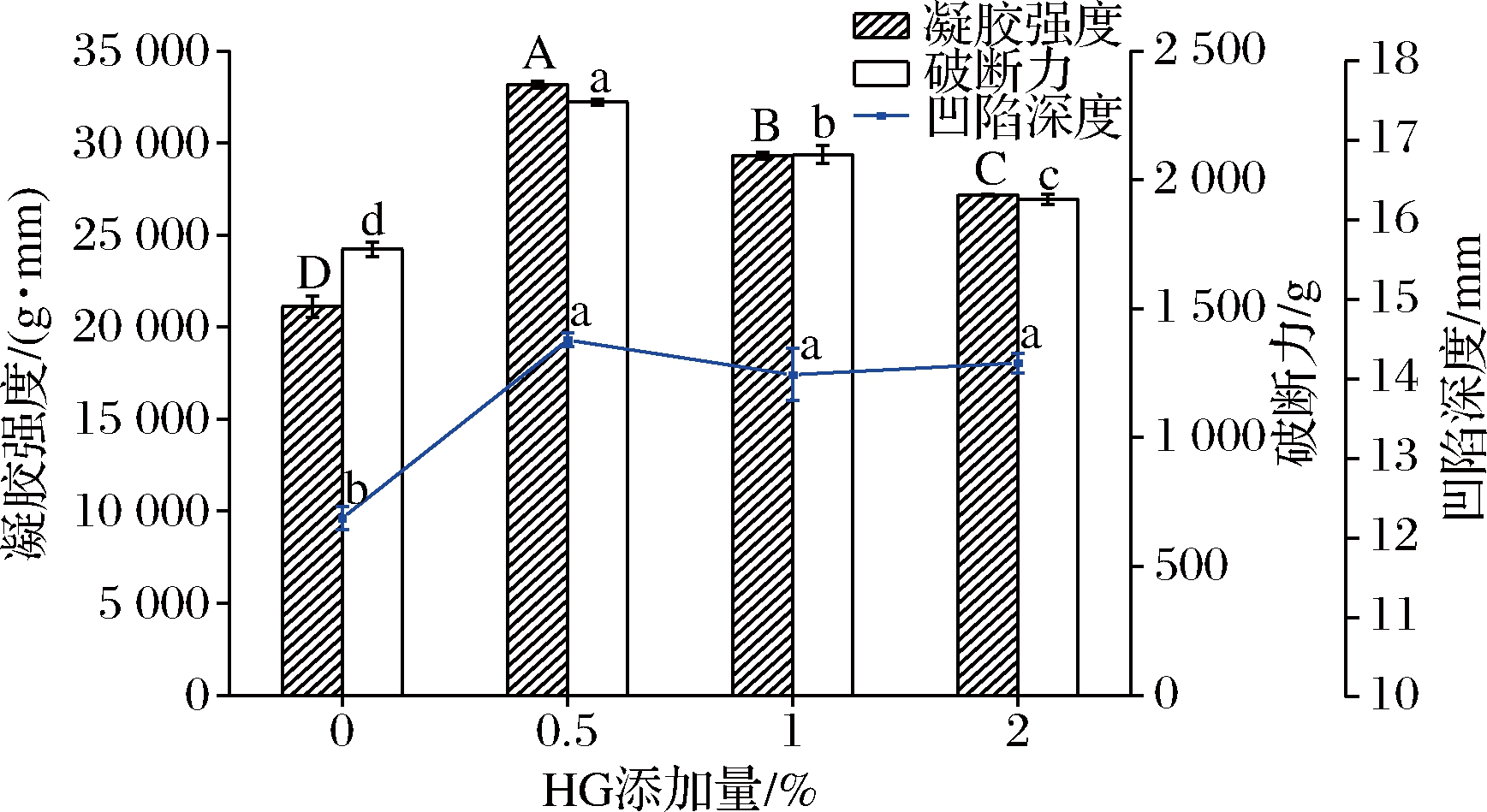
图2 添加HG对淀粉-鱼糜凝胶破断力、陷深度和凝胶强度的影响
Fig.2 Effects of adding HG on breaking force, deformation, gel strength of starch-added surimi gels
注:同一指标不同字母表示差异显著(P<0.05)(下同)
2.3 HG对淀粉-鱼糜凝胶质构特性的影响
添加HG对鱼糜凝胶质构特性的影响如表2所示。与对照组相比,添加HG可改变鱼糜凝胶质构特性,其中硬度、黏性、胶着性和咀嚼性呈现先增加后减小的趋势,而弹性呈现逐渐增加的趋势。添加0.5%HG时鱼糜凝胶硬度、胶着性和咀嚼性均最大,分别较对照组增加11.35%、10.08%和10.74%;添加2.0%(质量分数)HG时凝胶弹性和黏性均最大,分别较对照组增加2.63%和100%。另外,前期试验发现添加HG对不含淀粉的鱼糜凝胶弹性影响无明显差异(P>0.05),而添加HG显著增加鱼糜凝胶弹性(P<0.05),与HG-淀粉-蛋白质3种物质相互作用有关:(1)HG-淀粉相互作用可产生协同效应[8],例如增大淀粉黏弹性;(2)HG-蛋白质[7]、淀粉-蛋白质[17]均发生相互作用。多糖-蛋白质相互作用改变蛋白质结构,增强凝胶网络结构形成作用力(疏水相互作用和二硫键)(图3),改善鱼糜凝胶质构特性;而结冷胶[16]和绿藻硫酸基多糖[13]对鱼糜凝胶弹性无明显影响,结果差异归因于不同结构的多糖-蛋白质相互作用。结果表明HG可改善淀粉-鱼糜凝胶质构特性,具有一定的应用价值。
表2 添加HG对淀粉-鱼糜凝胶质构特性的影响
Table 2 Effects of adding HG on the texture properties of starch-added surimi gels
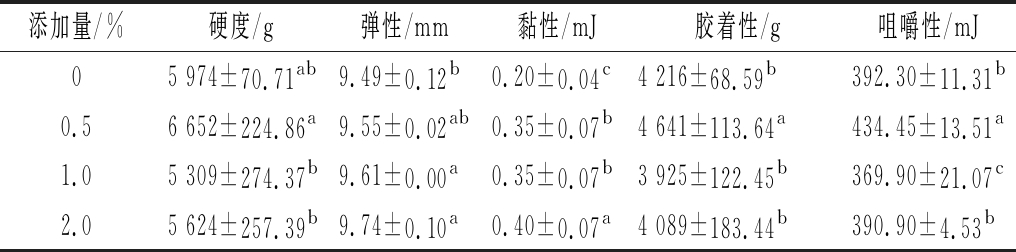
注:同一指标不同字母表示差异显著(P<0.05)(下同)
添加量/%硬度/g弹性/mm黏性/mJ胶着性/g咀嚼性/mJ05 974±70.71ab9.49±0.12b0.20±0.04c4 216±68.59b392.30±11.31b0.56 652±224.86a9.55±0.02ab0.35±0.07b4 641±113.64a434.45±13.51a1.05 309±274.37b9.61±0.00a0.35±0.07b3 925±122.45b369.90±21.07c2.05 624±257.39b9.74±0.10a0.40±0.07a4 089±183.44b390.90±4.53b
2.4 HG对淀粉-鱼糜凝胶形成作用力的影响
图3显示添加HG对淀粉-鱼糜凝胶可溶性蛋白质浓度的影响,间接反映凝胶形成过程中分子间作用力变化[12]。以未添加HG和淀粉的纯鱼糜凝胶为对照,只添加3%淀粉显著增大了凝胶形成二硫键和疏水作用(P < 0.05),表明淀粉和鱼糜蛋白质发生相互作用。亲水性淀粉竞争性减弱蛋白质-水互作,蛋白质疏水性环境增强,蛋白质分子间疏水相互作用增大[18];另外,蛋白质结构改变暴露更多的活性基团,促进了分子间交联形成二硫键[18]。在此基础上添加HG,凝胶形成二硫键呈现先增加后降低趋势,但差异不显著(P>0.05);添加0.5%HG时,凝胶强度、形变和破断力均最大(图1),此时二硫键作用力最大,且疏水作用较HG-0组差异不显著(P>0.05),表明二硫键和疏水相互作用是HG-淀粉-鱼糜凝胶的主要作用力。鱼糜凝胶化过程中,蛋白质分子伸展并形成凝胶网络结构,包络HG、淀粉和水等,且HG和淀粉均吸水溶胀并产生协同增稠效应,压迫蛋白凝胶基质,形成稳固凝胶网络结构[19];然而,过量的HG与淀粉和蛋白质相互作用阻碍蛋白质分子链伸展、聚积和交联[19],减弱二硫键和疏水作用,进而降低凝胶强度,与图1显示结果一致。此外,随着HG和淀粉的加入,鱼糜凝胶形成氢键作用力呈现先降低后升高的趋势,归因于HG和淀粉与鱼糜蛋白质竞争性结合水分,减弱了蛋白质-水相互作用[20],因此氢键作用力减弱,与YUAN等[20]发现脱乙酰魔芋葡甘聚糖减弱鱼糜凝胶氢键作用一致;当添加2%HG 时,HG和淀粉减弱了蛋白质分子间疏水相互作用,蛋白质分子与水分子作用加强,因此氢键作用力增强。随着HG和淀粉的加入,离子键作用力较对照组均降低,表明鱼糜凝胶化过程中蛋白质结构出现破坏[18],受加热温度和添加物(HG、淀粉)等因素影响。因此,添加HG可显著增加淀粉-鱼糜凝胶形成作用力(疏水相互作用和二硫键),增强凝胶网络结构,改善凝胶质构特性。

图3 添加HG对淀粉-鱼糜凝胶形成作用力的影响
Fig.3 Effects of adding HG on the formation force of starch-added surimi gels
注:未添加组表示未添加仙草胶和淀粉的纯鱼糜凝胶
2.5 HG对淀粉-鱼糜凝胶体外消化性的影响
采用体外消化模型,探究添加HG对淀粉-鱼糜凝胶样品分解率和蛋白质消化率的影响,结果如图4所示。随着HG添加量增加,样品分别经胃蛋白酶、胃蛋白酶+胰蛋白酶消化后,样品分解率均呈现先减小后增加的变化趋势,但均显著小于对照组(P<0.05),且均在添加0.5%HG时样品分解率最低。进一步分析样品的蛋白质含量变化,与对照组相比,添加HG显著降低了样品蛋白质消化率(P<0.05),且随着HG添加的增加,样品蛋白质消化率呈现现增加后减小的趋势。另外,经胃蛋白酶+胰蛋白酶消化后的样品分解率和蛋白质消化率均高于胃蛋白酶组。由于添加HG影响复合鱼糜凝胶强度和质构特性,改变凝胶形成作用力和微观结构,进而影响复合鱼糜凝胶的体外分解率和蛋白质消化率。添加0.5%HG时样品体外分解率和蛋白质消化率最低,可能与样品硬度较大有关;SEMEDO等[21]证实了蛋白质消化性与硬度呈现显著负相关性,支持本研究结果。然而,与HG-0组相比,添加HG均降低淀粉-鱼糜凝胶样品分解率和蛋白质消化率,这可能与HG对消化酶(胃蛋白酶、胰蛋白酶)有一定的抑制作用有关。已有研究报道HG对α-淀粉酶和α-葡萄糖苷酶活性产生非竞争性抑制作用[22],然而,HG-消化酶(胃蛋白酶、胰蛋白酶)相互作用研究鲜有报道,后续实验将进一步探讨HG结构特性、消化酶活性和样品消化性之间的关系。此外,添加仙草胶后蛋白质的体外分解率和蛋白质消化率下降,对于鱼糜制品有何益害?研究报道餐后蛋白质的增加取决于摄入蛋白质的消化率,快消化蛋白质(如乳清蛋白)会导致机体不能最佳化利用其分解的氨基酸,而自然慢消化蛋白质(如酪蛋白)不能平衡供给氨基酸[23-24]。BALLEVRE等[23]发明了一种利用阴离子多糖(黄原胶、阿拉伯胶、瓜尔胶等)减慢蛋白质消化速率的方法,旨在将快消化蛋白质转变为慢消化蛋白质,以增加餐后蛋白质的摄入和利用,同时慢消化蛋白质产生的饱腹效应可减少食物摄入量。因此,仙草胶减缓了鱼肉蛋白质消化速率,可增加餐后饱腹感,有利于机体充分吸收利用其分解的氨基酸,对于鱼糜制品有一定益处。

a-样品分解率;b-蛋白质体外消化率
图4 添加HG对淀粉-鱼糜凝胶样品分解率和蛋白质体外消化率的影响
Fig.4 Effects of adding HG on the disintegration and protein digestibility of starch-added surimi gel in vitro
2.6 HG对淀粉-鱼糜凝胶微观结构的影响
添加HG对淀粉-鱼糜凝胶微观结构的影响如图5所示。图5-a~图5-d蓝色部分为鱼糜蛋白质结构,图5-e~图5-h中的白色部分分别为图5-a~图5-d对应的孔隙。添加HG可明显促进聚集结构物质形成,同时凝胶中的孔隙数量(图5-e~图5-h中白色部分)较对照组明显增加,孔隙率大小为:HG-2(19.41%)>HG-0.5(10.36%)>HG-1(9.07%)>HG-0(6.43%),表明HG、淀粉、鱼糜蛋白和水分子间发生相互作用。由于HG和淀粉的强亲水作用,减弱了蛋白质-水相互作用,增大了蛋白质疏水相互作用力,同时,由于相邻蛋白质表面聚集产生排空作用[25],进而促进蛋白质聚集,形成凝胶网络结构。ZHANG等[4]发现β-葡聚糖可增加鱼糜凝胶微观结构孔洞数量和尺寸,支持本研究结果。HG-0和HG-1较HG-0.5和HG-2具有较高的蛋白质体外消化率,与蛋白质形成聚集结构的程度具有一定的关联性;HG-0.5和HG-2微观结构图显示有较多的孔隙,表明HG可促进淀粉-鱼糜蛋白形成更多聚集物,这些聚集物中的蛋白质较难被蛋白酶消化;同时较多聚集物的形成也解释了HG-0.5硬度和HG-2弹性较大的原因。另外HG-0.5具有较大凝胶强度与其形成均一的凝胶网络结构有关,表明添加0.5%HG能够与3%淀粉产生较好协同效应,并作为有效填充物均匀分散到鱼糜凝胶基质中,有效增强凝胶网络结构。因此,添加适量HG可促进鱼糜凝胶网络结构形成,改善凝胶质构特性。

a、e-HG-0;b、f-HG-0.5;c、g-HG-1;d、h-HG-2
图5 添加HG对淀粉-鱼糜凝胶微观结构的影响
Fig.5 Effects of adding HG on the microstructure of starch added surimi gel
注:a~d蓝色部分为鱼糜蛋白质结构,红圈为孔隙结构;e~h分别为a~d对应的孔隙分布图,白色部分代表孔隙
2.7 鱼糜凝胶特性、感官特性与体外消化性相关性分析
经主成分分析,PC1和PC2的总贡献率超过80%,表明主成分分析能较好反映原始高维矩阵数据信息。样品出现在3个不同区域,可分为3组(HG-0;HG-0.5;HG-1和HG-2),表明添加HG显著影响复合鱼糜凝胶特性。凝胶感官弹性与凝胶质构特性(硬度、胶着性和咀嚼性)和疏水相互作用存在正相关性,与质构特性(黏性、弹性)、凝胶强度和二硫键存在负相关性;而凝胶感官硬度与感官弹性存在负相关性。疏水相互作用与凝胶质构特性(硬度、胶着性和咀嚼性)呈现正相关性,二硫键与凝胶质构特性(黏性、弹性)和凝胶强度呈现正相关性。综合分析复合鱼糜凝胶强度、质构特性(硬度、弹性、黏性、胶着性和咀嚼性)、凝胶形成主要作用力(疏水作用、二硫键)、感官特性(硬度-SC、弹性-SC)与凝胶样品分解率和蛋白质消化率之间的关系,结果表明蛋白质消化率与疏水相互作用之间呈现正相关性,与样品硬度、胶着性、咀嚼性、黏性、弹性和凝胶强度呈现负相关性,而蛋白质体外消化率与二硫键呈现负相关性,这与FANG等[26]研究奶酪消化性与硬度、咀嚼性、黏性呈现负相关性结果一致。
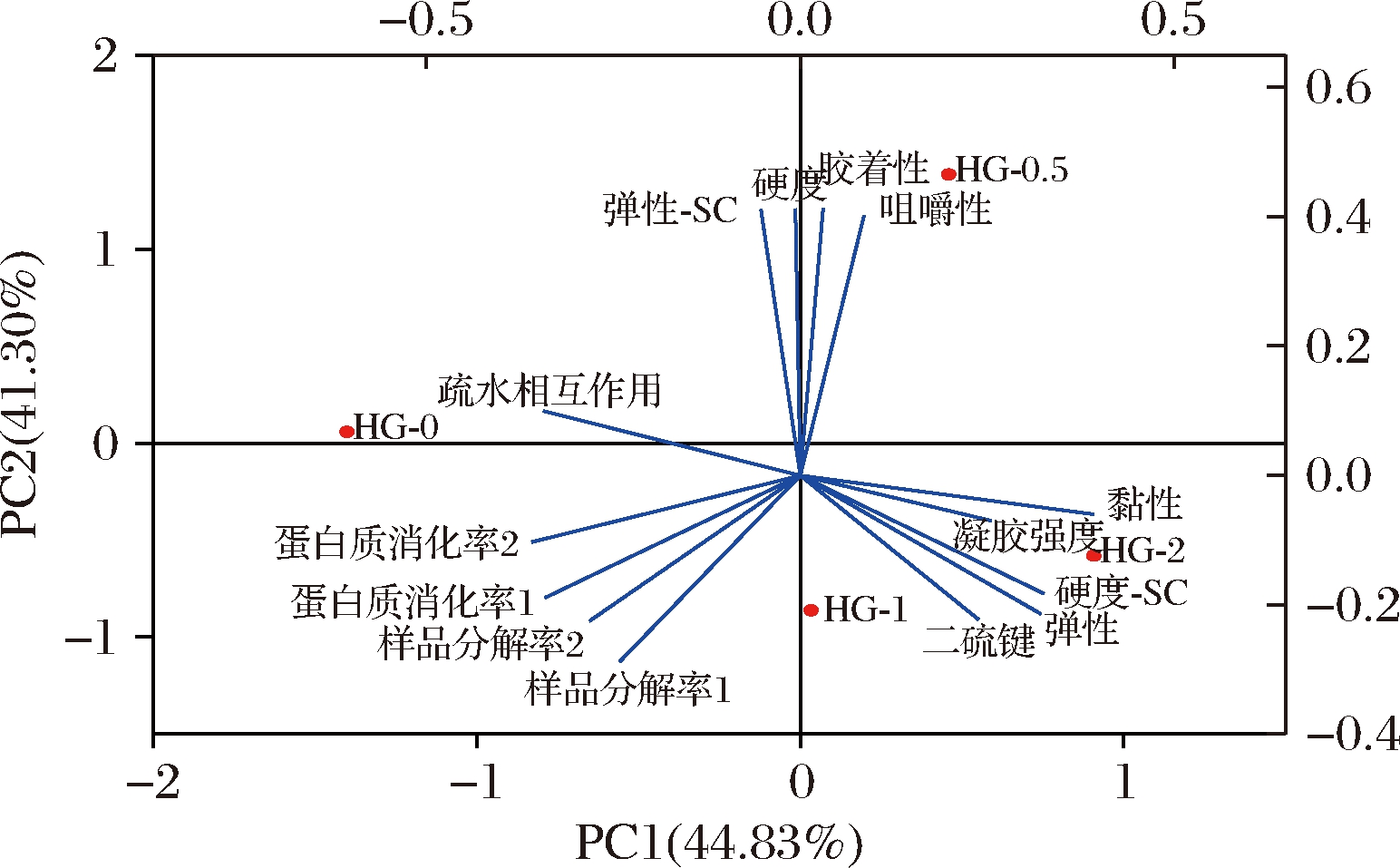
图6 鱼糜复合凝胶特性和消化性之间的主成分分析双标图
Fig.6 Principal components analtysis biplot among gel properties and digestibility of HG and starch-added surimi gel
注:质构特性:硬度、弹性、黏性、胶着性和咀嚼性,感官特性:硬度-SC、弹性-SC,形成作用力:疏水相互作用、二硫键,样品:HG-0、HG-0.5、HG-1、HG-2,样品分解率1和蛋白质消化率1:经胃蛋白酶消化,样品分解率2和蛋白质消化率2:经胃蛋白酶+胰蛋白酶消化
3 结论
研究HG对淀粉-鱼糜复合凝胶感官特性、凝胶特性(凝胶强度、质构特性、凝胶形成作用力、微观结构)和体外消化性的影响,并进行相关性分析。添加HG可改善鱼糜凝胶质地和风味,增加淀粉-鱼糜凝胶破断力、形变和凝胶强度,且添加0.5%HG时达最大值。添加HG可促进蛋白质聚集,增加淀粉-鱼糜凝胶形成作用力(疏水相互作用和二硫键),增强凝胶网络结构,改善淀粉-鱼糜凝胶质构特性,表现为凝胶硬度、弹性、黏性、胶着性和咀嚼性均增大,添加0.5%(质量分数)HG时淀粉-鱼糜凝胶硬度、胶着性和咀嚼性均最大。添加HG降低了淀粉-鱼糜凝胶体外分解率和蛋白质消化率,与凝胶结构特性有关。经主成分分析发现,疏水相互作用与样品硬度、胶着性和咀嚼性呈现正相关性,二硫键与样品弹性、黏性和凝胶强度呈现正相关性;样品分解率和蛋白质消化率与疏水相互作用之间呈现正相关性,与样品硬度、胶着性、咀嚼性、黏性、弹性和凝胶强度呈现负相关性。因此,HG可改善淀粉-鱼糜凝胶感官特性和凝胶结构特性,具有潜在的应用价值。后续实验将进一步从HG结构特性和HG-消化酶相互作用两个角度探讨HG对鱼糜凝胶结构特性和消化性的影响机制,为HG在淀粉-鱼糜凝胶中的应用提供参考。
[1] RAMíREZ J A, URESTI R M, VELAZQUEZ G, et al.Food hydrocolloids as additives to improve the mechanical and functional properties of fish products:A review[J].Food Hydrocolloids, 2011, 25(8):1 842-1 852.
[2] ALAKHRASH F Q, ANYANWU U, TAHERGORABI R.Physicochemical properties of Alaska pollock (Theragra chalcograma) surimi gels with oat bran[J].Lwt - Food Science and Technology, 2016, 66:41-47.
[3] HUANG J L, YE B B, WANG W, et al.Incorporation effect of inulin and microbial transglutaminase on the gel properties of silver carp (Hypophthalmichthys molitrix) surimi[J].Journal of Food Measurement and Characterization, 2021, 15(1):1-11.
[4] ZHANG H M, XIONG Y T, BAKRY A M, et al.Effect of yeast β-glucan on gel properties, spatial structure and sensory characteristics of silver carp surimi[J].Food Hydrocolloids, 2019, 88:256-264.
[5] SANTE-LHOUTELLIER V, AUBRY L, GATELLIER P.Effect of oxidation on in vitro digestibility of skeletal muscle myofibrillar proteins[J].Journal of Agricultural and Food Chemistry, 2007, 55(13):5 343-5 348.
[6] TANG W, CHEN X X, LIU D, et al.Bioactive components of Mesona Blume and their potential health benefits[J].Food Reviews International, 2020:1-16.
[7] 栗俊广, 李可, 柳红莉, 等.仙草多糖对鸡肉肌原纤维蛋白凝胶性能的影响[J].食品工业, 2017, 38(1):134-137.
LI J G, LI K, LIU H L, et al.Effects of hsian-tsao polysaccharide on gel properties of chicken myofibrillar proteins[J].The Food Industry, 2017, 38(1):134-137.
[8] REN Y M, RONG L Y, SHEN M Y, et al.Interaction between rice starch and Mesona chinensis Benth polysaccharide gels:Pasting and gelling properties[J].Carbohydrate Polymers, 2020, 240:116316.
[9] 程伟伟, 栗俊广, 蒋爱民, 等.仙草胶对贡丸的流变特性、感官品质和抗氧化能力的影响[J].食品科技, 2015, 40(2):282-286.
CHENG W W, LI J G, JIANG A M, et al.Effects of Hsian-tsao gum on rheological property, sensory quality and antioxidant activity of Chinese-style meatball[J].Food Science and Technology, 2015, 40(2):282-286.
[10] LIN L H, XIE J H, LIU S C, et al.Polysaccharide from Mesona chinensis:Extraction optimization, physicochemical characterizations and antioxidant activities[J].International Journal of Biological Macromolecules, 2017, 99:665-673.
[11] CHEN J X, DENG T Y, WANG C, et al.Effect of hydrocolloids on gel properties and protein secondary structure of silver carp surimi[J].Journal of the Science of Food and Agriculture, 2020, 100(5):2 252-2 260.
[12] ZHANG T, LI Z J, WANG Y M, et al.Effects of konjac glucomannan on heat-induced changes of physicochemical and structural properties of surimi gels[J].Food Research International, 2016, 83:152-161.
[13] ALIPOUR H J, REZAEI M, SHABANPOUR B, et al.Effects of sulfated polysaccharides from green alga Ulva intestinalis on physicochemical properties and microstructure of silver carp surimi[J].Food Hydrocolloids, 2018, 74:87-96.
[14] CAO J X, ZHOU C Y, WANG Y, et al.The effect of oxidation on the structure of G-actin and its binding ability with aroma compounds in carp grass skeletal muscle[J].Food Chemistry, 2018, 240:346-353.
[15] HU Y Q, LIU W J, YUAN C H, et al.Enhancement of the gelation properties of hairtail (Trichiurus haumela) muscle protein with curdlan and transglutaminase[J].Food Chemistry, 2015, 176:115-122.
[16] PETCHARAT T, BENJAKUL S.Effect of gellan incorporation on gel properties of bigeye snapper surimi[J].Food Hydrocolloids, 2018, 77:746-753.
[17] YANG C H, ZHONG F, GOFF H D, et al.Study on starch-protein interactions and their effects on physicochemical and digestible properties of the blends[J].Food Chemistry, 2019, 280:51-58.
[18] MI H B, WANG C, SU Q, et al.The effect of modified starches on the gel properties and protein conformation of Nemipterus virgatus surimi[J].Journal of Texture Studies, 2019, 50(6):571-581.
[19] SUN F Y, HUANG Q L, HU T, et al.Effects and mechanism of modified starches on the gel properties of myofibrillar protein from grass carp[J].International Journal of Biological Macromolecules, 2014, 64:17-24.
[20] YUAN L, YU J M, MU J L, et al.Effects of deacetylation of konjac glucomannan on the physico-chemical properties of surimi gels from silver carp (Hypophthalmichthys molitrix)[J].RSC Advances, 2019, 9(34):19 828-19 836.
[21] SEMEDO TAVARES W P, DONG S Y, YANG Y H, et al.Influence of cooking methods on protein modification and in vitro digestibility of hairtail (Thichiurus lepturus) fillets[J].LWT, 2018, 96:476-481.
[22] YURIS A, HARDACRE A K, GOH K K T, et al.The role of calcium in wheat starch-Mesona chinensis polysaccharide gels:Rheological properties, in vitro digestibility and enzyme inhibitory activities[J].LWT, 2019, 99:202-208.
[23] BALLEVRE O, GARCIA-RODENAS C L, REIFFERS-MAGNANI K, et al. Protein material for slow digestion and its use: United States, US6355612[P]. 2002-03-12.
[24] BOIRIE Y, DANGIN M, GACHON P, et al.Slow and fast dietary proteins differently modulate postprandial protein accretion[J].Proceedings of the National Academy of Sciences of the United States of America, 1997, 94(26):14 930-14 935.
[25] TUINIER R, DHONT J K G, DE KRUIF C G.Depletion-induced phase separation of aggregated whey protein colloids by an exocellular polysaccharide[J].Langmuir, 2000, 16(4):1 497-1 507.
[26] FANG X X, RIOUX L E, LABRIE S, et al.Disintegration and nutrients release from cheese with different textural properties during in vitro digestion[J].Food Research International, 2016, 88:276-283.