糯米酒是我国传统发酵酒之一,其酿造过程多采用开放式发酵,故酿造过程形成了复杂的微生物环境,拥有丰富的微生物资源[1],从中筛选出对酒风味物质形成和成品酒品质起作用的性能良好菌株已成为酿酒行业重要研究方向之一。
贝莱斯芽孢杆菌是芽孢杆菌属中的新种,广泛存在于土壤、水体、空气等自然环境中[2]。国内外科学家也相继从白酒[3]、豆豉[4]等发酵食品中分离筛选出贝莱斯芽孢杆菌。研究表明:贝莱斯芽孢杆菌具有生长繁殖速率快、抗逆性强、产酶能力强等特点,可作为发酵剂等应用于食品生产中[5],具有广阔应用前景。但是芽孢杆菌在其应用过程中的安全风险仍未明确。刘纯等[6]以商用益生芽孢杆菌为基础,对其安全性展开研究,结果显示被检测菌株都携带有一种或多种肠毒素基因。欧洲某饲料添加剂中的蜡状芽孢杆菌因携带含tetB基因的质粒,存在潜在的安全风险而被停止使用[7]。由此可见,贝莱斯芽孢杆菌生物安全性评价仍是值得深入探讨的科学问题,对其后续进一步深入研究与资源开发尤为必要。
本实验室前期从糯米酒中分离得到抗逆性强且产蛋白酶特性优良的贝莱斯芽孢杆菌共4株,但尚不了解其生物安全性,为充分开发其使用价值,本文从耐药性检测、耐药质粒检测、溶血实验、毒力基因PCR检测4个方面开展体外安全性评价,以期为糯米酒中贝莱斯芽孢杆菌菌株资源的挖掘与利用奠定科学基础。
1 材料与方法
1.1 材料与试剂
实验菌株:贝莱斯芽孢杆菌B1、B2、B7、B8,均为本实验室前期从糯米酒中分离得到。参照美国临床实验室标准化委员会标准,实验对照用标准菌株:金黄色葡萄球菌(Staphylococcus aureus ATCC 25923),南京茂捷微生物科技有限公司。
细菌基因组DNA提取试剂盒,北京索莱宝科技有限公司;Plasmid Minikit试剂盒,美国OMEGA Bio-tek公司;哥伦比亚血平板,广东环凯微生物科技有限公司;药敏纸片(四环素、庆大霉素、卡那霉素、万古霉素、红霉素、氯霉素、链霉素),杭州微生物试剂有限公司。
1.2 仪器与设备
ALLEGRA-64R台式高速冷冻离心机,美国贝克曼库尔特有限公司;SY-1220恒温水浴锅,美国精骐有限公司;EPOCH-2 721BR超微量酶标仪,美国伯腾仪器有限公司;FlexCycler2 PCR仪,德国耶拿分析仪器股份公司;DYY-7C凝胶电泳仪,北京六一生物科技有限公司;721BR 16103凝胶成像系统,美国 Bio-Rad 公司;GR60DA全自动灭菌锅,致微(厦门)仪器有限公司;SW-CJ-1FD超净工作台,苏州安泰空气技术有限公司;ME104电子分析天平,梅特勒—托利多精密仪器公司;LRH-150恒温培养箱,上海一恒科学仪器有限公司;428830数显式游标卡尺,宁波长城精工实业有限公司。
1.3 材料与试剂
1.3.1 贝莱斯芽孢杆菌菌液的制备
将4株贝莱斯芽孢杆菌接种于LB液体培养基中,37 ℃、160 r/min下活化2代后待用。
1.3.2 耐药性检测
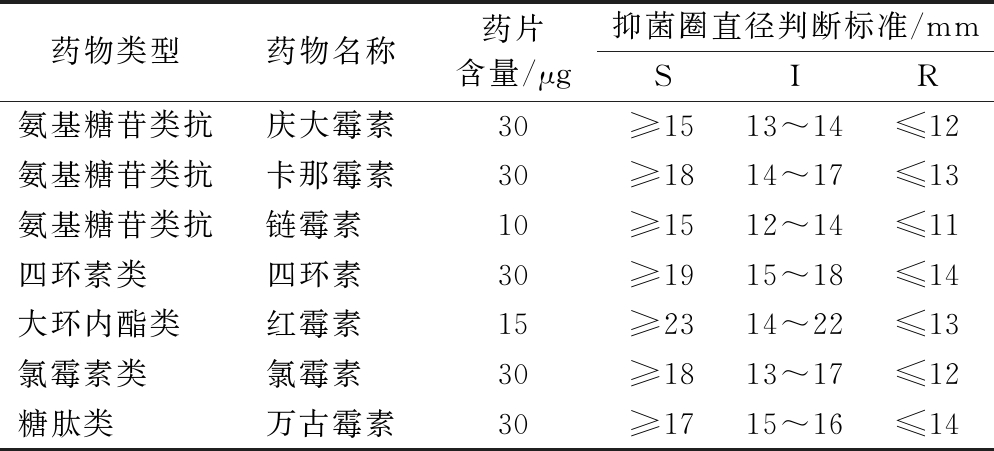
根据文献方法[8],适当修改如下:采用药敏纸片扩散法对本研究实验菌株进行药敏分析。实验使用的药敏纸片种类为庆大霉素、卡那霉素、链霉素、四环素、红霉素、氯霉素、万古霉素共7种。参照美国临床实验室标准化委员会标准[9],通过测量各药敏试纸产生的抑菌圈直径大小判断菌株对不同抗生素的敏感性,如表1所示。
表1 耐药性检测实验判断标准
Table 1 Criteria for classification of the drug resistance types
注:S为敏感,I为中度敏感,R为耐药(下同)
药物类型药物名称药片含量/μg抑菌圈直径判断标准/mmSIR氨基糖苷类抗庆大霉素30≥1513~14≤12氨基糖苷类抗卡那霉素30≥1814~17≤13氨基糖苷类抗链霉素 10≥1512~14≤11四环素类 四环素 30≥1915~18≤14大环内酯类 红霉素 15≥2314~22≤13氯霉素类 氯霉素 30≥1813~17≤12糖肽类 万古霉素30≥1715~16≤14
1.3.3 耐药质粒检测
根据文献方法[6],适当修改如下:使用Plasmid Minikit试剂盒对上述药敏实验分析结果中呈耐药结果的菌株进行质粒提取。以不含质粒的大肠杆菌DH5α为阴性对照,以含质粒的大肠杆菌PET-28a为阳性对照,使用0.8%(质量浓度)的琼脂糖凝胶电泳检测质粒存在情况。
1.3.4 溶血实验
根据文献方法[10],取本研究实验菌株于血琼脂培养基上接种,37 ℃培养14~18 h,观察是否产生溶血环。若菌落四周出现草绿色环,则为α-溶血;若菌落四周出现透明溶血环,则为β-溶血;若菌落四周无任何变化,则为γ-溶血,即不溶血。
1.3.5 毒力基因PCR检测
根据文献方法[6],采用PCR扩增技术对本研究实验菌株进行芽孢杆菌常见毒力基因检测,检测的毒力基因包括与肠毒素相关的溶血性肠毒素Hbl(hblA、hblC、hblD)、非溶血性肠毒素Nhe(nheA、nheB、nheC)、肠毒素T(bceT)、细胞毒素K(cytK)基因以及与呕吐毒素相关的ces和cer基因。通过检测实验菌株中所含毒力基因的情况,对菌株的安全性进行评价。
1.4 数据处理与统计分析
耐药性检测结果使用SPSS 25.0软件的单因素方差分析(analysis of variance,ANOVA)程序对数据进行显著性分析,使用Fisher氏最小显著差检验法进行多重比较,以P<0.05作为差异显著性判断标准。数据的表示方式为平均值±标准偏差![]()
2 结果与分析
2.1 耐药性检测结果与分析
为评估实验室筛选所得的贝莱斯芽孢杆菌的安全性,本文使用了庆大霉素、卡那霉素、链霉素、四环素、红霉素、氯霉素以及万古霉素等7种抗生素进行测定。由表2可知,对照菌株金黄色葡萄球菌对7种抗生素均敏感;4株贝莱斯芽孢杆菌对庆大霉素、卡那霉素、链霉素、红霉素、氯霉素、万古霉素敏感;菌株B1、B7、B8对四环素中度敏感,菌株B2对四环素耐药。这与高艳侠[11]和AMOAH等[12]对贝莱斯芽孢杆菌进行耐药性检测实验结果基本一致,前者研究表明贝莱斯芽孢杆菌LF01对庆大霉素、卡那霉素、链霉素、红霉素、氯霉素、万古霉素和四环素皆敏感;后者对贝莱斯芽孢杆菌GPSAK4进行耐药性检测,表明GPSAK4对庆大霉素、卡那霉素、红霉素、氯霉素、万古霉素、四环素敏感。这可能是由于氨基糖苷类抗生素庆大霉素、卡那霉素、链霉素可与细菌核糖体的30S亚基形成不可逆结合[13],大环内酯类抗生素红霉素和氯霉素类氯霉素可透过细胞膜与细菌核糖体的50S亚基形成可逆结合[14],来抑制细菌蛋白质合成;糖肽类抗生素万古霉素可通过作用于细胞壁上的D-丙氨酰-D-丙氨酸、阻碍多肽的形成,来干扰细菌细胞壁的合成[15],从而对细菌起到抑制作用。
表2 药敏实验判断结果 单位:mm
Table 2 Results of drug sensitivity test

注:括号内字母为耐药性判断结果;药敏纸片直径为6.35 mm
菌株编号庆大霉素卡那霉素链霉素四环素红霉素氯霉素万古霉素B119.98±0.57(S)21.66±0.39(S)17.95±0.88(S)15.01±0.75(I)23.06±1.00(S)25.44±0.49(S)21.14±0.51(S)B221.49±0.83(S)21.87±0.02(S)17.02±0.65(S)13.34±0.59(R)24.31±1.14(S)24.13±0.70(S)20.77±0.50(S)B723.26±0.37(S)23.56±0.20(S)17.65±0.59(S)15.01±0.24(I)23.43±0.42(S)25.95±0.72(S)21.13±0.88(S)B824.94±0.92(S)23.80±0.20(S)18.47±0.24(S)14.01±0.18(I)23.09±0.63(S)26.12±0.98(S)21.54±0.65(S)金黄色葡萄球菌26.77±0.66(S)29.44±1.33(S)21.46±1.54(S)27.26±0.68(S)29.96±0.53(S)32.15±1.29(S)18.17±1.65(S)
4株贝莱斯芽孢杆菌对同一种抗生素敏感程度有所差异。如图1-a所示,4株贝莱斯芽孢杆菌对庆大霉素、卡那霉素、四环素、红霉素、氯霉素的耐药性均呈显著差异(P<0.05),对链霉素、万古霉素的耐药性则无显著差异(P>0.05)。庆大霉素对B8的抑制效果最强,对B7的抑制效果次之,对B1、B2的抑制效果最弱,且庆大霉素对金黄色葡萄球菌的抑制效果与B1、B2、B7、B8呈显著性差异(P<0.05);卡那霉素对B7、B8的抑制效果最强,对B1、B2的抑制效果最弱,且卡那霉素对金黄色葡萄球菌的抑制效果与4株菌皆呈显著性差异(P<0.05);四环素对B1的抑制效果最强,对B2的抑制效果最弱;四环素对金黄色葡萄球菌的抑制效果与4株菌株皆呈显著性差异(P<0.05);红霉素对B2的抑制效果最强,对B7的抑制效果次之,对B8、B1的抑制效果最弱,红霉素对金黄色葡萄球菌的抑制效果与4株菌株皆呈显著性差异(P<0.05);氯霉素对B8的抑制效果最强,对B7、B1的抑制效果次之,对B2的抑制效果最弱,且氯霉素对对金黄色葡萄球菌的抑制效果与4株菌株皆呈显著性差异(P<0.05)。
7种抗生素对同一菌株的抑制效果亦有所不同。如图1-b所示,氯霉素对4株菌的抑制效果最强,四环素对4株菌的抑制效果最弱。此外,红霉素与氯霉素对B2、庆大霉素与氯霉素对B8的抑制效果无显著差异(P>0.05),说明红霉素对B2、庆大霉素对B8的抑制效果也是最强的。

a-不同菌株同一抗生素的耐药性分析;b-不同抗生素同一菌株的耐药性分析
图1 药敏实验判断结果
Fig.1 Results of drug sensitivity test
随着抗生素的广泛使用,细菌抗生素耐药性问题逐渐成为社会关注的热点,减少耐药菌株的传播成为维护公共卫生安全的关键之一。2013年,欧洲食品安全局安全资格认证列表中提出,将抗生素耐药性测定列为微生物菌种通用安全评估项目[16],因此对菌株进行耐药性测定尤为重要。
2.2 耐药质粒检测结果与分析
图2为对上述存在耐药性的菌株的质粒提取电泳图,B2所在的泳道(泳道1)和阴性对照泳道(泳道2)上并未出现条带,而阳性对照所在的泳道上(泳道3)上出现了荧光条带,表明B2中无携带耐药基因的质粒存在,不具备通过质粒转移耐药性的可能性,故可初步判断B2在耐药性转移方面为安全菌株。
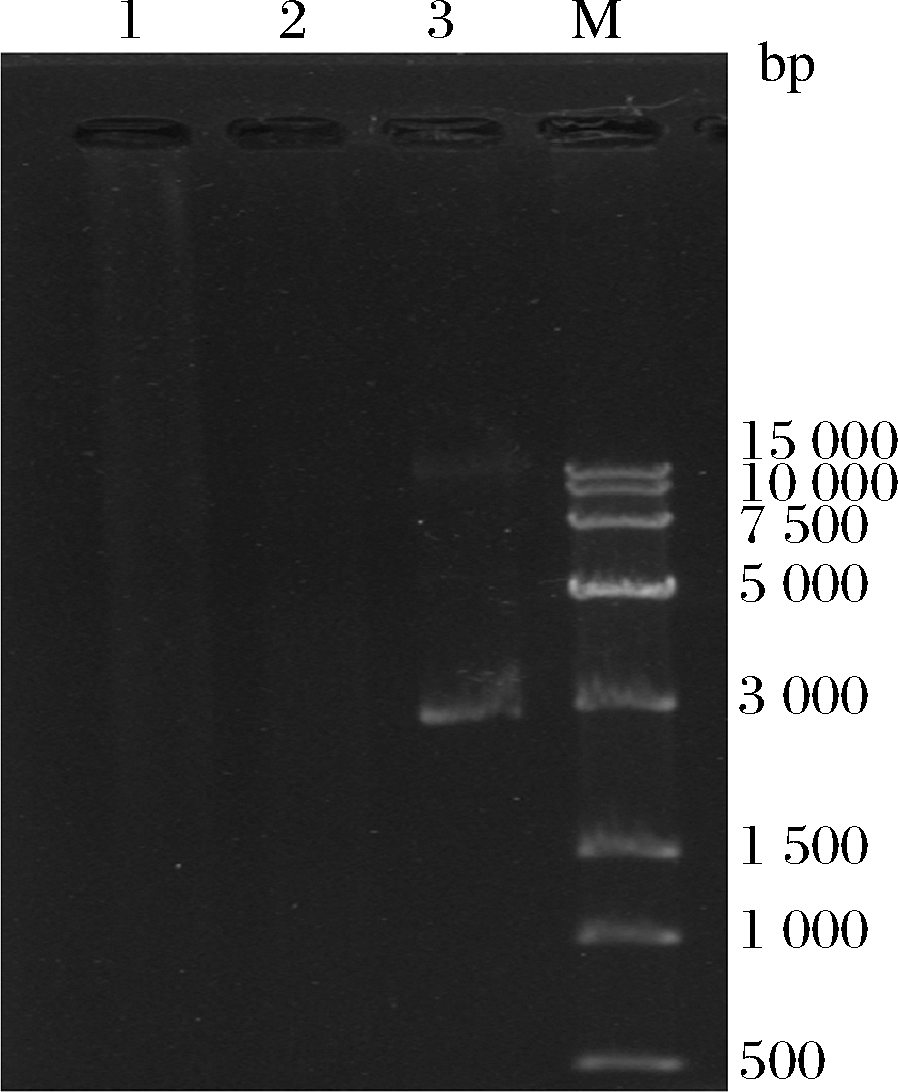
1-B2;2-阴性对照;3-阳性对照;M-15 000 DNA marker
图2 贝莱斯芽孢杆菌B2质粒提取电泳图
Fig.2 Electrophoretogram of B.velezensis B2 plasmid
细菌耐药性存在转移风险,在自然条件下,耐药基因可通过质粒在不同种属间发生水平转移[17]。已有研究表明,当含有耐药基因菌株作用于肠道时,耐药基因不仅可以在肠道菌群间进行交换,还可以转移到短暂通过肠道的细菌中,当肠道中的条件致病菌获得耐药性时,将会对宿主健康造成一定危害[18]。
目前关于芽孢杆菌通过质粒等移动元件将耐药基因传递至其他菌株的现象已有报道。AGERSØ等[19]发现蜡状芽孢杆菌中的四环素耐药基因可通过移动元件转移至枯草芽孢杆菌、金黄色葡萄球菌和肠球菌中。卢俊杰[20]的实验结果也表明耐药枯草芽孢杆菌质粒中的四环素类耐药基因tet(K)可通过接合的方式转移至大肠杆菌中。因此,为避免筛选所得的贝莱斯芽孢杆菌抗生素耐药性向其他菌株、动物甚至人类转移的风险,对具有耐药性的菌株进行耐药质粒检测实验尤为重要。
2.3 溶血实验结果
溶血素是一类作用于细胞膜,能使细胞膜结构和功能发生紊乱、细胞内容物外泄、细胞死亡的蛋白毒素[21]。研究表明,溶血素除了对血细胞有溶解作用外,还能对有核细胞和血小板造成损伤和致死[22],因此,菌株是否产生溶血素是检验菌株安全性的一个重要环节,对菌株的开发与利用至关重要。图3为实验室筛选所得的4株贝莱斯芽孢杆菌溶血实验结果,由图可知,4株菌株菌落周围无产生透明溶血环及草绿色环情况,这与BORAH等[23]的结果一致,因此可判断菌株为γ-溶血,菌株B1、B2、B7、B8为安全菌株。

a-贝莱斯芽孢杆菌B1;b-贝莱斯芽孢杆菌B2;c-贝莱斯芽孢杆菌B7;d-贝莱斯芽孢杆菌B8
图3 贝莱斯芽孢杆菌B1、B2、B7、B8溶血实验结果
Fig.3 Hemolysis test results of B.velezensis B1、B2、B7、B8
2.4 毒力基因PCR检测结果
芽孢杆菌中是否携带毒力基因是判断菌株是否安全的一个重要方面。图4与表3为4株芽孢杆菌进行毒力基因PCR的检测结果。

1~10-毒力基因hblA、hblC、hblD、nheA、nheB、nheC、bceT、cytK、ces、cer;M-2 000 DNA marker
a-贝莱斯芽孢杆菌B1;b-贝莱斯芽孢杆菌B2;c-贝莱斯芽孢杆菌B7;d-贝莱斯芽孢杆菌B8
图4 贝莱斯芽孢杆菌B1、B2、B7、B8毒力基因PCR扩增结果
Fig.4 PCR amplification of virulence genes for B.velezensis B1、B2、B7、B8
表3 贝莱斯芽孢杆菌B1、B2、B7、B8毒力基因PCR检测结果
Table 3 PCR detection results of virulence genes of B.velezensis B1、B2、B7、B8
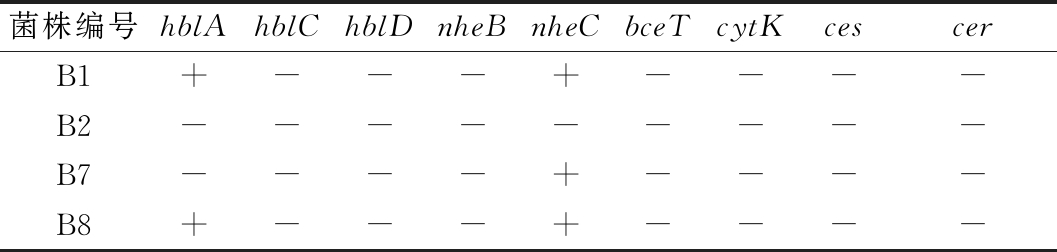
注:-:阴性;+:阳性
菌株编号hblAhblChblDnheBnheCbceTcytKcescerB1+---+----B2---------B7----+----B8+---+----
结果显示,除菌株B2外,B1、B7、B8均检测出一种或两种毒力基因。在产溶血性肠毒素基因检测方面,除菌株B2、B7外,菌株B1、B8皆检测出携带有溶血性肠毒素hblA(1 154 bp)基因,4株菌株皆不携带溶血性肠毒素hblC(740 bp)和hblD(829 bp)基因;在非溶血性肠毒素基因检测方面,除菌株B2外,菌株B1、B7、B8皆携带有非溶血性肠毒素nheC(683 bp)基因,4株菌株皆不携带非溶血性肠毒素nheA(755 bp)、nheB(743 bp)基因。在其他产肠毒素基因检测方面,4株菌株皆不携带有肠毒素T bceT(924 bp)基因,不携带有产细胞毒素K cytK(809 bp)基因;在产呕吐毒素基因检测方面,4株菌株皆不携带有产呕吐毒素ces(699 bp)以及cer(370 bp)基因。贝莱斯芽孢杆菌的安全性与其携带的毒力基因直接相关,溶血性肠毒素和非溶血性肠毒素均为复合型毒素,溶血性肠毒素分别由hblA、hblB、hblC、hblD 4个毒力基因编码,非溶血性肠毒素由nheA、nheB、nheC 3个毒力基因编码,当所有组分共同参与时,毒性达到最大[24]。研究表明,溶血性肠毒素需要hblA、hblC、hblD共同表达时才能产生溶血素[6],单独或成对的非溶血性肠毒素Nhe成分无法对蛋白起到抑制作用[25],故可判断本实验中4株菌株为安全菌株。
3 结论
本研究对分离自糯米酒中的4株抗逆性强且产蛋白酶特性优良的贝莱斯芽孢杆菌进行了体外安全性研究。在耐药性检测中,抗生素庆大霉素、卡那霉素、链霉素、红霉素、氯霉素、万古霉素对菌株有较强的抑制作用,4株菌均对上述抗生素敏感;四环素对菌株的抑制效果较弱,菌株B1、B7、B8对四环素表现为中度敏感,菌株B2对四环素表现为耐药。对耐药性检测中具有四环素耐药性的菌株B2进行耐药质粒检测,结果显示,菌株B2中不存在耐药基因的质粒,不具备耐药性通过质粒转移的可能。在溶血实验中,4株菌株在血琼脂培养基上正常生长且菌落四周不产生透明溶血环及草绿色环,可判断菌株不是溶血性菌株。在毒力基因PCR检测中,部分菌株携带一种或两种复合型毒素毒力基因,但由于复合型毒素需所有组分共同参与才能产生毒性作用,可判断菌株不具备产生相关毒素的可能,故4株菌株不具备产生肠毒素和呕吐毒素的可能性,表现出了良好的安全性,可用于后续进一步的深入研究,为后续贝莱斯芽孢杆菌菌株资源的开发与利用奠定科学基础。在后续的实验中将进一步通过动物实验对其安全性进行评价,以期为贝莱斯芽孢杆菌作为发酵剂用于发酵食品生产中的应用安全性提供科学理论依据。
[1] ZHAO C, SU W, MU Y C, et al.Correlations between microbiota with physicochemical properties and volatile flavor components in black glutinous rice wine fermentation[J].Food Research International, 2020, 138:109800.
[2] 张德锋, 高艳侠, 王亚军, 等.贝莱斯芽孢杆菌的分类、拮抗功能及其应用研究进展[J].微生物学通报, 2020, 47(11):3 634-3 649.
ZHANG D F, GAO Y X, WANG Y J, et al.Advances in taxonomy, antagonistic function and application of Bacillus velezensis[J].Microbiology China, 2020, 47(11):3 634-3 649.
[3] 刘延波, 张世凯, 赵志军, 等.高产淀粉酶细菌的分离鉴定及产酶条件优化[J].食品与机械, 2020, 36(1):65-71.
LIU Y B, ZHANG S K, ZHAO Z J, et al.Isolation and identification of amylase bacterial and optimization of enzyme production conditions by response surface[J].Food & Machinery, 2020, 36(1):65-71.
[4] LIU Z Y, GUAN X F, ZHONG X X, et al.Bacillus velezensis DP-2 isolated from Douchi and its application in soybean meal fermentation[J].Journal of the Science of Food and Agriculture, 2020, 101(5):1 861-1 868.
[5] LONG J, ZHANG X, GAO Z X, et al.Isolation of Bacillus spp.with high fibrinolytic activity and performance evaluation in fermented Douchi[J].Journal of Food Protection, 2021,84(4):717-727.
[6] 刘纯, 方莹, 龙祝, 等.商用益生芽孢杆菌的安全性分析[J].中国畜牧杂志, 2020, 56(8):203-208.
LIU C, FANG Y, LONG Z, et al.Safety analysis of commercial Probiotic Bacillus[J].Chinese Journal of Animal Science, 2020, 56(8):203-208.
[7] ELSHAGHABEE F M F, ROKANA N, GULHANE R D, et al.Bacillus as potential probiotics:Status, concerns, and future perspectives[J].Frontiers in Microbiology, 2017, 8:1 490.
[8] ZHANG D X, KANG Y H, ZHAN S, et al.Effect of Bacillus velezensis on Aeromonas veronii-induced intestinal mucosal barrier function damage and inflammation in crucian carp (Carassius auratus)[J].Frontiers in Microbiology, 2019, 10:2 663.
[9] Clinical and Laboratory Standards Institute.M100-S25Performance standards for antimicrobial susceptibility testing:Twenty-eightth informantional supplement[S].Wayne:CLSI, 2018.
[10] WU Z B, QI X Z, QU S Y, et al.Dietary supplementation of Bacillus velezensis B8 enhances immune response and resistance against Aeromonas veronii in grass carp[J].Fish & Shellfish Immunology, 2021, 115:14-21.
[11] 高艳侠. 一株贝莱斯芽孢杆菌LF01的分离、鉴定及其应用研究[D].上海:上海海洋大学, 2019.
GAO Y X.Isolation, identification and application of a Bacillus velezensis LF01 strain[D].Shanghai:Shanghai Ocean University, 2019.
[12] AMOAH K, DONG X H, TAN B P, et al.In vitro assessment of the safety and potential probiotic characteristics of three Bacillus strains isolated from the intestine of hybrid grouper (Epinephelus fuscoguttatus♀ × Epinephelus lanceolatus♂)[J].Frontiers in Veterinary Science, 2021, 8:675962.
[13] 谢全喜, 侯楠楠, 鹿晓慧, 等.芽孢杆菌的产酶特性及其对抗生素的耐受性[J].中国酿造, 2021, 40(5):91-96.
XIE Q X, HOU N N, LU X H, et al.Enzyme-producing characteristic and antibiotic tolerance of Bacillus[J].China Brewing, 2021, 40(5):91-96.
[14] BRUNTON L L, LAZO J S, PARKER K, et al.Book review:Goodman and gilman′s the pharmacological basis of therapeutics:Digital edition, 11th edition[J].Annals of Pharmacotherapy, 2006, 40(6):1 218.
[15] COURVALIN P.Vancomycin resistance in gram-positive cocci[J].Clinical Infectious Diseases, 2006, 42(S1):S25-S34.
[16] 赵婷, 姚粟, 徐友强, 等.欧洲食品安全局(EFSA)细菌耐药性评估概述[J].食品与发酵工业, 2014, 40(10):162-167.
ZHAO T, YAO S, XU Y Q, et al.Overview of antimicrobial resistance assessment by EFSA[J].Food and Fermentation Industries, 2014, 40(10):162-167.
[17] 丁燕霞. 市售鲜肉中细菌污染的安全评价和耐药性分析[D].长春:吉林大学, 2015.
DING Y X.Safety assessment and antibiotic resistance analysis of the bacterial contamination in retail meat[D].Changchun:Jilin University, 2015.
[18] 李海北, 杨沂嫡, 李君文, 等.人类肠道菌群中抗生素耐药基因的研究进展[J].中国药理学与毒理学杂志, 2021,35(2):81-89.
LI H B, YANG Y D, LI J W, et al.Research progress in antibiotic resistance genes in human gut microbiota[J].Chinese Journal of Pharmacology and Toxicology, 2021, 35(2):81-89.
[19] AGERSØ Y, JENSEN L B, GIVSKOV M, et al.The identification of a tetracycline resistance gene Tet (M), on a Tn 916-like transposon, in the Bacillus cereus group[J].FEMS Microbiology Letters, 2002, 214(2):251-256.
[20] 卢俊杰. 枯草芽孢杆菌金霉素耐药基因转移研究[D].武汉:华中农业大学, 2008.
LU J J.Transfer of the chlortetracycline resistant gene from Bacillus subtilis[D].Wuhan:Huazhong Agricultural University, 2008.
[21] 陈希, 索占伟, 许剑琴, 等.细菌溶血素的分类及代表性溶血素研究进展[J].中国农学通报, 2008, 24(8):16-22.
CHEN X, SUO Z W, XU J Q, et al.Review on classification and representative species of hemolysin[J].Chinese Agricultural Science Bulletin, 2008, 24(8):16-22.
[22] 马碧书, 马丽娜, 林旭瑷, 等.细菌溶血素毒性和致病机制研究进展[J].中国人兽共患病学报, 2018, 34(2):175-181.
MA B S, MA L N, LIN X A, et al.Advance in toxic and pathogenic mechanisms of bacterial hemolysins[J].Chinese Journal of Zoonoses, 2018, 34(2):175-181.
[23] BORAH T, GOGOI B, KHATANIAR A, et al. Probiotic characterization of indigenous Bacillus velezensis strain DU14 isolated from Apong, a traditionally fermented rice beer of Assam[J].Biocatalysis and Agricultural Biotechnology, 2019, 18:101008.
[24] 杨高继, 刘欢欢, 马艳, 等.糙米中蜡样芽孢杆菌的分离鉴定及其毒力基因与药敏性检测[J].现代食品科技, 2020, 36(10):290-299.
YANG G J, LIU H H, MA Y, et al.Isolation, identification of Bacillus cereus from brown rice and its virulence genes detection and antibiotic susceptibility[J].Modern Food Science and Technology, 2020, 36(10):290-299.
[25] LINDB CK T, FAGERLUND A, RØDLAND M S, et al.Characterization of the Bacillus cereus nhe enterotoxin[J].Microbiology(Reading,England), 2004, 150(12):3 959-3 967.
CK T, FAGERLUND A, RØDLAND M S, et al.Characterization of the Bacillus cereus nhe enterotoxin[J].Microbiology(Reading,England), 2004, 150(12):3 959-3 967.