鹰嘴豆(Cicer arietinum Linn.)是世界第三大豆类,具有耐热、耐干旱、耐贫瘠等特征[1],在非洲、地中海沿岸、美洲以及我国云南、新疆等地都有广泛种植[2]。与其他豆类相比,鹰嘴豆不含胆固醇,是蛋白质、膳食纤维和维生素的极佳营养来源。除了是珍贵的种植资源外,鹰嘴豆还具有极高的药用价值,可以降低慢性病的发病风险,具有降糖降脂、抗氧化、抗肿瘤等功能[3]。
近年来,膳食纤维(dietary fiber,DF)因其丰富的营养价值和功能特性而备受关注[4]。作为第七大营养素,膳食纤维对某些疾病的治疗具有重要意义,如抗肠癌、降低胆固醇和预防肥胖等[5]。膳食纤维结构中含有较多的亲水性基团,可与水分子发生作用,使之具有较高的持水力和膨胀力[6],摄入后能加快排便速度,使体内毒物迅速排出体外。膳食纤维应用于食品可以赋予食品特定的流变学特性,从而改善其品质特性[7]。膳食纤维分子可以聚集在油滴表面形成界面层,阻止油滴的聚集,从而维持体系平衡,因此,可以作为乳化剂稳定高脂肪食品和乳液,也可作为脂溶性物质载体,提高食品风味。从鹰嘴豆中提取出的鹰嘴豆膳食纤维(chickpea dietary fiber, CDF)具有良好的生物活性,如抗肿瘤、抗氧化、降低胆固醇等,具有很大的开发潜力[8]。然而,目前关于CDF乳化性的研究还少有报道。
本实验通过测定CDF持水性、持油性、膨胀性、微观结构、乳液粒径、电位、总体稳定指数(total stable index, TSI)、微观稳定性、界面张力、乳液流变性能等指标,分析了CDF的理化特性和不同质量分数CDF乳液(0.4%、0.8%、1.2%、1.6%、2.0%)的乳化特性,为鹰嘴豆膳食纤维在乳化食品中的开发利用提供理论依据[9]。
1 材料与方法
1.1 材料与试剂
鹰嘴豆购自云南省文州自治区丘北市天星乡;金龙鱼大豆油购自郑州某超市;正己烷、氢氧化钠、盐酸、溴化钾等均为分析纯。
1.2 仪器设备
Aanti J-26 s XPI高速冷冻离心机,美国Beakman公司;LS13320/ULM2激光粒度仪,美国贝克曼库尔特公司;ertex70傅里叶变换红外光谱仪,美国Bruker光学公司;Regulus 8100高分辨场发射扫描电子显微镜,日本日立公司;Ultraturrax T25高速分散器,德国IKA公司;Discoery旋转流动仪、DSC Q20差示量热扫描仪,美国TA仪器有限公司;Nano-ZS90纳米激光粒度仪,英国马尔文仪器公司;PH50光学显微镜,江西凤凰光学有限公司;Turbiscan LabMeasurngExpert多重光散射仪,法国Formulaction仪器公司;K100自动界面张力仪,德国Krüss公司。
1.3 实验方法
1.3.1 CDF的提取
参考LAN等[10]的方法提取CDF。以鹰嘴豆脱脂粉为原料,与0.5 mol/L NaOH按料液比1∶15(g∶mL)混合均匀,在50 ℃水浴条件下搅拌2 h,3 000×g离心15 min后倒掉上清液,沉淀用0.5 mol/L NaOH洗涤并离心,与1.0 mol/L的HCl溶液按料液比1∶10(g∶mL)混合均匀,再次搅拌并离心除去可溶性组分,然后用0.5 mol/L NaCl溶液洗涤,加碱调至pH为7,离心取沉淀,蒸馏水洗涤2次后真空冷冻干燥16 h,超微粉碎后,过100目筛,得到CDF。
1.3.2 CDF理化性质的测定
1.3.2.1 持水力的测定
参考SOWBHAGYA等[11]的方法稍加修改。准确称取CDF样品1.000 g,加入30 mL蒸馏水,振荡均匀,在室温下放置18 h,离心(4 000×g,20 min)倒掉上清液,在105 ℃下干燥至恒重。持水力(water holding capacity,WHC)计算如公式(1)所示:
(1)
式中:m1,干燥后样品质量,g;m2,干燥前样品质量,g。
1.3.2.2 持油力的测定
参考曾蓓蓓等[12]的方法稍加修改。准确称取CDF样品1.000 g于50 mL干燥离心管中,加入20 mL大豆油,振荡均匀,在室温下放置18 h,离心(4 000×g,20 min)倒掉上清液,至离心管内壁无油迹,称量样品和离心管的质量。持油力(oil holding capacity,OHC)计算如公式(2)所示:
(2)
式中:m0,样品质量,g;m1,离心管质量,g;m2,样品和离心管的质量,g。
1.3.2.3 膨胀力的测定
参考SOWBHAGYA等[11]的方法稍加修改。准确称取CDF样品1.000 g于干燥后的10 mL量筒中,加入8 mL蒸馏水,混合均匀后室温静置18 h,记录膨胀后的膳食纤维体积,膨胀力按公式(3)计算:
膨胀力![]()
(3)
式中:m0,样品质量,g;0,样品体积,mL;1,静置18 h后样品体积,mL。
1.3.3 CDF微观结构
将制备好的CDF样品平铺在贴好导电胶的样品台上,用洗耳球吹去多余的粉末,喷金120 s。置于扫描电子显微镜下观察各样品颗粒的形态,加速电压为1.0 k。
1.3.4 CDF乳化性质的测定
1.3.4.1 CDF乳液的制备
称取一定质量的CDF样品,加入大豆油,用高速分散器在10 000 r/min条件下均质3次,每次20 s,得到CDF乳液,且CDF的最终质量分数分别为0.4%、0.8%、1.2%、1.6%、2.0%,大豆油含量为25%。
1.3.4.2 CDF乳液粒径、电位的测定
采用LS13320/ULM2激光粒度仪分析不同浓度CDF乳液的粒径,结果用D(4,3)表示,每个样品重复3次。参考刘兴丽等[13]的方法测定乳液Zeta电位并稍加修改。制备不同浓度CDF新鲜乳液加到电位样品池中,使用Nano-ZS90纳米激光粒度仪测定Zeta电位,测试温度为25 ℃,平衡时间120 s,每个样品测定3次。
1.3.4.3 CDF乳液微观形貌
乳液微观形貌使用光学显微镜观察,取一滴稀释后的乳液滴在载玻片中心,缓慢盖上盖玻片,防止产生气泡,在10×物镜下观察图像。
1.3.4.4 CDF分层指数
将制备好的新鲜CDF乳液装到10 mL具塞比色管中,室温条件下储藏72 h,观察乳液的分层情况。乳液分层指数以乳清层的高度占乳化液高度的百分比表示。
1.3.4.5 CDF乳液总体稳定性指数的测定
使用多重光散射仪测定乳液的总体稳定指数(total stable index, TSI)。取20 mL新鲜CDF乳液加入样品瓶中进行测定,扫描时间1 800 s,每60 s扫描1次。
1.3.4.6 CDF乳液流变学特性的测定
参考ZHUANG等[14]和LI等[15]的方法,使用旋转流动仪对乳液进行静态流变和动态流变测定,选用直径为40 mm的平板夹具,样品加载在平行板之间,平板间隙为0.4 mm。
对于静态流变,测定不同CDF质量分数的乳液表观黏度随剪切速率的变化,剪切速率从0.1~1 000 s-1增加,测试温度设为25 ℃,每个样品测试4次。对于动态流变,测定乳液的储能模量(G′)和损耗模量(G″)随角频率的变化,角频率从0.1~100 rad/s增加,应变为0.6%。
1.3.4.7 CDF-大豆油界面张力的测定
参考O’SULLIAN等[16]的方法测定界面张力。采用铂金平板法测定油相与CDF溶液之间的界面张力。将CDF溶液(20 g)装在自动界面张力仪配带的玻璃皿中,缓慢下降铂金板,使之浸入溶液3 mm的深度。再加入约50 g的大豆油,注意加入过程应缓慢以防气泡产生,测试温度25 ℃,时间3 600 s。
1.3.5 数据分析
试验重复3次,结果表示为平均数±标准差。采用SPSS Statistics 19.0分析软件进行统计分析,使用单因素方差分析(ANOA)、Duncan’s多重比较检验法进行显著性分析(P<0.05);采用Origin 9.0进行数据绘图。
2 结果与分析
2.1 CDF理化性质分析
DF的持水力、持油力和膨胀力的大小是衡量其性能的重要指标。CDF的理化性质如表1所示,其持水力为1.22 g/g,高于已有报道的鹰嘴豆皮多糖(0.37 g/g)[8]。膨胀力为16.34 mL/g,高于糯米DF(2.73 g/g)[12]。持油力为3.17 g/g,高于米糠DF(0.99 g/g)[17]、花生壳DF(2.03 g/g)[18]、大豆DF(3.06 g/g)[7]。膳食纤维的结构影响其理化性质,疏松的孔状结构可形成亲水性骨架截留水分子,从而填充多糖准晶态的孔隙引起较强的溶胀作用。此外,海绵状的亲水基质可提高肠道中粪便体积和稠度从而预防便秘[19]。
表1 CDF理化性质
Table 1 Physicochemical properties of chickpea dietary fiber(CDF)
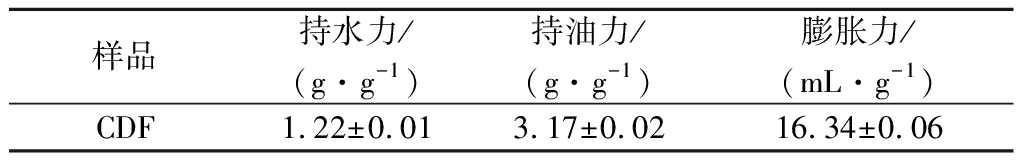
样品持水力/(g·g-1)持油力/(g·g-1)膨胀力/(mL·g-1)CDF1.22±0.013.17±0.0216.34±0.06
2.2 CDF扫描电镜结果
从图1-a中可以看出,脱脂鹰嘴豆粉在500 倍数下多为椭圆球状,可能是残存的淀粉和蛋白质,另含有不规则块状的紧密结构,其表面有很多凸起堆积,且大小不均一,形态各异。图1-b和图1-c是CDF在不同放大倍数下呈现出来的微观结构,可看出结构疏松多孔,表面凹凸不平,空隙深而宽,呈现出蜂窝块状。由于凹陷和褶皱的存在,使蜂窝状结构突出,膳食纤维的表面积增加,同时还会暴露多糖类内部更多的活性基团,从而增强其理化特性(持水性、持油性、膨胀性)。因此,CDF的微观结构为其物理特性提供了形态学方面的依据。

a-脱脂鹰嘴豆粉(500×);b-鹰嘴豆膳食纤维(500×); c-鹰嘴豆膳食纤维(1 000×)
图1 CDF的扫描电镜图
Fig.1 SEM images of CDF
2.3 CDF乳液粒径和显微结构
CDF质量分数0.4%~2.0%所制备的乳液粒径大小见表2。可以看出,当CDF质量分数由0.4%增加到0.8%时,乳液粒径从101.66 μm增至111.55 μm;CDF质量分数达2.0%时,乳液粒径又显著减小为71.81 μm。乳液粒径变化趋势与曾伟奇[20]研究相似,随着浓度的增加,柑橘膳食纤维乳液粒径呈现先增加后减小的趋势。
表2 不同质量分数CDF对其乳液粒径大小的影响
Table 2 Particle size of emulsions under different concentrations of CDF

粒径CDF质量分数/%0.40.81.21.62.0D (4,3)/μm101.66±3.98b111.55±5.60a107.23±3.43ab92.49±0.94c71.81± 0.85d
注:上标不同字母表示差异显著(P<0.05)
不同质量分数CDF乳液的粒径分布和显微镜结构如图2所示。当质量分数达到2%时,乳液粒径分布呈现一个峰,表明形成均匀的乳液,而其余浓度下的乳液液滴粒径都表现出相似的三峰分布。从显微镜结构也可看出,CDF质量分数低于0.8%时,液滴较大且存在聚结,这是由于CDF质量分数较低,连续相中存在的CDF不足以形成弱凝胶,使得纤维在低浓度的液滴之间形成更大的絮凝;CDF质量分数为1.2%~1.6%时,少量液滴之间出现絮凝,油滴分布不均匀;CDF质量分数达2.0%时,乳液液滴较小且分布更均匀,这更有利于乳液的稳定。不同浓度的CDF对乳液稳定性影响较大,这是因为CDF通过高速分散器剪切后会吸附在乳液液滴表面,从而达到稳定乳液的目的。CDF质量分数在0.8%以内时,液滴粒径与其浓度呈负相关,当CDF质量分数增加到0.8%以上时,CDF在油水界面的吸附密度提高,乳液液滴间的空间位阻效应变强,液滴间的有效碰撞可能性降低,从而减少液滴聚结的发生,因此液滴粒径减小[21-22],乳液乳化性能增强。

a-0.4%;b-0.8%;c-1.2%;d-1.6%;e-2.0%
图2 不同质量分数CDF乳液粒径分布和显微结构
Fig.2 Particle size distributions and microstructure of emulsions under different concentrations of CDF
2.4 CDF乳液电位
Zeta电位能够反映油滴在分散体系中的稳定情况。图3为不同浓度CDF乳液Zeta电位。

图3 不同质量分数CDF对其乳液电位大小的影响
Fig.3 Zeta potential of emulsions under different concentrations of CDF
CDF乳液Zeta电位为负值,这主要因为CDF带有阴离子电荷—COO-。当CDF质量分数从0.4%增加到0.8%时,Zeta电位显著减小;从0.8%增加到1.6%时,Zeta电位变化不显著;质量分数进一步增加到2%时,Zeta电位再次减小。产生这样的现象可能是因为当膳食纤维粒子包覆在油滴表面时,油滴会与疏水基团结合,使亲水基团暴露,导致液滴之间的静电排斥作用增加。随着CDF质量分数的增加,包覆在乳液液滴表面的纤维粒子相互缠结,界面吸附的粒子与液相中粒子缠结,减少了暴露在外面的亲水基团的数量,液滴之间静电排斥作用减弱,这有助于液滴周围形成致密薄膜,进而形成更强的网络结构,使得乳液Zeta电位减小且稳定性提高[23]。因此,质量分数2%的CDF乳状液稳定性最好。
2.5 CDF乳液分层稳定性
乳液分层指数可以反映油滴与水相乳化液的聚集和分离程度,图4为不同质量分数CDF乳液在储藏72 h内的分层指数。随着CDF浓度的增加,分层指数下降,当质量分数达到2.0%时乳液的分层指数最低,稳定系数最高。分层稳定性的提高主要是因为液滴颗粒粒径减小,增加了连续相的黏度,减小了连续相之间的密度差。可能是因为随着CDF质量分数增加,连续相中的粒子通过高速分散器剪切后会形成三维凝胶网络结构,增加连续相的黏度,限制液滴的迁移,这与图6-a中乳液黏度随质量分数增加而增大一致。此外,CDF包裹在油滴表面,通过增加油滴的密度使油滴和连续相的密度差减小,也有助于提高乳液的分层稳定性[23]。

图4 不同质量分数CDF乳液分层指数
Fig.4 Creaming index of emulsions under different concentrations of CDF
2.6 CDF乳液TSI结果
TSI是对乳液不稳定过程的定量分析,用于表征样品的稳定性。TSI值越大,稳定性越差[24]。如图5所示,随着时间的延长所有处理组TSI值增大,在1 800 s内,CDF的添加提高了乳液体系的总体稳定性,且在质量分数为2.0%时TSI值最小,说明此时乳液最稳定,不易聚集、絮凝或相分离,该结果与乳液分层指数变化趋势一致。
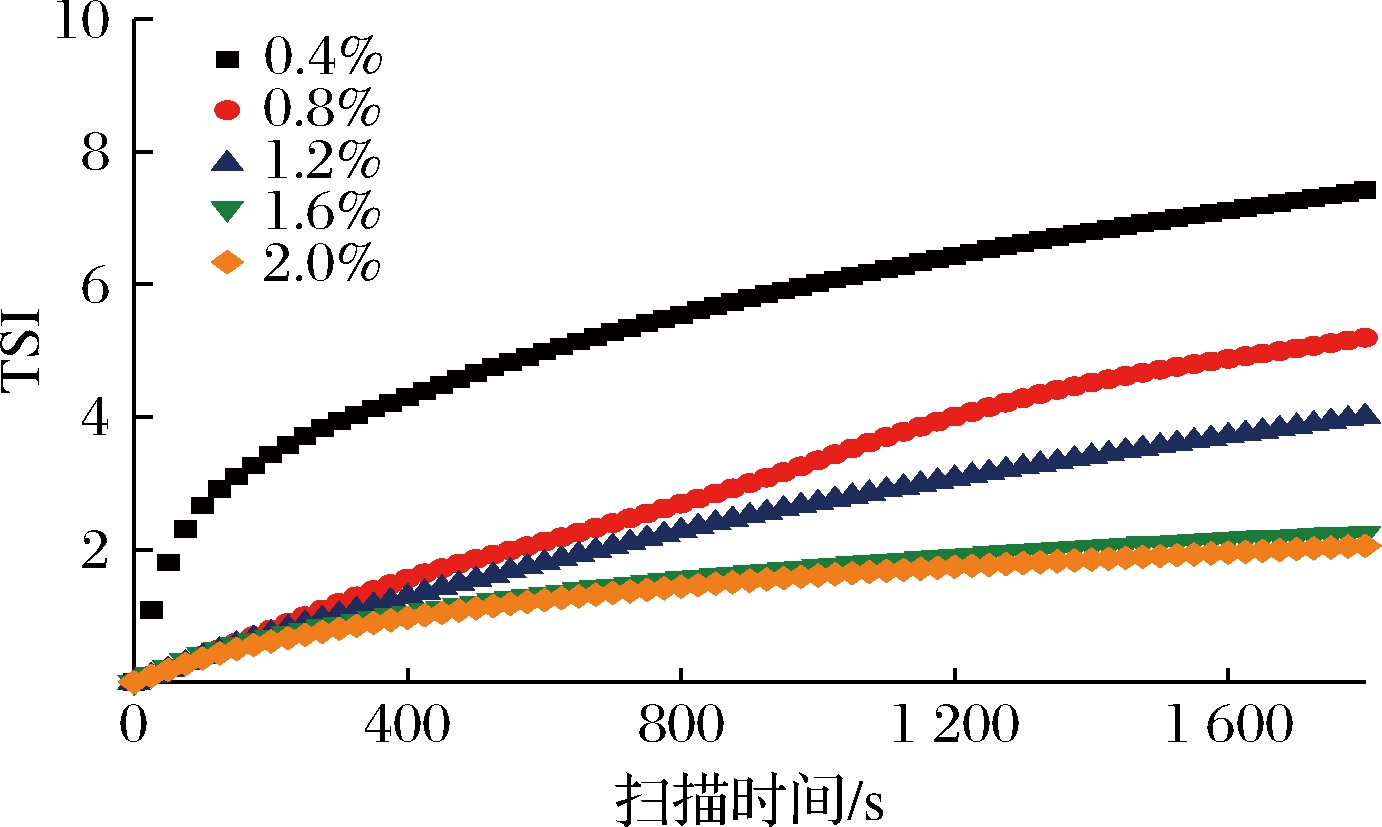
图5 不同质量分数CDF乳液TSI的变化
Fig.5 Turbiscan stability index of emulsions under different concentrations of CDF
2.7 CDF乳液流变学特性
图6-a显示了CDF乳液在不同剪切速率下表观黏度的变化。乳液黏度随着CDF质量分数的增加(0.4%~2.0%)而升高,可能是由于CDF质量分数增加,未被吸附的粒子数增加,增强了分子间的相互作用和摩擦,使得连续相中的CDF黏连形成更加稳定的三维网络结构,提高了乳液黏度。这与LAN等[10]的研究相一致,乳液的表观黏度随着玉竹膳食纤维浓度的增加而增加。
图6-b显示了CDF乳液在角频率扫描模式下G′与G″的变化。在乳液分散体系中,除0.4%的添加量外,其他质量分数CDF乳液体系的G′均高于G″,说明在整个体系中弹性占据主导地位[25]。0.4%质量分数CDF在低频率下主要表现出弹性响应,高频率下主要是黏性响应,因此在中间频率下存在交叉点。这种黏弹性现象显示了浓缩溶液的特征,而非形成稳定的三维网络结构[26]。乳液体系的G′和G″随着CDF质量分数的增加而提高,且呈现出较弱的频率依赖性,这可能是CDF质量分数增加时,体系中纤维粒子浓度也增加,使得更多的纤维粒子参与构建网络结构,导致体系弹性和黏性提升,从而形成强度更大的凝胶网络。

a-剪切速率扫描;b-角频率扫
图6 不同质量分数CDF对其乳液流变学特性的影响
Fig.6 Rheological properties of emulsions under different concentrations of CDF
2.8 CDF-大豆油界面张力
如图7所示,所有乳液界面张力随时间的延长而降低,说明CDF能够吸附油滴表面,在油-水界面形成界面层,使体系趋于稳定。在500 s内,界面张力值下降迅速,表明DF粒子迅速吸附在油滴表面;随着时间的延长,界面张力值下降缓慢,这可能是因为油水界面逐渐达到饱和。界面张力的降低有助于DF粒子在界面上的吸附、拉伸和重排,从而改善其乳化性。与低质量分数CDF相比,高质量分数的CDF与大豆油之间的界面张力明显降低,且2.0%时达到最低。不同浓度CDF能明显改变油-水的界面张力,主要是乳液体系中DF粒子吸附在油滴表面形成界面层的稳定程度不同。

图7 不同质量分数CDF对其乳液界面张力的影响
Fig.7 Interfacial tension of emulsions under different concentrations of CDF
3 结论与讨论
鹰嘴豆膳食纤维表现出较高的持水、持油性,可能是CDF的疏松多孔结构,存在的凹陷和褶皱使其表面积增加所致;随着CDF质量分数的增加,乳液粒径减小,液滴分布更加均匀;乳液分层指数、TSI及界面张力结果表明,CDF质量分数的增加能显著提高乳液稳定性,且2%的CDF乳液稳定性最好;乳液的表观黏度随着CDF浓度的增加而增大,使CDF在油水界面的吸附密度提高,减少了液滴间的聚集;角频率扫描模式下乳液的储能模量在CDF质量分数2%时达到最大,这有利于形成有序的凝胶网络结构。因此,CDF的良好理化及乳化特性,在改善产品质量、丰富膳食纤维含量方面具有良好的应用前景。
[1] SIMSEK S, HERKEN E N, OANDO-MARTINEZ M.Chemical composition, nutritional alue and in itro starch digestibility of roasted chickpeas[J].Journal of the Science of Food and Agriculture, 2016, 96(8):2 896-2 905.
[2] 陈文晋, 孔庆全, 赵存虎, 等.鹰嘴豆种质资源主要农艺性状遗传多样性分析[J].北方农业学报, 2018, 46(5):9-18.
CHEN W J, KONG Q Q, ZHAO C H, et al.Analysis of genetic diersity of the main agronomic traits of chickpea germplasm resources[J].Journal of Northern Agriculture, 2018, 46(5):9-18.
[3] LUNN J, THEOBALD H E.The health effects of dietary unsaturated fatty acids[J].Nutrition Bulletin, 2006, 31(3):178-224.
[4] XU Y, ZHANG X, YAN X H, et al.Characterization, hypolipidemic and antioxidant actiities of degraded polysaccharides from Ganoderma lucidum[J].International Journal of Biological Macromolecules, 2019, 135:706-716.
[5] 姜龙波, 吕静, 张喜文, 等.小米糠膳食纤维复合酶法改性工艺优化[J].轻工学报, 2017, 32(5):16-23.
JIANG L B, LYU J, ZHANG X W, et al.Process optimization of complex enzyme modification of millet bran dietary fiber[J].Journal of Light Industry, 2017, 32(5):16-23.
[6] RAGHAENDRA S N, RAMACHANDRA SWAMY S R, RASTOGI N K, et al.Grinding characteristics and hydration properties of coconut residue:A source of dietary fiber[J].Journal of Food Engineering, 2006, 72(3):281-286.
[7] 张华, 李银丽, 李佳乐, 等.竹笋膳食纤维对冷冻面团流变学特性、水分分布和微观结构的影响[J].食品科学, 2018, 39(1):53-57.
ZHANG H, LI Y L, LI J L, et al.Effect of bamboo shoot dietary fiber on rheological properties, moisture distribution and microstructure of frozen dough[J].Food Science, 2018, 39(1):53-57.
[8] AKHTAR H M S, ABDIN M, HAMED Y S, et al.Physicochemical, functional, structural, thermal characterization and α-amylase inhibition of polysaccharides from chickpea (Cicer arietinum L.) hulls[J].LWT, 2019, 113:108265.
[9] 陈文晋, 孔庆全, 赵存虎, 等.鹰嘴豆营养功能研究进展[J].北方农业学报, 2019, 47(2):119-123.
CHEN W J, KONG Q Q, ZHAO C H, et al.Reiew of progress in chickpea(Cicer arietinum) research[J].Journal of Northern Agriculture, 2019, 47(2):119-123.
[10] LAN G S, CHEN H X, CHEN S H, et al.Chemical composition and physicochemical properties of dietary fiber from Polygonatum odoratum as affected by different processing methods[J].Food Research International, 2012, 49(1):406-410.
[11] SOWBHAGYA H B, SUMA P F, MAHADEAMMA S, et al.Spent residue from cumin - a potential source of dietary fiber[J].Food Chemistry, 2007, 104(3):1 220-1 225.
[12] 曾蓓蓓, 常锦玉, 吕庆云, 等.黑糯米米糠中水不溶膳食纤维功能特性研究[J].中国食物与营养, 2019, 25(6):51-55.
ZENG B B, CHANG J Y, LYU Q Y, et al.Functional properties of insoluble dietary fiber from black glutinous rice bran[J].Food and Nutrition in China, 2019, 25(6):51-55.
[13] 刘兴丽, 赵双丽, 肖乃勇, 等.马铃薯蛋白微凝胶对皮克林乳液乳化特性的影响[J].轻工学报, 2019, 34(5):1-9.
LIU X L, ZHAO S L, XIAO N Y, et al.Effect of potato protein microgel on emulsifying properties of Pickering emulsion[J].Journal of Light Industry, 2019, 34(5):1-9.
[14] ZHUANG X B, JIANG X P, ZHOU H Y, et al.The effect of insoluble dietary fiber on myofibrillar protein emulsion gels:Oil particle size and protein network microstructure[J].LWT, 2019, 101:534-542.
[15] LI K, FU L, ZHAO Y Y, et al.Use of high-intensity ultrasound to improe emulsifying properties of chicken myofibrillar protein and enhance the rheological properties and stability of the emulsion[J].Food Hydrocolloids, 2020, 98:105275.
[16] O’SULLIAN J, MURRAY B, FLYNN C, et al.The effect of ultrasound treatment on the structural, physical and emulsifying properties of animal and egetable proteins[J].Food Hydrocolloids, 2016, 53:141-154.
[17] 黄萍, 林亲录, 朱凤霞, 等.米糠水溶性膳食纤维理化特性及抗氧化性[J].食品科学, 2017, 38(23):14-19.
HUANG P, LIN Q L, ZHU F X, et al.Physicochemical properties and antioxidant actiity of water-soluble dietary fiber from rice bran[J].Food Science, 2017, 38(23):14-19.
[18] 朱妞, 吴丽萍.花生壳膳食纤维理化特性研究[J].粮食与油脂, 2014, 27(2):38-41.
ZHU N, WU L P.Study on physical and chemical properties of peanut DF[J].Cereals & Oils, 2014, 27(2):38-41.
[19] YEH H Y, SU N W, LEE M H.Chemical compositions and physicochemical properties of the fiber-rich materials prepared from shoyu mash residue[J].Journal of Agricultural and Food Chemistry, 2005, 53(11):4 361-4 366.
[20] 曾伟奇. 柑橘纤维性能及其形态结构研究[D].广州:华南理工大学, 2019.
ZENG W Q.Study on properties and morphological structure of citrus fiber[D].Guangzhou:South China Uniersity of Technology, 2019.
[21] SONG X Y, PEI Y Q, ZHU W, et al.Particle-stabilizers modified from indica rice starches differing in amylose content[J].Food Chemistry, 2014, 153:74-80.
[22] SONG X Y, PEI Y Q, QIAO M W, et al.Preparation and characterizations of Pickering emulsions stabilized by hydrophobic starch particles[J].Food Hydrocolloids, 2015, 45:256-263.
[23] 赵强忠, 周海媚.大豆纤维稳定水包油型皮克林乳液的研究[J].现代食品科技, 2016, 32(10):39-44;8.
ZHAO Q Z, ZHOU H M.Soybean fiber as particle stabilizers for oil-in-water Pickering emulsions[J].Modern Food Science and Technology, 2016, 32(10):39-44;8.
[24] RAIKOS .Encapsulation of itamin E in edible orange oil-in-water emulsion beerages:Influence of heating temperature on physicochemical stability during chilled storage[J].Food Hydrocolloids, 2017, 72:155-162.
[25] PENG X Y, MU T H, ZHANG M, et al.Effects of pH and high hydrostatic pressure on the structural and rheological properties of sugar beet pectin[J].Food Hydrocolloids, 2016, 60:161-169.
[26] ZHANG Y Y, XU X J, ZHANG L N.Dynamic iscoelastic behaior of triple helical Lentinan in water:Effect of temperature[J].Carbohydrate Polymers, 2008, 73(1):26-34.