红枣(Zizyphus jujuba Mill.)又名枣子,鼠李科枣属植物枣树果实,在我国分布极广,据统计我国现有上万公顷枣树,年产鲜枣140多万t,占世界总产量的98%[1]。红枣营养价值丰富,含有丰富的有机酸、生物碱类、三萜皂苷类、黄酮类化合物以及各种维生素,具有良好的营养保健作用[2]。目前市场上红枣大部分仍作为原枣进行销售,由于深加工技术不足导致了大量的损失,我国红枣制品主要为基于初级加工的干枣、枣粉等,而其深加工产品,产品如枣酒、枣醋等相对较少,使得红枣资源的利用价值大大降低[3]。
红枣酒具有酒精度低、营养价值丰富、口感酸甜适宜等特点,可提高机体免疫力、防治骨质疏松、软化血管等[4],SAN等[5]研究发现,使用稀释过的红枣酒给小鼠灌胃7 d后发现小鼠腹腔内巨噬细胞的吞噬指数显著提高,说明红枣酒具有提高机体免疫力的作用;PAWLOWSKA等[6]利用HPLC/PDA/ESI-MS法对红枣酒中的黄酮类化合物含量进行了测定并对其抗氧化能力进行了研究,结果表明红枣酒中的黄酮类化合物具有良好的抗氧化活性。但是红枣中果胶含量十分丰富,导致红枣在制汁过程中产生大量的甲醇,不仅会对红枣酒的品质产生不良影响,同时过量的甲醇也会对人的健康造成危害[7],目前常见的降低果酒中甲醇的方法通常是利用胶体物质吸附果汁中的果胶甲酯酶,从而降低其活性,或是通过添加酚酸来降低果胶甲酯酶的活性[8],但不含果胶甲酯酶的酶制剂往往活性较低,对果胶分解不彻底,从而导致酶解效果不好,出汁率较低。如何能够在不影响出汁率的情况下降低红枣汁中的甲醇,同时最大程度保留其原有的风味,是红枣酒产业急需解决的问题。
分子蒸馏技术是近年来发展起来的一种高效、环保的分离技术,它是一种非平衡的短程液-液蒸馏技术[9],由于不同物质分子的平均自由程不同,因此其表面蒸发速率有差异,在高真空条件下,分子受热逸出液体表面,使液体中不同成分在远低于其沸点的温度下分离[10]。分子蒸馏技术具有真空度高、操作温度低、受热时间短、分离程度高等优点,目前已广泛用于天然药物精制及香精香料提纯等行业[11]。本研究通过分子蒸馏技术,将酶解后红枣汁中的甲醇分离出来,从而达到降低红枣酒中甲醇含量的效果,通过响应面法优化分子蒸馏最佳工艺条件,并与未蒸馏的红枣酒进行品质对比,探讨分子蒸馏在降低甲醇含量方面的工艺适用性,以期为分子蒸馏降低甲醇含量提供理论支持。
1 材料与方法
1.1 材料与试剂
红枣、灰枣,购于新疆,4 ℃贮藏;果浆酶,诺维信;乙醇、甲醇、叔戊醇,均为分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
KL70-5分子蒸馏仪器,德国TA公司;TRACE ISQ气相色谱-质谱联用仪,美国赛默飞科技公司;HH-4数显恒温水浴锅,江苏省金坛市荣华仪器制造有限公司;WAY阿贝折光仪,上海光学仪器五厂。
1.3 实验方法
1.3.1 红枣酶解液制备工艺流程
将无病害、新鲜红枣用自来水冲洗干净,加入80 ℃水,按料水比1∶3(g∶mL)混合浸泡1 h后打浆,在匀浆加入0.5 g/kg果浆酶在50 ℃下酶解1.5 h,后经40目尼龙滤袋压榨取汁,此为红枣酶解液。
1.3.2 红枣酶解液甲醇分子蒸馏清除
将150 mL红枣汁酶解液加入到分子蒸馏设备进料器中,依次打开散热泵、刮板泵、真空泵和冷却泵,当设备真空度到达0.1 Pa后往冷阱中倒入适量液氮。打开加热器调整至设定的温度,调节刮板转速和进料流速,对红枣酶解液进行分子蒸馏。记录轻组分馏出液的体积,同时以未处理酶解液甲醇质量(mg)作为对照。
1.3.3 分子蒸馏清除甲醇条件优化
控制蒸馏温度30 ℃、进料流速20 mL/min、刮板转速100 r/min。分别研究蒸馏温度(20、30、40、50、60 ℃),进料流速(10、15、20、25、30 mL/min),刮板转速(50、100、150、200、250 r/min)对150 mL红枣酶解液中甲醇含量的影响,并计算清除率,分析蒸馏效果。
1.3.4 分子蒸馏响应面优化设计
根据单因素确定3个水平,以蒸馏温度、进料流速、刮板转速为试验因素,以酶解液甲醇清除率为响应值,采取Box-Behnken中心组合法进行3因素3水平实验设计,见表1。
表1 响应面实验水平表
Table 1 Factors and leels in response surface design

水平因素A蒸馏温度/℃B进料流速/(mL·min-1)C刮板转速/(r·min-1)-130101500401520015020250
1.3.5 分子蒸馏对红枣酒品质的影响
将300 mL红枣酶解液平均分为2份,通过优化后的分子蒸馏工艺进行蒸馏处理的为蒸馏组;不经分子蒸馏的为未蒸馏组。后加入酿酒酵母在20 ℃发酵7 d,发酵结束后对发酵液进行可溶性固形物、酒精度、香气成分检测。
1.4 测定方法
1.4.1 甲醇含量测定
参考GB 5009.266—2016《食品安全国家标准 食品中甲醇的测定》,采用气相色谱法测定甲醇含量,甲醇清除率按照公式(1)计算。
甲醇清除率![]()
(1)
1.4.2 可溶性固形物测定
将待测液充分混匀,用阿贝折光仪检测。
1.4.3 酒精度测定
使用酒度计检测。
1.4.4 香气含量测定
参照文献[12]的方法,采用气相色谱-质谱联用仪对红枣酒的挥发性成分进行测定。
1.4.4.1 样品处理
量取5 mL样品于顶空进样瓶中,加入1 g NaCl,进样瓶40 ℃平衡30 min,将老化处理过的萃取头(SPME Fiber Assembly:DB/CAR/PDMS, Autosampler)插入进样瓶中,顶空吸附30 min,解吸。
1.4.4.2 气相色谱与质谱条件
色谱柱:TG-WAXMS色谱柱(30 mm×0.25 mm,0.25 μm);升温程序:起始温度40 ℃,保持2 min,然后以5 ℃/min升温至150 ℃,保持2 min,最后以8 ℃/min升温至250 ℃,保持5 min;载气(He)流速1.2 mL/min,压力52.76 kPa;进样量1 μL;不分流。
电子电离离子源:电子能量70 e,质量扫描范围m/z 35~450,0.2 scans/s;传输线温度280 ℃,离子源温度280 ℃。
1.4.4.3 数据处理
采用NIST MS search 2.0数据采集及分析,根据保留指数及谱库检索确定风味物质;采用内标法对各挥发性成分进行定量,内标为2-辛醇(质量浓度16.33 mg/L)。
1.5 数据处理
实验数据使用Origin 9.0、SPSS 20、Excel等软件对数据进行统计、分析,每个试验重复3次。
2 结果与分析
2.1 蒸馏温度对甲醇清除率效果的影响
分子蒸馏系统的特点是蒸发器与冷凝器间距很小(20~50 mm),蒸馏温度是决定物料分离效果的关键因素,温度越高,蒸汽分子的平均自由程越大,物料的分离效果越好[13]。由图1可知,甲醇清除率随蒸馏温度的升高而逐渐增大,温度>30 ℃后趋势变缓,40 ℃时甲醇清除率达到74.94%,之后清除效果趋于饱和。但考虑到较高温度对果酒中香气及营养成分产生较大损失,因此选取蒸馏温度为40 ℃。
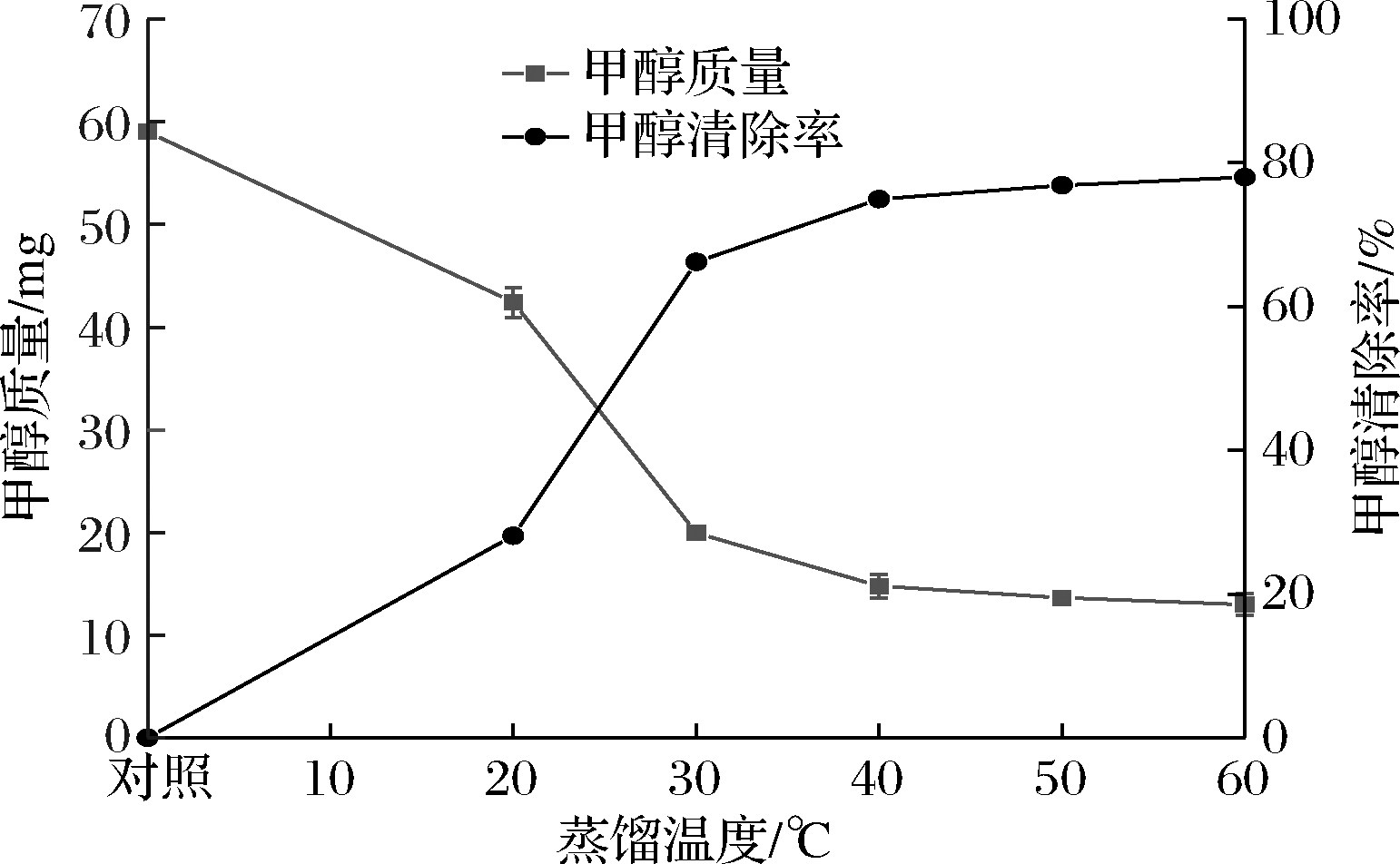
图1 蒸馏温度对红枣酶解液中甲醇清除效果的影响
Fig.1 Effect of distillation temperature on the remoal of methanol in jujube enzymatic hydrolysate 注:甲醛质量为馏出液中的含量(下同)
2.2 进料流速对甲醇清除效果的影响
由图2可知,随着进料流速的增大,发酵液中甲醇清除效果逐渐降低,可能是当蒸馏温度和刮板转速一定的情况下,进料流速大则意味着在蒸发器表面停留时间短,液体厚度增加,导致受热时间减小,单位面积上需要蒸发的物料量增加,不利于甲醇的分离[14]。当进料流速15 mL/min时,甲醇清除率最大为79.46%,继续减小进料流速差异不明显,对甲醇清除达到饱和状态,但导致发酵液过度受热[15]。综上所述,选取的最适进料流速为15 mL/min。
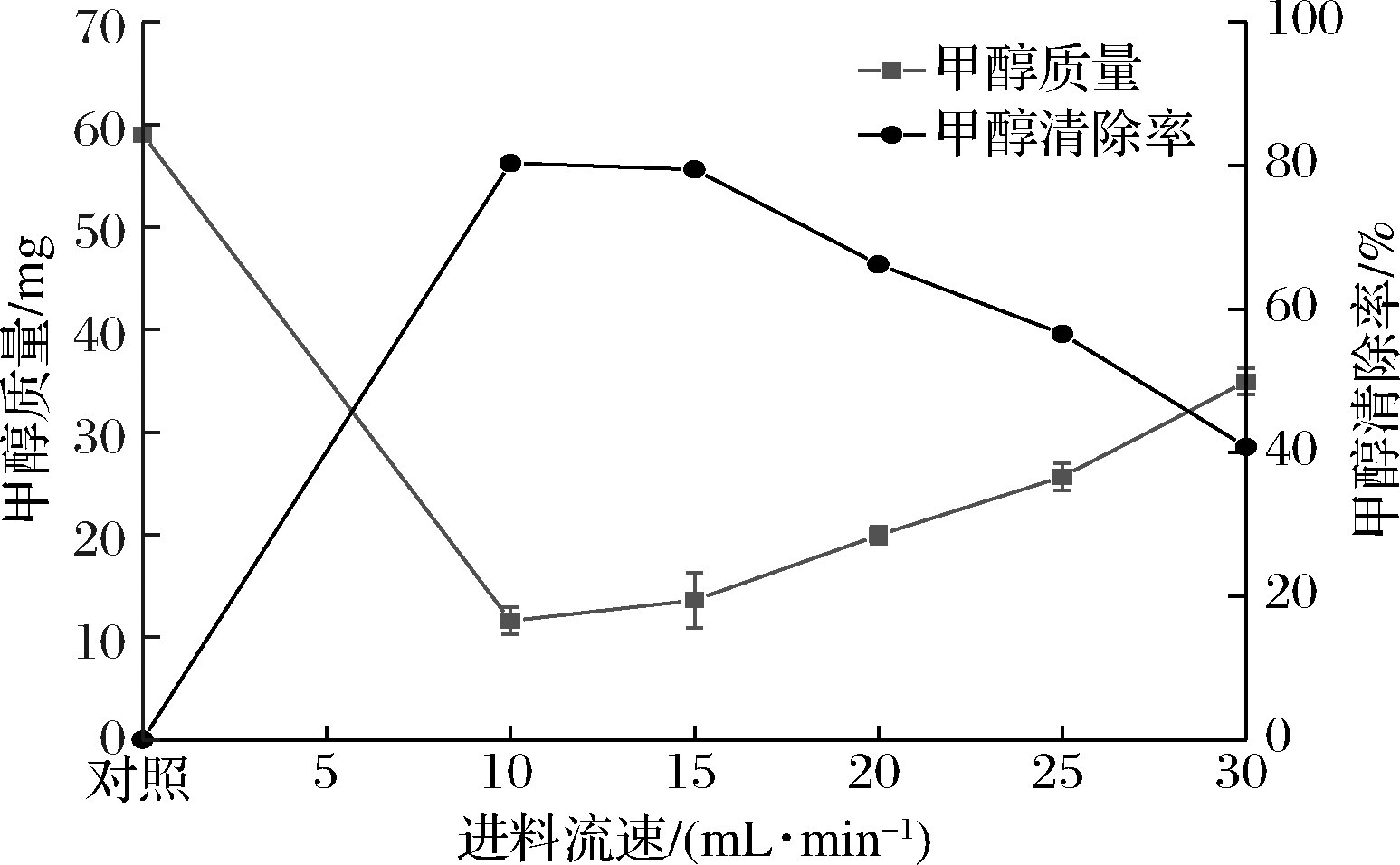
图2 进料流速对红枣酶解液中甲醇清除效果的影响
Fig.2 Effect of feeding speed on the remoal of methanol in jujube enzymatic hydrolysate
2.3 刮板转速对甲醇清除效果的影响
刮板通过围绕蒸发器壁转动,尽可能提高物料的驻留时间和适合的薄膜厚度,进而到达更好的传热分离效果[16]。若转速过小,物料无法形成均匀的薄膜,导致分离效果降低,提高转速可以减小液体薄膜厚度,增加传热传质效果,提高分离效率[17]。由图3可知,发酵液中甲醇含量随着刮板转速的提升而逐渐降低,清除率逐渐提高。当刮板转速为200 r/min时,甲醇清除率最大为79.88%,当刮板转速继续提高后,甲醇清除率呈下降趋势,这可能是刮板转速过高导致蒸发面液膜飞溅,甲醇分子剧烈运动易于与飞沫碰撞而返回液面中,使分离效果下降,这与黄会娜等[18]的研究结果一致。
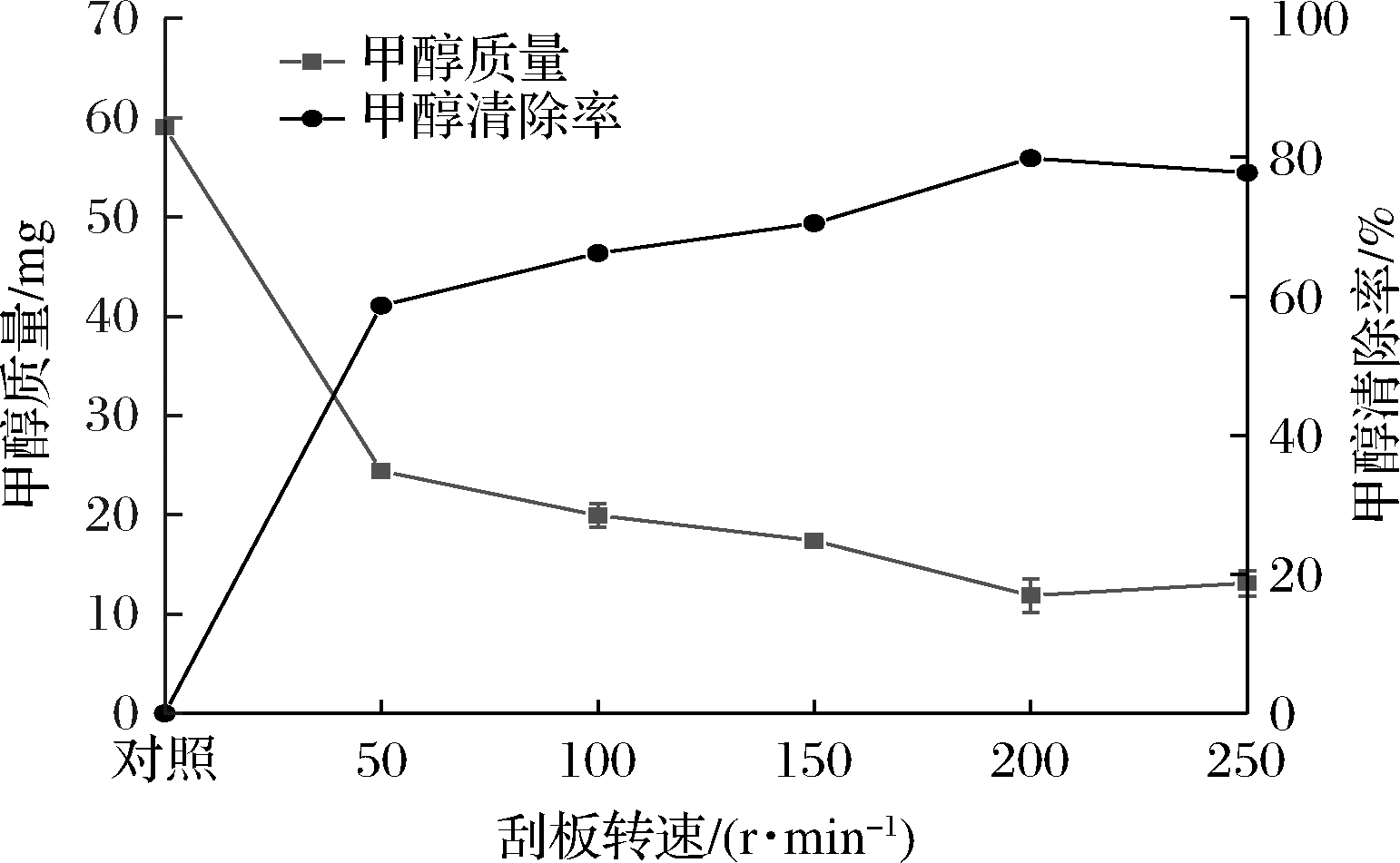
图3 刮板转速对红枣酶解液中甲醇清除效果的影响
Fig.3 Effect of scraping speed on the remoal of methanol in jujube enzymatic hydrolysate
2.4 响应面优化分析
2.4.1 回归模型的建立及其显著性检验
根据单因素试验结果,本试验以甲醇清除率为响应值,分析蒸馏温度、进料流速、刮板转速对响应值的影响,响应面设计方案和结果见表2。
表2 响应面试验设计及结果
Table 2 Experimental design and results for response surface methodology
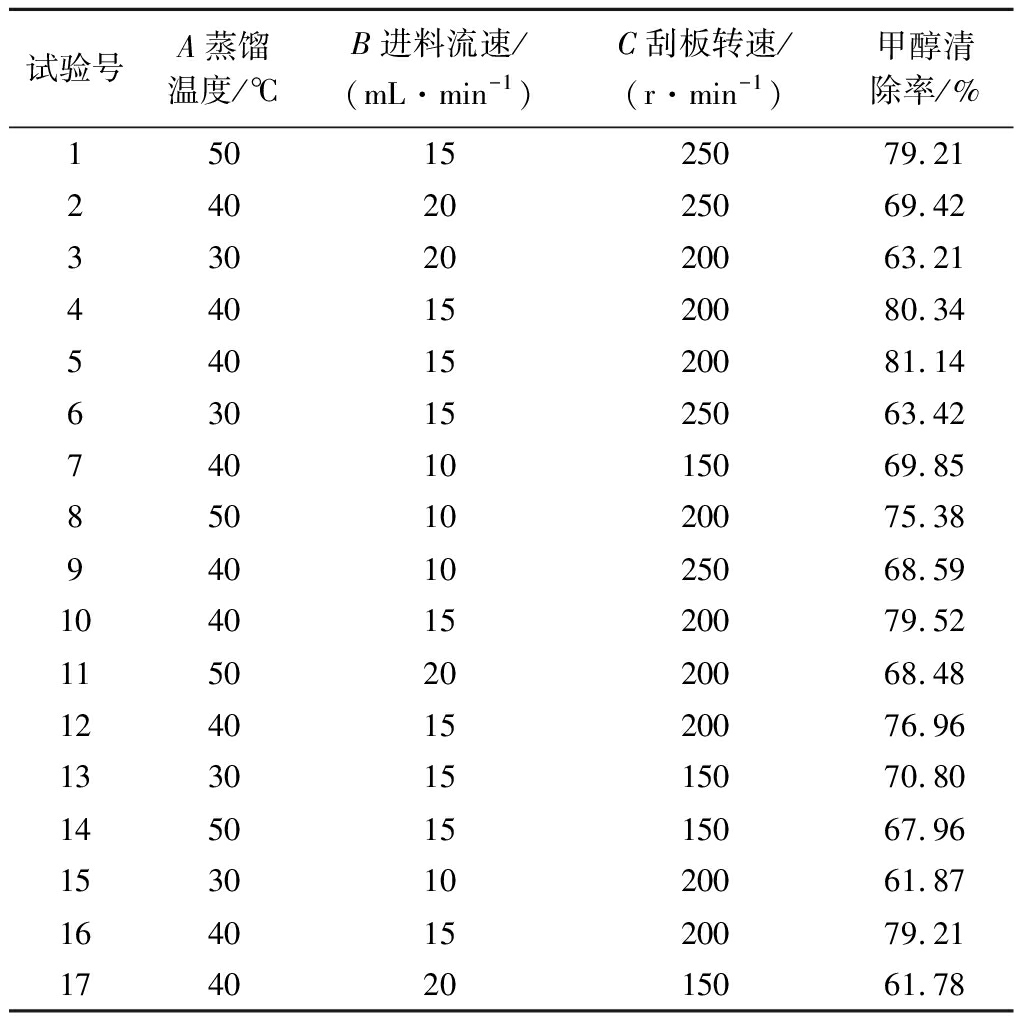
试验号A蒸馏温度/℃B进料流速/(mL·min-1)C刮板转速/(r·min-1)甲醇清除率/%1501525079.212402025069.423302020063.214401520080.345401520081.146301525063.427401015069.858501020075.389401025068.5910401520079.5211502020068.4812401520076.9613301515070.8014501515067.9615301020061.8716401520079.2117402015061.78
用Design-Expert软件对试验数据进行多项式回归拟合,并进一步研究和优化影响甲醇清除率的因素,做响应面图。多元回归拟合,得到甲醇清除率与各因素的二次方程模型为:
Y=79.43+3.97A-1.60B+1.28C-2.06AB+4.6AC+2.22BC-4.63A2-7.57B2-4.46C2
根据表2响应面设计实验结果进行方差分析,结果由表3所示。得出的回归模型对酶解液甲醇清除率性达到显著水平(P<0.01),表明该回归方程模型极显著,失拟项差异性不显著(P>0.05),说明建立的回归模型对试验结果的拟合情况误差较小,能够很好地表现出各影响因素和响应值之间的联系并能较好地预测试验值。其中,3个因素蒸馏温度(A)、进料流速(B)、刮板转速(C),二次项交互作用的AB、AC、BC以及二次项A2、B2、C2对甲醇清除率均有显著影响(P<0.05),3个因素对酶活性的影响大小依次为蒸馏温度>刮板转速>进料流速。
表3 回归模型甲醇清除率方差分析
Table 3 ANOA of response surface model for pectinesterase
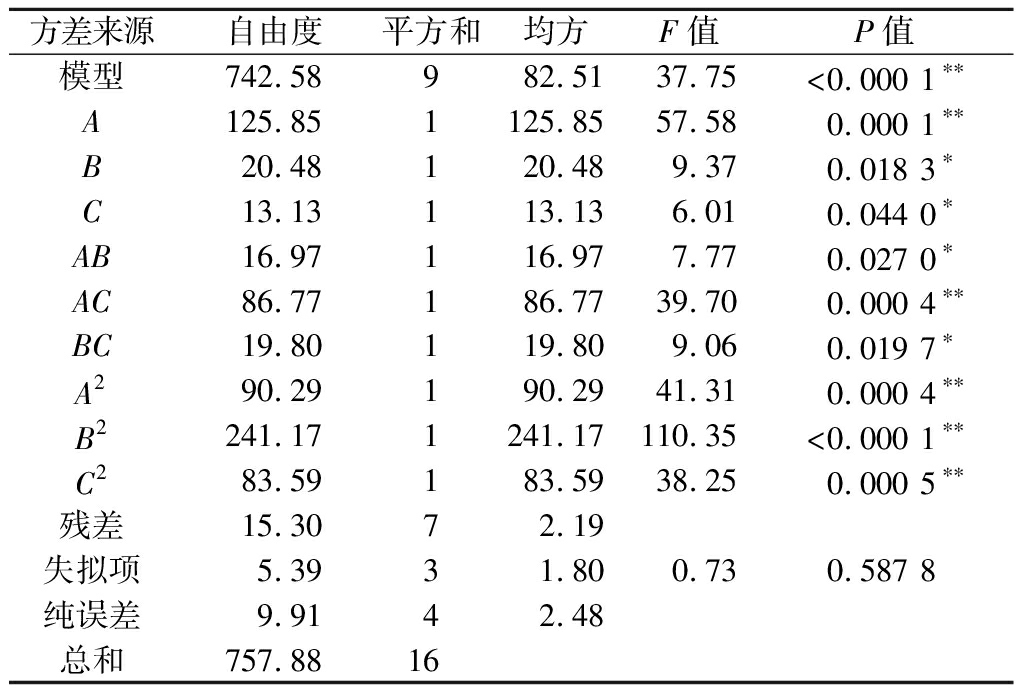
方差来源自由度平方和均方F值P值模型742.58982.5137.75<0.000 1∗∗A125.851125.8557.580.000 1∗∗B20.48120.489.370.018 3∗C13.13113.136.010.044 0∗AB16.97116.977.770.027 0∗AC86.77186.7739.700.000 4∗∗BC19.80119.809.060.019 7∗A290.29190.2941.310.000 4∗∗B2241.171241.17110.35<0.000 1∗∗C283.59183.5938.250.000 5∗∗残差15.3072.19失拟项5.3931.800.730.587 8纯误差9.9142.48总和757.8816
注:*差异显著(P<0.05);**差异非常显著(P<0.01)
2.4.2 响应面分析
响应面图的坡度陡峭程度决定了两者交互作用对甲醇清除率的影响大小,坡度越陡峭,两者作用越显著[19]。由图4可知,蒸馏温度和进料流速、蒸馏温度和刮板转速、进料流速和刮板转速的响应面图坡度陡峭,说明该三者的交互作用对响应值的影响显著(P<0.05),其他作用不显著(P>0.05),这与表3方差分析的结果一致。
通过Design-Expert 10软件分析得到酶解液分子蒸馏最佳工艺条件为蒸馏温度46.96 ℃、进料流速14.35 mL、刮板转速223.72 r/min,预测在此工艺条件甲醇清除率为81.23%。考虑到工艺可行性,将上述工艺条件优化为蒸馏温度47 ℃,进料流速14 mL/min,刮板转速223 r/min,测定实际甲醇清除率为82.11%,与预测值较接近,采用响应面优化的工艺条件较可靠。
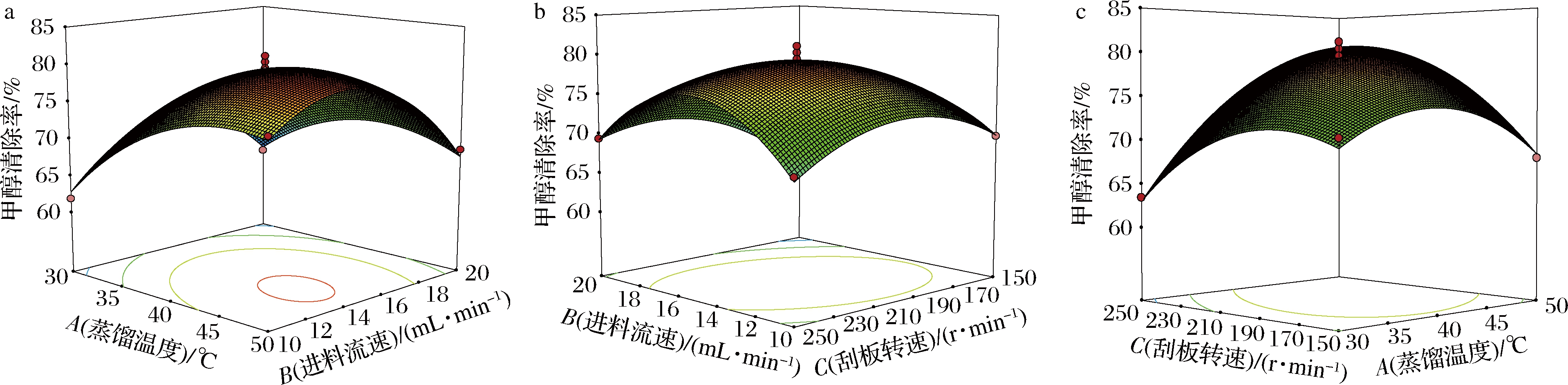
a-蒸馏温度和进料流速;b-进料流速和刮板转速;c-蒸馏温度和刮板转速
图4 交互作用响应面图
Fig.4 Response surface plots for the interactie effects
2.5 分子蒸馏对红枣酒品质的影响
2.5.1 分子蒸馏对红枣酒发酵效果的影响
由表4可知,分子蒸馏过程中有部分水蒸出,提高了酶解液的可溶性固形物含量,更利于酵母发酵,成品酒的酒精度更高,分析可知同等条件下酒精度提高约1%(ol),同时经过分子蒸馏后,果酒甲醇含量也低于未蒸馏组。综上所述,分子蒸馏作为发酵前处理工艺能够显著提高发酵效率,降低成品酒中甲醇含量。
表4 分子蒸馏对红枣酒发酵效果的影响
Table 4 Effect of molecular distillation on the fermentation of jujube wine

项目蒸馏组未蒸馏组发酵前糖度/°Brix18.26±0.0516.73±0.03酒精度/(%ol)11.9±0.111.0±0.1甲醇含量/(mg·L-1)79.54±1.24327.26±2.52
2.5.2 分子蒸馏对红枣酒香气成分的影响
香气是评价红枣酒品质好坏的重要指标[20],本实验通过GC-MS对蒸馏与未蒸馏组红枣酒香气成分进行定量分析,共检测出35种香气成分,其中酯类物质17种,醇类物质7种,酸类物质7种,其他成分4种。如表5所示,经过分子蒸馏后红枣酒中香气化合物总量(146.37 mg/L)高于未蒸馏组(123.34 mg/L)。酯类物质是红枣酒中主要的香气成分,其中乙酸酯多产生于酵母发酵阶段,具有怡人果香和酒香味[21],分子蒸馏在减压加热过程中虽然温度不高,但也伴随着一些果香味的逸出,因此发酵后乙酸乙酯、丁酸乙酯、辛酸乙酯等含量略有降低,但酯类物质总量蒸馏组(101.58 mg/L)显著高于未蒸馏组(90.23 mg/L)。醇类物质是发酵过程中主要的次级代谢产物,其中异戊醇作为含量最高的物质,是构成酒香味的主要成分;酸类物质可增加红枣酒风味的复杂性和浓郁性,其中辛酸含量最高,给予酒更好的水果香味;同时一些萜烯类和醛类物质赋予了红枣酒玫瑰香、苹果香等香气,使红枣酒的香味更加协调、厚重[22]。由表5可知,蒸馏组的醇类、酸类、醛类物质的含量均高于未蒸馏组,可能是分子蒸馏后糖度上升,特征香气成分含量也得到显著提升,红枣酒的香气也更加浓郁。
表5 分子蒸馏对红枣酒香气成分的影响
Table 5 Effect of molecular distillation on the aroma components of jujube wine

香气化合物质量浓度/(mg·L-1)蒸馏组未蒸馏组特征酯类 乙酸乙酯4.05±0.324.28±0.06花香、水果香 丁酸乙酯0.42±0.020.53±0.01果香 乙酸异戊酯5.20±0.624.46±0.42焦味 正己酸乙酯14.09±1.3213.76±1.51水果香 乙酸己酯0.04±0.000.06±0.01 己酸乙酯0.08±0.02/苹果香 庚酸乙酯1.97±0.140.47±0.10果香 辛酸甲酯0.31±0.030.08±0.02 辛酸乙酯32.21±2.0533.03±1.28甜果香 癸酸甲酯10.09±0.037.11±0.01花香、酒香 己酸己酯0.06±0.00/ 癸酸乙酯28.24±2.4220.04±1.33果香、酒香 苯甲酸乙酯0.04±0.010.06±0.02 乙酸苯乙酯0.75±0.041.04±0.01枣香 十一酸乙酯1.20±0.121.36±0.21柠檬味 癸酸异戊酯0.13±0.02/ 3-苯丙酸乙酯2.69±0.041.95±0.01花香醇类 异丁醇1.14±0.080.81±0.07溶剂味 异戊醇30.42±3.1226.57±3.23酒香 正己醇0.08±0.020.02±0.01青草味 2-癸醇0.64±0.010.37±0.01酒香 2,3-丁二醇1.26±0.040.17±0.02果香 芳樟醇0.04±0.010.20±0.01花香 苯乙醇4.40±0.442.06±0.17花香酸类 异戊酸0.10±0.020.19±0.01腐败味 己酸0.58±0.030.25±0.01青草味 乙酸0.71±0.070.04±0.01刺激味 庚酸0.09±0.020.01±0.00脂肪味 辛酸2.42±0.221.09±0.12糖果 壬酸0.12±0.040.02±0.00脂肪味 正癸酸0.96±0.120.11±0.03木头味其他类 α-法呢烯0.76±0.070.03±0.01 癸醛/0.04±0.00甜橙油味 苯乙醛0.03±0.00/花香 大马士酮1.05±0.031.13±0.01玫瑰香合计146.37123.34
注:/表示未检出
3 结论
通过对分子蒸馏温度、进料流速、刮板转速对红枣酶解液甲醇清除率的影响,结合响应面设计优化清除甲醇的最适工艺条件为蒸馏温度47 ℃,进料流速14 mL/min,刮板转速223 r/min,在此工艺条件下,酶解液甲醇清除率达到82.11%。通过与未经分子蒸馏红枣酒品质对比发现,分子蒸馏能使酶解液糖度上升,使红枣酒酒精度和香气成分含量提升,提高红枣酒品质。
分子蒸馏作为一种近几十年发展起来的分离技术广泛应用于天然物质的提取与分离,对在红枣酒中去除甲醇的应用研究较少,本文针对红枣酒中清除甲醇的工艺条件及适用性进行了探讨,为果酒加工产品在甲醇控制方面提供理论支持。
[1] 侯韬, 朱沛沛, 曾懿, 等.红枣多糖的提取技术及生物活性的研究进展[J].饮料工业, 2013, 16(9):50-53.
HOU T, ZHU P P, ZENG Y, et al.Research progress in extraction and biological actiities of jujube polysaccharides[J].Beerage Industry, 2013, 16(9):50-53.
[2] 李雁琴, 宋丽军, 张丽, 等.不同品种红枣冻干片的理化品质及抗氧化性比较[J].食品研究与开发, 2020, 41(11):28-33;65.
LI Y Q, SONG L J, ZHANG L, et al.Comparison of physic-chemistry qualities and antioxidant actiity of frozen slices of different jujube arieties[J].Food Research and Deelopment, 2020, 41(11):28-33;65.
[3] 周禹含, 毕金峰, 陈芹芹, 等.中国红枣加工及产业发展现状[J].食品与机械, 2013, 29(4):214-217.
ZHOU Y H, BI J F, CHEN Q Q, et al.An introduction on the jujube processing and industry status in China[J].Food & Machinery, 2013, 29(4):214-217.
[4] 宋艺君, 郭涛, 刘世军, 等.响应面法优化黄精-大枣果酒发酵工艺及其抗氧化活性[J].食品工业科技, 2021, 42(1):156-161.
SONG Y J, GUO T, LIU S J, et al.Optimization of fermentation process and antioxidant actiity of polygonati rhizoma-jujubae fructus fruit wine by response surface methodology[J].Science and Technology of Food Industry, 2021, 42(1):156-161.
[5] SAN B, YILDIRIM A N.Phenolic, alpha-tocopherol, beta-carotene and fatty acid composition of four promising jujube (Ziziphus jujuba Miller) selections[J].Journal of Food Composition and Analysis, 2010, 23(7):706-710.
[6] PAWLOWSKA A M, CAMANGI F, BADER A, et al.Flaonoids of Zizyphus jujuba L.and Zizyphus spina-christi (L.) Willd (Rhamnaceae) fruits[J].Food Chemistry, 2009, 112(4):858-862.
[7] 张丽芝. 发酵枣酒中的甲醇和杂醇油控制[J].酿酒科技, 2013(8):36-39.
ZHANG L Z.Control of methanol and fusel oil content in the fermenting process of jujube wine[J].Liquor-making Science & Technology, 2013(8):36-39.
[8] 王胜, 孟昆, 罗会颖, 等.果胶甲酯酶的结构与功能研究进展[J].生物工程学报, 2020, 36(6):1 021-1 030.
WANG S, MENG K, LUO H Y, et al.Research progress in structure and function of pectin methylesterase[J].Chinese Journal of Biotechnology, 2020, 36(6):1 021-1 030.
[9] WANG S R, GU Y L, LIU Q, et al.Separation of bio-oil by molecular distillation[J].Fuel Processing Technology, 2009, 90(5):738-745.
[10] LI D M, ZHONG X R, FAIZA M, et al.Simultaneous preparation of edible quality medium and high purity diacylglycerol by a noel combined approach[J].LWT, 2021, 150:111949.
[11] 刘文龙, 全小梅, 雷英杰, 等.分子蒸馏技术精制柠檬精油工艺[J].食品工业, 2020, 41(9):98-101.
LIU W L, QUAN X M, LEI Y J, et al.Refine of lemon essential oil by molecular distillation technology[J].The Food Industry, 2020, 41(9):98-101.
[12] ZHANG Q X, DU J H, JIN Y H, et al.SO2reduction in distilled grape spirits by three methods[J].Journal of the Institute of Brewing, 2013, 119(4):314-320.
[13] 郭婷婷, 曾俊鹏, 彭斌, 等.分子蒸馏纯化花生油甘油二酯及其成分变化研究[J].中国食品学报, 2020, 20(12):176-183.
GUO T T, ZENG J P, PENG B, et al.Studies on purification of peanut oil diglyceride by molecular distillation and its changes of components[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(12):176-183.
[14] LAORETANI D S, IRIBARREN O A.Optimization of the recycle structure of multiple stages molecular distillation[J].Chemical Engineering Research and Design, 2018, 130:35-41.
[15] 胡雪芳, 田志清, 裴海生, 等.短程分子蒸馏技术精制巨尾桉叶精油工艺优化[J].农业工程学报, 2018, 34(2):299-307.
HU X F, TIAN Z Q, PEI H S, et al.Optimization of short-path molecular distillation technology for refining essential oil from Eucalyptus grandis leaes[J].Transactions of the Chinese Society of Agricultural Engineering, 2018, 34(2):299-307.
[16] YU J, YUAN X G, ZENG A W.A noel purification process for dodecanedioic acid by molecular distillation[J].Chinese Journal of Chemical Engineering, 2015, 23(3):499-504.
[17] MARTINELLO M, HECKER G, CARMEN PRAMPARO M D.Grape seed oil deacidification by molecular distillation:Analysis of operatie ariables influence using the response surface methodology[J].Journal of Food Engineering, 2007, 81(1):60-64.
[18] 黄会娜, 刘玉兰, 杨争光, 等.分子蒸馏法脱除油脂中3-氯丙醇酯和缩水甘油酯[J].食品科学, 2020, 41(20):41-45.
HUANG H N, LIU Y L, YANG Z G, et al.Remoal of 3-monochloro-1,2-propanediol esters and glycidyl esters from corn oil by molecular distillation[J].Food Science, 2020, 41(20):41-45.
[19] ZHANG L, JIANG Y H, PANG X N, et al.Simultaneous optimization of ultrasound-assisted extraction for flaonoids and antioxidant actiity of Angelica keiskei using response surface methodology (RSM)[J].Molecules (Basel, Switzerland), 2019, 24(19):3461.
[20] 马腾臻, 宫鹏飞, 史肖, 等.红枣发酵酒香气成分分析及感官品质评价[J].食品科学, 2021, 42(4):247-253.
MA T Z, GONG P F, SHI X, et al.Aroma components and sensory properties of fermented jujube wine[J].Food Science, 2021, 42(4):247-253.
[21] CAI W C, TANG F X, GUO Z, et al.Effects of pretreatment methods and leaching methods on jujube wine quality detected by electronic senses and HS-SPME-GC-MS[J].Food Chemistry, 2020, 330:127330.
[22] WANG L N, WANG Y Q, WANG W Z, et al.Comparison of olatile compositions of 15 different arieties of Chinese jujube (Ziziphus jujuba Mill.)[J].Journal of Food Science and Technology, 2019, 56(3):1 631-1 640.