凡纳滨对虾(Litopenaeus annamei)又称南美白对虾,是我国大宗养殖对虾之一,2020年中国虾产量496.95万t,其中凡纳滨对虾产量186.29万t[1]。凡纳滨对虾是一种高蛋白、低脂肪的水产品,深受消费者的青睐。但我国对虾主要以去头虾、冷冻虾仁等初级的加工方式为主,低附加值的对虾制品较多,高附加值产品较为缺乏[2]。在对虾精加工方式中,虾肉糜是其高附加值制品之一,其营养价值高和良好的感官体验受到广大消费者的喜爱。
在虾肉糜制作漂洗过程中,部分水溶性蛋白流失,从而降低了虾肉糜的营养价值;但是不经过漂洗盐溶性蛋白含量相对较低,使得虾肉糜凝胶强度较差,不仅增加了生产成本,也限制了其规模化生产,热处理方式与添加辅料是增强虾肉糜制品凝胶强度的主要方式[3]。GUO等[4]采用高密度 CO2来改良虾肉糜的凝胶品质,改良后的虾肉糜凝胶品质比传统热处理更优质;杨林莘等[5]研究表明通过微波处理大豆分离蛋白复合的虾肉糜比传统的水浴加热更能有效提高虾肉糜凝胶品质;袁莉莉等[6]在虾肉糜中添加一定量的鱼糜,复配虾肉糜的硬度、弹性与持水性得到有效的改良。相较于传统热处理方式,新型的热处理方式虽然能有效改良虾肉糜的凝胶品质,但是设备昂贵,操作繁琐,与需专门技术人员管理,生产成本没有降低。
黄原胶是一种高黏度水溶性微生物胞外多糖,能与蛋白质发生共凝胶作用,有效促进凝胶结构的形成,是一种廉价并且在食品工业中广泛使用的凝胶增强剂[7];罗非鱼是我国大宗养殖的淡水鱼类之一,价格低廉、营养丰富,其蛋白比一些海水鱼蛋白有着良好的凝胶性能,能有效地提高鱼糜的弹性、凝胶强度,鱼糜制品外观更为圆润、完整[8]。因此,黄原胶和罗非鱼鱼糜都能有效地改良肉糜制品的凝胶品质且能降低生产成本,但目前尚未有利用黄原胶与罗非鱼鱼糜产生共凝胶作用来改良虾肉糜的研究。本文以虾肉糜为原料,通过添加黄原胶和罗非鱼鱼糜制备复配虾肉糜,以凝胶强度为主要指标,优化改良虾肉糜的工艺条件,并通过持水性、水分分布、傅里叶红外光谱、热稳定性与流变特性来比较改良前后虾肉糜凝胶品质的变化,以期为虾肉糜的凝胶品质改良提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜凡纳滨对虾(Litopenaeus annamei),规格为40~45尾/kg,捕获于2021年6~8月,购买于广东省湛江市霞山区水产品批发市场,加冰块保活运输至实验室;罗非鱼鱼糜,广东省汕尾市林记水产股份有限公司;黄原胶(食品级),山东皁丰发酵有限公司;食盐(食品级),广东省盐业集团有限公司。
溴化钾(分析纯),国药集团化学试剂有限公司;其他试剂均为国产试剂纯。
1.2 仪器与设备
GZB20型高速斩拌机,广州市汕宝食品厂机械部;Thermo Lynx6000高速落地离心机,美国赛默飞世尔科技公司;FJ-200高速均质机,上海标本模型厂;HAAKE MARSⅢ型模块化高级流变仪,美国 Thermo Fisher Scientific公司;TMS-Pro型物性分析质构仪,美国FTC公司;NMI20-060H-I型低频核磁共振成像分析仪,苏州纽迈分析仪器股份有限公司;TENSOR27 傅立叶红外光谱仪,江苏天瑞仪器股份有限公司;SA449F3差示扫描量热仪,美国TA公司。
1.3 实验方法
1.3.1 虾肉糜的制备工艺
新鲜凡纳滨对虾清洗干净、去壳、去头等前处理,称取适量的虾仁放入斩拌机进行斩拌处理(添加3%食盐、黄原胶与罗非鱼鱼糜),斩拌至虾肉糜呈灰色黏稠状即可。将制备好的虾肉糜灌装至聚乙烯肠衣中,两端扎紧,采用二段加热的方法进行凝胶化,随后取出冷却, 4 ℃放置过夜备用。
1.3.2 复配虾肉糜的单因素试验
复配虾肉糜的固定条件为:黄原胶添加量为3%、罗非鱼鱼糜添加量为7%,斩拌时间为90 s、凝胶化温度为44 ℃[9]与凝胶化时间为25 min。固定其他条件不变,改变其中某个因素条件分别分析对复配虾肉糜凝胶强度的影响。设置各因素的梯度分别为:以虾肉质量为基准,不低于85% 计算,黄原胶添加量为虾肉质量的0%、1%、2%、3%、4%、5%;罗非鱼鱼糜添加量为虾肉质量的0%、1%、3%、5%、7%、9%;斩拌时间30、50、70、90、110 s;凝胶时间15、20、25、30、35 min。用质构仪测定凝胶强度作为判定指标,测试参数为:探头上升到样品表面的高度为30 mm,测试速度1 mm/s,选用P/0.5柱形探头,测试形变量50%,起始力为 0.5 N,每个样品测6次取平均值。
1.3.3 正交试验优化复配虾肉糜的最佳工艺
以凝胶强度为评价指标,依据单因素试验结果,选取黄原胶添加量(A)、罗非鱼鱼糜添加量(B)、斩拌时间(C)与凝胶化时间(D)4因素的3个水平进行L9(34)的正交试验。因素水平表如表1所示。
表1 正交试验设计
Table 1 Orthogonal experimental design

水平因素A黄原胶添加量/%B罗非鱼鱼糜添加量/%C斩拌时间/sD凝胶时间/min1257020237902534911030
1.3.4 虾肉糜持水性的测定
参考ZHANG等[10]的方法,稍作修改。从冰箱中取出虾肉糜,在室温20 ℃左右放置到常温状态,去除虾糜的肠衣,切成薄片(2 mm厚),再平均分成8等份。称取1.5~2.0 g样品(m1,g)在18 ℃下离心(8 000 r/min)10 min,离心后用滤纸吸干虾肉糜表面水分,称取样品的质量(m2,g)。在每组样品中重复测定5次,取平均值,持水性(water holding capacity,WHC)计算如公式(1)所示:
(1)
1.3.5 虾肉糜水分分布的测定
参考ZHANG等[11]的方法,稍作修改。低场核磁共振仪(low-field nuclear magnetic resonance,LF-NMR)中的自旋质子自旋弛豫时间定义为测量时的条件:其质子共振频率约为22.6 MHz,温度为3 ℃。将9 g样品放入15 mm的核磁管中。选择Caar-Purcell-Meiboom-Gill(CPMG)脉冲序列用于线性确定序列数据,τ值(90°电流脉冲和180 °电流脉冲之间的持续时间)为100 μs。重复进行波扫描可以得到稳定的波曲线,使用电子仪器系统随附的反演计算软件,对通过测量CPMG索引序列获得的每个索引峰的衰减率曲线进行反演CPMG指数衰减曲线得到T2图谱。
1.3.6 虾肉糜傅里叶变换红外光谱的测定
参考JI等[12]的方法,稍作修改。在玛瑙研钵中取1.50 mg样品和25.0 mg白色晶体状溴化钾,在蓝色红外灯下研磨以制成细粉,使用电动压片机压制成粉粒饼状的小薄片。用夹子固定好放入傅里叶气相变换吸收红外光谱仪中,测试在4 000~400 cm-1的相变吸收红外光谱,在N2的保护下进行测定。
1.3.7 虾肉糜流变特性热稳定性的测定
参考于传龙等[13]的方法,稍作修改。称取30 mg虾肉糜样品于铝盘中,放入压片机密封,同时以密封的空铝盘作为参比。初始温度为25 ℃,结束温度为115 ℃,升温速度为10 ℃/min,N2流速40 mL/min,得差示扫描量热法曲线。
1.3.8 虾肉糜流变特性的测定
参考JI等[14]的方法,稍作修改。样品被切割成1 mm厚的均匀薄片,在25 ℃下以1 mm的固定间隙添加到直径20 mm的平行板上,转子型号 P35Ti L。在0.01~10 Hz对动态黏弹性进行弹性模量(G′)和黏性模量(G″)的频率扫描,应变扫描为1%。
1.4 数据处理
所有试验重复3 次,每次样品检测重复3 次以上。用JMP Pro 14.0软件对数据进行分析,显著性差异检验使用Tukey多重检验(P<0.05,差异显著),图形均采用Origin 2021软件绘制,结果以平均值±标准差的形式表示。
2 结果与分析
2.1 复配虾肉糜的单因素试验
2.1.1 黄原胶和罗非鱼鱼糜添加量对虾肉糜凝胶特性的影响
凝胶强度是虾肉糜质量优劣的重要指标之一,虾肉糜蛋白形成的三维网状结构是维持凝胶特性的重要因素,添加辅料是改良虾肉糜凝胶强度重要方式之一[3]。如图1-a所示,随着黄原胶添加量的增加,虾肉糜的凝胶强度先升高后降低。当黄原胶添加量为3%时,虾肉糜凝胶强度达到最大值为37.5 N·mm,然而当黄原胶添加量继续增加时,虾肉糜的凝胶强度却随之显著下降(P<0.05),这是因为低添加量的黄原胶能够与蛋白通过静电作用产生的共凝胶作用来提高虾肉糜的凝胶强度,而过多的添加量提高了黄原胶的阴离子电负性与虾肉糜蛋白基团之间静电斥力,不利于三维网状结构的形成,从而降低了虾肉糜凝胶强度[15]。
从图1-b可知,在罗非鱼鱼糜添加量为5%时,虽然凝胶强度有所下降,但差异不显著(P>0.05)。当罗非鱼鱼糜添加量为7% 时,其凝胶强度达到最大值为38 N·mm,然而随着罗非鱼鱼糜添加量继续增加,虾肉糜凝胶强度显著下降(P<0.05)。添加适量的罗非鱼鱼糜能提高虾肉糜凝胶强度,是因为其内源性的金属离子等催化剂促进了内部肌球蛋白之间的相互作用,从而使三维网状结构更加紧密,而且黄原胶与罗非鱼鱼糜存在着共凝胶作用,因此通过添加黄原胶和罗非鱼鱼糜能显著提高虾肉糜的凝胶强度;但是罗非鱼鱼糜本身盐溶性蛋白含量较少,而巯基含量较高,所以过多的罗非鱼鱼糜反而导致虾肉糜凝胶强度的下降[16]。因此,最佳添加量为黄原胶3%、罗非鱼鱼糜7%。
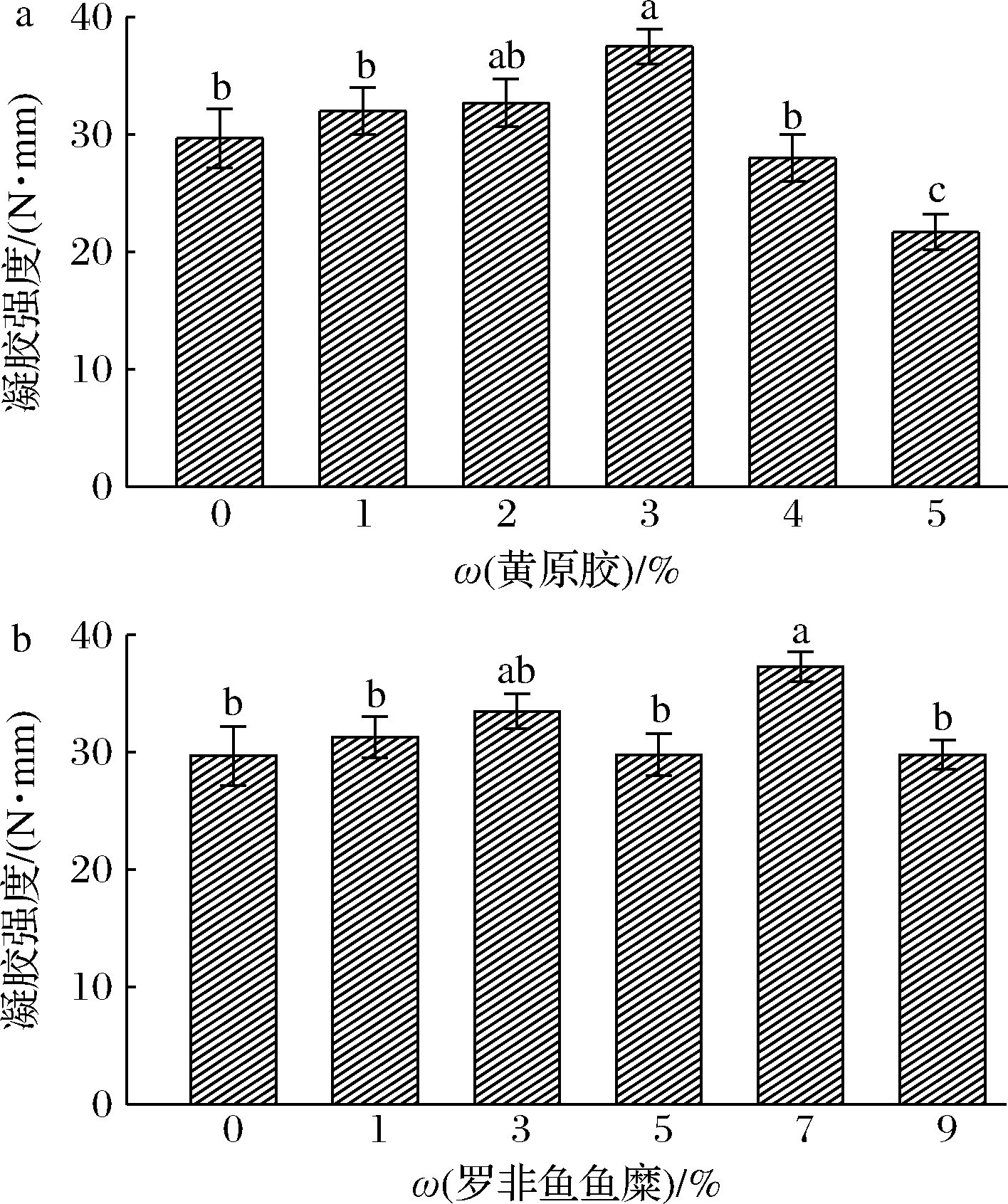
a-黄原胶;b-罗非鱼鱼糜
图1 黄原胶和罗非鱼鱼糜对虾肉糜凝胶强度的影响
Fig.1 Effect of xanthan gum and tilapia surimi on the gel strength of shrimp surimi 注:不同小写字母表示有差异性显著(P<0.05)(下同)
2.1.2 斩拌时间和凝胶化时间对虾肉糜凝胶特性的影响
盐溶性蛋白的含量能够直接影响到虾肉糜的凝胶强度,斩拌时间的长短能够在一定程度上影响到盐溶性蛋白的含量。适当的斩拌时间能够破坏虾肉糜中的肌纤维组织,促进盐溶性蛋白的释放,从而增加虾肉糜的凝胶强度。从图2-a可知,斩拌时间为30~70 s,虾肉糜的凝胶强度没有显著差异(P>0.05),但当斩拌时间为90 s时,虾肉糜凝胶强度达到最大值为14 N·mm。可能是由于斩拌时间过短,没有充分使肌纤维组织中的盐溶性蛋白释放出来,不利于三维网状结构的形成;然而过长的斩拌时间促进了组织蛋白酶从肌肉细胞中的释放,使得组织蛋白酶对肌原纤维蛋白产生降解作用,从而不利于凝胶结构的形成[17]。
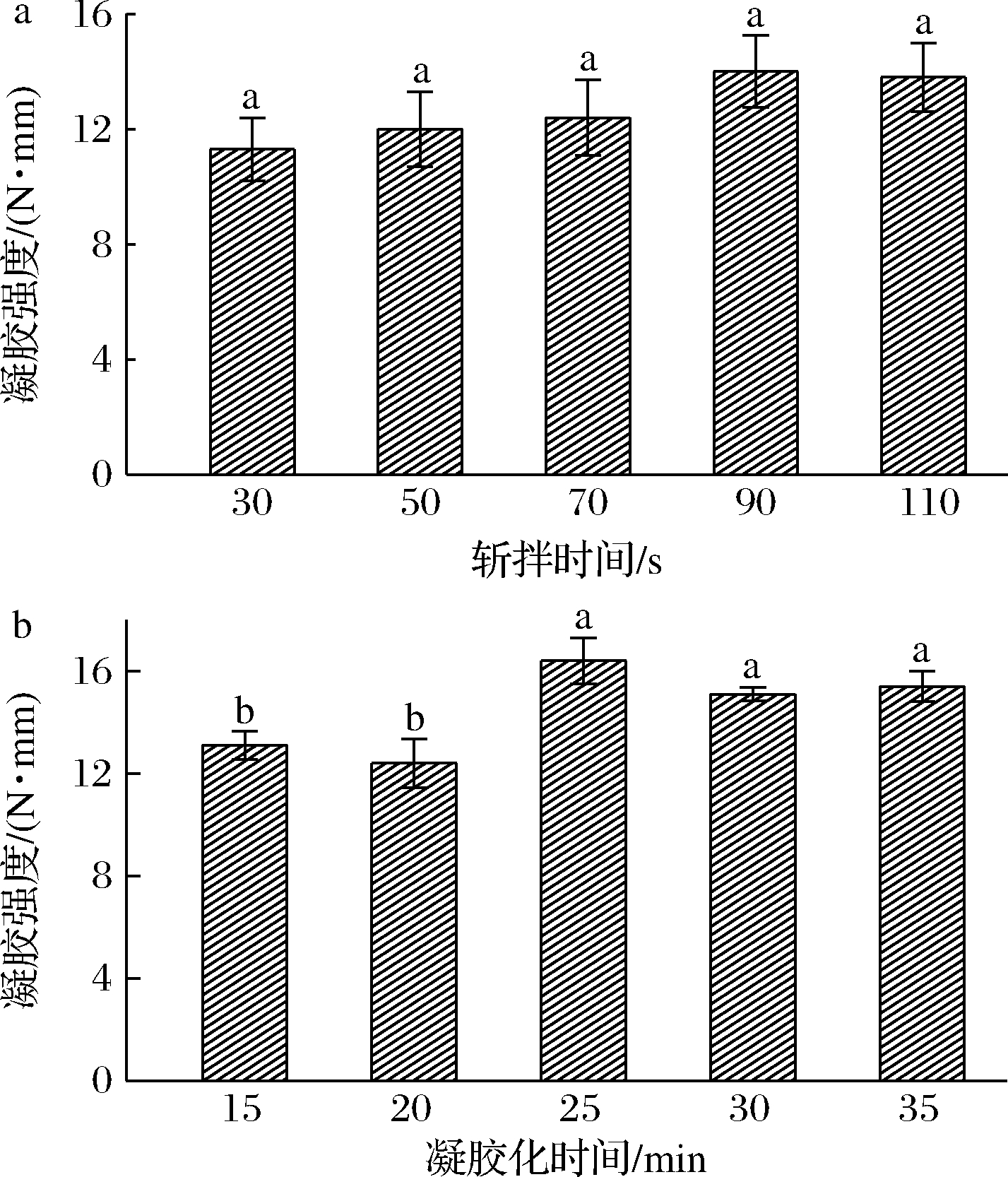
a-斩拌时间;b-凝胶时间
图2 斩拌时间和凝胶化时间对复配虾肉糜 凝胶强度的影响
Fig.2 Effect of chopping time and gelling time on the gel strength of compound shrimp surimi
凝胶化过程中,三维网状空间结构的形成需要一定的时间,适当的凝胶化时间促使黄原胶-罗非鱼鱼糜复合物中具有疏水性活性位点的转谷氨酰胺酶和虾肉糜中谷氨酰胺残基充分暴露出来,有利于其共凝胶作用,从而提高凝胶化程度。从图2-b中可知,凝胶化时间为 25 min 时,与15、20 min相比较有显著增加(P<0.05),其凝胶强度达到最大值为 16.5 N·mm,证明凝胶化时间能有效提高虾肉糜的凝胶强度,但是随着凝胶化时间的增加,虾肉糜凝胶强度呈现下降的趋势。这是因为过度的凝胶化时间会使得组织蛋白酶与热稳定碱性蛋白酶过度水解蛋白质,从而使得虾肉糜的凝胶化程度下降[18]。因此,最佳的斩拌时间与凝胶化时间分别为90 s、25 min。
2.2 复配虾肉糜的正交试验
在单因素试验结果的基础上,对黄原胶添加量、罗非鱼鱼糜添加量、斩拌时间、凝胶化时间,采用4因素3水平的正交表L9(34),以凝胶强度为评价指标进行试验。具体试验方案及结果如表2所示。
由表2 极差分析结果可知,在复配虾肉糜的工艺条件中影响凝胶强度的主次因素为凝胶化时间>罗非鱼鱼糜添加量>黄原胶添加量>斩拌时间;复配虾肉糜的最佳工艺为A2B2C2D1,即黄原胶添加量3%,罗非鱼鱼糜添加量7%,斩拌时间90 s,凝胶时间20 min,在此条件下凝胶强度为29.55 N·mm,而纯虾肉糜凝胶强度为19.23 N·mm;根据GB/T 36187—2018《冷冻鱼糜》,复配虾肉糜凝胶强度达到AA级国家标准,而纯虾肉糜凝胶强度仅为AB级国家标准。
表2 正交试验方案及结果
Table 2 Orthogonal experiment scheme and result analysis
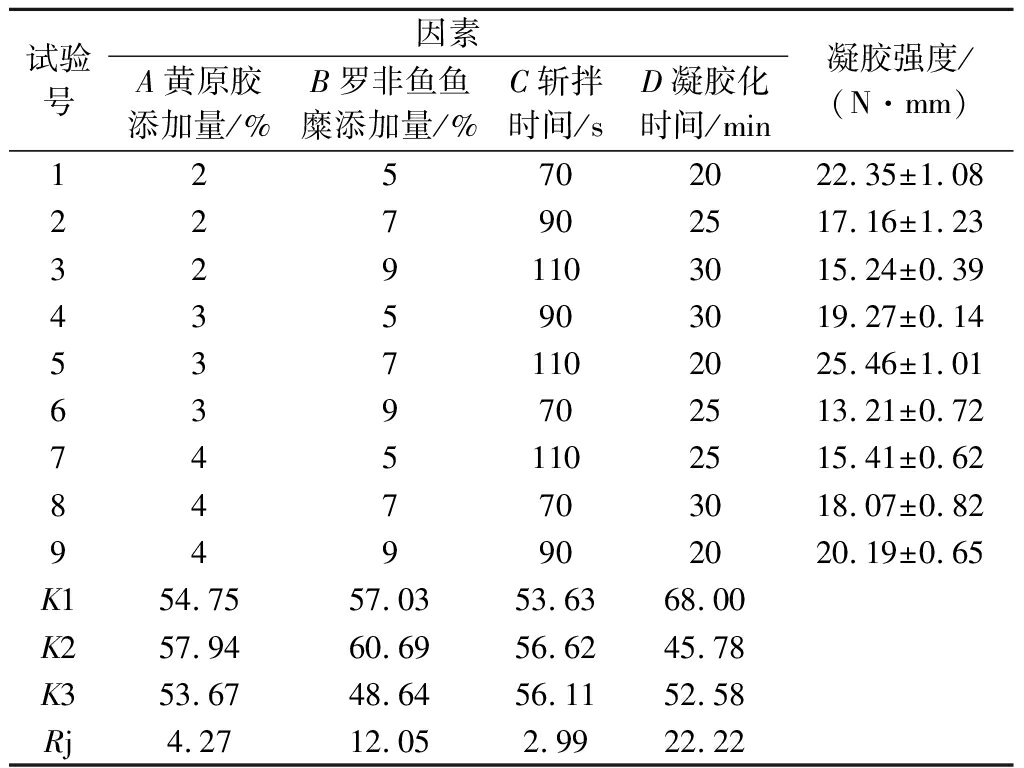
试验号因素A黄原胶添加量/%B罗非鱼鱼糜添加量/%C斩拌时间/sD凝胶化时间/min凝胶强度/(N·mm)125702022.35±1.08227902517.16±1.233291103015.24±0.39435903019.27±0.145371102025.46±1.01639702513.21±0.727451102515.41±0.62847703018.07±0.82949902020.19±0.65K154.7557.0353.6368.00K257.9460.6956.6245.78K353.6748.6456.1152.58Rj4.2712.052.9922.22
2.3 复配虾肉糜的最优工艺与验证试验
通过正交试验得到最佳的制备条件为:黄原胶添加量3%,罗非鱼鱼糜添加量7%,斩拌时间90 s,凝胶时间20 min,得到虾肉糜凝胶强度理论最大值为29.55 N·mm。对此理论结果进行验证,3次平行试验验证结果为(28.17±0.39)N·mm,与理论预测值的相对误差为2.56%,说明该模型能较好预测复配虾肉糜的生产工艺。
2.4 复配虾肉糜与纯虾肉糜的凝胶品质比较
2.4.1 黄原胶和罗非鱼鱼糜对虾肉糜持水性的影响
持水性反映了虾肉糜凝胶保持其内部水分的能力,是虾肉糜凝胶品质的重要参数之一;具有良好持水性的虾肉糜制品受到外部压力挤压时,能够降低其内部的水分渗出率,保持水分稳定在凝胶的三维网状结构中,并保持优良的品质[19]。与纯虾肉糜相比较,复配虾肉糜的持水性由74.8%显著增加到87.5%,是由于黄原胶-鱼肉蛋白共凝胶作用形成更加致密的三维网状结构,使得虾肉糜凝胶能够截留更多的水分,以及黄原胶与蛋白质发生相互作用后,填充于虾肉糜凝胶的网状孔洞中,使其具有一定的吸水性,从而提高虾肉糜的持水性能,改善虾肉糜的品质[20]。
2.4.2 黄原胶和罗非鱼鱼糜对虾肉糜水分分布的影响
虾肉糜凝胶不同状态的水分子分布情况与虾肉糜凝胶性能有着密切的关联性。在虾肉糜凝胶中,其主要的水分状态是不易流动水,能够直接反映凝胶三维网状结构的状态,从而反映出虾肉糜的品质优劣。通过弛豫时间 T2反映虾肉糜凝胶中水分的结合状态,随着弛豫时间 T2的增加,水分从结合水逐渐过渡到自由水,水分子变得更容易流动[21]。由图3-a可知,在低场核磁共振曲线中呈现出3个峰,其中 T21(0~10 ms)代表的是水分子与底物紧密结合水;T22(10~100 ms)代表的是包裹在虾肉糜凝胶三维网状结构中的不易流动水,是虾肉糜凝胶最为主要的水分状态;T23(100~10 000 ms)代表不与底物结合的自由流动水[22]。
图3-b呈现的是虾肉糜中结合水、不易流动水与自由水之间的相对百分含量,与纯虾肉糜相比,复配虾肉糜凝胶中不易流动水含量从91.6%提升到94.1%,自由水从4.13%下降到1.8%,结合水变化较小。黄原胶-鱼肉蛋白共凝胶作用形成更加致密的网状结构,具有截留更多水分子与吸水的特性,使得不易流动水含量增加[16]。该结果与虾肉糜的持水性相对应,表明通过复配的虾肉糜能够有效地改善其凝胶性能,提高虾肉糜的品质。
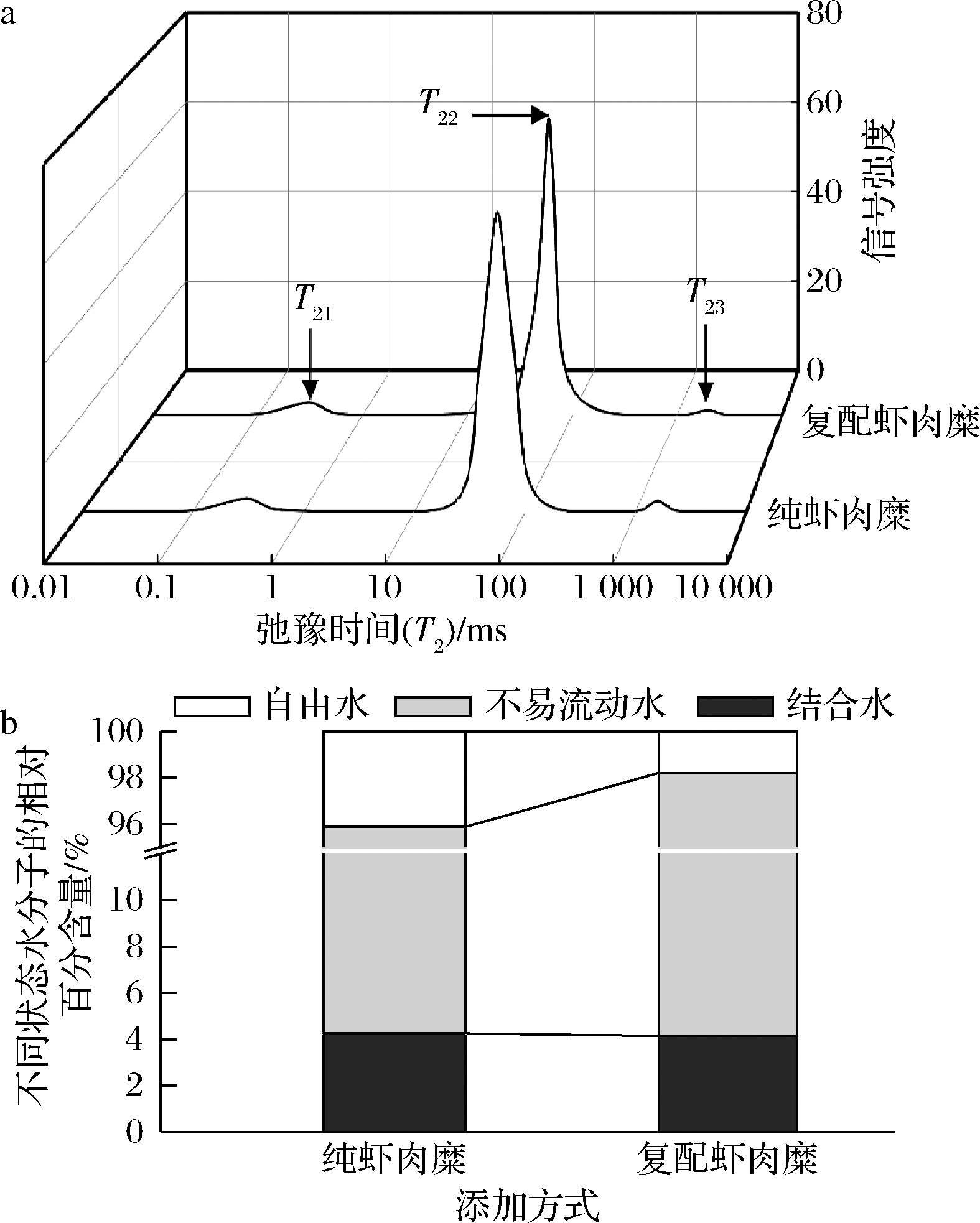
a-虾肉糜水分弛豫时间T2分布; b-虾肉糜不同状态水分子的相对百分含量
图3 黄原胶和罗非鱼鱼糜对虾肉糜水分分布的影响
Fig.3 Effect of xanthan and gum-tilapia surimi on the water distribution of shrimp surimi
2.4.3 黄原胶和罗非鱼鱼糜对虾肉糜傅里叶变换红外光谱的影响
虾肉糜凝胶三维网状空间结构的形成主要是由大量的盐溶性蛋白质分子的化学基团之间发生相互作用的结果;蛋白质的二级结构是蛋白质的三维网状空间构象的基础,氢键是蛋白质二级结构的主要作用力,维持着二级结构不受破坏,傅里叶变换红外光谱是1种有效检测蛋白质分子中的化学基团特征吸收带的方法[23]。从图4可以看出,与纯虾肉糜相比较,复配虾肉糜在3 300 cm-1附近吸收峰发生了红移,是由于盐溶蛋白含量的增加,使得虾肉糜凝胶体系中的N—H增多,提高蛋白质二级结构的稳定性,使得虾肉糜的三维结构更为致密,提高虾肉糜的凝胶品质[15]。
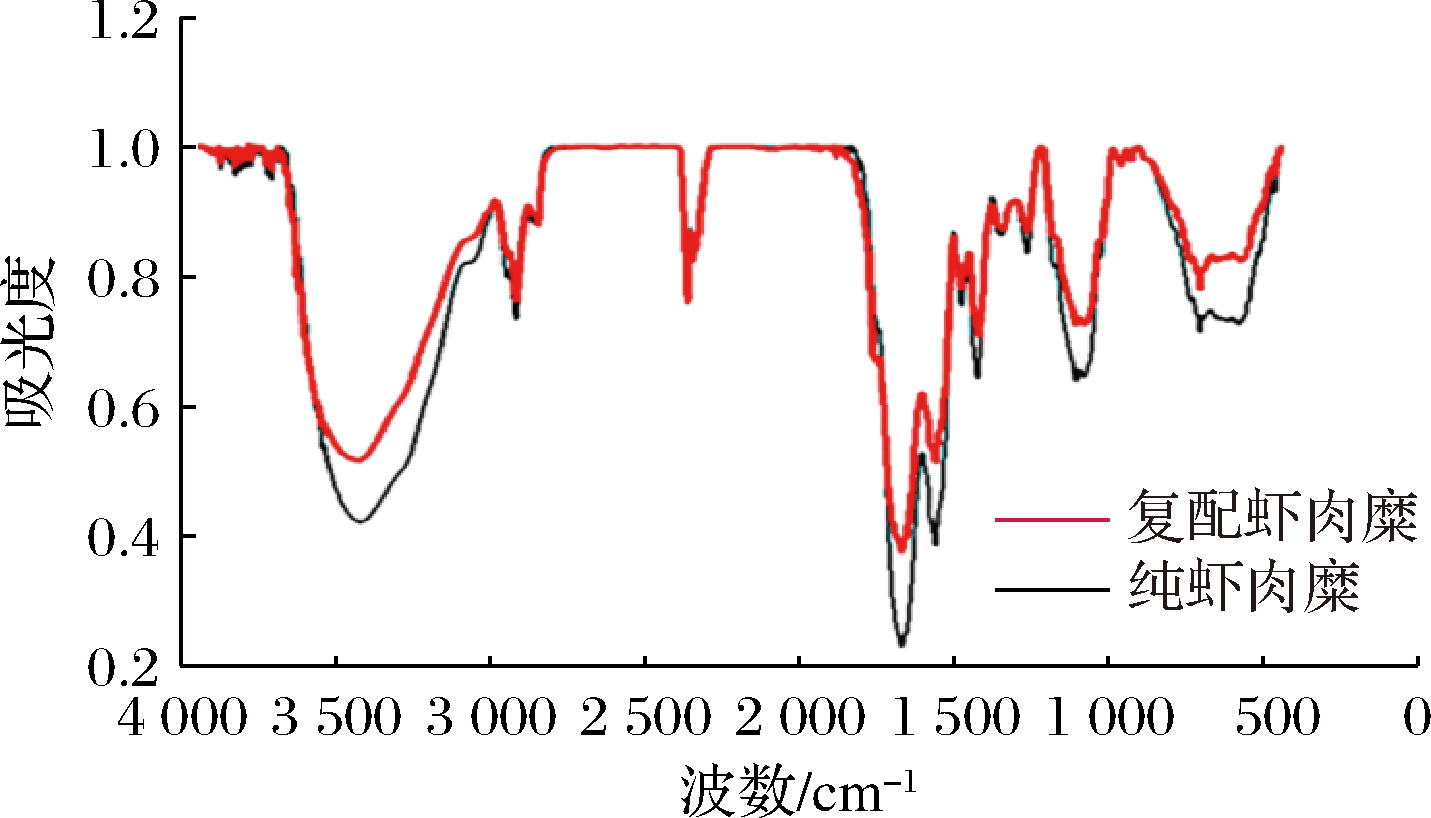
图4 黄原胶和罗非鱼鱼糜对虾肉糜傅里叶 变换红外光谱的影响
Fig.4 Effect of xanthan and gum-tilapia surimi on Fourier transform infrared spectrum of shrimp surimi
2.4.4 黄原胶和罗非鱼鱼糜对虾肉糜热稳定性的影响
从制备好的虾肉糜到消费者品尝的过程中,经历了存储、运输、烹饪等环节,每个环节都会影响虾肉糜凝胶品质的稳定性,特别是在消费者环节会进行热处理,而蛋白质三维网状结构的热稳定性会在很大程度上影响虾肉糜凝胶品质的稳定性。从表3可知,在热相变温度峰1是吸热峰,表明肌球蛋白发生了变性,但是复配虾肉糜的热相变温度比纯虾肉糜更高,为43.5 ℃;在热相变温度峰2是放热峰,表明肌动蛋白发生了分子聚集[13],但是复配虾肉糜的热相变温度比纯虾肉糜更高,为105.4 ℃。改良后的虾肉糜蛋白变性温度上升,表明黄原胶-鱼肉蛋白共凝胶作用能有效提高虾肉糜凝胶品质的热稳定性,更有利于虾肉糜在进一步的深加工与销售过程中保持其品质的稳定性。
表3 黄原胶和罗非鱼鱼糜对虾肉糜热稳定性的影响
Table 3 Effect of xanthan and gum- tilapia surimi on the thermal stabilityof shrimp surimi
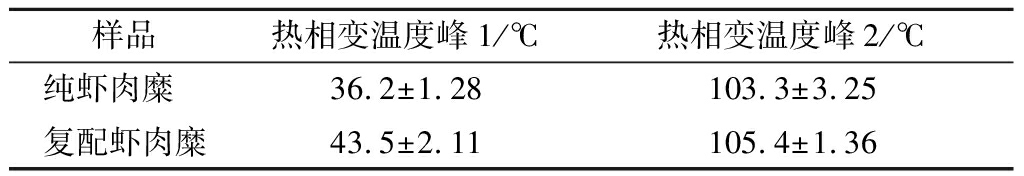
样品热相变温度峰1/℃热相变温度峰2/℃纯虾肉糜 36.2±1.28103.3±3.25复配虾肉糜43.5±2.11105.4±1.36
2.4.5 黄原胶和罗非鱼鱼糜对虾肉糜流变特性影响
在流变学中,弹性模量(G′)反映的是凝胶制品的弹性特征,黏性模量(G″)反映的是凝胶制品的黏性特征;在虾肉糜凝胶中,其弹性特征比黏性特征更为重要,因为其能够反映出虾肉糜凝胶的三维网状结构结合状态;通过G″与G′的比值,即损耗角正切tan δ值反映凝胶体系的流变特性,tan δ<1代表凝胶体系以弹性为主,tan δ>1代表凝胶体系以黏性为主[24]。由图5可知,在线性区间内,复配虾肉糜凝胶的G′与G″都比纯虾肉糜的大,改良前后的虾肉糜的G′远大于G″,即tan δ<1,其中复配虾肉糜的tan δ比纯虾肉糜更小,表明复配的虾肉糜相比于纯虾肉糜具有优良的弹性,黄原胶-鱼肉蛋白共凝胶作用提高了虾肉糜的凝胶品质。随着振荡频率的增加,复配虾肉糜凝胶的G′与G″也随之增加,这是由于虾肉糜的剪切稀化现象导致的;在较低的振荡频率下,虾肉糜凝胶内部的蛋白质分子相互作用,形成稳定的三维结构,使其不被破坏,较小的频率反而更有利于其网状结构的形成[25]。当振荡频率过高时,虾肉糜凝胶的三维网状结构受到破坏,流动性增加,但G′始终远大于G″,虾肉糜凝胶的弹性成分占优势。
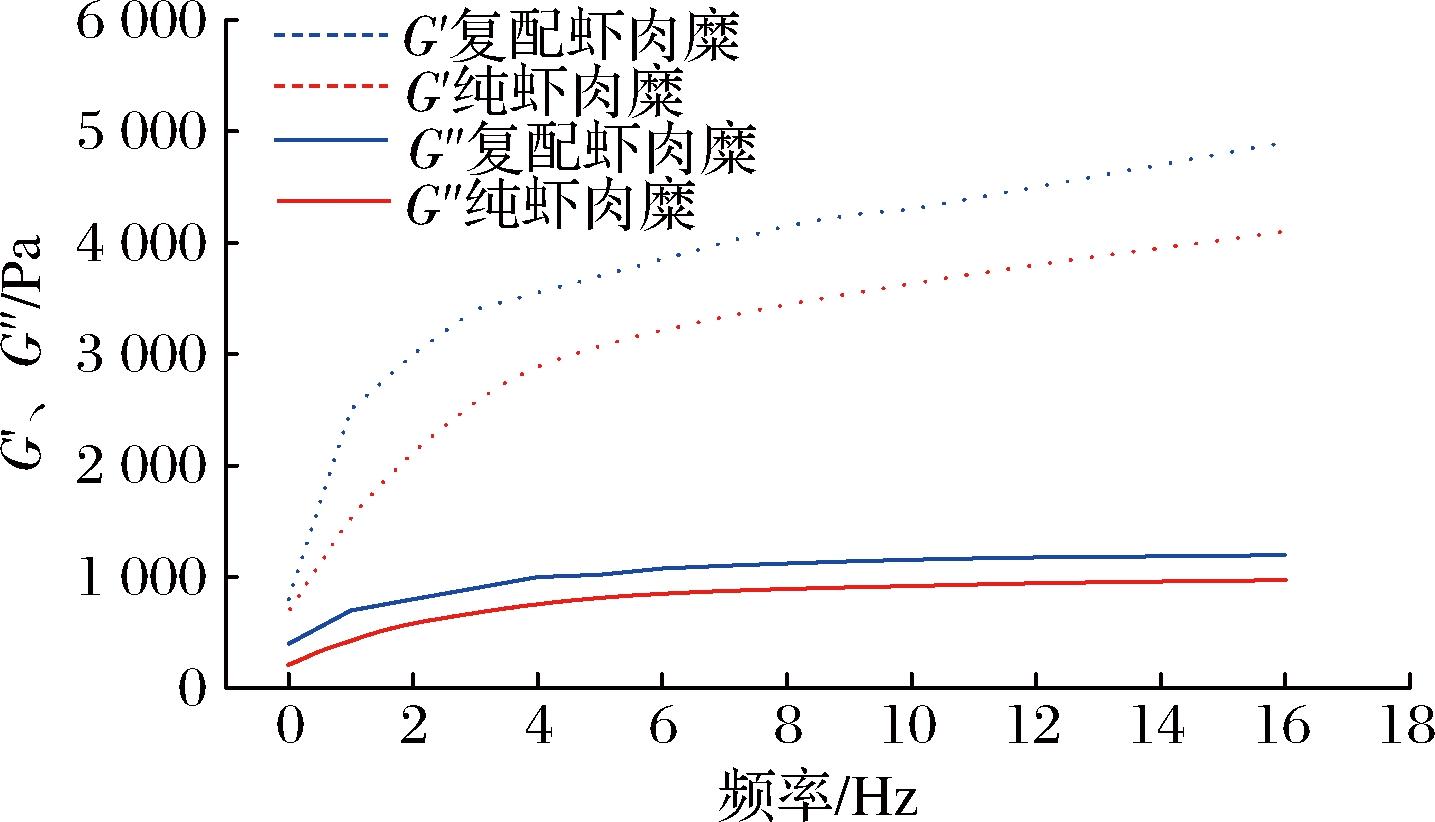
图5 黄原胶和罗非鱼鱼糜对虾肉糜流变特性的影响
Fig.5 Effect of xanthan and gum- tilapia surimi on the rheological properties of shrimp surimi
3 结论
本研究添加了黄原胶和罗非鱼鱼糜改良虾肉糜的凝胶品质,优化得到工艺条件:黄原胶添加量3%,罗非鱼蛋白添加量7%,斩拌时间90 s,凝胶时间20 min,在此条件下凝胶强度为29.55 N·mm,达到AA级国家标准。相比于纯虾肉糜,复配虾肉糜的持水性有所提高,水分组成的分布更为理想,促进了凝胶品质;复配虾肉糜的盐溶性蛋白质含量与热稳定性有所提高,凝胶强度、弹性模量(G′)与黏性模量(G″)也有所提高,有助于保持虾肉糜的形状和提高产品的稳定性,这说明黄原胶和罗非鱼鱼糜复配产生的共凝胶作用能显著提高虾肉糜的凝胶品质,降低生产成本,得到优质的虾肉糜制品。
[1] 农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会.中国渔业统计年鉴—2021[M].北京:中国农业出版社, 2021.
Ministry of Agriculture and Rural Affairs of the People’s Republic of China, National Fisheries Technology Extension Centre, China Society of Fisheries.China Fishery Statistical Yearbook-2021[M].Beijing:China Agric ulture Press, 2021.
[2] 杨帆, 万金庆, 厉建国.微冻贮藏虾仁的水分迁移与品质变化[J].食品与发酵工业, 2019, 45(20):68-74.
YANG F, WAN J Q, LI J G.Study on water migration and quality changes of shrimp in hyper-chilling storage[J].Food and Fermentation Industries, 2019, 45(20):68-74.
[3] 王锡昌, 汪之和.鱼糜制品加工技术[M].北京:中国轻工业出版社, 1997.
WANG X C, WAN Z H.Processing Technology of Surimi Products[M], Beijing:China Light Industry Press, 1997.
[4] GUO M H, LIU S C, ISMAIL M, et al.Changes in the myosin secondary structure and shrimp surimi gel strength induced by dense phase carbon dioxide[J].Food Chemistry, 2017, 227:219-226.
[5] 杨林莘, 王冰冰, 尹雅岚, 等.加热方式对南美白对虾虾肉糜及其大豆分离蛋白复合物凝胶特性的影响[J].食品与发酵工业, 2017, 43(7):201-206.
YANG L X, WANG B B, YIN Y L, et al.Effects of heating processing on gel properties of minced white shrimp(Penaeus anmamei) and soy protein isolate compounds[J].Food and Fermentation Industries, 2017, 43(7):201-206.
[6] 袁莉莉, 刘书成, 解万翠, 等.虾肉和鱼肉混合肉糜凝胶特性的研究[J].食品工业科技, 2013, 34(12):246-250.
YUAN L L, LIU S C, XIE W C, et al.Study on gel properties of surimi mixed by shrimp and fish meat[J].Science and Technology of Food Industry, 2013, 34(12):246-250.
[7] LUTFI Z, ALAM F, NAWAB A, et al.Effect of NaCl on physicochemical properties of xanthan gum-water chestnut starch complexes[J].International Journal of Biological Macromolecules, 2019, 131:557-563.
[8] 何晓萌, 黄卉, 李来好, 等.罗非鱼与海水鱼制备混合鱼糜的凝胶特性研究[J].食品工业科技, 2018, 39(2):5-9.
HE X M, HUANG H, LI L H, et al.Research on gel properties of tilapia and sea fish mixed surimi[J].Science and Technology of Food Industry, 2018, 39(2):5-9.
[9] 蓝尉冰. 凡纳滨对虾肌肉蛋白组成及其肉糜特性研究[D].湛江:广东海洋大学, 2012.
LAN W B.Study on the muscle protein composition of Litopenaeus annamei and its meat surimi properties[D].Zhanjiang:Guangdong Ocean Uniersity, 2012.
[10] ZHANG Z Y, REGENSTEIN J M, ZHOU P, et al.Effects of high intensity ultrasound modification on physicochemical property and water in myofibrillar protein gel[J].Ultrasonics Sonochemistry, 2017, 34:960-967.
[11] ZHANG L L, XUE Y, XU J, et al.Effects of high-temperature treatment (≥100 ℃) on Alaska Pollock (Theragra chalcogramma) surimi gels[J].Journal of Food Engineering, 2013, 115(1):115-120.
[12] JI L, ZHANG T, FENG D, et al.Dielectric properties and deacetylation of konjac glucomannan[J].Current Topics in Nutraceutical Research, 2015, 13(4):267-274.
[13] 于传龙, 王嵬, 乔翠平, 等.金线鱼-白鲢鱼混合鱼糜凝胶蛋白质构象和作用力的研究[J].食品安全质量检测学报, 2020, 11(22):8 200-8 209.
YU C L, WANG W, QIAO C P, et al.Study on the protein conformation and chemical forces of mixed surimi from Nemipterus irgatus and siler carp[J].Journal of Food Safety & Quality, 2020, 11(22):8 200-8 209.
[14] JI L, XUE Y, ZHANG T, et al.The effects of microwae processing on the structure and arious quality parameters of Alaska pollock surimi protein-polysaccharide gels[J].Food Hydrocolloids, 2017, 63:77-84.
[15] MONTERO P, HURTADO J L, PÉREZ-MATEOS M.Microstructural behaiour and gelling characteristics of myosystem protein gels interacting with hydrocolloids[J].Food Hydrocolloids, 2000, 14(5):455-461.
[16] 王嵬, 仪淑敏, 李学鹏, 等.鱼糜凝胶的形成机制及混合鱼糜研究进展[J].食品安全质量检测学报, 2016, 7(1):231-237.
WANG W, YI S M, LI X P, et al.Formation mechanism of surimi gelation and research progress on blend surimi[J].Journal of Food Safety & Quality, 2016, 7(1):231-237.
[17] POOWAKANJANA S, MAYER S G, PARK J W.Optimum chopping conditions for Alaska pollock, Pacific whiting, and threadfin bream surimi paste and gel based on rheological and Raman spectroscopic analysis[J].Journal of Food Science, 2012, 77(4):E88-E97.
[18] LIU L, LUO Y K, SONG Y L, et al.Study on gel properties of siler carp (Hypophthalmichthys molitrix) and white croaker (Argyrosomus argentatus) blended surimi at different setting conditions[J].Journal of Aquatic Food Product Technology, 2013, 22(1):36-46.
[19] RAWDKUEN S, BENJAKUL S.Whey protein concentrate:Autolysis inhibition and effects on the gel properties of surimi prepared from tropical fish[J].Food Chemistry, 2008, 106(3):1 077-1 084.
[20] MORRIS J, STEPHEN A M, PHILLIPS G O, et al.Food polysaccharides and their applications[J].Bacterial Polysaccharides,2006, 413-424.
[21] AHMAD M U, TASHIRO Y, MATSUKAWA S, et al.Gelation mechanism of surimi studied by 1H NMR relaxation measurements[J].Journal of Food Science, 2007, 72(6):E362-E367.
[22] MØLLER S M, GROSSI A, CHRISTENSEN M, et al.Water properties and structure of pork sausages as affected by high-pressure processing and addition of carrot fibre[J].Meat Science, 2011, 87(4):387-393.
[23] HUANG Y T, LIAO H F, WANG S L, et al.Glycation and secondary conformational changes of human serum albumin:Study of the FTIR spectroscopic cure-fitting technique[J].AIMS Biophysics, 2016, 3(2):247-260.
[24] ZHAO Y L, WANG J B, SHAN L M, et al.Effect of Radix isatidis polysaccharides on immunological function and expression of immune related cytokines in mice[J].Chinese Journal of Integratie Medicine, 2008, 14(3):207-211.
[25] ZHANG M, LI J H, DING C C, et al.The rheological and structural properties of fish collagen cross-linked by N-hydroxysuccinimide actiated adipic acid[J].Food Hydrocolloids, 2013, 30(2):504-511.