白鲢鱼肉质鲜嫩、营养丰富、产量高,是我国最受欢迎的淡水鱼种之一[1]。据中国渔业年鉴统计,2020年我国白鲢鱼总产量高达38.12万t,且产量呈逐年递增趋势,在渔业中占有重要生态地位。目前,市场上白鲢鱼的主要加工方式为鱼糜及其制品[2]。鱼糜凝胶是由冷冻或新鲜鱼肉经低温固化和高温加热制成的黏弹性凝胶食品。然而,鲢鱼鱼糜存在凝胶形成能力差和冷冻储存期间蛋白质易氧化的问题,极大限制了白鲢鱼糜制品的开发。因此,寻找改善鱼糜制品凝胶特性的方法成为相关学者的研究重点。
多糖由于其良好的胶凝特性、强吸水性和生物活性,成为改善鱼糜品质的主要添加剂[3]。多糖改善鱼糜凝胶特性的机制为:(1)在热诱导凝胶化过程中,多糖与蛋白质分子相互作用促进交联网络的形成;(2)多糖具有较强水结合能力,可以填充三维网络结构并截留水分;(3)多糖可以通过改变蛋白质体系的黏度,在凝胶基质中发挥胶凝或增稠作用[4]。XIONG等[5]发现,添加魔芋葡聚糖后的草鱼鱼糜凝胶破断强度和凝胶强度显著增加。WU[6]研究表明,添加普鲁兰多糖后的鱼糜凝胶性能改善,持水性提高,证明多糖是改善鱼糜制品品质的有效添加剂。如今,相关学者更加注重开发具有多功能性添加剂的新型鱼糜制品,在改善鱼糜制品凝胶性能的同时,还能赋予食物有益的健康特性。
条斑紫菜是中国南方沿海地区的重要经济海藻,具有高蛋白、低脂肪的特点,是水溶性多糖的重要来源。紫菜多糖是一种线性硫酸化杂多糖,主要由交替的“β-(1→3)-D-半乳糖”与“α-(1→4)-3,6-内醚-L-半乳糖”单元以及硫酸化的线性骨架组成[7]。基于其独特的结构,紫菜多糖可在适当的添加范围内表现出良好的凝胶增强和吸水作用,在食品工业中被用作胶凝剂、稳定剂、增稠剂和乳化剂[8]。此外,紫菜多糖还富含抗氧化活性、免疫调节作用和抗炎等生物活性[9-10]。根据多糖良好的水结合能力、胶凝特性和抗氧化活性,紫菜多糖可能有提高鱼糜凝胶性能和品质的潜力。然而,目前还没有紫菜多糖在鲢鱼鱼糜加工中的应用。因此,本研究旨在阐明紫菜多糖对鱼糜凝胶特性、微观结构和抗氧化活性的影响,并探索多糖-鱼糜复合凝胶的水分状态和蛋白质二级结构变化,旨在为开发新型鱼糜制品提供科学依据。
1 材料与方法
1.1 材料与试剂
新鲜白鲢鱼购于广州市融渔海鲜超市,质量为(1.7±0.31)kg/条;条斑紫菜,江苏南通昌钰海苔有限公司;木薯淀粉、食盐、食用油,市售;三聚磷酸钠、焦磷酸钠、六偏磷酸钠、CaCl2、戊二醛、无水乙醇,均为分析纯,广州化学试剂厂。
1.2 仪器与设备
SHA·BA水浴恒温振荡器,常州金坛精达仪器制造有限公司;UMC5真空斩拌机,德国Stephan Machinery公司;T50型均质机,德国IKA公司;CT3质构仪,美国Brookfield公司;AantiJ26XP型台式高速冷冻离心机,美国贝克曼库尔特公司;CR-400型全自动色差计,日本柯尼卡美能达控股公司;Alpha1-4冷冻干燥机,德国Christ公司;SU8020场发射扫描子显微镜,日本日立公司;Bruker AANCE Ⅲ 600M核磁共振仪,德国布鲁克公司。
1.3 实验方法
1.3.1 条斑紫菜多糖的制备
参考JI等[11]的方法并稍作修改,按料液比1∶20(g∶mL)加入紫菜粉末和无水乙醇,450 W超声波处理30 min,90 ℃热水搅拌浸提4 h,抽滤烘干。随后按料液比1∶75(g∶mL)加入去离子水,90 ℃搅拌浸提4 h,8 000 r/min离心15 min,旋蒸浓缩,倒入4倍体积95%无水乙醇,置于4 ℃冰箱静置过夜。收集沉淀,加入去离子水复溶,调节pH 6.5后添加1 g/L木瓜蛋白酶,50 ℃恒温水浴2.5 h,沸水灭活并离心。上清液加入Seage试剂(上清液∶氯仿∶正丁醇=25∶5∶1,体积比),将所得多糖溶液透析72 h,旋蒸浓缩并冷冻干燥,以获得紫菜多糖。紫菜多糖的得率、总糖含量、硫酸基含量和蛋白质含量分别为(15.05±0.35)%、(66.12±0.28)%、(12.27±0.06)%和(0.33±0.16)%,分子质量为7.07×105 Da。
1.3.2 鱼糜凝胶的制备
参考ZHENG等[12]的方法并稍作修改,将新鲜白鲢鱼斩首,去鳞,去内脏后用清水洗涤,收集背部白色肌肉,使用5倍体积冷水冲洗2次鱼肉,再用0.5%(质量分数)NaCl溶液冲洗。纱布过滤,以1 500 r/min离心5 min,获得鱼糜。称取6组质量为300 g的鱼糜,放入真空斩拌机低温空斩2 min,各组加入2%食盐(以鱼糜质量计算,下同),10%食用油,10%木薯淀粉,0.3%复合磷酸盐(三聚磷酸钠∶焦磷酸钠∶六偏磷酸钠=2∶2∶1)斩拌3 min。随后添加15%冰水及含有0.6% CaCl2的不同质量分数的紫菜多糖(0%、0.2%、0.4%、0.6%、0.8%和1.0%),混合样品于3 000 r/min直升搅拌机内斩拌10 min(整个过程温度控制低于10 ℃)。将斩拌后的样品灌入塑料肠衣内(Φ25 mm),两端扎紧密封。然后采用两段式加热(45 ℃加热15 min,90 ℃加热30 min),最后将煮过的多糖-鱼糜复合凝胶置于冰水冷却30 min。去除肠衣于4 ℃冰箱冷藏过夜,待测各项指标。
1.3.3 凝胶强度的测定
将鱼糜凝胶样品切成2.5 cm圆柱体,在室温条件下平衡30 min后,采用CT3质构仪测定样品凝胶强度。探头型号:TA/44球形探头,测试模式:压缩模式,测试速度1.0 mm/s,下压距离15.0 mm,触发力5.0 g。力-形变曲线上获得的第1个峰值定义为破断强度,相应的到达第1个峰值的距离定义为破断距离,每组3个平行。凝胶强度按公式(1)计算:
凝胶强度/(g·mm)=破断强度(g)×破断距离(mm)
(1)
1.3.4 质地剖面分析参数的测定
采用1.3.3相同处理方式测定样品质构特性。探头型号:TA/44球形探头,测试模式:质地多面剖析(texture profile analysis,TPA),测试速度1.0 mm/s,压缩比50%,触发力5.0 g。选取硬度、弹性、内聚性、咀嚼性和回复性为TPA参数,每组3个平行。
1.3.5 白度测定
将鱼糜凝胶切成3 mm厚的薄片,采用色差仪测定凝胶的白度,测量前使用标准白板对色差仪进行校准,然后记录L*(亮度),a*(红色/绿色)和b*(黄色/蓝色)值。白度按公式(2)计算:
白度![]()
(2)
1.3.6 凝胶持水性测定
称取约3.0 g鱼糜凝胶记质量为m1,用3层滤纸裹住样品后装入50 mL离心管内。4 ℃、5 000 r/min离心15 min,离心结束后移除滤纸并再次称质量记为m2。持水性按公式(3)计算:
持水性![]()
(3)
1.3.7 凝胶水分分布及存在状态分析
参考宋春勇等[13]的方法并稍作修改,鱼糜凝胶在室温下静置30 min后切成15 mm×15 mm×20 mm的长方体(约2.0 g),装入核磁管中,插入探针。采用Carr-Purcell-Meiboom-Gill(CPMG)脉冲序列,在32 ℃条件下测定鱼糜凝胶的横向弛豫时间T2。测量参数:SFI=22 MHz,TR=6 s,NS=8,τ=400 μs,EchoCount=1 500。使用MultiExp In Analysis软件对CPMG衰减曲线进行分布指数拟合。根据峰位置确定横向弛豫时间常数,并通过累计积分确定图谱中各峰面积,所得峰面积表示为样品中水的百分含量。
1.3.8 微观结构测定
参考熊雅雯等[14]的方法并略作修改,将6组鱼糜凝胶切成约1 mm3小块,去离子水冲洗10 min,放入2.0%戊二醛溶液中4 ℃固定24 h,再用0.1 mol/L,pH 7.2的磷酸缓冲液漂洗3次,15 min/次。随后依次在30%、50%、70%、90%及无水乙醇中进行10 min梯度洗脱。最后,将鱼糜凝胶真空冷冻干燥和喷金,在电压0.5~30 k下分别放大200倍和500倍观察样品微观结构。
1.3.9 傅立叶红外变换光谱测定
将各组样品冷冻干燥并研磨成粉末,并分别与KBr按1∶100比例均匀混合,真空压缩成片。利用傅立叶红外光谱仪在4 000-400 cm-1分辨率下扫描样品,共扫描32次。
1.3.10 抗氧化活性测定
将鱼糜凝胶和去离子水按体积比1∶20混合,4 ℃、3 000 r/min均质5 min。混合液以5 000 r/min离心10 min去除沉淀,并通过0.22 μm滤膜。真空冷冻干燥后,将200 mg样品重新溶解在10 mL去离子水中,并进行抗氧化活性试验。
1.3.10.1 DPPH自由基清除活性
参考WU等[10]的方法并稍作修改,取2 mL样品溶液与2 mL(0.2 mmol/L)DPPH溶液混匀,室温下混合物在黑暗中反应30 min。随后,在波长517 nm处测量其吸光值,以2 mL无水乙醇溶液作为空白。DPPH自由基清除活性按公式(4)计算:
DPPH自由基清除率![]()
(4)
式中:A0,空白组吸光值;A1,样品溶液吸光值。
1.3.10.2 ·OH清除活性
参考JI等[11]的方法并稍作修改,将1 mL样品溶液、1 mL 6 mmol/L FeSO4和1 mL 6 mmol/L H2O2依次加入离心管中,充分混匀静置10 min。随后,加入1 mL 6 mmol/L水杨酸,室温下静置反应30 min,测定510 nm处吸光值。·OH清除活性按公式(5)计算:
·OH清除率![]()
(5)
式中:A0,空白组吸光值(用去离子水代替样品溶液);A1,样品溶液吸光值;A2,本底组吸光值(用去离子水代替水杨酸溶液)。
1.3.10.3 ABTS阳离子自由基清除活性
参考TANG等[15]的方法并稍作修改,将7 mmol/L ABTS溶液与2.4 mmol/L K2S2O8溶液等比例混匀,室温下黑暗反应12~16 h,形成ABTS储备液。然后用50%(体积分数,下同)甲醇溶液稀释混合物,直至734 nm处吸光值为0.70±0.02,形成ABTS工作液。取0.1 mL样品溶液与3.9 mL ABTS工作液充分混匀,室温下黑暗中反应30 min,测定734 nm处吸光值。ABTS阳离子自由基清除活性按公式(6)计算:
ABTS阳离子自由基清除率![]()
(6)
式中:A0,空白组吸光值(用去离子水代替样品溶液);A1,样品溶液吸光值;A2,50%甲醇溶液吸光值(用50%甲醇代替样品溶液)
1.3.11 数据处理
数据样本通过Excel软件进行整理,采用OriginPro 2019b软件作图、SPSS Statistics 26.0软件数据处理,使用Duncan方法进行多重比较分析,P<0.05为统计学上显著差异。
2 结果与分析
2.1 紫菜多糖对鱼糜凝胶强度的影响
凝胶强度表示破断强度与破断距离的乘积,可反映凝胶内部蛋白质聚集能力[16]。如图1所示,紫菜多糖添加量≤0.4%时,破断强度和破断距离随多糖添加量的增加而增加(P<0.05),多糖添加量>0.4%时反而减少。因此,添加0.4%多糖的鱼糜表现为最佳破断强度(427.50 g)和破断距离(8.39 mm),相较于对照组分别提高54.51%和22.37%。通常,破断强度与凝胶强度和抗凝胶破断性有关,破断距离与凝胶弹性呈正相关[17]。此外,图1还显示出加入多糖的鱼糜凝胶破断强度和破断距离均高于对照组,表明复合凝胶组具有较强的破断强度和破断距离。这是由于紫菜多糖具有较强吸水性,可与鱼糜竞争水分,致使鱼糜蛋白浓度增加,提高凝胶强度。同时,作为填料的多糖均匀分散在整个凝胶体系中时,可促进蛋白质与多糖之间的相互作用,有利于增强凝胶网络结构[8]。然而,添加过量的多糖(>0.4%)破断强度和破断距离均降低,其原因为过量的多糖分散在鱼糜凝胶网络中,会破坏连续网络中氢键的形成,阻碍多糖与蛋白分子之间的交联,导致凝胶强度降低。这与YU等[18]研究的κ-卡拉胶改善鱼糜制品凝胶强度变化得到的结果相似。

图1 紫菜多糖添加量对白鲢鱼鱼糜凝胶强度的影响
Fig.1 Effect of Porphyra polysaccharide content on strength of siler carp surimi gel 注:不同字母表示差异显著(P<0.05)(下同)
2.2 紫菜多糖对鱼糜凝胶质构特性的影响
质地是影响食物口感和功能特性的重要品质参数。相较于液体食物而言,固体食物在口腔内变化更为强烈。硬度定义为食物第一压缩循环期间的峰值力;弹性表示鱼糜在第一次压缩过程中变形后物理回弹的程度;内聚性表示相对于第一个变形的承受能力;回复性定义为第一下压时,形变目标之前面积与形变目标之后的面积比值[19]。由表1可知,添加紫菜多糖对鱼糜凝胶质构特性影响显著。随多糖添加量的增加,硬度和咀嚼性达到最大值510.83 g和29.28 mJ,分别是对照组的1.96和2.31倍(P<0.05)。这与WU[6]研究的多糖类物质能提升鱼糜制品质构特征结果一致。然而,弹性、内聚性和回复性随多糖添加量的增加呈现先增加后减小的趋势,与凝胶强度结果一致。紫菜多糖添加量为0.4%时,弹性、内聚性和回复性均达到最大值,表明在鱼糜凝胶的空腔和连续相中填充适量的多糖可促进凝胶网络中蛋白质和水分子之间的交联,形成均匀致密的三维凝胶网络结构,从而改善鱼糜制品的质构特征[17]。
表1 紫菜多糖添加量对白鲢鱼鱼糜凝胶质构的影响
Table 1 Effect of Porphyra polysaccharide content on the texture of siler carp surimi gel.
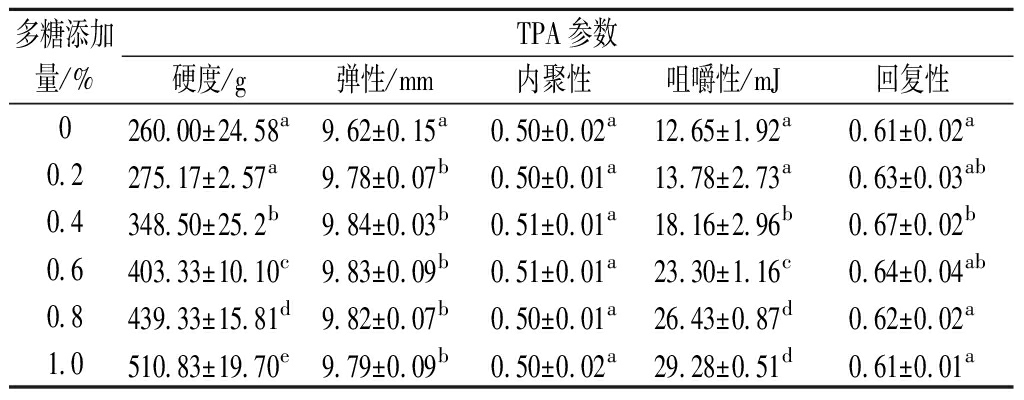
多糖添加量/%TPA参数硬度/g弹性/mm内聚性咀嚼性/mJ回复性0260.00±24.58a9.62±0.15a0.50±0.02a12.65±1.92a0.61±0.02a0.2275.17±2.57a9.78±0.07b0.50±0.01a13.78±2.73a0.63±0.03ab0.4348.50±25.2b9.84±0.03b0.51±0.01a18.16±2.96b0.67±0.02b0.6403.33±10.10c9.83±0.09b0.51±0.01a23.30±1.16c0.64±0.04ab0.8439.33±15.81d9.82±0.07b0.50±0.01a26.43±0.87d0.62±0.02a1.0510.83±19.70e9.79±0.09b0.50±0.02a29.28±0.51d0.61±0.01a
注:同一列数据不同小写字母,表示差异性显著(P<0.05)(下同)
2.3 紫菜多糖对鱼糜凝胶白度的影响
白度直接影响鱼糜制品的整体可接受性,是评估鱼糜制品品质的重要指标。通常,理想状态的鱼糜凝胶具有高L*,低b*和高白度特点[4]。由表2可知,添加紫菜多糖后的鱼糜凝胶,L*值降低,而a*值和b*值上升(P<0.05),表明鱼糜凝胶亮度逐渐变暗且色泽向红色和黄色方向发展。RAWDKUEN等[20]的研究表明,鱼糜制品的白度主要取决于添加剂的颜色、类型和数量。由于紫菜多糖本身为淡黄色,导致均匀分散在鱼糜凝胶中时整体白度下降,但与淀粉/鱼糜和大豆分离蛋白/鱼糜复合凝胶的白度相比,添加0.2%~1.0%多糖的鱼糜凝胶整体白度仍能为消费者所接受[16]。
表2 紫菜多糖添加量对鲢鱼鱼糜凝胶色度的影响
Table 2 Effects of Porphyra polysaccharide on chroma of siler carp surimi gel

色泽多糖添加量/%00.20.40.60.81.0L∗87.06±0.68f85.38±0.16e84.59±0.06d83.80±0.31c82.96±0.41b81.43±0.32aa∗-1.05±0.06a-0.93±0.02b-0.87±0.02b-0.73±0.03c-0.67±0.05d-0.59±0.02eb∗7.31±0.08a7.54±0.19b7.74±0.06c8.31±0.02d8.52±0.06e8.99±0.13f白度85.10±0.60f83.52±0.22e82.73±0.08d81.78±0.28c80.93±0.34b79.36±0.34a
2.4 持水性
在热诱导鱼糜凝胶化过程中,蛋白质高级结构受热松动,分子之间相互交联形成三维网状结构,与水结合并截留其他成分,使鱼糜凝胶具有一定的持水能力。持水性反映了凝胶网络截留或结合水分的能力[21]。如图2所示,随着紫菜多糖的加入,持水性显著提高(P<0.05),整体呈先上升后下降趋势。当多糖添加量为0.4%时,凝胶持水性达到最大值94.74%,与对照组相比提高10.41%。这是由于多糖具有较强的吸水和保水能力,可增强蛋白质凝胶网络[7]。多糖吸水引起溶胀,向蛋白质基质施加压力,使凝胶基质变得更加致密和牢固。此外,多糖还可以作为填充材料填充蛋白质基质中的空腔,以诱导形成更加均匀致密的空间网络结构,从而容纳更多的水分[21]。然而,多糖添加量>0.4%时,鱼糜凝胶持水性下降,其原因为添加过量多糖会干扰蛋白质与水分子之间的相互作用,破坏凝胶网络的形成,导致鱼糜持水能力降低。CHEN等[22]添加亲水胶体(可得然胶、明胶、黄原胶和κ-卡拉胶)以提高鱼糜制品的保水能力和凝胶质量,结果显示,在0~5 g/kg添加范围内,4种胶最佳添加量分别为4、1、0、2 g/kg,即添加少量的亲水胶体有助于提高凝胶持水性,过量添加会降低持水性。因此,添加适量的多糖可促进与蛋白质之间的相互作用,形成均匀致密的凝胶网络结构,提高鱼糜的持水能力,改善鱼糜凝胶品质。

图2 紫菜多糖添加量对鲢鱼鱼糜凝胶持水性的影响
Fig.2 Effect of Porphyra polysaccharide content on water holding capacity of siler carp surimi gel
2.5 低场核磁共振
利用低场核磁弛豫时间T2分析鱼糜凝胶内部水分流动性、分布状态及相互迁移情况[17]。弛豫时间T2可反映鱼糜凝胶氢质子受抑制程度,弛豫时间越短说明氢质子受抑制程度越强,即水分越稳定。如图3所示,鱼糜凝胶通过衰减曲线反演后弛豫时间T2图谱中存在3个峰,代表3种不同水分状态,即T21:(0~10 ms)表示与蛋白质等大分子疏水基团紧密结合水,移动性较弱,属于结合水;T22:(10~150 ms)表示束缚在三维凝胶网络中的水分,具有一定移动性,属于不易流动水;T23:(150~1 000 ms)表示存在于三维凝胶网络以外的水分,移动性较强,属于自由水[23]。对照组凝胶T21、T22、T23分别为0.54、52.61、579.41 ms,而加入多糖后的鱼糜凝胶T21、T22、T23分别降至0.43、46.94、327.27 ms。随着多糖添加量的增加,弛豫时间向短时间迁移,表明多糖具有更强的结合水和限制水分子自由运动的能力[21]。
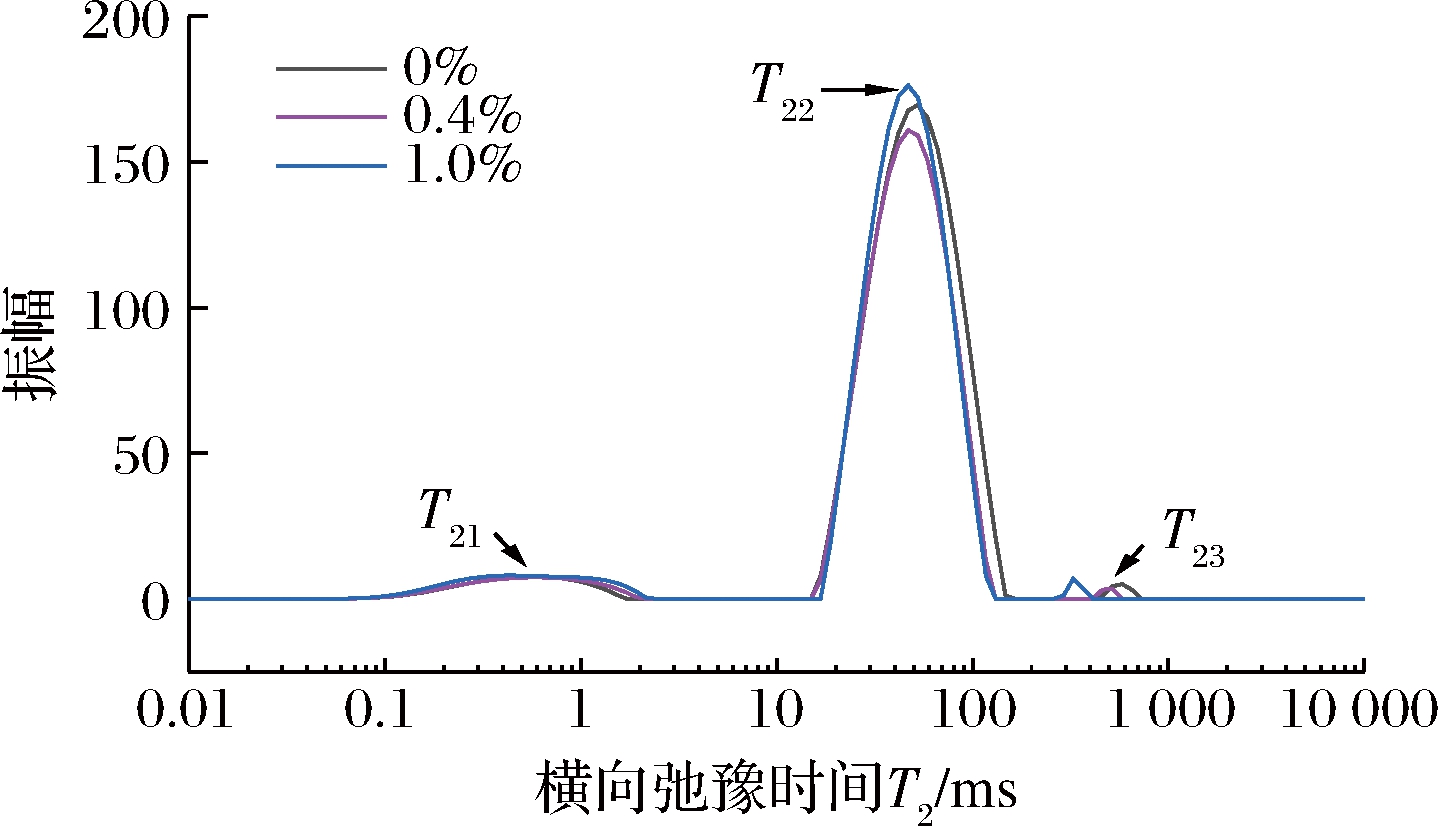
图3 紫菜多糖添加量对鲢鱼鱼糜凝胶弛豫时间T2的影响
Fig.3 Effect of Porphyra polysaccharide on relaxation time T2 of siler carp surimi gel
使用P21、P22、P23表示不同状态水分相应的各峰面积比例,反映水分在鱼糜中的分布与迁移。如图4所示,不易流动水是鱼糜凝胶的主要水分,所占比例约为92%,直接关系到鱼糜凝胶的持水能力。当蛋白质凝胶网络结构变化时,凝胶中水分会发生相互转化[18]。不同状态水分中自由水流动性最强,在离心过程中易流失对鱼糜凝胶的保水性产生不利影响。因此,当自由水所占比较高时,凝胶持水性较低。在该实验中,对照组P23在所有凝胶中占比最高达到0.63%,表明其保水能力最弱。添加多糖后的凝胶,P23占比减少,P21占比增加,表明凝胶内部水分逐渐趋于稳定。这是由于多糖吸水膨胀与蛋白质相互作用增强,部分自由水转化为束缚水,使水的流动性降低,三维凝胶网络增强。其中添加0.4%多糖的鱼糜凝胶,P21和P22二者所占总峰面积比例达到最大值99.64%,表明具有最大持水能力,该结果与持水性结果一致。
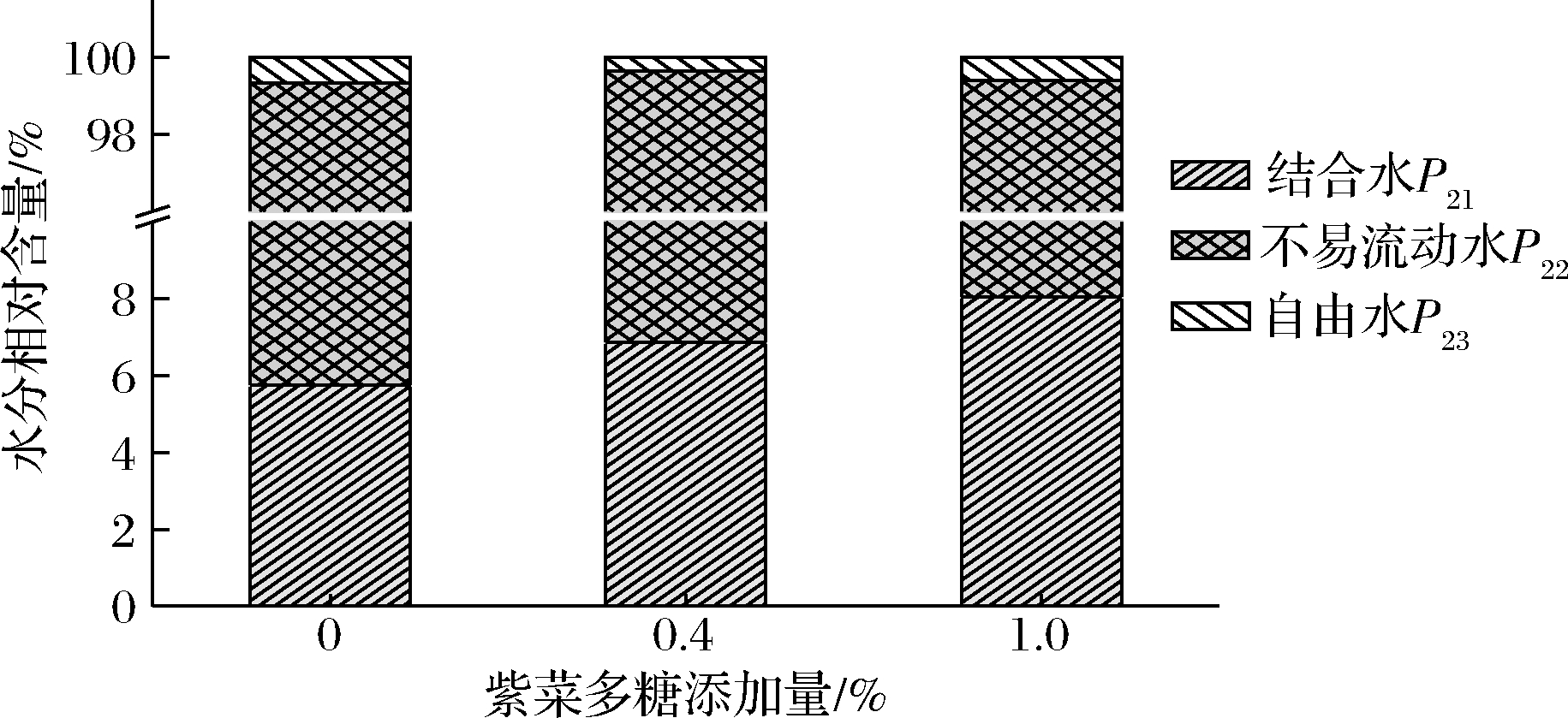
图4 紫菜多糖添加量对鲢鱼鱼糜凝胶水分分布的影响
Fig.4 Effect of Porphyra polysaccharide content on water distribution in siler carp surimi gel
2.6 微观结构分析
鱼糜内部三维凝胶网络的形成与蛋白质链的有序聚集密切相关。链密度越高,凝胶越均匀有序,所表现的凝胶强度越强[24]。如图5所示,对照组样品结构松散,表面粗糙,呈团簇状,说明蛋白质分子之间交联较少,蓄水能力低,导致鱼糜凝胶强度和持水能力差。

a-0%(a1:×200、a2:×500);b-0.2%(b1:×200、b2:×500); c-0.4%(c1:×200、c2:×500);d-0.6%(d1:×200、d2:×500); e-0.8%(e1:×200、e2:×500);f-1.0%(f1:×200、f2:×500)
图5 紫菜多糖添加量对白鲢鱼鱼糜凝胶微观结构的影响
Fig.5 Effect of Porphyra polysaccharide content on the microstructure of siler carp surimi gel
与对照组相比,添加多糖的鱼糜凝胶可以引入更多氢键和亲水相互作用,凝胶基质更致密,表面也更光滑平整且孔径分布均匀,表明形成的凝胶连接性更好,蛋白质链密度高,网络结构也更均匀有序。在鱼糜凝胶化过程中,蛋白质变性,暴露出更多与多糖相互作用的隐藏位点,二者之间静电相互作用增强,限制凝胶基质中水分子的运动,从而形成均匀紧凑的网络结构[6]。然而,添加过量的紫菜多糖(>0.4%),凝胶结构逐渐松散,孔径增大,这是由于过量的多糖会阻碍与蛋白质之间的交联,致使质构特性弱化。鱼糜凝胶微观结构的变化与凝胶强度和持水性结果一致。
2.7 傅立叶红外光谱分析
傅立叶红外光谱广泛用于食品的定性与定量分析,通过鱼糜凝胶在红外光谱中出现的若干特征吸收峰,反映蛋白质二级结构的变化[19]。徐安琪等[8]研究表明,位于1 600~1 700 cm-1区域内的特征吸收峰属于酰胺I带,该区域对蛋白质二级结构变化敏感。酰胺I带局部空间构象由分子内氢键维系,主要形式为:α-螺旋(1 650~1 660 cm-1),β-折叠(1 600~1 640 cm-1),β-转角(1 660~1 700 cm-1)和无规则卷曲(1 640~1 650 cm-1)[25]。根据酰胺I带特征吸收峰面积,计算蛋白质二级结构含量。
由图6可知,添加紫菜多糖的鱼糜凝胶蛋白质二级结构含量发生变化。当紫菜多糖添加量为0%~0.4%时,α-螺旋含量从11.91%降至6.87%(P<0.05),而β-转角含量从36.09%增至39.86%(P<0.05),β-折叠与无规则卷曲无显著性差异(P>0.05)。随着多糖的进一步添加,α-螺旋含量逐渐上升,β-转角含量呈相反趋势。这与CHEN等[22]研究的添加κ-卡拉胶后的凝胶蛋白质二级结构变化结果相似。通常,凝胶化过程中,α-螺旋含量下降表示肌球蛋白展开程度增加,促进凝胶网络形成,β-结构含量增加表示蛋白质分子发生聚集形成凝胶,无规则卷曲含量下降表示蛋白质三维凝胶网络结构从无序向规则有序转变,而均匀有序的网络结构有利于提高鱼糜制品的凝胶强度。维系蛋白质二级结构的主要作用力为氢键、疏水相互作用和静电相互作用等非共价键力,其中α-螺旋结构的稳定性主要依赖多肽链上氨基和羰基之间的氢键作用[14]。热处理导致蛋白质分子变性,破坏了氨基与羰基之间的氢键作用,使得α-螺旋结构发生解旋并转变为β-折叠和β-转角结构,凝胶内部水分随蛋白质分子的展开发生迁移,暴露出更多疏水基团,有利于良好的凝胶网络形成[25]。然而继续添加多糖,β-折叠和β-转角结构开始分解,蛋白质结构逐渐松散,通过疏水相互作用,α-螺旋含量逐渐回升。因此,热诱导凝胶化过程中蛋白质二级结构处于不断变化中,其原因可能为熵的作用,导致α-螺旋、β-折叠、β-转角和无规则卷曲结构之间发生相互转化[26]。这与上述鱼糜凝胶凝胶强度、持水性、微观结构的测定结果一致。

图6 紫菜多糖添加量对蛋白质二级结构含量的影响
Fig.6 Effect of Porphyra polysaccharide addition on protein secondary structure content
2.8 抗氧化活性分析
在冷冻贮藏期间,鱼糜制品品质劣变主要与蛋白质氧化有关。因此,抑制蛋白质氧化可有效稳定肌原纤维蛋白的结构和功能,保持良好的肉制品品质[27]。多糖的抗氧化机制主要是通过直接清除自由基或间接抑制氧化过程实现[11]。自由基清除模型由于操作便捷、结果可靠被广泛用于评价多糖的抗氧化活性。本实验通过测定鱼糜凝胶的DPPH自由基、·OH和ABTS阳离子自由基清除率,评估紫菜多糖对鱼糜凝胶的氧化抑制能力。由图7-a可知,添加多糖的DPPH自由基清除活性与对照组相比差异显著(P<0.05),且多糖添加量与DPPH自由基清除活性呈剂量依赖性关系。当多糖添加量为1.0%时DPPH自由基清除能力为(69.56±1.54)%,相较于对照组提高了68.71%,表明紫菜多糖可以向DPPH自由基捐赠电子或H+,有效抑制蛋白质氧化[10]。图7-b显示,·OH清除率与多糖添加量呈正相关,各组鱼糜凝胶·OH清除活性分别为:(54.88±0.33)%、(56.12±0.37)%、(60.00±0.19)%、(62.41±0.34)%、(65.25±0.32)%、(68.34±0.41)%。图7-c显示,随多糖添加量从0%增加到1.0%,ABTS阳离子自由基清除率呈先增加后稳定趋势。与添加至鱼糜中的其他植物多糖相比,紫菜多糖显示出更好的氧化抑制能力。ZHENG等[12]的研究表明,添加1.0%岩藻依聚糖的鱼糜·OH和ABTS阳离子自由基清除能力约为65%和73%,而在相同添加量下,紫菜多糖-鱼糜凝胶清除率分别为68.34%和79.11%。综上,添加紫菜多糖能够有效抑制自由基氧化,且以剂量依赖性方式延缓蛋白质的氧化。

a-DPPH自由基;b-·OH;c-ABTS阳离子自由基
图7 紫菜多糖含量对白鲢鱼鱼糜凝胶抗氧化活性的影响
Fig.7 Effect of Porphyra polysaccharide content on antioxidant actiity of siler carp surimi gel
3 结论
添加紫菜多糖对白鲢鱼鱼糜凝胶特性、水分状态、微观结构、蛋白质二级结构及抗氧化活性有重要影响。当多糖添加量为0.4%时,鱼糜凝胶强度、质构特性和持水性表现最佳,并具有最均匀致密的三维网状结构,这主要归因于多糖具有强吸水性和填充作用。白度随多糖添加量增加而下降,这与多糖自身颜色有关,但整体色泽在可接受范围内。此外,添加紫菜多糖使鱼糜凝胶弛豫时间T2向短时间迁移,并使部分自由水转化为束缚水,增强凝胶形成能力。但添加过量的多糖会削弱鱼糜中蛋白质交联作用,破坏凝胶网络结构的完整性,导致凝胶质量下降。热诱导凝胶化过程中,α-螺旋含量先下降后上升,β-转角呈相反趋势。抗氧化实验表明,添加紫菜多糖后的鱼糜凝胶显示出优异的氧化抑制能力。本研究为开发新型多糖-鱼糜制品提供理论依据。
[1] FANG M X, XIONG S B, YIN T, et al.Proteomic profiling and oxidation site analysis of gaseous ozone oxidized myosin from siler carp (Hypophthalmichthys molitrix) with different oxidation degrees[J].Food Chemistry, 2021, 363:130307.
[2] YI S M, YE B B, LI J R, et al.Physicochemical properties, protein conformation, and aggregate morphology of heated myosin from Hypophthalmichthys molitrix and Nemipterus irgatus mixtures[J].Food Frontiers, 2020, 1(4):473-483.
[3] MANZOOR M, SINGH J, BANDRAL J D, et al.Food hydrocolloids:Functional, nutraceutical and noel applications for deliery of bioactie compounds[J].International Journal of Biological Macromolecules, 2020, 165:554-567.
[4] RAM REZ J A, URESTI R M, ELAZQUEZ G, et al.Food hydrocolloids as addities to improe the mechanical and functional properties of fish products:A reiew[J].Food Hydrocolloids, 2011, 25(8):1 842-1 852.
REZ J A, URESTI R M, ELAZQUEZ G, et al.Food hydrocolloids as addities to improe the mechanical and functional properties of fish products:A reiew[J].Food Hydrocolloids, 2011, 25(8):1 842-1 852.
[5] XIONG G Q, CHENG W, YE L X, et al.Effects of konjac glucomannan on physicochemical properties of myofibrillar protein and surimi gels from grass carp (Ctenopharyngodon idella)[J].Food Chemistry, 2009, 116(2):413-418.
[6] WU S J.Effect of pullulan on gel properties of Scomberomorus niphonius surimi[J].International Journal of Biological Macromolecules, 2016, 93:1 118-1 120.
[7] QIU H M, EERAPERUMAL S, LYU J H, et al.Physicochemical properties and potential beneficial effects of porphyran from Porphyra haitanensis on intestinal epithelial cells[J].Carbohydrate Polymers, 2020, 246:116626.
[8] 徐安琪, 杨镕, 朱煜康, 等.紫菜粉添加对鱿鱼鱼糜凝胶特性及其蛋白结构的影响[J].食品科学, 2021, 42(2):46-52.
XU A Q, YANG R, ZHU Y K, et al.Effect of laer(Porphyra umbilicalis) powder on gel properties and protein structure of giant squid(Dosidicus gigas) surimi[J].Food Science, 2021, 42(2):46-52.
[9] WANG Y H, HWANG J Y, PARK H B, et al.Porphyran isolated from Pyropia yezoensis inhibits lipopolysaccharide-induced actiation of dendritic cells in mice[J].Carbohydrate Polymers, 2020, 229:115457.
[10] WU Y T, HUO Y F, XU L, et al.Purification, characterization and antioxidant actiity of polysaccharides from Porphyra haitanensis[J].International Journal of Biological Macromolecules, 2020, 165:2 116-2 125.
[11] JI C Y, PAN C, HUANG H C, et al.Effects of origin and harest period on characterisation, structure and antioxidant actiity of polysaccharides deried from Porphyra haitanensis[J].International Journal of Food Science & Technology, 2022, 57(1):123-136.
[12] ZHENG M J, LIU X, CHUAI P J, et al.Effects of crude fucoidan on physicochemical properties, antioxidation and bacteriostasis of surimi products[J].Food Control, 2021, 122:107806.
[13] 宋春勇, 洪鹏志, 周春霞, 等.大豆油和预乳化大豆油对金线鱼鱼糜凝胶品质的影响[J].食品科学, 2021, 42(8):90-97.
SONG C Y, HONG P Z, ZHOU C X, et al.Effect of soybean oil and pre-emulsified soybean oil on the quality of Nemipterus irgatus surimi gel[J].Food Science, 2021, 42(8):90-97.
[14] 熊雅雯, 黄卉, 李来好, 等.不同煮制条件对罗非鱼片品质的影响[J].食品科学, 2022,43(11):39-48.
XIONG Y W, HUANG H, LI L H, et al.Effects of different cooking conditions on the quality of tilapia fillets[J].Food Science, 2022,43(11):39-48
[15] TANG J, NIE J, LI D P, et al.Characterization and antioxidant actiities of degraded polysaccharides from Poria cocos sclerotium[J].Carbohydrate Polymers, 2014, 105:121-126.
[16] 熊泽语, 谢晨, 陈百科, 等.不同添加物对未漂洗大黄鱼鱼糜品质的影响[J].食品与发酵工业, 2021, 47(10):151-158.
XIONG Z Y, XIE C, CHEN B K, et al.Effects of different addities on the quality of non-rinsed large yellow croaker surimi[J].Food and Fermentation Industries, 2021, 47(10):151-158.
[17] WANG R H, GAO R C, XIAO F, et al.Effect of chicken breast on the physicochemical properties of unwashed sturgeon surimi gels[J].LWT, 2019, 113:108306.
[18] YU W Y, WANG Z M, PAN Y X, et al.Effect of κ-carrageenan on quality improement of 3D printed Hypophthalmichthys molitrix-sea cucumber compound surimi product[J].LWT, 2022, 154:112279.
[19] QIAO L K, LI Y P, CHI Y Z, et al.Rheological properties, gelling behaior and texture characteristics of polysaccharide from Enteromorpha prolifera[J].Carbohydrate Polymers, 2016, 136:1 307-1 314.
[20] RAWDKUEN S, BENJAKUL S, ISESSANGUAN W, et al.Effect of chicken plasma protein and some protein addities on proteolysis and gel-forming ability of sardine (Sardinella gibbosa) surimi[J].Journal of Food Processing and Preseration, 2007, 31(4):492-516.
[21] CAO Y, ZHAO L Y, HUANG Q L, et al.Water migration, ice crystal formation, and freeze-thaw stability of siler carp surimi as affected by inulin under different additie amounts and polymerization degrees[J].Food Hydrocolloids, 2022, 124:107267.
[22] CHEN J X, DENG T Y, WANG C, et al.Effect of hydrocolloids on gel properties and protein secondary structure of siler carp surimi[J].Journal of the Science of Food and Agriculture, 2020, 100(5):2 252-2 260.
[23] ZHUANG X B, HAN M Y, BAI Y, et al.Insight into the mechanism of myofibrillar protein gel improed by insoluble dietary fiber[J].Food Hydrocolloids, 2018, 74:219-226.
[24] BUAMARD N, BENJAKUL S.Improement of gel properties of sardine (Sardinella albella) surimi using coconut husk extracts[J].Food Hydrocolloids, 2015, 51:146-155.
[25] 汤嘉慧, 郭全友, 邹咪, 等.κ-卡拉胶/K+凝胶体系对鱼糜凝胶特性和流变的影响[J].食品与发酵工业, 2020, 46(16):86-92.
TANG J H, GUO Q Y, ZOU M, et al.Effects of κ-carrageenan/K+ gel system on surimi gel properties and rheology[J].Food and Fermentation Industries, 2020, 46(16):86-92.
[26] 徐永霞, 王瑞, 李学鹏, 等.热处理对鱼肌原纤维蛋白结构及腥味物质结合能力的影响[J].中国食品学报, 2020, 20(9):131-138.
XU Y X, WANG R, LI X P, et al.Effects of heat treatment on the structure of myofibrillar protein and binding ability with fishy odor compounds[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(9):131-138.
[27] LIN J, HONG H, ZHANG L T, et al.Antioxidant and cryoprotectie effects of hydrolysate from gill protein of bighead carp (Hypophthalmichthys nobilis) in preenting denaturation of frozen surimi[J].Food Chemistry, 2019, 298:124868.