金黄色葡萄球菌(Staphylococcus aureus)是危害公共卫生的主要食源性致病菌之一[1]。中国疾病预防控制中心2019年共报告了91起因金黄色葡萄球菌及其毒素引起的暴发性食源性疾病事件,导致了1 023人患病住院治疗[2-3]。金黄色葡萄球菌的爆发主要与被污染的食品有关,其广泛存在于未经深度处理的食品原材料、即食食品和操作不规范加工场所中[4]。
低温冷藏是短时间内储存食品原料和产品、延长食品货架期及长距离运输食品的最常用方法之一[5]。虽然低温会影响基因的转录和翻译,从而抑制细胞复制[6]。但是金黄色葡萄球菌对4 ℃的低温环境有较强的适应性,在4 ℃贮藏60 d的奶制品进行微生物检测仍能发现有金黄色葡萄球菌存在。金黄色葡萄球菌长期受到低温胁迫后可能会以小菌落变种(small colony ariants, SCs)形态存活8周或者更长的时间。SCs细胞是食品安全的重要挑战,这是因为与正常细胞相比,SCs细胞通常具有较强的耐药性,而且能够抵抗宿主细胞的清除并存活数十年[7]。
细菌的细胞膜是保卫细胞正常功能的第一道生物防线,在维持细胞形态、传递信息和与外界进行物质交换起到重要作用[8]。研究发现抗生素、抗菌肽和天然抑菌剂等物质能通过作用细胞膜的靶向位点、破坏细胞膜的完整性改变其通透性,从而起到抑菌的作用[9]。然而,致病菌对低温等环境胁迫的抗性差异性较大,细菌细胞膜的完整性对环境胁迫的抵抗能力是致病菌胁迫抗性的重要体现[10]。然而,金黄色葡萄球菌在低温胁迫下细胞膜的完整性以及其抗性差异急需深入研究。
本实验对4株具有不同低温耐受性金黄色葡萄球菌为供试菌株,基于平板计数法区分低温抗性强弱不同的菌株,并观测菌落形态、计算存活率。通过测定细胞内容物泄露量、测定电导率方法、结晶紫方法对细胞膜完整性进行研究;进而通过实时荧光定量PCR(quantitatie real-time PCR, qRT-PCR)分析4株金黄色葡萄球菌的基因表达在低温处理后参与机体调控的变化,以期在基因调控上诠释不同金黄色葡萄球菌在低温下的存活机制。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株来源
金黄色葡萄球菌(BB-1、BK-1、BH-25和FA-3),实验室前期分离自当地冷链食品,并通过Biolog技术[11]和nuc基因[12]作为引物的PCR法鉴定,菌株均保存于-80 ℃甘油管中。
1.1.2 培养基与试剂
TSA培养基、TSB培养基,北京陆桥技术有限责任公司;酵母浸粉(yeast extract, YE),上海生工生物工程股份有限公司;PBS、10 μg/mL结晶紫,北京索莱宝科技有限公司;无水乙醇,天津市德恩化学试剂有限公司;TRIzon Reagent试剂,江苏康为世纪生物科技有限公司;反转录试剂盒、实时荧光定量试剂盒,翌圣生物科技有限公司。
1.1.3 仪器与设备
SX-500高压蒸汽灭菌锅,日本Tomy公司;Centrifuge 5430高速台式离心机,德国Eppendorf公司;LHP-250智能恒温恒湿培养箱,上海鸿都电子科技有限公司;CD-6 ASX游标卡尺,日本株式会社三丰;NanoDrop 2000核酸蛋白微量测定仪,美国赛默飞世尔科技有限公司;DDS-307A电导率仪,上海仪电有限公司;EPOCH2微孔板分光光度计,美国Biotek公司;StepOne Plus实时荧光定量PCR仪,美国ABI公司。
1.2 实验方法
1.2.1 菌悬液的制备
将供试菌株37 ℃振荡培养至指数期后期,取25 mL的细胞培养液经4 ℃、8 000 r/min离心5 min收集后,用PBS清洗2次,悬浮于等体积的PBS中制成菌悬液。
1.2.2 金黄色葡萄球菌菌落形态和活性细胞数目测定
将上述菌悬液保存于4 ℃冰箱中,每7 d在TSA-YE平板上用涂布平板法测定菌落总数,连续测定4周,存活率[13]按照公式(1)计算:
存活率![]()
(1)
观察菌落TSA-YE平板上的金黄色葡萄球菌菌落形态,直径小于1 mm的菌落定义为SCs细胞[7],并比较形成SCs细胞的菌株与未形成的菌株在低温下存活能力的差异。
1.2.3 菌悬液内容物泄漏量的测定
取1 mL低温处理的菌液到1.5 mL无酶离心管,4 ℃、8 000 r/min离心5 min,取上清液3 μL,用核酸蛋白微量测定仪测定胞内核酸和蛋白质泄露量[14]。所有操作都在冰上完成,以减少核酸和蛋白质的降解。
1.2.4 菌悬液电导率的测定
取5 mL低温处理的菌液到15 mL无酶离心管,4 ℃、8 000 r/min离心5 min,吸上清液并使用电导率仪进行电导率的测定,所有操作皆在冰上完成。
1.2.5 细胞膜完整性的测定
取5 mL低温处理的菌液,4 ℃、8 000 r/min离心5 min,并用预冷的PBS清洗,重复3次。得到的菌泥重悬于含有10 μg/mL结晶紫的PBS中37 ℃培养10 min。之后于4 ℃、12 000 r/min离心15 min,收集上清液使用微孔板分光光度计测量590 nm处吸光度。
1.2.6 RNA提取和反转录
使用TRIzol法分别提取低温处理7 d和新鲜的金黄色葡萄球菌RNA,操作按照TRIzon Reagent说明书。提取的RNA经1%琼脂糖凝胶电泳和核酸蛋白微量测定仪检测纯度、浓度和完整度,随后使用反转录试剂盒反转录为cDNA,操作按照说明书进行。反转录后的cDNA和引物经过1%琼脂糖凝胶电泳验证后,进行实时荧光定量PCR实验。
1.2.7 反转录实时荧光定量PCR检测目的基因表达
qRT-PCR检测方法如下,20 μL反应体系包括:10 μL qPCR SYBR Green Master Mix (High Rox Plus)、上下游引物各0.4 μL、1 μL模板DNA、剩余体积使用无菌超纯水补齐。部分引物参考文献[15]设计,其余引物通过Primer-BLAST(https://www.ncbi.nlm.nih.go/)设计,并由郑州尚亚生物公司合成,如表1所示,引物所扩增产物的正确性通过对基因组DNA的PCR扩增后测序以验证。qRT-PCR使用StepOnePlus实时荧光定量PCR仪进行,扩增程序[15]为:95 ℃预变性5 min,95 ℃变性10 s、60 ℃退火20 s、72 ℃延伸20 s,扩增40个循环。以16 s rDNA为内参基因,数据使用2-ΔΔCt法定量分析[16]。
表1 实时荧光定量引物
Table 1 Primer pairs used for qRT-PCR
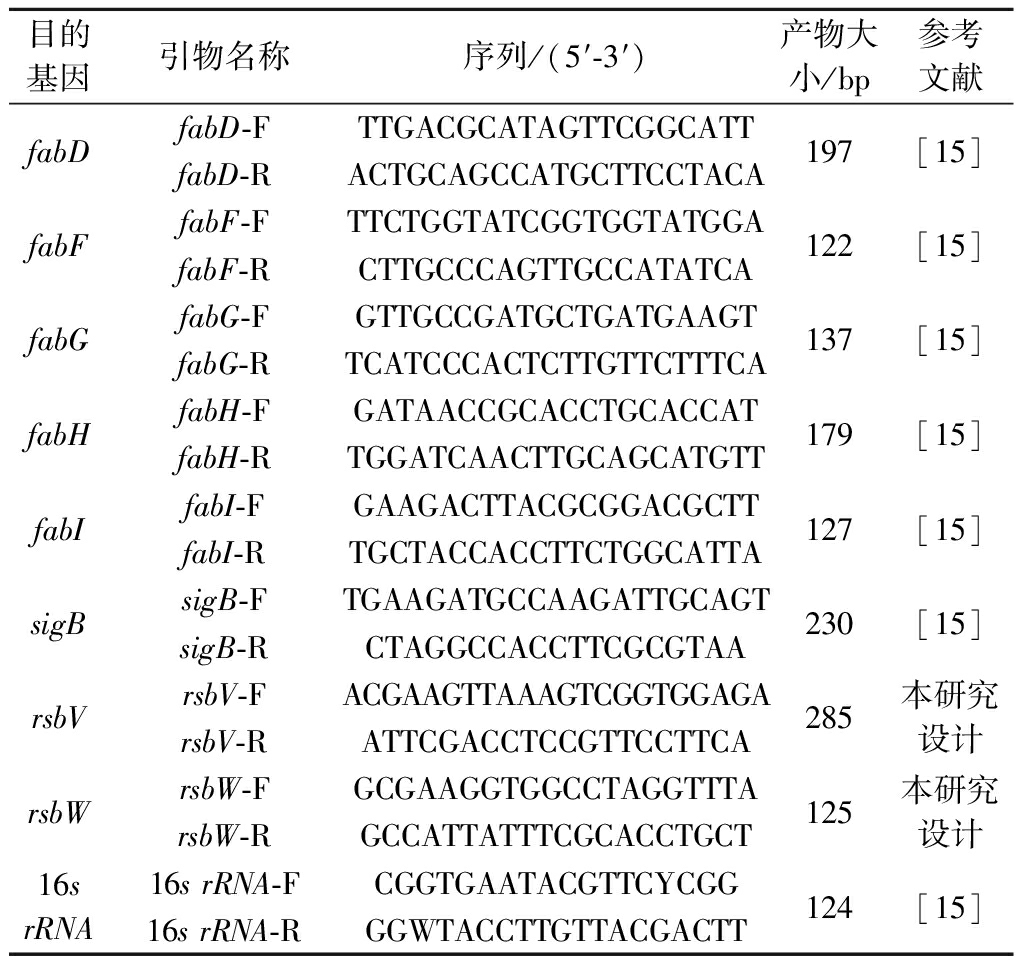
目的基因引物名称序列/(5′-3′)产物大小/bp参考文献fabDfabD-FTTGACGCATAGTTCGGCATTfabD-RACTGCAGCCATGCTTCCTACA197[15]fabFfabF-FTTCTGGTATCGGTGGTATGGAfabF-RCTTGCCCAGTTGCCATATCA122[15]fabGfabG-FGTTGCCGATGCTGATGAAGTfabG-RTCATCCCACTCTTGTTCTTTCA137[15]fabHfabH-FGATAACCGCACCTGCACCATfabH-RTGGATCAACTTGCAGCATGTT179[15]fabIfabI-FGAAGACTTACGCGGACGCTTfabI-RTGCTACCACCTTCTGGCATTA127[15]sigBsigB-FTGAAGATGCCAAGATTGCAGTsigB-RCTAGGCCACCTTCGCGTAA230[15]rsbrsb-FACGAAGTTAAAGTCGGTGGAGArsb-RATTCGACCTCCGTTCCTTCA285本研究设计rsbWrsbW-FGCGAAGGTGGCCTAGGTTTArsbW-RGCCATTATTTCGCACCTGCT125本研究设计16s rRNA16s rRNA-FCGGTGAATACGTTCYCGG16s rRNA-RGGWTACCTTGTTACGACTT124[15]
1.2.8 数据处理与统计分析
所有实验均进行3个平行,应用Excel 2019软件计算平均值和误差,并采用One-Way ANOA比较在P<0.05水平的差异显著性。
2 结果与分析
2.1 低温处理后金黄色葡萄球菌菌落形态和活细胞数目的变化
经过低温处理后,4株金黄色葡萄球菌平板菌落的形态如图1所示,BB-1表现出与其未处理正常细胞所见非典型生长特征,呈明显的小菌落形态(即SCs细胞)(图1-b),通过游标卡尺测量直径为(0.32±0.04) mm;而其他3株金黄色葡萄球菌形态上与处理前变化不大(图1-d、图1-f、图1-h),测量出直径为(1.12±0.02) mm,和SCs细胞直径具有显著性差异(P<0.05)。
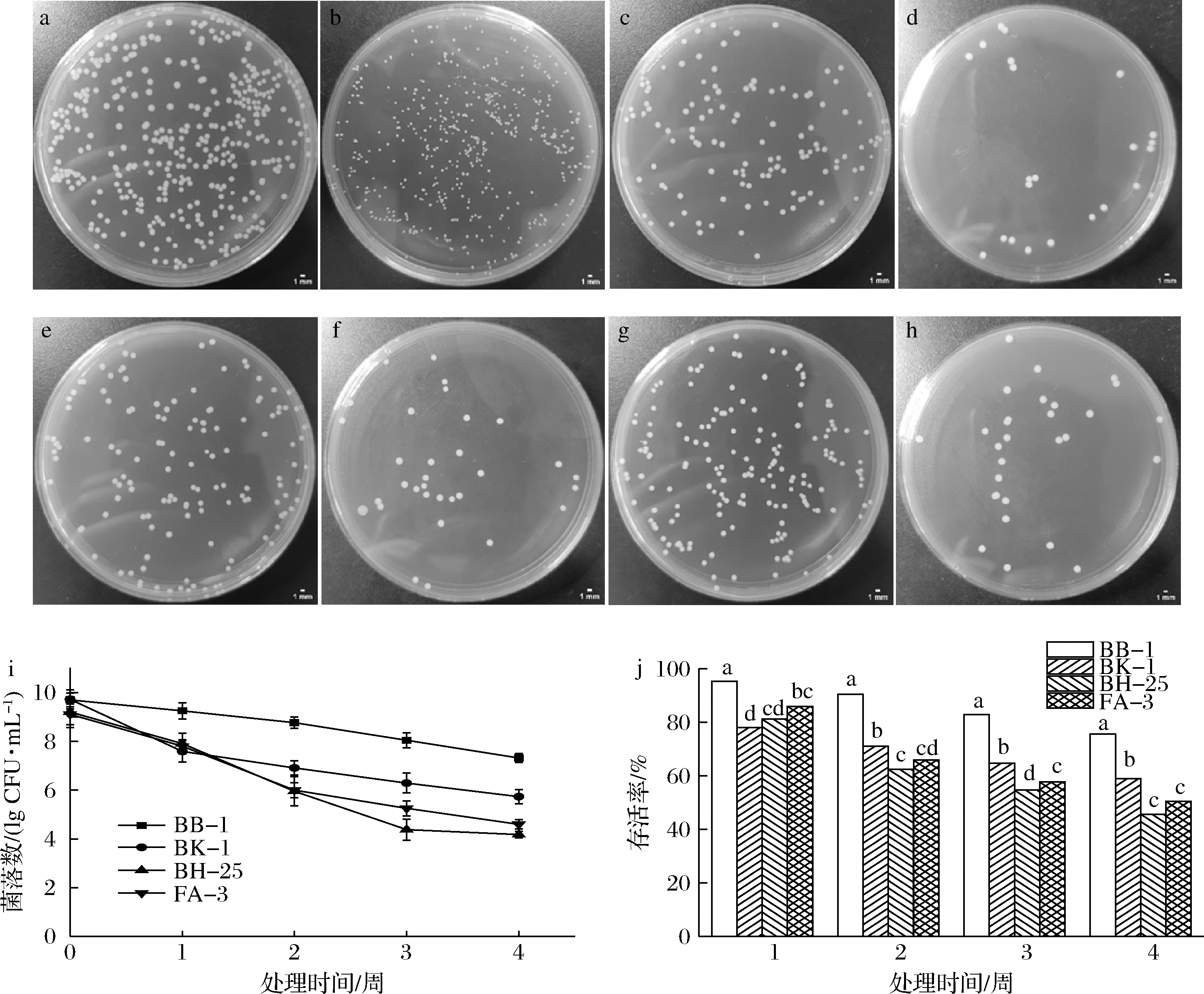
a, c, e和g-BB-1、BK-1、BH-25和FA-3在平板上的菌落形态;b, d, f和h-经过低温处理后的菌株BB-1、BK-1、BH-25和FA-3 在平板上的菌落形态;i-低温对不同金黄色葡萄球菌的活细胞数目的影响;j-低温对不同金黄色葡萄球菌存活率的影响
图1 低温处理后金黄色葡萄球菌菌落形态和活细胞数目以及存活率的变化
Fig.1 Changes in colonial morphology and iable cell number of S.aureus after low temperature treatment 注:不同字母表示在P<0.05水平上差异显著
在低温胁迫下,4株金黄色葡萄球菌的活细胞数下降2.38~5.03 lg CFU/mL (图1-i),但下降程度各不相同。其中,金黄色葡萄球菌BB-1在4周的低温胁迫后数目下降2.38 lg CFU/mL,存活率为75.5%。然而,BH-25在4周低温胁迫后活细胞数目下降5.03 lg CFU/mL,与BB-1相比高2.65 lg CFU/mL(P<0.05),存活率仅为45.34%,与BB-1相差30.16%(P<0.05)。因此,能形成SCs细胞金黄色葡萄球菌BB-1的低温抗性较其他3株金黄色葡萄球菌强,而BH-25的低温抗性最弱。
2.2 低温胁迫下金黄色葡萄球菌细胞膜通透性的变化
如图2-a、图2-b所示,在低温胁迫处理过程中,4株金黄色葡萄球菌的胞内物质泄露量均不断增大,其中BB-1蛋白质泄露量最低,为0.687 mg/mL,核酸泄露量为96.1 ng/μL;但是,BH-25蛋白质泄露量为1.284 mg/mL,比BB-1多0.597 mg/mL(P<0.05),核酸泄露量为130.9 ng/μL比BB-1多34.8 ng/μL(P<0.05);其余2株菌的泄露量介于BB-1和BH-25菌株之间,BK-1蛋白质泄露量为0.938 mg/mL,核酸泄露量为117.5 ng/μL;FA-3蛋白质泄露量为1.216 mg/mL,核酸泄露量为129.1 ng/μL。由此可见,在4周低温处理后的BB-1胞内蛋白质和核酸泄露量均少于其他3株金黄色葡萄球菌,而BH-25的泄露量最多。
菌悬液的电导率测定结果如图2-c所示。4周后BB-1电导率上升最小为1.6 μS/cm,BH-25电导率上升最大为2.3 μS/cm比BB-1多上升0.7 μS/cm(P<0.05);BK-1菌悬液电导率上升1.9 μS/cm、FA-3上升2.1 μS/cm。结果表明,BB-1的电解质泄露量较少,菌悬液电导率较低;而BH-25电解质泄露量较大,菌悬液电导率较高。
各菌株细胞膜通透性如图2-d所示。经过4周低温处理后,4株金黄色葡萄球菌的细胞膜通透性都有所上升。4周低温处理后BB-1的OD590值在4株菌株中下降最少为1.81;BH-25的OD590值在4株菌株中下降最多为2.32;BK-1的OD590值下降2.08;FA-3的OD590值下降2.23。
因此,通过测量胞内泄露量、菌悬液电导率和结晶紫染色法测定金黄色葡萄球菌细胞膜完整性,结果表明在低温胁迫处理后,金黄色葡萄球菌BB-1的细胞膜通透性最低,完整性最好;BH-25的细胞膜通透性最高且完整性最差,BB-1和BH-25菌株在细胞膜完整性上具有显著性差异(P<0.05)。
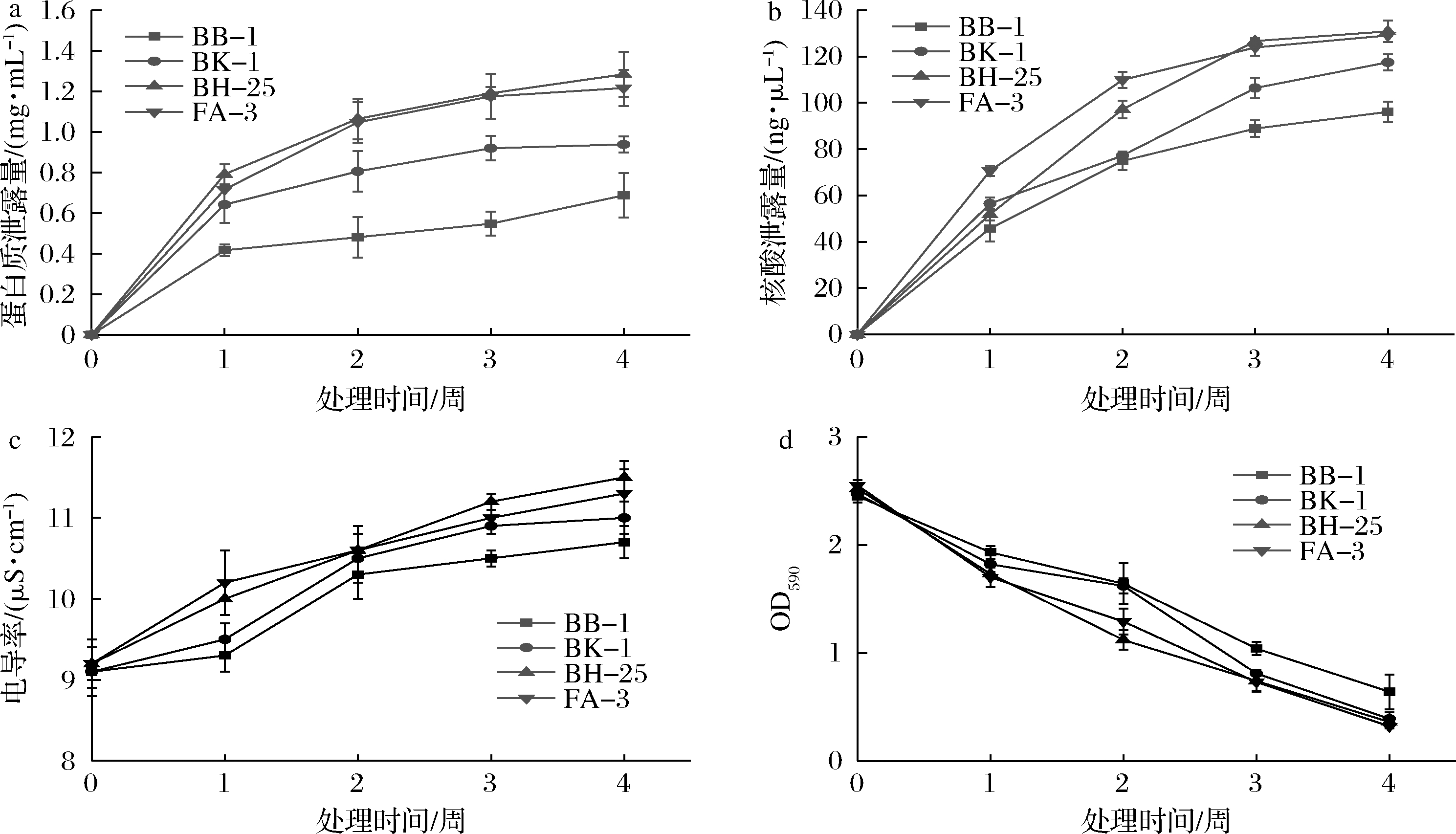
a-胞内蛋白质泄露量;b-胞内核酸泄露量;c-菌悬液电导率;d-细胞膜通透性
图2 低温对不同金黄色葡萄球菌细胞膜完整性的影响
Fig.2 Effect of low temperature on the cell membrane integrity of different S.aureus strains
2.3 基因实时荧光定量PCR分析
金黄色葡萄球菌的抗逆基因(rsb、rsbW和sigB)和细胞膜脂肪酸相关基因(fabD、fabF、fabG、fabH和fabI)表达量结果如图3所示。
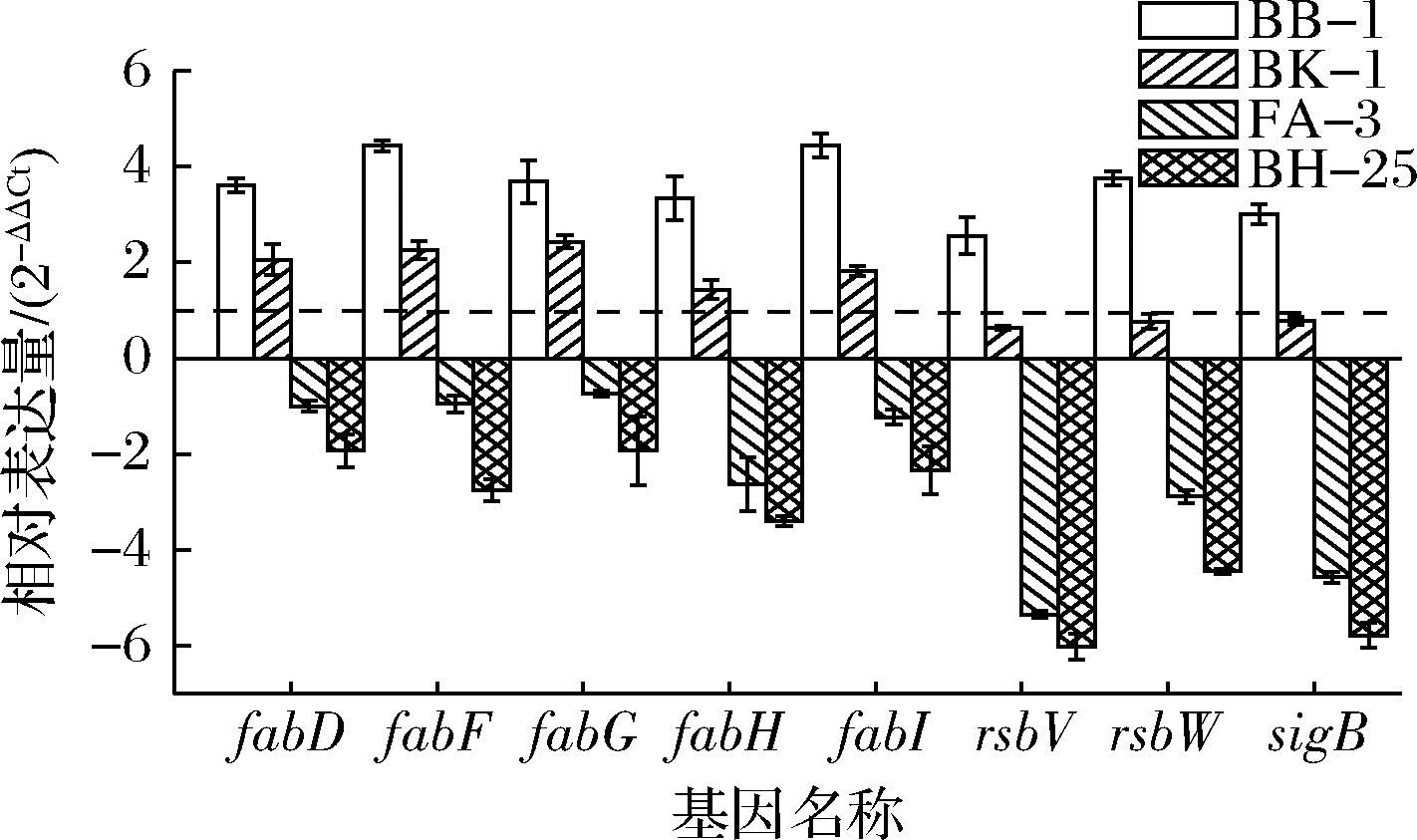
图3 低温对不同金黄色葡萄球菌相关基因表达量的影响
Fig.3 Effect of low temperature on the transcription of related genes of different S.aureus strains 注:虚线为内参基因表达量
在7 d低温处理后,BB-1和BK-1上述基因表达水平上调,而FA-3和BH-25基因表达水平下调。其中,BB-1的rsb、rsbW和sigB基因表达水平分别上调5.89、13.49和8.02倍,可能和机体积极抵抗环境的作用有关;然而BH-25的rsb、rsbW和sigB基因表达水平却分别下调0.015、0.046和0.018倍,显著低于BB-1的基因表达(P<0.05)。在fab家族基因表达水平中,BB-1的fabD、fabF、fabG、fabH和fabI基因表达水平分别上调12.18、21.64、12.87、10.10和21.71倍,这可能和细胞膜脂肪酸的生物合成水平增加有关;但是BH-25的fabD、fabF、fabG、fabH和fabI基因表达水平却分别下调0.26、0.14、0.26、0.095和0.19倍,显著低于BB-1的基因表达水平(P<0.05)。因此,在8个基因表达上,4株金黄色葡萄球菌有不同结果,低温抗性能力强的BB-1抗逆基因和细胞膜脂肪酸相关基因表达皆上调,而低温抗性能力最弱的BH-25基因表达水平皆显著下调。
3 讨论
金黄色葡萄球菌的低温抗性较强[17],本研究对不同金黄色葡萄球菌在长期低温胁迫下活细胞数目、细胞膜完整性和相关基因转录表达水平等进行探究。结果表明,能形成SCs细胞的BB-1比未能形成SCs细胞的其他3株菌在低温下存活能力更强,存活率更高。而在环境胁迫下可形成SCs状态的致病菌被认为是其抗逆存活的重要调控方式之一,并且SCs细胞通常具有极强的耐受性和抵抗能力,这和前人结果一致[7]。
细胞膜可以控制物质的进出和细胞内物质的运输,同时协助其抵抗外界不利环境和宿主免疫系统的侵害[18]。本研究通过测定细胞内容物泄露量、电导率和结晶紫法验证金黄色葡萄球菌在低温胁迫下细胞膜的完整性。形成SCs细胞的BB-1在低温胁迫下金黄色葡萄球菌细胞膜的完整性要优于未形成SCs的菌株,细胞内容物泄露最少,且存活率最高。这和经过低温诱导而形成SCs细胞壁变厚,细胞膜更完整,细胞生存能力更强的研究结果近似[19]。
有研究称,rsb-rsbW/sigB系统是机体的抗性调节系统,SigB因子在抗恶劣环境中起到至关重要的作用,SigB因子介导嘧啶生物的合成,从而调控绿脓杆菌SCs形成[20]。而SigB因子调节功能的发挥受RsbW和Rsb的调控,其中RsbW能够与SigB结合,从而阻滞SigB功能的发挥。Rsb又称为SigB拮抗剂抑制因子,即只有当Rsb与RsbW结合后,SigB因子才能够释放并发挥其胁迫耐受调节功能。SigB因子可以在恶劣环境下激活,例如暴露于热、盐和抗菌物质,这些条件刺激sigma因子的sigB基因转录表达,进而编码应激蛋白和其他机体防御进程[21]。而Rsb、RsbW和SigB因子受到rsb、rsbW和sigB基因编码,所以通过rsb、rsbW和sigB表达情况分析可以了解抗性调节系统的作用情况。结果发现对低温抗性强且能突变成SCs细胞的BB-1菌株sigB基因表达量上调最多,而低温抗性最差的BH-25菌株sigB基因表达水平下调最多。而SCs细胞的形成可能与sigB基因的上调表达有关,这和ALRESHIDI等[19]的研究结果相符。这也表明BB-1菌株能更好地通过rsb-rsbW/sigB系统在低温胁迫下调节机体功能,使得菌体对低温的抗性更强。而BH-25菌株体内rsb-rsbW/sigB系统却无法发挥作用,这也可能是导致其低温抗性最差的原因之一。
另外,长期低温环境会引起细菌细胞膜发生改变,细胞膜的变化主要和细胞膜上的脂肪酸响应环境压力的修饰改变有关,并在很大程度上归功于生物合成基因的调节。fab家族基因主要参与调控细胞膜脂肪酸的合成,fabD基因编码丙二酸单酰-辅酶A-ACP转移酶参与脂肪酸合成第一步,其催化丙二酸单酰基从乙酰CoA到酰基载体ACP的硫酯转移[22]。fabF和fabH基因参与编码β-酮脂酰基-ACP合酶和β-酮脂酰基-ACP合酶III,它们分别在碳碳键合成和支链脂肪酸缩合中起作用[23],该过程是脂肪酸合成缩合步骤的起始。fabG负责编码酮脂酰基还原酶,可以还原4-氯乙酰乙酸乙酯[24]。fabI编码烯脂酰基-ACP还原酶在脂肪酸生物合成步骤和完成延伸步骤中作用[25],细胞膜脂肪酸合成详细步骤如图4所示。
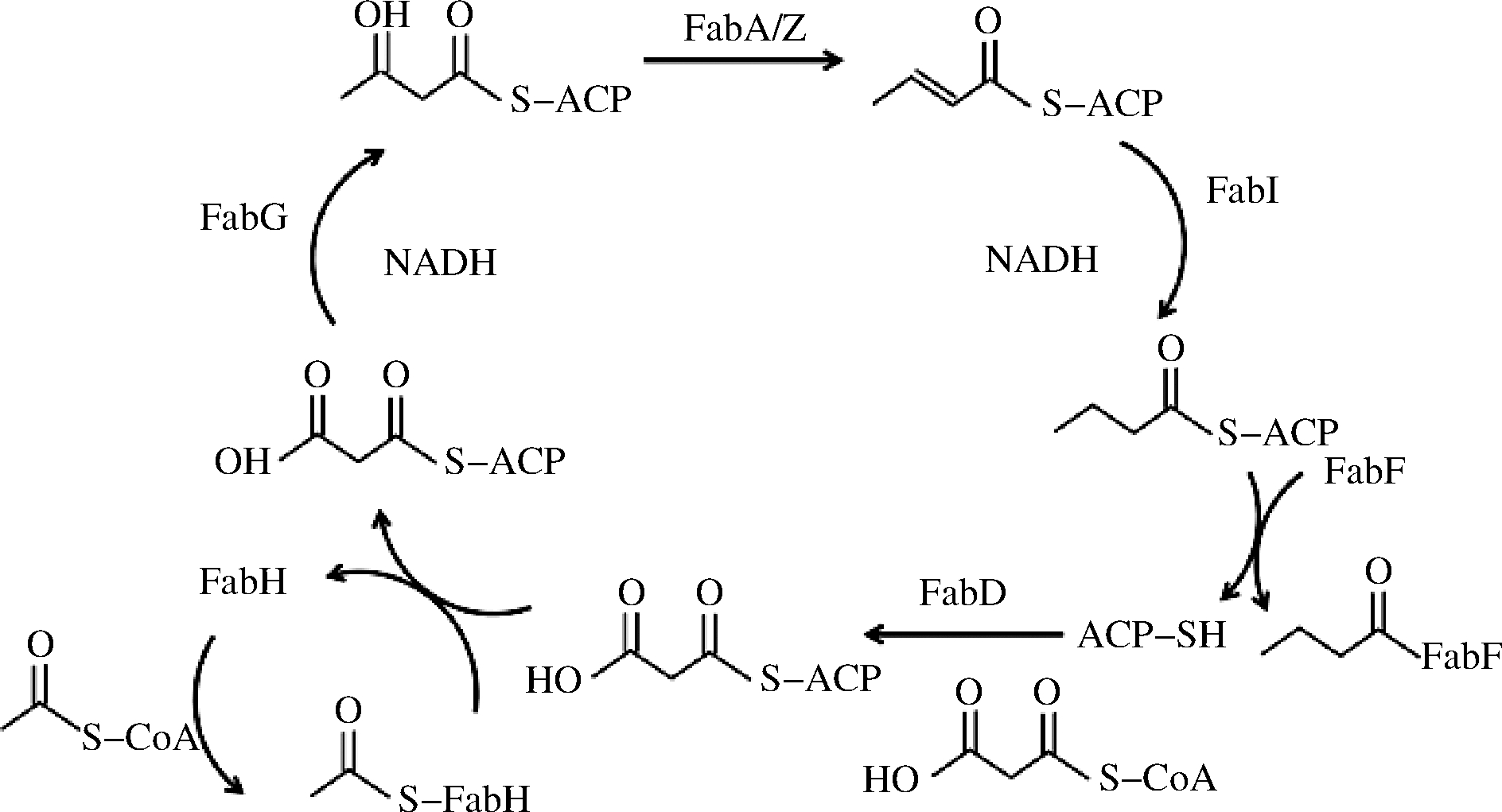
图4 细胞膜脂肪酸合成步骤
Fig.4 Cell membrane fatty acid synthesis steps 注:图中FabD、FabF、FabG、FabH和FabI皆为参与合成的酶, 分别由fabD、fabF、fabG、fabH和fabI基因编码
当细胞遭到胁迫后,细胞膜脂肪酸生物合成的基因会上调表达响应不利环境,这与WANG等[8]结果相似。因此解释了BB-1菌株在低温下通过细胞膜脂肪酸生物合成基因表达水平的上调导致机体合成脂肪酸能力加强,细胞膜完整性较好;而BH-25菌株细胞膜脂肪酸生物合成基因表达水平的下调可能导致机体无法维持正常生存的细胞膜脂肪酸能力,使得细胞膜完整性变差。
4 结论
总之,低温能够抑制金黄色葡萄球菌的生存,但由于存在种间抗性差异和小菌落变种情况,4株金黄色葡萄球菌对低温有不同的耐受性,能够形成SCs细胞的菌株低温抗性最强存活率更高。并且低温改变了细胞膜的通透性,使得细胞质物质流出胞外,但是SCs细胞的细胞膜完整性较好,细胞内容物流出最少,这可能由于形成SCs后细胞膜比普通菌株细胞膜更完整,具有存活优势。而能形成SCs细胞可能与rsb-rsbW/sigB系统发挥作用有关,能够使细胞在恶劣环境下做出有利的响应,并且该系统还可能调控细胞膜脂肪酸合成基因(fabD、fabF、fabG、fabH和fabI)的表达量增强,使得SCs细胞的细胞膜完整性更好,细胞内环境更加稳定,并且有助于细胞在低温下存活。但SCs细胞的低温胁迫抗性调节分子机制及关键基因的作用,仍有待于今后进一步的研究探讨。提醒我们即使长期冷藏的食品也会有金黄色葡萄球菌存活,更要避免低温耐受性强的菌株污染食品造成更大的危害,要求我们能找到对冷藏食品更有效的杀菌方式。
[1] BENCARDINO D, AMAGLIANI G, BRANDI G.Carriage of Staphylococcus aureus among food handlers:An ongoing challenge in public health[J].Food Control, 2021, 130(1):108362.
[2] 蓝素桂, 李治蓉, 苏爱秋, 等.金黄色葡萄球菌抗生素耐药研究进展[J].食品与发酵工业, 2021, 47(13):310-317.
LAN S G, LI Z R, SU A Q, et al.Reiew on the antibiotic resistance in Staphylococcus aureus[J].Food and Fermentation Industries, 2021, 47(13):310-317.
[3] 吴任之, 胡欣洁, 韩国全, 等.食源性金黄色葡萄球菌快速检测方法的研究进展[J].食品与发酵工业, 2021, 47(10):291-296.
WU R Z, HU X J, HAN G Q, et al.Research progress on rapid detection of food-borne Staphylococcus aureus[J].Food and Fermentation Industries, 2021, 47(10):291-296.
[4] EUROPEAN FOOD SAFETY AUTHORITY, EUROPEAN CENTRE FOR DISEASE PREENTION AND CONTROL.The European Union summary report on trends and sources of zoonoses, zoonotic agents and food-borne outbreaks in 2016[J].EFSA Journal, 2017, 15(12):e05077.
[5] TAS C E, UNAL H.Thermally buffering polyethylene halloysite phase change material nanocomposite packaging films for cold storage of foods[J].Journal of Food Engineering, 2021, 292(38):110351.
[6] SUO B, YANG H, WANG Y X, et al.Comparatie proteomic and morphological change analyses of Staphylococcus aureus during resuscitation from prolonged freezing[J].Frontiers in Microbiology, 2018, 9:866.
[7] QIAO J J, ZHU M J, FAN Y, et al.Properties and control of cold-induced small colony ariants of Staphylococcus aureus[J].Food Bioscience, 2021, 40:100874.
[8] WANG L H, WANG M S, ZENG X N, et al.Temperature-mediated ariations in cellular membrane fatty acid composition of Staphylococcus aureus in resistance to pulsed electric fields[J].Biochimica et Biophysica Acta (BBA)-Biomembranes, 2016, 1858(8):1 791-1 800.
[9] WANG Z C, YANG Q Q, WANG X Q, et al.Antibacterial actiity of xanthan-oligosaccharide against Staphylococcus aureus ia targeting biofilm and cell membrane[J].International Journal of Biological Macromolecules, 2020, 153:539-544.
[10] ANAPI G R, ABA R P M, GABRIEL A A.Screening for heat-resistant reference yeast isolate in orange juice[J].Food Microbiology, 2021, 94:103639.
[11] EL-LIETHY M A, HEMDAN B A, EL-TAWEEL G E.Phenotyping using semi-automated BIOLOG and conentional PCR for identification of Bacillus isolated from biofilm of sink drainage pipes[J].Acta Ecologica Sinica, 2018, 38(5):334-338.
[12] ZASTEMPOWSKA E, ORCZYKOWSKA-KOTYNA M, LASSA H.Isolation of nuc mutant isolates of Staphylococcus aureus from boine clinical mastitis[J].The eterinary Journal, 2014, 200(3):446-448.
[13] CHOI S J, YANG S Y, YOON K S.Lactic acid bacteria starter in combination with sodium chloride controls pathogenic Escherichia coli (EPEC, ETEC, and EHEC) in kimchi[J].Food Microbiology, 2021, 100:103868.
[14] HINGSTON P, CHEN J, DHILLON B K, et al.Genotypes associated with Listeria monocytogenes isolates displaying impaired or enhanced tolerances to cold, salt, acid, or desiccation stress[J].Frontiers in Microbiology, 2017, 8:369.
[15] WANG L H, ZENG X N, WANG M S, et al.Modification of membrane properties and fatty acids biosynthesis-related genes in Escherichia coli and Staphylococcus aureus:Implications for the antibacterial mechanism of naringenin[J].Biochimica et Biophysica Acta (BBA) - Biomembranes, 2018, 1860(2):481-490.
[16] GARCIA-GONZALEZ L, GEERAERD A H, MAST J, et al.Membrane permeabilization and cellular death of Escherichia coli, Listeria monocytogenes and Saccharomyces cereisiae as induced by high pressure carbon dioxide treatment[J].Food Microbiology, 2010, 27(4):541-549.
[17] QIU Y H, XU D, XIA X C, et al.Fie major two components systems of Staphylococcus aureus for adaptation in dierse hostile enironment[J].Microbial Pathogenesis, 2021, 159:105119.
[18] HUSSAIN CHAN M W, MIRANI Z A, KHAN M N, et al.Isolation and characterization of small colony ariants of Staphylococcus aureus in arious food samples[J].Biocatalysis and Agricultural Biotechnology, 2021, 35:102097.
[19] ALRESHIDI M M, DUNSTAN R H, MACDONALD M M, et al.Metabolomic and proteomic responses of Staphylococcus aureus to prolonged cold stress[J].Journal of Proteomics, 2015, 121(5):44-55.
[20] KINT N, JANOIR C, MONOT M, et al.The alternatie Sigma factor σB plays a crucial role in adaptie strategies of Clostridium difficile during gut infection[J].Enironmental Microbiology, 2017, 19(5):1 933-1 958.
[21] GOMES NETO N J, MAGNANI M, CHUECA B, et al.Influence of general stress-response alternatie sigma factors σS (RpoS) and σB (SigB) on bacterial tolerance to the essential oils from Origanum ulgare L.and Rosmarinus officinalis L.and pulsed electric fields[J].International Journal of Food Microbiology, 2015, 211:32-37.
[22] CAMPBELL J W, CRONAN J E Jr.Bacterial fatty acid biosynthesis:Targets for antibacterial drug discoery[J].Annual Reiew of Microbiology, 2001, 55:305-332.
[23] QIU X Y, CHOUDHRY A E, JANSON C A, et al.Crystal structure and substrate specificity of the β-ketoacyl-acyl carrier protein synthase III (FabH) from Staphylococcus aureus[J].Protein Science, 2005, 14(8):2 087-2 094.
[24] HEATH R J, ROCK C O.Fatty acid biosynthesis as a target for noel antibacterials[J].Current Opinion in Inestigational Drugs (London, England:2000), 2004, 5(2):146-153.
[25] HEATH R J, LI J, ROLAND G E, et al.Inhibition of the Staphylococcus aureus NADPH-dependent enoyl-acyl carrier protein reductase by triclosan and hexachlorophene[J].Journal of Biological Chemistry, 2000, 275(7):4 654-4 659.