‘阳光玫瑰’(Shine Muscat)葡萄为非呼吸跃变型水果,属于葡萄科葡萄属落叶藤本植物,是日本以安芸津21号和白南为亲本杂交选育而成的中晚熟品种[1],是中国近几年来发展最快的葡萄品种之一[2]。果实颗粒呈黄绿色,皮薄肉多,肉质香脆且玫瑰香味浓郁,矿质元素、糖类、维生素、柠檬酸等多种营养成分含量丰富,深受人们的喜爱。但易软化腐烂,不利于商品化进程,给葡萄的贮藏和售卖带来困难。因此研究不同形式SO2保鲜剂对保持‘阳光玫瑰’葡萄的硬度品质,延长果实贮藏期非常重要。
目前,‘阳光玫瑰’葡萄的常用防腐保鲜剂是能释放SO2的焦亚硫酸钠[3]。SO2还原性好, 对果蔬组织中的微生物和细胞壁降解酶活力有较强抑制作用, 能提高果实的耐贮性,延缓衰老软化[4]。果实软化与细胞壁组分含量的变化密切相关,原果胶是保持细胞壁结构完整的果胶成分,贮藏期间逐渐降解为可溶性果胶,细胞壁支持作用变弱甚至消失,细胞间隙扩大,组织结构松散,进而硬度下降,导致果实软化[5]。果实软化与细胞壁降解酶活力也有密切的关系,纤维素酶(cellulase,Cx)将纤维素解聚为低分子糖类;果胶甲酯酶(pectin methylesterase,PME)可去除果胶分子链上半乳糖醛酸羧基的酯化基团,使糖醛酸残基生成多聚半乳糖醛酸,为多聚半乳糖醛酸酶(polygalacturonase,PG)作用提供底物,PG催化多聚半乳糖醛酸生成低聚半乳糖醛酸或半乳糖醛酸;β-半乳糖苷酶(β-D-galactosidase,β-gal)降解果胶多聚醛酸上的半乳糖残基,使半乳糖和阿拉伯糖残基从细胞壁中分解,细胞壁降解酶协同作用导致细胞之间联结减少,细胞壁组分不稳定,进而导致果实软化腐烂[6]。近几年,国内外对SO2保鲜剂的研究较多,刘丽青等[7]发现SO2作用使葡萄活性氧含量升高,细胞的防御应答以及抗氧化能力增强,果实的抗感染能力增强,从而延长了货架期。田静[8]研究SO2保鲜剂中Na2SO3浓度时发现,浓度提高且作用时间延长,pH降低,抑制采后葡萄中灰霉菌的作用显著增强。佟继旭等[9]研究发现,SO2保鲜剂处理能提高‘红地球’葡萄的贮藏品质,其中SO2气体熏蒸与粉、片结合的效果最好。随葡萄保鲜剂的深入研究,SO2保鲜剂的形式从粉剂、片剂发展到第3代胶囊缓释贴片,但不同形式SO2保鲜剂处理对‘阳光玫瑰’葡萄贮藏效果的研究未见报道。
本研究通过SO2粉剂、SO2片剂和SO2胶囊贴片分别对‘阳光玫瑰’葡萄果实进行处理,测定葡萄果实贮藏期间硬度和细胞壁代谢变化,以探明不同形式SO2保鲜剂对葡萄硬度及细胞壁降解相关酶活力的影响程度,以期为抑制‘阳光玫瑰’葡萄贮藏期间果实软化、提高耐贮性提供理论参考。
1 材料与方法
1.1 材料与试剂
实验于2019年8月上旬进行,以湖南省张家界市葡萄基地中的‘阳光玫瑰’品种为材料,选择长势一致、颗粒大小及颜色均匀、无机械擦伤及病原菌感染、无褐变腐烂、成熟度相同、果穗底端可溶性固形物含量达18 °Brix以上的葡萄串。
SO2胶囊贴片,南非优卫士有限公司,其活性成分为含量94.0%的焦亚硫酸钠。每10 kg葡萄用1张贴片,平整放置在经过预冷的葡萄上部。
SO2片剂,天津绿达保鲜工程技术有限公司;每千克葡萄用2小包(2片/小包),在每包上扎2个直径为0.55~0.85 mm的孔,均匀放置在经过预冷的葡萄上部或穗之间。
SO2粉剂,陕西鲜博士保鲜剂厂;每千克葡萄用1包,在每包上扎2个直径为0.55~0.85 mm的孔,均匀放置在经过预冷的葡萄上部或穗之间。
咔唑、半乳糖醛酸、浓硫酸(分析纯)、冰醋酸、无水乙酸钠、NaCl、多聚半乳糖醛酸、柠檬酸、柠檬酸钠、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、羧甲基纤维素钠、醋酸、醋酸钠、果胶、β-巯基乙醇、4-硝基苯基-β-D-吡喃半乳糖苷、Na2CO3溶液,国药集团化学试剂有限公司;葡萄糖标准品,合肥博美生物技术有限公司;半乳糖醛酸标准品,北京京泰宏达生物科技有限公司;无水乙醇,成都曼斯特生物科技有限公司。
1.2 仪器与设备
BSA 124S型精密分析天平,梅特勒-托利多仪器上海有限公司;U-1 800型紫外可见分光光度计,岛津仪器(苏州)有限公司;26XP型冷冻离心机,美国Beckman公司;WP-UP-WF-20超纯水制备机,四川沃特尔水处理设备有限公司;CT3型质构分析仪,Brookfield工程试验室公司;DHG-9053A型电热恒温鼓风干燥箱,上海精宏试验设备厂。
1.3 实验方法
采后使用冷链车运回冷库,在-1~0 ℃冷库中预冷12 h,分别放入SO2粉剂、SO2片剂和SO2胶囊贴片保鲜剂,在相对湿度为90%~95%的冷库中贮藏,每隔10 d取样进行硬度测定,并将果实用液氮处理后,磨粉,-80 ℃超低温冰箱保存,用于细胞壁组分及其降解酶活性的分析检测。实验设3 次重复。对照组不采用任何SO2保鲜剂处理,其他条件与处理组一致。
1.3.1 硬度的测定
将葡萄颗粒放置于质构仪载具上,采用 TA9探头,TA-BT-KI夹具,在 TPA模式下进行硬度的测定[10],每个果实在赤道部取1点循环测定2次,测试速率为0.5 mm/s,触发点负载5.0 g。每批样品随机取10颗果实,结果取平均值。
1.3.2 可溶性果胶和原果胶质量分数的测定
参照曹建康等[11]的咔唑比色法,稍作修改。称取1.0 g样品于离心管中,加入25 mL 95%乙醇,煮沸30 min,冷却,12 000 r/min离心10 min,将上清液倒出,重复3次。加入20 mL蒸馏水,50 ℃保温30 min,冷却后离心,得到的上清液为可溶性果胶溶液。向沉淀中加入25 mL 0.5 mol/L H2SO4溶液,煮沸1 h,冷却后离心,得到的上清液为原果胶溶液。
1.3.3 PME活力的测定
参照GE等[12]的方法,稍作修改。称取5.0 g样品于离心管中,加入10 mL 95%已预冷的乙醇,振荡,4 ℃ 12 000 r/min离心10 min,将上清液倒出。加入 5.0 mL 80%已预冷的乙醇,振荡,离心,将上清液倒出。再加入5.0 mL 50 mmol/L乙酸盐缓冲液,离心,得到的上清液即为酶提取液。
取1.0 mL醋酸缓冲液、0.5 mL果胶和0.5 mL酶提取液加入具塞刻度试管中,振荡,37 ℃保温1 h,迅速加入1.5 mL 3,5-二硝基水杨酸,煮沸5 min,冷却至常温,加水至刻度后混匀,测定540 nm处吸光度值,每个处理平行测定3次。
1.3.4 PG活力的测定
参照曹建康等[11]的DNS比色法, 稍作修改。称取10.0 g样品于离心管中,加入20 mL 95%已预冷的乙醇,振荡,低温放置10 min,4 ℃下12 000×g离心20 min,将上清液倒出。加入10 mL 80%已预冷的乙醇,振荡,低温静置,离心后倒出上清液。再加入5 mL已预冷的提取缓冲液,低温静置20 min,离心,得到的上清液即为酶提取液。
取1.0 mL多聚半乳糖醛酸溶液和1.0 mL乙酸-乙酸钠缓冲液加入2支具塞刻度试管中,再分别加入0.5 mL酶提取液和煮沸5 min的酶提取液,振荡,37 ℃保温1 h,迅速加入1.5 mL DNS,煮沸5 min,冷却至常温,加水至刻度后混匀。按半乳糖醛酸标准曲线的操作测定,每个处理平行测定3次,PG活性以每小时每克样品在37 ℃催化多聚半乳糖醛酸水解生成半乳糖醛酸的质量表示。
1.3.5 Cx活力的测定
参照曹建康等[11]的DNS比色法,与PG活力测定相同,Cx活性以每小时每克葡萄样品在37 ℃催化羧甲基纤维素形成还原糖的质量表示。
1.3.6 β-gal活力的测定
参照KLUCK等[13]的方法,稍作修改。称取1.0 g样品于离心管中,加4 mL 0.05 mmol/L已预冷的醋酸钠缓冲液,低温静置30 min,4 ℃ 12 000 r/min离心20 min,得到的上清液即为酶提取液。
试管中加入2 mL 3 mmol/L 4-硝基苯基-β-D-吡喃半乳糖苷和0.1 mL酶液,振荡,40 ℃保温1 h,加入2 mL 1 mol/L Na2CO3溶液,对照组不经过保温直接加入2 mL Na2CO3溶液,振荡,测定400 nm处吸光度值,每个处理平行测定3次。
1.4 数据统计与分析
采用Excel 2010软件对数据进行整理和统计处理,采用SPSS 26软件进行方差分析和Duncan法显著性检验(P<0.05表示差异显著),采用Origin 2021软件作图。
2 结果与分析
2.1 不同形式SO2保鲜剂处理对‘阳光玫瑰’葡萄贮藏期间硬度的影响
硬度反映了果实抗外界压力的强弱,是衡量果实贮藏效果的重要指标。如图1 所示,在贮藏期间,葡萄硬度总体呈下降趋势,不同形式SO2保鲜剂处理,葡萄硬度变化幅度不同。各处理组果实硬度在贮藏前期(0~40 d)的下降速度比贮藏后期(40~60 d)快,贮藏到第40天时出现“拐点”。与贮藏初期相比,SO2粉剂、SO2片剂和SO2胶囊贴片处理组硬度在贮藏第40天时分别下降25.47%、26.15%和20.80%。对照组果实硬度在整个贮藏期间持续以较快速度下降,到第60天时分别比SO2粉剂、SO2片剂和SO2胶囊贴片处理的果实低19.05%、30.81%和40.62%。进一步比较发现,在贮藏期内的同一时间点,处理组果实的硬度均高于对照,顺序依次为:SO2胶囊贴片>SO2片剂>SO2粉剂>对照。
以上结果表明,不同形式SO2保鲜剂处理明显减缓了贮藏期间葡萄硬度的下降速度,在一定程度上延缓了葡萄的软化进程,其中SO2胶囊贴片处理的葡萄果实,其硬度下降最慢,其次是SO2片剂。SO2保鲜剂中释放的SO2能抑制细胞壁降解酶活力,从而减缓葡萄内原果胶向可溶性果胶的转化进程。在SO2粉剂和SO2片剂中,前者释放SO2较快,适用于葡萄产品的短期贮藏;后者释放SO2较均匀、药效期长,但SO2的释放起始浓度低,不能起到良好的抑酶杀菌效果。SO2胶囊贴片采用3层膜夹2层焦亚硫酸钠的技术[14],分两段释放SO2,释放速率慢的成分被蜡封在极小的胶囊中,再均匀分布于2层膜之间的蜡格内,保证在贮藏的各时期都有SO2释放且释放量合适,具有效果稳定、作用时间长和效率高等特点,使得葡萄硬度变化相对平缓。
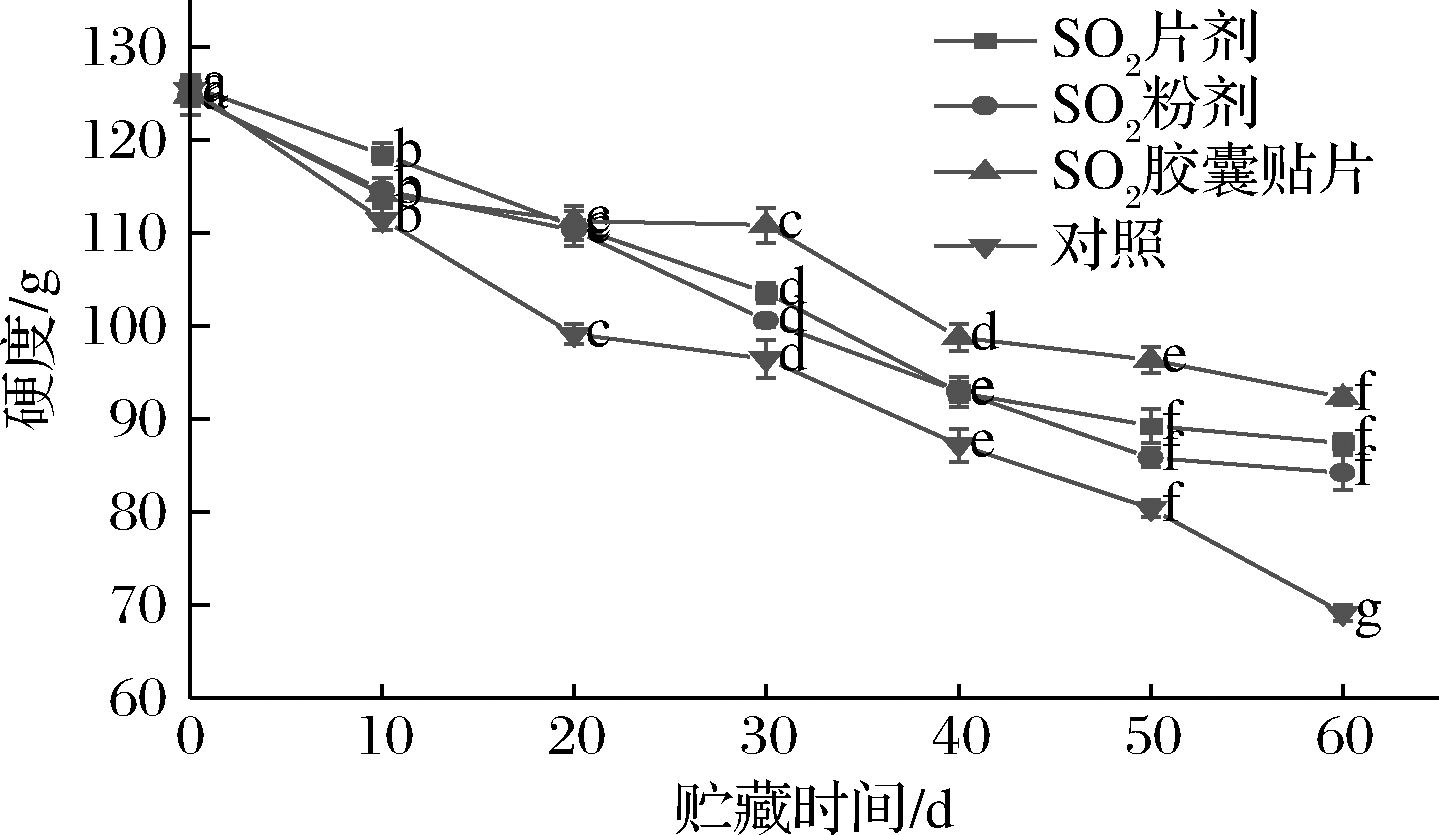
图1 不同形式SO2保鲜剂处理对果实硬度的影响
Fig.1 Effect of different forms of SO2 preseratie treatment on fruit firmness 注:图中不同小写字母表示相同处理的样品在不同贮藏期 有显著差异(P<0.05)(下同)
2.2 不同形式SO2保鲜剂处理对‘阳光玫瑰’葡萄贮藏期间果胶质量分数的影响
果胶是组成细胞壁结构的重要成分,存在于细胞的胞间层,将相邻细胞紧密黏合在一起。在贮藏过程中,果实内原果胶不断降解为可溶性果胶,导致果实变软。如图2-a所示,葡萄果实内原果胶质量分数在贮藏期间总体呈下降趋势。贮藏0~10 d,SO2粉剂、SO2片剂和SO2胶囊贴片处理组原果胶质量分数分别下降了5.83%、10.82%和0.94%。SO2粉剂组在贮藏后期(10~60 d)持续下降,降低了62.30%。SO2片剂和SO2胶囊贴片组分别在贮藏第20天和第30天时下降较快速,而后下降速度缓慢。对照组在整个贮藏期间持续以较快速度下降,第60天时分别比SO2粉剂、SO2片剂和SO2胶囊贴片处理的果实低19.05%、30.81%和40.62%。进一步比较发现,在贮藏期内的同一时间点,不同形式SO2保鲜剂处理的原果胶质量分数均高于对照,顺序依次为:SO2胶囊贴片>SO2片剂>SO2粉剂>对照。
如图2-b所示,葡萄内可溶性果胶质量分数在贮藏期间总体呈上升趋势。贮藏0~20 d内,SO2粉剂组可溶性果胶质量分数上升14.73%,SO2片剂组基本保持不变,SO2粉剂和SO2片剂组可溶性果胶质量分数在贮藏中后期(30~60 d)缓慢上升,贮藏第60天时,与贮藏初期相比分别上升了37.10%和35.71%。SO2胶囊贴片组可溶性果胶质量分数在贮藏前期(0~30 d)变化平缓,第30天开始快速上升,而后速度减慢,在贮藏60 d内升高了25.95%。对照组果实内可溶性果胶质量分数在贮藏期间以较快速度持续上升,第60天时分别比SO2粉剂、SO2片剂和SO2胶囊贴片处理组高18.07%、22.91%和28.63%。进一步比较发现,在贮藏期内的同一时间点,不同形式SO2保鲜剂处理的可溶性果胶质量分数均低于对照,顺序依次为:对照>SO2粉剂>SO2片剂>SO2胶囊贴片。
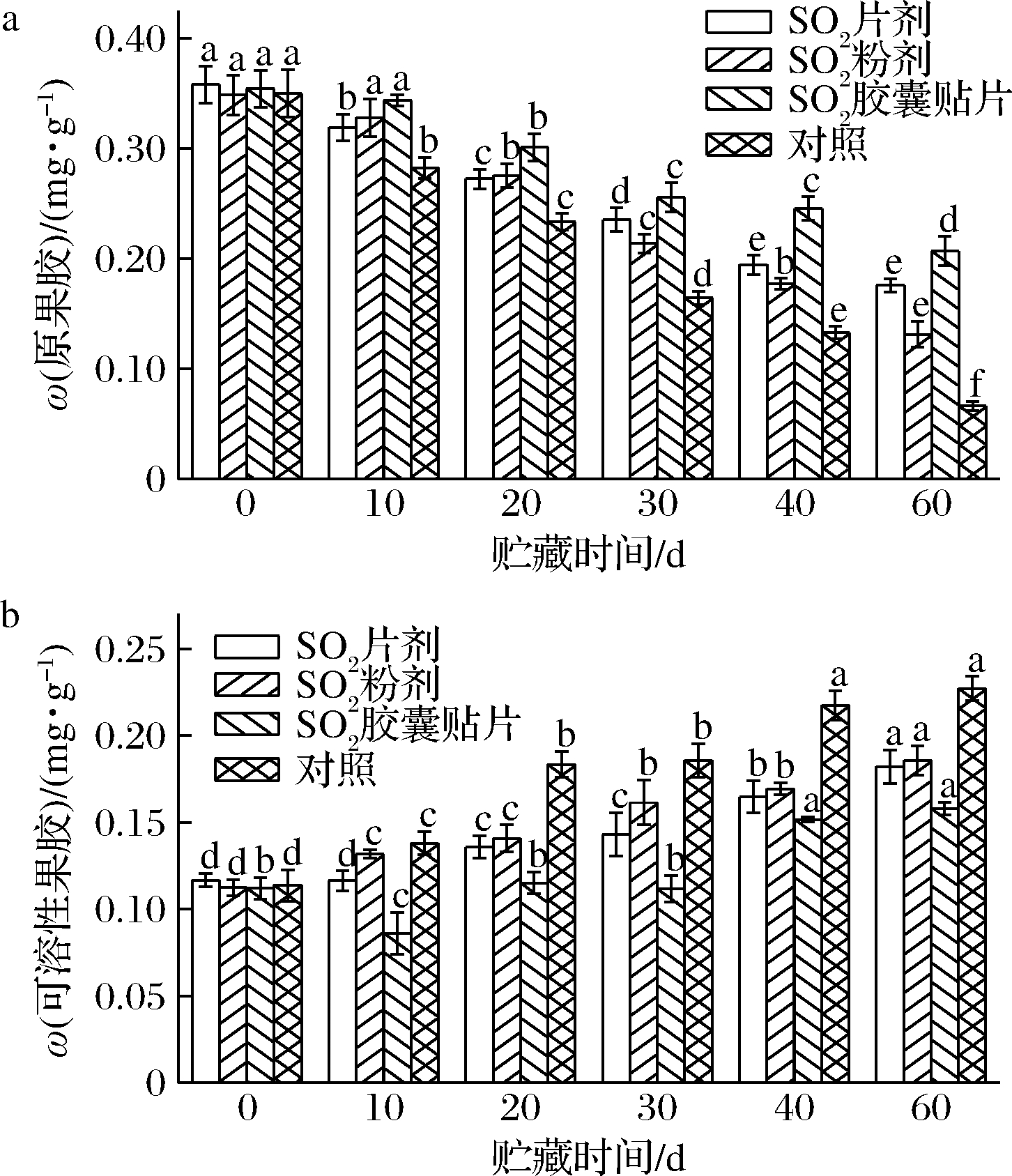
a-原果胶;b-可溶性果胶
图2 不同形式SO2保鲜剂处理对葡萄果胶 质量分数的影响
Fig.2 Effect of different forms of SO2 preseratie treatment on pectin mass fraction of grape
不同形式SO2保鲜剂处理明显减缓了贮藏期间葡萄果实内原果胶的降解,一定程度上延缓了果实的软化进程,其中SO2胶囊贴片处理的葡萄果实,其原果胶降解最慢,其次是SO2片剂,与张玉丽等[6]对红提葡萄采后软化的研究结果相似。果胶是胞间层与初生细胞壁之间的主要物质,起到将相邻细胞紧密黏在一起的作用。在贮藏过程中,果胶解聚为低分子物质,细胞壁网孔加大,进而细胞壁降解酶更易与对应底物接触,导致细胞解体进程加快,细胞壁降解[15]。SO2保鲜剂释放的SO2通过抑制细胞壁降解酶对细胞壁中的半乳糖醛酸和阿拉伯糖的分解作用,保护细胞壁的完整结构,延缓果实软化,与李欢[16]对冬枣成熟软化机制的研究结果相似。SO2粉剂作用时间短,SO2片剂释放SO2浓度低,SO2胶囊贴片在贮藏初期大量释放的SO2迅速高效杀灭病原菌,中后期低浓度释放的SO2抑制细胞壁相关酶活力,且SO2作用时间长,克服了SO2粉剂和SO2片剂的缺陷,显著减缓了果胶物质的降解,保护了细胞壁结构的完整性,与陈守江等[17]对蓝莓的研究结果相似。
2.3 不同形式SO2保鲜剂处理对‘阳光玫瑰’葡萄贮藏期间细胞壁降解酶活力的影响
2.3.1 对葡萄果实内Cx活力的影响
如图3所示,葡萄果实内Cx活力总体呈先上升后缓慢降低趋势,不同形式SO2保鲜剂处理,Cx活力变化幅度不同。SO2粉剂、SO2片剂、SO2胶囊贴片和对照组果实内Cx活力在贮藏前中期(0~40 d)分别上升了88.31%、86.28%、78.44%和90.61%,于第40天时达到峰值。贮藏后期(40~60 d)Cx活力缓慢降低,贮藏第60天时,对照组Cx活力分别比SO2粉剂、SO2片剂和SO2胶囊贴片组高68.38%、62.88%和39.90%。进一步比较发现,在贮藏期内的同一时间点,不同形式SO2保鲜剂处理的果实Cx活力都低于对照组,顺序依次为:对照>SO2粉剂>SO2片剂>SO2胶囊贴片。
以上结果表明,不同形式SO2保鲜剂处理明显抑制了贮藏期间葡萄果实内Cx活力,一定程度上延缓了果实的软化进程,其中SO2胶囊贴片处理的葡萄,其Cx活力最小,其次是SO2片剂。Cx能分解含β-1,4-糖苷键的半纤维素,对羧甲基纤维素也表现出活性,在果实成熟中发挥重要作用,果实内Cx活力越大,果实软化腐烂越快,不同形式SO2保鲜剂处理在不同程度上抑制了Cx活力,减少了对细胞壁结构的破坏,从而延缓了果实的软化。SO2胶囊贴片对葡萄的保鲜周期比SO2粉剂长,SO2释放的浓度比SO2片剂大,有效抑制Cx活力的同时防止了病原菌的浸染,是果蔬贮藏的理想保鲜剂。
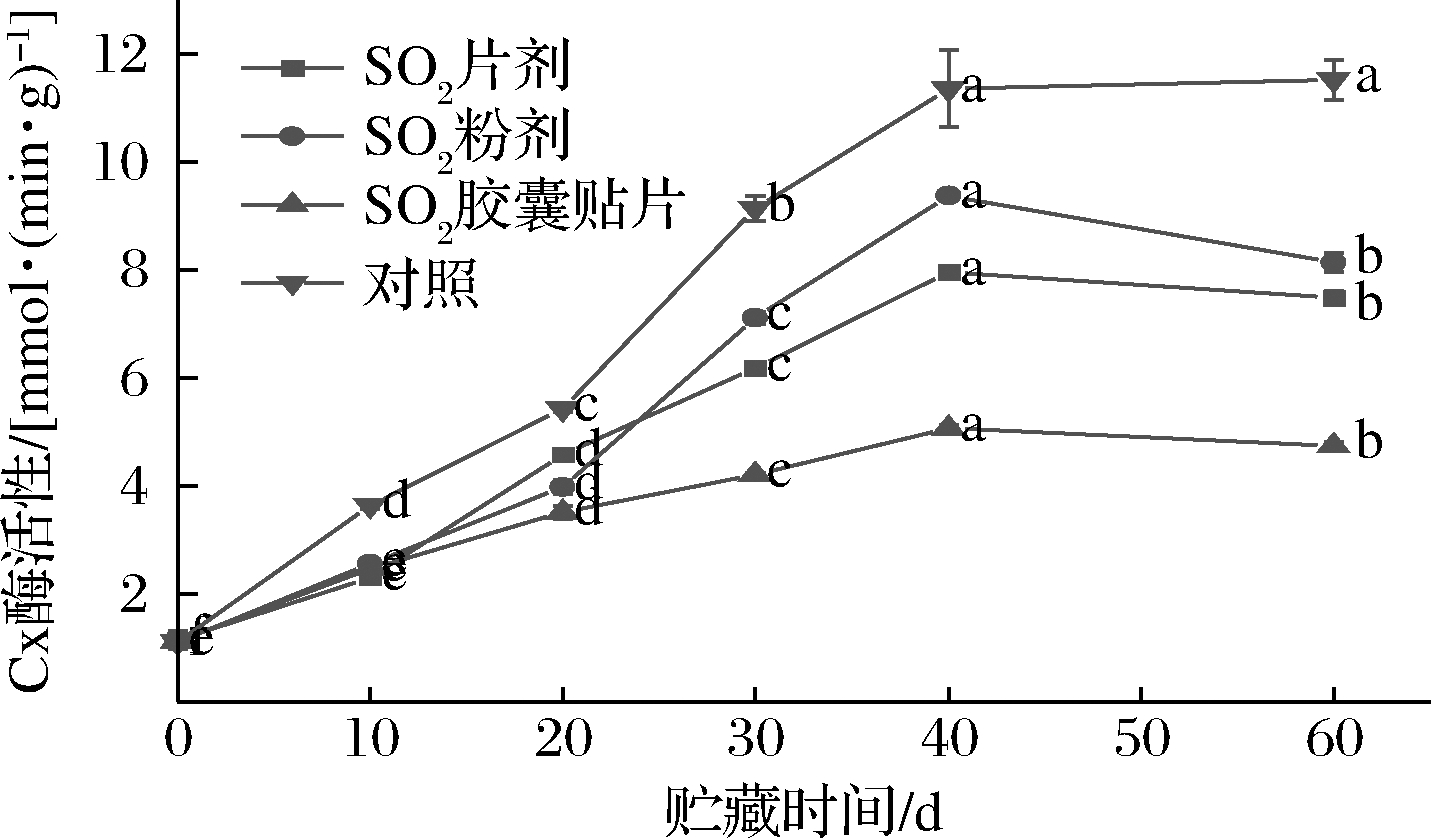
图3 不同形式SO2保鲜剂处理对果实内Cx活力的影响
Fig.3 Effect of different forms of SO2 preseratie treatment on Cx actiity in fruit
2.3.2 对葡萄果实内PME活力的影响
如图4所示,葡萄果实内PME活力总体呈先上升后降低趋势,不同形式SO2保鲜剂处理,PME活力变化幅度不同。SO2粉剂、SO2片剂和SO2胶囊贴片组和对照组果实内PME活力在贮藏0~40 d内快速上升,分别上升了81.83%、77.29%、73.66%和88.33%,于第40天时达到峰值。贮藏后20 d内各处理组和对照组PME活力以不同速度下降,贮藏第60天时,对照组PME活力分别是SO2粉剂、SO2片剂、SO2胶囊贴片组的1.466倍、1.621倍和2.040倍。进一步比较发现,在贮藏期内的同一时间点,不同形式SO2保鲜剂处理的果实内PME活力都低于对照组,顺序依次为:对照>SO2粉剂>SO2片剂>SO2胶囊贴片。
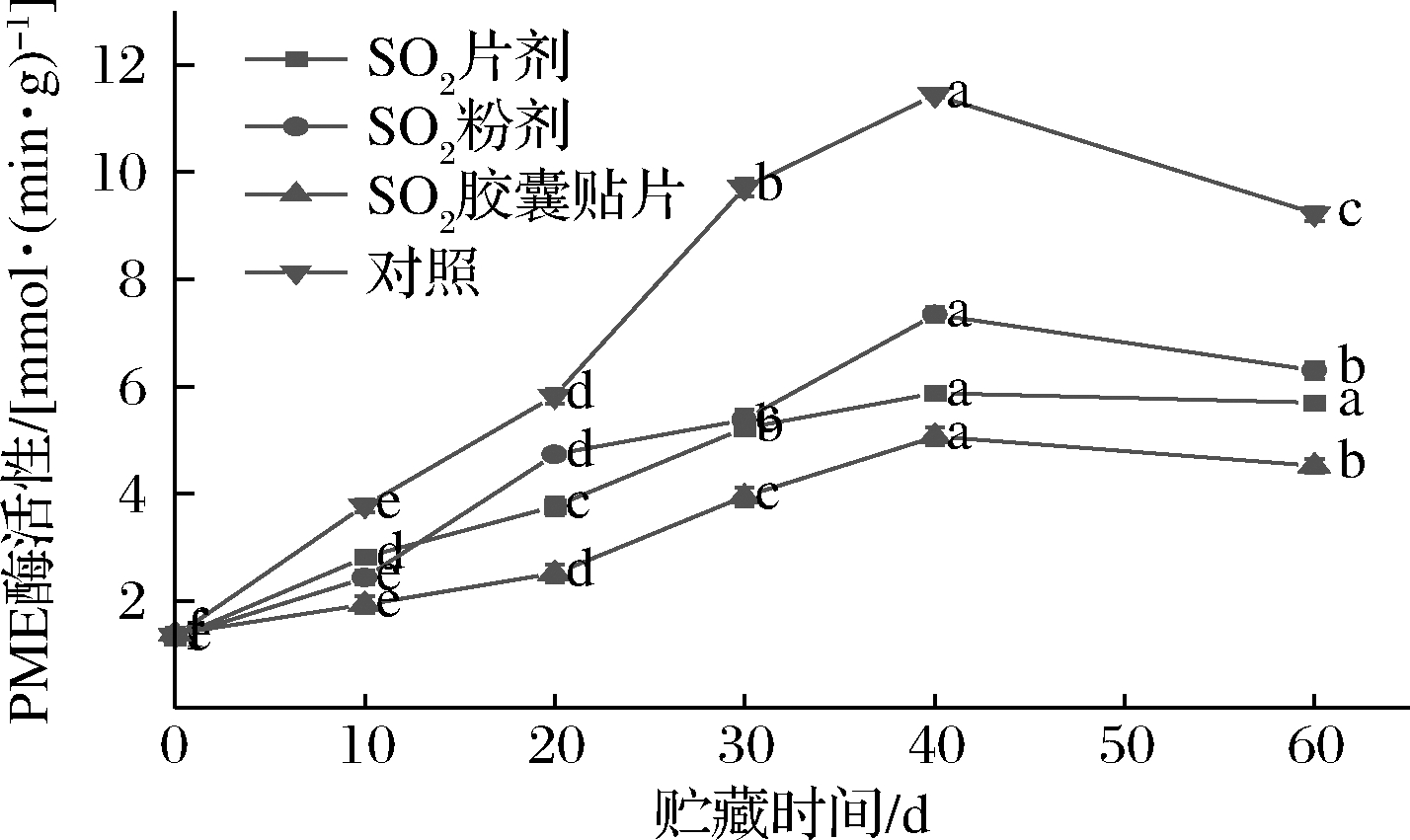
图4 不同形式SO2保鲜剂处理对果实内PME活力的影响
Fig.4 Effect of different forms of SO2 preseratie on PME actiity in fruit
以上结果表明,不同形式SO2保鲜剂处理明显抑制了贮藏期间葡萄果实内PME活力,一定程度上延缓了果实的软化进程,其中SO2胶囊贴片形式处理的葡萄,其PME活力最小,其次是SO2片剂。PME可去除果胶分子链上半乳糖醛酸羧基的酯化基团,形成多聚半乳糖醛酸,破坏果胶结构。对照组中PME活力始终较高,使得葡萄细胞壁中大量果胶去甲酯化,结构被破坏,硬度降低,果实软化腐烂。SO2保鲜剂释放的SO2对PME活力有明显的抑制作用,使得果胶甲酯化程度降低,减慢果胶的降解速度。另外,SO2释放的浓度和稳定性不同,保鲜效果有明显差异,SO2释放浓度越稳定、持续时间越久,对酶活力的抑制效果越好,果实软化越缓慢。SO2粉剂释放浓度高但稳定性差,SO2片剂稳定性好但释放浓度低,而SO2胶囊贴片结合了前两者的优点,贮藏初期释放的高浓度SO2能显著抑制果实表面引起腐败的细菌以及内部引起腐败的降解酶等,贮藏中后期释放稳定的低浓度SO2持续抑制降解酶活力,减慢原果胶向可溶性果胶的转化进程,更有利于葡萄的长期贮藏。
2.3.3 对葡萄果实内PG活力的影响
如图5所示,葡萄果实内PG活力总体呈上升趋势,不同形式SO2保鲜剂处理,PG活力变化幅度不同。贮藏前40 d内,SO2粉剂、SO2片剂、SO2胶囊贴片和对照组果实内PG活力快速增加。贮藏40~60 d,SO2粉剂组和对照组PG活力分别上升8.54%和8.52%,SO2片剂组降低4.53%,而SO2胶囊贴片组维持稳定状态;第60天时对照组果实内PG活力分别是SO2粉剂、SO2片剂和SO2胶囊贴片组的1.473倍、1.826倍和2.418倍。进一步比较发现,在贮藏期内的同一时间点,不同形式SO2保鲜剂处理的葡萄果实内PG活力均低于对照组,顺序依次为:对照>SO2粉剂>SO2片剂>SO2胶囊贴片。
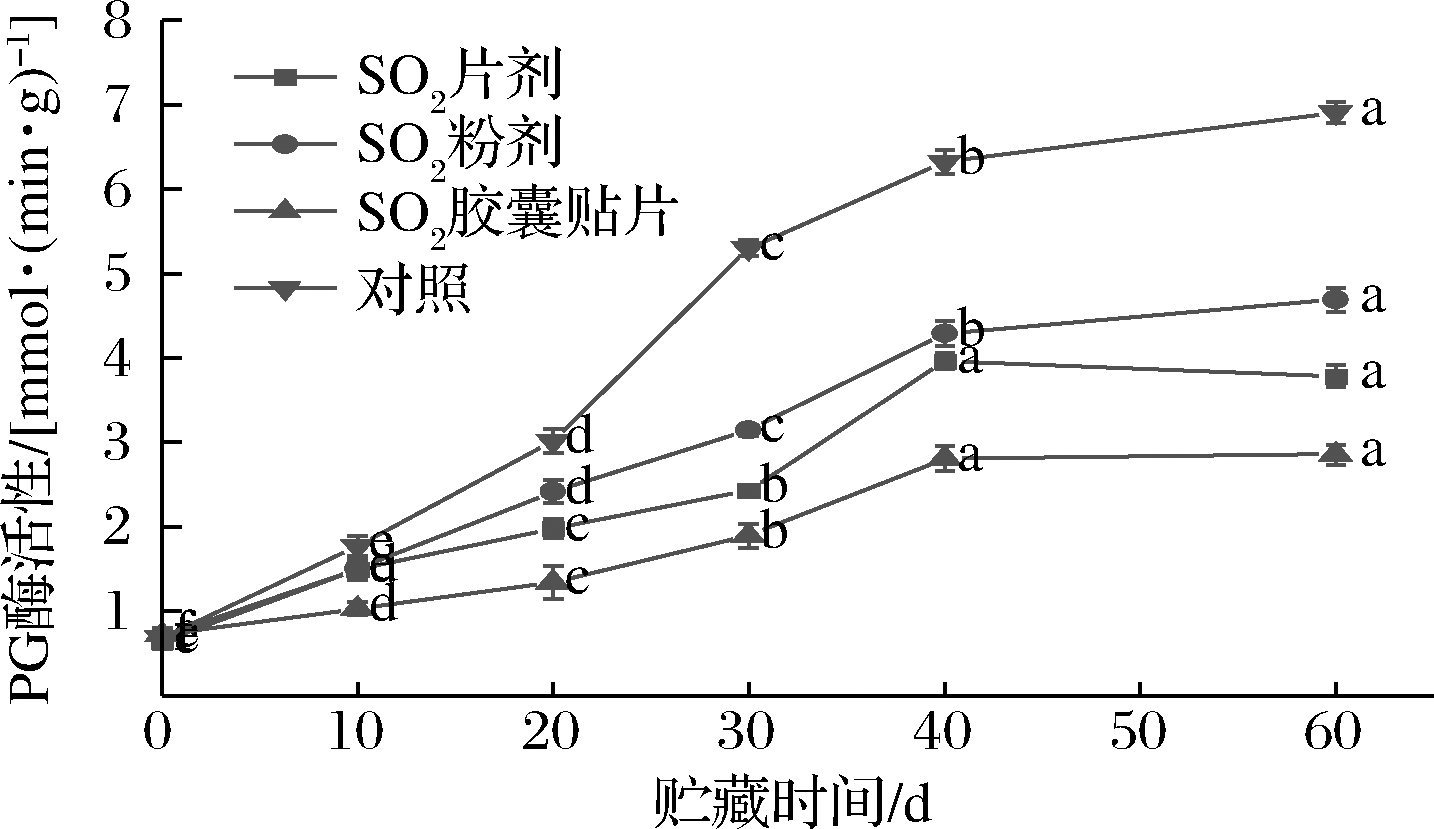
图5 不同形式SO2保鲜剂处理对果实内PG活力的影响
Fig.5 Effect of different forms of SO2 preseratie treatment on PG actiity in fruit
以上结果表明,不同形式SO2保鲜剂处理明显抑制了贮藏期间葡萄果实内PG活力,一定程度上延缓了果实的软化进程,其中SO2胶囊贴片形式处理的葡萄果实,其PG活力最小,其次是SO2片剂。PG是一类重要的细胞壁降解酶,催化多聚半乳糖醛酸形成半乳糖醛酸。SO2保鲜剂释放的SO2抑制PG活力的同时也抑制了PG作用底物的生成,减少了果实中多聚半乳糖醛酸的产生及其进一步的解聚,维持果胶的紧密结构。SO2胶囊贴片稳定释放适宜浓度的SO2,不仅克服了SO2粉剂作用时间短、不能用于果蔬长期贮藏保鲜的问题,也解决了SO2片剂释放的SO2浓度低、不能有效抑制病原菌和降解酶活力的问题,更有效延缓葡萄果实的软化腐烂。
2.3.4 对葡萄果实内β-gal活力的影响
β-gal主要降解果胶多聚醛酸侧链的半乳糖残基,使半乳糖从细胞壁中分解,破坏细胞壁结构。如图6所示,葡萄果实内β-gal活力总体呈先下降后上升趋势,不同形式SO2保鲜剂处理,β-gal活力变化幅度不同。各处理组和对照组果实内β-gal活力在贮藏前40 d内快速下降,其中SO2胶囊贴片组下降速度最快,对照组下降最慢,分别下降了74.14%和35.02%;SO2粉剂和SO2片剂组下降速度基本相同,为57.05%。SO2粉剂、SO2片剂、SO2胶囊贴片组和对照组果实内β-gal活力在贮藏第40天时下降至最小值,在贮藏后期(40~60 d)快速上升,贮藏第60天时,β-gal活力与贮藏第40天相比,分别上升了44.59%、45.00%、52.68%和40.18%。进一步比较发现,在贮藏期内的同一时间点,不同形式SO2保鲜剂处理的葡萄果实内β-gal活力都低于对照组,顺序依次为:对照>SO2粉剂>SO2片剂>SO2胶囊贴片。
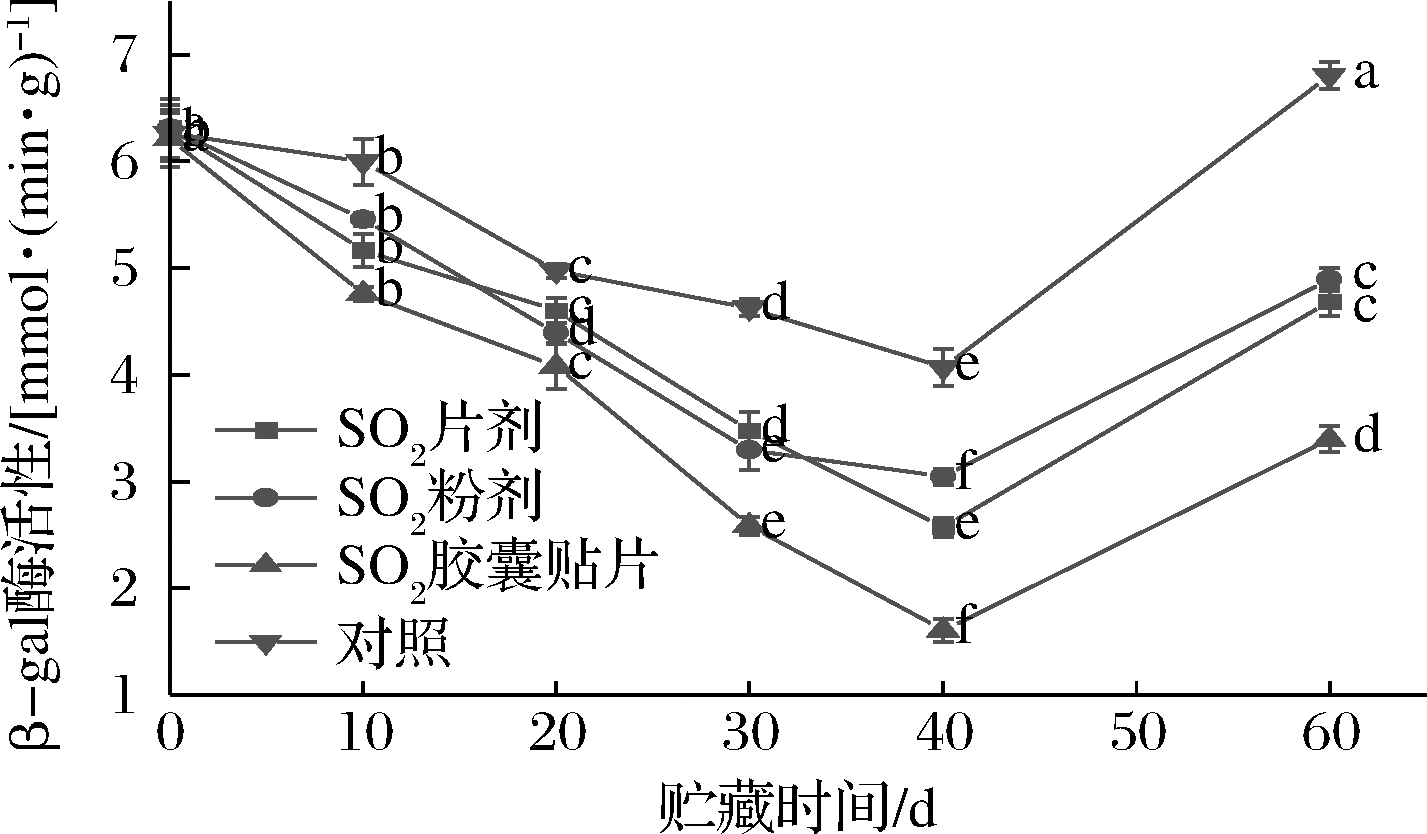
图6 不同形式SO2保鲜剂处理对果实内β-gal活力的影响
Fig.6 Effect of different forms of SO2 preseratie on β-gal actiity in fruit
以上结果表明,不同形式SO2保鲜剂处理明显抑制了贮藏期间葡萄果实内β-gal活力,一定程度上延缓了葡萄的软化进程,其中SO2胶囊贴片形式处理的葡萄果实,其β-gal活力最小,其次是SO2片剂。SO2保鲜剂释放的SO2通过抑制降解果胶聚合体的β-gal活力,维持细胞壁的完整性,防止其他降解酶对果实的水解作用。SO2胶囊贴片是优于SO2片剂和SO2粉剂的良好保鲜剂,结合不同形式SO2保鲜剂的特点分析,说明β-gal与其他果胶酶或纤维素酶相似,SO2两段式释放对其有更好的抑制作用,且SO2释放周期越长,抑制效果越好,果胶中半乳糖残基的降解越少,进而果实软化的速度越缓慢。
2.4 贮藏期间‘阳光玫瑰’葡萄硬度、细胞壁组分含量及其降解酶活力之间的相关性分析
由表1可知,在贮藏期间,‘阳光玫瑰’葡萄果实硬度与细胞壁组分含量及其降解酶活力之间有一定的相关性。硬度与原果胶含量呈极显著正相关(P<0.01,r=0.959),与可溶性果胶含量呈极显著负相关(P<0.01,r=-0.877);硬度与Cx活力呈极显著负相关(P<0.01,r=-0.925),与PG活力呈极显著负相关(P<0.01,r=-0.799),与PME活力也呈极显著负相关(P<0.01,r=-0.929),与β-gal活力无相关性(P>0.05),说明Cx、PG和PME对‘阳光玫瑰’葡萄硬度品质的贡献大于β-gal,Cx、PG和PME协同作用于细胞壁,细胞壁中原果胶不溶于水,其在细胞壁中的含量与果实硬度密切相关,含量越多,果实硬度越高。随着贮藏时间的延长,细胞壁降解酶将原果胶降解为可溶性果胶,由于其黏合能力差,细胞间的支持作用变弱,导致果实硬度下降。
表1 葡萄果实软化指标的相关系数矩阵
Table 1 Correlation coefficient matrix of grape fruit softening index

指标硬度原果胶质量分数可溶性果胶质量分数Cx活力PG活力PME活力β-gal活力硬度1原果胶含量 0.959∗∗1可溶性果胶含量-0.877∗∗-0.936∗∗1Cx活力-0.925∗∗-0.963∗∗ 0.906∗∗1PG活力-0.799∗∗-0.884∗∗ 0.857∗∗ 0.906∗∗1PME活力-0.929∗∗-0.970∗∗ 0.941∗∗ 0.976∗∗ 0.911∗∗1β-gal活力 0.321 0.232-0.175 -0.328 -0.261 -0.2191
注:**表示极显著,P<0.01
由表1还可知,在贮藏期间,‘阳光玫瑰’葡萄果实细胞壁组分含量与其降解酶活力之间有密切的相关性,果实内原果胶含量与Cx活力呈极显著负相关(P<0.01,r=-0.963),与PG活力呈极显著负相关(P<0.01,r=-0.884),与PME活力也呈极显著负相关(P<0.01,r=-0.970);可溶性果胶含量与Cx活力呈极显著正相关(P<0.01,r=0.906),与PG活力呈极显著正相关(P<0.01,r=0.857),与PME活力也呈极显著正相关(P<0.01,r=0.941),说明在贮藏期间‘阳光玫瑰’葡萄果实内细胞壁降解酶与果胶物质相互关联,其中PME可以催化原果胶形成果胶酸,增加原果胶在水中的溶解度。PG活力增加有助于可溶性果胶的积累,加速细胞解体,促进果实软化腐烂,与李圆圆等[5]对猕猴桃果实内细胞壁降解酶活力的研究结果相似。SO2保鲜剂释放的SO2是通过抑制Cx、PG和PME等细胞壁降解酶的活力来减缓原果胶向水溶性果胶的转换,抑制果胶的水解速度,较好地保持细胞壁的完整性,从而延缓果实软化。
3 讨论
3.1 不同形式SO2保鲜剂处理对果实硬度与细胞壁组分含量的影响
细胞壁是支撑细胞形态的主要物质,其结构、组分及其含量变化是研究果实软化的重要因素,细胞壁结构破坏和细胞壁物质降解是果实软化的重要原因。贮藏初期,葡萄果实硬度高,果胶物质主要是原果胶。随着贮藏时间的延长,细胞壁中胶层明显解体,原果胶含量下降,导致硬度下降。本研究中硬度和原果胶含量随贮藏时间的延长而下降,可溶性果胶含量逐渐升高,与ELLA等[18]对杏的研究结果相似。原果胶降解,细胞壁支撑作用变弱甚至消失,细胞变形,组织结构松散,果实硬度下降。与对照组相比,SO2保鲜剂处理的葡萄果实内,原果胶转化为可溶性果胶的量减少,硬度下降速度减慢,与王世军[19]对葡萄保鲜中SO2抑制腐烂的研究结果相似。相关性分析表明,果实硬度与原果胶含量呈极显著正相关(P<0.01,r=0.959),与可溶性果胶含量呈极显著负相关(P<0.01,r=-0.877),细胞壁组分与硬度关系密切,细胞壁的完整性直接决定果实的硬度。
不同形式SO2保鲜剂的使用对葡萄贮藏期间的硬度、细胞壁组分含量的影响不尽相同。与SO2粉剂和SO2片剂处理组相比,SO2胶囊贴片处理的葡萄果实能保持较高的硬度和原果胶含量。因此,‘阳光玫瑰’葡萄采后使用SO2胶囊贴片处理能更好地保持其细胞壁结构的完整性,延缓果实硬度的下降,提高耐贮性。
3.2 不同形式SO2保鲜剂处理对果实细胞壁组分含量与细胞壁降解酶活力的影响
果实软化主要由于细胞壁降解酶降解了细胞壁多糖,导致细胞之间联结减少,细胞壁结构离散。KLEIN等[20]通过对鳄梨及苹果中酶活性及细胞壁结构的研究发现,PG造成了细胞壁中胶层溶解,进而导致细胞聚合力消失。PME作用是PG作用的必要前提,PME水解果胶分子中甲酯化的羧基,生成多聚半乳糖醛酸,进而PG将其催化为半乳糖醛酸[6-7],导致原果胶解体。果实软化也与降解细胞壁多糖的糖苷酶有关,这些糖苷酶可降解带有支链的多聚糖醛酸,进而导致细胞壁降解。
葡萄果实内PG和PME活力随贮藏时间的延长而先上升后缓慢下降,PME活力高峰出现的时间比PG早。SO2保鲜剂处理的果实内降解酶活力始终低于同一贮藏时间的对照组,这与罗岩等[21]对杏的研究结果相似。SO2保鲜剂释放的SO2抑制了PG作用底物生成的同时又抑制PG活力,导致原果胶的水解受到抑制。Cx活力的上升速度随贮藏时间的延长而先快后慢,催化纤维素解聚为低分子糖类;β-gal活力在贮藏期间呈先下降后上升趋势,主要降解果胶多聚醛酸侧链的半乳糖残基,使细胞壁结构不稳定。林艺芬等[22]对龙眼的软化研究中发现,SO2通过抑制细胞壁降解酶活力来抑制细胞壁的解体,保持细胞壁的完整结构,达到延缓软化的目的。相关性分析表明,葡萄果实内果胶含量与Cx、PME和PG活力均呈极显著相关(P<0.01),与β-gal呈无显著相关(P>0.05),说明PG、PME和Cx对‘阳光玫瑰’葡萄果实软化的贡献大于β-gal,β-gal不是引起葡萄软化的主要酶,与张群[23]对‘红地球’葡萄的研究结果一致。
在葡萄贮藏过程中,不同形式SO2保鲜剂的使用对细胞壁组分的降解以及酶活力的影响不尽相同。与SO2粉剂和SO2片剂处理组相比,SO2胶囊贴片处理的葡萄果实,其Cx、PG、PME和β-gal活力在贮藏期间保持较低,从而减少了果实中原果胶及其他细胞壁成分的降解,较好地维持了细胞壁结构。因此,‘阳光玫瑰’葡萄采后使用SO2胶囊贴片处理能更有效抑制细胞壁降解酶活力,延缓果实的软化腐烂进程。
4 结论
不同形式SO2保鲜剂中,SO2胶囊贴片形式的保鲜剂对葡萄贮藏保鲜的效果最好,其果实硬度下降最慢,细胞壁相关降解酶活力变化最小,软化进程最缓慢,在蓝莓[17]和小白菜[24]等果蔬的研究中也有相似的结果。SO2胶囊贴片是将焦亚硫酸钠活性物质与胶囊基材结合,避免了环境因素对活性物质的干扰,焦亚硫酸钠分解的SO2以合适的速率稳定释放到外界环境中,使SO2在体系内维持一定有效浓度;贮藏前期高浓度SO2短时高效杀死携带菌,中后期低浓度SO2抑制果实内酶活力,其作用效果强、稳定性高,保证了葡萄优良的硬度品质[8,14]。另外,佟继旭[25]研究发现,SO2胶囊贴片技术大大降低了葡萄在贮藏期间SO2的残留量。综上所述,为延长‘阳光玫瑰’葡萄的贮藏保鲜时间,防止在贮藏、销售期间果实硬度下降太快,且提高其食用安全性,宜使用SO2胶囊贴片作为保鲜剂。
[1] 李明. 阳光玫瑰葡萄的引种表现和优质栽培技术[J].中国南方果树, 2021, 50(3):163-166.
LI M.Introduction performance and high quality cultiation techniques of sunshine rose grape[J].South China Fruits, 2021, 50(3):163-166.
[2] 张晓锋, 娄玉穗, 尚泓泉, 等.不同保鲜处理对“阳光玫瑰”葡萄贮藏品质及生理生化的影响[J].河南农业大学学报, 2019, 53(5):698-703.
ZHANG X F, LOU Y S, SHANG H Q, et al.Effects of different preseraties treatments on storage quality and physiological-biochemical index of Shine Muscat grape[J].Journal of Henan Agricultural Uniersity, 2019, 53(5):698-703.
[3] XUE M Z, YI H L.Induction of disease resistance proiding new insight into sulfur dioxide preseration in itis inifera L[J].Scientia Horticulturae, 2017, 225:567-573.
[4] DUARTE-SIERRA A, AISPURO-HERN NDEZ E, ARGAS-ARISPURO I, et al.Quality and PR gene expression of table grapes treated with ozone and sulfur dioxide to control fungal decay[J].Journal of the Science of Food and Agriculture, 2016, 96(6):2 018-2 024.
NDEZ E, ARGAS-ARISPURO I, et al.Quality and PR gene expression of table grapes treated with ozone and sulfur dioxide to control fungal decay[J].Journal of the Science of Food and Agriculture, 2016, 96(6):2 018-2 024.
[5] 李圆圆, 罗安伟, 李琳, 等.采前氯吡脲处理对‘秦美’猕猴桃贮藏期间果实硬度及细胞壁降解的影响[J].食品科学, 2018, 39(21):273-278.
LI Y Y, LUO A W, LI L, et al.Effect of preharest 1-(2-chloropyridin-4-yl)-3-phenylurea treatment on fruit firmness and cell wall degradation of ‘Qinmei’ kiwifruit during cold storage[J].Food Science, 2018, 39(21):273-278.
[6] 张玉丽, 郭芹, 彭新媛, 等.双组份SO2-ClO2保鲜剂对红提葡萄采后软化相关酶的影响[J].食品工业科技, 2014, 35(6):307-312.
ZHANG Y L, GUO Q, PENG X Y, et al.Bi-component SO2-ClO2 preseratie to softening related enzymes of Red Globe grape[J].Science and Technology of Food Industry, 2014, 35(6):307-312.
[7] 刘丽青, 王燕楠, 仪慧兰, 等.二氧化硫对玫瑰香葡萄果实采后保鲜的机理[J].应用与环境生物学报, 2016, 22(2):338-341.
LIU L Q, WANG Y N, YI H L, et al.The mechanism of SO2 presering Muscat Hamburg table grapes[J].Chinese Journal of Applied and Enironmental Biology, 2016, 22(2):338-341.
[8] 田静. SO2在葡萄保鲜中的抑菌作用及果皮色素抗氧化功能评价[D].太原:山西大学, 2018.
TIAN J.The antibacterial action of SO2 in grape preseration and ealuation of antioxidant function of peel pigment[D].Taiyuan:Shanxi Uniersity, 2018.
[9] 佟继旭, 朱志强, 赵瑞瑞, 等.不同SO2保鲜剂对红地球葡萄采后贮藏品质的影响[J].农产品质量与安全, 2019(1):19-23.
TONG J X, ZHU Z Q, ZHAO R R, et al.Influence of different SO2 preseraties on post-harest quality of red-global grapes[J].Quality and Safety of Agro-Products, 2019(1):19-23.
[10] 罗斌, 赵有斌, 尹学清, 等.质构仪在果蔬品质评定中应用的研究进展[J].食品研究与开发, 2019, 40(5):209-213.
LUO B, ZHAO Y B, YIN X Q, et al.Application progress of texture analyzer in the research of fruit and egetable quality ealuation[J].Food Research and Deelopment, 2019, 40(5):209-213.
[11] 曹建康, 姜微波, 赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社, 2007.
CAO J K, JIANG W B, ZHAO Y M.Physiological and Biochemical Experiments of Postharest Fruits and egetables[M].Beijing:China Light Industry Press, 2007.
[12] GE Y H, DUAN B, LI C Y, et al.Application of sodium silicate retards apple softening by suppressing the actiity of enzymes related to cell wall degradation[J].Journal of the Science of Food and Agriculture, 2019, 99(4):1 828-1 833.
[13] KLUCK R M, BOSSY-WETZEL E, GREEN D R, et al.The release of cytochromec from mitochondria:A primary site for Bcl-2 regulation of apoptosis[J].Science, 1997, 275(5 303):1 132-1 136.
[14] 董路路, 任春涛, 张新华, 等.缓释技术及其在果蔬保鲜中的应用研究进展[J].山东理工大学学报(自然科学版), 2020, 34(4):73-78.
DONG L L, REN C T, ZHANG X H, et al.Research progress of slow-release technology and its application in fruits and egetables preseration[J].Journal of Shandong Uniersity of Technology (Natural Science Edition), 2020, 34(4):73-78.
[15] WANG D D, YEATS T H, ULUISIK S, et al.Fruit softening:Reisiting the role of pectin[J].Trends in Plant Science, 2018, 23(4):302-310.
[16] 李欢. 枣果实成熟软化的细胞壁物质代谢及其基因表达研究[D].杨凌:西北农林科技大学, 2017.
LI H.The metabolism of cell wall materials and gene expression during fruit ripening and softening in Ziziphus jujuba Mill[D].Yangling:Northwest A & F Uniersity, 2017.
[17] 陈守江, 王海鸥, 扶庆权, 等.不同剂量SO2缓释剂对蓝莓果实抑菌、漂白及残留量的影响[J].江苏农业科学, 2018, 46(14):174-177.
CHEN S J, WANG H O, FU Q Q, et al.Influences of sulfur dioxide slow release preseratie on anti-fungi, bleaching and residues in blueberry fruits[J].Jiangsu Agricultural Sciences, 2018, 46(14):174-177.
[18] ELLA MISSANG C, MAINGONNAT J F, RENARD C M G C, et al.Apricot cell wall composition:Relation with the intra-fruit texture heterogeneity and impact of cooking[J].Food Chemistry, 2012, 133(1):45-54.
[19] 王世军. 二氧化硫类防腐杀菌剂在葡萄保鲜中的应用[J].保鲜与加工, 2015, 15(2):1-6.
WANG S J.Application of sulfur dioxide fungicides in the preseration of grape[J].Storage and Process, 2015, 15(2):1-6.
[20] KLEIN J D, HANZON J, IRWIN P L, et al.Pectin esterase actiity and pectin methyl esterification in heated golden delicious apples[J].Phytochemistry, 1995, 39(3):491-494.
[21] 罗岩, 李蓓.1-MCP结合低温贮藏对杏果实采后软化及相关酶活的影响[J].保鲜与加工, 2018, 18(3):43-48.
LUO Y, LI B.Effects of 1-MCP combined with low temperature storage on postharest softening and related enzyme actiity of apricot fruits[J].Storage and Process, 2018, 18(3):43-48.
[22] 林艺芬, 林毅雄, 林河通, 等.‘东壁’和‘福眼’龙眼果实果皮褐变差异的生理机制[J].食品科学, 2016, 37(20):221-227.
LIN Y F, LIN Y X, LIN H T, et al.Physiological mechanism of the difference in pericarp browning of harested fruit between longan cultiars ‘Dongbi’ and ‘Fuyan’[J].Food Science, 2016, 37(20):221-227.
[23] 张群. 欧亚种提子类葡萄贮藏期间果实能量亏损与品质劣变机理研究[D].长沙:中南林业科技大学, 2018.
ZHANG Q.Study on mechanism of energy loss on quality deterioration of itis inifera L.grape fruit during storage[D].Changsha:Central South Uniersity of Forestry & Technology, 2018.
[24] 王晓, 陈冰洁, 刘晨霞, 等.ClO2缓释熏蒸处理对小白菜保鲜效果的影响[J].江苏农业科学, 2021, 49(6):160-163.
WANG X, CHEN B J, LIU C X, et al.Influences of chlorine dioxide slow-release fumigation on preseration of Chinese cabbage[J].Jiangsu Agricultural Sciences, 2021, 49(6):160-163.
[25] 佟继旭. 二氧化硫防腐保鲜处理对红地球葡萄品质影响及风险评估的研究[D].北京:中国农业科学院, 2018.
TONG J X.Study on the effect of SO2 preseratie treatment on the quality and risk assessment of Red Globe grape[D].Beijing:Chinese Academy of Agricultural Sciences, 2018.