目前在植物病害的防治中,化学防治仍处于主要地位,但长期使用化学农药不仅会造成环境污染、土壤结构破坏、抗药性病害菌增多等后果,也会对人畜的健康造成危害[1]。生物防治具有成本低、见效快、环保健康、不易产生耐药菌等优点[2],是目前替代化学防治或减少化学农药用量的有效手段。研究者已经从土壤、种子等材料中开发出多种生防菌[3],并将其应用于人参[4]、槟榔芋[5]、马铃薯[6]等多种植物病害的防治,同时,在食品防腐[7]等领域亦有应用。这些生防菌主要有芽孢杆菌、链霉菌、枯草杆菌、侧单胞菌等。研究报道显示,虽然已经有大量的生防菌被开发,但由于菌株的筛选多处于实验室环境,导致在应用中仍存在菌株不稳定、抑菌活性弱等不足,因此开发新型、优良的菌株,已成为生防菌研究亟需解决的问题。溶杆菌是一类新兴的生防菌,对多种微生物如真菌、卵菌、革兰氏阳性菌、革兰氏阴性菌等均具有很高的拮抗作用,应用前景广泛[8]。
产酶溶杆菌属于溶杆菌属,是极具生防潜力的一类菌株,主要通过分泌多种胞外酶与小分子次生代谢物起生物防治作用,包括蛋白酶、磷酸酶、几丁质酶、纤维素酶、β-1,3-葡聚糖酶、热稳定性抗真菌因子(heat-stable antifungal factor, HSAF)、脂肽类化合物等。产酶溶杆菌分泌的α-蛋白酶可以降解线虫体壁的蛋白质[9];磷酸酶能够有效降解病原菌胞膜中的磷脂,导致菌体细胞破灭[10-11];几丁质酶可以降解病原微生物细胞壁中的几丁质而发挥作用[12];纤维素酶能够作用于卵菌的细胞壁,破坏卵菌的结构;β-1,3-葡聚糖酶作用于病原真菌细胞壁,抑制菌体的生长[13]。多种酶类协同作用,加强了产酶溶杆菌的拮抗作用。HSAF是一类大环内酰胺类化合物,对丝状真菌与卵菌有很强的抑制作用。此外,HSAF热稳定性高,可以靶向作用于丝状真菌鞘脂的生物合成[14-15],且对植物与哺乳类动物不产生危害。目前报道的脂肽类化合物WAP-8294有WAP-8294A1、WAP-8294A2、WAP-8294A3几种结构,其对革兰氏阳性菌具有较强的拮抗作用,但热稳定性不高[16]。KATO等[17]对WAP-8294A2进行了临床试验,将其作用于由耐甲氧西林金黄色葡萄球菌引起的小鼠系统性感染,发现其药效是万古霉素的14倍。此外,产酶溶杆菌产生的表面活性物质[18],也可以防治植物病害。
产酶溶杆菌分泌的多种酶类与次生代谢物相互协同作用,使产酶溶杆菌具有广谱的抑菌性,在食品、农业与医学等方面具有广泛的应用价值。本课题组前期从土壤中分离并鉴定出1株产酶溶杆菌L-43,经研究发现其代谢物对革兰氏阳性菌和部分真菌均具有很强的抑制性,对其抑菌物质进行鉴定发现其为小分子肽类化合物,且与WAP-8294不同,其热稳定性较好,具有研究应用价值,有望开发为生物防菌剂。前期研究发现,仅用常规的牛肉膏蛋白胨培养基进行菌株培养时,菌株并不能有效合成抗菌肽,抑菌活性低,因此,寻求抗菌肽高效合成且成本低廉的培养基十分必要,这也是实现规模生产的基础。
目前,国内外对溶杆菌属的发酵优化研究还较少。2008年,王云霞等[19]采用单因素与正交试验对产酶溶杆菌OH11的摇瓶发酵条件进行了优化,优化后培养基中活菌数明显高于原基础培养基中的活菌数。2011年,田囡[20]对产酶溶杆菌OH11产HSAF的培养基进行了优化,优化后的HSAF产量比优化前提高了25%~30%。2012年,李宁等[21]利用响应面法对溶杆菌UCo1产溶菌酶的培养基进行了优化,将溶菌酶活力提高了11.93%。2015年,应晨等[22]在LB液体培养基的基础上,采用正交试验对产酶溶杆菌R-2-1的发酵培养基与发酵条件进行了优化,优化后培养基中的活菌数与发酵代谢物产量得到了有效提高。2018年,TANG等[23]对产酶溶杆菌OH11发酵HSAF的培养基进行了优化,以价格低廉的大豆粉、葡萄糖、CaCl2作为营养成分,HSAF的合成量提高了近12倍。本研究以实验室分离获得的产酶溶杆菌L-43作为实验菌株,利用价格低廉的碳源、氮源与无机盐对产酶溶杆菌合成抗菌肽的发酵培养基进行了优化,降低了发酵成本,并在此基础上,对发酵时间等6个发酵条件进一步优化,以期为产酶溶杆菌L-43抗菌肽的规模化发酵生产,以及抗菌肽的性质、合成途径与应用等研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 供试菌株
产酶溶杆菌(Lysobacter enzymogenes)L-43由本实验室前期从土壤中分离并保藏。抑菌性测定指示菌:金黄色葡萄球菌(Staphyloccocus aureus)ATCC 25923,由河北科技大学酶工程实验室保藏。
1.1.2 培养基
牛肉膏蛋白胨培养基(NB,g/L):蛋白胨10.0、牛肉膏3.0、NaCl 5.0;牛肉膏蛋白胨琼脂培养基(NA,g/L):蛋白胨10.0、牛肉膏3.0、NaCl 5.0、琼脂18.0,pH 7.2~7.4,上述培养基均于121 ℃高压灭菌20 min。
1.2 实验方法
1.2.1 L.enzymogenes L-43生长曲线测定
将L.enzymogenes L-43接种至NB培养基中,37 ℃,200 r/min振荡培养,于0、2、4、6、8、10、12、14、16、18、20、24 h时取样并用生理盐水进行适当稀释后,涂布于NA固体培养基上,37 ℃倒置培养24 h进行菌落计数。
1.2.2 L.enzymogenes L-43种子液制备
将L.enzymogenes L-43接种至NB培养基中,37 ℃,200 r/min条件下培养24 h后,以2.0%(体积分数)接种量接种至NB培养基中,37 ℃,200 r/min培养10 h至二代对数生长期。将二代种子液以2.0%(体积分数)接种量接种至发酵培养基进行摇瓶发酵。
1.2.3 抗菌肽效价测定
选用牛津杯琼脂扩散法测定效价。选用金黄色葡萄球菌为指示菌,参照张凤娇[24]的方法进行发酵上清液效价测定。
1.2.4 培养基的碳源优化
向NB培养基中,分别添加10.0 g/L的葡萄糖、果糖、麦芽糖、蔗糖、乳糖、糊精、壳聚糖、甘露醇、可溶性淀粉和液糖,以NB培养基为对照,筛选出最优碳源。分别向NB培养基中添加5.0、10.0、15.0、20.0、25.0、30.0、40.0、50.0 g/L的最优碳源,优化碳源添加量。
1.2.5 培养基的氮源优化
以10.0 g/L麦芽糖为碳源,5.0 g/L NaCl为无机盐,分别以10.0 g/L的牛肉膏、蛋白胨、酪蛋白胨、胰蛋白胨、酵母膏、酵母浸粉、NH4Cl、NH4NO3、(NH4)2SO4、玉米浆粉、鱼蛋白胨和尿素作为氮源,以不添加氮源的培养基作为对照,筛选最优氮源。分别向培养基中添加5.0、10.0、15.0、20.0、25.0、30.0、40.0 g/L的最优氮源,优化其添加量。
1.2.6 培养基无机盐优化
以10.0 g/L麦芽糖作为碳源、10.0 g/L胰蛋白胨作为氮源,分别以1.0 g/L的NaCl、MgSO4、K2HPO4、CaCl2、FeCl3、Fe2(SO4)3、ZnSO4、CuSO4和MnSO4作为无机盐,以不添加无机盐的培养基作为对照,筛选出最优无机盐。设置最优无机盐添加量为0.5、1.0、1.5、2.0、3.0、4.0、5.0 g/L,进一步优化无机盐添加量。
1.2.7 培养基表面活性剂优化
以10.0 g/L麦芽糖为碳源,10.0 g/L胰蛋白胨为氮源,1.0 g/L MgSO4为无机盐,分别添加0.5%(体积分数)的吐温-80和吐温-20作为表面活性剂,以不添加表面活性剂的培养基作为对照,筛选出最优表面活性剂。设置最优表面活性剂添加量(体积分数)为0.1%、0.5%、1.0%、1.5%和2.0%,优化表面活性剂添加量。
1.2.8 发酵培养基的正交试验
以1.2.4~1.2.7筛选出的最佳碳源(麦芽糖)、氮源(胰蛋白胨)、无机盐(MgSO4)为因素,分别设置3个水平,采用L9(33)正交试验,因素与水平如表1所示,进行摇瓶发酵,筛选出最优发酵培养基组合。
表1 发酵培养基成分正交试验因素与水平
Table 1 Factors and leels of orthogonal experiment of fermentation medium
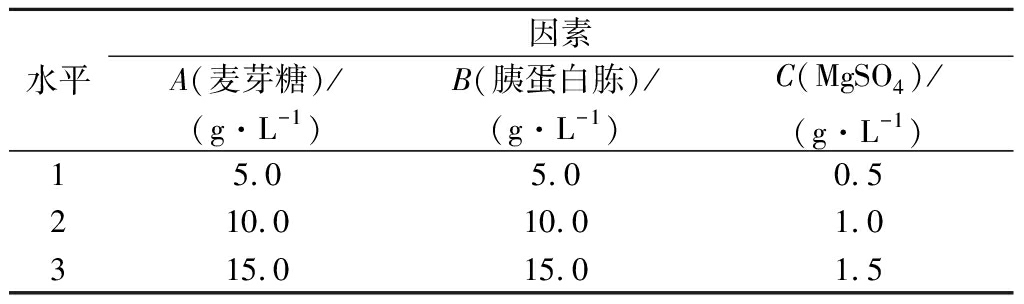
水平因素A(麦芽糖)/(g·L-1)B(胰蛋白胨)/(g·L-1)C(MgSO4)/(g·L-1)15.05.00.5210.010.01.0315.015.01.5
1.2.9 发酵培养基初始pH优化
其他条件不变,调整发酵培养基初始pH为6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5和10.0,进行摇瓶发酵,测定其效价,筛选出最佳初始pH。
1.2.10 发酵温度优化
其他条件不变,分别设置发酵温度为28、30、32、34、36 ℃,进行摇瓶发酵,测定其效价,筛选出最佳发酵温度。
1.2.11 发酵时间优化
其他条件不变,分别测定发酵液16、20、22、24、30、36、48、60、72 h时的效价,确定最佳发酵时间。
1.2.12 接种量优化
其他条件不变,分别设置种子液接种量为(体积分数):1.0%、2.0%、3.0%、4.0%、5.0%和6.0%,进行摇瓶发酵,测定其效价,确定最佳接种量。
1.2.13 发酵溶氧量优化
其他条件不变,分别设定摇床转速为180、200、220、240、260 r/min进行摇瓶发酵,测定其效价,确定最佳摇瓶发酵转速;分别设定250 mL三角瓶中,装液量为30、40、50、60、70、80 mL,进行摇瓶发酵,测定其效价,确定最佳装液量。
1.2.14 发酵条件的正交试验
以1.2.9~1.2.13筛选出的初始pH、装液量、接种量与发酵时间为因素,分别设置4个水平,进行L16(44)的正交试验,水平与因素如表2所示,进行摇瓶发酵,筛选出最优发酵条件组合。
表2 发酵条件正交试验因素与水平
Table 2 Factors and leels of orthogonal experiment of fermentation conditions
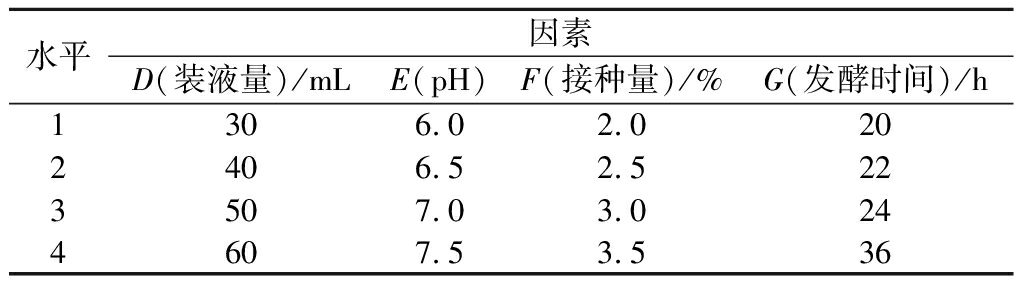
水平因素D(装液量)/mLE(pH)F(接种量)/%G(发酵时间)/h1306.02.0202406.52.5223507.03.0244607.53.536
2 结果与分析
2.1 L.enzymogenes L-43生长曲线
根据L.enzymogenes L-43在24 h内的菌体生长情况,绘制其生长曲线(如图1所示)。L.enzymogenes L-43在NB培养基中生长的迟缓期在0~4 h内,对数生长期在4~12 h内,稳定期在12~24 h内。
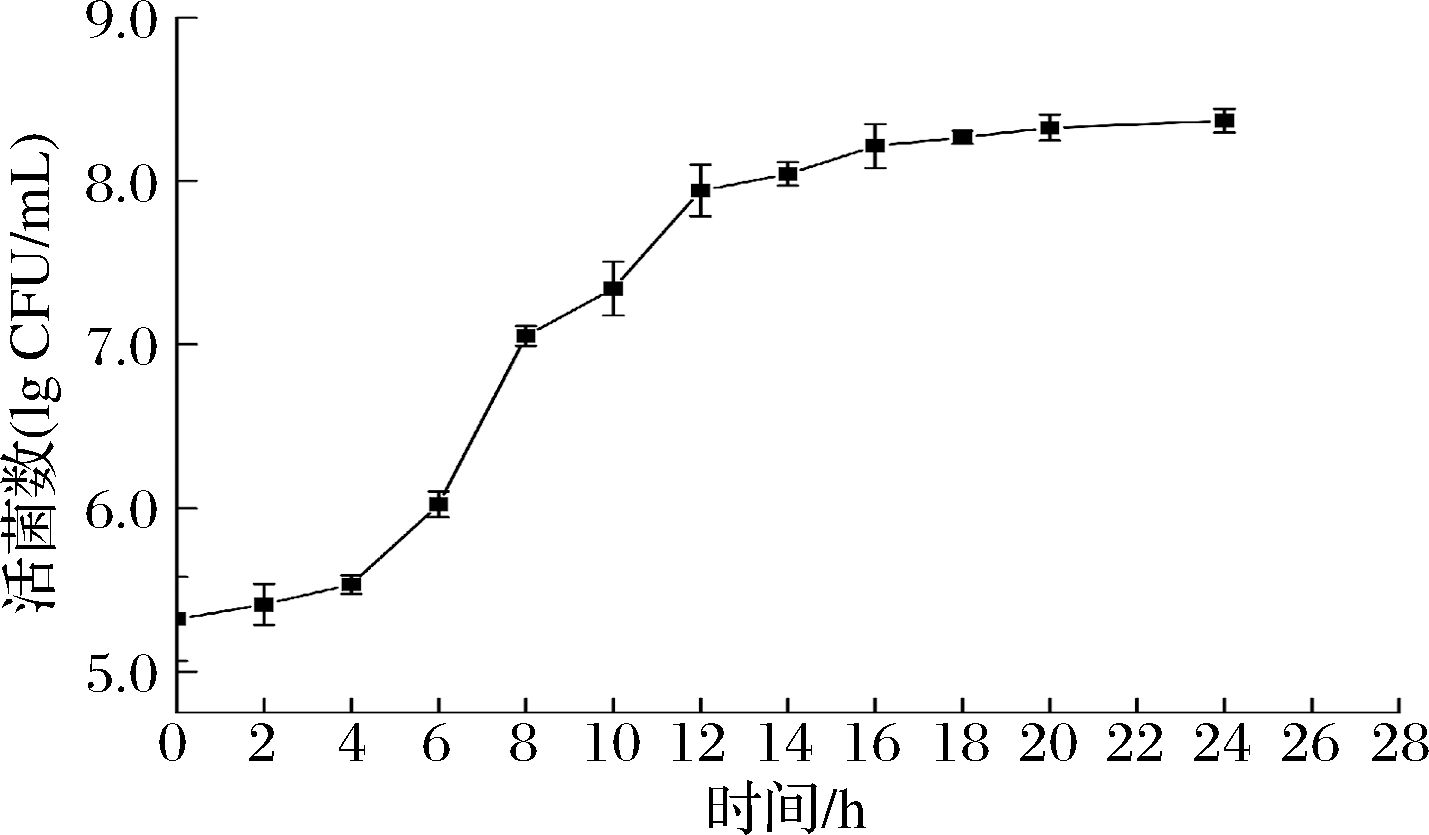
图1 L.enzymogenes L-43的生长曲线
Fig.1 The growth cure of L.enzymogenes L-43
2.2 培养基碳源优化
对于一切异源微生物,碳源又兼做能源,是菌体生长存活必不可少的营养物质之一,不同的碳源会对菌体的生长代谢产生不同的影响。本研究选用10种碳源,探究其对抗菌肽合成的影响,结果如图2所示。
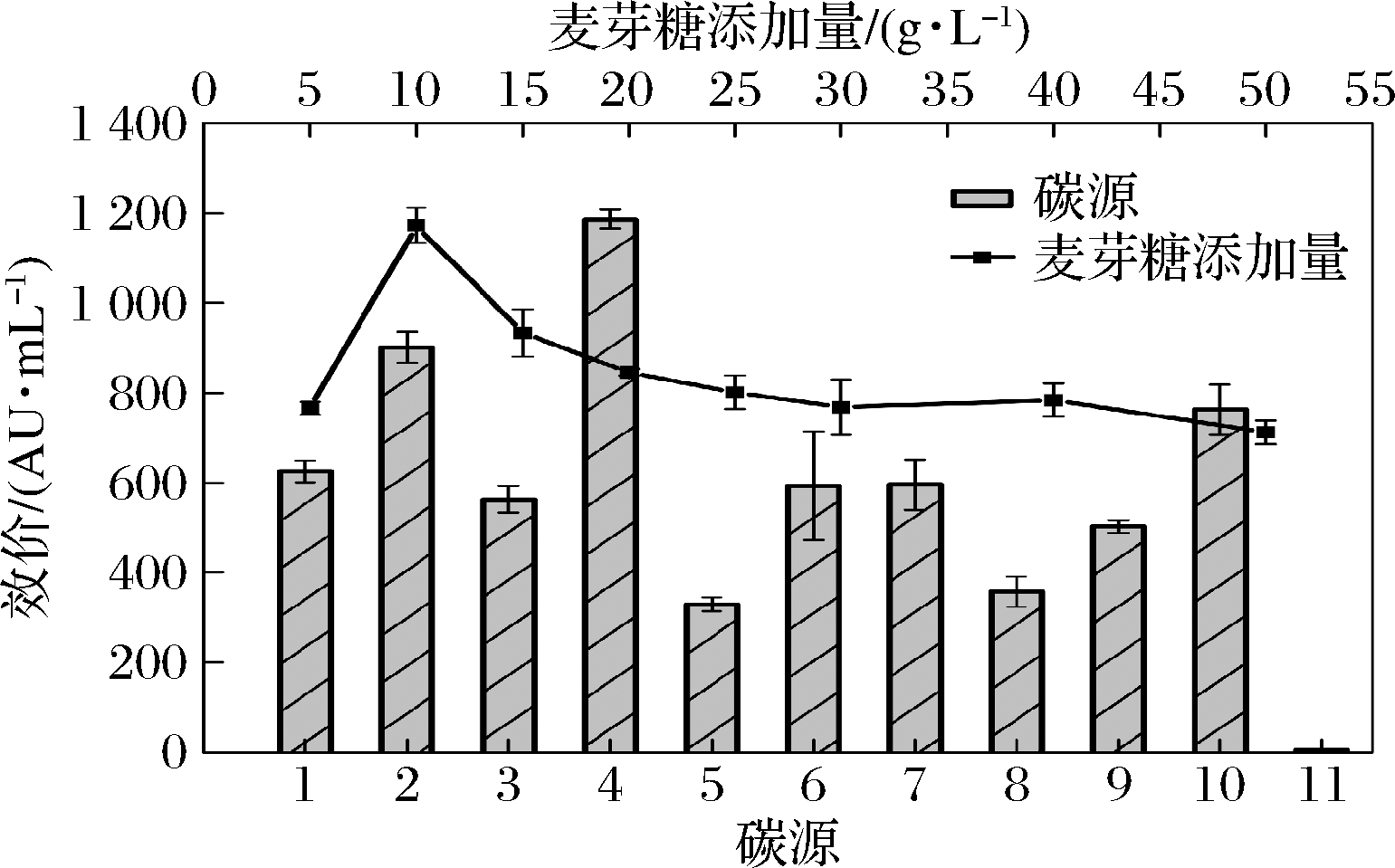
1-空白CK组;2-果糖;3-蔗糖;4-麦芽糖;5-葡萄糖; 6-壳聚糖;7-乳糖;8-淀粉;9-甘露醇;10-液糖;11-糊精
图2 碳源对L.enzymogenes L-43合成抗菌肽的影响
Fig.2 Effect of different carbons on the antimicrobial peptides production by L.enzymogenes L-43
相比于果糖、葡萄糖,麦芽糖更有利于抗菌肽的合成,上清液效价达到了1 185.72 AU/mL,与NB培养基(空白CK组)相比,效价提高了近2倍。可见,以麦芽糖为碳源不仅能明显促进抗菌肽合成,而且成本较低,可以作为工业化生产的碳源参考。
进一步对麦芽糖的添加量进行优化(图2),当添加量为10.0 g/L时,最利于抗菌肽的合成。麦芽糖具有一定黏度,添加量过高可能会导致溶氧量降低从而影响菌体生长。
2.3 培养基氮源优化
对于L.enzymogenes L-43来说,氮源不仅是支持菌体生长繁殖的必需营养物质,更是支持合成代谢物抗菌肽的原料。本研究对9种有机氮源与3种无机氮源进行了筛选,结果如图3所示。当培养基中不添加氮源时,发酵效价仅为44.31 AU/mL,说明氮源是影响抗菌肽合成的重要因素。此外,氮源的种类也影响了抗菌肽的合成。与常见的牛肉膏、蛋白胨相比,胰蛋白胨作为氮源更能促进L.enzymogenes L-43抗菌肽的合成,其发酵液效价达到了2 281.30 AU/mL。
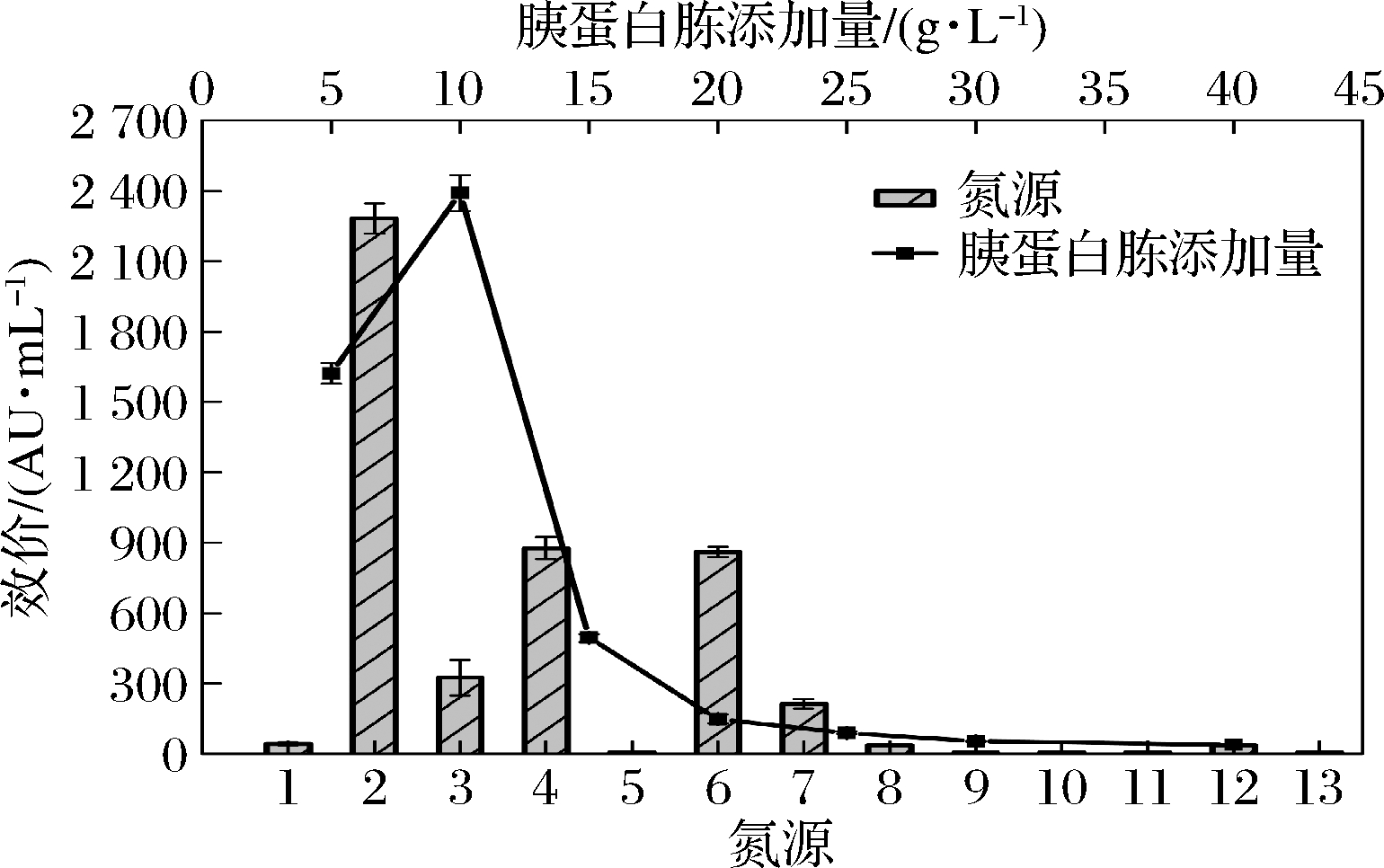
1-空白组;2-胰蛋白胨;3-牛肉膏;4-蛋白胨;5-酪蛋白胨; 6-鱼蛋白胨;7-玉米浸粉;8-酵母膏;9-酵母浸粉;10-NH4Cl; 11-NH4NO3;12-(NH4)2SO4;13-尿素
图3 氮源对L.enzymogenes L-43合成抗菌肽的影响
Fig.3 Effect of different nitrogen on the antimicrobial peptides production by L.enzymogenes L-43
进一步优化胰蛋白胨的添加量(图3)。当添加量为10.0 g/L时,抗菌肽合成量最高,效价达到了2 390.02 AU/mL,而当添加量低于10.0 g/L或高于10.0 g/L时其合成量均呈现降低趋势,这可能与培养基中的碳氮比有关。氮源能够促进菌体的生长繁殖与代谢物的合成,但当氮源比例过高时,菌体生长旺盛,pH也随之升高,并不利于代谢物的积累。
2.4 培养基无机盐优化
L.enzymogenes L-43抗菌肽的合成需要多种酶作用,无机盐与酶的激活等作用息息相关。本研究对9种无机盐进行了筛选,其中包括对酶有激活作用的Cu2+、Mn2+、Zn2+、Mg2+以及调节渗透压的Na+等,结果如图4所示。CaCl2、FeCl3、Fe2(SO4)3对抗菌肽的合成没有明显影响,ZnSO4、MnSO4、CuSO4、K2HPO4抑制抗菌肽的合成,NaCl与MgSO4会促进抗菌肽合成,其中MgSO4对L.enzymogenes L-43合成抗菌肽的促进作用最强,发酵效价达到了3 483.74 AU/mL,与其他无机盐相比,较为突出。
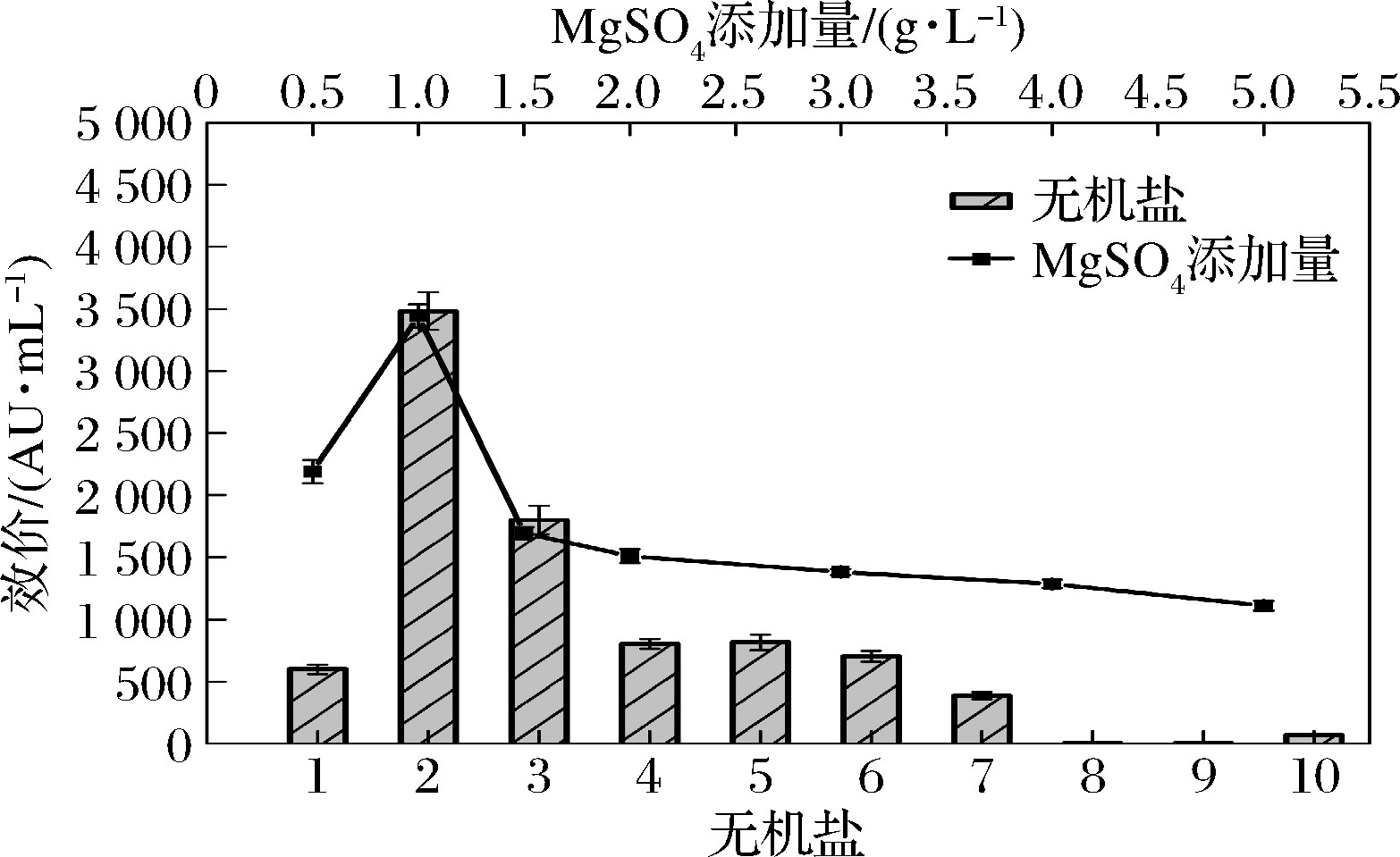
1-空白组;2-MgSO4;3-NaCl;4-CaCl2;5-FeCl3;6-Fe2(SO4)3; 7-ZnSO4;8-K2HPO4;9-MnSO4;10-CuSO4
图4 无机盐对L.enzymogenes L-43合成抗菌肽的影响
Fig.4 Effect of different inorganic salt on the antimicrobial peptides production by L.enzymogenes L-43
进一步对MgSO4添加量进行优化(图4),当添加量为1.0 g/L时能够显著促进抗菌肽的合成。对于菌体来说,MgSO4作为无机盐可以提供与酶活力息息相关的Mg2+,从而促进菌体的代谢。
2.5 培养基表面活性剂优化
表面活性剂对L.enzymogenes L-43抗菌肽合成量的影响结果如图5所示。
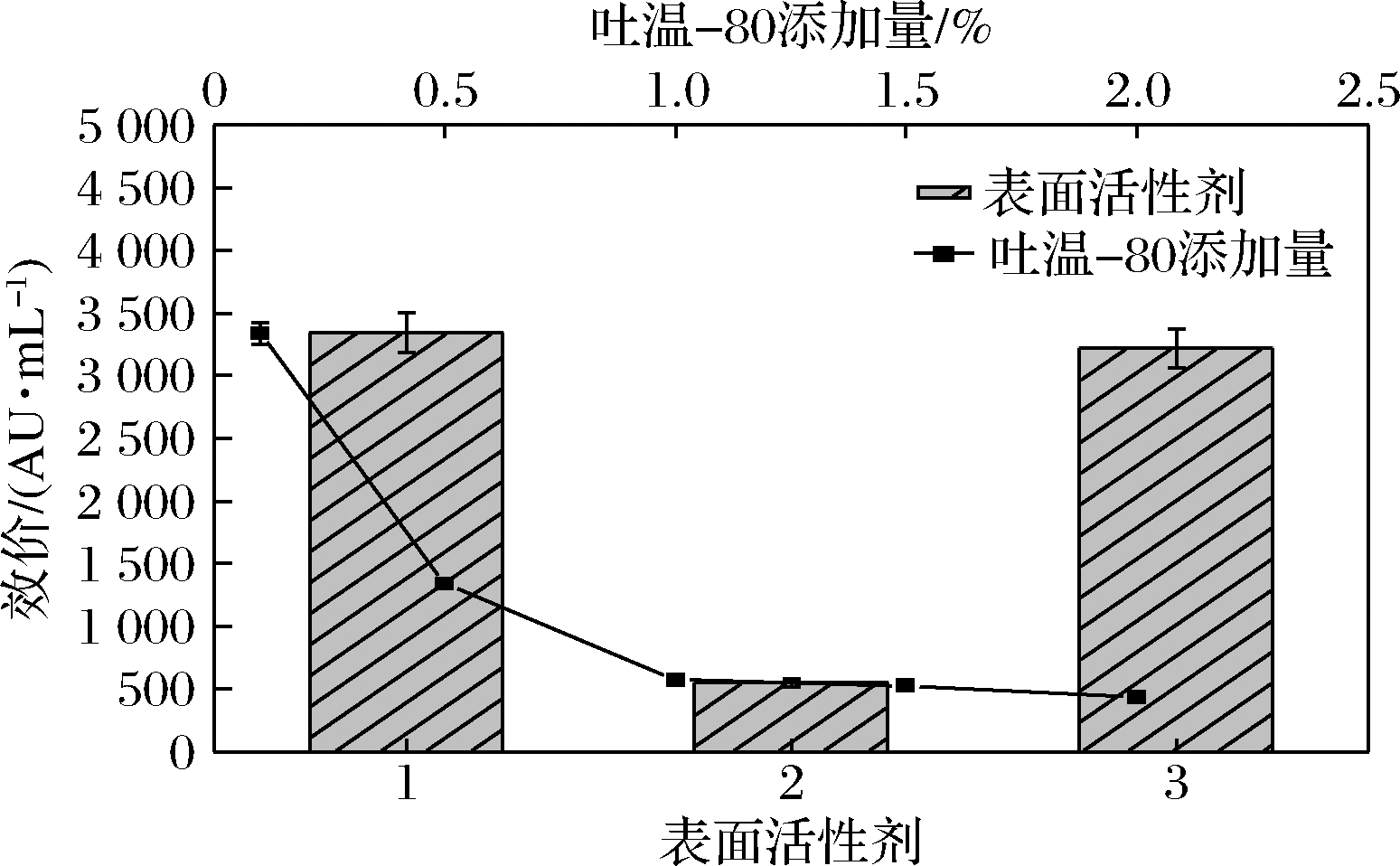
1-空白组;2-吐温-20;3-吐温-80
图5 表面活性剂对L.enzymogenes L-43合成抗菌肽的影响
Fig.5 Effect of different surface actie agents on the antimicrobial peptides production by L.enzymogenes L-43
培养基中加入2种表面活性剂对抗菌肽的合成均无促进作用,吐温-20甚至会抑制L.enzymogenes L-43抗菌肽的合成。对吐温-80的添加量进行优化,结果显示,随着添加量的增加,L.enzymogenes L-43抗菌肽合成量逐渐降低,可见加入吐温-80并不利于抗菌肽的合成。
2.6 发酵培养基优化正交试验
将碳源、氮源、无机盐3个因素进行正交试验,结果如表3所示,与其他组合相比,组合5的抗菌肽合成量最高,效价达到了3 770.52 AU/mL,与NB培养基中发酵效价(602.32 AU/mL)相比,提高了6.26倍。最终确定优化的培养基组合为A2B2C3,即麦芽糖10.0 g/L,胰蛋白胨10.0 g/L,MgSO41.5 g/L。
表3 发酵培养基成分正交试验结果
Table 3 Orthogonal test results of fermentation culture
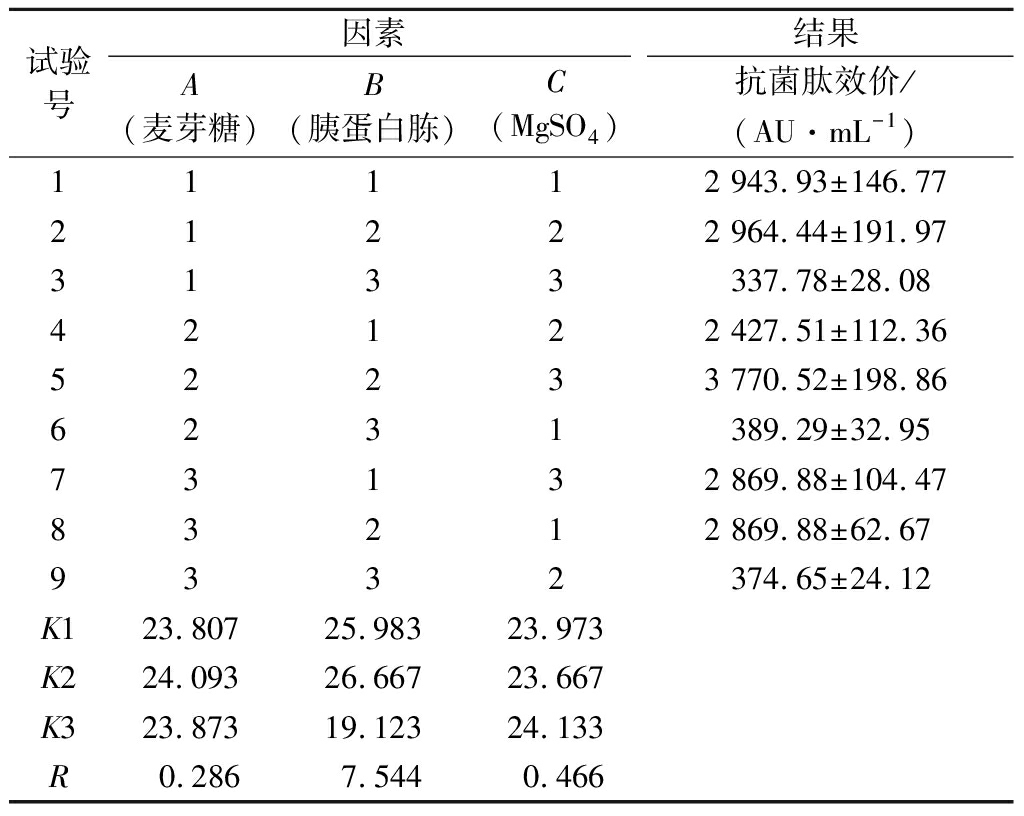
试验号因素结果A(麦芽糖)B(胰蛋白胨)C(MgSO4)抗菌肽效价/(AU·mL-1)11112 943.93±146.7721222 964.44±191.973133337.78±28.0842122 427.51±112.3652233 770.52±198.866231389.29±32.9573132 869.88±104.4783212 869.88±62.679332374.65±24.12K123.80725.98323.973K224.09326.66723.667K323.87319.12324.133R0.2867.5440.466
2.7 发酵初始pH优化
同一种微生物在不同生长阶段或生理生化过程中对pH值有不同的要求。对L.enzymogenes L-43合成抗菌肽的初始pH进行优化,结果如图6-a所示。图6-a显示,随着初始pH的逐渐升高,抗菌肽合成量先增高后降低。当初始pH为6.5时,合成量最高,效价达到了4 335.34 AU/mL;pH高于6.5后,随着pH的升高,效价逐渐降低;pH为10时,效价最低,这可能是由于pH太高,导致菌体死亡或不能生长,从而抑制抗菌肽合成。
2.8 发酵温度优化
对L.enzymogenes L-43的发酵温度进行优化。根据菌体生长的温度规律,分别设置了5个温度进行发酵,结果如图6-b所示。L.enzymogenes L-43在28 ℃不能高效地合成抗菌肽,随着温度升高,抗菌肽合成量逐渐提高,至32 ℃时,抗菌肽合成量最高,效价达到了5 186.32 AU/mL;发酵温度高于32 ℃后,抗菌肽合成量又逐渐降低,这可能与抗菌肽合成酶的催化温度有关。
2.9 发酵时间优化
抗菌肽作为L.enzymogenes L-43合成分泌的一种代谢物,会随着培养时间的延长而积累。本研究分别设置了9个时间点,探究L.enzymogenes L-43抗菌肽在发酵培养基中的合成情况。结果如图6-c所示,当菌体发酵至16 h时,抗菌肽合成量仍处于持续上升的趋势,直至22 h效价最高,达到5 664.47 AU/mL;随着时间的延长,效价又逐渐下降,至24 h后,效价几乎稳定不变。随着发酵时间的延长,菌体量增多,导致培养基内营养成分减少,从而不利于抗菌肽的合成,综合考虑发酵时间确定为22 h。目前,产酶溶杆菌抑菌物质的发酵周期较长,几乎均在24 h以上[23,25-27]。本研究将L.enzymogenes L-43抗菌肽的发酵时间缩短至22 h,有效缩短了发酵周期,降低了发酵成本。
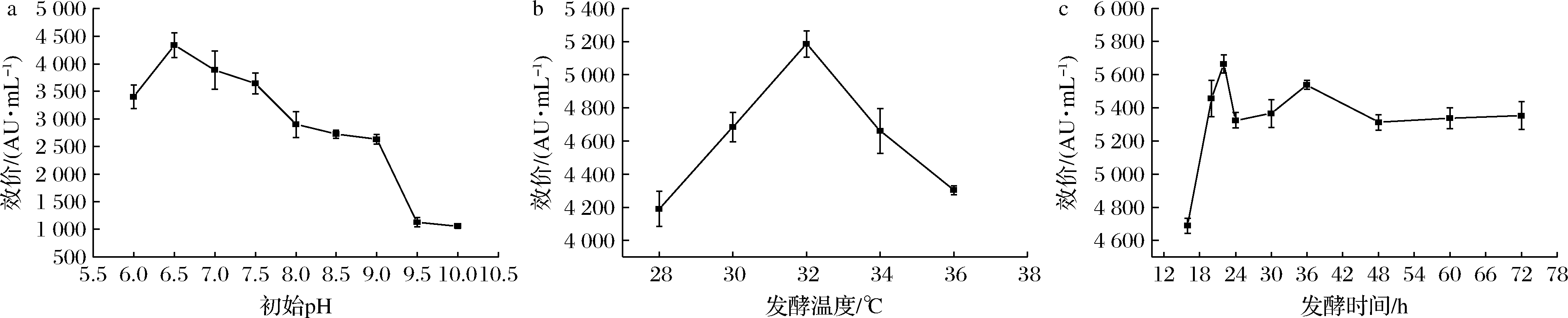
a-初始pH;b-发酵温度;c-发酵时间
图6 发酵初始pH、发酵温度与发酵时间对L.enzymogenes L-43合成抗菌肽的影响
Fig.6 Effect of different fermentation initial pH, temperature and time on the antimicrobial peptides production by L.enzymogenes L-43
2.10 接种量优化
对菌体接种量进行优化,结果如图7-a所示。随着接种量的增加,抗菌肽合成量也逐渐提高。当接种量为3.0%(体积分数,下同)时抗菌肽合成量最高,效价达到了5 961.75 AU/mL;当接种量超过3.0%时,抗菌肽合成量开始逐步降低,至接种量4.0%时其合成量趋于稳定。
2.11 发酵溶氧量优化
适宜的溶氧水平有助于菌体的生长与代谢。本研究从转速与装液量的角度对发酵溶氧水平进行调整。观察转速对抗菌肽合成的影响,结果如图7-b所示,当摇床转速在180~220 r/min时,抗菌肽合成量随着转速的升高而降低;当转速上升至220~240 r/min时,抗菌肽合成量又逐渐升高;当转速上升至240~260 r/min时,抗菌肽合成量呈现降低的趋势。综合比较,确定发酵的转速为180 r/min,此时抗菌肽发酵效价最高,达到了6 876.55 AU/mL。
对发酵装液量进行优化,结果如图7-c所示,当装液量为30 mL/250 mL时,抗菌肽的发酵效价达到了最高(8 421.02 AU/mL);随着装液量的增加,发酵效价逐渐降低,装液量超过60 mL/250 mL,发酵效价显著下降。装液量的增加导致溶解氧降低,从而影响菌体的生长与代谢。

a-接种量;b-摇床转速;c-装液量
图7 接种量、摇床转速与装液量对L.enzymogenes L-43合成抗菌肽的影响
Fig.7 Effect of different inoculum amount, shaking speed and liquid loading on the antimicrobial peptides production by L.enzymogenes L-43
2.12 发酵条件优化正交试验
对发酵条件的4个因素分别设置4个水平进行正交试验。结果如表4所示,对抗菌肽效价影响的显著程度依次是pH>装液量>发酵时间>接种量;与其他组合相比,第11组试验E3F3G1H2的抗菌肽合成量尤为突出,效价达到了9 422.33 AU/mL,与NB培养基中发酵效价(602.32 AU/mL)相比提高了15.6倍。通过正交试验确定发酵条件为装液量50 mL/250 mL,初始pH 7.0,接种量2.0%,发酵时间22 h。
表4 发酵条件正交试验结果
Table 4 Orthogonal test results of fermentation conditions
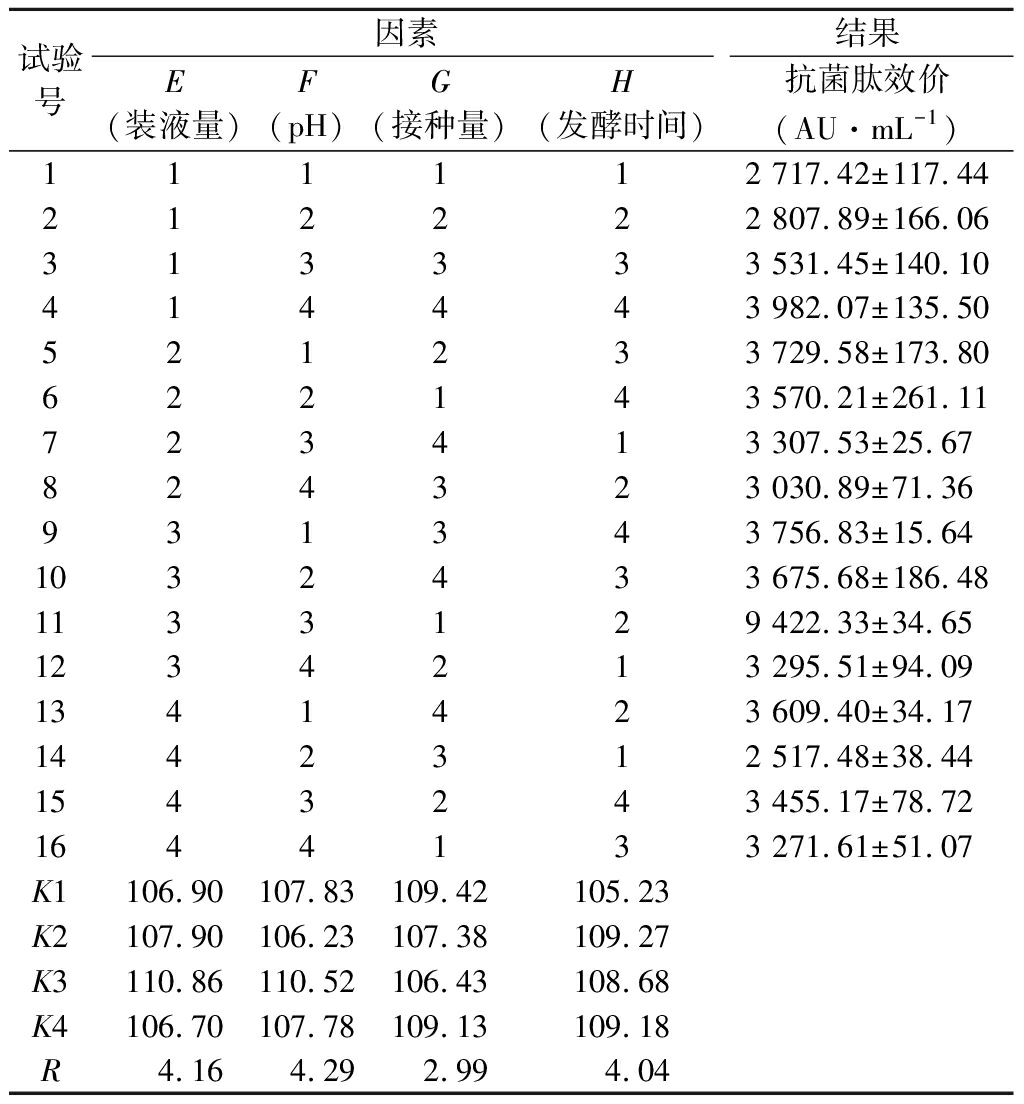
试验号因素结果E(装液量)F(pH)G(接种量)H(发酵时间)抗菌肽效价(AU·mL-1)111112 717.42±117.44212222 807.89±166.06313333 531.45±140.10414443 982.07±135.50521233 729.58±173.80622143 570.21±261.11723413 307.53±25.67824323 030.89±71.36931343 756.83±15.641032433 675.68±186.481133129 422.33±34.651234213 295.51±94.091341423 609.40±34.171442312 517.48±38.441543243 455.17±78.721644133 271.61±51.07K1106.90107.83109.42105.23K2107.90106.23107.38109.27K3110.86110.52106.43108.68K4106.70107.78109.13109.18R4.164.292.994.04
3 结论与讨论
产酶溶杆菌具有广谱的抑菌能力与多种生防机制[28-30],在食品、农业与医学等方面均具有广阔的应用前景。目前,产酶溶杆菌的生防能力以及对作物病害的防治研究已经有了较大进展,但与其他类生防菌相比,开发利用的产酶溶杆菌仍较少[30-31]。因此,开发新型、优良的产酶溶杆菌仍是研究的重点。利用廉价易得的原料对菌株进行发酵,优化其培养环境,降低发酵成本,获得较高的产物浓度、较高的底物转化率和较高的生产强度,是菌株开发的重要环节。
本研究从发酵培养基与发酵条件的角度对产酶溶杆菌L-43合成抗菌肽进行优化,分别对10种碳源、12种氮源、9种无机盐以及2种表面活性剂进行筛选,得到了以麦芽糖为碳源、胰蛋白胨为氮源、MgSO4为无机盐的发酵培养基,优化后抗菌肽效价达到了3 770.52 AU/mL,与最初发酵效价相比(602.32 AU/mL)提高了6.26倍,且有效降低了发酵培养基成本。在优化发酵培养基的基础上对培养基初始pH、装液量、接种量、摇床转速、发酵温度以及发酵时间6个发酵条件进行优化,获得了初始pH 7.0、装液量50 mL/250 mL、接种量2.0%(体积分数)、发酵温度32 ℃、摇床转速180 r/min和发酵时间22 h的组合,优化后抗菌肽的效价达到了9 422.33 AU/mL,与最初发酵效价相比(602.32 AU/mL)提高了15.6倍。
2019年,CHEN等[26]从碳源、氮源、无机盐以及初始pH角度对产酶溶杆菌在摇瓶中合成抗菌肽WAP-8294A的产量进行了优化,得到了以葡萄糖、牛肉膏、大豆油、CaCO3、NaCl作为成分的发酵培养基与初始pH为8.5的发酵条件,发酵48 h,抗菌肽WAP-8294A的产量提高了近10倍,经过探究发现以双糖作为碳源更能促进抗菌肽WAP-8294A的合成与菌体的生长,与本研究筛选出的麦芽糖结果相吻合。但不同的是,与CHEN等筛选出的CaCO3作为无机盐相比,MgSO4作为无机盐更能促进产酶溶杆菌L-43合成抗菌肽,且初始pH为7.0时更适宜菌体合成抗菌肽,这可能与菌体之间的代谢差异相关,需要后续进一步研究。与CHEN等优化的培养基相比,本研究获得的培养基成分较为简单,仍有效提高了抗菌肽效价。除此之外,本研究亦对菌体的发酵时间进行了优化,将发酵时间缩短至22 h,在保证产量的情况下节约了时间与成本;同时对初始pH、装液量、接种量、发酵温度以及摇床转速进行了优化,使产量进一步得到了提高,这也为后期产酶溶杆菌的放大生产以及抗菌肽的应用等研究提供了参考。
[1] HU R F, HUANG X S, HUANG J K, et al.Long- and short-term health effects of pesticide exposure:A cohort study from China[J].PLoS One, 2015, 10(6):e0128766.
[2] LI J Y, ZHAO Q Q, WURIYANGHAN H, et al.Biocontrol bacteria strains Y4 and Y8 alleiate tobacco bacterial wilt disease by altering their rhizosphere soil bacteria community[J].Rhizosphere, 2021, 19:100390.
[3] HUANG B, JIA H J, HAN X B, et al.Effects of biocontrol Bacillus and fermentation bacteria additions on the microbial community, functions and antibiotic resistance genes of prickly ash seed oil meal-biochar compost[J].Bioresource Technology, 2021, 340:125668.
[4] 朴京培, 代越强, 周晓梅.人参病害生物防治的研究进展[J].吉林师范大学学报(自然科学版), 2021, 42(4):103-107.
PIAO J P, DAI Y Q, ZHOU X M.Research progress on biological control of ginseng diseases[J].Journal of Jilin Normal Uniersity (Natural Science Edition), 2021, 42(4):103-107.
[5] DONG X F, FANG L, YE Z Y, et al.Screening of biocontrol bacteria against soft rot disease of Colocasia esculenta (L.) Schott and its field application[J].PLoS One, 2021, 16(7):e0254070.
[6] LI C P, SHI W C, WU D, et al.Biocontrol of potato common scab by Breibacillus laterosporus BL12 is related to the reduction of pathogen and changes in soil bacterial community[J].Biological Control, 2021, 153:104496.
[7] EL-SABER BATIHA G, HUSSEIN D E, ALGAMMAL A M, et al.Application of natural antimicrobials in food preseration:Recent iews[J].Food Control, 2021, 126:108066.
[8] 姬广海. 溶杆菌属及其在植物病害防治中的研究进展[J].云南农业大学学报(自然科学版), 2011, 26(1):124-130.
JI G H.Adances in the study on Lysobacter spp.bacteria and their effects on biological control of plant diseases[J].Journal of Yunnan Agricultural Uniersity (Natural Science), 2011, 26(1):124-130.
[9] 朱慧, 王云霞, 胡白石, 等.产酶溶杆菌OH11菌株α-水解蛋白酶基因的克隆与表达[J].中国生物防治, 2007, 23(4):358-362.
ZHU H, WANG Y X, HU B S, et al.Cloning and expression of α-lytic protease gene from Lysobacter enzymogenes strain OH11[J].Chinese Journal of Biological Control, 2007, 23(4):358-362.
[10] MAHESHWARI D K.Bacteria in Agrobiology:Plant Growth Responses[M].Berlin, Heidelberg:Springer Berlin Heidelberg, 2011.
[11] ON TIGERSTROM R G, STELMASCHUK S.Comparison of the phosphatases of Lysobacter enzymogenes with those of related bacteria[J].Journal of General Microbiology, 1987, 133(11):3 121-3 127.
[12] 钱栋宇. 产酶溶杆菌OH11菌株几丁质酶基因的功能研究[D].南京:南京农业大学, 2011.
QIAN D Y.Function of chitinase in Lysobacter enzymogenes OH11[D].Nanjing:Nanjing Agricultural Uniersity, 2011.
[13] PALUMBO J D, YUEN G Y, JOCHUM C C, et al.Mutagenesis of beta-1, 3-glucanase genes in Lysobacter enzymogenes strain C3 results in reduced biological control actiity toward Bipolaris leaf spot of tall fescue and Pythium damping-off of sugar beet[J].Phytopathology, 2005, 95(6):701-707.
[14] LOU L L, QIAN G L, XIE Y X, et al.Biosynthesis of HSAF, a tetramic acid-containing macrolactam from Lysobacter enzymogenes[J].Journal of the American Chemical Society, 2011, 133(4):643-645.
[15] 田囡, 王超, 刘新利.热稳定抗真菌因子HSAF及其生物防治研究进展[J].山东轻工业学院学报(自然科学版), 2013, 27(4):1-6;21.
TIAN N, WANG C, LIU X L.Research progress on heat-stable antifungal factor(HSAF) and its role in biological control[J].Journal of Shandong Polytechnic Uniersity (Natural Science Edition), 2013, 27(4):1-6;21.
[16] HARADA K I, SUZUKI M, KATO A, et al.Separation of WAP-8294A components, a noel anti-methicillin-resistant Staphylococcus aureus antibiotic, using high-speed counter-current chromatography[J].Journal of Chromatography A, 2001, 932(1-2):75-81.
[17] KATO A, NAKAYA S, KOKUBO N, et al.A new anti-MRSA antibiotic complex, WAP-8294A.I.Taxonomy, isolation and biological actiities[J].The Journal of Antibiotics, 1998, 51(10):929-935.
[18] FOLMAN L B, POSTMA J, AN EEN J A.Characterisation of Lysobacter enzymogenes (Christensen and Cook 1978) strain 3.1T8, a powerful antagonist of fungal diseases of cucumber[J].Microbiological Research, 2003, 158(2):107-115.
[19] 王云霞, 钱国良, 胡白石, 等.产酶溶杆菌OH11菌株摇瓶发酵条件研究[J].中国生物防治, 2008, 24(3):267-271.
WANG Y X, QIAN G L, HU B S, et al.Optimization of the conditions for fermentation of Lysobacter enzymogenes srain OH11[J].Chinese Journal of Biological Control, 2008, 24(3):267-271.
[20] 田囡. 产酶溶杆菌C3产生热稳定性抗真菌因子(HSAF)的研究[D].济南:山东轻工业学院, 2011.
TIAN N.Research progress on heat-stable antifungal factor (HSAF) by Lysobacter enzymogenes C3[D].Jinan:Shandong Polytechnic Uniersity, 2011.
[21] 李宁, 李晓清, 贾英民.利用响应面法优化溶杆菌UCo1产溶菌酶的发酵培养基[J].中国酿造, 2012, 31(3):116-119.
LI N, LI X Q, JIA Y M.Optimization of fermentation medium producing lysozyme by Lysobacter UCo1 using response surface methodology[J].China Brewing, 2012, 31(3):116-119.
[22] 应晨, 阮川芬, 汤逸飞, 等.内生产酶溶杆菌R-2-1发酵工艺优化[J].浙江农业学报, 2015, 27(2):220-228.
YING C, RUAN C F, TANG Y F, et al.Optimization of fermentation conditions of the endophytic strain Lysobacter enzymogenes R-2-1 for microbicide production[J].Acta Agriculturae Zhejiangensis, 2015, 27(2):220-228.
[23] TANG B, SUN C, ZHAO Y C, et al.Efficient production of heat-stable antifungal factor through integrating statistical optimization with a two-stage temperature control strategy in Lysobacter enzymogenes OH11[J].BMC Biotechnology, 2018, 18(1):69.
[24] 张凤娇. 侧孢短芽孢杆菌S62-9抗菌肽的发酵放大工艺研究[D].石家庄:河北科技大学, 2016.
ZHANG F J.Research on scale-up fermentation of antimicrobial peptides produced by B.laterosporus S62-9[D].Shijiazhuang:Hebei Uniersity of Science and Technology, 2016.
[25] TANG B, ZHAO Y C, SHI X M, et al.Enhanced heat stable antifungal factor production by Lysobacter enzymogenes OH11 with cheap feedstocks:Medium optimization and quantitatie determination[J].Letters in Applied Microbiology, 2018, 66(5):439-446.
[26] CHEN X S, LI S R, YU L J, et al.Systematic optimization for production of the anti-MRSA antibiotics WAP-8294A in an engineered strain of Lysobacter enzymogenes[J].Microbial Biotechnology, 2019, 12(6):1 430-1 440.
[27] 王纯婷. 产酶溶杆菌抗菌活性物质产率促进及其应用[D].南京:南京农业大学, 2014.
WANG C T.The yield promotion and application of antifungal factor produced by Lysobacter enzymogenes[D].Nanjing:Nanjing Agricultural Uniersity, 2014.
[28] POSTMA J, STEENS L H, WIEGERS G L, et al.Biological control of Pythium aphanidermatum in cucumber with a combined application of Lysobacter enzymogenes strain 3.1T8 and chitosan[J].Biological Control, 2009, 48(3):301-309.
[29] QIAN G L, HU B S, JIANG Y H, et al.Identification and characterization of Lysobacter enzymogenes as a biological control agent against some fungal pathogens[J].Agricultural Sciences in China, 2009, 8(1):68-75.
[30] ZHAO Y Y, JIANG T P, XU H Y, et al.Characterization of Lysobacter spp.strains and their potential use as biocontrol agents against pear anthracnose[J].Microbiological Research, 2021, 242:126624.
[31] YUEN G Y, BRODERICK K C, JOCHUM C C, et al.Control of cyst Nematodes by Lysobacter enzymogenes strain C3 and the role of the antibiotic HSAF in the biological control actiity[J].Biological Control, 2018, 117:158-163.