苯丙酮尿症(phenylketonuria, PKU)是一种由于苯丙氨酸羟化酶(phenylalanine hydroxylase, PAH)基因缺陷所致的常染色体遗传病[1],患者体内PAH活性降低或缺乏后,导致血、脑中苯丙氨酸的积累,对大脑和神经系统造成损害[2]。苯丙氨酸不能进一步代谢为左旋多巴、甲状腺素、多巴胺、去甲肾上腺素、肾上腺素等,其中多巴胺、肾上腺素等与神经精神障碍相关的认知密切相关[3]。
目前治疗苯丙酮尿症广泛使用的方法有3种,即饮食治疗[4]、酶治疗[5]和基因治疗[6]。然而酶疗法会导致严重的免疫介导的不良反应和过敏反应,基因治疗虽然具有一次性治疗的特点,但存在价格高昂和潜在的遗传毒性。因此,低苯丙氨酸饮食目前正受到越来越多的关注[7]。多项研究表明,益生菌具有代谢苯丙氨酸、增强肠道屏障功能、促进肠道菌群平衡等作用[8],因此开发安全、高效的益生菌制剂及其产品来辅助治疗苯丙酮尿症具有重要意义。
苯丙氨酸作为一种必需氨基酸,是乳酸菌生长所必须的氮源。乳酸菌能够合成苯丙氨酸解氨酶(phenylalaninammo nialyase, PAL),可以将苯丙氨酸代谢成为无毒的反式肉桂酸。此外,苯丙氨酸还可通过苯乙酸途径、苯丙酮酸途径进行降解[9]。ISABELLA等[10]构建了具有高苯丙氨酸解氨酶活性的基因工程菌株并成功应用于临床。因此,益生菌有望在苯丙酮尿症的预防和辅助治疗中发挥重要作用。目前,低苯丙氨酸含量的益生元糖巨肽在疾病治疗方面取得了进展[11],但针对治疗或缓解苯丙酮尿症的益生菌的研究报道不多。本研究筛选出具有苯丙氨酸降解能力的益生菌菌株,并对这些菌株的益生菌特性及其发酵乳中的应用潜力进行了探讨,以期为开发针对苯丙酮尿症的功能性微生态制剂或特医食品提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
本试验选取的31株乳酸菌,分离自发酵乳和干酪等传统发酵食品和婴儿粪便;对照菌株、鼠李糖乳杆菌LGG,均保存于中国海洋大学食品科学与工程学院功能性乳制品与益生菌工程研究室;酸奶发酵剂YF-L907(保加利亚杆菌和嗜热链球菌),北京多爱特生物科技有限公司。
1.1.2 培养基
MRS培养基、M17培养基、脱脂乳培养基,青岛海博生物技术有限公司
L-苯丙氨酸特异选择培养基(g/L):葡萄糖20.0,K2HPO4 2.0,柠檬酸氢二胺2.0,乙酸钠5.0,MgSO4 0.2,MnSO4 0.04,吐温80 1.0,L-苯丙氨酸0.5,pH值(5.7±0.2)(25 ℃)。
1.1.3 主要实验材料
L-苯丙氨酸、反式肉桂酸、全脂乳粉、白砂糖。
1.2 仪器与设备
SW-CJ-1D洁净工作台,苏州净化设备有限公司;Sartorius 普及型pH计,德国赛多利斯普公司;Blue pard恒温培养箱,上海一恒科学仪器有限公司;TG20KR-D高速冷冻离心机,长沙东旺实验仪器有限公司;LDZX-75KBS全自动灭菌锅,上海申安医疗器械厂;L-8900氨基酸分析仪,日本日立公司。
1.3 实验方法
1.3.1 降解苯丙氨酸益生菌的筛选
实验方法参考SU等[12]的方法略有修改。活化后的菌株以相同的OD600(0.600~0.750)取10 mL培养液,8 000 r/min,4 ℃离心5 min,菌体沉淀用Tris-HCl(pH 7.4)洗涤2次后重悬。反应体系中依次加入苯丙氨酸(50 mmol/L)2.5 mL,菌悬液4 mL,吐温-80(0.5 g/L)0.5 mL并混合均匀,以不加入菌株的培养基作为空白对照,37 ℃水浴保温10 min,加入HCl溶液(6 mol/L)0.2 mL终止反应,离心除去菌体后,测定上清液在280 nm下的吸光值。酶活性的计算如公式(1)所示:
(1)
式中:U,酶活性,mU/mL;Mw,肉桂酸的摩尔质量,g/mol;,反应体积,mL;t,反应时间,min;ρ,生成的肉桂酸质量浓度,mg/L。
1.3.1.2 以苯丙氨酸降解率为靶标的筛选
将上述菌悬液接种于L-苯丙氨酸特异选择培养基中,37 ℃静置培养72 h后离心(6 000 r/min,4 ℃,15 min),取2.00 mL稀释液使用茚三酮比色法测定培养基中苯丙氨酸含量,以不接种菌株的培养基作为空白对照,由接入菌株前后体系苯丙氨酸含量计算苯丙氨酸降解率。
1.3.2 降解苯丙氨酸益生菌生长特性、胃肠耐受及黏附性能测定
以2%的接种量将活化后的菌株接种于MRS肉汤中,每2 h测定培养体系在600 nm下的吸光值和体系的pH值,绘制生长曲线和产酸曲线。菌体活化后经离心(5 000 r/min,4 ℃,10 min)操作后,用PBS(pH 7.4)缓冲液洗涤2次后悬浮。吸取菌悬液于人工胃液中[13](胃蛋白酶0.35%、NaC1 0.2%,pH为3.0,过滤除菌)消化2 h,使用平板计数法测定活菌数。吸取经人工胃液消化的菌液到人工肠液中[14](NaCl 0.44%,胰蛋白酶0.2%,NaHCO3 2.2%,胆盐1.2%,pH为8.0,过滤除菌)消化4 h。存活率的计算如公式(2)所示:
存活率![]()
(2)
式中:N,消化一定时间后消化液中的活菌数,CFU/mL;N0,消化0 h消化液中的活菌数,CFU/mL。
根据SHAHEEN[15]的实验方法略有修改。取3 mL上述菌悬液与1 mL三氯甲烷混合,将混合液涡旋30 s后室温静置30 min。菌株表面疏水性的计算如公式(3)所示:
表面疏水性![]()
(3)
式中:A0,初始菌悬液的OD600值;Ax,混合溶液中水相的OD600值。
根据丁诗瑶等[16]的实验方法略有修改。取菌液4 mL涡旋10 s后在室温下静置3 h,将0.1 mL上层悬浮液加入3.9 mL PBS(pH 7.4),菌株自聚性的计算如公式(4)所示:
自聚性![]()
(4)
式中:A0,初始菌悬液的OD600值;A1,静置后菌悬液的OD600值。
1.3.3 发酵乳的制备
全脂复原乳(全脂乳粉12%,白砂糖6%)60 ℃水浴30 min,均质(65 ℃,20 MPa)后迅速分装至锥形瓶中,105 ℃下高温杀菌5 min后,迅速冰浴冷却至42 ℃,接种发酵剂YF-L907(保加利亚杆菌:108 CFU/mL,嗜热链球菌:108 CFU/mL)为对照,L.plantarum YZX21的接种量分别为0、1×106、1×107 CFU/mL,42 ℃发酵至pH 4.5左右,置于4 ℃下冷藏24 h后熟。酸奶冷藏后进行感官评价,贮藏期间于第1、4、7、10、13、16、19、22天测量相关理化指标。
1.3.4 pH和滴定酸度测定
将发酵乳样品置于室温平衡一定时间,采用pH计进行测定,每2 h测定1次,至发酵终点(pH 4.5)。在冷藏期间每3 d测量1次pH值。滴定酸度测定参照GB 5009.239—2016《食品安全国家标准 食品酸度的测定》。
1.3.5 活菌数测定
参照GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》。
1.3.6 感官评价
参照中国乳制品工业行业规范RHB 103—2004《酸牛乳感官质量评鉴细则》,选取10名评价员从色泽、组织状态、口感、气味、滋味5个方面对发酵乳进行感官评价。
1.3.7 发酵乳中蛋白质和苯丙氨酸含量的测定
将发酵乳适当稀释后,用BCA试剂盒测定发酵乳中的蛋白质浓度。氨基酸分析使用氨基酸分析仪测定,准确称取2.0 g发酵乳样品,加入1.5 mL质量分数为5%磺基水杨酸,充分振荡后,5 000 r/min,4 ℃离心20 min,取上清液过0.22 μm的水相滤膜后装入液相管备用。上样量为10 μL。
1.4 数据分析
采用SPSS 22.0软件和GraphPad Prism er8.02进行统计分析。结果用均数±标准差表示,P<0.05表示有统计学意义。
2 结果与分析
2.1 降解苯丙氨酸益生菌的筛选
采用茚三酮比色法和分光光度法,以苯丙氨酸降解能力和苯丙氨酸解氨酶酶活性为指标,菌株初筛结果见表1。
经过初筛得到L.plantarum YZX21和动物双歧杆菌(Bifidobacterium animalis)F1-7,2株菌株的苯丙氨酸降解率分别为12.43%和10.09%(表1)。L.plantarum YZX21的苯丙氨酸降解率最高,可能是由于苯丙氨酸作为乳酸菌生长的必需氨基酸之一,通过苯丙氨酸解氨酶对苯丙氨酸进行降解,这与HUANG等[9]发现苯丙氨酸可以通过肉桂酸代谢途径进行降解的研究报道一致。进一步测定了2株菌的苯丙氨酸解氨酶酶活性,结果显示L.plantarum YZX21和B.animalis F1-7的苯丙氨酸解氨酶活性分别为28.62和24.23 mU/mL。这与苯丙氨酸降解率分析的结果一致,同时也说明不同菌株对苯丙氨酸的降解能力与苯丙氨酸解氨酶活性相关。
2.2 降解苯丙氨酸益生菌的生长和产酸特性测定
菌株的生长和产酸能力是评价其生产应用潜力的重要指标。对L.plantarum YZX21和B.animalis F1-7的生长特性和产酸特性进行分析,结果如图1所示。
表1 菌株初筛实验结果
Table 1 Experimental results of strain screening

菌株名称苯丙氨酸解氨酶酶活力/(mU·mL-1)苯丙氨酸降解率/%阴道乳杆菌FN2395.670 2±0.009 8p1.007 4±1.051 7p格氏乳杆菌F27-314.834 2±0.028 0hij3.375 5±0.574 4hij副干酪乳杆菌YRL57713.894 6±0.064 3j2.052 1±0.197 0j鼠李糖乳杆菌LGG18.900 0±0.017 0d5.750 1±0.160 9p植物乳杆菌Q715.523 9±0.009 8gh3.491 6±3.860 5gh动物双歧杆菌BB125.178 2±0.017 0p0.659 1±3.229 1p副干酪乳杆菌YZX-3819.361 5±0.050 1d4.698 9±0.788 0d副干酪乳杆菌M1817.544 2±0.081 3f4.420 3±0.588 0f鼠李糖乳杆菌MDXHM1315.727 0±0.076 6g3.354 0±0.175 7g唾液乳杆菌K1118.576 0±0.091 0e3.416 1±0.167 6e副干酪乳杆菌X1114.695 2±0.045 0ij3.188 4±0.379 5ij副干酪乳杆菌1F-2017.683 2±0.131 6f4.906 8±1.383 3f植物乳杆菌M3-2-114.294 9±0.084 7j2.525 8±1.242 2j酸性乳球菌GAN5-4-111.153 5±0.079 7l1.118 0±1.168 5l副干酪乳杆菌MN115.624 6±0.058 2p1.246 6±1.405 4p动物双歧杆菌F1-724.228 0±0.003 7b10.091 8±1.796 3b发酵乳杆菌F40-417.975 5±0.006 4ef4.039 7±0.613 3f阴道乳杆菌FN312.308 4±0.145 0k2.339 9±2.542 6k副干酪乳杆菌J512.893 8±0.022 2k2.958 1±0.669 1k动物双歧杆菌K915.403 7±0.009 8ghi3.807 9±0.655 6ghi鼠李糖乳杆菌MN4523.088 2±0.013 4c9.602 7±0.877 5c鼠李糖乳杆菌MN206.856 6±0.024 3o1.567 3±0.370 8o植物乳杆菌F3-219.238 4±0.019 6d4.831 4±0.976 3d德氏乳杆菌NFGSQ9.259 2±0.016 1n2.821 5±0.398 6n鼠李糖乳杆菌FN51814.171 8±0.013 4j3.258 4±0.462 4j植物乳杆菌YZX2128.617 1±0.013 4a12.434 5±0.605 5a副干酪乳杆菌MN1814.094 7±0.040 1j3.520 6±0.370 8j发酵乳杆菌MN705.316 5±0.028 0p1.073 7±0.506 6p动物双歧杆菌F1-3-210.460 2±0.013 4m2.104 0±0.546 9m动物双歧杆菌YR311511.291 8±0.007 5l2.286 3±0.182 3l阴道乳杆菌1F-64.330 8±0.007 5q0.736 8±0.273 5q
注:不同小写字母表示各组之间存在显著差异(P<0.05)

a-生长曲线;b-产酸曲线
图1 生长特性和产酸特性
Fig.1 Growth characteristics and acid production characteristics
L.plantarum YZX21和B.animalis F1-7的生长特性与产酸特性相似,培养2 h左右即进入对数期,培养18 h左右生长、产酸趋于稳定;在对数期间,随着培养时间的延长,培养基的pH值逐渐下降;稳定期时培养基的pH值为3.6,表明L.plantarum YZX21和B.animalis F1-7均具有较强的产酸能力,具有研究与开发低苯丙氨酸发酵食品的潜力[17]。
2.3 降解苯丙氨酸益生菌的胃肠环境耐受和定植能力评价
益生菌能够发挥作用的前提是以一定数量的活菌形式到达肠道,对胃液和肠液环境具有一定的耐受性。胃液的pH值一般为2~3,食物成分在胃中一般停留时间为2~4 h,同时人体肠液中胆盐浓度一般在0.03~0.30 g/100 mL[18]。体外实验对L.plantarum YZX21和B.animalis F1-7的胃肠液耐受性进行了测定。结果表明(图2-a),虽然胃液和肠液对这2株菌的生存和增殖具有一定的抑制作用,但L.plantarum YZX21和B.animalis F1-7均具有较强的抵抗胃酸和肠液的低pH值能力,其中L.plantarum YZX21在肠液中的存活率为76.91%,显著高于B.animalis F1-7。
益生菌在肠道中的黏附是益生菌在肠道定植发挥益生作用的重要因素之一。通过疏水性和自聚性的测定评价了L.plantarum YZX21和B.animalis F1-7的肠道黏附能力。结果表明L.plantarum YZX21和B.animalis F1-7的疏水性无显著差异,但在自聚性方面,L.plantarum YZX21显著高于B. animalis F1-7(图2-b),这表明L.plantarum YZX21的黏附能力优于B.animalis F1-7,后续选择L.plantarum YZX21进一步研究。

a-胃肠液耐受性;b-黏附能力
图2 胃肠液耐受性和定植能力
Fig.2 Gastrointestinal tolerance and adhesion ability
2.4 L.plantarum YZX21对酸奶发酵和贮藏的影响
以市售发酵剂YF-L907(含有保加利亚乳杆菌和嗜热链球菌)生产的发酵乳为对照,研究了不同添加量L.plantarum YZX21(1×106和1×107 CFU/mL)在酸奶发酵中的应用潜力,结果如图3所示。
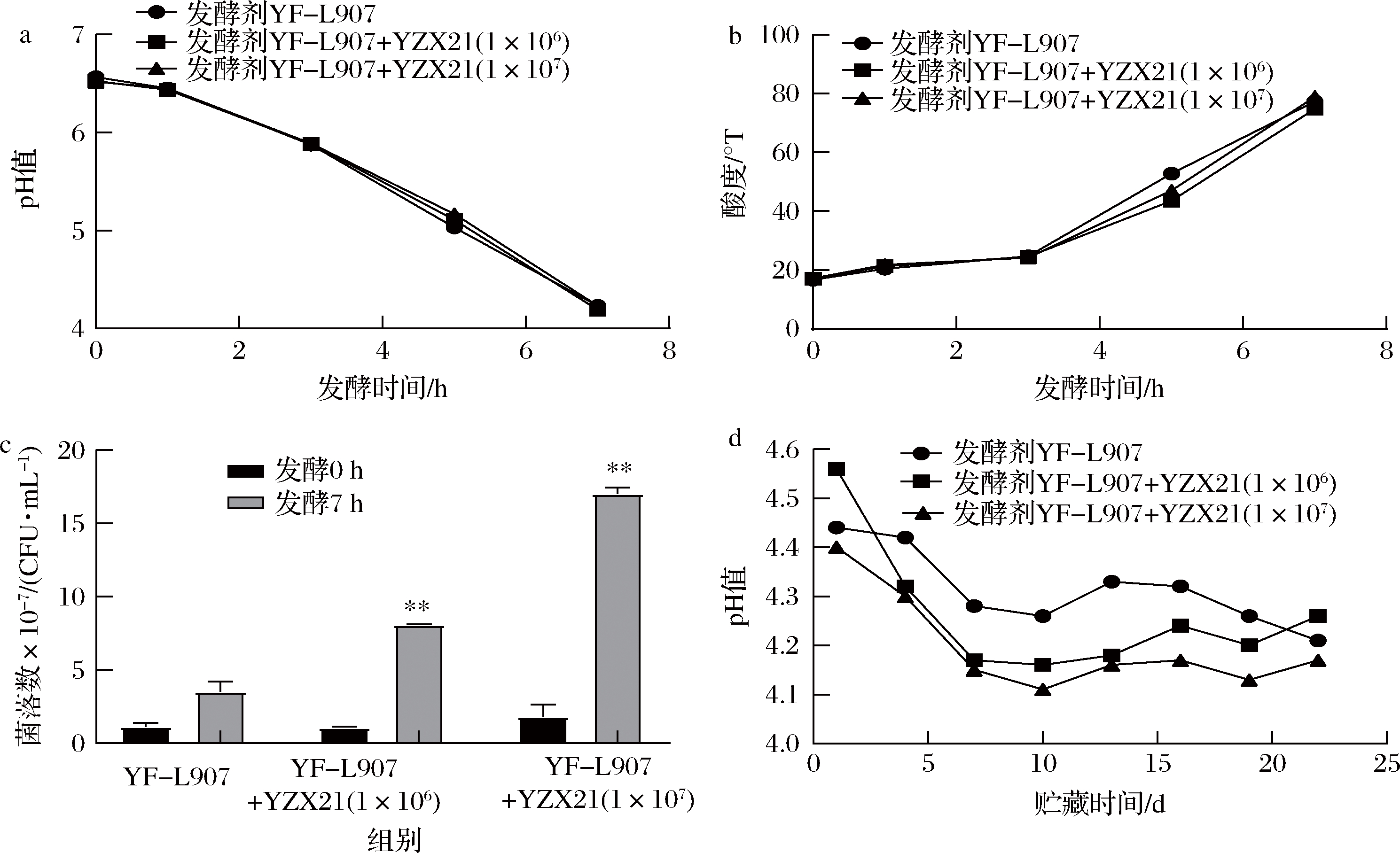
a-发酵过程pH变化;b-发酵过程酸度变化;c-发酵过程活菌数变化;d-冷藏过程pH变化
图3 植物乳杆菌YZX21对酸奶发酵和冷藏过程中pH、酸度和活菌数的影响
Fig.3 Effect of L.plantarum YZX21 on pH, acidity and iable count during yogurt fermentation and storage at 4 ℃
与市售发酵剂YF-L907相比,接种L.plantarum YZX21的发酵乳pH值和酸度变化均稍晚于对照组,但添加L.plantarumYZX21对酸奶的整体发酵进程没有影响。此外,从图3-a,3-b可知,L.plantarum YZX21对发酵乳产酸贡献不大,这与L.plantarum YZX21在MRS培养基中的产酸特性不一致,表明L.plantarum YZX21的产酸特性与发酵底物有关。此外,添加L.plantarum YZX21的发酵乳活菌数量高于对照组,结合发酵过程中pH值和酸度变化结果(图3-a,3-b),推测L.plantarum YZX21与发酵剂菌株(嗜热链球菌和保加利亚乳杆菌)具有一定的协同共生作用。L.plantarum YZX21对酸奶发酵的整体进程没有影响,表明其可以作为辅助发酵剂应用于酸奶发酵。在冷藏期间,3组发酵乳的pH值缓慢降低,说明发酵乳样品的后酸化进程缓慢,L.plantarum YZX21的加入不会导致发酵乳的后酸化,再次表明L.plantarum YZX21具有发酵乳辅助发酵菌株的应用潜能。
2.5 L.plantarum YZX21对发酵乳感官品质的影响
从色泽、组织状态、口感、气味、滋味等方面研究了L.plantarum YZX21对发酵乳感官特性的影响,结果如图4所示。
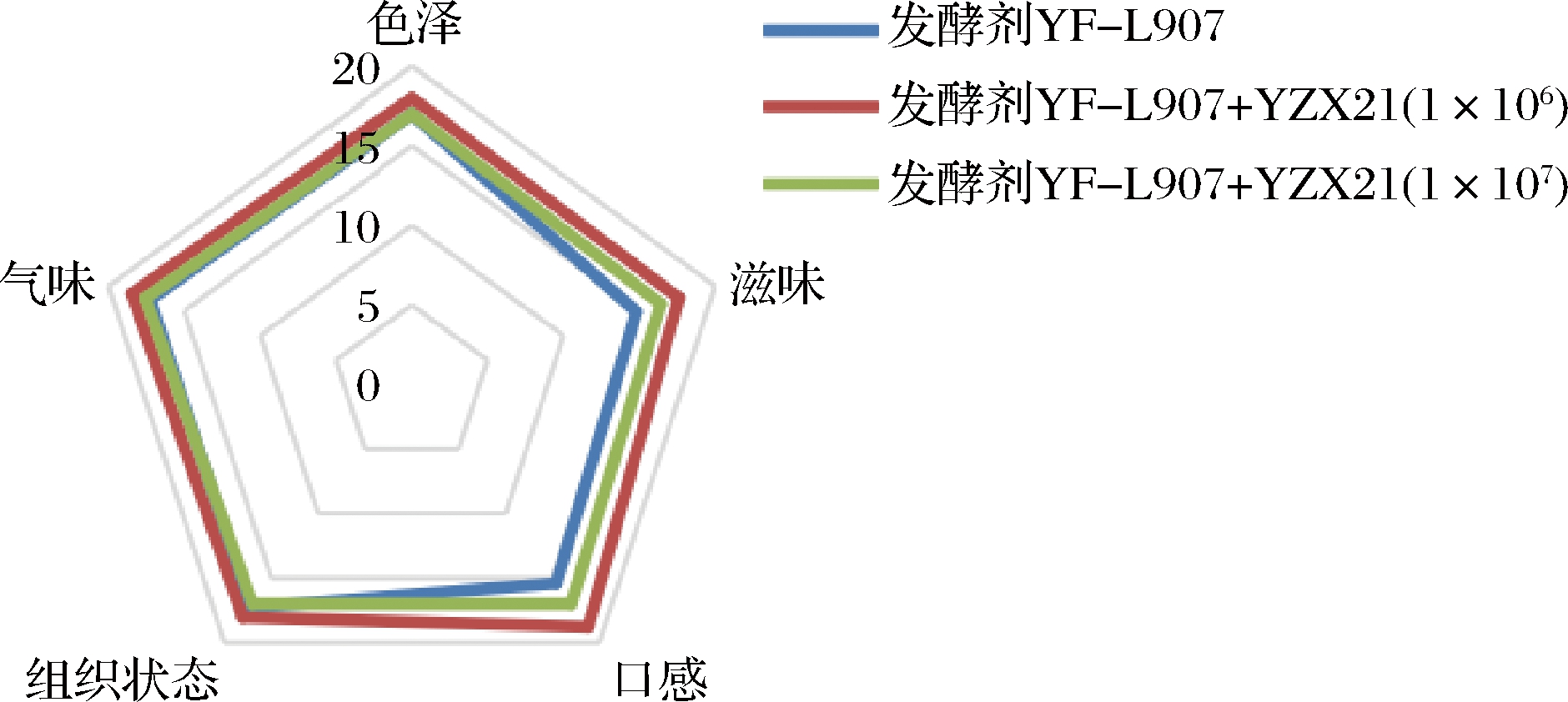
图4 发酵乳的感官评价结果
Fig.4 Sensory ealuation of fermented milk
接种L.plantarum YZX21的发酵乳在口感和滋味这2个方面的评价结果优于对照组,添加不同剂量的L.plantarum YZX21发酵乳口感得分分别为23.50和22.25,显著高于商业发酵乳,在滋味上得分分别为22.00和20.50,高于商业发酵乳,但无显著差异。这可能与L.plantarum YZX21代谢苯丙氨酸等芳香族氨基酸产生特殊风味物质有关,表明L.plantarum YZX21可以改善酸奶的感官特性。
2.6 L.plantarumYZX21对发酵乳苯丙氨酸含量的影响
研究比较了添加和未添加L.plantarum YZX21的发酵乳中蛋白质和苯丙氨酸的含量变化。结果表明L.plantarum YZX21具有较强的乳蛋白和苯丙氨酸降解能力(表3)。
表3 发酵乳蛋白质和苯丙氨酸含量的变化 单位:mg/mL
Table 3 Changes of protein and phenylalanine contents in fermented milk

组别ρ(蛋白质)ρ(苯丙氨酸)YF-L90728.863 5±0.836 41.159 3±0.001 0YF-L907+YZX21(1×106 CFU/mL)27.171 0±0.711 3∗1.027 3±0.001 1∗YF-L907+YZX21(1×107 CFU/mL)25.831 4±0.313 7∗1.007 4±0.012 2∗
注:*表示各组之间存在显著差异(P<0.05)
对照发酵乳样品中苯丙氨酸的含量为1.159 3 mg/mL。相较于对照组发酵乳,接种不同剂量L.plantarum YZX21的发酵乳苯丙氨酸含量分别下降了11.39%和13.10%,且呈现剂量依赖性,YANG等[19]对乳酸菌发酵豆乳过程苯丙氨酸的含量变化进行了研究,发现发酵豆乳中的苯丙氨酸含量呈缓慢下降趋势,这与本研究结果类似,但对苯丙氨酸降解及其调控机制还有待进一步深入研究。
3 结论
以苯丙氨酸降解能力和苯丙氨酸解氨酶酶活性为筛选靶标,筛选出高效降解苯丙氨酸的L.plantarum YZX21和B.animalis F1-7,且2株菌的生长特性与益生特性良好。将L.plantarum YZX21作为辅助发酵剂应用于发酵乳,L.plantarum YZX21对发酵和冷藏过程中的pH、酸度、活菌数均无负面影响,同时能够有效降低发酵乳中苯丙氨酸含量。综上所述,L.plantarum YZX21具有明显的苯丙氨酸降解能力,有望作为辅助发酵剂应用于酸奶发酵,为苯丙酮尿症患者开发低苯丙氨酸的功能性发酵食品。
[1] SHINTAKU H, OHURA T, TAKAYANAGI M, et al.Guide for diagnosis and treatment of hyperphenylalaninemia[J].Pediatrics International:Official Journal of the Japan Pediatric Society, 2021, 63(1):8-12.
[2] TREPP R, MURI R, ABGOTTSPON S, et al.Impact of phenylalanine on cognitie, cerebral, and neurometabolic parameters in adult patients with phenylketonuria (the PICO study):A randomized, placebo-controlled, crossoer, noninferiority trial[J].Trials, 2020, 21(1):178.
[3] SU Y J, WANG H J, REJIAFU N, et al.The molecular epidemiology of hyperphenylalaninemia in Uygur population:Incidence from newborn screening and mutational spectra[J].Annals of Translational Medicine, 2019, 7(12):258.
[4] BUSHUEA T , BOROIK T E, SEMYONOA N N, et al.Use of low-protein enriched starch products in diet therapy of children with phenylketonuria aged oer one year[J].Pediatric Pharmacology, 2018, 15(2):129-134.
[5] ZHANG Z, GAO J J, FENG Y, et al.Mutational spectrum of the phenylalanine hydroxylase gene in patients with phenylketonuria in the central region of China[J].Scandinaian Journal of Clinical and Laboratory Inestigation, 2018, 78(3):211-218.
[6] GRISCH-CHAN H M, SCHWANK G, HARDING C O, et al.State-of-the-art 2019 on gene therapy for phenylketonuria[J].Human Gene Therapy, 2019, 30(10):1 274-1 283.
[7] GOLDSTEIN A, OCKLEY J.Clinical trials examining treatments for inborn errors of amino acid metabolism[J].Expert Opinion on Orphan Drugs, 2017, 5(2):153-164.
[8] REID G, ABRAHAMSSON T, BAILEY M, et al.How do probiotics and prebiotics function at distant sites?[J].Beneficial Microbes, 2017, 8(4):521-533.
[9] 黄珊. 基于转录组学与代谢组学的Streptococcus thermophilus TF96氨基酸代谢机制研究[D].哈尔滨:东北农业大学, 2017.
HUANG S.Integrating transcriptomics and metabolomics to reeal metabolism of amino acid of Streptococcus thermophilus TF96[D].Harbin:Northeast Agricultural Uniersity, 2017.
[10] ISABELLA M, HA B N, CASTILLO M J, et al.Deelopment of a synthetic lie bacterial therapeutic for the human metabolic disease phenylketonuria[J].Nature Biotechnology, 2018, 36(9):857-864.
[11] PINTO A, ALMEIDA M F, RAMOS P C, et al.Nutritional status in patients with phenylketonuria using glycomacropeptide as their major protein source[J].European Journal of Clinical Nutrition, 2017, 71(10):1 230-1 234.
[12] SU Y, LI N, LIANG Z Q.Stabilization of phenylalanine ammonia lyase actiity in the yeast[J].Chemistry of Natural Compounds, 2007, 43(5):639-640.
[13] 康小红, 王凡, 陈建国, 等.嗜热链球菌MN-ZLW-002体外益生特性与安全性分析[J].食品工业科技, 2020, 41(15):124-128.
KANG X H, WANG F, CHEN J G, et al.The probiotic properties in itro and safety analysis of Streptococcus thermophiles MN-ZLW-002[J].Science and Technology of Food Industry, 2020, 41(15):124-128.
[14] 丁淑娟. 降胆固醇乳酸菌筛选及其在高脂大鼠模型上的应用评价[D].广州:华南理工大学, 2019.
DING S J.Screening and comparatie analysis of cholesterol-lowing Lactobacillus[D].Guangzhou:South China Uniersity of Technology, 2019.
[15] SHAHEEN A, EL-BAGHDADY K, ZAKARIA A.Isolation and identification of potent probiotics with high lead remoal capability[J].Egyptian Journal of Botany, 2018,59(1):95-105.
[16] 丁诗瑶, 雷文平, 刘成国, 等.不同来源植物乳杆菌的益生特性研究[J].中国乳品工业, 2021, 49(1):20-24.
DING S Y, LEI W P, LIU C G, et al.Probiotic characteristics of Lactobacillus plantarum strains isolated from different habitats[J].China Dairy Industry, 2021, 49(1):20-24.
[17] RAI R, TAMANG J P.In itro and genetic screening of probiotic properties of lactic acid bacteria isolated from naturally fermented cow-milk and yak-milk products of Sikkim, India[J].World Journal of Microbiology & Biotechnology, 2022, 38(2):25.
[18] 张莉. 植物乳杆菌的黏附特性研究及其在益生菌干酪中的应用[D].长春:吉林大学, 2013.
ZHANG L.Study on adhesion properties of Lactobacillus plantarum and applications in probiotic cheese[D].Changchun:Jilin Uniersity, 2013.
[19] YANG S O, KIM S H, CHO S, et al.Classification of fermented soymilk during fermentation by 1H NMR coupled with principal component analysis and elucidation of free-radical scaenging actiities[J].Bioscience, Biotechnology, and Biochemistry, 2009, 73(5):1 184-1 188.