肽是含有2个至几十个氨基酸残基的特定蛋白质片段,其中,肽链上含有10个及以上氨基酸的肽称为多肽,含有2~9个氨基酸的肽称为寡肽,含有2~4个氨基酸的肽又称为小分子肽[1]。20世纪80年代初,GARDNER等研究人员证明了寡肽不需被分解为游离氨基酸,而可以直接被机体吸收,在被消化吸收方面具有蛋白质无法比拟的优点[2-3]。肽链通常因氨基酸组成及排列方式不同,会表现出不同的生理调节功能[4]。乳蛋白重要功能是提供氨基酸和氮,是膳食蛋白质的重要组成部分,促进多种重要营养物质的吸收,如微量元素和维生素。此外研究表明,乳源蛋白质经降解,可释放出具有血管紧张素转换酶抑制活性、抗氧化活性、抗菌活性、免疫调节活性和阿片样活性的肽类物质,例如,由牛乳αs1酪蛋白中的23~34、23~27、194~199氨基酸残基和β酪蛋白的177~183氨基酸残基组成的4个寡肽具有抗高血压活性,由牛乳β酪蛋白的60~64氨基酸残基组成的β-酪啡肽5具有很强的阿片样活性,可发挥镇静、镇痛、刺激胰岛素和生长激素释放、免疫调节等功能[5-9]。近年来,乳源蛋白肽的研究及应用是食品领域的热点。但是,乳源蛋白质经水解,一些水解产物末端暴露了疏水性氨基酸残基,与味蕾上的受体蛋白接触会产生苦味[10],从而限制乳源蛋白肽在食品领域的应用。
酸奶可以满足乳糖不耐症人群对乳制品的需求,提供丰富的蛋白质和钙,在发酵过程中产生的一些生理活性物质可以抑制有害微生物的增殖,维持肠道菌群平衡,对慢性疾病有一定功效,但不易于保藏,酸奶粉具有保质期长、便于储存等优点,已形成了商品化生产[11-12]。但是,由于寡肽苦味困扰,市场上尚未有富含寡肽的酸奶粉。本文筛选高产氨肽酶的乳酸菌,并利用该菌种对乳源蛋白肽进行脱苦研究,以期为解决富含寡肽酸奶粉的苦味问题提供参考。
1 材料与方法
1.1 材料
自然发酵马奶、脱脂牛乳,新疆天牛乳业有限公司提供。DNA提取试剂盒、16S rDNA的扩增引物以及PCR扩增试剂,其中细菌通用引物27F/1492R,27F:5′-AGAGTTTGATCCTGGCTCAG-3、1492R:5′-GGTTACCTTGTTACGACTT-3,购于深圳华大基因科技服务公司。葡萄糖、酪蛋白胨、酵母粉、脱脂奶粉、NaCl、琼脂、HCl、三羟甲基氨基甲烷(Tris)、L-亮氨酸对硝基苯胺,市售。
1.2 主要仪器
SW-11厌氧培养箱,上海胜卫电子科技有限公司;S-300扫描电镜,日本日立公司;A200型PCR仪,杭州朗基科学仪器有限公司;酶解罐、种子罐、发酵罐,新疆天牛乳业有限公司;H1850R高速离心机,湖南湘仪实验室仪器开发有限公司;752 N型紫外可见分光光度计,上海仪电分析仪器有限公司;LNG-UF-101超滤膜分离装置,上海朗极膜分离设备工程有限公司。
1.3 平板分离
平板分离培养基(g/L):乳糖10,酪蛋白胨10,酵母粉5,NaCl 5,琼脂18,调节pH 7.0,121 ℃灭菌15 min。用无菌生理盐水对自然发酵马奶进行梯度稀释,涂布于平板分离培养基上,37 ℃厌氧培养72 h,挑取周围有透明圈的菌落。
1.4 氨肽酶产生菌筛选
种子培养基(g/L):乳糖40,脱脂奶粉5,酪蛋白胨20,酵母粉5,调节pH 7.0,121 ℃灭菌15 min。发酵培养基同种子培养基。将上述挑取菌落的斜面菌种分别接入10 mL种子培养基,于37 ℃厌氧培养8 h,再分别接入200 mL发酵培养基,于37 ℃厌氧培养16 h。然后,测定发酵液中氨肽酶活力,优选产酶能力最强的菌株。
1.5 氨肽酶产生菌鉴定
利用普通光学显微镜和扫描电镜观察菌体形态。按照《常见细菌系统鉴定手册》和《伯杰细菌鉴定手册》(第八版)的方法[13-14],对菌种的生理生化特性进行分析。参照文献[15]的分子生物学鉴定方法,对菌种进行16S rDNA测序。将序列在NCBI中进行同源性检索,利用MEGA7.0软件以Neighbor-joining法构建系统发育树。
1.6 发酵产酶条件的优化
用20 kDa超滤膜浓缩脱脂牛乳至一半体积,按蛋白质含量加入5 000 U/g风味蛋白酶,于55 ℃下进行酶解3 h,升温至90 ℃灭酶。将5 L牛乳酶解液放入锥形瓶,于105 ℃灭菌10 min,冷却后,接入氨肽酶产生菌的斜面菌种,于37 ℃下培养8 h,作为发酵种子液。将100 L牛乳酶解液放入发酵罐,于105 ℃灭菌10 min,冷却后,接入上述种子液,分别在不同温度下和不同初始pH的条件下进行氨肽酶发酵,优选最佳的发酵产酶条件。
1.7 发酵脱苦时间的优化
在最佳温度和初始pH条件下进行发酵,从发酵9 h开始,每隔3 h取样评价苦味强度,优选最佳的脱苦时间。
1.8 氨肽酶测定方法
采用LNA法测定粗酶液的酶活力[16]。测定前,配制一系列对硝基苯胺的标准溶液,在405 nm下测定吸光度,绘制标准曲线。将发酵液于8 000 r/min、4 ℃的条件下离心15 min,收集上清液,即为粗酶液。在具塞试管中,依次加入Tris-HC1缓冲溶液、L-亮氨酸对硝基苯胺和粗酶液,在40 ℃水浴反应10 min,用30%乙酸终止反应,在405 nm波长下测定吸光度,根据标准曲线的回归方程计算酶活力。酶活力定义:在40 ℃的条件下,1 min分解L-亮氨酸对硝基苯胺产生1 nmol对硝基苯胺所需的酶量即为1个酶活力单位。
1.9 苦味强度评价方法
将不同发酵时间的发酵液与等体积纯净水混匀,用360 Da超滤膜进行浓缩至一半体积,收集浓缩液,用于苦味强度评价。参照文献[17]的苦味评价方法,以0.5×10-2、0.5×10-3、0.5×10-4、0.5×10-5、0.5×10-6 g/L的硫酸奎宁溶液为苦味强度参照物,分别对应5个苦味强度级别:强、较强、中、弱、无,由11名人员组成的小组进行感官评价。
2 结果与分析
2.1 菌种筛选
从分离平板上挑取126个周边有透明圈的菌落,经过氨肽酶发酵筛选,发酵16 h的氨肽酶活力分布于302~1 962 U/mL。发酵液中氨肽酶活力最强的10个菌株产酶情况如图1所示,其中,菌种KM-022发酵液的酶活力最高,与有关文献报道的德氏乳杆菌保加利亚亚种、乳酸乳球菌等乳酸菌相比[18-19],属于产酶能力较强的氨肽酶产生菌,故优选为进一步实验的研究菌种。

图1 十株菌发酵液中的酶活力
Fig.1 Enzyme actiity in fermentation broth of 10 strains
2.2 菌种鉴定
经革兰氏染色与显微镜观察,菌种KM-022的菌体形态呈球形,是革兰氏阳性菌。在扫描电镜下观察,菌体的呈现形式主要是2个卵圆形菌体连成的长链,长度约为1.0~1.4 μm(图2)。

图2 菌种KM-022的电子显微镜扫描结果
Fig.2 Scanning electron microscope result of strain KM-022
菌种KM-022的生理生化试验结果如表1所示,该菌种具有耐热性能,能够在15~45 ℃生长,其明胶液化试验为阳性,表明能够产生蛋白酶。
表1 菌种KM-022生理生化试验结果
Table 1 Physiological and biochemical test results of strain KM-022

试验项目结果15 ℃生长+45 ℃生长+pH 4.5生长+pH 9.6生长+明胶液化试验+乙酰基甲醇试验+硝酸盐还原试验-葡萄糖产酸+葡萄糖产气-H2S产生试验-阿拉伯糖发酵-果糖发酵+蔗糖发酵+麦芽糖发酵-乳糖发酵+柠檬酸盐利用+
经测序,16S rDNA序列为1 539 bp,在NCBI中Blast比较后,发现该菌种与嗜热链球菌(Streptococcus thermophilus)的许多菌种序列同源性达到99%以上,采用MEGA10的Neighbor-joining法构建系统发育树,如图3所示。
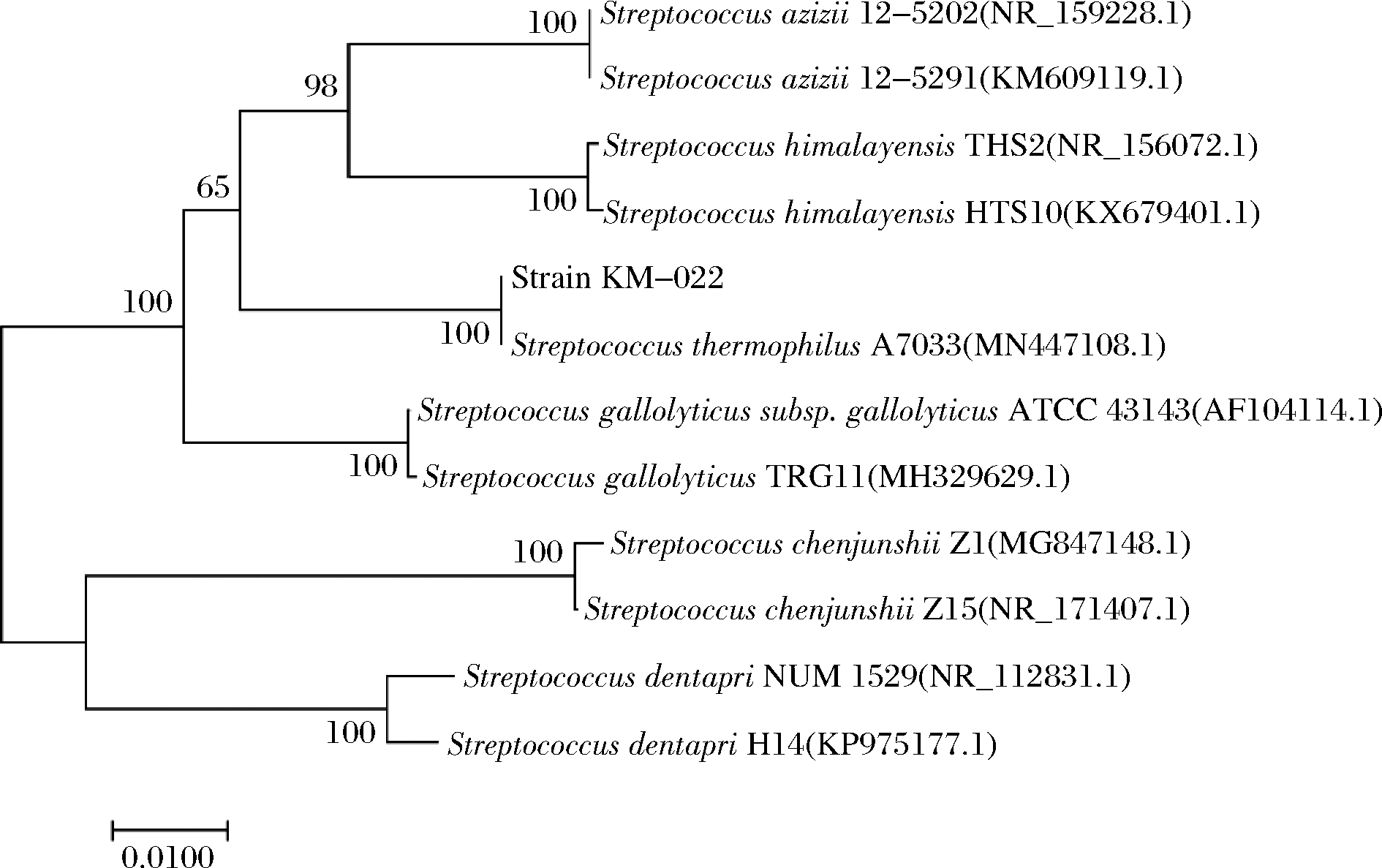
图3 菌种KM-022的系统发育树
Fig.3 Phylogenetic tree of strain KM-022
菌种KM-022与菌株Streptococcus thermophilus A7033(登录号:MN447108.1)遗传距离最近,结合形态观察和生理生化试验,菌种KM-022被鉴定为嗜热链球菌(S. thermophilus)。研究表明,嗜热链球菌可产生包括氨肽酶T、氨肽酶N、氨肽酶C、Xaa-Pro氨肽酶、三肽氨肽酶、谷酰基氨肽酶、蛋氨酸氨肽酶等氨肽酶[20],已有多个氨肽酶基因被克隆和研究,包括pepN、pepC、pepS等基因序列,通过转录组和蛋白质组学方法研究,表明嗜热链球菌生长后期上调表达的蛋白质有肽类与氨基酸运载体及特定氨基酸合成[21-22],这与菌种KM-022具有氨肽酶产生能力的性质是一致的。
2.3 温度对产酶的影响
在初始pH 7.0和不同温度下,嗜热链球菌KM-022产氨肽酶的结果如图4所示。分别在37、40、43 ℃的条件下进行发酵,发酵液中酶活力最大值均出现在18 h,分别为2 097、2 416、2 203 U/mL,随后呈下降趋势。在40 ℃下发酵的酶活力最高,故嗜热链球菌KM-022氨肽酶发酵最适温度优选为40 ℃。其最适产酶温度与该菌种以及文献报道的其他菌株的最适生长温度是一致的[23-24],表明该菌种在生长和发酵过程中均有较好的耐热性能。
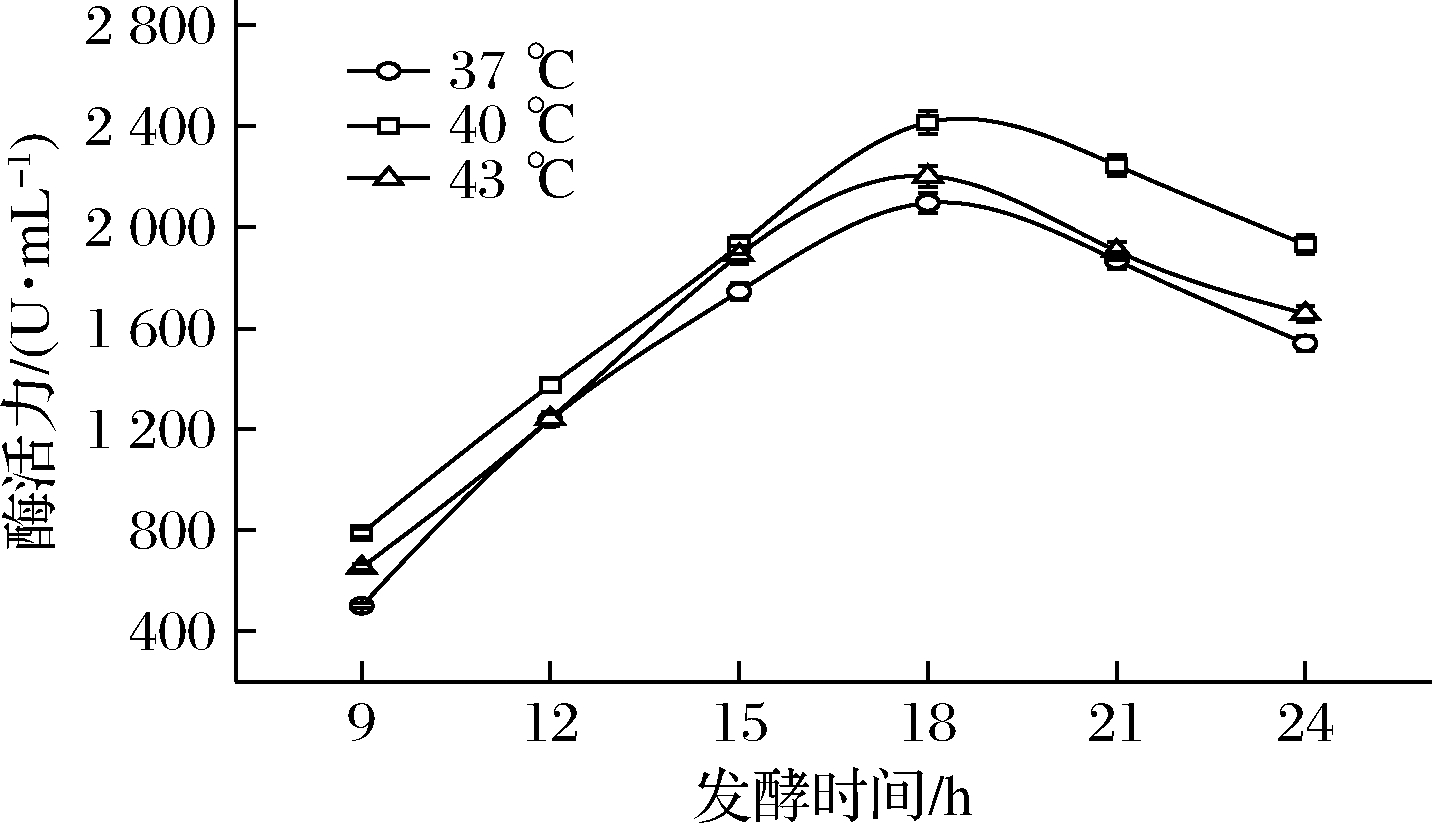
图4 温度对产酶的影响
Fig.4 Influence of temperature on enzyme production
2.4 初始pH对产酶的影响
在不同初始pH和40 ℃下,嗜热链球菌KM-022产氨肽酶的结果如图5所示。分别在初始pH 6.5、7.0、7.5下进行发酵,发酵液中酶活力最大值分别出现在18、18、21 h,分别为2 135、2 416、2 197 U/mL,随后呈下降趋势。在初始pH 7.0下发酵的酶活力最高,故嗜热链球菌KM-022氨肽酶发酵最适初始pH优选为7.0。

图5 初始pH对产酶的影响
Fig.5 Effect of initial pH on enzyme production
2.5 时间对短肽脱苦的影响
在初始pH 7.0和40 ℃下,嗜热链球菌KM-022发酵脱苦的结果如表2所示。在产酶以后,产酶和酶解作用是同步的,随着发酵产酶和氨肽酶酶解作用的进行,发酵液的苦味强度逐渐减弱,发酵21 h的苦味基本消失。该条件下发酵液最高酶活力出现在18 h,脱苦效果仅延迟3 h,表明该菌种对牛乳酶解液的发酵脱苦效果良好。
表2 发酵浓缩液的苦味强度变化
Table 2 Bitterness intensity of concentrated fermented liquid
时间/h091215182124苦味强度中中中弱弱无无
3 结论
从自然发酵马奶中分离得到126株氨肽酶产生菌株,经产酶发酵筛选,确定菌种KM-022产酶能力最强。经菌体形态观察、生理生化试验和16S rDNA分子鉴定,菌种KM-022被鉴定为嗜热链球菌,属于我国可用于食品的微生物菌种。利用脱脂牛乳的酶解液为基质进行氨肽酶发酵,产酶的最佳温度和初始pH分别为40 ℃和7.0。在最佳温度和初始pH的条件下,嗜热链球菌KM-022发酵18 h的氨肽酶酶活力达到最大值2 416 U/mL,发酵21 h苦味基本消失。该菌种对乳肽的发酵脱苦效果明显,具有生产应用潜力。
[1] 张传好, 郭杰夫, 李海涛, 等.小分子肽的研究进展及应用情况[J].化学试剂, 2015, 37(8):707-710.
ZHANG C H, GUO J F, LI H T, et al.Progress and application of small molecular peptides[J].Chemical Reagents, 2015, 37(8):707-710.
[2] GARDNER M L G.Absorption of intact peptides:Studies on transport of protein digests and dipeptides across rat small intestine in itro[J].Quarterly Journal of Experimental Physiology, 1982, 67(4):629-637.
[3] GANAPATHY , LEIBACH F H.Role of pH gradient and membrane potential in dipeptide transport in intestinal and renal brush-border membrane esicles from the rabbit.Studies with L-carnosine and glycyl-L-proline[J].Journal of Biological Chemistry, 1983, 258(23):14 189-14 192.
[4] 邹媛婷, 张健, 王共明, 等.生物活性肽在特殊医学用途配方食品中的应用研究进展[J].食品与发酵工业, 2022,48(17):336-344.
ZOU Y T,ZHANG J,WANG G M, et al.Research progress on the application of bioactie peptides in Food for Special Medical Purpose[J].Food and Fermentation Industries, 2022,48(17):336-344.
[5] 于洋, 祁艳霞, 靳艳.乳源生物活性肽研究进展[J].食品与发酵工业, 2017, 43(9):259-266.
YU Y, QI Y X, JIN Y.Milk-deried bioactie peptides:A reiew[J].Food and Fermentation Industries, 2017, 43(9):259-266.
[6] 赵烜影, 刘振民, 雍靖怡, 等.乳源生物活性肽研究进展[J].乳业科学与技术, 2021, 44(6):51-57.
ZHAO X Y, LIU Z M, YONG J Y, et al.Progress in research on milk-deried bioactie peptides[J].Journal of Dairy Science and Technology, 2021, 44(6):51-57.
[7] 赵家龙, 桂德芳.乳源生物活性肽的研究进展[J].当代畜牧, 2019(3):30-32.
ZHAO J L, GUI D F.Adances in bioactie peptides deried from milk[J].Contemporary Animal Husbandry, 2019, 3:30-32.
[8] NAGPAL R, BEHARE P, RANA R, et al.Bioactie peptides deried from milk proteins and their health beneficial potentials:An update[J].Food & Function, 2011, 2(1):18-27.
[9] KILARA A, PANYAM D.Peptides from milk proteins and their properties[J].Critical Reiews in Food Science and Nutrition, 2003, 43(6):607-633.
[10] 吕锦弟, 张珍, 张盛贵, 等.酪蛋白磷酸肽脱苦工艺研究[J].食品与发酵科技, 2017, 53(3):55-60.
LYU J D, ZHANG Z, ZHANG S G, et al.Study on the extraction of casein phosphopeptides[J].Food and Fermentation Sciences & Technology, 2017, 53(3):55-60.
[11] 耿瑞蝶, 王金水.呈味氨基酸和肽对发酵食品中风味的作用[J].中国调味品, 2019, 44(7):176-178;183.
GENG R D, WANG J S.Effect of flaored amino acids and peptides on the flaor of fermented foods[J].China Condiment, 2019, 44(7):176-178;183.
[12] 王丹, 邵景海, 李凯锋, 等.响应面法优化酸奶粉的发酵工艺[J].食品工业, 2022, 43(1):109-112.
WANG D, SHAO J H, LI K F, et al.Response surface methodology to optimize the fermentation process of yogurt powder[J].The Food Industry, 2022, 43(1):109-112.
[13] 东秀珠, 蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社, 2001.
DONG X Z, CAI M Y.Handbook of Systematic Identification of Common Bacteria[M].Beijing:Science Press, 2001.
[14] R.E布坎南, N.E.吉本斯.伯杰细菌鉴定手册[M].第八版.北京:科学出版社, 1984.
BUCHANAN R E, GIBBONSN E.Bergey’s Manual of Systematic Bacteriology[M].9th ed.Beijing:Science Press, 1984.
[15] LI J, WANG Y, ZHOU W, et al.Characterization of a new biosurfactant produced by an effectie pyrene-degrading Achromobacter species strain AC15[J].International Biodeterioration & Biodegradation, 2020, 152:104959.
[16] 田亚平, 须瑛敏.一种枯草芽孢杆菌氨肽酶的纯化及酶学性质[J].食品与发酵工业, 2006, 32(3):7-10.
TIAN Y P, XU Y M.Purification and characteristic of a kind of aminopeptidase from Bacillus subtilis[J].Food and Fermentation Industries, 2006, 32(3):7-10.
[17] 李静, 邓毛程, 陆志鸿, 等.氨肽酶对罗非鱼下脚料水解液脱苦的研究[J].食品研究与开发, 2014, 35(21):112-116.
LI J, DENG M C, LU Z H, et al.Research on the remoal of bitter of protein hydrolysates of tilapia by-product by aminopeptidase[J].Food Research and Deelopment, 2014, 35(21):112-116.
[18] 陈嘉琪, 崔树茂, 唐鑫, 等.德式乳杆菌保加利亚亚种的乳清蛋白利用能力比较[J].食品与发酵工业, 2020, 46(7):28-34.
CHEN J Q, CUI S M, TANG X, et al.Comparison of whey protein hydrolytic ability of Lactobacillus delbrueckii subsp.bulgaricus[J].Food and Fermentation Industries, 2020, 46(7):28-34.
[19] 陈森怡, 刘振民, 焦晶凯, 等.干酪用乳酸菌的特性比较及新鲜干酪的制作[J].食品科学, 2020, 41(22):112-118.
CHEN S Y, LIU Z M, JIAO J K, et al.Comparison of characteristics of lactic acid bacteria as starter cultures for cheese and application in fresh cheese production[J].Food Science, 2020, 41(22):112-118.
[20] 李柏良, 丁秀云, 靳妲, 等.基于基因组学分析嗜热链球菌KLDS SM的蛋白质水解系统和氨基酸合成途径[J].食品科学, 2018, 39(18):120-126.
LI B L, DING X Y, JIN D, et al.Genomic studies of proteolysis system and amino acid biosynthesis pathway in Streptococcus thermophilus KLDS SM[J].Food Science, 2018, 39(18):120-126.
[21] DANDOY D, FREMAUX C, DE FRAHAN M H, et al.The fast milk acidifying phenotype of Streptococcus thermophilus can be acquired by natural transformation of the genomic island encoding the cell-enelope proteinase PrtS[J].Microbial Cell Factories, 2011, 10(Suppl 1):S21.
[22] 田辉, 梁宏彰, 霍贵成, 等.嗜热链球菌的特性与应用研究进展[J].生物技术通报, 2015, 31(9):38-48.
TIAN H, LIANG H Z, HUO G C, et al.Research progress on the property and application of Streptococcus thermophilus[J].Biotechnology Bulletin, 2015, 31(9):38-48.
[23] 刘冬梅, 胡金双, 黄泳尧, 等.中国传统发酵乳中嗜热链球菌H2的培养及益生特性评价[J].华南理工大学学报(自然科学版), 2020, 48(9):133-140;148.
LIU D M, HU J S, HUANG Y Y, et al.Cultiation of Streptococcus thermophilus H2 and the ealuation on its prebiotic properties in Chinese traditional fermented milk[J].Journal of South China Uniersity of Technology (Natural Science Edition), 2020, 48(9):133-140;148.
[24] 官雪芳, 郑怡, 徐庆贤, 等.一株酸奶发酵嗜热链球菌的筛选及特性研究[J].西北农业学报, 2018, 27(1):124-130.
GUAN X F, ZHENG Y, XU Q X, et al.Identification and characterization of a Streptococcus thermophilus strain for yogurt fermentation[J].Acta Agriculturae Boreali-Occidentalis Sinica, 2018, 27(1):124-130.