杆菌肽是由地衣芽胞杆菌等菌株通过非核糖体合成酶系合成的环肽分子[1],包含Orn、His、Cys、Leu等11种氨基酸[2],杆菌肽能抑制细菌细胞壁的合成,对革兰氏阳性菌和部分革兰氏阴性菌有抑制作用[3]。其在动物肠道内稳定性好、安全性高、吸收率低等优点,因而广泛用于动物疾病的防治[4]。
杆菌肽合成需要提供能量和前体氨基酸,刘铁军等[5]发现地衣芽胞杆菌细胞对数生长时消耗大量的葡萄糖,从而产生分解代谢产物阻遏(carbon catabolite repression, CCR)效应[6],抑制杆菌肽的合成,维持初级代谢强度可以满足产物合成期对能量和前体氨基酸的需求。分解代谢物调控蛋白CcpA是枯草芽胞杆菌中介导CCR效应的全局调控因子,CcpA蛋白与辅助蛋白HPr/Crh-Ser46-P形成复合物,作用于靶基因的分解代谢物响应元件,抑制或激活靶基因的转录[7]。张清等[8]在地衣芽胞杆菌基因cydB(编码细胞色素bd泛醇氧化酶)缺失的基础上整合表达qoxA(编码细胞色素aa3氧化酶)和dck(编码腺苷激酶DcK),使菌体胞内ATP浓度提高了49.32%,杆菌肽效价提高21.66%。李阳等[9]敲除地衣芽胞杆菌yhdG基因(编码氨基酸转运蛋白YhdG),显著提高了胞内氨基酸含量,且与原始菌株相比杆菌肽效价提高了11%。
枯草芽胞杆菌的CcpN蛋白调控糖异生途径的运转效率,其对数期阻遏gapB(编码3-磷酸甘油醛脱氢酶)和pckA(编码磷酸烯醇式丙酮酸羧激酶,消耗GTP)的表达[10]。敲除ccpN后细胞对数期会在草酰乙酸-磷酸烯醇式丙酮酸-丙酮酸之间产生耗能循环,菌体糖耗和生长速率降低。但是地衣芽胞杆菌敲除ccpN对细胞生长、杆菌肽合成代谢(包括溢流代谢、氨基酸代谢与转运、能量代谢等)的调控细节尚有待进一步阐明。
地衣芽胞杆菌DW2生长、杆菌肽合成代谢在能量及前体利用方面存在竞争关系,为了提高对数期杆菌肽的合成效率,在20 L发酵罐水平研究了地衣芽胞杆菌DW2和DW2ΔccpN发酵期间细胞生长速率、糖耗速率、胞外氨基酸浓度以及溢流代谢[11]和杆菌肽合成代谢差异,并基于转录组数据,分析了对数期与能量代谢、氨基酸转运以及丙酮酸转化相关的13个基因转录组表达的差异,为地衣芽胞杆菌DW2发酵生产杆菌肽提供有效的思路和策略。
1 材料和方法
1.1 菌株和培养基
地衣芽胞杆菌(Bacillus licheniformis)DW2,地衣芽胞杆菌(Bacillus licheniformis)DW2ΔccpN,湖北大学绿康生物工程研究所。
平板、茄子瓶斜面培养基(g/L):酵母浸膏20,NaCl 5,琼脂20,调pH 7.5。
发酵培养基(g/L):豆粕85,玉米淀粉40,玉米浆10,轻质CaCO3 6,蛋白胨20,(NH4)2SO4 1.0,MgSO4·7H2O 1.0。
1.2 主要试剂与仪器
细胞总RNA提取试剂盒(带gDNA清除柱),成都福际生物技术有限公司;高灵敏性染料法定量PCR检测试剂盒,南京诺唯赞生物科技股份有限公司;PrimeScriptTM Ⅱ 1st Strand cDNA Synthesis Kit,TaKaRa公司;H2O2含量检测试剂盒,北京索莱宝科技有限公司;玉米淀粉、豆粕粉、玉米浆,福建浦城绿康生化有限公司;其他试剂均为分析纯,国药化学试剂有限公司。
20 L发酵罐,上海保兴生物设备有限公司;Thermal Cycler PCR仪、Uniersal Hood 凝胶成像系统、荧光定量PCR仪,Bio-Rad(美国);U3000高效液相色谱仪,赛默飞世尔科技有限公司;7890B气相色谱仪(配氢火焰离子化FID检测器), 美国Agilent公司。
1.3 培养方法
1.3.1 平板种子活化
取-80 ℃甘油管中的菌液200 μL于平板均匀涂布,37 ℃培养24 h。
1.3.2 茄子瓶种子培养
用无菌接种环刮取培养后平板菌苔,均匀涂抹至茄子瓶斜面后,37 ℃培养24 h。准备好无菌竹签和60 mL无菌水,用竹签和无菌水刮洗长满菌苔的茄子瓶斜面,得到种子液。
1.3.3 20 L发酵罐培养
20 L发酵罐装液量为12 L,接种量为一个茄子瓶斜面刮洗的菌悬液60 mL。发酵条件:初始通风量1.2 m3/h,转速500 r/min,发酵24 h后调至1.6 m3/h,转速900 r/min,培养温度37 ℃。由于分批发酵中,22 h的细胞数是峰值细胞数的1/3左右;杆菌肽效价为峰值效价的1/10左右,因而22 h后细胞仍然处于对数生长前期、杆菌肽合成的主合成期也在22 h之后(资料未显示),22 h开始取样可以反映出细胞生长代谢过程的特征信息,因而以发酵22 h作为周期取样分析的起点。
1.4 分析方法
1.4.1 生物量的测定
发酵液中细胞数(CFU/mL)采用稀释涂布平板法测定。
1.4.2 葡萄糖的测定
参考文献[12],用DNS法测定葡萄糖的含量。
1.4.3 杆菌肽效价测定
参考文献[13],采用高效液相色谱仪进行杆菌肽效价测定。
1.4.4 有机酸的测定
参考文献[13],采用气相色谱仪,氢火焰离子化FID检测器,进行挥发性有机酸含量测定。
1.4.5 胞外氨基酸的测定
参考文献[14],采用茚三酮法测定胞外氨基酸。
1.4.6 转录组样品制备与数据分析
选定对数生长中期作为取样点,分别对DW2和DW2ΔccpN菌株于20 L发酵罐培养至对数中期,取20 mL发酵液至50 mL离心管中,4 ℃、1 500 r/min离心5 min后初步除去浊液培养基里的不溶物质(花生饼粉、豆粕等),4 ℃、2 500 r/min离心5 min再次离去不溶性杂质。取上层液体4 ℃、12 000 r/min离心2 min。此时EP管内分3层,上层清液弃置,中层杂质用200 μL枪头吸取4 ℃无菌生理盐水轻柔吹打后弃置,留最下层菌体沉淀。菌体保存于-80 ℃冰箱中待转录组测定。转录组测序由上海美吉生物医药科技有限公司完成。转录表达定量分析指标TPM(transcripts per million reads)按照公式(1)计算:
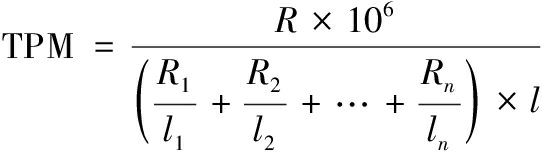
(1)
式中:R和l,需计算基因的read counts和基因长度,Ri和li(i=1,2…,n), 样品中第i个基因的read counts和基因长度。
1.5 统计分析
试验数据为3个平行试验的平均值,用平均值±标准差表示。采用Origin 9.0和SPSS 23.0进行数据处理和分析。其中*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。
2 结果与分析
2.1 地衣芽胞杆菌DW2发酵过程参数变化
如图1-a所示,杆菌肽效价在发酵22~36 h一直处于上升状态,22 h的起步效价为108 U/mL,一直合成至36 h效价到达峰值1 024 U/mL,平均杆菌肽合成效率为65.43 U/(mL·h)。菌体对数生长至30 h时,菌体量到达高点5.56×1010 CFU/mL,30 h后菌体自溶。发酵过程中22 h的残糖量为7.42 g/L,22~36 h葡萄糖基本耗完,36 h的残糖量为3.27 g/L,平均糖耗速率为0.3 g/(L·h)。胞外氨基酸含量由22 h的43.8 mmol/L逐渐上升为36 h的131.5 mmol/L,说明发酵过程中豆粕分解较充分。
芽胞杆菌高糖浓度生长会发生溢流代谢[15],图1-a中,发酵至22 h时基料的碳源已消耗83%,而且22 h后乙酸等溢流分子处于被利用状态,说明此时细胞的CCR效应已消除,原受CcpA-Hpr-Ser复合物阻遏的基因脱阻遏表达,包括乙酸在内的溢流分子被利用,这与SCHUMACHER等[7]的报道一致。

a-生物量、杆菌肽效价、葡萄糖、氨基酸;b-有机酸
图1 地衣芽胞杆菌DW2发酵过程中效价、葡萄糖、 氨基酸、生物量和有机酸含量
Fig.1 Changes in bacitracin titers, glucose, amino acids, biomass and organic acids content during fermentation of Bacillus licheniformis DW2
碳源浓度高时芽胞杆菌的碳代谢会引起蛋白酶表达系统的阻遏[16],随着发酵的进行碳源逐渐被消耗,蛋白酶的表达活性逐渐增强,因此氨基酸的含量上升(图1-a)。另外,22 h及之后溢流分子处于被利用状态,此时CCR效应消失而细胞仍处于对数生长状态(图1-a),说明细胞可能启动了糖异生过程并通过磷酸烯醇式丙酮酸羧激酶消耗GTP[10],而GTP浓度降低亦会降低CodY的阻遏活性,使蛋白酶基因和氨基酸转运基因脱阻遏表达[17],这也会导致氨基酸浓度上升。
如图1-b所示,乙酸、异戊酸和异丁酸在发酵22 h的质量浓度分别为2.69、0.9、1.3 g/L,之后处于被利用状态。而乙偶姻在27 h积累到1.45 g/L,随后被消耗。其中乙偶姻、异戊酸和异丁酸都在30 h耗完。乙酸质量浓度在30 h后一直低位维持在0.7 g/L。
2.2 地衣芽胞杆菌DW2ΔccpN发酵过程参数变化
如图2-a所示,杆菌肽22 h的起步效价为276.6 U/mL,至36 h效价到达峰值1 337 U/mL,比DW2峰值效价提高了30.6%,平均杆菌肽合成效率为75.74 U/(mL·h)。菌体对数生长至30 h到达高点(生物量3.39×1010 CFU/mL),但只有DW2的61%,这和T NNLER等[10]发现菌体生长速率减半的现象吻合,30 h后菌体依然会自溶,但30~33 h效价合成效率最高。22 h的残糖量为9.3 g/L,比DW2发酵22 h时多出25.3%。菌株DW2ΔccpN胞外氨基酸含量由22 h的63 mmol/L逐渐上升至36 h的158.3 mmol/L,发酵周期内胞外氨基酸含量比DW2提高20.38%~43.8%。这与CAI等[18]发现敲除ccpN能提高ATP和NADPH的供应从而使氨基酸的供应量增加的报道一致。
NNLER等[10]发现菌体生长速率减半的现象吻合,30 h后菌体依然会自溶,但30~33 h效价合成效率最高。22 h的残糖量为9.3 g/L,比DW2发酵22 h时多出25.3%。菌株DW2ΔccpN胞外氨基酸含量由22 h的63 mmol/L逐渐上升至36 h的158.3 mmol/L,发酵周期内胞外氨基酸含量比DW2提高20.38%~43.8%。这与CAI等[18]发现敲除ccpN能提高ATP和NADPH的供应从而使氨基酸的供应量增加的报道一致。
菌株DW2ΔccpN溢流代谢产酸变化趋势如图2-b所示。乙酸、异戊酸和异丁酸在22 h的浓度分别为2.4、1.33、2.43 g/L,乙偶姻在27 h积累到2.88 g/L。随后,乙偶姻、异戊酸和异丁酸在33 h耗完,乙酸在22~33 h被消耗,33 h后乙酸浓度一直低位维持在0.64 g/L。由于CcpA的调控效应,两菌株都会产生溢流代谢[19],但菌株DW2ΔccpN溢流有机酸总量(22~27 h)比对照DW2高24.7%~37.6%,说明菌株DW2ΔccpN在培养条件下,CcpA的调控活性远高于DW2,这可能与ccpN敲除后对数期细胞存在的草酰乙酸-磷酸烯醇式丙酮酸-丙酮酸耗能循环[10]有关。

a-生物量、杆菌肽效价、葡萄糖、氨基酸;b-有机酸含量
图2 地衣芽胞杆菌DW2ΔccpN发酵过程中效价、 葡萄糖、氨基酸、生物量和有机酸含量
Fig.2 Changes in bacitracin titers, glucose, amino acids, biomass and organic acids content during fermentation of B.licheniformis DW2ΔccpN
2.3 能量代谢相关基因转录组表达差异分析
敲除ccpN有效降低了菌体生长,并提高了杆菌肽产量(图2-a)。杆菌肽合成以及前体氨基酸活化均需要消耗ATP,因而,能量供应对其影响很大。刘钊远[20]在地衣芽胞杆菌中过表达基因icd(编码异柠檬酸脱氢酶),显著提升了ATP、NADPH和氨基酸的供应,进而提高了杆菌肽产量。在细胞对数生长中期比较了DW2和DW2ΔccpN能量代谢相关基因(citZ、icd、zwf、cydA)的转录表达量差异,如图3所示。
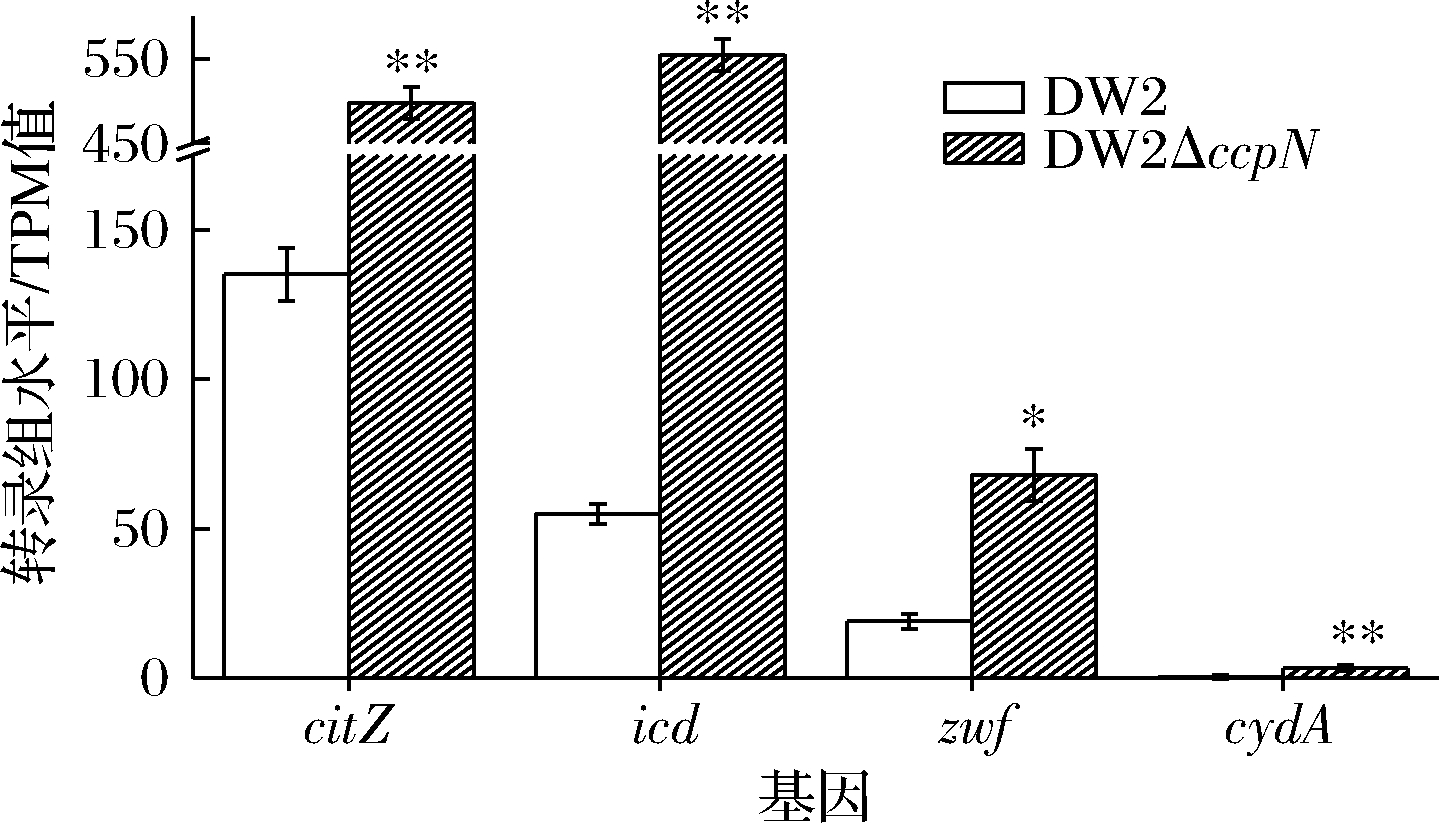
图3 能量代谢相关基因转录组表达差异
Fig.3 Differences in transcriptome expression of genes related to energy metabolism
citZ参与编码柠檬酸合酶,催化草酰乙酸和乙酰辅酶A缩合生成柠檬酸,是三羧酸(tricarboxylic acid,TCA)循环的关键限速酶之一;icd参与编码异柠檬酸脱氢酶,也是TCA循环的限速酶之一。DW2ΔccpN中citZ和icd的转录表达量分别是DW2的3.7倍和10.1倍,说明敲除ccpN能增加TCA循环通量,从而提高杆菌肽产量。zwf编码的葡萄糖-6-磷酸脱氢酶是磷酸戊糖途径关键酶,可催化生成5-磷酸核糖和NADPH等,为细胞生长提供重要碳骨架和还原力。ZHU等[21]通过过表达zwf增强了NADPH供应,提高了杆菌肽的产量。DW2ΔccpN中zwf转录表达量是DW2的3.6倍,说明敲除ccpN能供应更多的NADPH促进杆菌肽的合成。cydA参与编码电子传递链中细胞色素a氧化酶,DW2ΔccpN菌株中cydA的转录表达量是DW2的8.3倍,表明敲除ccpN使菌体有氧呼吸能力更强,可供应更多的ATP。
2.4 氨基酸转运蛋白相关基因转录组表达差异分析
氨基酸利用效率是杆菌肽合成的重要因素之一,杆菌肽合成代谢既需要碳源和有氧呼吸供应能量,又需要氮源分解的氨基酸为其合成供应前体[22]。增强前体的供应是常用的策略之一,ZHU等[23]通过强化表达支链氨基酸(branched chain amino acid,BCAA)转运蛋白brnQ能促进了BCAA的胞内积累和杆菌肽合成。由于22 h后发酵液中氨基酸才出现大量积累的现象,而且DW2ΔccpN菌株杆菌肽合成效率远高于DW2菌株(图1、图2),这可能与前期氨基酸不足或氨基酸转运效率低有关。因而对相关基因(codY、relA、brnQ、pr、ybW)的转录表达差异进行了对比,如图4所示。

图4 氨基酸转运相关基因转录组表达差异
Fig.4 Differences in transcriptome expression of genes related to amino acidstransport
CodY是芽胞杆菌氮代谢调控因子,活性CodY能阻遏BCAA合成基因的表达[18]。其调控机制是通过感知胞内GTP和BCAA浓度变化做出响应,当胞内GTP和BCAA含量较低时,CodY作为DNA结合蛋白便会失去活性[24]。如图4所示,DW2ΔccpN中codY、brnQ(编码BCAA转运蛋白)、pr(编码丝氨酸蛋白酶)和ybW(编码通用氨基酸转运酶)的转录表达量分别是DW2的9.9、4.9、8.2和11.2倍。说明敲除ccpN提高了菌体氮源分解及氨基酸转运的能力,充分满足了杆菌肽合成过程前体氨基酸的供应,对于提升杆菌肽效价起到了重要的作用。这也与菌株DW2ΔccpN胞外氨基酸(22~36 h)浓度比DW2提高20.4%~43.8%的结果相一致(图1、图2)。
但是DW2ΔccpN菌株在codY高表达的情况下,氨基酸转运基因(brnQ和ybW)仍然显著高表达,说明CodY对brnQ和ybW表达的阻遏活性较低。这与relA高水平表达(比DW2提高2.0倍,图4)有关。因为relA编码的RelA蛋白消耗GTP生成鸟苷四磷酸[25],进而降低CodY的调控活性、干扰RNA的正确加工、降低生长速率、引发细胞的严谨响应。这与DW2ΔccpN对数生长细胞数只有DW2的61%是一致的。
2.5 丙酮酸转化途径相关基因和hprK转录组表达差异分析
CcpN调控保证了对数期细胞不会启动糖异生途径,但是T NNLER等[10]发现枯草芽胞杆菌ccpN敲除后,pckA在对数期脱阻遏表达(即细胞启动了糖异生途径),同时降低了菌体糖耗和生长速率,对碳代谢产生重大影响。因而探究与丙酮酸代途径的相关基因(pycA、pckA、pyk)以及hprK的转录表达差异,结果如图5所示。
NNLER等[10]发现枯草芽胞杆菌ccpN敲除后,pckA在对数期脱阻遏表达(即细胞启动了糖异生途径),同时降低了菌体糖耗和生长速率,对碳代谢产生重大影响。因而探究与丙酮酸代途径的相关基因(pycA、pckA、pyk)以及hprK的转录表达差异,结果如图5所示。
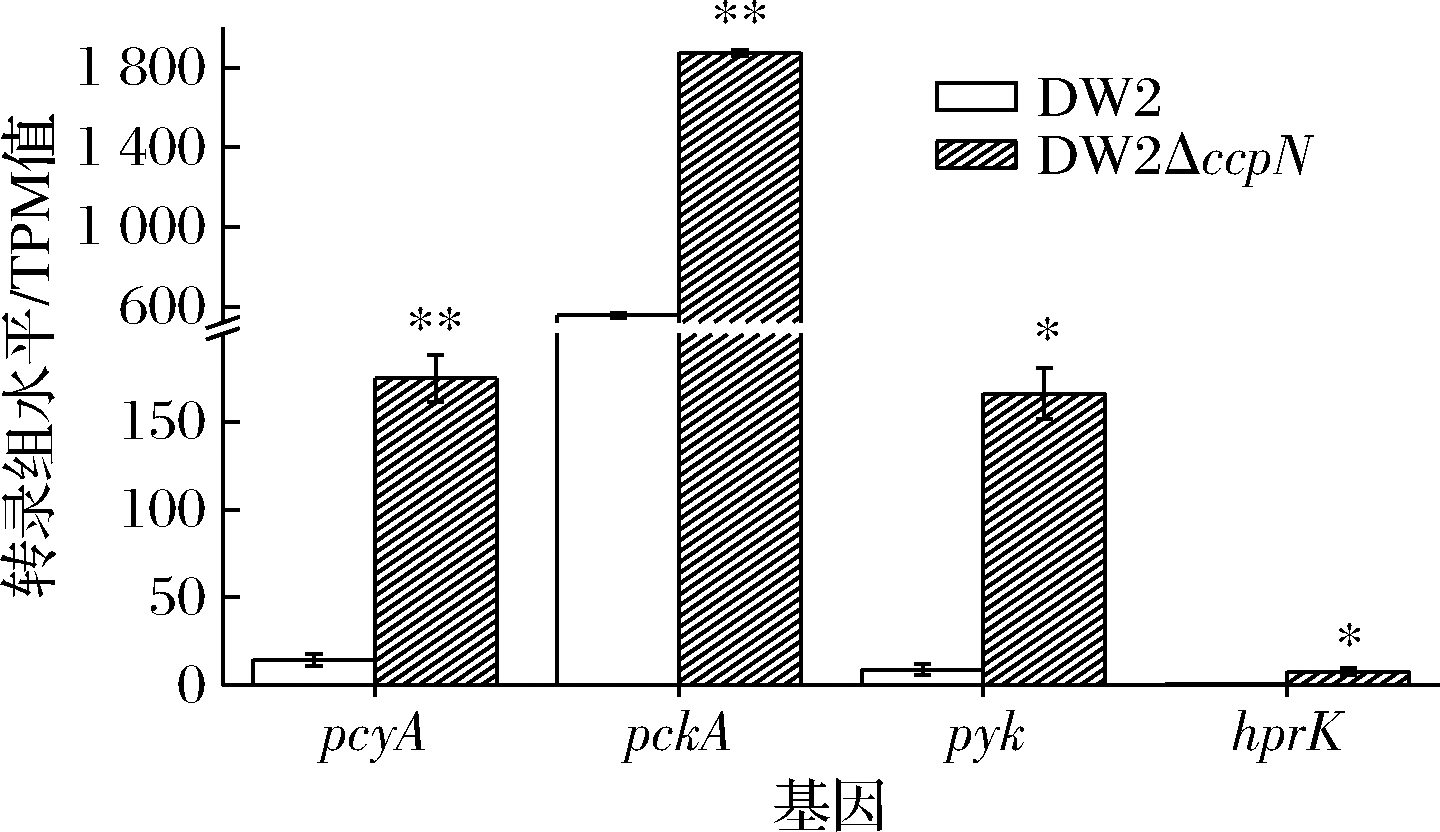
图5 丙酮酸转化途径相关基因转录组表达差异
Fig.5 Differences in transcriptome expression of genes related to the pyruate conersion pathway
pycA参与编码丙酮酸羧化酶,消耗ATP催化丙酮酸为草酰乙酸。DW2ΔccpN中pycA转录表达量是DW2的12.0倍,说明ccpN敲除后丙酮酸转化能力更强,这与T NNLER等[10]ccpN敲除菌株的报道一致。pckA参与编码磷酸烯醇式丙酮酸羧激酶,消耗ATP/GTP催化草酰乙酸转化为糖酵解途径(Embden Meyerhof pathway,EMP)磷酸烯醇式丙酮酸。DW2ΔccpN中pckA的转录表达量是DW2的3.4倍。CcpN在对数期阻遏pckA表达,ccpN敲除后pckA表达在对数期即脱阻遏而表达。pyk编码丙酮酸激酶,催化磷酸烯醇式丙酮酸转化为丙酮酸,DW2ΔccpN中pyk的转录表达量是DW2的18.4倍。
NNLER等[10]ccpN敲除菌株的报道一致。pckA参与编码磷酸烯醇式丙酮酸羧激酶,消耗ATP/GTP催化草酰乙酸转化为糖酵解途径(Embden Meyerhof pathway,EMP)磷酸烯醇式丙酮酸。DW2ΔccpN中pckA的转录表达量是DW2的3.4倍。CcpN在对数期阻遏pckA表达,ccpN敲除后pckA表达在对数期即脱阻遏而表达。pyk编码丙酮酸激酶,催化磷酸烯醇式丙酮酸转化为丙酮酸,DW2ΔccpN中pyk的转录表达量是DW2的18.4倍。
如图5所示,pycA、pckA、pyk基因在DW2ΔccpN中转录水平都比DW2高3.4~18.4倍。因而,对数期形成了草酰乙酸-磷酸烯醇式丙酮酸-丙酮酸耗能循环,并影响了菌体生长效率,这可能是DW2ΔccpN菌株生物量只有DW2菌株61%的原因。
另外,耗能循环会导致EMP途径1,6-二磷酸果糖上升[10],从而促进hprK的表达和HPrK的激酶活性、提高CcpA-(Hpr-46-Ser-P)复合体形成效率[7],从而促发CCR效应。这也是DW2ΔccpN菌株溢流代谢有机酸总量高于DW2菌株24.7%~37.6%的原因(图1、图2),菌株DW2ΔccpN中hprK的转录表达量是DW2的12.3倍支持了这一结果。
3 结论
在20 L发酵罐研究了ccpN敲除对地衣芽胞杆菌DW2细胞生长和杆菌肽合成代谢的影响,结果表明,菌株DW2ΔccpN峰值生物量仅为DW2菌株(5.56×1010 CFU/mL)的61%;胞外氨基酸(22~36 h)和溢流有机酸(22~27 h)比DW2分别提高20.4%~43.8%和24.7%~37.6%;菌株DW2ΔccpN在36 h时的峰值杆菌肽效价(1 337 U/mL)比DW2提高了30.6%。另外,敲除ccpN后,细胞对数生长期杆菌肽合成代谢相关基因转录组数据差异显著:citZ、icd、zwf、cydA转录表达分别上调3.7、10.1、3.6、8.3倍;codY、relA、brnQ、pr、ybW转录表达分别上调9.9、2.0、4.9、8.2和11.2倍;pycA、pckA、pyk、hprK转录表达分别上调12.0、3.4、18.4、12.3倍。同时ccpN敲除使地衣芽胞杆菌DW2对数期糖耗降低、溢流代谢增强,为对数后期提供了更多的碳源和能源分子。ccpN敲除使细胞严谨响应增强、CodY的调控活性下降,降低了细胞的生长速率、提高了氨基酸转运能力。同时增加了ATP和NADPH的供应,最终提高了杆菌肽的合成效率。
[1] SHU C C, WANG D, GUO J, et al.Analyzing AbrB-knockout effects through genome and transcriptome sequencing of Bacillus licheniformis DW2[J].Frontiers in Microbiology, 2018, 9:307.
[2] DRABLØS F, NICHOLSON D G, RØNNING M.EXAFS study of zinc coordination in bacitracin A[J].Biochimica et Biophysica Acta, 1999, 1431(2):433-442.
[3] HANCOCK R E.Mechanisms of action of newer antibiotics for Gram-positie pathogens[J].The Lancet.Infectious Diseases, 2005, 5(4):209-218.
[4] WANG Q, ZHENG H, WAN X, et al.Optimization of inexpensie agricultural by-products as raw materials for bacitracin production in Bacillus licheniformis DW2[J].Applied Biochemistry and Biotechnology, 2017, 183(4):1 146-1 157.
[5] 刘铁军, 吴飞.葡萄糖浓度对杆菌肽发酵过程的影响[J].医学信息(中旬刊), 2011, 24(9):4 659-4 660.
LIU T J, WU F.Effect of glucose concentration on baciartcin fermentation process[J].Medical Information, 2011, 24(9):4 659-4 660.
[6] GÖRKE B, STÜLKE J.Carbon catabolite repression in bacteria:Many ways to make the most out of nutrients[J].Nature Reiews Microbiology, 2008, 6(8):613-624.
[7] SCHUMACHER M A, SPREHE M, BARTHOLOMAE M, et al.Structures of carbon catabolite protein A-(HPr-Ser46-P) bound to dierse catabolite response element sites reeal the basis for high-affinity binding to degenerate DNA operators[J].Nucleic Acids Research, 2011, 39(7):2 931-2 942.
[8] 张清, 朱杉, 崔乃香, 等.能量代谢工程促地衣芽胞杆菌DW2高效合成杆菌肽[J].生物工程学报, 2020, 36(6):1 126-1 137.
ZHANG Q, ZHU S, CUI N X, et al.Enhanced production of bacitracin ia energy metabolism engineering in Bacillus licheniformis DW2[J].Chinese Journal of Biotechnology, 2020, 36(6):1 126-1 137.
[9] 李阳, 吴非, 蔡冬波, 等.地衣芽胞杆菌DW2中敲除氨基酸转运蛋白基因yhdG提高杆菌肽产量[J].生物工程学报, 2018, 34(6):916-927.
LI Y, WU F, CAI D B, et al.Enhanced production of bacitracin by knocking out of amino acid permease gene yhdG in Bacillus licheniformis DW2[J].Chinese Journal of Biotechnology, 2018, 34(6):916-927.
[10] T NNLER S, FISCHER E, LE COQ D, et al.CcpN controls central carbon fluxes in Bacillus subtilis[J].Journal of Bacteriology, 2008, 190(18):6 178-6 187.
NNLER S, FISCHER E, LE COQ D, et al.CcpN controls central carbon fluxes in Bacillus subtilis[J].Journal of Bacteriology, 2008, 190(18):6 178-6 187.
[11] MA W L, LIU Y F, SHIN H D, et al.Metabolic engineering of carbon oerflow metabolism of Bacillus subtilis for improed N-acetyl-glucosamine production[J].Bioresource Technology, 2018, 250:642-649.
[12] 曾新年, 鲍帅帅, 李洪杰, 等.双氧水对地衣芽胞杆菌合成杆菌肽的影响[J].中国酿造, 2013, 32(3):94-97.
ZENG X N, BAO S S, LI H J, et al.Effects of H2O2 addition on bacitracin production by Bacillus licheniformis LC-11[J].China Brewing, 2013, 32(3):94-97.
[13] 刘道奇, 陈守文, 李俊辉, 等.混合碳源对地衣芽孢杆菌发酵合成杆菌肽的影响[J].食品与发酵工业, 2017, 43(9):52-57.
LIU D Q, CHEN S W, LI J H, et al.Effects of the mixed carbon resource addition on bacitracin biosynthesis by Bacillus licheniformis[J].Food and Fermentation Industries, 2017, 43(9):52-57.
[14] 黄松, 吴月娜, 刘梅, 等.茚三酮比色法测定青天葵中总游离氨基酸的含量[J].中国中医药信息杂志, 2010, 17(12):50-52.
HUANG S, WU Y N, LIU M, et al.Quantitatie determination of total free-amino acid in Nerilia fordii(hance) schltr.by ninhydrin colorimetric method[J].Chinese Journal of Information on Traditional Chinese Medicine, 2010, 17(12):50-52.
[15] WON H I, WATSON S M, AHN J S, et al.Inactiation of the Pta-AckA pathway impairs fitness of Bacillus anthracis during oerflow metabolism[J].Journal of Bacteriology, 2021, 203(9):e00660-e00620.
[16] 王境. 毕赤酵母和枯草杆菌产碱性蛋白酶的对比研究[D].太原:山西大学, 2019.
WANG J.Comparatie study on alkaline protease produced by Pichia pastoris and Bacillus subtilis[D].Taiyuan:Shanxi Uniersity, 2019.
[17] SHIERS R P, SONENSHEIN A L.Actiation of the Bacillus subtilis global regulator CodY by direct interaction with branched-chain amino acids[J].Molecular Microbiology, 2004, 53(2):599-611.
[18] CAI D B, ZHU J, ZHU S, et al.Metabolic engineering of main transcription factors in carbon, nitrogen, and phosphorus metabolisms for enhanced production of bacitracin in Bacillus licheniformis[J].ACS Synthetic Biology, 2019, 8(4):866-875.
[19] WEN J H, ZHAO X Y, SI F M, et al.Surfactin, a quorum sensing signal molecule, globally affects the carbon metabolism in Bacillus amyloliquefaciens[J].Metabolic Engineering Communications, 2021, 12:e00174.
[20] 刘钊远. 增强地衣芽胞杆菌TCA循环代谢水平高产杆菌肽[D].武汉:湖北大学, 2018.
LIU Z Y.Enhance bacitracin production by increasing the TCA cycle in Bacillus licheniformis[D].Wuhan:Hubei Uniersity, 2018.
[21] ZHU S, CAI D B, LIU Z W, et al.Enhancement of bacitracin production by NADPH generation ia oerexpressing glucose-6-phosphate dehydrogenase zwf in Bacillus licheniformis[J].Applied Biochemistry and Biotechnology, 2019, 187(4):1 502-1 514.
[22] CAI D B, ZHANG B W, RAO Y, et al.Improing the utilization rate of soybean meal for efficient production of bacitracin and heterologous proteins in the AprA-deficient strain of Bacillus licheniformis[J].Applied Microbiology and Biotechnology, 2019, 103(12):4 789-4 799.
[23] ZHU J, CAI D B, XU H X, et al.Enhancement of precursor amino acid supplies for improing bacitracin production by actiation of branched chain amino acid transporter BrnQ and deletion of its regulator gene lrp in Bacillus licheniformis[J].Synthetic and Systems Biotechnology, 2018, 3(4):236-243.
[24] MAJERCZYK C D, SADYKO M R, LUONG T T, et al.Staphylococcus aureus CodY negatiely regulates irulence gene expression[J].Journal of Bacteriology, 2008, 190(7):2 257-2 265.
[25] CHOWDHURY N, KWAN B W, WOOD T K.Persistence increases in the absence of the alarmone guanosine tetraphosphate by reducing cell growth[J].Scientific Reports, 2016, 6:20519.