贝氏酵母(Saccharomyces bayanus)是一种常用于发酵西打果酒的酵母菌,已在苹果西打果酒商业中得以应用。研究显示,贝氏酵母在果酒发酵过程中能产生丰富的挥发性风味物质,增加酒体的香气[1]。JANUSZEK等[1]将贝氏酵母发酵的苹果白兰地与酿酒酵母(Saccharomyces cereisiae)发酵的果酒进行比较,结果表明前者中的香气成分(包括醋酸酯、乙酸异戊酯、棕榈酸乙酯)浓度明显增加。EGLINTON等[2]将贝氏酵母应用于葡萄酒发酵,结果显示在发酵过程中产生了更多的甘油、乙醛和较少的乙酸、苹果酸等物质,并在感官方面,赋予了果酒“熟橘皮”、“坚果”等风味。此外,有研究人员为使酒体的挥发性物质更加丰富,将贝氏酵母与其他菌株混合应用到猕猴桃酒的发酵[3]。可见利用贝氏酵母发酵的果酒具有更高的风味强度,增加果酒风味的丰富性。
荔枝(Litchi chinensis Sonn.)属于无患子科热带和亚热带水果,因其诱人的颜色、独特的风味、丰富的营养和保健作用而受到人们的喜爱[4]。荔枝果肉含有多种营养成分,如碳水化合物、蛋白质、必需氨基酸、维生素和矿物质,其含量因荔枝品种而异[5]。由于新鲜荔枝采后寿命短,贮藏时间过久会导致其中的活性成分迅速流失,极大地影响其贮藏性和市场价值[6]。酿酒是荔枝深加工的重要途径,通过发酵不仅可以保留原始果汁中的大部分营养成分,还可产生包含氨基酸在内的其他营养物质[7],在合理利用荔枝资源的同时提高荔枝产业的经济效益。
目前已有研究者探讨荔枝果酒和啤酒的风味成分和抗氧化特性[8-10],但将贝氏酵母应用于荔枝酒发酵的研究还鲜见报道,因而研究贝氏酵母对荔枝酒挥发性风味物质的影响对提高荔枝果酒的品质有重要意义。采用电子鼻和气相色谱-离子迁移谱(gas chromatography-ion mobility spectrometry,GC-IMS)等技术分析食品的挥发性成分特征备受重视[11-12]。故本文采用贝氏酵母发酵制备荔枝果酒,利用电子鼻和GC-IMS技术对其发酵过程中挥发性风味成分的变化进行分析,以期为荔枝酒的开发利用及其品质的控制提供科学依据。
1 材料与方法
1.1 材料与试剂
荔枝,品种为妃子笑 (Litchi chinensis Sonn c.Feizixiao),产地为海南,鲜果当天运回实验室进行处理,并于-20 ℃以下冻藏备用;贝氏酵母(商品名SafCider),法国Fermentis酵母公司。
PEN3电子鼻系统,德国Airsense公司;LHS-HC-250恒温恒湿培养箱,广州市深华生物技术有限公司;BS110S电子分析天平,梅特勒-托利多仪器有限公司;Flaour Spec 1H1-00053型风味分析仪,配有分析软件包括LA(Laboratory Analytical iewer)、Reporter 插件、Gallery Plot插件以及GC×IMS Library Search),德国G.A.S公司。
1.2 实验方法
1.2.1 样品制备
选择充分成熟,无腐烂变质的荔枝去皮去核后打浆处理并过滤,随后离心得荔枝清汁。发酵条件参照文献[1,8-9],为抑制杂菌繁殖,加入120 mg/L偏重亚硫酸钾,调整糖度为20°Brix,加入0.3 g/L贝氏酵母于20 ℃条件下进行发酵。于0、2、4、6、8、10 d采集发酵液,制备分析样品,立即于-80 ℃下保存,待分析。
1.2.2 电子鼻分析
表1为PEN3型电子鼻10个金属传感器的阵列及性能描述。参照CAO等[11]方法,稍作修改。准确量取5 mL样品于30 mL样品瓶中,加密封盖,室温富集30 min后将进样针插入样品瓶采用顶空吸气法进行电子鼻分析试验。测试前对电子鼻参数进行设置,传感器清洗时间100 s,传感器归零时间5 s,样品准备时间5 s,进样流量 150 mL/min,检测时间120 s。完成每次检测系统进行清零和标准化后再测试下一个样品,每种样品重复3次测定,采用电子鼻软件WinMuster对所测数据进行主成分分析(principal component analysis,PCA)和载荷分析。
表1 PEN3传感器阵列及性能描述
Table 1 Sensor arrays and performance specification of electronic nose PEN3

序号传感器名称敏感物质参考物质及检测限S1W1C芳香成分,苯类甲苯,10 mg/LS2W5S氮氧化合物二氧化氮,1 mg/LS3W3C芳香成分,氨类苯,1 mg/LS4W6S对氢气有选择性氢气,100 mg/LS5W5C烷烃,芳香成分丙烷,1 mg/LS6W1S甲基类甲烷,100 mg/LS7W1W萜烯类,硫化物硫化氢,1 mg/LS8W2S醇类,醛酮类一氧化碳,100 mg/LS9W2W芳香成分,有机硫化物硫化氢,1 mg/LS10W3S烷烃甲烷,100 mg/L
1.2.3 气相色谱-离子迁移谱分析
参考陈小爱等[12]的方法,并稍加修改。
制样方法:称取1 mL样品,置于20 mL顶空瓶中待分析;顶空孵化温度70 ℃,孵化时间15 min,孵化转速500 r/min,进样体积200 μL,进样针温度85 ℃。
GC条件:MXT-WAX(30 m×0.53 mm,1 μm)色谱柱,色谱柱温60 ℃,运行时间30 min,载气为高纯度N2;载气流速:起始2 mL/min保持2 min,在2~20 min线性增加至100 mL/min,保持10 min。
IMS条件:在500 /cm的电场下施加氚源,漂移管长度为9.8 cm,漂移气为高纯度N2,流速150 mL/min,漂移管温度45 ℃。
挥发性风味物质的相对百分含量测定:运用GC-IMS内置的数据库进行二维定性,根据定性物质峰面积计算相对百分含量,应用于相对活度值(relatie odor actiity alue,ROA) 计算。
1.2.4 ROA分析
参考刘登勇等[13]的方法,计算ROA,考察样品总体风味贡献最大的组分:ROAstan=100,对其他组分活度值按公式(1)计算:
(1)
式中:CA,各风味组分的相对百分含量,%;TA,各风味组分的感觉阈值;Cstan,样品风味贡献最大成分的相对百分含量,%;Tstan,风味贡献最大组分的感觉阈值。其中风味物质的相对百分含量均由GC-IMS测定得出。ROA≥1的组分为所分析样品的关键风味化合物,0.1≤ROA<1的组分对样品的总体风味具有重要的修饰作用。
1.2.5 感官评定
参考秦献泉等[14]对荔枝果酒的模糊综合评判法进行研究,评价指标包括色泽、香气、口味和风格4项,总分值为100,各项权重分别为0.1、0.4、0.3和0.2,各项评价分5个等级:很好、较好、一般、较差和差。评定人员由8名经过培训的具有食品专业背景的人员组成。
1.3 数据分析
采用Origin 2018统计软件分析数据并作图,采用SPSS Statistics 25软件进行邓肯单因素方差分析(P<0.05);采用GC-IMS自带仪器分析软件,包括LA、Reporter和Gallery plot对样品挥发性成分进行采集和分析,通过保留指数(retention index,RI)和漂移时间与GC-IMS文库以及峰面积归一化处理进行化合物定性定量分析。
2 结果与分析
2.1 电子鼻对荔枝酒发酵过程中挥发性风味物质的特征分析
电子鼻技术是基于气体传感阵列响应图谱识别气体的电子系统,是一种用途广泛、实时无损的挥发性风味物质分析检测方法[15]。荔枝酒发酵过程中挥发性风味物质在电子鼻传感器响应信号强度如图1所示,样品响应强度较突出的传感器有W1C、W5S、W5C、W1W和W2S,它们分别对芳香成分、氮氧化合物、烷烃、萜烯类、硫化物、醇类和醛酮类物质灵敏。其中W5S传感器响应值最高,并且荔枝酒在发酵期间该传感器上的响应值有较大差异,表明传感器W5S对荔枝酒的发酵程度可较好地区分。其次W1W(硫化物)响应值呈现降低的趋势,由于硫化物具有臭鸡蛋味,对样品气味起负面作用,因此样品的硫化物响应值越低越好。结果表明,经过贝氏酵母发酵的荔枝酒主要挥发性风味物质为氮氧化合物、烷烃、醇类及醛酮类,可根据对应传感器的响应值大小判定荔枝酒的发酵程度。
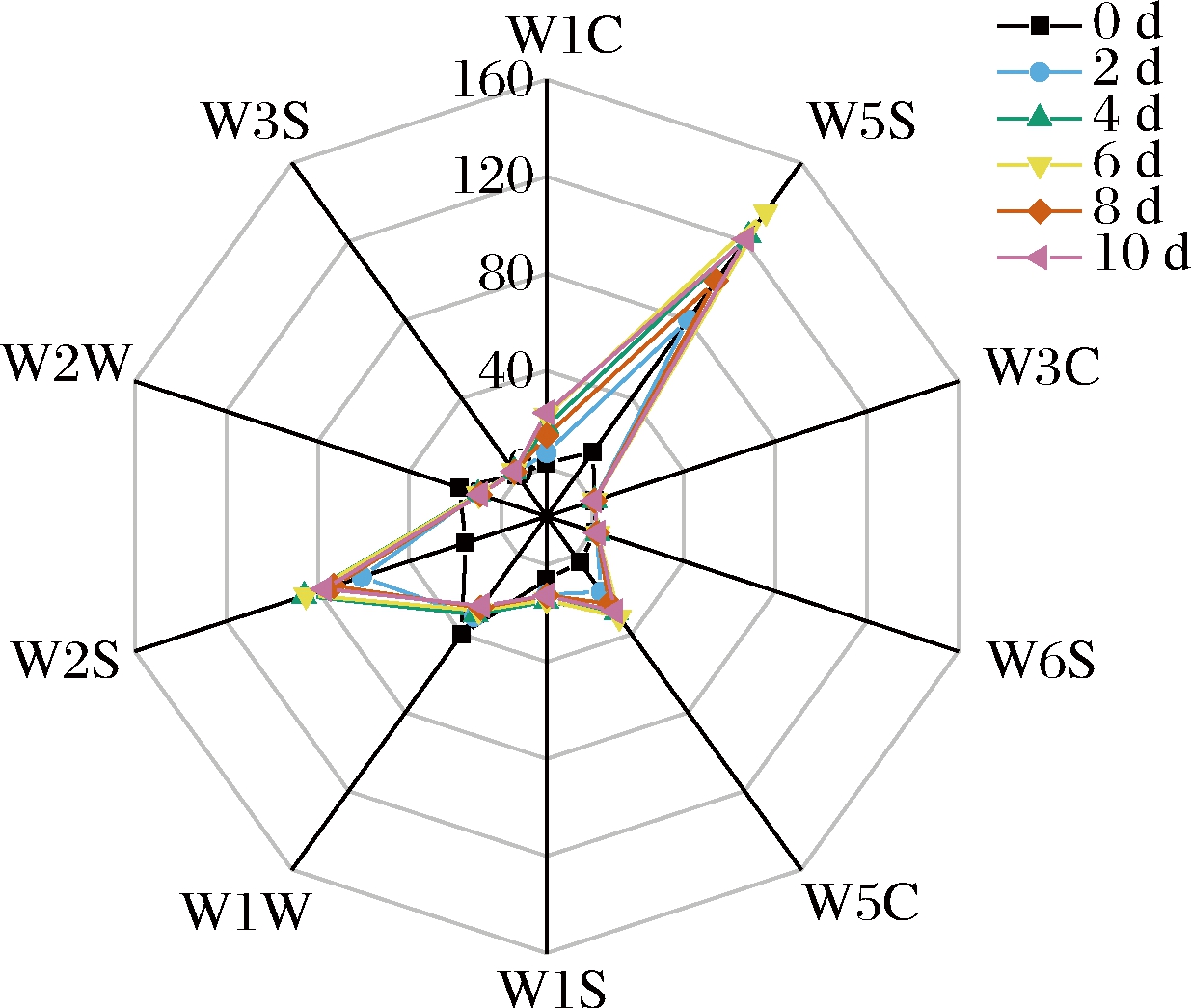
图1 荔枝酒发酵过程中电子鼻响应雷达图
Fig.1 Radar diagram of electronic nose response during litchi wine fermentation
2.2 GC-IMS对荔枝酒发酵过程中挥发性风味物质的特征分析
电子鼻测定结果仅能得到样品挥发性风味物质的整体轮廓,显示发酵过程中荔枝酒响应信号的差异。为了更全面且细致的分析荔枝酒发酵过程中挥发性风味物质变化,采用气相色谱-离子迁移谱技术进行分析,结果如图2所示,纵坐标表示GC保留时间,横坐标代表反应离子峰迁移时间。在1.0~1.8 ms的迁移时间内,200~1 200 s的保留时间内,有效的挥发性风味物质较多。运用GC-IMS内置的数据库进行二维定性,共检出60种化合物,其中定性出41种挥发性风味物质。图中蓝色背景上每个亮点代表一种挥发性物质,由白到红,浓度升高。由图2可知,发酵过程挥发性风味化合物的含量和种类在2 d后明显增加,而发酵后期挥发性风味物质的含量和种类差异较小,与电子鼻分析的测定结果相符。

图2 荔枝酒发酵过程挥发性风味化合物 GC-IMS二维俯视图
Fig.2 Two-dimensional GC-IMS top iew of olatile flaor compounds during litchi wine fermentation
图3是运用LA软件与插件“Gallery plot”选取每种样本谱图中挥发性物质信号峰进行排序形成指纹图,横轴为一个样品检测出的所有挥发性成分,纵轴为不同发酵时间的样品。颜色深浅程度代表挥发性化合物的含量,含量越高的颜色越亮。

图3 荔枝酒发酵过程挥发性风味成分GC-IMS指纹图谱
Fig.3 GC-IMS fingerprint of olatile flaor compounds in the fermentation process of litchi wine
由于单体离子和中性分子可能在漂移区形成附属物,因此可能产生单倍体(M)、二聚体(D)和三聚体(T)[16],未经鉴定的挥发性风味化合物用数字进行标识。其中A区为荔枝汁(0 d)与发酵后荔枝酒共有的挥发性成分,分别为2-甲基丙醛(M)、正丙醇和丁酸乙酯(M)。B区为仅在发酵第2 天时大量存在的挥发性物质,且随着发酵时间的增加迅速降低,分别为2-甲基丁醛、丙醛(M/D)、3-羟基-2-丁酮(M/D)、2-甲基丙醛(D)、甲酸乙硫醚和正丁醇。C区为发酵过程新产生且含量较高的挥发性物质,以乙酸酯类为主,包括乙酸丁酯(D)、乙酸丙酯(M)、乙酸异戊酯(M)等,该结果与JANUSZEK等[1]使用贝氏酵母发酵苹果白兰地的香气成分相似。这是由于酿酒酵母有2种AAT酶(ATF1和ATF2),而在贝氏酵母中存在另一种AAT酶(Lg-ATF1),并且ATF1是合成乙酸酯类重要的酯合酶,醇乙酰基转移酶(AATase)主要由基因ATF1、ATF2和Lg-ATF1编码,催化酵母中乙酰辅酶A(acetyl-CoA)和乙醇结合,生成乙酸酯类[17]。
对GC-IMS测定的荔枝酒发酵过程中挥发性风味化合物进行PCA载荷分析,结果如图4所示。

图4 不同发酵时间样品中挥发性风味化合物PCA载荷图
Fig.4 PCA loading plots of olatile flaor compounds in samples at different fermentation times
第一主成分的贡献率为66.98%,第二主成分的贡献率为22.25%,总贡献率为89.23%,具有较好的代表性。与电子鼻结果一致,PCA结果可较好地将原汁和发酵后期的荔枝酒区分开来,且在发酵后的第6、8、10天较为接近。其中在发酵第2天,起到主要作用的挥发性物质分别是丙醛M/D、2-甲基正丁醛、2-甲基丙醛M/D、3-羟基-2-丁酮、甲酸乙硫醚。随着发酵时间的增加,在第6、8和10天起主要作用的挥发性物质以酯类物质为主,主要包括乙酸丁酯M、乙酸乙酯、乙酸丙酯D、乙酸异戊酯T、丁酸乙酯T等挥发性风味物质,其中丁酸乙酯和乙酸丁酯赋予荔枝酒甜香、果香,乙酸异戊酯具有强烈的水果香气,似香蕉味,且癸酸乙酯具有新鲜的水果香味和酒香味[18]。
2.3 荔枝酒发酵过程挥发性风味物质的ROA
采用ROA法确定GC-IMS测定的荔枝酒发酵过程中关键挥发性风味化合物,以此进一步评价挥发性物质对总体风味的贡献。基于前人的研究工作,已表明挥发性风味物质的含量与特征香气并非呈直接的比例关系,由于不同物质的阈值差异大,起到的嗅觉反应也不同,挥发性风味化合物对食品总体风味的贡献由其浓度和感觉阈值共同决定[19]。按照公式(1)计算获得的挥发性风味物质的ROA如表2所示。荔枝原汁中有4种关键风味化合物,分别为丁酸乙酯(甜香、苹果香)、异丁醛(草香、麦芽香)、己醛(青草、脂肪气味)和丙醛。而经贝氏酵母发酵后荔枝酒的关键风味化合物主要有丁酸乙酯、二氢草莓酸乙酯、异丁醛(草香、麦芽香)、乙酸异戊酯(果香、香蕉味)、己酸乙酯(香蕉味、菠萝味)、辛酸乙酯(果香、脂香)。有研究者也证实采用酵母(D10,Lallemand Co,France)发酵的荔枝酒中挥发性组分对总体气味有直接影响的物质包括丁酸乙酯、乙酸异戊酯、己酸乙酯、辛酸乙酯等[20]。除了关键风味化合物还有其他的起修饰作用的挥发性物质,主要包括乙酸丁酯(水果香)、丙酸乙酯(菠萝香)和丙醛,这些挥发性风味物质共同赋予了荔枝酒果香、甜香。
表2 荔枝酒发酵过程中挥发性风味物质的相对风味活度值
Table 2 ROA of olatile flaor compounds in the fermentation process of litchi wine

成分阈值∗/(μg·L-1)ROA0 d2 d4 d6 d8 d10 d丁酸乙酯1100100100100100100异丁醛0.763.7472.5328.0914.3410.918.24异戊醛0.4-70.513.14---二氢草莓酸乙酯0.2-56.4139.7535.3234.5538.46乙酸异戊酯30-19.0122.3621.4320.3421.17辛酸乙酯2-14.626.697.067.279.23乙酸丁酯66-0.10.130.140.330.13己醛4.51.603.872.051.651.781.97丙醛9.50.591.890.480.230.190.20丙酸乙酯10-0.820.960.930.951.08己酸乙酯8-8.467.325.764.774.13
注:*,香气物质阈值和气味特征参考文献[21-24];“-”表示ROA<0.1
2.4 感官评价
采用模糊评判法对发酵终了的荔枝果酒样品进行感官评定,结果如图5所示。色泽、香气、口味和风格的评分分别为81.25、77.5、71.25、77.5,由权重算出感官综合评价分数为76。各指标均位于较好水平,样品色泽略带微黄,澄清,无悬浮物,具有果香和酒香。

图5 荔枝果酒样品感官评价雷达图
Fig.5 Sensory ealuation radar diagram of litchi wine samples
3 结论
贝氏酵母常被用于改善发酵果酒的风味,采用电子鼻和GC-IMS技术结合分析了经贝氏酵母发酵的荔枝酒挥发性风味成分的变化,结果表明,电子鼻可以根据对应传感器的响应值大小对荔枝酒发酵程度进行判定,较好地区分不同发酵阶段的荔枝酒,其差异主要集中在W5S(氮氧化合物)和W2S(醇类、醛酮类)2个传感器的响应值。GC-IMS同样测定出发酵过程醇类和醛酮类物质发生了显著变化,此外,GC-IMS分析结果表明酯类物质在发酵过程中变化明显,以乙酸酯类为主,并且贝氏酵母是一种很好的乙酸酯类生产者。ROA显示发酵过程的差异主要来源于关键性风味化合物贡献度的不同,发酵后期的关键风味化合物主要有丁酸乙酯、二氢草莓酸乙酯、异丁醛、乙酸异戊酯、己酸乙酯、辛酸乙酯,其在总体风味上起关键性作用。对贝氏酵母发酵终点的荔枝果酒进行感官评价,综合感官评分为76,样品具有果香和酒香。本研究分析了贝氏酵母发酵荔枝果酒挥发性风味物质的变化,为贝氏酵母应用于荔枝果酒的发酵提供一定的理论与实践依据。此外,在挥发性成分的测定方法上还可利用气相色谱-质谱联用和气相色谱嗅觉测量技术测定分析,进一步分析贝氏酵母对荔枝酒挥发性风味物质的影响,便于更全面的探究贝氏酵母的发酵特征。
[1] JANUSZEK M, SATORA P, WAJDA  , et al.Saccharomyces bayanus enhances olatile profile of apple brandies[J].Molecules, 2020, 25(14):3127.
, et al.Saccharomyces bayanus enhances olatile profile of apple brandies[J].Molecules, 2020, 25(14):3127.
[2] EGLINTON J M, MCWILLIAM S J, FOGARTY M W, et al.The effect of Saccharomyces bayanus-mediated fermentation on the chemical composition and aroma profile of Chardonnay wine[J].Australian Journal of Grape and Wine Research, 2000, 6(3):190-196.
[3] LIU J, LIU M, YE P, et al.Characterization of major properties and aroma profile of kiwi wine co-cultured by Saccharomyces yeast (S.cereisiae, S.bayanus, S.uarum) and T.delbrueckii[J].European Food Research and Technology, 2020, 246(4):807-820.
[4] GUO X M, LUO T, HAN D M, et al.Multi-omics analysis reealed room temperature storage affected the quality of litchi by altering carbohydrate metabolism[J].Scientia Horticulturae, 2022, 293:110663.
[5] WU Z C, YANG Z Y, LI J G, et al.Methyl-inositol, γ-aminobutyric acid and other health benefit compounds in the aril of litchi[J].International Journal of Food Sciences and Nutrition, 2016, 67(7):762-772.
[6] YAO P F, GAO Y, SIMAL-GANDARA J, et al.Litchi (Litchi chinensis Sonn.):A comprehensie reiew of phytochemistry, medicinal properties, and product deelopment[J].Food & Function, 2021, 12(20):9 527-9 548.
[7] SWAMI S B, THAKOR N, DIATE A.Fruit wine production:A reiew[J].Journal of Food Research and Technology, 2014, 2(3):93-100.
[8] CHEN D, LIU S Q.Impact of simultaneous and sequential fermentation with Torulaspora delbrueckii and Saccharomyces cereisiae on non-olatiles and olatiles of lychee wines[J].LWT - Food Science and Technology, 2016, 65:53-61.
[9] TANG Z S, ZENG X N, BRENNAN M A, et al.Characterization of aroma profile and characteristic aromas during lychee wine fermentation[J].Journal of Food Processing and Preseration, 2019, 43(8):e14003.
[10] 苗俨龙, 龚诗媚, 张子希,等.不同品种荔枝啤酒的理化性质及其抗氧化性评价[J].食品与发酵工业, 2021, 47(13):174-179.
MIAO Y L, GONG S M, ZHANG Z X, et al.Physicochemical properties and antioxidant actiity analysis of craft beers brewed by different litchi arieties[J].Food and Fermentation Industries, 2021, 47(13):174-179.
[11] CAO Y X, WU Z F, WENG P F.Comparison of bayberry fermented wine aroma from different cultiars by GC-MS combined with electronic nose analysis[J].Food Science & Nutrition, 2020, 8(2):830-840.
[12] 陈小爱, 蔡惠钿, 刘静宜, 等.基于电子鼻、GC-MS和GC-IMS技术分析老香黄发酵期间的挥发性成分变化[J].食品工业科技, 2021, 42(12):70-80.
CHEN X A, CAI H T, LIU J Y, et al.Analysis of olatile components in Laoxianghuang during fermentation by electronic nose, GC-MS and GC-IMS[J].Science and Technology of Food Industry, 2021, 42(12):70-80.
[13] 刘登勇, 周光宏, 徐幸莲.确定食品关键风味化合物的一种新方法:“ROA”法[J].食品科学, 2008, 29(7):370-374.
LIU D Y, ZHOU G H, XU X L.“ROA” method:A new method for determining key odor compounds of Rugao ham[J].Food Science, 2008, 29(7):370-374.
[14] 秦献泉, 李鸿莉, 李冬波, 等.基于模糊综合评判法的荔枝酒感官评价研究[J].西南农业学报, 2016, 29(6):1 443-1 447.
QIN X Q, LI H L, LI D B, et al.Study on litchi wine sensory ealuation based on fuzzy comprehensie ealuation[J].Southwest China Journal of Agricultural Sciences, 2016, 29(6):1 443-1 447.
[15] LOUTFI A, CORADESCHI S, MANI G K, et al.Electronic noses for food quality:A reiew[J].Journal of Food Engineering, 2015, 144:103-111.
[16] LI X R, WANG K, YANG R W, et al.Mechanism of aroma compounds changes from sea cucumber peptide powders (SCPPs) under different storage conditions[J].Food Research International, 2020, 128:108757.
[17] ERSTREPEN K J, AN LAERE S D M, ANDERHAEGEN B M P, et al.Expression leels of the yeast alcohol acetyltransferase genes ATF1, Lg-ATF1, and ATF2 control the formation of a broad range of olatile esters[J].Applied and Enironmental Microbiology, 2003, 69(9):5 228-5 237.
[18] AYESTAR N B, MART
N B, MART NEZ-LAPUENTE L, GUADALUPE Z, et al.Effect of the winemaking process on the olatile composition and aromatic profile of Tempranillo Blanco wines[J].Food Chemistry, 2019, 276:187-194.
NEZ-LAPUENTE L, GUADALUPE Z, et al.Effect of the winemaking process on the olatile composition and aromatic profile of Tempranillo Blanco wines[J].Food Chemistry, 2019, 276:187-194.
[19] ZHANG H Y, HUANG D, PU D D, et al.Multiariate relationships among sensory attributes and olatile components in commercial dry porcini mushrooms (Boletus edulis)[J].Food Research International, 2020, 133:109112.
[20] WU Y W, ZHU B Q, TU C, et al.Generation of olatile compounds in litchi wine during winemaking and short-term bottle storage[J].Journal of Agricultural and Food Chemistry, 2011, 59(9):4 923-4 931.
[21] 林翔云. 调香术[M].北京:化学工业出版社, 2001.
LIN X Y.Perfumery[M].Beijing:Chemical Industry Press, 2001.
[22] 孙宝国. 食用调香术[M].北京:化学工业出版社, 2015.
SUN B G.The Technology of Food Flaoring[M].Beijing:Chemical Industry Press, 2015.
[23] 赵宁, 魏新元, 樊明涛, 等.SPME-GC-MS结合电子鼻技术分析不同品种猕猴桃酒香气物质[J].食品科学, 2019, 40(22):249-255.
ZHAO N, WEI X Y, FAN M T, et al.Analysis of olatile components of kiwifruit wines made from different cultiars using solid phase microextraction-gas chromatography-mass spectrometry combined with electronic nose[J].Food Science, 2019, 40(22):249-255.
[24] 钟平娟, 叶丽芳, 门戈阳, 等.大果山楂酒发酵过程中抗氧化活性和香气成分分析[J].食品研究与开发, 2021, 42(8):24-29.
ZHONG P J, YE L F, MEN G Y, et al.Analysis of antioxidant actiity and aromatic components of Malus doumeri (Bois) chealier wine during fermentation[J].Food Research and Deelopment, 2021, 42(8):24-29.